ALVESCO - Solución en aerosol
Sustancia(s):
- Ciclesonida
Presentaciones:
- 1 Caja, 1 Frasco(s), 10 ml, 200/120 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 50/120 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 100/120 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 50/60 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 100/60 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 200/60 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 50/30 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 100/30 µg/dosis
- 1 Caja, 1 Frasco(s), 10 ml, 200/30 µg/dosis
INDICACIONES TERAPÉUTICAS: Antiinflamatorio esteroideo. ALVESCO® es un nuevo anti-asmático esteroide tópico inhalado, con una potente actividad anti-inflamatoria sobre la mucosa del tracto respiratorio, indicado en la profilaxis y terapia de mantenimiento del asma persistente leve, moderada y severa en niños (mayores de 4 años), adolescentes y adultos.
ALVESCO® también está indicado como auxiliar en el tratamiento de algunos pacientes con enfermedades pulmonares crónicas de origen inflamatorio, tales como bronquitis crónica, enfisema o enfermedad pulmonar obstructiva crónica (EPOC).
ALVESCO® está también indicado en pacientes que requieren tratamiento con corticosteroides orales para el manejo del asma. La utilización de ALVESCO® como medicamento "controlador" de base en pacientes con asma persistente severa, permite reducir de manera gradual y progresiva la necesidad de corticosteroides orales.
FARMACOCINÉTICA Y FARMACODINAMIA: La ciclesonida (epímero R puro) pertenece a una nueva clase de glucocorticoides inhalados no halogenados que se activan in situ. La ciclesonida es hidrolizada en el pulmón a través de la enzima estearasa en su principal metabolito activo (C21 des-isobutiril-ciclesonida), el cual tiene un pronunciado efecto anti-inflamatorio. A dosis de 100 a 800 mcg por día, mejora significativamente la función respiratoria medida por el volumen espiratorio forzado en el primer segundo (FEV1), el flujo espiratorio máximo (PEF) y el control sintomático del asma.
Más del 50% de la dosis inhalada se deposita y se activa en las vías aéreas. La biodisponibilidad oral de la ciclesonida y su principal metabolito activo es insignificante (< 0.5% ciclesonida y < 1% su metabolito). Después de la administración I.V., existe una rápida distribución del fármaco debido a sus propiedades lipofílicas. El volumen de distribución promedio es de 2.9 L/kg. El metabolito activo se une a las proteínas plasmáticas en 98-99%. La ciclesonida es catabolizada por sistema CYP3A4 en el hígado para finalmente ser excretado por las heces. Al no existir prácticamente metabolito activo libre en plasma, existe un bajo potencial de supresión del eje hipotálamo-hipófisis-suprarrenal. La farmacocinética es idéntica en pacientes asmáticos y en voluntarios sanos. No se requiere ajustar la dosis en pacientes ancianos ni en pacientes con insuficiencia hepática. Dado que se excreta predominantemente por las heces, no existen estudios en pacientes con insuficiencia renal.
CONTRAINDICACIONES: Hipersensibilidad a los componentes de la fórmula.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No hay estudios adecuados y bien controlados de ALVESCO® en mujeres embarazadas. Sin embargo, las concentraciones séricas de ciclesonida después de su inhalación son muy bajas; por tanto, la exposición del feto es prácticamente nula y el potencial de toxicidad reproductiva es bajo. No se ha investigado la excreción de ciclesonida o sus metabolitos en la leche humana. Al igual que con otros productos corticosteroides inhalados ALVESCO® no debe ser usado durante el embarazo y la lactancia, a menos que los beneficios potenciales a la madre, superen los riesgos potenciales para el feto o lactante.
En animales de estudio los glucocorticoides han mostrado inducir malformaciones. Es poco probable que esto sea relevante para las dosis inhaladas recomendadas en humanos.
Los bebés de madres que recibieron corticosteroides durante el embarazo, se deben observar cuidadosamente por posible hipoadrenalismo.
REACCIONES SECUNDARIAS Y ADVERSAS: En estudios clínicos con ALVESCO®, en donde se administró un rango de dosis entre 100 a 1,600 mcg por día, aproximadamente 4% de los pacientes experimentaron eventos adversos, los cuales son comparables con el placebo.
Efectos adversos: Muy comunes (> 10%), Comunes (1% - < 10%), Poco comunes (0.1 < 1%), Raros (0.01% - < 0.1%), Muy raros (< 0.01%).
En la mayoría de los casos, los eventos adversos fueron leves y no se requirió descontinuar el tratamiento con ALVESCO®.
Desórdenes gastrointestinales:
Poco comunes: mal sabor de boca.
Desórdenes generales y del sitio de administración:
Poco comunes: reacciones en el sitio de aplicación como ardor, inflamación e irritación; resequedad en el sitio de aplicación.
Desórdenes respiratorios, torácicos y mediastinales:
Poco comunes: voz ronca, tos después de la inhalación, broncospasmo paradójico.
Desórdenes en la piel y tejido subcutáneo:
Poco comunes: rash y eccema.
Desórdenes del sistema inmune:
Muy raros: reacciones de hipersensibilidad inmediata o retardada tales como angioedema con inflamación de labios, lengua y faringe.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Se ha identificado en estudios sobre toxicidad reproductiva en animales, que los glucocorticoides son capaces de inducir algunas malformaciones (ej. paladar hendido, malformaciones esqueléticas, etc.). Sin embargo, estos resultados no parecen ser relevantes para el ser humano a las dosis recomendadas.
Los datos preclínicos con ciclesonida muestran que no existen riesgos especiales para los humanos basados en estudios convencionales de seguridad farmacológica, toxicidad a dosis repetidas, genotoxicidad, fertilidad o potencial carcinogénico.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GENERO: Los datos in vitro indican que en el hombre CYP3A4 es la enzima más involucrada en el metabolismo de M1, metabolito activo de ciclesonida.
Los niveles séricos de ciclesonida y su metabolito activo son muy bajos, por lo que no son de esperarse interacciones clínicamente relevantes. Sin embargo, la administración concomitante de medicamentos que compiten por la vía metabólica del sistema del citocromo P450, isoenzima 3A4 (ej. ketoconazol, itraconazol y ritonavir o nelfinavir), deben de ser evaluados con cautela ya que pueden incrementar los niveles séricos de ciclesonida o sus metabolitos activos. Estudios de interacción droga-droga con ciclesonida y sustrato de prueba (ej. eritromicina) para evaluar la actividad de la isoenzima CYP3A4 han demostrado que no existe interacción mutua.
No se puede excluir el riesgo de efectos clínicos adversos ( ej. síndrome cushingoide).
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Ninguna.
PRECAUCIONES GENERALES: Como con todos los corticosteroides inhalados, ALVESCO® debe ser usado con precaución en los pacientes con infecciones pulmonares activas o latentes ya sean virales, micóticas o bacterianas. Al igual que con todos los esteroides inhalados, ALVESCO® no está indicado en el alivio del broncoespasmo agudo. El paciente debe ser informado de la necesidad de contar con un medicamento de rescate.
Los pacientes con asma persistente severa están en riesgo de sufrir ataques agudos y deben tener evaluaciones regulares del control del asma incluyendo pruebas de función pulmonar. El incremento del uso de broncodilatadores de acción corta para el alivio de los síntomas asmáticos es indicativo del deterioro del control del asma. Si los pacientes observan que el alivio con los broncodilatadores de acción rápida se vuelve menos efectivo, o si requiere incrementar el número de inhalaciones de las usuales, se debe buscar atención médica. En esta situación los pacientes deben ser inmediatamente re-evaluados y considerar la posibilidad de incrementar el tratamiento con fármacos anti-inflamatorios (ej. dosis más altas de ALVESCO® o un periodo de tratamiento con corticosteroides orales). Las exacerbaciones de asma persistente severa deben ser manejadas de acuerdo con los estándares de la práctica médica.
Pueden ocurrir efectos sistémicos indeseables debido al uso de corticosteroides, particularmente cuando estos fármacos son utilizados a altas dosis y durante periodos prolongados de tiempo. Estos efectos son mucho menos frecuentes con los inhalados que con los orales. Los posibles efectos sistémicos incluyen supresión adrenal, retardo en el crecimiento de niños y adolescentes, disminución en la densidad mineral ósea, cataratas y glaucoma. Por esto, es importante que la dosis del corticosteroide inhalado sea ajustado a la dosis más baja a la cual se mantiene un control efectivo del asma. Después de la administración prolongada de 1,600 mcg de ciclesonida no se han observado signos de supresión adrenal.
No existe información disponible en pacientes con disfunción hepática severa. Se espera un aumento en la exposición a ALVESCO® en pacientes con disfunción hepática severa, y en estos pacientes se deben monitorear los potenciales efectos sistémicos.
La falta de respuesta o exacerbaciones severas de asma deberán ser tratadas con el incremento en la dosis de ciclesonida inhalada y, si es necesario, mediante la administración de un esteroide sistémico y/o un antibiótico si hay infección.
Los beneficios del tratamiento con ALVESCO®, minimizarán la necesidad de corticosteroides orales, pero se debe de tener en cuenta que los pacientes que han sido transferidos de los esteroides orales mantendrán el riesgo de una reserva adrenal alterada durante un tiempo considerable. En estos casos, la posibilidad de eventos adversos podrá persistir por algún tiempo. Estos pacientes requieren de la evaluación especializada para determinar el nivel de afectación adrenal antes de realizar cualquier procedimiento quirúrgico electivo. La posibilidad de una respuesta adrenal insuficiente o alterada, siempre debe ser considerada en los casos de urgencias (médicas o quirúrgicas) y en situaciones electivas que producen estrés, se debe considerar el tratamiento apropiado con corticosteroides.
Después de aproximadamente una semana, el retiro gradual de los esteroides sistémicos deberá iniciarse mediante la reducción de la dosis de 1 mg de prednisolona por semana, o su equivalente. Para dosis de mantenimiento de prednisolona de 10 mg o más al día, puede ser apropiada una mayor reducción de la dosis de manera cuidadosa, en intervalos semanales.
Durante la fase de retiro a pesar del mantenimiento o incluso de una mejora en la función respiratoria, algunos pacientes no se sienten bien de manera inespecífica; estos pacientes deben ser animados a perseverar con la ciclesonida inhalada y continuar con el retiro del esteroide sistémico, a menos que existan signos objetivos de insuficiencia adrenal.
Los pacientes transferidos de esteroides orales cuya función adrenocortical es aun disfuncional, deberán llevar una tarjeta de advertencia sobre el esteroide, indicando que ellos necesitan esteroides suplementarios durante los periodos de estrés, por ejemplo, empeoramiento de ataques de asma, infecciones en el pecho, enfermedades mayores concomitantes, cirugía o trauma.
El broncoespasmo paradójico puede ocurrir inmediatamente después de la dosificación y es una reacción aguda inespecífica para todos los medicamentos inhalados.
El broncoespasmo paradójico con incremento inmediato de sibilancias u otros síntomas de broncoconstricción después de la dosificación deberán ser tratados con un broncodilatador inhalado de corta acción, que usualmente da un rápido alivio. El paciente deberá ser asesorado y, solamente se deberá continuar con el tratamiento, si después de una consideración cuidadosa, el beneficio esperado es mayor que el posible riesgo. La correlación entre la severidad del asma y la susceptibilidad general para las reacciones bronquiales agudas deberán mantenerse en mente. La técnica de inhalación del paciente, debe revisarse periódicamente para asegurar que exista una adecuada sincronización entre el disparo y la inhalación, para que el fármaco se deposite óptimamente en los pulmones.
La ciclesonida inhalada tiene efecto nulo en la capacidad de manejar vehículos y usar maquinaria.
DOSIS Y VÍA DE ADMINISTRACIÓN: Se debe administrar una dosis de inicio de ALVESCO® apropiada de acuerdo a la severidad del padecimiento.
La dosis usual de inicio en pacientes con diagnóstico nuevo o que nunca habían sido tratados con corticosteroides inhalados son:
|
Edad (años) |
Grado de asma |
Dosis recomendada |
|
Adultos y adolescentes ≥12 |
Leve persistente |
200 µg una vez al día |
|
Moderada persistente |
200-400 µg una vez al día |
|
|
Severa persistente |
400-800 µg una vez al día o 400 µg dos veces al día |
|
|
Niños ≥ 4 años |
Leve-Severa persistente |
100-200 µg una vez al día |
Vía de administración: Bucal, para inhalación.
Para la transferencia de pacientes de otros esteroides inhalados a ALVESCO®: En pacientes en los que el cuadro de asma esté bien controlado con el tratamiento previo y se desee cambiar al régimen de ciclesonida, la dosis de inicio de ALVESCO® deberá ser la mitad de la dosis de beclometasona o su equivalente. Los pacientes con un pobre control de asma con el fármaco previo deberán cambiarse a ALVESCO® en base a una dosis equivalente microgramo a microgramo sin rebasar la dosis máxima autorizada para adultos, adolescentes y niños.
Para la utilización de una vez al día, ALVESCO® debe ser administrado preferentemente en la noche. La dosis matutina de ALVESCO® también ha mostrado ser eficaz. Para algunos pacientes con asma con cuadros más severos, éstos podrían ser mejor controlados si la máxima dosis recomendada diaria se divide en dos dosis al día. La decisión final de administrarlo en la noche o en la mañana o dividir la dosis máxima en dos se deja a discreción del médico tratante.
De acuerdo a las necesidades del paciente, se puede utilizar un espaciador Aero Chamber® Plus.
Los síntomas empiezan a mejorar en las primeras 24 horas de tratamiento. Una vez que se obtiene el control del cuadro clínico, disminuir gradualmente la dosis a la mínima necesaria.
Recomendaciones especiales para adultos y adolescentes: El rango de dosis recomendada es de 200 a 800 microgramos por día en adultos y adolescentes mayores a 12 años. La reducción de la dosis a 100 microgramos una vez al día puede ser la dosis efectiva de mantenimiento para algunos pacientes.
Para los pacientes que actualmente reciben terapia a largo plazo con corticosteroides orales: En pacientes con asma severo persistente que son dependientes del tratamiento oral con prednisona, la dosis recomendada para ALVESCO® varía de 400 a 800 microgramos dos veces al día. Para la transferencia de corticosteroides orales a ALVESCO® el paciente debe encontrarse en una fase relativamente estable. Se debe administrar una dosis alta de ALVESCO® (ej. 800 mcg dos veces al día) en combinación con el esteroide oral por un tiempo aproximado de 10 días. A partir de entonces, el esteroide oral debe ser reducido gradualmente sin sobrepasar 2.5 mg/día cada semana hasta alcanzar la mínima dosis posible.
Instrucciones de uso: El paciente necesita ser instruido en el uso correcto del inhalador.
Si el inhalador es nuevo o no ha sido usado por una semana o más, se deben hacer tres disparos al aire. No es necesario agitar dado que es una solución en aerosol.
Remover la tapa y asegurarse que la boquilla esté limpia y seca. El inhalador deberá ser tomado en posición vertical (con el pulgar en la base, debajo de la boquilla).
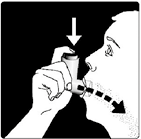
Sacar el aire de los pulmones lo más que pueda. Colocar la boquilla en la boca y rodearla firmemente con los labios. Justamente cuando empiece a inhalar por la boca, apretar con el dedo índice la lata sobre el inhalador para disparar el medicamento. Continuar inhalando de manera constante y profunda, pegando la lengua al piso de la boca. Después del disparo, el paciente no debe espirar dentro del inhalador. Retirar el inhalador de la boca y mantener el aire dentro de los pulmones por 10 segundos o tanto como sea posible. Exhalar suavemente a través de la boca. Después de su uso siempre colocar la tapa del inhalador sobre la boquilla.
Se recomienda limpiar con un pañuelo seco cada semana. El inhalador no debe ser lavado o puesto en agua.
Como en la mayoría de los medicamentos inhalados contenidos en envases presurizados, los efectos terapéuticos pueden disminuir cuando el envase está frío. Sin embargo, ALVESCO® entrega dosis consistentemente en un rango de -10°C a 40°C.
Y FORMULACIÓN:
|
50 µg/dosis |
100 µg/dosis |
200 µg/dosis |
Cada g contiene:
|
Ciclesonida |
0.84 mg |
1.69 mg |
3.37 mg |
|
Vehículo cbp |
1 g |
1 g |
1 g |
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Aguda: La inhalación por voluntarios sanos de una dosis de 3600 µg de ciclesonida fue bien tolerada.
El potencial de una intoxicación aguda por sobredosis de ALVESCO® inhalado es baja. No se requiere ningún tratamiento específico.
Crónica: Después de la administración prolongada de 1600 mcg de ciclesonida, no se observaron signos de supresión adrenal. Sin embargo, si se requieren dosis superiores a las recomendadas por periodos prolongados, no se puede excluir cierto grado de supresión adrenal. Puede ser necesario el monitoreo de la reserva adrenal. En casos de sobredosis de ciclesonida la terapia debe mantenerse a las dosis suficientes para controlar los síntomas.
PRESENTACIONES:
Caja con frasco de 10 ml de 120 dosis en presentaciones de 50, 100 y 200 µg/dosis.
Caja con frasco de 10 ml de 60 dosis en presentaciones de 50, 100 y 200 µg/dosis.
Caja con frasco de 10 ml de 30 dosis en presentaciones de 50, 100 y 200 µg/dosis.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C.
Peligro: inflamable.
No se use cerca del fuego o flama.
No fume o encienda flama cuando se aplique.
El envase contiene líquido presurizado.
No exponga el envase a los rayos del sol o a temperaturas mayores a 50°C ni lo perfore o arroje al fuego, aun cuando aparentemente esté vacío.
Evite el contacto con los ojos.
LEYENDAS DE PROTECCIÓN:
No se deje al alcance de los niños. Su venta requiere receta médica. El uso de este medicamento durante el embarazo y la lactancia queda bajo la responsabilidad del médico. Literatura exclusiva para médicos.
Hecho en Reino Unido por:
3M Health Care Limited
Derby Road , Loughborough
Leicestershire LE11 5SF, Reino Unido
Según fórmula de:
Takeda GmbH
Konstanz, Alemania
Distribuido por:
TAKEDA MÉXICO, S.A. de C.V.
Av. Primero de Mayo No. 130
Industrial Atoto, C.P. 53519
Naucalpan de Juárez, México
Reg. Núm. 456M2004, SSA IV
®Marca Registrada
