
BENLYSTIA IV
BELIMUMAB
Solución inyectable
1 Caja , 1 Frasco(s) ámpula con liofilizado , 120 mg , 80 mg/ml
1 Caja , 1 Frasco(s) ámpula con liofilizado , 400 mg , 80 mg/ml
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
FORMA FARMACÉUTICA Y FORMULACIÓN:
El frasco ámpula con polvo liofilizado contiene:
Belimumab1 120 mg o 400 mg
Excipientes cbp
1Anticuerpo monoclonal humano IgG1? de origen ADN recombinante expresado en una línea celular de la clona #97 de ratón Balb/C.
Después de la reconstitución del liofilizado con agua estéril, cada mL de solución contiene 80 mg de belimumab.
INDICACIONES TERAPÉUTICAS: Tratamiento para Lupus Eritematoso Sistémico (LES) activo, con autoanticuerpos positivos. BENLYSTIA® IV está indicado para.
• Reducir la actividad de la enfermedad en pacientes adultos con Lupus Eritematoso Sistémico (LES) activo, con autoanticuerpos positivos, que están recibiendo tratamiento estándar.
• Tratamiento de nefritis lúpica activa en pacientes adultos que están recibiendo tratamiento estándar.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades Farmacodinámicas:
Grupo farmacoterapéutico: Inmunosupresores selectivos.
Código ATC: L04AA26.
Mecanismo de Acción: Belimumab es un anticuerpo monoclonal humano IgG1? que se une específicamente a la forma soluble de la Proteína Estimuladora de Linfocitos B humanos (BLyS), e inhibe su actividad biológica.
Belimumab no se une directamente a las células B, pero al unirse y neutralizar a BLyS, inhibe la supervivencia de las células B, incluyendo las células B autorreactivas, y reduce la diferenciación de células B en células plasmáticas productoras de inmunoglobulinas. BLyS también llamado BAFF y TNFSF13, es un miembro de la familia de ligandos del factor de necrosis tumoral (TNF), que inhibe la apoptosis de células B y estimula la diferenciación de células B a células plasmáticas productoras de inmunoglobulinas. BLyS se sobreexpresa en pacientes con LES (Lupus Eritematoso Sistémico), lo que conduce a niveles plasmáticos elevados de BLyS. Existe una fuerte asociación entre la actividad del LES (evaluada mediante Evaluación Nacional de la Seguridad de los Estrógenos en el Lupus Eritematoso Sistémico - Índice de Actividad del Lupus Eritematoso Sistémico [SELENA-SLEDAI]) y las concentraciones plasmáticas de BLyS.
Efecto Farmacodinámico: En pacientes adultos con LES, se observaron reducciones de las concentraciones séricas elevadas de IgG y de anticuerpos anti-DNA desde la semana 8, y continuaron hasta la semana 52. En pacientes con hipergammaglobulinemia basal, se observó una normalización de las concentraciones de IgG en la semana 52 en 49% y 20% de los pacientes que recibieron belimumab y placebo, respectivamente. En pacientes con anticuerpos anti-DNA a nivel basal, las reducciones en pacientes que estaban recibiendo belimumab fueron evidentes desde la semana 8, y para la semana 52, 16% de los pacientes tratados con belimumab se habían convertido a anti-DNA negativo, en comparación con 7% de los pacientes tratados con placebo.
En pacientes con LES con niveles bajos de complemento a nivel basal, el tratamiento con belimumab causó incrementos en el complemento C3 y C4 que se observaron desde la semana 4, y se mantuvieron con el tiempo. Para la Semana 52, las concentraciones de C3 y C4 se habían normalizado en 38% y 44% de los pacientes recibiendo belimumab, en comparación con 17% y 19% de los pacientes recibiendo placebo.
El sitio de acción de belimumab, BLyS, es una citocina fundamental para la supervivencia, diferenciación y proliferación de las células B. Belimumab redujo significativamente las células B circulantes, naïve, activadas, plasmáticas, así como el subconjunto de células B en pacientes con LES en la Semana 52. Las reducciones en las células naïve, plasmáticas, y plasmáticas de vida corta, así como del subconjunto de células B en pacientes con LES, se observaron desde la Semana 8. Las células de memoria inicialmente aumentaron y disminuyeron lentamente hacia niveles basales para la Semana 52.
En un estudio para LES de extensión no controlado a largo plazo, se dio seguimiento a los niveles de las células B (incluyendo células naïve, activadas, células plasmáticas y el subtipo de células B de LES), así como los niveles de IgG durante más de 7 años de tratamiento continuo, se observó una disminución sustancial y sostenida en varios subtipos de células B, incluyendo una disminución en la mediana de 87% en células B naïve, 67% en células B de memoria, 99% en células B activadas, y 92% en células plasmáticas después de más 7 años de tratamientos. Alrededor de los 7 años, se observó una reducción de la mediana de 28% en los niveles de IgG, 1.6% de los sujetos experimentó una disminución en los niveles de IgG por debajo de 400 mg/dL. Durante el curso del estudio, la incidencia reportada de (EAs) Eventos Adversos graves generalmente permaneció estable o declinó.
En pacientes con nefritis lúpica activa, después del tratamiento con belimumab o placebo, hubo un aumento en los niveles séricos de IgG que se asoció con una disminución de la proteinuria. En relación con placebo, se observaron aumentos más pequeños en los niveles séricos de IgG en el grupo de belimumab según lo esperado con el mecanismo conocido de belimumab. En la semana 104, el aumento del porcentaje de la media con respecto al valor basal en IgG fue del 17% para belimumab y del 37% para placebo. Las reducciones de los autoanticuerpos, los aumentos en el complemento y las reducciones en el total circulante de células B y subconjuntos de células B observadas fueron consistentes con los estudios de LES
Inmunogenicidad: En los dos estudios de LES en Fase III con BENLYSTIA® IV administrado por vía intravenosa en pacientes adultos, 4 de 563 (0.7%) pacientes en el grupo de 10 mg/kg, y 27 de 559 (4.8%) pacientes en el grupo de 1 mg/kg, desarrollaron anticuerpos anti-belimumab persistentes. La frecuencia reportada para el grupo de 10 mg/kg puede subestimar la frecuencia real debido a una menor sensibilidad del ensayo en presencia de altas concentraciones del fármaco.
Se detectaron anticuerpos neutralizantes en 3 pacientes que recibieron 1 mg/kg de belimumab vía intravenosa.
En un estudio de Fase III/IV con BENLYSTIA® IV 10 mg/kg administrado por vía intravenosa a pacientes de raza negra con LES, dos de los 321 pacientes (0.6%) desarrollaron anticuerpos anti-belimumab.
En un estudio de Fase III con BENLYSTIA® IV 10 mg/kg administrado por vía intravenosa a pacientes adultos con nefritis lúpica activa, ninguno de los 224 pacientes desarrolló anticuerpos anti- belimumab.
La presencia de anticuerpos anti-belimumab fue relativamente rara en pacientes tratados con BENLYSTIA® IV, por lo cual no es posible hacer conclusiones definitivas acerca del efecto que ejerce la inmunogenicidad en la farmacocinética de belimumab, debido al bajo número de sujetos con anticuerpos positivos anti-belimumab.
Propiedades farmacocinéticas:
Estudios LES:
Los parámetros farmacocinéticos siguientes están basados en estimaciones de los parámetros poblacionales de 563 pacientes con LES que recibieron 10 mg/kg de belimumab vía intravenosa (Días 0, 14, 28 y posteriormente cada 28 días hasta 52 semanas) en los dos estudios de Fase III en adultos.
Absorción: Belimumab se administra a través de infusión intravenosa. Se observaron concentraciones séricas máximas de belimumab al final de la infusión, o poco después de ésta. La concentración sérica máxima fue de 313 μg/mL, con base a la simulación del perfil de concentración-tiempo utilizando los valores paramétricos típicos del modelo farmacocinético poblacional.
Distribución: Belimumab se distribuyó en los tejidos con un volumen de distribución global de aproximadamente 5 L.
Metabolismo: Belimumab es una proteína cuya vía metabólica esperada es la degradación a péptidos pequeños y aminoácidos individuales mediante enzimas proteolíticas ampliamente distribuidas. No se han realizado estudios clásicos de biotransformación.
Eliminación: Las concentraciones séricas de belimumab disminuyeron de manera bi-exponencial, con una vida media de distribución de 1.75 días y una vida media terminal de 19.4 días. La depuración sistémica fue de 215 mL/día.
Estudio de nefritis lúpica: Se realizó un análisis farmacocinético poblacional en 224 pacientes adultos con nefritis lúpica que recibieron BENLYSTIA® IV 10 mg/kg por vía intravenosa (días 0, 14, 28 y luego cada 28 días hasta 104 semanas). En pacientes con nefritis lúpica, debido a la actividad de la enfermedad renal, la depuración de belimumab fue inicialmente mayor que la observada en los estudios de LES; sin embargo, después de 24 semanas de tratamiento y durante el resto del estudio, la depuración y la exposición a belimumab fueron similares a los observados en pacientes adultos con LES que recibieron BENLYSTIA® IV 10 mg/kg por vía intravenosa.
Transición de la administración intravenosa a la subcutánea:
LES: Los pacientes con LES que pasan de 10 mg/kg por vía intravenosa cada 4 semanas a 200 mg por vía subcutánea semanal utilizando un intervalo de cambio de 1 a 4 semanas recibieron una dosis inicial de belimumab de concentraciones séricas cercanas en su primera dosis subcutánea a su concentración mínima subcutánea en estado estacionario (ver Dosis y vía de administración). Basado en simulaciones poblacionales con parámetros farmacocinéticos, el promedio de las concentraciones de belimumab en estado estacionario para 200 mg administrados vía subcutánea cada semana fue similar a 10 mg/kg administrados por vía intravenosa cada 4 semanas.
Nefritis lúpica: Se predice que de una o dos semanas después de completar las 2 primeras dosis intravenosas, los pacientes con nefritis lúpica que cambien de la administración intravenosa de 10 mg/kg a la administración subcutánea de 200 mg semanalmente, tendrán concentraciones séricas promedio de belimumab similares a las de los pacientes que reciben belimumab 10 mg/kg por vía intravenosa cada 4 semanas según simulaciones farmacocinéticas poblacionales (ver Dosis y vía de administración).
Interacciones farmacológicas: El uso concomitante de mofetil micofenolato, ciclofosfamida, azatioprina, metotrexato e hidroxicloroquina, no influenció sustancialmente en la farmacocinética de belimumab con base en los resultados del análisis farmacocinético poblacional. Tampoco influenciaron de manera significativa en un amplio rango de otros co-medicamentos (anti-inflamatorios no esteroideos, aspirina e inhibidores de la HMG-CoA reductasa) en la farmacocinética de belimumab. La co-administración de esteroides e inhibidores de la ECA causó un aumento estadísticamente significativo en la depuración sistémica en el análisis farmacocinético poblacional. Sin embargo, estos efectos no fueron clínicamente significativos, ya que su magnitud se mantuvo dentro del rango de variabilidad normal de la depuración.
Grupos especiales de pacientes:
Pacientes de edad avanzada: Belimumab ha sido estudiado en un número limitado de pacientes de edad avanzada. La edad no afectó la exposición a belimumab en el análisis farmacocinético poblacional. Sin embargo, debido al bajo número de sujetos de 65 años de edad o mayores, no puede descartarse definitivamente un efecto de la edad.
Niños y adolescentes: Hasta la fecha, no hay datos farmacocinéticos disponibles en pacientes pediátricos.
Insuficiencia renal: No se han realizado estudios formales para examinar los efectos de la insuficiencia renal sobre la farmacocinética de belimumab. Durante el desarrollo clínico, belimumab se estudió en un número limitado de pacientes con LES y con insuficiencia renal (depuración de creatinina < 60 mL/min, incluyendo un número bajo con depuración de creatinina < 30 mL/min). Aunque la presencia de proteinuria (≥ 2 g/día) aumentó la depuración de belimumab, y las disminuciones en la depuración de creatinina disminuyeron la depuración de belimumab, estos efectos se mantuvieron dentro del rango esperado de variabilidad. Por lo tanto, no se recomienda ajuste de la dosis en pacientes con insuficiencia renal.
Insuficiencia hepática: No se realizaron estudios formales para examinar los efectos de la insuficiencia hepática en la farmacocinética de belimumab. Las moléculas IgG1 como belimumab se catabolizan mediante enzimas proteolíticas ampliamente distribuidas, las cuales no están restringidas al tejido hepático; por lo tanto, no es probable que los cambios en la función hepática tengan algún efecto sobre la eliminación de belimumab.
Otras características de los pacientes: No se observó un efecto significativo del género, la raza, o la etnicidad, sobre la farmacocinética de belimumab. Los efectos del tamaño corporal en la exposición a belimumab se encuentran justificados por la dosificación normalizada con el peso.
Estudios clínicos:
Infusión intravenosa en pacientes adultos:
LES:
Se evaluó la eficacia de BENLYSTIA® IV en dos estudios aleatorizados, doble ciego, controlados con placebo y de Fase III, en 1,684 pacientes con diagnóstico clínico de LES de acuerdo con los criterios de clasificación del Colegio Americano de Reumatología (CAR). Los pacientes elegibles tenían la enfermedad de LES activo, definido como una puntuación de SELENA-SLEDAI ≥ 6 y resultados positivos en las pruebas de anticuerpos antinucleares (ANA o anti-DNA) (título de ANA ≥ 1:80 y/o anti-DNA positivos [≥ 30 unidades/mL]). Los pacientes se encontraban en un régimen terapéutico estable para LES (cuidado estándar) que consistía en cualquiera de los siguientes (solos o en combinación): corticoesteroides, anti-maláricos, AINE u otros inmunosupresores. Los pacientes fueron excluidos del estudio si tenían lupus grave activo del sistema nervioso central o nefritis lúpica activa grave, si alguna vez habían recibido tratamiento con cualquier terapia dirigida a las células B, si habían recibido otro agente biológico en investigación dentro del año previo, o si habían tenido una respuesta positiva a anticuerpos contra HIV , antígeno de superficie de hepatitis B, o anticuerpos anti-hepatitis C. Los dos estudios fueron similares en diseño exceptuando que el Estudio 1 fue de 76 semanas y el Estudio 2 fue de 52 semanas. Ambos estudios tuvieron criterios primarios de valoración de 52 semanas.
El Estudio 1 (HGS1006-C1056) se realizó principalmente en Norteamérica y en Europa Occidental. La distribución racial fue 70% blancos/Caucásicos, 14% negros/afroamericanos, 13% Nativos de Alaska o Indios Americanos, y 3% Asiáticos. Los medicamentos de base incluyeron corticoesteroides (76%), inmunosupresores (56%), y anti-maláricos (63%).
El Estudio 2 (HGS1006-C1057) se realizó en Sudamérica, Europa del Este, Asia, y Australia. La distribución racial fue 38% Asiáticos, 26% blancos/Caucásicos, 32% Nativos de Alaska o Indios Americanos, y 4% negros/Afro Americano. Los medicamentos de base incluyeron corticoesteroides (96%), inmunosupresores (42%), y anti-maláricos (67%).
La mediana de edad de los pacientes entre ambos estudios fue de 37 años (rango: 18 a 73 años), y la mayoría (94%) eran mujeres. En la selección, los pacientes fueron estratificados según la severidad de la enfermedad con base en su puntuación de SELENA-SLEDAI (≤ 9 vs. ≥ 10), nivel de proteinuria (< 2 g por 24 h vs. ≥ 2 g por 24 h), y raza, y luego se asignaron aleatoriamente para recibir 1 mg/kg de BENLYSTIA® IV, 10 mg/kg de BENLYSTIA® IV, o placebo, además del cuidado estándar. Se administró a los pacientes el medicamento del estudio por vía intravenosa durante un periodo de 1 hora los Días 0, 14, 28, y luego cada 28 días durante 48 ó 72 semanas.
El criterio de valoración primario de eficacia fue un criterio de valoración compuesto denominado como SRI (Índice de Respuesta en el LES) que definió la respuesta como el cumplimiento de cada uno de los siguientes criterios en la Semana 52 en comparación con la basal:
• Reducción ≥ 4 puntos en la calificación de SELENA-SLEDAI, y
• Sin nueva calificación de dominio orgánico A, de acuerdo al Grupo de Evaluación del Lupus de las Islas Británicas (BILAG), o dos nuevas puntuaciones/calificaciones de dominio orgánico B de acuerdo al BILAG, y
• Sin empeoramiento (incremento menor de 0.30 puntos) en la calificación de la Evaluación Global del Médico (EGM).
El Índice de Respuesta en el LES utiliza la puntuación de SELENA-SLEDAI como una medida objetiva de la reducción en la actividad global de la enfermedad; el índice BILAG se utiliza para asegurarse que no hay empeoramiento significativo en ningún sistema orgánico específico, y la EGM se utiliza para asegurarse que las mejorías en la actividad de la enfermedad no se deben a la condición global del paciente.
BENLYSTIA® IV produjo mejorías significativas en el Índice de Respuesta del LES así como en la calificación del componente individual de SELENA-SLEDAI en ambos estudios, véase Tabla 1.
Tabla 1. Tasa de respuesta en la semana 52
|
Respuesta |
Estudio 1 |
Estudio 2 |
Estudios 1 y 2 agrupados |
|||
|
Placebo (n = 275) |
BENLYSTIA® IV 10 mg/kg (n = 273) |
Placebo (n = 287) |
BENLYSTIA® IV 10 mg/kg (n = 290) |
Placebo (n = 562) |
BENLYSTIA® IV 10 mg/kg (n = 563) |
|
|
Índice de respuesta del LES |
33.8% |
43.2% (P = 0.021) |
43.6% |
57.6% (P = 0.0006) |
38.8% |
50.6% (P < 0.0001) |
|
Componentes del índice de respuesta del LES |
||||||
|
Porcentaje de pacientes con reducción en SELENA-SLEDAI ≥ 4 |
35.6% |
46.9% (P = 0.006) |
46.0% |
58.3% (P = 0.0024) |
40.9% |
52.8% (P < 0.0001) |
|
Porcentaje de pacientes sin empeoramiento por índice BILAG |
65.1% |
69.2% (P = 0.32) |
73.2% |
81.4% (P = 0.018) |
69.2% |
75.5% (P = 0.019) |
|
Porcentaje de pacientes sin empeoramiento por EGM |
62.9% |
69.2% (P = 0.13) |
69.3% |
79.7% (P = 0.0048) |
66.2% |
74.6% (P = 0.0017) |
En un análisis combinado de los dos estudios, el porcentaje de pacientes que estaban recibiendo > 7.5 mg/día de prednisona (o equivalente) en la línea basal, cuya dosis promedio de corticoesteroides se redujo por lo menos en 25% en comparación con la basal a una dosis equivalente a ≤ 7.5 mg/día de prednisona durante las Semanas 40 a 52, fue de 17.9% en el grupo recibiendo belimumab y de 12.3% en el grupo recibiendo placebo (P = 0.0451).
Las exacerbaciones de LES se definieron mediante el Índice Modificado de Exacerbaciones de LES de SELENA SLEDAI, en el que la modificación excluye exacerbaciones severas que están desencadenadas sólo por un aumento en la puntuación SELENA SLEDAI a > 12. La mediana de tiempo hasta la primera exacerbación se retrasó en el grupo combinado recibiendo belimumab en comparación con el grupo recibiendo placebo (cociente de riesgo = 0.84, P = 0.012). El riesgo de exacerbaciones severas también se redujo en 36% durante las 52 semanas de observación en el grupo que estaba recibiendo belimumab, en comparación con el grupo que estaba recibiendo placebo (cociente de riesgo =0.64, P = 0.0011).
El análisis univariable y multivariable del criterio de valoración primario demostró que el beneficio más importante se observó en los pacientes con la enfermedad más activa a la basal incluyendo pacientes con calificación de SELENA SLEDAI mayor o igual a 10, o pacientes requiriendo esteroides para controlar su enfermedad o aquellos pacientes con niveles bajos de complemento.
El análisis post-hoc identificó a un subgrupo que tuvo una alta respuesta en aquellos pacientes con niveles bajos de complemento y anti-DNAds positivos en la evaluación basal, véase la Tabla 2 para los resultados de este ejemplo de un grupo con mayor actividad de la enfermedad. De esos pacientes, el 64.5% tenía calificación de SELENA SLEDAI mayores o iguales a 10 en la evaluación basal.
Tabla 2. Pacientes con niveles de complemento bajos y anti-DNAds positivos en la evaluación basal
|
Subgrupo |
Anti-DNAds positivos y complemento bajo |
|
|
Datos agrupados BLISS-76 y BLISS-52 |
Placebo (n = 287) |
BENLYSTIA® IV 10 mg/kg (n = 305) |
|
Índice de respuesta SRI a la Semana 52 (%) |
31.7 |
51.5 (p < 0.0001) |
|
Diferencia observada tratamiento vs. placebo (%) |
19.8 |
|
|
Índice de respuesta SRI (excluyendo cambios en complemento y anti-DNAds) a la semana 52 (%) |
28.9 |
46.2 (p < 0.0001) |
|
Diferencia observada tratamiento vs. placebo (%) |
17.3 |
|
|
Exacerbaciones graves durante las 52 semanas |
||
|
Pacientes experimentando una exacerbación grave (%) |
29.6 |
19.0 |
|
Diferencia observada tratamiento vs. placebo (%) |
10.6 |
|
|
Tiempo para la exacerbación grave [índice de Riesgo (95% CI)] |
0.61 (0.44, 0.85) (p = 0.0038) |
|
|
Reducción prednisona ≥ 25% a partir de la basal a ≤ 7.5 mg/día de la semana 40 a la 521 (%) |
(n = 173) 12.1 |
(n = 195) 18.5 (p = 0.0964) |
|
Diferencia observada tratamiento vs. placebo (%) |
6.3 |
|
|
Mejoría en el índice FACIT-fatiga, desde nivel basal, a la semana-52 (promedio) |
1.99 |
4.21 (p = 0.0048) |
|
Diferencia observada tratamiento vs. placebo (diferencia promedio) |
2.21 |
|
|
Estudio BLISS-76 solamente |
Placebo (n = 131) |
BENLYSTIA® IV 10 mg/kg (n = 134) |
|
Índice de respuesta SRI a la semana 76 (%) |
||
|
Diferencia observada tratamiento vs. placebo (%) |
27.5 |
39.6 (p = 0.0160) 12.1 |
1 Entre los pacientes con dosis basal de prednisona mayor a 7.5 mg/día.
Nefritis lúpica: La eficacia y seguridad de BENLYSTIA® IV 10 mg/kg administrado por vía intravenosa durante un período de 1 hora en los días 0, 14, 28, y luego cada 28 días, se evaluaron en un estudio aleatorizado de 104 semanas (1:1), doble ciego, controlado con placebo, Fase III (BEL114054) en 448 pacientes con nefritis lúpica activa. Los pacientes presentaron un diagnóstico clínico de LES según criterios de clasificación ACR, nefritis lúpica confirmada por biopsia clase III, IV y/o V y presentaron enfermedad renal activa en la selección que requirió tratamiento estándar (corticosteroides con [1] micofenolato mofetil para inducción y mantenimiento, o [2] ciclofosfamida para la inducción seguida de azatioprina para mantenimiento). Este estudio se llevó a cabo en Asia, América del Norte, América del Sur y Europa. La mediana de edad del paciente fue de 31 años (rango: 18 a 77 años); la mayoría (88%) de los pacientes eran mujeres.
El criterio de valoración de eficacia primaria fue la Respuesta Renal de Eficacia Primaria (PERR) en la semana 104 definida como una respuesta en la semana 100 confirmada por una medición repetida en la semana 104 de los siguientes parámetros: proteína urinaria : proporción de creatinina (uPCR) ≤ 0.7 y la tasa de filtración glomerular estimada (eGFR) de ≥60 mL/min/1.73 m2 o ninguna disminución en eGFR > 20% del valor del pre-brote.
Los principales criterios de valoración secundarios incluyeron:
• Respuesta renal completa (CRR) definida como una respuesta en la semana 100 confirmada por una medición repetida en la semana 104 de los siguientes parámetros: uPCR < 0.5 y eGFR ≥ 90 mL/min/1.73 m2 o ninguna disminución en eGFR > 10% del valor del pre-brote.
• PERR en la semana 52.
• Tiempo hasta el evento relacionado con la función renal o la muerte (evento relacionado con la función renal definido como primer evento de enfermedad renal en etapa final, duplicación de creatinina sérica, empeoramiento renal [definido como aumento de la proteinuria y/o deterioro de la función renal], o recepción de terapia prohibida relacionada con la enfermedad renal).
Para los criterios de valoración PERR y CRR, el tratamiento con esteroides tuvo que ser reducido a ≤10 mg/día a partir de la semana 24 para ser considerado como respuesta. Para estos criterios de valoración, los pacientes que interrumpieron el tratamiento en una etapa temprana, recibieron medicamentos prohibidos o se retiraron del estudio en una etapa temprana, se consideraron sin respuesta.
La proporción de pacientes que alcanzaron PERR en la semana 104 fue significativamente mayor en los pacientes que recibieron belimumab en comparación con placebo. Los principales criterios de valoración secundarios también mostraron una mejora significativa con BENLYSTIA® IV en comparación con placebo (Tabla 3).
Tabla 3. Resultados de eficacia en pacientes adultos con nefritis lúpica
|
Criterio de valoración de eficacia |
Placebo N = 223 |
BENLYSTIA® IV 10 mg/kg N = 223 |
Diferencia observada vs placebo |
Tasa de probabilidad/riesgo vs. Placebo (IC 95%) |
Valor P |
|
PERR en la semana 1041 Pacientes con respuesta |
32.3% |
43.0% |
10.8% |
1.55 (1.04, 2.32) |
0.0311 |
|
Componentes de PERR |
|||||
|
Tasa proteína de orina:creatinina ≤ 0.7 |
33.6% |
44.4% |
10.8% |
1.54 (1.04, 2.29) |
0.0320 |
|
eGFR ≥ 60 mL/min/1.73 m2 o sin disminución de eGFR del valor del pre-brote de > 20% |
50.2% |
57.4% |
7.2% |
1.32 (0.90, 1.94) |
0.1599 |
|
Sin falla en el tratamiento3 |
74.4% |
83.0% |
8.5% |
1.65 (1.03, 2.63) |
0.0364 |
|
CRR en la semana 1041 Pacientes con respuesta |
19.7% |
30.0% |
10.3% |
1.74 (1.11, 2.74) |
0.0167 |
|
Componentes de CRR |
|||||
|
Tasa proteína de orina:creatinina < 0.5 |
28.7% |
39.5% |
10.8% |
1.58 (1.05, 2.38) |
0.0268 |
|
eGFR ≥ 90 mL/min/1.73 m2 o sin disminución de eGFR del valor del pre- brote de > 10% |
39.9% |
46.6% |
6.7% |
1.33 (0.90, 1.96) |
0.1539 |
|
Sin falla en el tratamiento3 |
74.4% |
83.0% |
8.5% |
1.65 (1.03, 2.63) |
0.0364 |
|
PERR en la semana 521 Pacientes con respuesta |
35.4% |
46.6% |
11.2% |
1.59 (1.06, 2.38) |
0.0245 |
|
Tiempo para el evento relacionado con la función renal o la muerte1 Porcentaje de pacientes con evento2 |
28.3% |
15.7% |
- |
||
|
Tiempo para el evento (Tasa de riesgo [IC 95%]) |
- |
0.51 (0.34, 0.77) |
0.0014 |
||
1 La PERR en la semana 104 fue el principal análisis de eficacia; CRR en la semana 104, PERR en la semana 52 y el tiempo para eventos relacionados con la función renal o la muerte se incluyeron en la jerarquía de pruebas pre-especificadas.
2 Al excluir las muertes del análisis (1 para BENLYSTIA® IV; 2 para placebo), el porcentaje de pacientes con un evento relacionado con la función renal fue del 15.2% para BENLYSTIA® IV en comparación con el 27.4% para placebo (HR – 0.51; IC 95%: 0.34, 0.78).
3 Falla en el tratamiento: los pacientes que tomaron medicamentos prohibidos por protocolo.
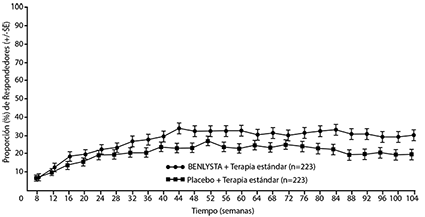
Un porcentaje numéricamente mayor de pacientes que recibieron BENLYSTIA® IV lograron PERR a partir de la semana 24 en comparación con placebo, y esta diferencia de tratamiento se mantuvo hasta la semana 104. A partir de la semana 12, un porcentaje numéricamente mayor de pacientes que recibieron BENLYSTIA® IV logró la CRR en comparación con placebo y la diferencia numérica se mantuvo hasta la semana 104 (Figura 1).
Figura 1. Tasas de respuesta en adultos con nefritis lúpica por visita respuesta renal de eficacia primaria (PERR)
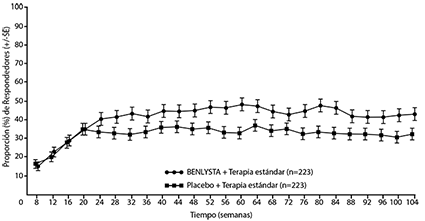
Respuesta renal completa (CRR)
Pacientes de raza negra: BENLYSTIA® IV se administró por vía intravenosa a pacientes de raza negra en un estudio de fase III/IV aleatorizado (2:1), doble ciego, controlado con placebo de 52 semanas (BEL115471). Se evaluó la eficacia en 448 pacientes. El diseño del estudio fue el mismo que el de los estudios pivote resumidos anteriormente, aparte de: los pacientes incluidos tuvieron una puntuación SELENA SLEDAI ≥ 8 y el criterio de valoración primaria fue la respuesta del SRI en la Semana 52 con puntuación SLEDAI-2K modificada para proteinuria (SRI-S2K). El estudio se realizó en América del Norte, América del Sur, Europa y África. La edad media de los pacientes fue de 38 años (rango: 18 a 71 años), y la mayoría de los pacientes fueron femeninos (97%).
La proporción de pacientes de raza negra que lograron una respuesta SRI-S2K fue mayor en los pacientes que recibieron BENLYSTIA® IV, pero la diferencia no fue estadísticamente significativa en comparación con el placebo. Las tendencias en las comparaciones entre los grupos de tratamiento para las tasas de la respuesta para los componentes individuales del punto final fueron generalmente consistentes con la del SRI-S2K (véase Tabla 4).
Tabla 4. Tasa de respuesta en pacientes de raza negra en la semana 52
|
Respuesta1 |
Placebo (n = 149) |
BENLYSTIA® IV 10 mg/kg (n = 298) |
|
Índice de respuesta de LES (SRI-S2K) Relación de probabilidades (IC 95%) versus placebo |
41.6% |
48.7% 1.40 (0.93, 2.11) (P = 0.1068) |
|
Componentes del índice de respondedor LES (SRI-S2K) |
||
|
Porcentaje de pacientes con reducción en SELENA-SLEDAI-S2K ≥ 4 |
42.3% |
50.0% |
|
Relación de probabilidades (IC 95%) versus placebo |
1.46 (0.97, 2.20) |
|
|
Porcentaje de pacientes sin empeoramiento por el índice BILAG |
62.4% |
67.8% |
|
Relación de probabilidades (IC 95%) versus placebo |
1.24 (0.81, 1.88) |
|
|
Porcentaje de pacientes sin empeoramiento por EGM |
64.4% |
69.5% |
|
Relación de probabilidades (IC 95%) versus placebo |
1.26 (0.82, 1.93) |
|
1 El análisis excluyó a cualquier sujeto al que le faltara una evaluación inicial para cualquiera de los componentes (1 para belimumab)
El perfil de seguridad de BENLYSTIA® IV en pacientes de raza negra (n = 331) fue consistente con el perfil de seguridad conocido de BENLYSTIA® IV en la población general.
De acuerdo con los resultados de otros estudios, en pacientes con alta actividad de la enfermedad (complemento bajo y anti-dsDNA positivo al inicio del estudio, n = 141) la respuesta SRI-S2K fue de 45.1% para BENLYSTIA® IV 10 mg/kg en comparación con 24.0% para placebo (relación de probabilidades 3,00; IC del 95%: 1.35, 6.68). Estos resultados sugieren una mayor respuesta relativa al BENLYSTIA® IV en comparación con el placebo en pacientes de raza negra con alta actividad de la enfermedad.
Otros grupos especiales de pacientes:
Hubo muy pocos hombres o pacientes mayores de 65 años de edad enrolados en los estudios clínicos controlados para describir conclusiones significativas sobre los efectos del género o la edad en los resultados clínicos.
CONTRAINDICACIONES: Hipersensibilidad al principio activo o a cualquiera de los componentes de la fórmula, embarazo y lactancia.
NIÑOS Y ADOLESCENTES MENORES DE 18 AÑOS DE EDAD:?
BENLYSTIA® IV no ha sido estudiado en pacientes menores de 18 años de edad. No existen datos acerca de la seguridad y eficacia de belimumab en este grupo de edad.Pacientes que han demostrado anafilaxia a BENLYSTIA® IV.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Existen datos limitados acerca del uso de BENLYSTIA® IV en mujeres embarazadas. Los datos posteriores a la comercialización de un registro prospectivo de embarazo han recolectado información sobre el embarazo en mujeres expuestas a belimumab. Debido al pequeño tamaño de muestra logrado, no se pueden sacar conclusiones definitivas de este registro con respecto al riesgo potencial de defectos congénitos después de la exposición a belimumab.
Los anticuerpos tipo inmunoglobulina G (IgG), incluyendo belimumab, pueden cruzar la placenta. BENLYSTIA® IV no debe utilizarse durante el embarazo.
Si se quiere garantizar la prevención del embarazo, las mujeres en edad reproductiva deben utilizar métodos anticonceptivos adecuados mientras utilizan BENLYSTIA® IV y durante al menos 4 meses después del último tratamiento con BENLYSTIA® IV.
Lactancia: No se ha establecido la seguridad de BENLYSTIA® IV durante la lactancia. No existen datos acerca de la excreción de belimumab en la leche materna, o de la absorción sistémica de belimumab después de la ingestión. Aunque, belimumab se excretó en la leche de monos macacos a las que se administró con 150 mg/kg cada 2 semanas, la literatura publicada sugiere que el consumo de leche materna en neonatos humanos y lactantes no resulta en absorción clínicamente significativa de anticuerpos IgG maternos hacia la circulación.
Se recomienda tomar una decisión acerca del tratamiento con BENLYSTIA® IV en madres en lactancia, tomando en cuenta la importancia de la lactancia para el lactante y la importancia del fármaco para la madre y cualquier potencial efecto adverso por belimumab para el lactante o por la condición materna subyacente.
REACCIONES SECUNDARIAS Y ADVERSAS: La seguridad de BENLYSTIA® IV en pacientes con LES se evaluó en tres estudios controlados con placebo pre autorización donde se administraba por vía intravenosa, y un estudio regional subsecuente administrado por vía intravenosa controlado con placebo, un estudio administrado por vía subcutánea controlado con placebo, y dos estudios administrados por vía intravenosa, controlados con placebo posterior a la comercialización. La seguridad en pacientes con nefritis lúpica activa se ha evaluado en un estudio intravenoso controlado con placebo.
Los datos descritos en la tabla a continuación reflejan la exposición a BENLYSTIA® IV administrado por vía intravenosa en 674 pacientes con LES de los tres estudios clínicos preautorización y 470 pacientes en el estudio posterior controlado con placebo (10 mg/kg durante un periodo de 1 hora los días 0, 14, 28, y luego cada 28 días hasta 52 semanas), y 556 pacientes con LES administrados con BENLYSTIA® IV por vía subcutánea (200 mg una vez por semana hasta 52 semanas). Los datos de seguridad presentados incluyen datos posteriores a la semana 52 de algunos pacientes con LES. Los datos reflejan una exposición adicional en 224 pacientes con nefritis lúpica activa que recibieron BENLYSTIA® IV por vía intravenosa (10 mg/kg hasta por 104 semanas). También se incluye información de los reportes postcomercialización.
La mayoría de los pacientes también recibieron uno o más de los siguientes tratamientos concomitantes para el LES: corticoesteroides, agentes inmunomoduladores, anti-maláricos, antiinflamatorios no esteroideos.
Se notificaron reacciones adversas en 84 % de los pacientes tratados con BENLYSTIA® IV y en el 87% de los pacientes tratados con placebo. Las reacciones adversas notificadas más frecuentes (≥ 5% de los pacientes con LES tratado con BENLYSTIA® IV junto con el tratamiento estándar y en una tasa ≥ 1% mayor que placebo) fue nasofaringitis. La proporción de pacientes que suspendió el tratamiento debido a reacciones adversa fue del 7% para pacientes tratados con BENLYSTIA® IV y del 8% para pacientes tratados con placebo.
Las reacciones adversas notificadas más frecuentes (> 5% de los pacientes con nefritis lúpica activa tratados con BENLYSTIA® IV y con el tratamiento estándar) fueron: infección del tracto respiratorio superior, infección del tracto urinario y herpes zóster. La proporción de pacientes que interrumpieron el tratamiento debido a reacciones adversas fue del 12.9% para los pacientes tratados con BENLYSTIA® IV y del 12.9% para pacientes tratados con placebo.
Lista tabulada de reacciones adversas: Las reacciones adversas, se enumeran en base a la clasificación de órganos y sistemas de MedDRA y por frecuencia. Las categorías de frecuencia utilizadas son:
Muy común ≥ 1/10.
Común ≥ 1/100 y < 1/10.
No común ≥ 1/1,000 y < 1/100.
Raras ≥ 1/10,000 y < 1/1,000.
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. La frecuencia dada es la más alta observada con cualquiera de las formulaciones.
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas |
|
Infecciones e infestaciones1 |
Muy comunes |
Infecciones bacterianas, como bronquitis, infección del tracto urinario. |
|
Comunes |
Gastroenteritis viral, faringitis, nasofaringitis, infección viral del tracto respiratorio superior. |
|
|
Trastornos de la sangre y del sistema linfático |
Comunes |
Leucopenia. |
|
Trastornos del sistema inmunológico |
Comunes |
Reacciones de hipersensibilidad2. |
|
Poco comunes |
Reacciones anafilácticas. |
|
|
Raras |
Reacciones de hipersensibilidad tardía no aguda. |
|
|
Trastornos psiquiátricos |
Comunes |
Depresión. |
|
Poco comunes |
Comportamiento suicida, ideación suicida. |
|
|
Trastornos del sistema nervioso |
Comunes |
Migraña. |
|
Trastornos gastrointestinales |
Comunes |
Diarrea, náuseas. |
|
Trastornos de la piel y del tejido subcutáneo |
Comunes |
Urticaria, erupción cutánea. |
|
Poco comunes |
Angioedema |
|
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Comunes |
Dolor en las extremidades. |
|
Trastornos generales y alteraciones en el lugar de la administración |
Comunes |
Reacciones sistémicas relacionadas con la infusión o inyección2, pirexia. |
1 Véase “Descripción de reacciones adversas seleccionadas” e “Infecciones” para mayor información.
2 “Reacciones de hipersensibilidad" considera un grupo de términos, incluyendo anafilaxia, que se puede manifestar como diferentes síntomas incluyendo hipotensión, angioedema, urticaria u otro exantema, prurito, y disnea. “Las reacciones sistémicas relacionadas con la infusión o inyección" consideran un grupo de términos y puede manifestarse con diferentes síntomas incluyendo bradicardia, mialgia, cefalea, exantema, urticaria, fiebre, hipotensión, hipertensión, mareo, y artralgia. Debido a la similitud de signos y síntomas, no es posible distinguir entre reacciones de hipersensibilidad y reacciones relacionadas con la infusión o inyección en todos los casos.
Descripción de reacciones adversas seleccionadas: Los datos presentados a continuación se agrupan a partir de los tres estudios clínicos previos al registro de administración intravenosa (10 mg/kg dosis intravenosa únicamente) y el estudio clínico subcutáneo. Las "Infecciones" y "Trastornos psiquiátricos" también incluyen datos de un estudio postcomercialización.
Reacciones sistémicas relacionadas con la infusión o inyección y reacciones de hipersensibilidad: Generalmente se observaron reacciones de hipersensibilidad el día de la administración, pero las reacciones de hipersensibilidad aguda se pueden producir también varios días después de la administración. Los pacientes con antecedentes de múltiples alergias a medicamentos o reacciones de hipersensibilidad significativas pueden estar en un mayor riesgo.
La incidencia de reacciones relacionadas con la infusión y reacciones de hipersensibilidad tras la administración intravenosa durante los 3 días posteriores a la infusión fue del 12% en el grupo que recibió BENLYSTIA® IV y 10% en el grupo que recibió placebo, de los que 1.2% y 0.3% respectivamente, requirieron interrupción permanente del tratamiento.
Infecciones: La incidencia global de las infecciones en los estudios de LES con administración intravenosa y subcutánea previos al registro fue del 63% en ambos grupos que recibieron BENLYSTIA® IV o placebo. Las infecciones que ocurrieron en al menos 3% de los pacientes que recibieron BENLYSTIA® IV y que fueron por lo menos un 1% más frecuentes que en los pacientes que recibieron placebo, fueron infecciones virales del tracto respiratorio superior, bronquitis e infecciones bacterianas del tracto urinario. Las infecciones graves ocurrieron en 5 % de los pacientes en ambos grupos que recibieron BENLYSTIA® IV o placebo; las infecciones oportunistas graves representaron el 0.4% y el 0%, respectivamente; las infecciones que condujeron a una interrupción del tratamiento se produjeron en el 0.7% de los pacientes que recibieron BENLYSTIA® IV y en el 1.5% de los pacientes que recibieron placebo. Algunas infecciones fueron graves o mortales.
En el estudio de nefritis lúpica, los pacientes estuvieron recibiendo una terapia estándar base (véase Eficacia y Seguridad Clínica) y la incidencia total de infecciones fue del 82% en pacientes que recibieron BENLYSTIA® IV en comparación con el 76% en pacientes que recibieron placebo. Se produjeron infecciones graves en el 13.8% de los pacientes que recibieron BENLYSTIA® IV y en el 17.0% de los pacientes que recibieron placebo. Se produjeron infecciones mortales en el 0.9% (2/224) de los pacientes que recibieron BENLYSTIA® IV y en el 0.9% (2/224) de los pacientes que recibieron placebo.
En un estudio de seguridad en LES posterior a la comercialización, aleatorizado, doble ciego, de 52 semanas de duración (BEL115467), que evaluó la mortalidad y los eventos adversos específicos en adultos, se produjeron infecciones graves en el 3.7% de los pacientes que recibieron BENLYSTIA® IV (10 mg/kg por vía intravenosa) frente al 4.1% de los pacientes que recibieron placebo. Sin embargo, se produjeron infecciones graves (p. ej. neumonía y sepsis) en el 0.45% (9/2002) de los pacientes que recibieron BENLYSTIA® IV y en el 0.15% (3/2001) de los pacientes que recibieron placebo, mientras que la incidencia de mortalidad por todas las causas fue del 0.50% (10/2002) frente al 0.40% (8/2001), respectivamente. La mayoría de las infecciones mortales se observaron durante las primeras 20 semanas de tratamiento con BENLYSTIA® IV.
Trastornos psiquiátricos: En estudios clínicos de LES preautorización por vía intravenosa se notificaron eventos psiquiátricos graves en el 1.2% (8/674) de los pacientes que recibieron BENLYSTIA® IV 10 mg/kg y en el 0.4% (3/675) de los pacientes que recibían placebo. Se informó depresión grave en el 0.6% (4/674) de los pacientes que recibieron BENLYSTIA® IV 10 mg/kg y en el 0.3% (2/675) de los pacientes que recibieron placebo. Hubo dos suicidios en los pacientes tratados con BENLYSTIA® IV (incluyendo uno que recibió 1 mg/kg de BENLYSTIA® IV).
En un estudio posterior a la comercialización de LES, se informaron eventos psiquiátricos graves en el 1.0% (20/2002) de los pacientes que recibieron BENLYSTIA® IV y en el 0.3% (6/2001) de pacientes que recibieron placebo. Se notificó depresión grave en el 0.3% (7/2002) de los pacientes que recibieron BENLYSTIA® IV y en < 0.1% (1/2001) que recibieron placebo. La incidencia global de ideación o conducta suicida grave o autolesión sin intención suicida fue del 0.7% (15/2002) en el grupo de BENLYSTIA® IV y del 0.2% (5/2001) en el grupo de placebo. No se reportó suicidio en ninguno de los grupos.
Los estudios de LES intravenosos anteriores no excluyeron a pacientes con antecedentes de trastornos psiquiátricos.Leucopenia: La incidencia de leucopenia notificada en pacientes con LES como un evento adverso fue del 3% en el grupo que recibió BENLYSTIA® IV y del 2% en el grupo que recibió placebo.
Trastornos gastrointestinales: Los pacientes obesos [Índice de Masa Corporal (IMC)> 30 kg/m2] con LES tratados con BENLYSTIA® IV administrado por vía intravenosa presentaron tasas más altas de náuseas, vómito y diarrea frente al placebo, y en comparación con los pacientes con peso normal (IMC ≥ 18.5 a ≤ 30 kg/m2). Ninguno de estos acontecimientos gastrointestinales en los pacientes obesos fue grave.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Hasta el momento no hay eventos relacionados con la administración de belimumab.
Información pre-clínica: Los datos preclínicos no revelaron ninguna amenaza especial para los humanos en base a los estudios de toxicidad con dosis repetidas y de toxicidad reproductiva.
La administración intravenosa y subcutánea en monos, causó una reducción esperada en la cuenta de células B periféricas y en tejido linfoide, sin hallazgos toxicológicos asociados.
Se han realizado estudios reproductivos en monos cynomolgus preñados que estaban recibiendo 150 mg/kg de belimumab mediante infusión intravenosa (aproximadamente 9 veces la exposición clínica máxima anticipada en humanos) cada 2 semanas hasta por 21 semanas, y el tratamiento con belimumab no se asoció con efectos perjudiciales directos o indirectos respecto a la toxicidad materna, toxicidad en el desarrollo, o teratogenicidad.
Los hallazgos relacionados con el tratamiento se limitaron a una reducción esperada reversible de las células B, tanto en hembras como en lactantes, así como reducción reversible de IgM en monos lactantes. Los números de células B se recuperaron después de suspender el tratamiento con belimumab aproximadamente 1 año después del parto en monos adultos, y a los 3 meses de vida en monos lactantes; los niveles de IgM en lactantes expuestos a belimumab en útero se recuperaron a los 6 meses de edad.
Debido a que belimumab es un anticuerpo monoclonal, no se han realizado estudios de genotoxicidad. No se han realizado estudios de carcinogenicidad o de fertilidad (machos o hembras).
Fertilidad: No existen datos sobre los efectos de BENLYSTIA® IV en la fertilidad humana. En estudios realizados en animales, no se han evaluado los efectos en la fertilidad masculina y femenina (véase Información preclínica).
Los estudios realizados en animales no indicaron efectos dañinos directos o indirectos con respecto a toxicidad materna, embarazo o desarrollo embriofetal. Los hallazgos relacionados con el tratamiento se limitaron a reducciones reversibles de las células B en monos lactantes (véase Información preclínica). Se debe monitorear una disminución de células B en los lactantes de madres tratadas y dependiendo de los resultados, considerar el retrasar la vacunación con virus vivos. La reducción de células B en lactantes puede también interferir con la respuesta a las inmunizaciones (véase Precauciones generales).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se han realizado estudios de interacción con BENLYSTIA® IV.
En los ensayos clínicos, la administración concomitante de micofenolato de mofetilo, ciclofosfamida, azatioprina, hidroxicloroquina, metotrexato, anti-inflamatorios no esteroideos, aspirina, e inhibidores de la HMG CoA reductasa no mostró efecto significativo con la exposición de belimumab (véase Farmacocinética).
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: La incidencia de leucopenia notificada en pacientes con LES como un evento adverso fue del 3% en el grupo que recibió BENLYSTIA® IV y del 2% en el grupo que recibió placebo.
PRECAUCIONES GENERALES:
BENLYSTIA® IV no ha sido estudiado en los siguientes grupos de pacientes, y no se recomienda su uso en:
• Lupus del sistema nervioso central activo grave.
• VIH.
• Pacientes con antecedentes o infección activa por virus de hepatitis B o C.
• Hipogammaglobulinemia (IgG < 400 mg) o deficiencia de la IgA (IgA < 10 mg/dL).
• Antecedentes de trasplante de órgano mayor o trasplante de células madre hematopoyética/médula ósea o trasplante renal.
Uso concomitante con tratamientos dirigidos a las células B: Los datos disponibles no respaldan la seguridad y eficacia de rituximab coadministrado con BENLYSTIA® IV en pacientes con LES. La seguridad y eficacia de BENLYSTIA® IV no ha sido estudiada en combinación con tratamientos dirigidos a las células B. Debe tenerse precaución si BENLYSTIA® IV se co-administra con otros tratamientos dirigidos a las células B.
Reacciones sistémicas relacionadas a la infusión e hipersensibilidad: La administración de BENLYSTIA® IV puede ocasionar reacciones sistémicas relacionadas a la infusión e hipersensibilidad que pueden ser graves, o fatales. En caso de que se presente una reacción grave, debe interrumpirse la administración de BENLYSTIA® IV y administrarse un tratamiento médico apropiado. Los pacientes con historia de múltiples alergias a medicamentos o hipersensibilidad significativa pueden estar en mayor riesgo (véase Reacciones secundarias y adversas).
Las reacciones sistémicas relacionadas a la infusión y las reacciones de hipersensibilidad ocurrieron con mayor frecuencia en las primeras dos dosis y tendieron a disminuir con las dosis subsiguientes. Se ha observado demora en el inicio de reacciones de hipersensibilidad aguda. Los pacientes tratados con BENLYSTIA® IV deben ser advertidos de los riesgos potenciales, los signos y síntomas de tales reacciones, y de la importancia de buscar inmediatamente atención médica. Los síntomas pueden incluir reacciones anafilácticas, bradicardia, hipotensión, angioedema y disnea. También pueden ocurrir reacciones no agudas de hipersensibilidad retardada tales como exantema, náusea, fatiga, mialgia, cefalea, y edema facial.
Información adicional para la administración intravenosa:
En estudios clínicos, las reacciones graves a la infusión e hipersensibilidad afectaron a menos del 1% de los pacientes. Se ha observado un retraso en la aparición de reacciones de hipersensibilidad aguda.
Por lo tanto, se debe monitorear a los pacientes durante y por un periodo apropiado después de la administración intravenosa de BENLYSTIA® IV. Puede administrarse premedicación con un antihistamínico oral, con o sin un antipirético, antes de la infusión de BENLYSTIA® IV. Hay evidencia insuficiente para determinar si la premedicación disminuye la frecuencia o gravedad de las reacciones de infusión.
Riesgo de infecciones: Como con otros agentes inmunomoduladores, el mecanismo de acción de BENLYSTIA® IV puede aumentar el riesgo de desarrollar infecciones. En estudios clínicos controlados, la incidencia de infecciones graves fue poco común, pero se produjeron con más frecuencia en pacientes que recibieron BENLYSTIA® IV en comparación con placebo. En general, la incidencia de infecciones graves fue similar en los grupos de BENLYSTIA® IV y placebo (véase Reacciones secundarias y adversas). Los pacientes que desarrollen una infección al estar bajo tratamiento con BENLYSTIA® IV, deben ser monitoreados estrechamente, y se debe considerar la posibilidad de suspender el tratamiento inmunosupresor.
Los médicos deben tener precaución al considerar el uso de BENLYSTIA® IV en pacientes con infecciones graves o crónicas.
Depresión y suicidio: En estudios clínicos controlados intravenosos y subcutáneos, se han notificado con más frecuencia trastornos psiquiátricos (depresión, ideación y comportamiento suicida) en pacientes que reciben tratamiento con BENLYSTIA® IV, incluidos 1 caso de suicidio en un paciente que recibió 10 mg/kg y otro caso de suicidio en un paciente que recibió 1 mg/kg (véase Reacciones Secundarias y Adversas). Los médicos deben evaluar cuidadosamente el riesgo de depresión y suicidio considerando el historial médico del paciente y el estado psiquiátrico actual antes del tratamiento con BENLYSTIA® IV, y continuar monitoreando a los pacientes durante el tratamiento. Los médicos deben aconsejar a los pacientes (y cuidadores cuando corresponda) que se comuniquen con el personal de atención médica acerca de síntomas psiquiátricos nuevos o que empeoren. El riesgo y el beneficio de continuar el tratamiento con BENLYSTIA® IV se deben evaluar cuidadosamente para los pacientes que desarrollan tales síntomas.
Leucoencefalopatía Multifocal Progresiva (PML, por las siglas en inglés para Progressive Multifocal Leukoencephalopathy):
Se ha reportado Leucoencefalopatía Multifocal Progresiva (PML), en pacientes con LES que reciben farmacoterapia inmunosupresora, incluyendo BENLYSTIA® IV. Se debe considerar un diagnóstico de PML en cualquier paciente que presente signos y síntomas neurológicos de nueva aparición o deterioro. El paciente deberá ser referido con un neurólogo u otro especialista apropiado para evaluación como está clínicamente indicado, si se sospecha de PML, se debe suspender la terapia inmunosupresora, incluyendo BENLYSTIA® IV, hasta que la PML se haya eliminado. Si la PML es confirmada, la terapia inmunosupresora, incluyendo BENLYSTIA® IV se debe suspender.
Riesgo de neoplasias malignas: Como con otros agentes inmunomoduladores, el mecanismo de acción de BENLYSTIA® IV puede aumentar el riesgo potencial de desarrollar neoplasias malignas. En estudios clínicos, no se observó diferencia alguna en la tasa de neoplasias malignas entre los grupos tratados con BENLYSTIA® IV y los grupos tratados con placebo.
Inmunización: Las vacunas con microorganismos vivos no deben administrarse 30 días antes o de manera concurrente con BENLYSTIA® IV, ya que no se ha establecido su seguridad clínica. No hay datos disponibles acerca de la transmisión secundaria de infección de personas que reciben vacunas vivas a los pacientes que están recibiendo BENLYSTIA® IV.
Debido a su mecanismo de acción, BENLYSTIA® IV puede interferir con la respuesta a las inmunizaciones. Sin embargo, en un estudio para evaluar la respuesta a una vacuna 23 valente antineumocóccica, las respuestas globales inmunológicas a los diferentes serotipos fueron similares en pacientes con LES recibiendo BENLYSTIA® IV comparado con aquellos no recibiendo tratamiento en el momento de la vacunación.
Existen datos limitados que sugieren que BENLYSTIA® IV no afecta significativamente la capacidad de mantener una respuesta inmune protectora a las inmunizaciones recibidas antes de la administración de BENLYSTIA® IV.
Efectos sobre la capacidad de conducir y utilizar máquinas: No se han realizado estudios para investigar el efecto de BENLYSTIA® IV en el desempeño para manejar o la capacidad de operar maquinaria. No se predicen efectos negativos sobre dichas actividades con base en la farmacología de BENLYSTIA® IV.
Debe tenerse en mente el estado clínico del paciente y el perfil de seguridad de BENLYSTIA® IV al considerar la capacidad del paciente para realizar tareas que requieren juicio, habilidades motoras o cognitivas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
BENLYSTIA® IV se administra por vía intravenosa mediante infusión, y debe reconstituirse y diluirse antes de la administración (véase Instructivo-Instrucciones paso a paso para uso y manejo).
BENLYSTIA® IV debe ser administrado por un profesional de la salud entrenado en el tratamiento de reacciones de hipersensibilidad incluyendo la anafilaxia.
BENLYSTIA® IV debe infundirse durante un periodo de 1 hora.
BENLYSTIA® IV no se debe administrar como pulso o bolo intravenoso.
La velocidad de infusión puede disminuirse o interrumpirse si el paciente desarrolla una reacción a la infusión. La infusión debe suspenderse inmediatamente si el paciente presenta una reacción adversa potencialmente mortal (véase Contraindicaciones y Precauciones generales).
Se debe monitorear a los pacientes durante y por un periodo de tiempo apropiado después de la administración de BENLYSTIA® IV (véase Precauciones generales).
Premedicación para la infusión intravenosa:
Puede administrarse premedicación con un antihistamínico oral, con o sin un antipirético, antes de la infusión de BENLYSTIA® IV (véanse Precauciones generales y Farmacocinética - Eficacia y seguridad clínica).
Adultos:
LES
El régimen de dosificación recomendado es de 10 mg/kg los días 0, 14 y 28, y posteriormente en intervalos de 4 semanas. Debe considerarse la interrupción del tratamiento con BENLYSTIA® IV si no hay mejoría en el control de la enfermedad después de 6 meses de tratamiento.
Nefritis lúpica:
El régimen de dosificación recomendado es de 10 mg/kg los días 0, 14 y 28, y posteriormente en intervalos de 4 semanas.
Población pediátrica: BENLYSTIA® IV no ha sido estudiado en pacientes menores de 18 años de edad. No existen datos acerca de la seguridad y eficacia de belimumab en este grupo de edad.
Pacientes de edad avanzada: Aunque los datos son limitados, no se recomienda un ajuste de la dosis (véase Farmacocinética-Grupos Especiales de Pacientes).
Insuficiencia renal: No se han realizado estudios formales de BENLYSTIA® IV en pacientes con insuficiencia renal.
BENLYSTIA® IV ha sido estudiado en un número limitado de pacientes con LES con insuficiencia renal. No se requiere ajuste de la dosis en pacientes con insuficiencia renal (véase Farmacocinética-Grupos Especiales de Pacientes).
Insuficiencia hepática: No se han realizado estudios formales de BENLYSTIA® IV en pacientes con insuficiencia hepática. Sin embargo, no es probable que los pacientes con insuficiencia hepática requieran modificaciones de la dosis (véase Farmacocinética; Poblaciones de pacientes especiales).
Uso y manejo:
Reconstitución y dilución:
BENLYSTIA® IV no contiene conservadores; por lo tanto, la reconstitución y la dilución deben realizarse bajo condiciones asépticas.
Permita que el frasco ámpula se entibie a temperatura ambiente durante 10 a 15 minutos.
Se recomienda usar una aguja calibre 21-25 para perforar el tapón del frasco para reconstituir y diluir.
El frasco ámpula monodosis de 120 mg de BENLYSTIA® IV debe reconstituirse con 1.5 mL de agua estéril para uso inyectable, para lograr una concentración final de 80 mg/mL de belimumab. El frasco ámpula monodosis de 400 mg de BENLYSTIA® IV debe reconstituirse con 4.8 mL de agua estéril para uso inyectable para lograr una concentración final de 80 mg/mL de belimumab.
El chorro de agua estéril para uso inyectable debe dirigirse hacia la pared del frasco ámpula para minimizar la formación de espuma. Haga remolinos suaves con el frasco ámpula durante 60 segundos. Permita que el frasco ámpula se asiente a temperatura ambiente durante la reconstitución, haciendo remolinos suaves con el frasco ámpula durante 60 segundos cada cinco minutos hasta que el polvo se disuelva. No agite.
La reconstitución normalmente está completa 10-15 minutos después de haber añadido el agua estéril para uso inyectable, pero puede tomar hasta 30 minutos. Proteja la solución reconstituida de la luz solar directa.
Si se utiliza un dispositivo mecánico de reconstitución para reconstituir BENLYSTIA® IV, no debe exceder 500 rpm y no se debe girar el frasco ámpula por más de 30 minutos.
Una vez que la reconstitución esté completa, la solución deberá ser opalescente e incolora a amarillo pálido, y sin partículas. Sin embargo, se esperan y son aceptables pequeñas burbujas de aire.
El medicamento reconstituido se diluye a 250 mL con solución de cloruro de sodio 9 mg/mL (solución salina normal al 0.9%), para infusión intravenosa.
Las soluciones de dextrosa intravenosa al 5% son incompatibles con BENLYSTIA® IV y no deben utilizarse: De una bolsa o frasco de infusión de 250 mL de solución salina normal, al 0.9%, retire y elimine un volumen equivalente al volumen requerido de solución reconstituida de BENLYSTIA® IV para la dosis del paciente. Luego se agrega el volumen necesario de la solución reconstituida de BENLYSTIA® IV en la bolsa o frasco de infusión. Invierta suavemente la bolsa o frasco para mezclar la solución. Se deberá desechar cualquier solución no utilizada en los frascos ámpulas.
Inspeccione visualmente la solución de BENLYSTIA® IV en busca de partículas y decoloración antes de la administración. Deseche la solución si se observan partículas o decoloración.
Si no se utiliza inmediatamente, se debe proteger la solución reconstituida de la luz solar directa y almacenarse en refrigeración entre 2°C a 8°C. Las soluciones diluidas en solución salina normal al 0.9% pueden almacenarse entre 2°C a 8°C o a temperatura ambiente (a no más de 25°C).
El tiempo total desde la reconstitución de BENLYSTIA® IV hasta la finalización de la administración de la infusión no debe exceder ocho horas.
Administración:
BENLYSTIA® IV debe administrarse en infusión durante un periodo de 1 hora.
BENLYSTIA® IV no debe administrarse concomitantemente en infusión en la misma línea intravenosa con otros agentes. No se han realizado estudios físicos o bioquímicos de compatibilidad para evaluar la coadministración de BENLYSTIA® IV con otros agentes.
No se han observado incompatibilidades entre BENLYSTIA® IV y las bolsas de cloruro de polivinilo o poliolefina.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Hay experiencia limitada con la sobredosis de BENLYSTIA® IV. Las reacciones adversas asociadas con casos de sobredosificación han sido consistentes con aquellas esperadas para belimumab.
Se han administrado dos dosis hasta de 20 mg/kg por infusión intravenosa con 21 días de diferencia en humanos, sin aumento en la incidencia o severidad de las reacciones adversas, en comparación con dosis de 1, 4 o 10 mg/kg.
PRESENTACIONES: Caja de cartón con un frasco ámpula con 120 mg o 400 mg de polvo liofilizado (80 mg/mL después de la reconstitución) e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Frasco ámpula cerrado:
Consérvese la caja bien cerrada, en refrigeración entre 2°C y 8°C. No se congele.
Protéjase de la luz.
Almacenar en la caja original hasta su uso.
Solución reconstituida:
Si la solución reconstituida en el frasco ámpula no se utiliza de inmediato, deberá protegerse de la luz solar directa, y almacenarse en refrigeración de 2 °C a 8 °C.
Después de la reconstitución del liofilizado con agua estéril para uso inyectable, y de la dilución con solución de NaCl al 0.9%, la solución puede almacenarse en refrigeración de 2 °C a 8 °C o a no más de 25 °C. Proteger de la luz solar directa.
El tiempo total desde la reconstitución en el frasco ámpula hasta que finalice la administración de la infusión no debe exceder 8 horas.
Protéjase de la luz solar directa.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. No se administre si el cierre ha sido violado. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. No se use en el embarazo y lactancia. No se use en menores de 18 años. No debe mezclarse con otros medicamentos.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx y
farmacovigilancia.mx@gsk.com
Titular del Registro Sanitario:
Glaxo Wellcome, S.A.
Avda. Extremadura, 3, Pol. Ind. Allendeduero,
Aranda de Duero, 09400 Burgos, España.
Representante Legal:
GLAXOSMITHKLINE MÉXICO, S.A. de C.V.
Autopista México-Querétaro Km. 41.5 Edif. TR9,
Interior 5-C, Ex. Hacienda San Miguel,
C.P. 54715, Cuautitlán Izcalli, México, México.
Reg. Núm. 292M2012, SSA IV
®Marca registrada