BENTABUD - Suspensión nasal
Sustancia(s):
- Budesonida
Presentaciones:
- 1 Caja, 1 Frasco pulverizador, 120 Dosis, 32 µg/dosis
- 1 Caja, 1 Frasco pulverizador, 120 Dosis, 64 µg/dosis
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada mL contiene:
Budesonida 0.64 mg o 1.28 mg
Vehículo cbp 1 mL
Un disparo libera 32 o 64 microgramos de budesonida por dosis, frasco con 120 dosis
INDICACIONES TERAPÉUTICAS:
– Rinitis alérgicas, estacional y perenne.
– Rinitis vasomotora.
– Tratamiento adyuvante de los pólipos nasales.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética: Los metabolitos de budesonida tienen una actividad biológica mínima. Después de la aplicación nasal de budesonida, la concentración plasmática máxima se alcanza después de aproximadamente 30 minutos. Después de la inhalación de budesonida, la concentración plasmática máxima se alcanza después de aproximadamente 5-10 minutos. La vida media plasmática es de aproximadamente 2 horas. La budesonida no sufre metabolismo local en las mucosas nasal y pulmonar. La budesonida se une fuertemente a las proteínas plasmáticas (85-90%), principalmente a la albúmina.
Farmacodinamia: La budesonida es un glucocorticoide con un intenso efecto antiinflamatorio sobre la mucosa nasal y un débil efecto sistémico después de la administración tópica.
CONTRAINDICACIONES:
Hipersensibilidad a la budesonida o a cualquiera de los excipientes.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Uso durante el embarazo: Los resultados de estudios epidemiológicos prospectivos y de la experiencia post-comercialización a nivel mundial indican que no hay mayor riesgo de malformaciones congénitas en general sobre el uso de budesonida inhalada o intranasal durante las primeras etapas del embarazo. Al igual que con otros fármacos, la administración de budesonida durante el embarazo requiere que los beneficios para la madre se comparen con los riesgos para el feto.
Uso durante la lactancia: La budesonida se excreta en la leche materna. Sin embargo, dosis terapéuticas de budesonida no se anticipan efectos sobre el lactante. La budesonida puede ser utilizada durante la lactancia.
La exposición sistémica a la budesonida en niños lactantes se considera insignificante cuando la madre es tratada con las dosis de mantenimiento de budesonida inhalada (200 o 400 μg dos veces al día).
En un estudio farmacocinético, la dosis diaria estimada para el lactante fue 0.3% de la dosis diaria materna para ambos niveles de dosis, y la concentración plasmática media en lactantes se estimó en 1/600 de las concentraciones observadas en el plasma materno, asumiendo una biodisponibilidad oral completa para el producto de la gestación. Las concentraciones de budesonida en muestras de plasma de lactantes todas fueron menores que el límite de cuantificación.
Basados en datos de budesonida inhalada y el hecho de que exhibe propiedades de una farmacocinética lineal, dentro de los rangos de dosificación terapéuticos después de la administración nasal, inhalada, oral y rectal, en dosis terapéuticas, se prevé que será baja la exposición del lactante a la budesonida.
REACCIONES SECUNDARIAS Y ADVERSAS:
La frecuencia de las reacciones adversas se define como: Muy comunes (≥1/10), comunes (≥1/100 a <1/10), poco comunes (≥1/1000 a <1/100), raras (≥1/10000 a <1/1000), muy raras (<1/10000) y desconocidas (no se pueden calcular a partir de los datos disponibles).
Trastornos del sistema inmunológico:
Poco comunes: Reacciones inmediatas y tardías de hipersensibilidad, incluyendo urticaria, sarpullido, dermatitis, angioedema, urticaria y prurito.
Muy raras: Reacción anafiláctica.
Trastornos endocrinos:
Raros: Signos y síntomas de efectos corticosteroides sistémicos, incluyendo la supresión adrenal y retraso del crecimiento.
Trastornos oculares:
Desconocido: Catarata, glaucoma.
Trastornos respiratorios, torácicos y mediastinales:
Común: Secreción hemorrágica y epistaxis, irritación nasal.
Muy raros: Ulceraciones de la mucosa, perforación del tabique nasal y disfonía.
Trastornos musculoesqueléticos y del tejido conjuntivo:
Poco frecuentes: Espasmos musculares.
Lesiones traumáticas, intoxicaciones y complicaciones de procedimiento:
Raras: Contusión.
En casos raros pueden ocurrir signos o síntomas de efectos secundarios sistémicos propios de los corticoides nasales, probablemente dependiendo de la dosis, el tiempo de exposición, la exposición concomitante o previa a corticoides y la sensibilidad individual.
Los efectos sistémicos de los corticosteroides nasales pueden ocurrir, particularmente a dosis altas cuando se utilizan durante periodos prolongados (ver Precauciones generales).
Población pediátrica: Se ha reportado retraso del crecimiento en niños que recibieron esteroides intranasales. Debido al riesgo de retraso del crecimiento en la población pediátrica, el crecimiento debe ser monitoreado como se describe en la sección de Precauciones generales.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Los datos no clínicos no muestran riesgos especiales para los seres humanos a dosis terapéuticas, según los estudios convencionales de toxicidad crónica, genotoxicidad y carcinogenicidad.
Las pruebas toxicológicas en animales muestran los efectos típicos de los glucocorticoides, tales como una disminución en la ganancia de peso, atrofia suprarrenal y del timo, y los efectos sobre el recuento de leucocitos. Pruebas de teratogenicidad en ratas y conejos mostraron paladar hendido y anomalías esqueléticas, como ocurre con otros glucocorticoides.
Se considera improbable que se produzcan efectos similares en los seres humanos a dosis terapéuticas.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
No se ha observado que la budesonida interactúe con ningún fármaco utilizado para el tratamiento de la rinitis.
El metabolismo de budesonida es mediado principalmente por CYP3A4. Los inhibidores de esta enzima, por ejemplo, el ketoconazol y el itraconazol, pueden aumentar la exposición sistémica de la budesonida varias veces. Dado que no existen datos que apoyen una recomendación de dosificación, la combinación debe ser evitada. Si esto no es posible, el periodo entre los tratamientos debería ser tan largo como sea posible y una reducción de la dosis de budesonida también podría ser considerada.
En mujeres que están en tratamiento concomitante con estrógenos y esteroides anticonceptivos se ha observado un aumento de las concentraciones plasmáticas y del efecto de los corticoides; sin embargo, este efecto no se ha observado con la budesonida y la ingesta concomitante de anticonceptivos orales combinados a dosis bajas.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Debido a que la función suprarrenal se puede suprimir, una prueba de estimulación con ACTH para el diagnóstico de insuficiencia hipofisaria puede mostrar resultados falsos (valores bajos).
A las dosis recomendadas, budesonida no causa cambios clínicamente relevantes en la concentración basal de cortisol en plasma o en la prueba de estimulación con ACTH. En voluntarios sanos, después de la administración a corto plazo de budesonida, se observó una supresión dependiente de la dosis de las concentraciones plasmáticas y urinarias de cortisol.
PRECAUCIONES GENERALES:
Pueden ocurrir efectos sistémicos de los corticosteroides nasales, especialmente a dosis elevadas prescritas durante periodos prolongados. Es menos probable que esto ocurra que con los corticosteroides orales y puede variar en pacientes individuales y entre diferentes preparaciones de corticosteroides. Los posibles efectos sistémicos pueden incluir el síndrome de Cushing, aspecto “cushinoides”, supresión suprarrenal, retraso del crecimiento en niños y adolescentes, cataratas, glaucoma y más raramente, una serie de efectos psicológicos o de comportamiento, tales como hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad (especialmente en niños).
La disminución de la función hepática afecta la eliminación de corticosteroides, causando una disminución en la velocidad de eliminación y una mayor exposición sistémica. Tenga en cuenta los posibles efectos secundarios sistémicos.
Es necesaria precaución especial en pacientes con tuberculosis pulmonar activa o quiescente, y en pacientes con infecciones micóticas o virales de las vías respiratorias.
Influencia en el crecimiento: Se recomienda llevar a cabo un seguimiento periódico de la estatura de los niños que reciben tratamiento prolongado con corticosteroides por vía nasal. Si el crecimiento es más lento, se debe re-evaluar la terapia con el fin de reducir la dosis de corticosteroides nasales. Deben sopesarse cuidadosamente los beneficios del tratamiento con corticosteroides frente a los posibles riesgos de la disminución del crecimiento.
Se debe evaluar también la posibilidad de remitir al paciente a un especialista en neumología pediátrica. Se han reportado casos de retraso del crecimiento en niños que reciben corticosteroides por vía nasal a las dosis autorizadas.
Este medicamento contiene sorbato de potasio y puede causar reacciones en la piel (como dermatitis de contacto).
Cambio de la vía de administración: Se deberá tener también especial cuidado mientras se pretenda cambiar la vía de administración sistémica de esteroides a budesonida, en caso de que exista la sospecha de que el paciente pudiera tener alteraciones en la función suprarrenal alterada.
Efectos sobre la capacidad para conducir y operar maquinaria: Budesonida no afecta la capacidad para conducir ni para operar máquinas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Para uso nasal únicamente.
La dosis debe ser determinada individualmente. La dosis debe ajustarse a la dosis mínima con la que se mantiene un control eficaz de los síntomas. La duración de la terapia con budesonida nasal debe ser restringida al periodo de exposición al alérgeno y depende de la naturaleza y las características de éste. Para máximo beneficio terapéutico es esencial el uso regular. El paciente debe ser informado de que el pleno efecto de la budesonida se alcanza hasta después de algunos días de tratamiento.
Rinitis:
Dosis inicial:
Adultos, adolescentes y niños mayores de 6 años de edad: La dosis inicial recomendada de 256 microgramos se puede administrar una vez al día por la mañana o dividida en dos administraciones, en la mañana y en la noche.
Budesonida 64 microgramos/dosis suspensión nasal: 2 disparos en cada fosa nasal una vez al día por la mañana o 1 disparo en cada fosa nasal por la mañana y por la noche.
Budesonida 32 microgramos/dosis en suspensión nasal: 4 disparos en cada fosa nasal una vez al día por la mañana o 2 disparos en cada fosa nasal por la mañana y por la tarde.
Los niños deben ser tratados bajo la supervisión de un adulto.
El tratamiento de la rinitis estacional, de ser posible, antes de iniciar la exposición a los alérgenos.
A veces puede ser necesaria la terapia concomitante para tratar los síntomas que afectan los ojos, causados por la alergia.
Dosis de mantenimiento: El efecto clínico deseado aparece en aproximadamente 1-2 semanas. Posteriormente, debe ser elegida la dosis mínima que mantiene al paciente asintomático. No se espera mayor eficacia con una dosis superior a 256 microgramos.
Pólipos nasales:
Adultos, adolescentes y niños mayores de 6 años de edad: La dosis recomendada para el tratamiento de pólipos nasales es de 256 microgramos. La dosis se puede administrar una vez al día por la mañana o dividida en dos administraciones, en la mañana y en la noche.
Budesonida 64 microgramos/dosis suspensión nasal: 2 disparos en cada fosa nasal una vez al día por la mañana o 1 disparo en cada fosa nasal por la mañana y por la noche.
Budesonida 32 microgramos/dosis suspensión nasal: 4 disparos en cada fosa nasal una vez al día por la mañana o 2 disparos en cada fosa nasal por la mañana y por la noche.
Los niños deben ser tratados bajo la supervisión de un adulto.
Después de que el efecto clínico deseado ha aparecido, debe elegirse la dosis mínima que mantiene al paciente asintomático.
Forma de administración:
1. Si es necesario, suénese suavemente la nariz para limpiar las fosas nasales.
2. Agite el envase (Figura 1). Retire la tapa protectora.
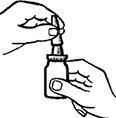
Figura 1.
3. Sostenga el envase como se muestra en la figura 2. Antes de usar Budesonida suspensión nasal por primera vez, usted debe preparar el aplicador (es decir, llenar de medicamento). Bombee aplicador nasal hacia arriba y hacia abajo varias veces (5-10 veces), hasta que se observe la salida de una nube de aerosol. El efecto de cebado se mantiene durante aproximadamente 24 horas. Si transcurre un periodo más largo de tiempo antes de aplicar la siguiente dosis, el aplicador debe ser cebado (lleno con el medicamento) de nuevo. Si la Budesonida suspensión nasal, se usa a intervalos más breves, es suficiente disparar sólo una vez al aire.
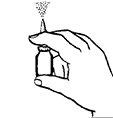
Figura 2.
4. Inserte la punta del aplicador en su fosa nasal como se muestra en la figura 3 y dispare el aerosol una vez (o más si su médico se lo indica). Use el aerosol en la otra fosa nasal de la misma manera.
Nota: No es necesario inhalar a la vez que dispara.
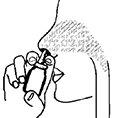
Figura 3.
5. Limpie el aplicador con un paño limpio y vuelva a colocar la tapa protectora.
6. Conserve el envase en posición vertical.
Limpieza del envase de Budesonida suspensión nasal: Usted debe limpiar regularmente el aplicador de plástico de Budesonida suspensión nasal y en cualquier momento cuando la dosis de medicamento no esté saliendo como debería. Si esto ocurre, compruebe primero si el aplicador se ceba con el medicamento (ver más arriba). Si después de cebar nuevamente el aplicador la bomba sigue sin funcionar, limpie la boquilla usando las siguientes instrucciones:
– Retire el aplicador de plástico con una toalla de papel limpia y lave en agua tibia-no caliente.
– Enjuague la boquilla concienzudamente, séquela y vuelva a colocar en la parte superior de la botella.
– No intente nunca destapar el aplicador con un alfiler u otro objeto punzante.
Después de la limpieza del aplicador debe cebarlo (es decir, llenar de nuevo con el medicamento), antes de su uso.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
La sobredosis aguda con budesonida, incluso en dosis excesivas, no se espera que sea un problema clínico.
PRESENTACIONES:
Caja de cartón con frasco ámbar con 6 mL con 120 dosis (32 mcg/dosis) e instructivo anexo.
Caja de cartón con frasco ámbar con 6 mL con 120 dosis (64 mcg/dosis) e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a no más de 25 °C o consérvese a no más de 30 °C.
Consérvese el frasco bien cerrado.
LEYENDAS DE PROTECCIÓN:
Léase instructivo anexo. Agítese antes de usarse. Su venta requiere receta médica. No se deje al alcance de los niños. El uso de este medicamento en el embarazo y lactancia debe hacerse bajo control médico. No se use en menores de 6 años.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Propiedad de:
Sandoz GmbH
Biochemiestraße 10, 6250 Kundl
Austria
Representante Legal:
SANDOZ, S.A. de C.V.
La Candelaria No. 186,
Col. Atlántida, C.P. 04370,
Coyoacán, Ciudad de México, México
Reg. Núm. 179M2013 SSA IV
22330022131225/15Nov2023/IPPA_DRA-Sandoz
®Marca Registrada