
BERODUAL
FENOTEROL, IPRATROPIO
Aerosol
1 Aerosol dosificador, 10 mL
1 Aerosol dosificador, 10 mL
FORMA FARMACÉUTICA Y FORMULACIÓN:
Frasco presurizado con válvula dosificadora
Cada g contiene:
Bromuro de ipratropio 0.394 mg
Fenoterol 0.938 mg
Vehículo cbp 1 g
10 mL = 200 dosis.
Cada dosis proporciona:
Bromuro de ipratropio 20 μg
Fenoterol 50 μg
INDICACIONES TERAPÉUTICAS: Broncodilatador útil para la prevención y tratamiento de los síntomas de enfermedades que cursen con obstrucción crónica de la vía aérea con broncospasmo reversible como el asma bronquial y especialmente la bronquitis crónica con o sin enfisema pulmonar. Tratamiento concomitante antiinflamatorio que puede considerarse para pacientes con asma bronquial y en aquellos pacientes con enfermedad obstructiva crónica que responde a la administración de esteroides.
FARMACOCINÉTICA Y FARMACODINAMIA:
Grupo farmacoterapéutico: Adrenérgicos en combinación con anticolinérgicos para las enfermedades obstructivas de las vías aéreas.
Código ATC: R03AL01.
El efecto terapéutico de BERODUAL® es producido por un efecto tópico en la vía aérea. La farmacodinamia de la broncodilatación por tanto, no se relaciona con la farmacocinética de los componentes activos de la preparación.
Tras ser administrado mediante inhalación, del 10 al 39% de la dosis se deposita en los pulmones, lo cual depende de la formulación, la técnica y el dispositivo de inhalación, mientras que el resto de la dosis administrada se deposita en la boquilla y en la parte superior del tracto respiratorio (orofaringe). La porción de la dosis depositada en los pulmones alcanza la circulación rápidamente (en minutos). La cantidad de principio activo depositada en la orofaringe es deglutida lentamente y pasa al tubo digestivo. Por consiguiente, la exposición sistémica está en función de la biodisponibilidad tanto oral como pulmonar.
No existe evidencia de que la farmacocinética de ambos ingredientes en combinación difiera de la dada por las dos sustancias por separado.
Bromhidrato de fenoterol:
Absorción: La biodisponibilidad absoluta seguida de la administración oral es baja (aproximadamente de 1.5%).
La biodisponibilidad absoluta de fenoterol después de la inhalación es de 18.7%. La absorción pulmonar sigue un curso bifásico. El 30% de la dosis de bromhidrato de fenoterol se absorbe rápidamente con una vida media de 11 minutos, y el 70% se absorbe lentamente con una vida media de 120 minutos.
Distribución: El fenoterol se distribuye ampliamente en el cuerpo. Alrededor del 40% del principio activo se une a las proteínas plasmáticas. En este modelo de 3 compartimientos, el volumen aparente de distribución de fenoterol en estado estacionario (Vdss) es de aproximadamente 189 L (≈ 2.7 L/kg).
Los estudios no clínicos con ratas revelaron que el fenoterol y sus metabolitos no atraviesan la barrera hematoencefálica.
Biotransformación: El fenoterol sufre un metabolismo extenso por conjugación con glucurónidos y sulfatos en humanos. Después de la administración oral, el fenoterol se metaboliza principalmente por sulfatación. Esta inactivación metabólica del compuesto original comienza en la pared intestinal.
Eliminación: Después de la inhalación de BERODUAL®, aproximadamente 1% de la dosis inhalada se excreta como fenoterol libre en la orina de 24 horas. Con base en esta información, la biodisponibilidad sistémica total de la dosis inhalada de bromhidrato de fenoterol se estima en 7%. El fenoterol tiene una depuración total de 1.8 L/min y una depuración renal de 0.27 L/min.
Los parámetros cinéticos que describen la disposición del fenoterol se calcularon de concentraciones de plasma después de la administración I.V. Después de la administración intravenosa, los perfiles de concentración plasmática/tiempo se pueden describir mediante un modelo de 3 compartimentos, en el que la vida media terminal es de aproximadamente 3 horas.
Después de la administración oral, la excreción en orina es de aproximadamente 39%, y de 40.2% en las heces de la dosis total a las 48 horas.
Bromuro de ipatropio:
Absorción: El bromuro de ipratropio tras ser administrado mediante inhalación tiene una biodisponibilidad estimada de 7 a 28%. Tomando esto en consideración, la porción de la dosis ingerida de bromuro de ipatropio no contribuye de forma relevante con la exposición sistémica.
Distribución: Los parámetros cinéticos que describen la disposición del ipratropio se calcularon a partir de las concentraciones plasmáticas después de la administración I.V. Se observa una rápida disminución bifásica de las concentraciones plasmáticas. El volumen aparente de distribución en estado estacionario (Vdss) es de aproximadamente 176 L (≈2.4 L/kg). El fármaco se une mínimamente (menos del 20%) a las proteínas plasmáticas. Estudios con ratas y perros revelaron que la amina cuaternaria ipratropio no atraviesa la barrera hematoencefálica.
La unión de los principales metabolitos urinarios al receptor muscarínico es insignificante y los metabolitos deben considerarse no efectivos.
Biotransformación: Seguido de su administración intravenosa, aproximadamente el 60% de la dosis se metaboliza, la mayor parte probablemente en el hígado por oxidación.
Eliminación: La vida media de la fase de eliminación terminal es de aproximadamente 1.6 horas. El ipatropio tiene una depuración total de 2.3 L/min y una depuración renal de 0.9 L/min.
En un estudio de balance de excreción, la excreción renal acumulada (6 días) de radiactividad relacionada con el fármaco (incluido el compuesto original y todos los metabolitos) representó el 9.3% después de la administración oral y el 3.2% después de la inhalación. La radiactividad total excretada a través de las heces fue del 88.5% tras la administración oral y del 69.4% tras la inhalación.
Los estudios clínicos con duración de tratamiento mayor de 3 meses involucran pacientes adultos asmáticos y con EPOC y niños asmáticos en los que la formulación HFA y la formulación CFC han sido comparadas, las dos formulaciones son terapéuticamente equivalentes.
BERODUAL® contiene dos ingredientes activos con efecto broncodilatador, el bromuro de ipratropio que presenta un efecto anticolinérgico y el bromhidrato de fenoterol un agente β-adrenérgico.
El bromuro de ipratropio es un compuesto cuaternario de amonio con propiedades anticolinérgicas (parasimpaticolítico). En estudios preclínicos, inhibió el reflejo vagal por la acción antagonista de la acetilcolina, el agente transmisor liberado por el nervio vago. Los anticolinérgicos previenen del incremento de la concentración intracelular del monofosfato cíclico de guanosina (GMPc) causado por la interacción de la acetilcolina con el receptor muscarínico del músculo liso bronquial.
La broncodilatación seguida de la inhalación del bromuro de ipratropio es el inicio local, con efecto sitio-específico y no sistémico.
En estudios controlados hasta de 90 días, en pacientes con broncospasmo asociado con la enfermedad pulmonar obstructiva crónica (bronquitis crónica y enfisema) se observó una mejoría significativa en la función pulmonar (FEV; y FEF 25-75% con incremento del 15% o mayor) ocurrió dentro de los primeros 15 minutos, alcanzando el pico máximo en 1-2 horas, y persistiendo en la mayoría de los pacientes hasta 6 horas después de su administración.
En estudios controlados hasta 90 días, en pacientes con broncospasmo asociado con asma se observó una mejoría significativa en la función pulmonar (FEV1) con un incremento del 15% o más, lo cual ocurrió en el 40% de los pacientes.
Evidencia preclínica y clínica sugiere que no hay efecto dañino del bromuro de ipratropio en la mucosa de la vía aérea, depuración mucociliar e intercambio gaseoso.
El bromhidrato de fenoterol es un agente simpaticomimético directo, en el rango de dosis terapéuticas es estimulante selectivo de los β1-receptores. La estimulación de los β1-receptores se da en rangos de administración de dosis mayores. La ocupación de los β2-receptores activa la adenilatociclasa por medio de la estimulación de la proteína Gs. El incremento del AMPc activa a la proteína cinasa A la cual fosforila proteínas blanco de las células del músculo liso. Esto a su vez da como resultado la fosforilación de cadenas ligeras de miosina en la cinasa, inhibición del hidrólisis del fosfoinositol y la apertura de canales de calcio de alta conductancia a su vez activados por potasio.
El fenoterol relaja los bronquios y el músculo liso vascular y protege contra el estímulo broncoconstrictor como los causados por la histamina, metacolina, aire frío y alergenos (respuesta temprana). Después de su administración se inhibe a los mediadores broncoconstrictores y pro-inflamatorios de los mastocitos. Además, se ha demostrado que a dosis altas de fenoterol se da un incremento en la depuración mucociliar.
Posterior a la administración oral, es donde frecuentemente se alcanzan las concentraciones más altas en plasma y aún más después de la administración intravenosa que inhibe la motilidad uterina. Incluso a dosis más altas, se observan efectos metabólicos como lipólisis, glucogenólisis, hiperglucemia e hipokalemia, esta última a causa de un incremento en la recaptura del potasio dada primeramente por el músculo esquelético. Los efectos beta-adrenérgicos en el corazón tales como un incremento en el ritmo cardiaco y la propiedad para contraerse se deben a los efectos vasculares del fenoterol, en cambio, la estimulación de los β-receptores, se da a dosis supraterapéuticas y ocasiona estimulación de los β2-receptores. Se han reportado prolongaciones del segmento QTc, como es el caso de otros agentes β-adrenérgicos; sin embargo, para las soluciones presurizadas para inhalar de fenoterol éstas fueron discretas y se observaron a dosis más altas de las recomendadas. El significado clínico no se ha establecido. El temblor es un efecto frecuentemente observado de los β-agonistas. A diferencia de los efectos en el músculo liso bronquial, los efectos sistémicos de los β-agonistas están sujetos al desarrollo de la tolerancia.
En estudios clínicos, el fenoterol demostró una alta eficacia en manifestaciones que se caracterizan por broncospasmo. Previene la broncoconstricción seguida de la exposición a varios estímulos como son el ejercicio, la exposición al aire frío y la respuesta temprana resultado de la exposición a agentes alergenos.
El uso concurrente de estos dos ingredientes activos dilata los bronquios debido a que afecta diferentes sitios de acción farmacológicos. Los ingredientes activos se complementan mutuamente en la acción espasmolítica que ejercen sobre el músculo liso bronquial y permiten un uso terapéutico amplio en el campo de los desórdenes broncopulmonares asociados con la constricción del tracto respiratorio. La acción complementaria es tal, que sólo se requiere una muy baja proporción del componente β-adrenérgico para obtener el efecto deseado, facilitando la adecuación de dosis individuales para cada paciente con un mínimo de reacciones adversas.
En pacientes con asma y con EPOC, BERODUAL® ha demostrado ser tan eficaz como una doble dosis de fenoterol sin ipratropio, pero fue mejor tolerado en estudios de dosis acumulativa.
En estudios realizados en pacientes con asma y EPOC se demostró mayor eficacia comparado con sus componentes ipratropio o fenoterol.
En casos que cursen con broncoconstricción aguda, BERODUAL® es efectivo de tal manera que resulta una elección adecuada para el tratamiento de crisis agudas de asma.
CONTRAINDICACIONES: BERODUAL® está contraindicado en pacientes con hipersensibilidad conocida al fenoterol o a sustancias similares a la atropina o a cualquier otro componente de la fórmula.
BERODUAL® está contraindicado en pacientes con cardiomiopatía hipertrófica obstructiva y taquiarritmia.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Datos preclínicos combinados con la experiencia disponible en humanos, han demostrado que no hay evidencia de efectos indeseables en el embarazo durante la administración de fenoterol o ipratropio. Sin embargo, deberán observarse las precauciones normales, en cuanto al uso de los medicamentos durante el embarazo, especialmente durante el primer trimestre.
Deberá tomarse en cuenta el efecto del fenoterol en la inhibición de las contracciones uterinas.
Lactancia: Estudios no clínicos demuestran que el bromuro de fenoterol es excretado por la leche materna. Se desconoce si el ipratropio se excreta por la leche materna. Siendo poco probable que el ipratropio llegue en cantidades considerables al producto, especialmente cuando se administra en aerosol. Sin embargo, debido a que muchos medicamentos son excretados en la leche materna, se debe tener especial precaución al administrar BERODUAL® a madres que están lactando.
REACCIONES SECUNDARIAS Y ADVERSAS: Muchos de los efectos adversos listados se pueden asignar a las propiedades anticolinérgicas y beta-adrenérgicas de BERODUAL®. Como sucede con todos los tratamientos inhalatorios, BERODUAL® puede producir síntomas de irritación local.
Los efectos secundarios observados con mayor frecuencia en los ensayos clínicos fueron tos, boca seca, dolor de cabeza, temblor, faringitis, náuseas, mareos, disfonía, taquicardia, palpitaciones, vómitos, aumento de la presión arterial sistólica y nerviosismo.
Resumen tabulado de reacciones adversas: Se han notificado las siguientes reacciones adversas durante el uso de BERODUAL® en ensayos clínicos y durante la experiencia poscomercialización.
|
Terminología de clasificación de órganos del sistema MedDRA |
Reacciones adversas de BERODUAL® |
|---|---|
|
Trastornos del sistema inmune |
Reacción anafiláctica |
|
Hipersensibilidad |
|
|
Trastornos del metabolismo y de la nutrición |
Hipokalemia |
|
Trastornos psiquiátricos |
Nerviosismo |
|
Agitación |
|
|
Trastorno mental |
|
|
Trastornos del sistema nervioso |
Dolor de cabeza |
|
Temblor |
|
|
Mareos |
|
|
Trastornos oculares |
Glaucoma |
|
Aumento de la presión intraocular |
|
|
Trastornos de la acomodación |
|
|
Midriasis |
|
|
Visión borrosa |
|
|
Dolor ocular |
|
|
Edema corneal |
|
|
Hiperemia conjuntival |
|
|
Visión de halos |
|
|
Trastornos cardiacos |
Taquicardia, aumento de la frecuencia cardiaca |
|
Palpitaciones |
|
|
Arritmia |
|
|
Fibrilación auricular |
|
|
Taquicardia supraventricular |
|
|
Isquemia miocárdica |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
|
Faringitis |
|
|
Disfonía |
|
|
Broncospasmo |
|
|
Irritación de la garganta |
|
|
Edema faríngeo |
|
|
Laringospasmo |
|
|
Broncospasmo paradójico |
|
|
Sequedad de garganta |
|
|
Trastornos gastrointestinales |
Vómito |
|
Náuseas |
|
|
Boca seca |
|
|
Estomatitis |
|
|
Glositis |
|
|
Trastornos de la motilidad gastrointestinal |
|
|
Diarrea |
|
|
Constipación |
|
|
Edema bucal |
|
|
Trastornos de la piel y del tejido subcutáneo |
Urticaria |
|
Erupción |
|
|
Prurito |
|
|
Angioedema |
|
|
Hiperhidrosis |
|
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Debilidad muscular |
|
Espasmos musculares |
|
|
Mialgia |
|
|
Trastornos renales y urinarios |
Retención urinaria |
|
Investigaciones |
Aumento de la presión arterial sistólica |
|
Disminución de la presión arterial diastólica |
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No han sido desarrollados estudios de genotoxicidad y carcinogenicidad. Sin embargo, en estudios in vivo e in vitro revelaron que ni el fenoterol ni el ipratropio tienen potencial mutagénico.
Asimismo, los estudios de carcinogenicidad llevados a cabo durante dos años con la administración por vía inhalada de fenoterol y administración oral de ipratropio en ratas y perros, revelaron que no existen efectos patológicos oncogénicos.
Fertilidad: No se dispone de datos clínicos sobre fertilidad con la combinación de bromuro de ipratropio y bromhidrato de fenoterol ni sobre cada uno de los dos componentes de la combinación. Los estudios no clínicos realizados con los componentes individuales bromuro de ipratropio y bromhidrato de fenoterol no mostraron efectos adversos sobre la fertilidad.
Toxicología:
Toxicidad de dosis únicas:
Los estudios de toxicidad con dosis únicas con la combinación de bromuro de ipratropio y bromhidrato de fenoterol en proporción 1/2.5 (bromuro de ipratropio/bromhidrato de fenoterol) en ratones y ratas tras la administración oral, intravenosa e inhalatoria, mostraron niveles bajos de toxicidad aguda. Comparados con los componentes individuales, los valores de la DL50 de la combinación fueron determinados principalmente por el componente bromuro de ipratropio que por el bromhidrato de fenoterol sin indicios de potenciación.
Toxicidad de dosis repetidas:
Se realizaron estudios de toxicidad con dosis repetidas con la combinación de bromuro de ipratropio y bromhidrato de fenoterol en ratas (vía oral e inhalatoria) y perros (vía intravenosa e inhalatoria) durante periodos hasta de 13 semanas. Sólo se observaron efectos tóxicos menores con concentraciones hasta varios cientos de veces superiores a las recomendadas en el hombre. Se observaron cicatrices en el miocardio ventricular izquierdo en sólo uno de los animales del grupo que recibió la dosis más elevada (84 mcg/kg/día) en el estudio de 4 semanas de administración intravenosa en perros. En el estudio de 13 semanas por vía oral en ratas y en el estudio de 13 semanas por vía inhalatoria en perros no se observaron cambios toxicológicos más allá de lo proporcional a los componentes individuales.
No hubo indicación de potenciación con la combinación, comparada con los componentes individuales.
Todos los efectos adversos observados son bien conocidos para el bromhidrato de fenoterol y el bromuro de ipratropio.
Toxicidad en la reproducción:
Tras la administración por vía inhalatoria de la combinación de bromuro de ipratropio y bromhidrato de fenoterol a ratas y conejos, no se produjeron efectos teratógenos. Tampoco se observaron efectos teratógenos después de administrar bromuro de ipratropio ni tras la inhalación de bromhidrato de fenoterol. Tras la administración oral de dosis > 25 mg/kg/día (conejo) y > 38.5 mg/kg/día (ratón) el bromhidrato de fenoterol indujo un aumento de la tasa de malformaciones.
Las malformaciones observadas se consideran efectos de clase para beta-agonistas. La fertilidad no se vio afectada en ratas con dosis orales de hasta 90 mg/kg/día de bromuro de ipratropio, y hasta 40 mg/kg/día de bromhidrato de fenoterol.
Genotoxicidad: No se realizaron estudios de genotoxicidad con la combinación. Los estudios in vitro e in vivo mostraron que ni el bromhidrato de fenoterol ni el bromuro de ipratropio tienen potencial mutagénico.
Carcinogenicidad: No se realizaron estudios de carcinogenicidad con la combinación. No se demostraron efectos oncógenos ni carcinógenos en estudios a largo plazo realizados en ratones y ratas con bromuro de ipratropio. Se realizaron estudios sobre carcinogenia con bromhidrato de fenoterol tras la administración oral (ratón, 18 meses; rata, 24 meses) y tras la administración inhalatoria (rata, 24 meses). Con dosis orales de 25 mg/kg/día se observó aumento de la incidencia de leiomiomas uterinos con actividad miótica variable en ratones y de leiomiomas mesováricos en ratas. Estos hallazgos son efectos conocidos causados por la acción local de los fármacos beta-adrenérgicos sobre las células musculares lisas uterinas de ratones y ratas. Tomando en cuenta el nivel actual de la investigación, estos resultados no son aplicables al ser humano. Todas las otras neoplasias halladas se consideraron comunes, del tipo que se encuentra espontáneamente en las cepas usadas, y no mostraron un aumento biológicamente importante de la incidencia con resultado del tratamiento con bromhidrato de fenoterol.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
La coadministración crónica de BERODUAL® con otros fármacos anticolinérgicos no ha sido estudiada. Por lo tanto, no se recomienda la coadministración crónica de BERODUAL® con otros anticolinérgicos.
Otros β-adrenérgicos, anticolinérgicos y derivados de la xantina (como teofilina) pueden incrementar el efecto broncodilatador. La administración conjunta con otros betamiméticos, anticolinérgicos y derivados de la xantina (p. ej. teofilina) puede incrementar las reacciones adversas.
Durante la administración concurrente de β-bloqueadores, puede ocurrir una potencial y severa reducción de la broncodilatación.
La hipokalemia inducida por los β2-agonistas puede verse incrementada con el tratamiento concomitante con derivados de la xantina, corticosteroides y diuréticos. Esto debe tenerse en cuenta particularmente en pacientes con obstrucción grave de la vía aérea.
La hipokalemia puede dar lugar a un incremento en la susceptibilidad a arritmias en pacientes que se encuentran recibiendo dioxina. Adicionalmente, la hipoxia puede agravar los efectos de la hipokalemia en el ritmo cardiaco. Se recomienda la vigilancia de los niveles de potasio sérico en dichas situaciones.
Los fármacos que contienen β2-agonistas deben ser administrados con precaución en pacientes tratados con inhibidores de la MAO o antidepresivos tricíclicos, debido a que puede aumentar la acción de los β-agonistas adrenérgicos.
La susceptibilidad a los efectos cardiovasculares de los β-agonistas, puede verse incrementada durante la inhalación de anestésicos de hidrocarburo halogenados tales como el halotano, tricloroetileno y enflurano.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Tras la administración de BERODUAL® puede producirse una reducción dosis-dependiente transitoria del potasio en suero.
PRECAUCIONES GENERALES:
Hipersensibilidad: Reacciones de hipersensibilidad inmediatas pueden presentarse después de la administración de BERODUAL® demostradas por casos raros de urticaria, angioedema, exantema, broncospasmo, edema orofaríngeo y anafilaxia.
Broncospasmo paradójico: Al igual que con otros medicamentos inhalables, existe la posibilidad de que BERODUAL® provoque un broncospasmo paradójico, cuadro potencialmente fatal. En el caso de producirse un broncospasmo paradójico, debe suspenderse de inmediato el uso de BERODUAL® y sustituirlo con una terapia alterna.
Complicaciones oculares: BERODUAL® debe utilizarse con precaución en pacientes predispuestos al glaucoma de ángulo estrecho.
Se han presentado casos aislados de complicaciones oculares (es decir, midriasis, aumento de la presión intraocular, glaucoma de ángulo estrecho, dolor ocular) cuando el bromuro de ipratropio en aerosol, solo o en combinación con un agonista β2-adrenérgico, ha entrado en contacto con los ojos.
El dolor o malestar ocular, visión borrosa, halos visuales o imágenes coloreadas en asociación con ojos rojos por congestión conjuntival y edema corneal pueden ser signos de glaucoma agudo de ángulo estrecho. En caso que una combinación de estos síntomas se desarrolle, debe iniciarse tratamiento con gotas mióticas y buscar inmediatamente una consulta con un especialista.
Por ende, se debe instruir a los pacientes sobre el uso correcto de BERODUAL®. Se debe tener cuidado de no permitir que el producto entre en los ojos.
Efectos sistémicos: Bajo las siguientes condiciones, debe usarse BERODUAL® solo tras haber evaluado los riesgos y beneficios, especialmente cuando se usan dosis más altas que las recomendadas: diabetes mellitus insuficientemente controlada, infarto al miocardio reciente, trastornos orgánicos graves del corazón o vasculares, hipertiroidismo, feocromocitoma o con obstrucción del tracto de salida urinario preexistente (por ejemplo, hiperplasia prostática u obstrucción del cuello de la vejiga).
Efectos cardiovasculares: Se pueden observar efectos cardiovasculares con fármacos simpaticomiméticos, incluido BERODUAL®. Existe evidencia de la información poscomercialización y de la literatura publicada de raros episodios de isquemia miocárdica asociada con beta-agonistas. Debe alertarse a los pacientes con enfermedad cardiaca grave subyacente (p. ej., cardiopatía isquémica, arritmia o insuficiencia cardiaca grave) que estén recibiendo BERODUAL® que busquen consejo médico si experimentan dolor torácico u otros síntomas de empeoramiento de la cardiopatía. Debe prestarse atención a la evaluación de síntomas como disnea y dolor torácico, ya que pueden ser de origen respiratorio o cardiaco.
Hipokalemia: Puede presentarse hipokalemia como resultado del uso de β2-adrenérgicos.
Alteraciones de la motilidad gastrointestinal: Los pacientes con fibrosis quística pueden tener una mayor propensión a padecer alteraciones de la motilidad gastrointestinal.
Disnea: Deberá indicarse a los pacientes que en caso de disnea aguda que empeora rápidamente deberá consultarse inmediatamente al médico.
Uso prolongado:
• En pacientes con asma bronquial, BERODUAL® se debe usar sólo según necesidad. En pacientes con EPOC leve puede ser preferible el uso bajo demanda (orientado a los síntomas) en lugar de un uso en forma regular.
• Debe considerarse agregar o aumentar el tratamiento antiinflamatorio para el control de la inflamación de las vías respiratorias y para prevenir el deterioro del control de la enfermedad en pacientes con asma bronquial y en pacientes con EPOC que responden al uso de esteroides.
El incremento en el uso de productos β2-agonistas tales como BERODUAL® en una base regular como control de síntomas de obstrucción bronquial puede sugerir un descontrol clínico. Si la obstrucción bronquial empeora, el simple incremento en el uso de β2-agonistas tales como BERODUAL® más allá de la dosis recomendada por periodos extensos de tiempo no es apropiado e incluso puede ser peligroso. En esta situación, el plan de tratamiento y, en particular, el adecuado tratamiento antiinflamatorio con corticoides inhalados, deberá revisarse con la finalidad de prevenir deterioro potencialmente amenazante de la vida en el control de la enfermedad.
Uso concomitante con otros broncodilatadores simpaticomiméticos: El uso de otros broncodilatadores simpaticomiméticos en conjunto con BERODUAL® únicamente deberá realizarse bajo supervisión médica.
Advertencias respecto del dopaje: El uso de BERODUAL® puede conducir a resultados positivos con respecto al fenoterol en pruebas de abuso de sustancias no clínicas, es decir, en el contexto de la mejora del rendimiento deportivo (dopaje).
DOSIS Y VÍA DE ADMINISTRACIÓN: La dosis debe ser adaptada al requerimiento individual. A menos de que se prescriba de otra manera, las dosis recomendadas para adultos y niños mayores de 6 años son las siguientes:
Episodios agudos de asma:
• Dos disparos son suficientes para aliviar los síntomas en la mayoría de los casos. En casos más severos, si la respiración no ha mejorado notablemente después de 5 minutos, pueden administrarse dos disparos más.
• Si un episodio no ha sido aliviado después de 4 disparos, pueden requerirse disparos adicionales. En dichos casos, los pacientes deberán consultar con su médico y/o trasladarlos al hospital más cercano.
Tratamiento a largo plazo o intermitente (en el asma, BERODUAL® Aerosol se debe usar sólo según necesidad):
1 a 2 inhalaciones en cada administración, hasta un máximo de 8 disparos por día (promedio: 1 a 2 inhalaciones, tres veces por día).
En los niños BERODUAL® sólo debe administrarse por prescripción mediante dispositivo médico y siempre bajo la supervisión de un adulto.
Los pacientes deben ser instruidos en la correcta administración del aerosol para garantizar el éxito del tratamiento.
Instrucciones de uso:
Antes del primer uso del aerosol, realice lo siguiente:
Retire la tapa protectora y presione la válvula dos veces.
Debe seguir los siguientes pasos antes de cada uso:
1. Retire la tapa protectora. (Si no ha usado el aerosol durante más de tres días, debe accionar la válvula una vez).
2. Exhale profundamente.
3. Sostenga el aerosol como se muestra en la figura 1, posteriormente cierre los labios alrededor de la boquilla. La flecha y el fondo del recipiente deben estar hacia arriba.
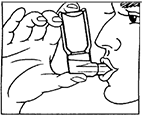
(Fig. 1)
4. Respire profundamente, presionando la base del contenedor firmemente al mismo tiempo, esto libera una dosis medida o disparo. Sostenga la respiración durante unos segundos, entonces retire la boquilla de la boca y exhale.
La misma acción debe repetirse para la segunda inhalación.
5. Coloque la tapa protectora después de su uso.
El contenedor no es transparente. Por lo tanto, no es posible ver si está vacío.
El aerosol proporciona 200 dosis (inhalaciones). Cuando éstas han sido utilizadas los aerosoles todavía parecen contener una pequeña cantidad de fluido. El aerosol debe; sin embargo, sustituirse para que pueda estar seguro que está recibiendo la cantidad correcta de medicamento en cada aplicación.
Limpie la boquilla al menos una vez a la semana.
Es importante mantener la boquilla de su inhalador limpia para asegurar que el medicamento no se acumule y obstruya el vaporizador.
Para la limpieza, primero retire la tapa y el recipiente de la boquilla. Enjuague con agua tibia a través de la boquilla hasta que no se vea acumulación de medicamento y/o suciedad.
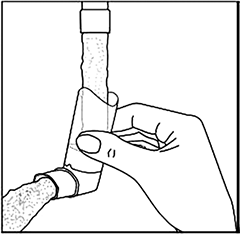
(Fig. 2)
Después de limpiar, agite la boquilla y déjela secar al aire sin utilizar ningún sistema de calefacción. Una vez que la boquilla esté seca, vuelva a colocar el recipiente y la tapa.
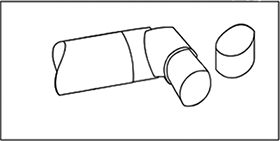
(Fig. 3)
Advertencia: La boquilla plástica se ha diseñado especialmente para usar con BERODUAL® para asegurar que usted siempre reciba la cantidad adecuada del medicamento. La boquilla nunca debe usarse con otro aerosol dosificador ni el aerosol dosificador BERODUAL® debe usarse con cualquier otra boquilla que no sea la proporcionada con el producto.
El contenedor está bajo presión y no debe abrirse a la fuerza o exponerse a temperaturas superiores a los 50 °C.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Síntomas: Los efectos de la sobredosis están relacionados principalmente con el fenoterol.
Los síntomas esperados con sobredosis son aquéllos en donde existe una dosificación excesiva de estimulantes β-adrenérgicos. Los más destacados son taquicardia, palpitaciones, temblor de las manos, hipertensión, hipotensión, ensanchamiento en la presión del pulso, angina, arritmias y enrojecimiento facial.
También se ha observado acidosis metabólica e hipokalemia con fenoterol, cuando se administra en dosis mayores que las recomendadas para las indicaciones aprobadas de BERODUAL®.
Los síntomas que se relacionan con el bromuro de ipratropio (como son xerostomía y alteraciones en el acomodamiento visual) son leves debido a que la disponibilidad sistémica en la inhalación del ipratropio es muy baja.
Tratamiento: Debe interrumpirse el tratamiento con BERODUAL®. Debe considerarse la posibilidad de efectuar un monitoreo de los valores de electrolitos y del equilibrio ácido-base.
Puede ser necesaria la administración de sedantes y, en casos graves, medidas de terapia intensiva.
Como antídotos específicos se recomiendan bloqueadores de los beta-receptores, de ser posible beta uno selectivos.
Casi siempre deberá considerarse un incremento en la obstrucción bronquial, por lo que la dosis deberá ajustarse cuidadosamente en pacientes con asma bronquial o EPOC ya que existe el riesgo de precipitar un broncoespasmo grave, el cual puede ser fatal.
PRESENTACIÓN: BERODUAL® Aerosol dosificador (10 mL = 200 dosis aerosol). Envase metálico con dispositivo bucal, para inhalación mediante dispositivo especial.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30 °C.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No se deje al alcance de los niños. Su venta requiere receta médica. Léase instructivo anexo. Agítese bien antes de usarse. No se deje al alcance de los niños. No se use cerca del fuego o flama. No fume o encienda alguna flama cuando se aplique. No exponga el envase a los rayos del sol o lugares excesivamente calientes, ni los perfore o arroje al fuego. Evite el contacto con los ojos. El empleo de este medicamento durante el embarazo y la lactancia queda bajo la responsabilidad del médico. Durante el empleo dirigir la válvula hacia abajo.
PELIGRO INFLAMABLE.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx y
farmacovigilancia.mex@boehringer-ingelheim.com
BOEHRINGER INGELHEIM PROMECO, S.A. de C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocan,
C.P. 16090, Xochimilco, Ciudad de México, México.
Reg. Núm. 023M86 SSA IV
®Marca Registrada