BLINCYTO - Polvo liofilizado para reconstituir
Sustancia(s):
- Blinatumomab
Presentaciones:
- 1 Caja, 1 Frasco(s) ámpula, 35 µg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada frasco ámpula de un solo uso contiene:
Blinatumomab 35 mcg
Excipientes cs
INDICACIONES TERAPÉUTICAS:
Leucemia linfoblástica aguda (LLA) de precursores de células B, enfermedad mínima residual (EMR) positiva:
BLINCYTO® está indicado para el tratamiento de la leucemia linfoblástica aguda (LLA) de precursores de células B en la primera o segunda remisión completa con una enfermedad mínima residual (EMR) mayor o igual al 0.1% en pacientes adultos y pediátricos.
Leucemia linfoblástica aguda (LLA) de precursores de células B en recaída o refractaria:
BLINCYTO® está indicado para el tratamiento de leucemia linfoblástica aguda (LLA) de precursores de células B, en recaída o refractaria en pacientes adultos y pediátricos.
LLA de precursores de células B en fase de consolidación:
BLINCYTO® está indicado para el tratamiento de la leucemia linfoblástica aguda (LLA) precursora de células B en fase de consolidación en pacientes adultos y pediátricos.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética:
La farmacocinética de blinatumomab aparece lineal sobre un intervalo de dosis de 5 mcg/m2/día a 90 mcg/m2/día (aproximadamente equivalente a 9 mcg/día a 162 mcg/día) en los pacientes adultos. Después de la infusión intravenosa continua, la concentración sérica en estado estable (Css) se logró en el curso de un día y permaneció estable con el tiempo. El aumento en los valores medios de Css fue aproximadamente proporcional a la dosis en el intervalo probado. A las dosis clínicas de 9 mcg/día y 28 mcg/día para el tratamiento de LLA recurrente o refractaria, la Css (DE) media fue 228 (356) pg/mL y 616 (537) pg/mL, respectivamente.
La farmacocinética de blinatumomab en pacientes adultos con LLA de precursores de células B y en pacientes adultos con LLA de precursores de células B en la fase de consolidación fue similar a la de los pacientes adultos con LLA en recaída o refractaria.
Distribución: El volumen de distribución medio (DE) estimado basado en la fase terminal (Vz) fue 4.35 (2.45) L con la infusión intravenosa continua de blinatumomab.
Metabolismo: La vía metabólica de blinatumomab no se ha caracterizado. Como ocurre con otras proteínas terapéuticas, se espera que blinatumomab se degrade en péptidos pequeños y aminoácidos a través de vías catabólicas.
Eliminación: La depuración sistémica media (DE) estimada con infusión intravenosa continua en pacientes recibiendo blinatumomab en estudios clínicos fue 3.10 (2.94) L/hora. La media (DE) de la vida media fue de 2.20 (1.34) horas. Se eliminaron cantidades insignificantes de blinatumomab en la orina en las dosis clínicas probadas.
Poblaciones específicas: No se produjeron diferencias clínicamente significativas en la farmacocinética de blinatumomab con base en la edad (de 0.6 a 80 años), el sexo, la raza (72% blancos, 17% asiáticos, 3% negros), la etnia, el estado del cromosoma Filadelfia o la presencia de insuficiencia hepática leve (bilirrubina total ≤ límite superior normal [LSN] y AST > LSN o bilirrubina total > 1 a 1.5 x LSN y cualquier nivel de AST) o moderada (bilirrubina total > 1.5 a 3 x ULN y cualquier valor de AST).
Se desconoce el efecto de otras razas o insuficiencia hepática grave (bilirrubina total > 3 x LSN, cualquier AST) sobre la farmacocinética de blinatumomab. El área de superficie corporal (0,4 a 2,9 m2 influye en la farmacocinética de blinatumomab, lo que respalda la dosificación basada en BSA en pacientes < 45 kg.
Pacientes pediátricos: La farmacocinética de blinatumomab se presenta lineal sobre un rango de dosis de 5 mcg/m2/día a 30 mcg/m2/día en pacientes pediátricos. A las dosis recomendadas de 5 mcg/m2/día y 15 mcg/m2/día para el tratamiento de LLA de precursores de células B en recaída o refractaria, los valores de la media (DE) de concentración en estado estable (Css) fueron 162 (179) pg/mL y 533 (392) pg/mL, respectivamente. La farmacocinética de blinatumomab en pacientes pediátricos con LLA de precursores de células B con EMR positiva fue similar a la de los pacientes pediátricos con LLA refractaria o en recaída.
En todos los pacientes pediátricos con LLA, la media estimada (DE) de volumen de distribución (Vz), depuración (CL) y vida media terminal (t½,z) en el Ciclo 1 fueron 4.14 (3.32) L/m2, 1.65 (1.62) L/hora/m2 y 2.14 (1.44) horas, respectivamente.
Las concentraciones de estado estable de blinatumomab fueron comparables en pacientes adultos y pediátricos en niveles de dosis equivalentes con base en regímenes basados en BSA.
La media estimada (DE) de volumen de distribución (Vz), depuración (CL) y la vida media terminal (t½,z) en el Ciclo 1 fueron 3.91 (3.36) L/m2, 1.88 (1.90) L/hora/m2 y 2.19 (1.53) horas, respectivamente.
Pacientes con insuficiencia renal: Los análisis de farmacocinética mostraron una diferencia aproximada del doble en los valores medios de depuración de blinatumomab entre pacientes con insuficiencia renal moderada (CrCL en el rango de 30 mL/min a 59 mL/min, N = 49) y función renal normal (CrCL de más de 90 mL/min, N = 674). Sin embargo, se percibió una alta variabilidad entre pacientes (CV% de hasta 98.4%), y los valores de depuración en pacientes con insuficiencia renal estuvieron esencialmente dentro del rango observado en pacientes con función renal normal. No hay información disponible de pacientes con insuficiencia renal severa (CrCL de 15-29 mL/min) o pacientes que estén recibiendo hemodiálisis.
Pacientes con insuficiencia hepática: No se han llevado a cabo estudios formales de farmacocinética con blinatumomab en pacientes con insuficiencia hepática.
Estudios de interacciones farmacológicas: La elevación transitoria de las citocinas puede suprimir la actividad de la enzima CYP450 (ver Interacciones medicamentosas y de otro género).
lnmunogenicidad: La incidencia observada de anticuerpos contra el medicamento depende en gran medida de la sensibilidad y especificidad del ensayo. Las diferencias en los métodos del ensayo no permiten realizar comparaciones significativas de la incidencia de anticuerpos contra el medicamento en los estudios descritos más abajo con la incidencia de anticuerpos contra el medicamento en otros estudios, incluidos los de BLINCYTO®.
La inmunogenicidad de BLINCYTO® se evaluó utilizando una tecnología de detección de electroquimioluminiscencia (ECL, por sus siglas en inglés) o un ensayo de inmunoadsorción enzimática (ELISA) para la detección de anticuerpos de unión anti-blinatumomab. Para los pacientes cuyos sueros dieron positivo en el inmunoensayo, se realizó un ensayo biológico in vitro para detectar los anticuerpos neutralizantes.
En estudios clínicos, menos del 2% de pacientes tratados con BLINCYTO® dieron positivo para anticuerpos de unión anti-blinatumomab. De los pacientes que desarrollaron anticuerpos anti-blinatumomab, 7 de cada 9 (78%) tenían actividad neutralizante in vitro. La formación de anticuerpos anti-blinatumomab puede afectar la farmacocinética de BLINCYTO®.
En general, la totalidad de la evidencia clínica respalda el hallazgo de que la presencia de anticuerpos anti-blinatumomab no sugiere que BLINCYTO® tenga un efecto clínico sobre la seguridad ni la efectividad.
Uso en poblaciones específicas:
Uso pediátrico: No se ha establecido para ninguna indicación la seguridad y eficacia de BLINCYTO® en pacientes pediátricos menores de 1 mes de edad.
LLA de precursores de células B con enfermedad mínima residual (EMR) positiva: Se han establecido la seguridad y la eficacia de BLINCYTO® para el tratamiento de la leucemia linfoblástica aguda (LLA) de precursores de células B con CD19 positivo en primera o segunda remisión completa con una enfermedad mínima residual (EMR) mayor o igual que el 0.1% en pacientes pediátricos. El uso de BLINCYTO® está respaldado por la evidencia de dos estudios controlados aleatorizados (Estudio AALL 1331 NCT02101853 y Estudio 20120215 NCT02393859) en sujetos pediátricos con LLA de precursores de células B en su primera recaída. En ambos estudios se incluyeron pacientes pediátricos con LLA de precursores de células B con EMR positiva. Los estudios incluyeron pacientes pediátricos tratados con BLINCYTO® en los siguientes grupos etarios: Seis lactantes (de 1 mes a menos de 2 años), 165 niños (de 2 años a menos de 12 años) y 70 adolescentes (de 12 años a menos de 17 años). En general, las reacciones adversas en los pacientes pediátricos tratados con BLINCYTO® fueron de tipos similares a aquellas observadas en pacientes adultos con LLA con EMR positiva [consulte Reacciones adversas], y no se observaron diferencias en la seguridad entre los diferentes subgrupos etarios pediátricos.
LLA de precursores de células B en recaída o refractaria:
La seguridad y eficacia de BLINCYTO® ha sido establecida en pacientes pediátricos con LLA de precursores de células B en recaída o refractaria. El uso de BLINCYTO® es respaldado por un estudio de un solo brazo en pacientes pediátricos con LLA de precursores de células B en recaída o refractaria. Este estudio incluyó pacientes pediátricos en los siguientes grupos de edad: 10 infantes (1 mes hasta menos de 2 años), 40 niños (2 años hasta menos de 12 años), y 20 adolescentes (12 años a menos de 18 años). No se observaron diferencias en la eficacia entre los diferentes subgrupos por edad.
En general, las reacciones adversas en pacientes pediátricos tratados con BLINCYTO® con LLA de precursores de células B en recaída o refractaria fueron similares en tipo a aquéllas observadas en pacientes adultos con LLA de precursores de células B en recaída o refractaria (ver Reacciones secundarias y adversas). Las reacciones adversas que fueron observadas con más frecuencia (≥ 10%) en la población pediátrica comparadas con la población adulta fueron pirexia (80% vs. 61%), hipertensión (26% vs. 8%), anemia (41% vs. 24%), reacción relacionada a la infusión (49% vs. 34%), trombocitopenia (34% vs. 21%), leucopenia (24% vs. 11%), e incremento de peso (17% vs. 6%).
En pacientes pediátricos con LLA en recaída o refractaria menores de 2 años (infantes), la incidencia de toxicidades neurológicas no fue significativamente diferente para los otros grupos de edad, pero sus manifestaciones fueron diferentes; los únicos términos del evento reportados fueron agitación, cefalea, insomnio, somnolencia e irritabilidad. Los infantes también tuvieron un incremento en la incidencia de hipocalemia (50%) en comparación con otros cohortes de edad pediátrica (15% a 20%) o adultos (17%).
Las concentraciones de estado-estable de blinatumomab fueron comparables en pacientes adultos y pediátricos en niveles de dosis equivalentes con base en regímenes basados en BSA.
LLA de precursores de células B en fase de consolidación: Se estableció la seguridad y la eficacia de BLINCYTO® para el tratamiento de la LLA de precursores de células B en fase de consolidación en pacientes pediátricos. El uso de BLINCYTO® para esta indicación está respaldado por la evidencia obtenida en un estudio aleatorizado y controlado en adultos obtenidos de dos estudios aleatorizados y controlados (Estudio AALL 1331 y Estudio 20120215) [consulte Reacciones adversas, Farmacología clínica y Estudios].
Toxicidad por alcohol bencílico en neonatos: En neonatos con muy poco peso al nacer (VLBW, por sus siglas en inglés) inferior a 1,500 g y neonatos muy prematuros (niños pequeños nacidos antes de la semana 34 de gestación) tratados con medicamentos con alcohol bencílico por vía intravenosa se pueden producir reacciones adversas graves y fatales. El "síndrome de jadeo" se caracteriza por depresión del sistema nervioso central, acidosis metabólica y respiración jadeante. En estos casos, las dosificaciones de alcohol bencílico de 99 mg/kg/día a 234 mg/kg/día produjeron altas concentraciones de alcohol bencílico y de sus metabolitos en la sangre y la orina (las concentraciones sanguíneas de alcohol bencílico fueron de 0.61 mmol/L a 1.378 mmol/L). Las reacciones adversas adicionales incluyeron deterioro neurológico gradual, convulsiones, hemorragia intracraneal, anomalías hematológicas, rotura de la piel, insuficiencia hepática y renal, hipotensión, bradicardia y colapso cardiovascular. Se desconoce la cantidad mínima de alcohol bencílico con la que se pueden producir reacciones adversas graves en neonatos (ver Advertencias y precauciones).
Cuando sea posible, se deben utilizar las formulaciones de BLINCYTO® libres de conservantes en neonatos. Cuando prescriba BLINCYTO® (con conservante) en pacientes neonatos, considere la carga metabólica diaria combinada de alcohol bencílico de todas las fuentes, incluyendo BLINCYTO® (con conservante). La bolsa de 7 días de BLINCYTO® (con conservante) contiene 7.4 mg de alcohol bencílico por mL (ver Precauciones generales).
La administración de alcohol bencílico puede contribuir a la acidosis metabólica en pacientes pediátricos, en especial aquellos cuya vía de metabolización del alcohol sea inmadura, o aquellos que padezcan afecciones subyacentes o que reciban medicamentos concomitantes que podrían predisponer a un desequilibrio ácido-básico. Monitoree a los pacientes durante el uso de BLINCYTO® (con conservante) para detectar la aparición o el empeoramiento de acidosis metabólica.
Uso geriátrico: Hubo 158 (7%) pacientes de 65 años o más en los estudios clínicos de BLINCYTO® para pacientes con ERM positiva, LLA de precursores de células B CD19 positiva en primera o segunda remisión completa, LLA de precursores de células B CD19 positiva en recaída o refractaria y CD19 positiva. LLA precursora de células B negativas con cromosoma Filadelfia en fase de consolidación. Del número total de pacientes tratados con BLINCYTO® en estos estudios, 123 (8%) tenían 65 años o más y 21 (1%) tenían 75 años o más. No se observaron diferencias generales en seguridad o eficacia entre estos pacientes y los pacientes más jóvenes, y otras experiencias clínicas informadas no han identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes. Sin embargo, los pacientes de edad avanzada experimentaron una mayor tasa de infecciones graves y toxicidades neurológicas, incluidos trastornos cognitivos, encefalopatía y confusión.
Farmacodinámica:
Durante la infusión intravenosa continua de 4 semanas, la respuesta farmacodinámica se caracterizó por la activación de los linfocitos T y la redistribución inicial, disminución de las células B periféricas y la elevación transitoria de las citocinas.
Después del inicio de la infusión con BLINCYTO® o el escalamiento de la dosis se observó redistribución de las células T periféricas (es decir, adición de células T al endotelio de los vasos sanguíneos y/o trasmigración al tejido). Inicialmente disminuyeron los recuentos de células T en los días 1 a 2 y posteriormente retornaron a los niveles basales dentro de los 7 a 14 días en la mayoría de los pacientes. En pocos pacientes se observó aumento de los recuentos de células T mayor a los valores basales (expansión de células T).
En la mayoría de los pacientes, los recuentos de células B periféricos disminuyeron a menos o igual a 10 células/microlitro durante el primer ciclo de tratamiento a una dosis ≥ 5 mcg/m2/día o ≥ 9 mcg/día. No se observó recuperación de los recuentos de las células B periféricas durante el periodo de 2 semanas sin BLINCYTO® entre los ciclos de tratamiento. La disminución incompleta de células B ocurrió a dosis de 0.5 mcg/m2/día y 1.5 mcg/m2/día y en algunos pacientes a dosis mayores.
Las citocinas incluidas IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, TNF-α e IFN-ℽ se midieron y se observó que IL-6, IL-10 e IFN-ℽ estuvieron elevadas. Las elevaciones más altas de citocinas se observaron en los primeros 2 días después del inicio de la infusión con BLINCYTO®. Los niveles elevados de citocinas retornaron a los valores basales dentro de las 24 a 48 horas durante la infusión. En los ciclos de tratamiento subsiguientes, se observó elevación de las citocinas en menos pacientes con menor intensidad en comparación con las primeras 48 horas del primer ciclo de tratamiento.
Mecanismo de acción: Blinatumomab es un acoplador biespecífico de células T CD3, dirigido a CD19 y que se une al CD19, expresado sobre la superficie de células de linaje B con CD3 expresado en la superficie de las células T. Éste activa las células T endógenas mediante la conexión de CD3 en el complejo de receptores de células T (TCR, por sus siglas en inglés) con CD19 sobre las células B benignas y malignas. Blinatumomab actúa como mediador en la formación de una sinapsis entre la célula T y la célula tumoral, regulación positiva de las moléculas de adhesión celular, la producción de proteínas citolíticas, la liberación de citocinas inflamatorias y la proliferación de células T, que dan lugar a la lisis redirigida de las células CD19+.
Estudios clínicos:
LLA de precursores de células B recurrente o refractario:
Estudio TOWER: La eficacia de BLINCYTO® se comparó con la quimioterapia estándar (SOC, por sus siglas en inglés) en un estudio aleatorizado, de etiqueta abierta, multicéntrico (Estudio TOWER) [NCT02013167]. Los pacientes elegibles tenían ≥ 18 años de edad con LLA de precursores de células B recurrente o refractario [> 5% de blastos en la médula ósea y refractaria a la terapia de inducción primaria o refractaria a la última terapia, primera recaída no tratada con primera duración de remisión < 12 meses, segunda recaída o posterior no tratada, o recaída en cualquier momento después del trasplante alogénico de células madre hematopoyéticas [alloHSCT, por sus siglas en inglés]). BLINCYTO® se administró en dosis de 9 mcg/día en los días 1 a 7 y 28 mcg/día en los días 8 a 28 para el Ciclo 1, y 28 mcg/día en los días 1 a 28 para los Ciclos 2 a 5 en ciclos de 42 días y para los Ciclos 6 a 9 en ciclos de 84-días. El ajuste de la dosis fue posible en caso de eventos adversos. La quimioterapia estándar SOC incluyó fludarabina, citarabina arabinósido y factor estimulante de colonias de granulocitos (FLAG); dosis altas de arabinósido de citarabina (HiDAC); combinación a base de dosis altas de metotrexato (HDMTX); o regímenes basados en clofarabina/clofarabina.
Hubo 405 pacientes aleatorizados 2:1 para recibir BLINCYTO® o quimioterapia estándar SOC seleccionada por el investigador. La aleatorización se estratificó por edad (< 35 años frente a ≥ 35 años de edad), terapia previa de rescate (sí vs. no) y previo alloHSCT (sí vs. no), según se evaluó en el momento del consentimiento. La demografía y las características basales estuvieron bien equilibradas entre los dos brazos (ver Tabla 1).
Tabla 1. Características basales y demográficas en el estudio TOWER
|
Características |
BLINCYTO® (n = 271) |
Quimioterapia estándar (SOC) (n = 134) |
|---|---|---|
|
Edad |
||
|
Mediana, años (mín., máx.) |
37 (18, 80) |
37 (18, 78) |
|
< 35 años, n (%) |
124 (46) |
60 (45) |
|
≥ 35 años, n (%) |
147 (54) |
74 (55) |
|
≥ 65 años, n (%) |
33 (12) |
15 (11) |
|
≥ 75 años, n (%) |
10 (4) |
2 (2) |
|
Hombres, n (%) |
162 (60) |
77 (58) |
|
Raza, n (%) |
||
|
Indio americano o nativo de Alaska |
4 (2) |
1 (1) |
|
Asiático |
19 (7) |
9 (7) |
|
Negro (o Afroamericano) |
5 (2) |
3 (2) |
|
Múltiple |
2 (1) |
0 |
|
Hawaiano nativo u otra isla del pacífico |
1 (0) |
1 (1) |
|
Otro |
12 (4) |
8 (6) |
|
Blanco |
228 (84) |
112 (84) |
|
Terapia previa de rescate |
171 (63) |
70 (52) |
|
AlloHSCT1 previa |
94 (35) |
46 (34) |
|
Estado del grupo cooperativo del Este n (%) |
||
|
0 |
96 (35) |
52 (39) |
|
1 |
134 (49) |
61 (46) |
|
2 |
41 (15) |
20 (15) |
|
Desconocido |
0 |
1 (1) |
|
Refractario a tratamiento de rescate-n (%) |
||
|
Sí |
87 (32) |
34 (25) |
|
No |
182 (67) |
99 (74) |
|
Desconocido |
2 (1) |
1 (1) |
|
Máximo de blastos en médula ósea central/local-n (%) |
||
|
≤ 5% |
0 |
0 |
|
> 5 a < 10% |
9 (3) |
7 (5) |
|
10 a < 50% |
60 (22) |
23 (17) |
|
≥ 50% |
201 (74) |
104 (78) |
|
Desconocido |
1 (0) |
0 |
1 alloHSCT = trasplante alogénico de células madre hematopoyéticas.
De los 271 pacientes asignados al azar al brazo de BLINCYTO®, 267 pacientes recibieron tratamiento con BLINCYTO®. La mediana del número de ciclos de tratamiento fue dos (rango: 1 a 9 ciclos); 267 (99%) recibieron Ciclos 1 a 2 (inducción), 86 (32%) recibieron Ciclos 3 a 5 (consolidación) y 27 (10%) recibieron ciclos 6 a 9 (terapia continua). De los 134 pacientes en el brazo de SOC, 25 abandonaron previo al inicio del tratamiento del estudio, y 109 pacientes recibieron una mediana de 1 ciclo de tratamiento (rango: 1 a 4 ciclos).
La determinación de la eficacia se basó en la supervivencia global (SG). El estudio demostró una mejoría estadísticamente significativa en la SG para los pacientes tratados con BLINCYTO® en comparación con la quimioterapia estándar SOC.
Consulte la Figura 1 y la Tabla 2 a continuación para conocer los resultados de eficacia del Estudio TOWER.
Figura 1. Curva de Kaplan-Meier de supervivencia global en el estudio TOWER
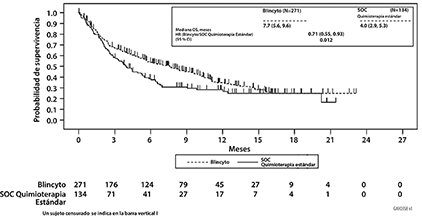
Tabla 2. Resultados de eficacia en pacientes ≥ 18 años de edad con LLA de precursores de células B cromosoma Filadelfia negativo en recaída o refractaria (estudio TOWER)
|
BLINCYTO® (n = 271) |
Quimioterapia estándar SOC (n = 134) |
|
|---|---|---|
|
Supervivencia global |
||
|
Número de muertes (%) |
164 (61) |
87 (65) |
|
Mediana, meses [95% IC] |
7.7 [5.6, 9.6] |
4.0 [2.9, 5.3] |
|
Coeficiente de riesgo [95% IC]1 |
0.71 [0.55, 0.93] |
|
|
Valor-p2 |
0.012 |
|
|
Respuesta global |
||
|
CR4/CRh*5, n (%) [95% IC] |
115 (42) [37, 49] |
27 (20) [14, 28] |
|
Diferencia de tratamiento [95% IC] |
22 [13, 31] |
|
|
Valor-p3 |
< 0.001 |
|
|
CR, n (%) [95% IC] |
91 (34) [28, 40] |
21 (16) [10, 23] |
|
Diferencia de tratamiento [95% IC] |
18 [10, 26] |
|
|
Valor-p3 |
< 0.001 |
|
|
Respuesta6 EMR para CR/CRh* |
||
|
n1/n2 (%)7 [95% IC] |
73/115 (64) [54, 72] |
14/27 (52) [32, 71] |
1 Basado en el modelo estratificado de Cox.
2 El valor de p se obtuvo usando la prueba de rango logarítmico estratificado.
3 El valor de p se obtuvo usando la prueba de Cochran-Mantel-Haenszel.
4 La CR (remisión completa) se definió como ≤ 5% de blastos en la médula ósea, sin evidencia de enfermedad y recuperación completa de los conteos de sangre periférica (plaquetas > 100,000/microlitro y recuentos de neutrófilos absolutos [ANC] > 1,000/microlitro).
5 La CRh* (remisión completa con recuperación hematológica parcial) se definió como ≤ 5% de blastocitos en la médula ósea, sin evidencia de enfermedad y recuperación parcial de los conteos de sangre periférica (plaquetas > 50,000/microlitro y ANC > 500/microlitro).
6 La respuesta de EMR (enfermedad mínima residual) se definió como EMR mediante PCR o citometría de flujo < 1 x 104 (0.01%).
7 n1: número de pacientes que alcanzaron la respuesta de EMR y CR/CRh*; n2: número de pacientes que alcanzaron CR/CRh* y tuvieron una evaluación posterior a la línea de base.
Estudio MT103-211: El estudio MT103-211 [NCT01466179] fue un estudio de etiqueta abierta, multicéntrico, de un solo brazo. Los pacientes elegibles tenían ≥ 18 años de edad con LLA de precursores de células B cromosoma Filadelfia negativo recurrente o refractario (recaída con una duración de la primera remisión de ≤ 12 meses en el primer rescate o recurrente o refractario después de la primera terapia de rescate o recurrente dentro de los 12 meses de alloHSCT y tenían ≥ 10% de blastos en la médula ósea).
BLINCYTO® se administró como una infusión intravenosa continua. La dosis recomendada para este estudio se determinó que era de 9 mcg/día en los Días 1 a 7 y 28 mcg/día en los Días 8 a 28 para el Ciclo 1 y 28 mcg/día en los Días 1 a 28 para los ciclos subsecuentes. El ajuste de la dosis fue posible en caso de eventos adversos. La población tratada incluyó 185 pacientes que recibieron al menos 1 infusión de BLINCYTO®; la mediana del número de ciclos de tratamiento fue 2 (rango: 1 a 5). Los pacientes que respondieron a BLINCYTO®, pero después recayeron tuvieron la opción de ser nuevamente tratados con BLINCYTO®. Entre los pacientes tratados, la mediana de edad fue de 39 años (rango: 18 a 79 años), 63 de 185 (34.1%) se habían sometido a un HSCT antes de recibir blinatumomab, y 32 de 185 (17.3%) habían recibido más de 2 terapias de rescate previas.
La eficacia se basó en la tasa de remisión completa (CR), la duración de la CR y la proporción de pacientes con una EMR-negativa CR/CR con recuperación hematológica parcial (CR/CRh*) en 2 ciclos de tratamiento con BLINCYTO®. La Tabla 3 muestra los resultados de eficacia de este estudio. La tasa de HSCT entre aquellos que alcanzaron CR/CRh* fue del 39% (30 de 77).
Tabla 3. Resultados de eficacia en pacientes ≥ 18 años de edad con LLA de precursores de células B cromosoma Filadelfia negativo en recaída o refractario (estudio MT103-211)
|
N = 185 |
|||
|---|---|---|---|
|
CR1 |
CRh*2 |
CR/CRh* |
|
|
n (%) [95% IC] |
60 (32.4) [25.7-39.7] |
17 (9.2) [5.4-14.3] |
77 (41.6) [34.4-49.1] |
|
Respuesta a EMR3 |
|||
|
n1/n2 (%)4 [95% IC] |
48/60 (80.0) [67.7-89.2] |
10/17 (58.8) [32.9-81.6] |
58/77 (75.3) [64.2-84.4] |
|
DOR/RFS5 |
|||
|
Mediana (meses) (rango) |
6.7 (0.46-16.5) |
5.0 (0.13-8.8) |
5.9 (0.13-16.5) |
1 La CR (remisión completa) se definió como ≤ 5% de blastos en la médula ósea, sin evidencia de enfermedad y recuperación completa de conteos sanguíneos periféricos (plaquetas > 100,000/microlitro y recuentos de neutrófilos absolutos [ANC] > 1,000/microlitro).
2 La CRh* (remisión completa con recuperación hematológica parcial) se definió como ≤ 5% de blastos en la médula ósea, sin evidencia de enfermedad y recuperación parcial de los conteos de sangre periférica (plaquetas > 50,000/microlitro y ANC > 500/microlitro).
3 La respuesta de EMR (enfermedad mínima residual) se definió como EMR mediante PCR < 1 x 10-4 (0.01%).
4 n1: número de pacientes que alcanzaron la respuesta EMR y el estado de remisión respectivo; n2: número de pacientes que alcanzaron el estado de remisión respectivo. Seis CR/CRh* respondedores con datos faltantes de EMR se consideraron como EMR-no respondedores.
5 La DOR (duración de la respuesta)/RFS (supervivencia libre de recaída) se definió como el tiempo desde la primera respuesta de CR o CRh* a recaída o muerte, lo que ocurra primero. La recaída se definió como una recaída hematológica (blastocitos en la médula ósea mayor al 5% después de CR) o una recaída extramedular.
Estudio ALCANTARA: La eficacia de BLINCYTO® para el tratamiento de la LLA de precursores de células B cromosoma Filadelfia positivo, se evaluó en un estudio abierto, multicéntrico, de brazo único (estudio ALCANTARA) [NCT02000427]. Los pacientes elegibles tenían ≥ 18 años de edad con LLA de precursores de células B cromosoma Filadelfia positivo, recurrentes o refractarios a al menos 1 inhibidor de tirosina cinasa (TKI) de segunda generación o posterior, o intolerantes a TKI de segunda generación e intolerantes o refractarios al mesilato de imatinib.
BLINCYTO® se administró a 9 mcg/día en los días 1 a 7 y 28 mcg/día en los días 8 a 28 para el ciclo 1 y 28 mcg/día en los días 1 a 28 para los ciclos subsecuentes. El ajuste de la dosis fue posible en caso de eventos adversos.
La población tratada incluyó 45 pacientes que recibieron al menos una infusión de BLINCYTO®; la mediana del número de ciclos de tratamiento fue 2 (rango: 1 a 5). Los datos demográficos y las características iniciales se muestran en la Tabla 4.
Tabla 4. Características y datos demográficos basales en el estudio ALCANTARA
|
Característica |
BLINCYTO® (n = 45) |
|---|---|
|
Edad |
|
|
Mediana, años (mín., máx.) |
55 (23, 78) |
|
≥ 65 años y < 75 años, n (%) |
10 (22) |
|
≥ 75 años, n (%) |
2 (4) |
|
Hombres, n (%) |
24 (53) |
|
Raza, n (%) |
|
|
Asiático |
1 (2) |
|
Negro (o afroamericano) |
3 (7) |
|
Otro |
2 (4) |
|
Blanco |
39 (87) |
|
Historia de la enfermedad |
|
|
Tratamiento previo con TKI1, n (%) |
|
|
1 |
7 (16) |
|
2 |
21 (47) |
|
≥ 3 |
17 (38) |
|
Terapia previa de rescate |
31 (62) |
|
alloHSCT2 previo |
20 (44) |
|
Blastocitos de médula ósea3 |
|
|
≥ 50% a < 75% |
6 (13) |
|
≥ 75% |
28 (62) |
1 Número de pacientes que fracasaron a ponatinib = 23 (51%).
2 alloHSCT = trasplante alogénico de células madre hematopoyéticas.
3 Evaluados centralmente.
La eficacia se basó en la tasa de remisión completa (CR), la duración de la CR y la proporción de pacientes con CR/CR con EMR-negativa y recuperación hematológica parcial (CR/CRh*) en 2 ciclos de tratamiento con BLINCYTO®. La Tabla 5 muestra los resultados de eficacia del estudio ALCANTARA. Cinco de los 16 pacientes que respondieron (31%) se sometieron a HSCT alogénico en CR/CRh* inducido con BLINCYTO®. Hubo 10 pacientes con mutación documentada de T3151; cuatro lograron CR en 2 ciclos de tratamiento con BLINCYTO®.
Tabla 5. Resultados de eficacia en pacientes ≥ 18 años de edad con LLA de precursores de células B cromosoma Filadelfia positivo en recaída o refractario (estudio ALCANTARA)
|
N = 45 |
|||
|---|---|---|---|
|
CR1 |
CRh*2 |
CR/CRh* |
|
|
n (%) [95% IC] |
14 (31) [18 a 47] |
2 (4) [1 a 15] |
16 (36) [22 a 51] |
|
Respuesta a EMR3 |
|||
|
n1/n2 (%)4 [95% IC] |
12/14 (86) [57 a 98] |
2/2 (100) [16, 100] |
14/16 (88) [62 a 98] |
|
DOR/RFS5 |
|||
|
Mediana (meses) (rango) |
6.7 (3.6 a 12.0) |
NE6 (3.7 a 9.0) |
6.7 (3.6 a 12.0) |
1 La CR (remisión completa) se definió como ≤ 5% de blastos en la médula ósea, sin evidencia de enfermedad y recuperación completa de conteos sanguíneos periféricos (plaquetas > 100,000/microlitro y recuentos de neutrófilos absolutos [ANC] > 1,000/microlitro.
2 CRh* (remisión completa con recuperación hematológica parcial) se definió como ≤ 5% de blastos en la médula ósea, sin evidencia de enfermedad y recuperación parcial de los conteos de sangre periférica (plaquetas > 50,000/microlitro y ANC > 500/microlitro).
3 La respuesta de EMR (enfermedad mínima residual) se definió como EMR mediante PCR < 1 x 10-4 (0.01%).
4 n1: número de pacientes que alcanzaron la respuesta EMR y el estado de remisión respectivo; n2: número de pacientes que alcanzaron el estado de remisión respectivo. Seis CR/CRh* respondedores con datos faltantes de EMR se consideraron como EMR-no respondedores.
5 La DOR (duración de la respuesta)/RFS (supervivencia libre de recaída) se definió como el tiempo desde la primera respuesta de CR o CRh* a recaída o muerte, lo que ocurra primero. La recaída se definió como una recaída hematológica (blastocitos en la médula ósea mayor al 5% después de CR) o una recaída extramedular.
6 NE = no estimable.
Estudio MT103-205: El estudio MT103-205 [NCT01471782] fue un estudio abierto, multicéntrico, de un solo brazo en pacientes pediátricos con LLA de precursores de células B recurrente o refractaria (segunda recaída o posterior de médula ósea, cualquier recaída de médula después de HSCT alogénico o refractaria a otros tratamientos, y > 25% de blastos en la médula ósea). BLINCYTO® se administró a 5 mcg/m2/día en los días 1 a 7 y 15 mcg/m2/día en los días 8 a 28 para el ciclo 1, y 15 mcg/m2/día en los Días 1 a 28 para los ciclos subsecuentes. El ajuste de la dosis fue posible en caso de eventos adversos. Los pacientes que respondieron a blinatumomab pero que después recayeron tuvieron la opción de ser retratados con BLINCYTO®.
Entre los 70 pacientes tratados, la mediana de edad fue de 8 años (rango: 7 meses a 17 años), 40 de 70 (57.1%) habían sido sometidos a HSCT alogénico antes de recibir BLINCYTO®, y 39 de 70 (55.7%) tenían enfermedad refractaria. La mediana del número de ciclos de tratamiento fue 1 (rango: 1 a 5).
Veintitrés de 70 (32.9%) pacientes alcanzaron CR/CRh* dentro de los primeros 2 ciclos de tratamiento con 17 de 23 (73.9%) ocurriendo dentro del Ciclo 1 de tratamiento. Consulte la Tabla 6 para conocer los resultados de eficacia del estudio. La tasa de HSCT entre los que alcanzaron CR/CRh* fue del 48% (11 de 23).
Tabla 6. Resultados de eficacia en pacientes < 18 años de edad con LLA de precursores de células B en recaída o refractario (estudio MT103 205)
|
n = 70 |
|||
|---|---|---|---|
|
CR1 |
CRh*2 |
CR/CRh* |
|
|
n (%) [95% IC] |
12 (17.1) [9.2-28.0] |
11 (15.7) [8.1-26.4] |
23 (32.9) [22.1-45.1] |
|
Respuesta a EMR3 |
|||
|
n1/n2 (%)4 [95% IC] |
6/12 (50.0) [21.1-78.9] |
4/11 (36.4) [10.9-69.2] |
10/23 (43.5) [23.2-65.5] |
|
DOR/RFS5 |
|||
|
Mediana (meses) (rango) |
6.0 (0.5-12.1) |
3.5 (0.5-16.4) |
6.0 (0.5-16.4) |
1 La CR (remisión completa) se definió como ≤ 5% de blastos en la médula ósea, sin evidencia de blastos circulantes o enfermedad medular extra, y recuperación completa de conteos sanguíneos periféricos (plaquetas > 100,000/microlitro y recuentos de neutrófilos absolutos [ANC] > 1,000/microlitro).
2 La CRh* (remisión completa con recuperación hematológica parcial) se definió como ≤ 5% de blastos en la médula ósea, sin evidencia de blastos circulantes o enfermedad medular extra, y recuperación parcial de conteos sanguíneos periféricos (plaquetas > 50,000/microlitro y ANC > 500/microlitro).
3 La respuesta de EMR (enfermedad mínima residual) se definió como EMR mediante PCR o citometría de flujo < 1 x 10-4 (0.01%).
4 n1: número de pacientes que alcanzaron la respuesta de EMR y el estado de remisión respectivo; n2: número de pacientes que alcanzaron el estado de remisión respectivo. Un respondedor CR/CRh* con datos EMR faltantes fue considerado como un EMR-no respondedor.
5 La DOR (duración de la respuesta)/RFS (supervivencia libre de recaída) se definió como el tiempo transcurrido desde la primera respuesta de CR o CRh* a recaída o muerte, lo que ocurra primero. La recaída se definió como una recaída hematológica (nivel de blastocitos en la médula ósea superior al 5% después de la CR) o una recaída extramedular.
LLA precursores de células B con cromosoma Filadelfia negativo en fase de consolidación:
Estudio E1910: La eficacia de BLINCYTO® se evaluó en un estudio aleatorizado y controlado de Fase 3 en pacientes adultos con LLA de precursores de células B con cromosoma Filadelfia negativo diagnosticado recientemente (Estudio E191 O) [NCT02003222]. Los pacientes elegibles recibieron quimioterapia de inducción. Después de la inducción, los pacientes en remisión hematológica completa (GR) o GR con recuperación incompleta del recuento en sangre periférica (GR1) continuaron en el estudio y recibieron quimioterapia de intensificación. Después de la terapia de intensificación, se aleatorizó a 286 pacientes o se les asignó para que recibieran BLINCYTO® alternando con quimioterapia (n = 152) o quimioterapia de consolidación del estándar de tratamiento (SOG) sola (n = 134). Los pacientes en cada grupo recibieron la misma quimioterapia de mantenimiento. La aleatorización se clasificó según el estado de EMR (negatividad de EMR definida como < 1 x 10-4), edad (< 55 años frente a ≥ 55 años), estado de CD20, administración de rituximab e intención de recibir un trasplante de células madre (TCM) alogénico.
El tratamiento posterior a la remisión consistió en un régimen de quimioterapia similar a BFM adaptado del ensayo clínico E2993/UKALLXII. Los pacientes asignados al azar al grupo de BLINCYTO® debían recibir 2 ciclos de BLINCYTO® seguidos de 3 ciclos de quimioterapia de consolidación, luego un tercer ciclo de BLINCYTO® seguido del cuarto ciclo de quimioterapia y un cuarto ciclo de BLINCYTO® (un total de 8 ciclos).
BLINCYTO® se administró como una infusión intravenosa continua a razón de 28 mcg/día los días 1 a 28.
Los pacientes asignados al azar al grupo de quimioterapia del estudio debían recibir 4 ciclos de quimioterapia sola (4 ciclos en total). Los pacientes del grupo de BLINCYTO® podrían someterse a un TCMH después de 1 o 2 ciclos de BLINCYTO® y hasta 2 ciclos de quimioterapia de consolidación, y los pacientes asegurados al azar al grupo de quimioterapia podrían someterse a un TCMH después de la intensificación y hasta 3 ciclos de quimioterapia de consolidación. Todos los pacientes que completaron la consolidación pero no fueron sometidos a TCMH recibieron terapia de mantenimiento durante 2 años y medio desde el inicio de la intensificación.
Las características demográficas y de referencia se proporcionan en la Tabla 7.
Tabla 7. Datos demográficos y características en el estudio E1910
|
Características |
Consolidación consistente en |
|
|---|---|---|
|
Ciclos de BLINCYTO® + ciclos de quimioterapia (n = 112) |
Ciclos de quimioterapia solo (n = 112) |
|
|
Edad |
||
|
Mediana, años (mín., máx.) |
52 (31, 69) |
50 (30, 70) |
|
Hombres, n (%) |
55 (49) |
56 (50) |
|
Raza, n (%) |
||
|
Indio americano o nativo de Alaska |
2 (2) |
1 (1) |
|
Asiático |
3 (3) |
2 (2) |
|
Negro (o afroamericano) |
9 (8) |
4 (4) |
|
Nativo de Hawái u otras islas del Pacífico |
1 (1) |
0 |
|
Blanco |
87 (78) |
89 (79) |
|
No reportado |
5 (4) |
6 (5) |
|
Desconocido |
5 (4) |
10 (9) |
|
Etnia, n (%) |
||
|
Hispanos o latinos |
13 (12) |
10 (9) |
|
Ni hispanos ni latinos |
95 (85) |
95 (85) |
|
No reportado |
1 (1) |
2 (2) |
|
Desconocido |
3 (3) |
5 (4) |
|
Factores de estratificación, n (%) |
||
|
Edad < 55 años en la aleatorización |
65 (58) |
65 (58) |
|
CD20 positivo |
45 (40) |
46 (41) |
|
Uso de rituximab |
33 (29) |
36 (32) |
|
SCTa alogénica planificada |
36 (32) |
35 (31) |
Un trasplante alogénico de células madre = trasplante alogénico de células madre.
La eficacia se estableció sobre la base de la supervivencia general (SG). Los resultados, con una mediana de seguimiento de 3,6 años, se muestran en la Figura 2 y en la Tabla 8.
Figura 2. Curva de Kaplan-Meier para la supervivencia global en el estudio E1910

KM = Kaplan-Meier. IC = intervalo de confianza. N = Número de pacientes en el conjunto de análisis.
Censor indicado por barra vertical.
Tabla 8. Supervivencia global en el estudio E1910
|
BLINCYTO® + Quimioterapia |
Quimioterapia |
|
|---|---|---|
|
Número de pacientes |
112 |
112 |
|
Supervivencia general |
||
|
Estimación de Kaplan-Meier a 3 años (%) [IC95%] |
84.8 [76.3, 90.4] |
69.0 [58.7, 77.2] |
|
Cociente de riesgos instantáneos [IC 95%]ª |
0.42 [0.24, O. 75] |
|
|
Valorb |
0.003 |
IC = Intervalo de confianza. La supervivencia general (SG) se calcula desde el momento de la aleatorización hasta la muerte por cualquier causa.
a Las estimaciones de la razón de riesgos instantáneos se obtienen a partir de un modelo de regresión estratificado de Cox en el tercer análisis intermedio.
b El valor p se obtuvo utilizando la prueba de rango logarítmico estratificado.
En un análisis posterior con una mediana de seguimiento de 4,5 años, la SG a 5 años fue de 82,4% [IC 95% (73, 7, 88,4)] en el grupo de BLINCYTO® + Quimioterapia y 62,5% [IC 95% (52,0, 71,3)] en el grupo de quimioterapia. El cociente de riesgos instantáneos fue de 0,44 [IC del 95% (0,25, 0,76)].
Estudio 20120215:
La eficacia de BLINCYTO® en comparación con la quimioterapia de consolidación se evaluó en un estudio aleatorizado, controlado, abierto y multicéntrico (Estudio 20120215) [NCT02393859]. Los pacientes elegibles tenían entre 28 días y 18 años de edad y tenían LLA de riesgo alto, con primera recaída del cromosoma Filadelfia, precursora de células B con < 25% de blastocitos en la médula ósea después de la inducción y 2 ciclos de quimioterapia de consolidación. Los pacientes fueron aleatorizados 1:1 para recibir BLINCYTO® o la quimioterapia combinada intensiva lntReALLHR2010 HC3 como tercer ciclo de consolidación. Los pacientes del grupo de BLINCYTO® recibieron un ciclo de BLINCYTO® en infusión intravenosa continua a 15 mcg/m2/día durante 4 semanas (la dosis diaria máxima no debía superar los 28 mcg/día). La aleatorización se estratificó según la edad, el estado residual mínimo de la enfermedad se determinó al final de la inducción con base en la evaluación local y el estado de la médula ósea se determinó al final del segundo bloque de quimioterapia de consolidación. Los pacientes debían proceder a un TCMH después de este ciclo de consolidación.
Hubo 54 pacientes asignados al azar al grupo de BLINCYTO® y 57 al grupo de quimioterapia. La demografía y las características de referencia se muestran en la Tabla 9.
Tabla 9. Demografía y características basales en el estudio 20120215
|
Características |
Ciclo de consolidación 3 |
|
|---|---|---|
|
BLINCYTO® (N = 54 |
Quimioterapia (N = 57) |
|
|
Edad, n (%) |
||
|
Mediana, (rango) |
6 (1,17) |
5 (1, 17) |
|
< 1 año |
0 |
0 |
|
De 1 a 9 años |
39 (72) |
41 (72) |
|
≥ 10 a 18 años |
15 (28) |
16 (28) |
|
Hombres, n (%) |
30 (56) |
23 (40) |
|
Raza, n (%) |
||
|
Indio americano o nativo de Alaska |
0 |
0 |
|
Asiático |
1 (2) |
3 (5) |
|
Negro (o afroamericano) |
0 |
3 (5) |
|
Nativo de Hawái u otras islas del Pacífico |
0 |
0 |
|
Otro |
3 (6) |
5 (9) |
|
Blanco |
50 (93) |
46 (81) |
|
Citomorfología en la aleatorización, n (%) |
||
|
Explosiones < 5% |
54 (100) |
54 (95) |
|
Las explosiones |
0 |
2 (4) |
|
Explosiones ≥ 25% explosiones |
0 |
0 |
|
No evaluable |
0 |
1 (2) |
|
Valor de PCR de ERM en la aleatorización, n (%) |
||
|
≥ 10-3 |
11 (20) |
16 (28) |
|
< 10-3 y ≥ 10-4 |
15 (28) |
6 (11) |
|
< 10-4 |
20 (37) |
23 (40) |
|
Desconocido |
8 (15) |
12 (21) |
|
Tiempo desde el primer diagnóstico hasta la recaída (mes), n (%) |
||
|
< 18 meses |
19 (35) |
22 (39) |
|
≥ 18 meses y ≤ 30 meses |
32 (59) |
31 (54) |
|
> 30 meses |
3 (6) |
4 (7) |
N = número de pacientes en el conjunto de análisis; n = número de pacientes con datos observados; ERM = enfermedad residual mínima; PCR = reacción en cadena de la polimerasa.
La eficacia se estableció sobre la base de la supervivencia general (SG) y la supervivencia libre de recaída (SLR). Para consultar el Tabla 10, la Figura 3 y la Figura 4 se presentan los resultados de SG y SLR del estudio 20120215.
Tabla 10. Resultados de eficacia en pacientes pediátricos con recaída inicial de alto riesgo precursores de células B para la leucemia linfoblástica aguda (estudio 20120215)
|
Ciclo de consolidación 3 |
||
|---|---|---|
|
BLINCYTO® (N = 54 |
Quimioterapia (N = 57) |
|
|
Supervivencia general |
||
|
Número de muertes (%) |
11 (20.4) |
28 (49.1) |
|
Estimación de KM a 5 años (%) [IC 95%]ª |
78.4 [64.2, 87.4] |
41.4 [26.3, 55.9] |
|
Hazard Ratio [IC 95%]b |
0.35 [0.17, 0.70] |
|
|
Supervivencia sin recaídas |
||
|
Eventos, n (%) |
20 (37.0) |
37 (64.9) |
|
Estimación de KM a 5 años (%) [IC 95%]ª |
61 .1 [46.3, 72.9] |
27.6 [16.2, 40.3] |
|
Hazard Ratio [IC 95%]b |
0.38 [0.22, 0.66] |
|
NE= No estimable. IC = Intervalo de confianza.
ª Los meses se calcularon como días desde la fecha de aleatorización hasta la fecha del evento/censura, divididos por 30,5.
b Las estimaciones de la razón de riesgos instantáneos se obtienen del modelo de riesgos proporcionales de Cox.
La mediana de tiempo de seguimiento para la SG fue de 55,2 meses para la población general. En la figura 3 se presenta un diagrama de Kaplan Meier en el que se compara la SG entre los grupos de tratamiento para la población general.
Figura 3. Kaplan-Meier para la supervivencia general (estudio 20120215)

KM= Kaplan-Meier. IC = intervalo de confianza. N = Número de pacientes en el conjunto de análisis Censor indicado por barra vertical.
Figura 4. Kaplan-Meier para la supervivencia sin recaídas (20120215 de estudio)

KM = Kaplan Meier. IC = intervalo de confianza. N = Número de pacientes en el conjunto de análisis.
Censor indicado por barra vertical
LLA de precursores de células B, EMR positiva:
Estudio BLAST: La eficacia de blinatumomab se evaluó en un estudio abierto, multicéntrico, de un solo grupo (Estudio BLAST) [NCT01207388] que incluyó pacientes que tenían ≥ 18 años de edad, que habían recibido, al menos, 3 bloques de quimioterapia estándar de LLA, que se encontraban en remisión completa hematológica (definida como < 5% de blastos en la médula ósea, recuento absoluto de neutrófilos > 1 Gi/L, plaquetas > 100 Gi/L) y que tenían una EMR en un nivel de e: 0.1%, usando un ensayo con una sensibilidad mínima de 0.01%. BLINCYTO® se administró a una dosis constante de 15 mcg/m2/día (equivalente a la dosis recomendada de 28 mcg/día) por vía intravenosa para todos los ciclos de tratamiento. Los pacientes recibieron hasta 4 ciclos de tratamiento. El ajuste de la dosis fue posible en caso de eventos adversos.
La población tratada incluyó 86 pacientes en la primera o segunda remisión completa hematológica (CR1 o CR2). Las características demográficas y basales se muestran en la Tabla 11. La mediana del número de ciclos de tratamiento fue 2 (rango: 1 a 4). Después del tratamiento con BLINCYTO®, 45 de 61 (73.8%) pacientes en CR1 y 14 de 25 (56.0%) pacientes en CR2 se sometieron a trasplante de células madre hematopoyéticas alogénicas en remisión completa hematológica continua.
Tabla 11. Características basales y demográficas en el Estudio BLAST
|
Características |
Blinatumomab (N = 86) |
|---|---|
|
Edad |
|
|
Mediana, años (mín., máx.) |
43 (18,76) |
|
≥ 65 años, n (%) |
10 (12) |
|
Hombres, n (%) |
50 (58) |
|
Raza, n (%) |
|
|
Asiáticos |
1 (1) |
|
Otro (mixto) |
0 (O) |
|
Blanco |
76 (88) |
|
Desconocido |
9 (11) |
|
Estado de la enfermedad del cromosoma Filadelfia, n (%) |
|
|
Positivo |
1 (1) |
|
Negativo |
85 (99) |
|
Historial de recaída, n (%) |
|
|
Pacientes en 1° CR |
61 (71) |
|
Pacientes en 2° CR |
25 (29) |
|
Nivel de EMR al inicio del estudio*, n (%) |
|
|
≥ 10% |
7 (8) |
|
≥ 1% y< 10% |
34 (40) |
|
≥ 0.1% y < 1% |
45 (52) |
* Evaluado de manera centralizada usando un ensayo con sensibilidad mínima del 0.01%
La eficacia se basó en el logro de una EMR indetectable dentro de un ciclo de tratamiento con BLINCYTO® y supervivencia libre de recaída hematológica (RFS). El ensayo utilizado para evaluar la respuesta de EMR tuvo una sensibilidad de 0.01 para 6 pacientes y < 0.005% para 80 pacientes. En general, 70 pacientes lograron una EMR indetectable (81.4%: IC 95%: 71.6%, 89.0%). La mediana de RFS hematológico fue de 22.3 meses. La Tabla 12 muestra la respuesta de EMR y RFS hematológica por número de remisión.
Tabla 12. Resultados de eficacia en pacientes ≥ 18 años de edad con LLA de precursores de células B EMR positiva estudio BLAST
|
Pacientes en CR1 (n = 61) |
Pacientes en CR2 (n = 25) |
|
|---|---|---|
|
Respuesta completa de EMR1, n (%), [95% IC] |
52 (85.2) 73.8, 93.0 |
18 (72.0) [50.6, 87.9] |
|
Mediana de supervivencia libre de recaída hematológica2 en meses (rango) |
35.2 (0.4, 53.5) |
12.3 (0.7, 42.3) |
1. La respuesta completa de EMR se definió como la ausencia de EMR detectable confirmada en un ensayo con sensibilidad mínima de 0.01%.
2. La recaída se definió como recaída hematológica o extramedular, leucemia secundaria o muerte por cualquier causa; incluye tiempo después del trasplante; estimación de Kaplan-Meier
La EMR indetectable se logró en 65 de 80 pacientes (81.3%: IC 95%:71.0%, 89.1%) con una sensibilidad de ensayo de al menos 0.005%. La mediana estimada de RFS hematológica entre los 80 pacientes que utilizaron el ensayo de sensibilidad más alta fue de 24.2 meses (IC 95% :17.9, NE).
CONTRAINDICACIONES:
Hipersensibilidad: BLINCYTO® está contraindicado en pacientes con hipersensibilidad conocida al blinatumomab u otro componente de la formulación del producto.
Embarazo: Verificar el estado de embarazo de las hembras en edad reproductiva antes de iniciar el tratamiento con BLINCYTO®.
Lactancia: Recomiende a las mujeres que no deben amamantar durante el tratamiento con BLINCYTO® y durante un periodo de 48 horas después de la última dosis [ver Uso en poblaciones específicas).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
Resumen de riesgo: Con base en su mecanismo de acción, BLINCYTO® puede causar daño fetal, cuando se administra a mujeres embarazadas. No existen datos disponibles sobre el uso de BLINCYTO® en mujeres embarazadas para evaluar el riesgo asociado con el medicamento. En estudios de reproducción animal, una molécula murina equivalente administrada a ratonas preñadas cruzó la barrera placentaria (ver Datos).
Blinatumomab causa la activación de las células T y la liberación de citocinas; la activación de la respuesta inmunitaria puede poner en riesgo el embarazo. Asimismo, con base en la expresión de CD19 en las células B y el hallazgo de la reducción de células B en animales no preñadas, blinatumomab puede causar linfocitopenia de células B en lactantes expuestos a blinatumomab en el útero. Aconsejar a mujeres embarazadas del riesgo potencial para el feto.
Consideraciones clínicas:
Reacciones adversas fetales/neonatos: Los linfocitos B deben ser monitorizados en lactantes antes del inicio de la vacunación con virus vivos debido al potencial de reducción de linfocitos B después de la exposición a BLINCYTO® en el útero (ver Precauciones generales).
Datos:
Datos en animales: No se han conducido estudios de reproducción en animales con blinatumomab. En estudios de toxicidad de desarrollo embrio-fetal, se administró intravenosamente una molécula murina equivalente a ratonas preñadas durante el periodo de organogénesis. La molécula equivalente cruzó la barrera placentaria y no causó teratogenicidad o toxicidad embrio-fetal. Se observaron las disminuciones esperadas de células B y células T en las ratonas preñadas, pero los efectos hematológicos no fueron evaluados en los fetos.
Lactancia:
Resumen de riesgo: No se cuenta con información relacionada con la presencia de blinatumomab en la leche materna, los efectos en el lactante, o efectos en la producción de leche. Dado que muchos fármacos son excretados en leche humana y debido al potencial de reacciones adversas serias de BLINCYTO® en lactantes, incluyendo linfocitopenia de células B, aconsejar a los pacientes sobre no amamantar durante el tratamiento con BLINCYTO® y por 48 horas después de la última dosis.
Mujeres y varones con potencial reproductivo: BLINCYTO® puede causar daño fetal cuando se administra a una mujer embarazada (ver Uso en poblaciones específicas).
Prueba de embarazo: Antes de iniciar el tratamiento con BLINCYTO®, verificar el estado de embarazo en mujeres con potencial reproductivo.
Anticoncepción:
Mujeres: Aconsejar a las mujeres con potencial reproductivo del uso de anticonceptivos efectivos durante el tratamiento BLINCYTO® y 48 horas después de la última dosis.
REACCIONES SECUNDARIAS Y ADVERSAS:
Las siguientes reacciones adversas clínicamente significativas se describen en la sección de Precauciones generales con la etiqueta:
• Síndrome de liberación de citocinas.
• Toxicidades neurológicas, incluido el síndrome de neurotoxicidad asociada a células inmunoefectoras.
• Infecciones.
• Síndrome de lisis tumoral.
• Neutropenia y neutropenia febril.
• Efectos sobre la capacidad para conducir y operar máquinas.
• Elevación de las enzimas hepáticas.
• Pancreatitis.
• Leucoencefalopatía.
Experiencia en estudios clínicos: Debido a que los estudios clínicos se llevan a cabo bajo condiciones que varían ampliamente, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los estudios clínicos de otro fármaco, y pueden no reflejar las tasas observadas en la práctica.
Se evaluó la seguridad de BLINCYTO® en pacientes con LLA de precursores de células B con EMR positiva (n = 137)y LLA de precursores de células B con cromosoma Filadelfia negativo en recaída o refractaria (n = 267) en tres estudios clínicos. Las reacciones adversas más frecuentes (≥ 20%) en esta población combinada fueron pirexia, reacciones relacionadas con la infusión, infecciones (sin especificación de germen patógeno), cefalea, infección, dolor musculoesquelético, neutropenia, náusea, anemia, trombocitopenia y diarrea.
LLA de precursores de células B, EMR-positivo: La seguridad de BLINCYTO® en pacientes con LLA de precursores de células B con EMR-positiva se evaluó en dos estudios clínicos de un solo brazo en los que 137 pacientes fueron tratados con BLINCYTO®. La mediana de edad de la población de estudio fue de 45 años (rango: 18 a 77 años).
Las reacciones adversas más comunes (≥ 20%) fueron pirexia, reacciones relacionadas con la infusión, dolor de cabeza, infecciones (patógenos no especificados), temblor y escalofríos. Se informaron reacciones adversas graves en el 61% de los pacientes. Las reacciones adversas graves más comunes (≥ 2%) incluyeron pirexia, temblor, encefalopatía, afasia, linfopenia, neutropenia, sobredosis, infección relacionada con el dispositivo, convulsiones e infección por estafilococos. Reacciones adversas Grado 3 o superiores se reportaron en 64% de los pacientes. La descontinuación de la terapia debido a reacciones adversas ocurrió en el 17% de los pacientes; los eventos neurológicos fueron las razones reportadas con mayor frecuencia para la interrupción. Hubo 2 reacciones adversas fatales que ocurrieron dentro de los 30 días posteriores al final del tratamiento con BLINCYTO® (neumonía atípica y hemorragia subdural).
La Tabla 13 resume las reacciones adversas que ocurren con una incidencia ≥ 10% para cualquier grado o ≥ 5% de incidencia para el Grado 3 o superior.
Tabla 13. Reacciones adversas que ocurren con una incidencia ≥ 10% para cualquier grado o ≥ 5% de incidencia para el Grado 3 o superior en pacientes tratados con BLINCYTO® con LLA de precursores de células B, EMR-positiva
|
Reacción adversa |
BLINCYTO® (n = 137) |
|
|---|---|---|
|
Cualquier grado* n (%) |
Grado ≥ 3* n (%) |
|
|
Trastornos de la sangre y del sistema linfático |
||
|
Neutropenia1 |
21 (15) |
21 (15) |
|
Leucopenia2 |
19 (14) |
13 (9) |
|
Trombocitopenia3 |
14 (10) |
8 (6) |
|
Trastornos cardiacos |
||
|
Arritmia4 |
17 (12) |
3 (2) |
|
Trastornos generales y condiciones del sitio de administración |
||
|
Pirexia5 |
125 (91) |
9 (7) |
|
Escalofrío |
39 (28) |
0 (0) |
|
Infecciones e infestaciones |
||
|
Infecciones-patógeno no especificado |
53 (39) |
11 (8) |
|
Lesión, envenenamiento y complicaciones del procedimiento |
||
|
Reacción relacionada con la infusión6 |
105 (77) |
7 (5) |
|
Investigaciones |
||
|
Disminución de inmunoglobulinas7 |
25 (18) |
7 (5) |
|
Peso aumentado |
14 (10) |
1 (< 1) |
|
Hipertransaminasemia8 |
13 (9) |
9 (7) |
|
Trastornos musculoesqueléticos y del tejido conectivo |
||
|
Dolor de espalda |
16 (12) |
1 (< 1) |
|
Trastornos del sistema nervioso |
||
|
Dolor de cabeza9 |
54 (39) |
5 (4) |
|
Temblor10 |
43 (31) |
6 (4) |
|
Afasia9 |
16 (12) |
1 (< 1) |
|
Mareo9 |
14 (10) |
1 (< 1) |
|
Encefalopatía9, 11 |
14 (10) |
6 (4) |
|
Trastornos psiquiátricos |
||
|
Insomnio9, 12 |
24 (18) |
1 (< 1) |
|
Trastornos respiratorios, torácicos y mediastínicos |
||
|
Tos |
18 (13) |
0 (0) |
|
Trastornos de la piel y tejido subcutáneo |
||
|
Erupción13 |
22 (16) |
1 (< 1) |
|
Trastornos vasculares |
||
|
Hipotensión |
19 (14) |
1 (< 1) |
* Calificación basada en los criterios de la terminología común del NCI para eventos adversos (CTCAE) versión 4.0.
1 La neutropenia incluye neutropenia febril, neutropenia y recuento de neutrófilos disminuido.
2 La leucopenia incluye leucopenia y disminución del conteo de glóbulos blancos.
3 La trombocitopenia incluye disminución del recuento de plaquetas y trombocitopenia.
4 La arritmia incluye bradicardia, arritmia sinusal, bradicardia sinusal, taquicardia sinusal, taquicardia y extrasístoles ventriculares.
5 La pirexia incluye aumento de la temperatura corporal y pirexia.
6 La reacción relacionada con la infusión es un término compuesto que incluye el término reacción relacionada con la infusión y los siguientes eventos que ocurren en las primeras 48 horas de infusión y el evento duró ≤ 2 días: síndrome de liberación de citocinas, edema ocular, hipertensión, hipotensión, mialgia, edema periorbitario, prurito generalizado, pirexia y erupción.
7 Disminución de inmunoglobulinas, incluye disminución de inmunoglobulina A sanguínea, disminución de inmunoglobulina G sanguínea, disminución de inmunoglobulina M sanguínea, hipogammaglobulinemia, hipoglobulinemia e inmunoglobulinas disminuidas.
8 La hipertransaminasemia incluye aumento de alanina aminotransferasa, aumento de aspartato aminotransferasa aumento de enzima hepática.
9 Puede representar un ICANS.
10 El temblor incluye temblor esencial, temblor intencional y temblor.
11 La encefalopatía incluye trastorno cognitivo, nivel de conciencia deprimido, alteración de la atención, encefalopatía, letargia, leucoencefalopatía, trastorno de la memoria, somnolencia y encefalopatía tóxica.
12 El insomnio incluye insomnio inicial, insomnio e insomnio terminal.
13 Erupción incluye dermatitis por contacto, eccema, eritema, erupción y erupción maculopapular.
Las reacciones adversas adicionales en pacientes con LLA con EMR-positiva que no cumplieron los criterios de umbral para la inclusión en la Tabla 14 fueron:
Trastornos de la sangre y del sistema linfático: Anemia.
Trastornos generales y condiciones del sitio de administración: Edema periférico, dolor y dolor en el pecho (incluye dolor en el pecho y dolor en el pecho musculoesquelético).
Trastornos hepatobiliares: Aumento de la bilirrubina en la sangre.
Trastornos del sistema inmunitario: Hipersensibilidad y síndrome de liberación de citocinas.
Infecciones e infestaciones: Trastornos infecciosos virales, trastornos infecciosos bacterianos y trastornos de infecciones fúngicas.
Lesión, envenenamiento y complicaciones del procedimiento: Error de medicación y sobredosis (incluye sobredosis y sobredosis accidental).
Investigaciones: Aumento de la fosfatasa alcalina en la sangre.
Trastornos musculoesqueléticos y del tejido conectivo: Dolor en las extremidades y dolor óseo.
Trastornos del sistema nervioso: Convulsiones (incluye convulsiones y crisis tónico-clónicas generalizadas), trastornos del habla e hipoestesia.
Trastornos psiquiátricos: Estado confusional, desorientación y depresión.
Trastornos respiratorios, torácicos y mediastínicos: Disnea y tos productiva.
Trastornos vasculares: Hipertensión (incluye aumento de la presión arterial e hipertensión), rubor (incluye rubor y sofocos) y síndrome de fuga capilar.
LLA de precursores de células B en recaída o refractaria: La seguridad de BLINCYTO® se evaluó en un estudio clínico aleatorizado, abierto, controlado con activo (estudio TOWER) en el que 376 pacientes con LLA de precursores de células B en recaída o refractaria con cromosoma Filadelfia negativo fueron tratados con BLINCYTO® (n = 267) o quimioterapia estándar (SOC) (n = 109). La mediana de edad de los pacientes tratados con BLINCYTO® fue de 37 años (rango: 18 a 80 años), 60% hombres, 84% blancos, 7% asiáticos, 2% negros o afroamericanos, 2% indios americanos o nativos de Alaska, y 5% múltiples/otros.
Las reacciones adversas más comunes (≥ 20%) en el grupo de BLINCYTO® fueron infecciones (bacterianas y patógenas no especificadas), pirexia, dolor de cabeza, reacciones relacionadas con la infusión, anemia, neutropenia febril, trombocitopenia y neutropenia. Se informaron reacciones adversas graves en el 62% de los pacientes. Las reacciones adversas graves más comunes (≥ 2%) incluyeron neutropenia febril, pirexia, sepsis, neumonía, sobredosis, shock séptico, CRS, sepsis bacteriana, infección relacionada con el dispositivo y bacteriemia. Las reacciones adversas de grado 3 o superiores se reportaron en el 87% de los pacientes. La descontinuación del tratamiento debido a reacciones adversas ocurrió en el 12% de los pacientes tratados con BLINCYTO®; los eventos neurológicos y las infecciones fueron las razones informadas con mayor frecuencia para la interrupción del tratamiento debido a una reacción adversa. Los eventos adversos fatales ocurrieron en el 16% de los pacientes. La mayoría de los eventos fatales fueron infecciones.
Las reacciones adversas que ocurren con una incidencia ≥ 10% para cualquier grado o ≥ 5% de incidencia para el grado 3 o superior en los pacientes tratados con BLINCYTO® en el primer ciclo de terapia se resumen en la Tabla 14.
Tabla 14. Reacciones adversas que ocurren con una incidencia ≥ 10% para cualquier grado o ≥ 5% de incidencia para el Grado 3 o superior en pacientes adultos con LLA precursora de células B en recaída o resistente al tratamiento (estudio TOWER) tratados Con BLINCYTO® en el primer ciclo de terapia
|
Reacción adversa |
BLINCYTO® (n = 267) |
Quimioterapia estándar (SOC) (n = 109) |
||
|---|---|---|---|---|
|
Cualquier grado* n (%) |
Grado ≥ 3* n (%) |
Cualquier grado* n (%) |
Grado ≥ 3* n (%) |
|
|
Trastornos de la sangre y sistema linfático |
||||
|
Neutropenia1 |
84 (31) |
76 (28) |
67 (61) |
61 (56) |
|
Anemia2 |
68 (25) |
52 (19) |
45 (41) |
37 (34) |
|
Trombocitopenia3 |
57 (21) |
47 (18) |
42 (39) |
40 (37) |
|
Leucopenia4 |
21 (8) |
18 (7) |
9 (8) |
9 (8) |
|
Trastornos cardiacos |
||||
|
Arritmia5 |
37 (14) |
5 (2) |
18 (17) |
0 (0) |
|
Trastornos generales y condiciones del sitio de administración |
||||
|
Pirexia |
147 (55) |
15 (6) |
43 (39) |
4 (4) |
|
Edema6 |
48 (18) |
3 (1) |
20 (18) |
1 (1) |
|
Trastornos del sistema inmune |
||||
|
Síndrome de liberación de citocina7 |
37 (14) |
8 (3) |
0 (0) |
0 (0) |
|
Infecciones e infestaciones |
||||
|
Infecciones-patógeno no especificado |
74 (28) |
40 (15) |
50 (46) |
35 (32) |
|
Trastornos infecciosos bacterianos |
38 (14) |
19 (7) |
35 (32) |
21 (19) |
|
Trastornos infecciosos virales |
30 (11) |
4 (1) |
14 (13) |
0 (0) |
|
Trastornos infecciosos fúngicos |
27 (10) |
13 (5) |
15 (14) |
9 (8) |
|
Lesiones, envenenamiento y complicaciones de procedimiento |
||||
|
Reacción relacionada con la infusión8 |
79 (30) |
9 (3) |
9 (8) |
1 (1) |
|
Investigaciones |
||||
|
Hipertransaminasemia9 |
40 (15) |
22 (8) |
13 (12) |
7 (6) |
|
Trastorno del sistema nervioso |
||||
|
Dolor de cabeza10 |
61 (23) |
1 (< 1) |
30 (28) |
3 (3) |
|
Trastornos de la piel y del tejido subcutáneo |
||||
|
Erupción11 |
31 (12) |
2 (1) |
21 (19) |
0 (0) |
* Calificación basada en la terminología común del NCI para eventos adversos (CTCAE) versión 4.0.
1 La neutropenia incluye agranulocitosis, neutropenia febril, neutropenia y recuento de neutrófilos.
2 La anemia incluye anemia y disminución de la hemoglobina.
3 La trombocitopenia incluye disminución del recuento de plaquetas y trombocitopenia.
4 La leucopenia incluye leucopenia y disminución del conteo de glóbulos blancos.
5 La arritmia incluye arritmia, fibrilación auricular, aleteo auricular, bradicardia, bradicardia sinusal, taquicardia sinusal, taquicardia supraventricular y taquicardia.
6 El edema incluye edema facial, retención de líquidos, edema, edema periférico, inflamación periférica e hinchazón de la cara.
7 El síndrome de liberación de citocinas incluye el síndrome de liberación de citocinas y la tormenta de citocinas.
8 La reacción relacionada con la infusión es un término compuesto que incluye el término reacción relacionada con la infusión y los siguientes eventos que ocurren con las primeras 48 horas de infusión y el evento duró ≤ 2 días: pirexia, síndrome de liberación de citoquina, hipotensión, mialgia, lesión renal aguda, hipertensión y erupción eritematosa.
9 La hipertransaminasemia incluye aumento de alanina aminotransferasa, aumento de aspartato aminotransferasa, aumento de enzima hepática y aumento de transaminasas.
10 Puede representar un ICANS
11 Erupción incluye eritema, erupción cutánea, erupción eritematosa, erupción generalizada, erupción macular, erupción maculo papular, erupción cutánea pruriginosa, exfoliación de la piel y erupción cutánea tóxica.
Las anomalías de laboratorio seleccionadas que empeoraron desde la basal grado 0-2 hasta el Grado 3 a 4 máximo relacionado con el tratamiento en el primer ciclo de terapia se muestran en la Tabla 15.
Tabla 15. Empeoramiento de anomalías de laboratorio seleccionadas a partir del grado 0 a 2 en la línea basal hasta el grado 3 a 4* máximo relacionado con el tratamiento en el primer ciclo de terapia para pacientes adultos con LLA precursora de células B en recaída o resistente al tratamiento estudio TOWER
|
BLINCYTO® Grado 3 o 4 (%) |
Quimioterapia estándar SOC Grado 3 o 4 (%) |
|
|---|---|---|
|
Hematología |
||
|
Disminución del recuento de linfocitos |
80 |
83 |
|
Disminución del recuento de glóbulos blancos |
53 |
97 |
|
Disminución de hemoglobina |
29 |
43 |
|
Disminución del recuento de neutrófilos |
57 |
68 |
|
Disminución del recuento de plaquetas |
47 |
85 |
|
Química |
||
|
Incremento de ALT |
11 |
11 |
|
Incremento de bilirrubina |
5 |
4 |
|
Incremento de AST |
8 |
4 |
* Incluye sólo pacientes que tuvieron una medición de laboratorio basal y al menos una medición de laboratorio disponible durante el primer ciclo de terapia.
Otras reacciones adversas importantes de los estudios de LLA de precursor de células B en recaída o refractaria agrupadas fueron:
Trastornos de la sangre y del sistema linfático: Linfadenopatía, histiocitosis hematofágica y leucocitosis (incluye leucocitosis y recuento de glóbulos blancos aumentado).
Trastornos generales y condiciones del sitio de administración: Escalofríos, dolor de pecho (incluye molestias en el pecho, dolor en el pecho, dolor de pecho musculoesquelético y dolor de pecho no cardiaco), dolor, aumento de la temperatura corporal, hipertermia y síndrome de respuesta inflamatoria sistémica.
Trastornos hepatobiliares: Hiperbilirrubinemia (incluye aumento de la bilirrubina en sangre e hiperbilirrubinemia).
Trastornos del sistema inmune: Hipersensibilidad (incluye hipersensibilidad, reacción anafiláctica, angioedema, dermatitis alérgica, erupción medicamentosa, hipersensibilidad a medicamentos, eritema multiforme y urticaria).
Lesiones, envenenamiento y complicaciones de procedimiento: Error de medicación y sobredosis (incluye sobredosis, error de medicación y sobredosis accidental).
Investigaciones: Aumento de peso, disminución de inmunoglobulinas (incluye disminución de inmunoglobulinas, reducción de inmunoglobulina A en sangre, disminución de inmunoglobulina G en sangre, disminución de inmunoglobulina M en sangre e hipogammaglobulinemia), aumento de fosfatasa alcalina en sangre e hipertransaminasemia.
Trastornos del metabolismo y la nutrición: Síndrome de lisis tumoral.
Trastornos musculoesqueléticos y del tejido conectivo: Dolor de espalda, dolor de huesos y dolor en las extremidades.
Trastornos del sistema nervioso: Temblor (temblor de reposo, temblor intencional, temblor esencial y temblor), estado de conciencia alterado (incluye estado de conciencia alterado, nivel de conciencia disminuido, alteración de la atención, letargia, cambios en el estado mental, estupor y somnolencia), mareo, deterioro de la memoria, convulsión (incluye convulsión y crisis atónicas), afasia, trastorno cognitivo, trastorno del habla, hipostesia, encefalopatía, parestesia y trastornos de los pares craneales (neuralgia del trigémino, trastorno del nervio trigémino, parálisis del sexto par, trastorno del par craneal, trastorno del nervio facial y paresis facial).
Trastornos psiquiátricos: Insomnio, desorientación, estado de confusión y depresión (incluye estado de ánimo deprimido, depresión, ideación suicida y suicidio consumado).
Trastornos respiratorios, torácicos y mediastínicos: Disnea (incluye insuficiencia respiratoria aguda, disnea, disnea de esfuerzo, insuficiencia respiratoria, dificultad respiratoria, broncospasmo, hiperreactividad bronquial, taquipnea y sibilancias), tos y tos productiva.
Trastornos vasculares: Hipotensión (incluye presión arterial disminuida, hipotensión, shock hipovolémico y colapso circulatorio), hipertensión (incluye aumento de la presión arterial, hipertensión y crisis hipertensiva), rubor (incluye rubor y sofocos) y síndrome de fuga capilar.
LLA precursora de células B en fase de consolidación: Estudio E1910: En un ensayo aleatorizado en pacientes adultos con LLA precursora de células B con cromosoma Filadelfia negativo recién diagnosticado (estudio E1910) [NCT02003222) que incluyó a 111 pacientes tratados en el grupo BLINCYTO® y 112 pacientes tratados en el grupo de quimioterapia sola. En el grupo de BLINCYTO®, la mediana (rango) de ciclos fue de 8 (1-8) (4 ciclos de BLINCYTO® y 4 ciclos de quimioterapia).
En el grupo de quimioterapia sola, la mediana (intervalo) de ciclos fue de 4 (1-4).
Las reacciones adversas mortales ocurrieron en 2 pacientes (2%) durante los ciclos de BLINCYTO® y se debieron a infección (n = 1) y coagulopatía (n = 1). La interrupción permanente de BLINCYTO® debido a una reacción adversa se produjo en el 2% de los pacientes. Las interrupciones de la dosis de BLINCYTO® debido a una reacción adversa ocurrieron en el 5% de los pacientes. Las reducciones de la dosis de BLINCYTO® debidas a una reacción adversa ocurrieron en el 28% de los pacientes.
Las reacciones adversas más comunes (≥ 20%) durante los ciclos de consolidación en el grupo de BLINCYTO® fueron neutropenia, trombocitopenia, anemia, leucopenia, cefalea, infección, náuseas, linfopenia, diarrea, dolor musculoesquelético y temblor. En la Tabla 16 se resumen las reacciones adversas que se producen con una incidencia de ≥ 10% para todos los grados o de ≥ 5% para los grados 3 o superiores.
Tabla 16: Reacciones adversas con una diferencia entre los grupos de ≥ 10% para cualquier grado o ≥ 5% para el Grado 3 o 4 durante la consolidación (Estudio E1910)
|
Reacción adversa |
Consolidación consistente en |
|||
|---|---|---|---|---|
|
BLINCYTO® ciclos + ciclos de quimioterapia (n = 111) |
Ciclos de quimioterapia solo (n = 112) |
|||
|
Todos los grados (%)7 |
Grado 3 o 4 (%) |
Todos los grados (%) |
Grado 3 o 4 (%) |
|
|
Trastornos de la sangre y del sistema linfático |
||||
|
Neutropenia1 |
82 |
77 |
89 |
89 |
|
Trombocitopenia1 |
75 |
57 |
75 |
71 |
|
Anemia |
59 |
29 |
50 |
38 |
|
Leucopenia1 |
43 |
41 |
57 |
56 |
|
Linfopenia1 |
32 |
30 |
25 |
23 |
|
Neutropenia febril |
19 |
19 |
25 |
25 |
|
Trastornos gastrointestinales |
||||
|
Náuseas2 |
32 |
5 |
22 |
4 |
|
Diarrea1 |
29 |
3 |
15 |
3 |
|
Trastornos del sistema inmunitario |
||||
|
Liberación de citocinas síndrome3 |
16 |
4 |
0 |
0 |
|
Infecciones e infestaciones |
||||
|
Infección-patógeno no especificado |
35 |
31 |
22 |
21 |
|
Trastornos musculoesqueléticos y del tejido conectivo |
||||
|
Dolor musculoesquelético4 |
23 |
5 |
5 |
4 |
|
Trastornos del sistema nervioso |
||||
|
Dolor de cabeza6 |
41 |
5 |
30 |
5 |
|
Temblor6 |
23 |
3 |
3 |
0 |
|
Afasia5,6 |
10 |
8 |
0 |
0 |
|
Trastornos vasculares |
||||
|
Hipertensión |
12 |
10 |
5 |
3 |
1 Otras reacciones adversas relacionadas incluyeron:
2 Náuseas, vómito.
3 Síndrome de liberación de citocinas, síndrome de fuga capilar.
4 Dolor musculoesquelético, dolor en las extremidades, dolor de espalda, artralgia, malgia, dolor de cuello, dolor de costado, dolor óseo, dolor torácico no cardiaco.
5 Afasia, disartria.
6 Puede representar a ICANS.
7 Incluye las siguientes reacciones adversas mortales: infección (n = 1)
Estudio 20120215: La inocuidad de BLINCYTO® como tercer ciclo de la fase de consolidación se evaluó en un estudio aleatorizado abierto (estudio 20120215) después de la inducción y dos ciclos de quimioterapia de consolidación en pacientes pediátricos y adultos jóvenes con LLA de alto riesgo con primera recaída.
El estudio incluyó a 54 pacientes tratados con un ciclo de BLINCYTO® y 52 pacientes tratados con un ciclo de quimioterapia.
Se produjeron reacciones adversas graves en el 28% de los pacientes que recibieron BLINCYTO®. La interrupción permanente de BLINCYTO® debido a una reacción adversa se produjo en el 4% de los pacientes. Las reacciones adversas que condujeron a la interrupción incluyeron trastorno del sistema nervioso y convulsiones. Las interrupciones de la dosis de BLINCYTO® debidas a una reacción adversa ocurrieron en el 11% de los pacientes. Las reacciones adversas que requirieron la interrupción de la dosis en > 2% de los pacientes incluyeron trastornos del sistema nervioso.
Las reacciones adversas más comunes (≥ 20%) en el grupo de BLINCYTO® fueron pirexia, náuseas, cefalea, erupción cutánea, hipogammaglobulinemia y anemia. En la Tabla 17 se resumen las reacciones adversas que ocurren con una incidencia de ≥ 10% para cualquier grado o con una incidencia de ≥ 5% para el grado 3 o 4 entre el grupo de BLINCYTO® y al grupo y el grupo de quimioterapia.
Tabla 17. Reacciones adversas con una diferencia entre grupos de ≥ 10% para cualquier grado o ≥ 5% para el Grado 3 o 4 durante el ciclo de consolidación 3 (estudio 20120215)
|
Reacción adversa |
BLINCYTO® (n = 54) |
Quimioterapia (n = 52) |
||
|---|---|---|---|---|
|
Todos los grados (%) |
Grado 3 o 4 (%) |
Todos los grados (%) |
Grado 3 o 4 (%) |
|
|
Trastornos de la sangre y del sistema linfático |
||||
|
Anemia1 |
24 |
15 |
46 |
42 |
|
Neutropenia1 |
19 |
17 |
35 |
31 |
|
Trombocitopenia1 |
15 |
15 |
39 |
35 |
|
Neutropenia febril |
2 |
2 |
25 |
25 |
|
Trastornos gastrointestinales |
||||
|
Náuseas2 |
43 |
2 |
31 |
2 |
|
Dolor abdominal1 |
13 |
0 |
23 |
2 |
|
Estomatitis3 |
11 |
4 |
60 |
29 |
|
Trastornos generales y condiciones del lugar de administración |
||||
|
Pirexia |
76 |
6 |
19 |
0 |
|
Trastornos hepatobiliares |
||||
|
Prueba de función hepática anormal4 |
9 |
6 |
27 |
17 |
|
Trastornos del sistema inmunitario |
||||
|
Hipogammaglobulinemia1 |
24 |
2 |
12 |
2 |
|
Infecciones e infestaciones |
||||
|
Infección: patógeno no especificado |
13 |
6 |
29 |
10 |
|
Trastornos musculoesqueléticos y del tejido conectivo |
||||
|
Dolor musculoesquelético5 |
9 |
0 |
29 |
2 |
|
Trastornos del sistema nervioso |
||||
|
Dolor de cabeza7 |
37 |
0 |
15 |
0 |
|
Trastornos cutáneos y subcutáneos |
||||
|
Erupción cutánea1 |
22 |
2 |
12 |
0 |
|
Trastornos vasculares |
||||
|
Hemorragía6 |
11 |
2 |
23 |
6 |
1 Otras reacciones adversas relacionadas incluyeron:
2 Náuseas, vómito.
3 Estomatitis: ulceración de la boca, inflamación de la mucosa.
4 Prueba de función hepática anormal: aumento de la alanina aminotransferas, aumento de la aspartato aminotransferas, aumento de la gama-glutamiltransferasa hipertransaminasemia.
5 Dolor musculoesquelético: dolor de espalda, dolor en las extremidades, dolor óseo.
6 Hemorragia: epistaxis, petequias, hemartrosis, hematoma, hematuria.
7 Representación de ICANS.
Experiencia post-comercialización: Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de BLINCYTO®. Debido a que estas reacciones se reportan voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar confiablemente su frecuencia o establecer una relación causal con la exposición al fármaco.
• Pancreatitis fatal en pacientes tratados con BLINCYTO® en combinación con dexametasona.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogénesis, mutagénesis, daño en la fertilidad: No se han conducido estudios de carcinogenicidad o genotoxicidad con blinatumomab.
No se han conducido estudios para evaluar los efectos de blinatumomab sobre la fertilidad. No se presentaron efectos en los órganos reproductores de los ratones macho y hembra en 13 semanas de estudio de toxicidad de dosis repetida con la molécula de murino equivalente.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se han conducido estudios formales de interacción del fármaco con BLINCYTO®. El inicio del tratamiento con BLINCYTO® causa liberación transitoria de citocinas que puede suprimir enzimas CYP450. El riesgo más alto de interacción fármaco-fármaco es durante los primeros 9 días del primer ciclo y los primeros 2 días del segundo ciclo en pacientes que están recibiendo sustratos concomitantes de CYP450, particularmente aquellos con un índice terapéutico estrecho. En estos pacientes, monitorizar para toxicidad (por ejemplo, warfarina) o concentraciones de fármaco (por ejemplo, ciclosporina). Ajustar la dosis del fármaco concomitante según se requiera (ver Farmacocinética y farmacodinamia).
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Se ha observado neutropenia y neutropenia febril, incluidos casos mortales, en pacientes que reciben BLINCYTO®. Monitoree los parámetros de laboratorio (incluidos, entre otros, el recuento de glóbulos blancos y el recuento absoluto de neutrófilos) durante la infusión de BLINCYTO®. En caso de que ocurra neutropenia prolongada, interrumpir BLINCYTO®.
PRECAUCIONES GENERALES:
Síndrome de liberación de citocinas: El síndrome de liberación de citocinas (CRS, por sus siglas en inglés), que puede ser potencialmente mortal o fatal, ocurrió en pacientes que recibían BLINCYTO®. La mediana de tiempo hasta el inicio del CRS fue de 2 días después del inicio de la infusión y la mediana de tiempo hasta la resolución del CRS fue de 5 días entre los casos que se resolvieron. Las manifestaciones de CRS incluyen fiebre, cefalea, náusea, astenia, hipotensión, incremento de la alanina-aminotransferasa (ALT), incremento del aspartato-aminotransferasa (AST), incremento en la bilirrubina total y coagulación intravascular diseminada (CID). Las manifestaciones de CRS después del tratamiento con BLINCYTO® se traslapan con aquéllas de reacciones a la infusión, síndrome de fuga capilar (CLS) e histiocitosis hemofagocítica/síndrome de activación de macrófagos (MAS). Usando todos estos términos para definir el CRS en los ensayos clínicos de BLINCYTO®, se informó CRS en el 15% de los pacientes con LLA recurrente o refractaria y en el 16% de los pacientes que recibieron ciclos de BLINCYTO® en la fase de consolidación del tratamiento [ver Reacciones secundarias y adversas].
Monitorizar a los pacientes para detectar signos o síntomas de estos eventos. Aconsejar a los pacientes ambulatorios que reciben BLINCYTO® que contacten a su profesional de la salud por signos y síntomas asociados con CRS. Si se produce un CRS grave, interrumpa BLINCYTO® hasta que se resuelva el CRS. Suspenda BLINCYTO® permanentemente si ocurre un CRS potencialmente mortal. Administre corticosteroides para CRS graves o potencialmente mortales (ver Dosificación y vía de administración).
Toxicidades neurológicas, incluido el síndrome de neurotoxicidad asociada a células inmunoefectoras:
BLINCYTO® puede causar toxicidad neurológica grave o potencialmente mortal, incluido el ICANS [ver Reacciones adversas].
La incidencia de toxicidades neurológicas en ensayos clínicos fue de aproximadamente el 65% (ver Reacciones adversas). Entre los pacientes que experimentaron toxicidad neurológica, la mediana de tiempo hasta la aparición del primer evento estuvo dentro de las primeras 2 semanas del tratamiento con BLINCYTO®. Las manifestaciones de toxicidades neurológicas más comunes(≥ 10%) fueron cefalea y temblor; el perfil de toxicidad neurológica varió por grupo etario [ver Uso en Poblaciones específicas].
Las toxicidades neurológicas de Grado 3 o superior después del inicio de la administración de BLINCYTO® ocurrieron en aproximadamente el 13% de los pacientes e incluyeron encefalopatía, convulsiones, trastornos del habla, alteraciones de la conciencia, confusión y desorientación, y alteraciones de la coordinación y el equilibrio. Las manifestaciones de toxicidad neurológica incluyeron trastornos de los pares craneales. La mayoría de las toxicidades neurológicas se resolvieron después de la interrupción del tratamiento con BLINCYTO®, pero algunas llevaron a la discontinuación del tratamiento.
La incidencia de signos y síntomas indicativos de ICANS en los ensayos clínicos fue del 7.5%. La aparición de ICANS puede ser concurrente con el CRS, después de la resolución del CRS o en ausencia del CRS.
Existe experiencia limitada con BLINCYTO® en pacientes con LLA activa en el sistema nervioso central (CNS, por sus siglas en inglés) o con historia de eventos neurológicos. Los pacientes con una historia o presencia de patología clínicamente relevante en el CNS fueron excluidos de los estudios clínicos. Los pacientes con síndrome de Down mayores de 10 años pueden tener un mayor riesgo de convulsiones con la terapia BLINCYTO®.
Monitorizar a los pacientes que reciben BLINCYTO® para detectar signos y síntomas de toxicidades neurológicas, incluido el ICANS. Aconseje a los pacientes ambulatorios con BLINCYTO® que se pongan en contacto con su profesional de la salud si desarrollan signos y síntomas de toxicidad neurológica. Interrumpir temporal o definitivamente BLINCYTO® como se recomienda (ver Dosis y vía de administración).
Infecciones: Se observaron infecciones serias tales como sepsis, neumonía, bacteriemia, infecciones oportunistas e infecciones en el sitio del catéter, de las cuales algunas fueron potencialmente mortales o fatales, en aproximadamente el 25% de los pacientes con LLA que recibieron BLINCYTO® en estudios clínicos (ver Reacciones secundarias y adversas). Según sea apropiado, administrar antibióticos de forma profiláctica y emplear pruebas de vigilancia durante el tratamiento con BLINCYTO®. Monitorizar a los pacientes para signos y síntomas de infección y tratar apropiadamente.
Síndrome de lisis tumoral: El síndrome de lisis tumoral (SLT), que puede ser potencialmente mortal o fatal, se ha observado en pacientes que reciben BLINCYTO® (ver Reacciones secundarias y adversas). Las medidas profilácticas adecuadas que incluyen pretratamiento de citorreducción no tóxica y la hidratación durante el tratamiento, deben ser utilizados para la prevención del SLT durante el tratamiento con BLINCYTO®. Monitorizar a los pacientes por signos o síntomas del SLT. El manejo de estos eventos puede requerir la interrupción temporal o permanente de BLINCYTO® (ver Dosis y vía de administración).
Neutropenia y neutropenia febril: La neutropenia y la neutropenia febril, incluyendo casos potencialmente mortales, se han observado en pacientes que reciben BLINCYTO® (ver Reacciones secundarias y adversas). Monitorizar los parámetros de laboratorio (incluidos el recuento de leucocitos y el recuento absoluto de neutrófilos) durante la infusión con BLINCYTO®. En caso de que ocurra neutropenia prolongada, interrumpir BLINCYTO®.
Efectos sobre la capacidad para conducir y operar máquinas: Debido al potencial de eventos neurológicos, incluyendo convulsiones, los pacientes que reciben BLINCYTO® están en riesgo de perder la conciencia (ver Reacciones secundarias y adversas). Aconsejar a los pacientes sobre abstenerse de manejar o comprometerse en actividades peligrosas o acciones tales como operar maquinaria pesada o potencialmente peligrosa mientras se administra BLINCYTO®.
Elevación de las enzimas hepáticas: El tratamiento con BLINCYTO® estuvo asociado con elevaciones transitorias de las enzimas hepáticas (ver Reacciones secundarias y adversas). En pacientes con LLA que recibieron BLINCYTO® en estudios clínicos, la mediana del tiempo para el inicio de las enzimas hepáticas elevadas fue de 3 días.
La mayoría de estas elevaciones transitorias de las enzimas hepáticas se observaron en el escenario de CRS. Para los eventos que se observaron fuera del escenario de CRS, la mediana de tiempo para el inicio fue de 19 días. Las elevaciones de enzimas Grado 3 o más, ocurrieron en aproximadamente el 7% de los pacientes fuera del escenario con CRS y resultó en una descontinuación del tratamiento en menos del 1% de los pacientes.
Monitorizar la alanina-aminotransferasa (ALT), aspartato-aminotransferasa (AST), la gamma glutamil transferasa (GGT), y la bilirrubina total en sangre antes de iniciar y durante el tratamiento con BLINCYTO®. Interrumpir BLINCYTO® si las transaminasas se elevan a más de 5 veces el límite superior del normal o si la bilirrubina total se eleva a más de 3 veces el límite superior del normal.
Pancreatitis: Se ha reportado pancreatitis fatal, en pacientes que están recibiendo BLINCYTO® en combinación con dexametasona en estudios clínicos y en la etapa de post-comercialización (ver Reacciones secundarias y adversas).
Evaluar a los pacientes que desarrollen signos y síntomas de pancreatitis. El manejo de pancreatitis puede requerir ya sea interrupción temporal o descontinuación de BLINCYTO® y dexametasona (ver Dosis y vía de administración).
Leucoencefalopatía: Se han observado cambios en las imágenes de resonancia magnética (IRM) craneal que muestran leucoencefalopatía en pacientes recibiendo BLINCYTO®, especialmente en pacientes con tratamiento previo con irradiación craneal y quimioterapia antileucémica (incluyendo metotrexato sistémico a dosis altas o la citarabina intratecal). Se desconoce la importancia clínica de estos cambios en dichas imágenes.
Errores en la preparación y administración: Se han producido errores de preparación y administración con el tratamiento con BLINCYTO®. Siga las instrucciones de preparación (incluida la mezcla) y la administración estrictamente para minimizar los errores de medicación (incluyendo subdosis y sobredosis) (ver Dosis y vía de administración).
Inmunización: No se ha estudiado la seguridad de la inmunización con vacunas de virus vivos durante o después de la terapia con BLINCYTO®. No se recomienda la vacunación con vacunas de virus vivos por lo menos 2 semanas antes de iniciar el tratamiento con BLINCYTO®, durante el tratamiento, y hasta la recuperación inmunitaria después del último ciclo de BLINCYTO®.
Toxicidad por alcohol bencílico en neonatos: Se han informado reacciones adversas graves, incluidas reacciones fatales y el "síndrome de jadeo", en neonatos con un peso muy bajo al nacer (VLBW, por sus siglas en inglés) de menos de 1,500 g y neonatos prematuros nacidos antes de término (lactantes nacidos antes de la semana 34 de gestación) que recibieron medicamentos intravenosos que contenían alcohol bencílico como conservante. Los neonatos prematuros con un VLBW pueden ser más susceptibles a presentar estas reacciones, debido a que pueden tener más dificultad para metabolizar el alcohol bencílico [ver Uso en Poblaciones específicas].
Cuando sea posible, se deben utilizar las preparaciones de BLINCYTO® libres de conservantes en neonatos. Cuando prescriba BLINCYTO® (con conservantes) a pacientes neonatales, considere la carga metabólica diaria combinada de alcohol bencílico de todas las fuentes, incluido BLINCYTO® (con conservantes), otros productos que contienen alcohol bencílico u otros excipientes (por ejemplo, etanol, propilenglicol) que compiten con el alcohol bencílico por la misma vía metabólica.
Monitoree a los pacientes neonatales que reciban BLINCYTO® (con conservantes) para detectar la aparición o el empeoramiento de acidosis metabólica. Se desconoce la cantidad mínima de alcohol bencílico a la que pueden producirse reacciones adversas graves en neonatos. La bolsa de 7 días de BLINCYTO® (con conservantes) contiene 7.4 mg de alcohol bencílico por mL [ver Uso en poblaciones específicas].
Toxicidad embriofetal: Con base en su mecanismo de acción, BLINCYTO® puede causar daño fetal cuando se administra a mujeres embarazadas. Aconsejar a las mujeres embarazadas del posible riesgo para el feto. Aconsejar a las mujeres con potencial reproductivo del uso de anticonceptivos efectivos durante el tratamiento con BLINCYTO® y 48 horas después de la última dosis [ver Uso en poblaciones específicas].
DOSIS Y VÍA DE ADMINISTRACIÓN:
Tratamiento de LLA de precursor de células B, EMR-positiva.
• Un tratamiento en curso consiste en 1 ciclo de BLINCYTO® para inducción seguido de hasta 3 ciclos adicionales para consolidación.
• Un ciclo único de tratamiento con BLINCYTO® para inducción o consolidación consiste de 28 días de infusión intravenosa continua seguida por un intervalo de 14 días libres de tratamiento (42 días en total).
• Consulte la Tabla 18 para conocer la dosis recomendada según el peso y el programa del paciente. Los pacientes con un peso de 45 kg o más reciben una dosis fija. Para pacientes que pesan menos de 45 kg, la dosis se calcula utilizando el área de superficie corporal del paciente (BSA).
Tabla 18. Dosis recomendada de BLINCYTO® y cronograma para el tratamiento de la LLA de precursores de células B, EMR-positiva
|
Ciclo |
Paciente 45 kg o más (dosis fija) |
Pacientes que pesan menos de 45 kg (dosis basada en BSA) |
|---|---|---|
|
Ciclo 1 inducción |
||
|
Días 1 a 28 |
28 mcg/día |
15 mcg/m2/día (sin exceder 28 mcg/día) |
|
Días 29 a 42 |
14 días libres de tratamiento |
14 días libres de tratamiento |
|
Ciclos 2 a 4 consolidación |
||
|
Días 1 a 28 |
28 mcg/día |
15 mcg/m2/día (sin exceder 28 mcg/día) |
|
Días 29 a 42 |
14 días libres de tratamiento |
14 días libres de tratamiento |
• Se recomienda hospitalización durante los primeros 3 días del primer ciclo y los primeros 2 días del segundo ciclo. Para todos los inicios y reinicios de ciclos subsecuentes (por ejemplo, si el tratamiento es interrumpido durante 4 horas o más), se recomienda la supervisión de un profesional de la salud u hospitalización.
• Se recomienda profilaxis con quimioterapia intratecal antes del tratamiento con BLINCYTO® y durante éste para prevenir la recaída de LLA del sistema nervioso central.
• Premedicar con prednisona o equivalente para LLA de precursores de células B, EMR-positiva.
- Para pacientes adultos, premedicar con 100 mg de prednisona intravenosa o equivalente (p. ej., dexametasona 16 mg) 1 hora antes de la primera dosis de BLINCYTO® de cada ciclo.
- Para pacientes pediátricos, premedicar con 5 mg/m2 de dexametasona por vía intravenosa u oral, a una dosis máxima de 20 mg antes de la primera dosis de BLINCYTO® en el primer ciclo y cuando se reinicie una infusión después de una interrupción de 4 horas o más en el primer ciclo.
• Para administración de BLINCYTO®:
- Consulte la sección Infusión de 24 horas o 48 horas.
- Consulte la sección Infusión de 7 días utilizando cloruro de sodio bacteriostático inyectable al 0.9%, (que contiene 0.9% de alcohol bencílico).
Tratamiento de LLA de precursores de células B en recaída o refractaria:
• Un curso de tratamiento consiste en hasta 2 ciclos de BLINCYTO® para inducción seguido de 3 ciclos adicionales para consolidación y hasta 4 ciclos adicionales de terapia continua.
• Un ciclo único de tratamiento de inducción o consolidación con BLINCYTO® consiste en 28 días de infusión intravenosa continua seguida por un intervalo de 14 días libres de tratamiento (42 días en total).
• Un ciclo único de tratamiento de terapia continua con BLINCYTO® consiste en 28 días de infusión intravenosa continua seguida por un intervalo de 56 días libres de tratamiento (84 días en total).
• Consulte la Tabla 19 para conocer la dosis recomendada según el peso y el programa del paciente. Los pacientes con un peso de 45 kg o más reciben una dosis fija y, para los pacientes que pesan menos de 45 kg, la dosis se calcula utilizando el BSA del paciente.
Tabla 19. Dosis recomendada de BLINCYTO® y cronograma para el tratamiento de la LLA de precursores de células B, en recaída o refractaria
|
Ciclo |
Pacientes que pesan 45 kg o más (dosis fija) |
Paciente que pesan menos de 45 kg (dosis basada en BSA) |
|---|---|---|
|
Ciclo 1 inducción |
||
|
Días 1 a 7 |
9 mcg/día |
5 mcg/m2/día (sin exceder 9 mcg/día) |
|
Días 8 a 28 |
28 mcg/día |
15 mcg/m2/día (sin exceder 28 mcg/día) |
|
Días 29 a 42 |
Intervalo de 14 días libres de tratamiento |
Intervalo de 14 días libres de tratamiento |
|
Ciclo 2 inducción |
||
|
Días 1 a 28 |
28 mcg/día |
15 mcg/m2/día (sin exceder 28 mcg/día) |
|
Días 29 a 42 |
Intervalo de 14 días libres de tratamiento |
Intervalo de 14 días libres de tratamiento |
|
Ciclos 3 a 5 consolidación |
||
|
Días 1 a 28 |
28 mcg/día |
15 mcg/m2/día (sin exceder 28 mcg/día) |
|
Días 29 a 42 |
Intervalo de 14 días libres de tratamiento |
Intervalo de 14 días libres de tratamiento |
|
Ciclos 6 a 9 terapia continua |
||
|
Días 1 a 28 |
28 mcg/día |
15 mcg/m2/día (sin exceder 28 mcg/día) |
|
Días 29 a 84 |
Intervalo de 56 días libres de tratamiento |
Intervalo de 56 días libres de tratamiento |
Se recomienda hospitalización durante los primeros 9 días del primer ciclo y los primeros 2 días del segundo ciclo. En todos los inicios y reinicios de ciclos subsecuentes (por ejemplo, si el tratamiento se interrumpe durante 4 horas o más), se recomienda la supervisión de un profesional de la salud u hospitalización.
Se recomienda profilaxis con quimioterapia intratecal antes del tratamiento con BLINCYTO® y durante este para prevenir la recaída de LLA del sistema nervioso central.
• Premedicar con dexametasona.
- Para pacientes adultos, pre medicar con 20 mg de dexametasona por vía intravenosa u oral 1 hora antes de la primera dosis de BLINCYTO® de cada ciclo, antes de un incremento de dosis (tal como el día 8 del Ciclo 1), y cuando se reinicia una infusión después de una interrupción de 4 o más horas.
- Para pacientes pediátricos, pre medicar con 5 mg/m2 de dexametasona, a una dosis máxima de 20 mg antes de la primera dosis de BLINCYTO® en el primer ciclo, antes de una dosis escalonada (como el día 8 del Ciclo 1) y cuando se reinicie una infusión después de una interrupción de 4 horas o más en el primer ciclo.
• Para la administración de BLINCYTO®:
- Consultar la sección Infusión de 24 horas o 48 horas:
- Consultar la sección Infusión de 7 días utilizando cloruro de sodio bacteriostático inyectable al 0.9%, (que contiene 0.9% de alcohol bencílico).
Tratamiento de la LLA de precursores de células B en fase de consolidación:
• Un solo ciclo de tratamiento corresponde a 28 días (4 semanas) de infusión continua seguida por un intervalo libre de tratamiento de 14 días (2 semanas).
• Consulte la Tabla 20 para conocer la dosis diaria recomendada según el peso del paciente. Los pacientes que pesan 45 kg o más reciben una dosis fija y, en el caso de los pacientes que pesan menos de 45 kg, la dosis se calcula utilizando su área de superficie corporal (BSA).
Tabla 20. Dosis recomendada de BLINCYTO® y cronograma para el tratamiento de la LLA de precursores de células B, en fase de consolidación
|
Ciclo de consolidación de BLINCYTO® (ciclos 1-4) |
Pacientes que pesan 45 kg o más (dosis fija) |
Pacientes que pesan menos de 45 kg (dosis basada en BSA) |
|---|---|---|
|
Días 1 a 28 |
28 mcg/día |
15 mcg/m2/día (sin exceder 28 mcg/día) |
|
Días 29 a 42 |
Intervalo de 14 días libres de tratamiento |
Intervalo de 14 días libres de tratamiento |
• Se recomienda la hospitalización durante los primeros 3 días del primer ciclo y los primeros 2 días del segundo ciclo. En todos los inicios y reinicios de ciclos subsecuentes (por ejemplo, si el tratamiento se interrumpe durante 4 horas o más), se recomienda la supervisión de un profesional de la salud o la hospitalización.
• Se recomienda profilaxis con quimioterapia intratecal antes del tratamiento con BLINCYTO® y durante este para prevenir la recaída de LLA del sistema nervioso central.
• Premedicar con dexametasona:
- Para pacientes adultos, premedicar con 20 mg de prednisona intravenosa 1 hora antes de la primera dosis de BLINCYTO® de cada ciclo.
- Para pacientes pediátricos, premedicar con 5 mg/m2 de dexametasona, con una dosis máxima de 20 mg, antes de la primera dosis de BLINCYTO® en el primer ciclo y cuando se reinicie una infusión después de una interrupción de 4 horas o más en el primer ciclo.
• Para la administración de BLINCYTO®:
- Consultar la sección Infusión de 24 horas o 48 horas.
- Consulte la sección Infusión de 7 días utilizando cloruro de sodio bacteriostático inyectable al 0.9%, USP (que contiene 0.9% de alcohol bencílico).
Modificaciones de la dosis por reacciones adversas: Si la interrupción después de una reacción adversa no es mayor a 7 días, continuar el mismo ciclo para un total de 28 días de infusión inclusive de días antes y después de la interrupción de dicho ciclo. Si una interrupción debida a una reacción adversa es mayor a 7 días, iniciar un nuevo ciclo (Tabla 21).
Tabla 21. Modificación de dosis por reacciones adversas
|
Reacciones adversas |
Grado* |
Pacientes que pesan 45 kg o más |
Pacientes que pesan menos de 45 kg |
|---|---|---|---|
|
Síndrome de liberación de citocina (CRS) |
Grado 3 |
Interrumpir BLINCYTO® Administrar 8 mg de dexametasona cada 8 horas por vía intravenosa u oral por hasta 3 días, e ir disminuyendo la dosis durante 4 días Cuando el CRS se resuelva, reiniciar BLINCYTO® a dosis de 9 mcg/día y escalar a 28 mcg/día después de 7 días si la reacción adversa no reincide |
Interrumpir BLINCYTO® Administrar 5 mg/m2 de dexametasona (máximo 8 mg) cada 8 horas por vía intravenosa u oral por hasta 3 días, e ir disminuyendo la dosis durante 4 días Cuando el CRS se resuelva, reiniciar BLINCYTO® a dosis de 5 mcg/m2/día y escalar a 15 mcg/m2/día después de 7 días si la reacción adversa no reincide. |
|
Grado 4 |
Suspender BLINCYTO® permanentemente. Administrar dexametasona como se indicó para el CRS de grado 3. |
||
|
Toxicidad neurológica |
Convulsión |
Suspender BLINCYTO® permanentemente si ocurre más de una convulsión. |
|
|
Grado 3 |
Suspender BLINCYTO® hasta que no sea mayor a Grado 1 (leve) y durante al menos 3 días, después reiniciar BLINCYTO® en dosis de 9 mcg/día. Escalar a 28 mcg/día después de 7 días si la reacción adversa no reincide. Si ocurrió una reacción adversa con una dosis de 9 mcg/día, o si la reacción adversa toma más de 7 días para resolverse, descontinuar BLINCYTO® permanentemente. |
Suspender BLINCYTO® hasta que no sea mayor que Grado 1 (leve) y durante al menos 3 días, después reiniciar BLINCYTO® con una dosis de 5 mcg/m2/día. Escalar a 15 mcg/m2/día después de 7 días si la reacción adversa no reincide. Si ocurrió la reacción adversa a dosis de 5 mcg/m2/día o si la reacción adversa toma más de 7 días para resolverse, descontinuar BLINCYTO® permanentemente. |
|
|
Grado 4 |
Suspender BLINCYTO® permanentemente. |
||
|
Otras reacciones adversas clínicamente relevantes |
Grado 3 |
Suspender BLINCYTO® hasta que no sea mayor que Grado 1 (leve), después reiniciar BLINCYTO® con una dosis de 9 mcg/día. Escalar a 28 mcg/día después de 7 días si la reacción adversa no reincide. Si la reacción adversa toma más de 14 días para resolverse, descontinuar BLINCYTO® permanentemente. |
Suspender BLINCYTO® hasta que no sea mayor que Grado 1 (leve), después reiniciar BLINCYTO® con una dosis de 5 mcg/m2/día. Escalar a 15 mcg/m2/día después de 7 días si la reacción adversa no reincide. Si la reacción adversa toma más de 14 días para resolverse, descontinuar BLINCYTO® permanentemente. |
|
Grado 4 |
Considerar suspender BLINCYTO® permanentemente. |
||
* Basado en los criterios de terminología común para eventos adversos (CTCAE). Grado 3 es severo, y Grado 4 es potencialmente mortal.
Preparación: Es de gran importancia que las instrucciones para la preparación (incluida la mezcla) y la administración proporcionadas en esta sección, sean seguidas de manera estricta para minimizar errores de preparación (incluidas dosis menores o sobredosis) (ver Precauciones generales).
BLINCYTO® se puede infundir durante 24 horas (sin conservador) o 48 horas (sin conservador), o 7 días (con conservador). La elección entre estas opciones para la duración de la infusión debe hacerla el médico tratante teniendo en cuenta la frecuencia de los cambios en la bolsa de infusión y el peso del paciente.
Para la preparación, reconstitución, y administración de BLINCYTO®:
• Consulte la sección Infusión de 24 horas o 48 horas.
• Consulte la sección Infusión de 7 días utilizando cloruro de sodio bacteriostático inyectable al 0.9%, (que contiene 0.9% de alcohol bencílico).
Llame al 55 44-24-45-55 si tiene alguna pregunta acerca de la reconstitución y preparación de BLINCYTO®.
Preparación aséptica: Observe estrictamente la técnica aséptica al preparar la solución para infusión dado que los frascos ámpula de BLINCYTO® no contienen conservadores antimicrobianos. Para prevenir contaminación accidental, preparar BLINCYTO® acorde a los estándares asépticos, incluyendo pero no limitado a:
• Preparar BLINCYTO® en una campana de flujo laminar. o superior.
• Asegurar que el área de mezclado cumpla con las especificaciones ambientales apropiadas, confirmadas mediante una monitorización periódica.
• Asegurar que el personal esté capacitado de manera apropiada en manipulaciones asépticas y en el mezclado de fármacos oncológicos.
• Asegurar que el personal use la vestimenta y los guantes de protección apropiados.
• Asegurar que los guantes y las superficies estén desinfectados.
Contenido del empaque:
1 empaque de BLINCYTO® incluye 1 frasco ámpula de BLINCYTO® y 1 frasco ámpula de solución estabilizadora IV.
• No utilice la solución estabilizadora IV para reconstituir BLINCYTO®. La solución estabilizadora IV está incluida en el empaque de BLINCYTO® y se utiliza para recubrir la bolsa intravenosa antes de la adición de BLINCYTO® reconstituido para evitar la adhesión de BLINCYTO® a la bolsa intravenosa y a la línea intravenosa.
• Es posible que se pueda necesitar más de 1 empaque de BLINCYTO® para preparar la dosis recomendada.
Información de incompatibilidad: BLINCYTO® es incompatible con el di-etilhexilftalato (DEHP) debido a la posibilidad de formación de partículas, lo que lleva a una solución turbia.
• Use bolsas/cartuchos de bomba de infusión de poliolefina, PVC sin DEHP, o acetato de etil vinilo (EVA).
• Use juegos de líneas de infusión intravenosa de poliolefina, PVC sin DEHP o EVA.
Preparación y administración de BLINCYTO® como una infusión de 24 horas o 48 horas:
Reconstituya BLINCYTO® con agua estéril sin conservantes para inyección: No reconstituya los frascos ámpula de BLINCYTO® con la solución estabilizadora IV.
Para purgar la línea de infusión intravenosa, utilice sólo la solución de la bolsa que contiene la solución de BLINCYTO® FINAL preparada para infusión. No lo purgue con la solución de cloruro de sodio al 0.9%.
Reconstitución de BLINCYTO® para infusión de 24 horas o 48 horas:
1. Determine la cantidad de frascos ámpula de BLINCYTO® necesarios para una dosis y la duración de la infusión.
2. Reconstituya cada frasco ámpula de BLINCYTO® con 3 ml de agua estéril inyectable libre de conservantes, dirigiendo el agua a lo largo de las paredes del frasco ámpula de BLINCYTO® y no directamente sobre el polvo liofilizado. La concentración resultante por frasco ámpula de BLINCYTO® es de 12.5 mcg/mL.
• No reconstituya los frascos ámpula de BLINCYTO® con la solución estabilizadora IV.
3 Agitar suavemente el contenido para evitar el exceso de espuma.
• No sacudir.
4. Inspeccionar visualmente la solución reconstituida en busca de partículas y decoloración durante la reconstitución y antes de la infusión. La solución resultante debe ser clara a ligeramente opalescente, incolora a ligeramente amarilla.
• No use la solución si está turbia o si se ha precipitado.
Preparación de bolsa de infusión de BLINCYTO® de 24 horas o 48 horas: Verifique la dosis prescrita y la duración de la infusión para cada bolsa de infusión de BLINCYTO®. A fin de minimizar los errores, use los volúmenes específicos descritos en las Tablas 22 y 23 para preparar la bolsa de infusión BLINCYTO®.
• La Tabla 22 corresponde a pacientes con un peso de 45 kg o más.
• La Tablas 23 corresponde a pacientes que pesan menos de 45 kg.
1. Añada asépticamente 270 mL de cloruro de sodio bacteriostático inyectable al 0.9% a la bolsa intravenosa vacía.
2. Transfiera asépticamente 5.5 mL de solución estabilizadora IV en la bolsa intravenosa que contiene cloruro de sodio inyectable al 0.9%. Mezcle suavemente el contenido de la bolsa para evitar la formación de espuma. Deseche el frasco ámpula que contiene la solución estabilizadora IV sin utilizar.
3. Transfiera asépticamente el volumen requerido de solución de BLINCYTO® reconstituido a la bolsa de infusión intravenosa que contiene solución inyectable de cloruro de sodio al 0.9% y solución estabilizadora IV. Mezcle suavemente el contenido de la bolsa para evitar la formación de espuma.
• Consulte la Tabla 22 correspondiente a pacientes con un peso de 45 kg o más para conocer el volumen específico de BLINCYTO® reconstituido requerido.
• Consulte la Tabla 23 correspondiente a pacientes que pesan menos de 45 kg (dosis basada en el BSA) para conocer el volumen específico de BLINCYTO® reconstituido requerido.
• Deseche el frasco ámpula que contiene BLINCYTO® no utilizado.
4. Bajo condiciones asépticas, coloque la línea de infusión intravenosa a la bolsa intravenosa con un filtro estéril de 0.2 micrones. Asegúrese de que la línea de infusión intravenosa es compatible con la bomba de infusión.
5. Extraiga el aire de la bolsa intravenosa. Esto es particularmente importante para el uso de una bomba de infusión ambulatoria.
6. Purgue la línea de infusión intravenosa sólo con la bolsa que contiene la solución FINAL de BLINCYTO® preparada para infusión.
7. Almacene de 2 °C a 8 °C si no se usa inmediatamente.
Tabla 22. Para pacientes que pesan 45 kg o más: volúmenes para agregar a la bolsa intravenosa
|
Cloruro de sodio inyectable al 0.9% (volumen inicial) |
270 mL |
|||
|
Solución estabilizadora IV (volumen fijo para infusiones de 24 y 48 horas) |
5.5 mL |
|||
|
Duración de la infusión |
Dosis |
Velocidad de infusión |
BLINCYTO® reconstituido |
|
|
Volumen |
Frascos ámpula |
|||
|
24 horas |
9 mcg/día |
10 mL/hora |
0.83 mL |
1 |
|
28 mcg/día |
10 mL/hora |
2.6 mL |
1 |
|
|
48 horas |
9 mcg/día |
5 mL/hora |
1.7 mL |
1 |
|
28 mcg/día |
5 mL/hora |
5.2 mL |
2 |
|
Tabla 23. Para pacientes que pesan menos de 45 kg: volúmenes para agregar a la bolsa intravenosa
|
Cloruro de sodio inyectable al 0.9% (volumen inicial) |
270 mL |
||||
|---|---|---|---|---|---|
|
Solución estabilizadora IV (volumen fijo para infusiones de 24 y 48 horas) |
5.5 mL |
||||
|
Duración de la infusión |
Dosis |
Velocidad de infusión |
BSA (m2) |
BLINCYTO® reconstituido |
|
|
Volumen |
Frascos ámpula |
||||
|
24 horas |
5 mcg/m2/día |
10 mL/hora |
1.5 a 1.59 |
0.7 mL |
1 |
|
1.4 a 1.49 |
0.66 mL |
1 |
|||
|
1.3 a 1.39 |
0.61 mL |
1 |
|||
|
1.2 a 1.29 |
0.56 mL |
1 |
|||
|
1.1 a 1.19 |
0.52 mL |
1 |
|||
|
1 a 1.09 |
0.47 mL |
1 |
|||
|
0.9 a 0.99 |
0.43 mL |
1 |
|||
|
0.8 a 0.89 |
0.38 mL |
1 |
|||
|
0.7 a 0.79 |
0.33 mL |
1 |
|||
|
0.6 a 0.69 |
0.29 mL |
1 |
|||
|
0.5 a 0.59 |
0.24 mL |
1 |
|||
|
0.4 a 0.49 |
0.2 mL |
1 |
|||
|
24 horas |
15 mcg/m2/día |
10 mL/hora |
1.5 a 1.59 |
2.1 mL |
1 |
|
1.4 a 1.49 |
2 mL |
1 |
|||
|
1.3 a 1.39 |
1.8 mL |
1 |
|||
|
1.2 a 1.29 |
1.7 mL |
1 |
|||
|
1.1 a 1.19 |
1.6 mL |
1 |
|||
|
1 a 1.09 |
1.4 mL |
1 |
|||
|
0.9 a 0.99 |
1.3 mL |
1 |
|||
|
0.8 a 0.89 |
1.1 mL |
1 |
|||
|
0.7 a 0.79 |
1 mL |
1 |
|||
|
0.6 a 0.69 |
0.86 mL |
1 |
|||
|
0.5 a 0.59 |
0.72 mL |
1 |
|||
|
0.4 a 0.49 |
0.59 mL |
1 |
|||
|
48 horas |
5 mcg/m2/día |
5 mL/hora |
1.5 a 1.59 |
1.4 mL |
1 |
|
1.4 a 1.49 |
1.3 mL |
1 |
|||
|
1.3 a 1.39 |
1.2 mL |
1 |
|||
|
1.2 a 1.29 |
1.1 mL |
1 |
|||
|
1.1 a 1.19 |
1 mL |
1 |
|||
|
1 a 1.09 |
0.94 mL |
1 |
|||
|
0.9 a 0.99 |
0.85 mL |
1 |
|||
|
0.8 a 0.89 |
0.76 mL |
1 |
|||
|
0.7 a 0.79 |
0.67 mL |
1 |
|||
|
0.6 a 0.69 |
0.57 mL |
1 |
|||
|
0.5 a 0.59 |
0.48 mL |
1 |
|||
|
0.4 a 0.49 |
0.39 mL |
1 |
|||
|
48 horas |
15 mcg/m2/día |
5 mL/hora |
1.5 a 1.59 |
4.2 mL |
2 |
|
1.4 a 1.49 |
3.9 mL |
2 |
|||
|
1.3 a 1.39 |
3.7 mL |
2 |
|||
|
1.2 a 1.29 |
3.4 mL |
2 |
|||
|
1.1 a 1.19 |
3.1 mL |
2 |
|||
|
1 a 1.09 |
2.8 mL |
1 |
|||
|
0.9 a 0.99 |
2.6 mL |
1 |
|||
|
0.8 a 0.89 |
2.3 mL |
1 |
|||
|
0.7 a 0.79 |
2 mL |
1 |
|||
|
0.6 a 0.69 |
1.7 mL |
1 |
|||
|
0.5 a 0.59 |
1.4 mL |
1 |
|||
|
0.4 a 0.49 |
1.2 mL |
1 |
|||
Administración de BLINCYTO® para infusión de 24 horas o 48 horas:
• Administrar BLINCYTO® como una infusión intravenosa continua con una velocidad de flujo constante usando una bomba de infusión. La bomba deberá ser programable, que se pueda cerrar, no-elastomérica, y tener una alarma.
• El volumen inicial (270 mL) es mayor que el volumen administrado al paciente (240 mL) para considerar el purgado de las líneas de infusión intravenosa y para asegurar que el paciente recibirá la dosis completa de BLINCYTO®.
• Infundir la solución de infusión final de BLINCYTO® preparada acorde a las instrucciones en la etiqueta de la bolsa preparada en una de las siguientes velocidades de infusión constantes:
- Velocidad de infusión de 10 mL/hora para una duración de 24 horas, o
- Velocidad de infusión de 5 mL/hora para una duración de 48 horas.
• Administre la solución de infusión final de BLINCYTO® preparada usando líneas de infusión intravenosa que contengan un filtro en línea de 0.2 micrones, estéril, no-pirogénico, de baja unión a proteína. Para obtener información acerca de la administración de la bolsa de 7 días, consulte la sección Administración de BLINCYTO® como infusión de 7 días.
• Nota importante: No purgar la línea de infusión de BLINCYTO®, o el catéter intravenoso especialmente cuando se cambian las bolsas de infusión. Purgar cuando se cambien las bolsas o al finalizar la infusión puede resultar en exceso de dosificación y complicaciones. Cuando se administra a través de un catéter venoso de múltiples vías, infunda BLINCYTO® a través de un lumen exclusivo.
• Al final de la infusión, deseche cualquier solución no usada de BLINCYTO® en la bolsa intravenosa y en las líneas intravenosas de acuerdo con los requerimientos locales.
Preparación y administración de BLINCYTO® como una infusión de 7 días usando solución bacteriostática inyectable de cloruro de sodio al 0.9% (conservante):
Utilice agua estéril sin conservador para la inyección a fin de reconstituir BLINCYTO®. No reconstituya los frascos ámpula de BLINCYTO® con la solución estabilizadora IV.
No utilice un filtro en línea con la bolsa de infusión de 7 días.
Purgue la línea de infusión intravenosa sólo con la solución de la bolsa que contiene la solución FINAL preparada para infusión: No la purgue con la solución de cloruro de sodio al 0.9%.
Reconstitución de BLINCYTO® para la infusión de 7 días:
1. Determine la cantidad de frascos ámpula de BLINCYTO® necesarios para una dosis.
2. Reconstituya cada frasco ámpula de BLINCYTO® con 3 mL de agua estéril inyectable sin conservadores, dirigiendo el agua a lo largo de las paredes del frasco ámpula de BLINCYTO® y no directamente sobre el polvo liofilizado. Lo que da como resultado una concentración final de BLINCYTO® de 12.5 mcg/mL.
• No reconstituya los viales con BLINCYTO® con la solución estabilizadora IV.
3. Agitar suavemente el contenido para evitar el exceso de espuma:
• No sacudir.
4. Inspeccionar visualmente la solución reconstituida en busca de partículas y decoloración durante la reconstitución y antes de la infusión: La solución resultante debe ser clara a ligeramente opalescente, incolora a ligeramente amarilla.
• No use la solución si está turbia o si se ha precipitado.
Preparación de la bolsa de infusión de BLINCYTO® para infusión de 7 días: Verifique la dosis prescrita y la duración de la infusión para cada bolsa de infusión de BLINCYTO®. A fin de minimizar los errores, use los volúmenes específicos descritos en la Tabla 24 para preparar la bolsa de infusión BLINCYTO®.
1. Añada asépticamente 90 mL de cloruro de sodio bacteriostático inyectable al 0.9% a la bolsa intravenosa vacía.
2. Transfiera asépticamente 2.2 mL de solución estabilizadora IV en la bolsa intravenosa que contiene 0.9% de cloruro de sodio inyectable. Mezcle suavemente el contenido de la bolsa para evitar la formación de espuma. Deseche el frasco ámpula que contiene la solución estabilizadora IV sin utilizar.
3. Transfiera asépticamente el volumen requerido de solución de BLINCYTO® reconstituido a la bolsa de infusión intravenosa que contiene solución bacteriostática inyectable de cloruro de sodio al 0.9% y solución estabilizadora IV. Mezcle suavemente el contenido de la bolsa para evitar la formación de espuma.
• Consulte la Tabla 23 para conocer el volumen específico de BLINCYTO® reconstituido. Deseche el frasco ámpula que contiene BLINCYTO® no utilizado.
4. Añada asépticamente el volumen requerido de solución inyectable de cloruro de sodio al 0.9% a la bolsa intravenosa para obtener un volumen final de 110 mL. Mezcle suavemente el contenido de la bolsa para evitar la formación de espuma.
• Consulte la Tabla 24 para conocer el volumen específico de cloruro de sodio inyectable al 0.9%.
5. Bajo condiciones asépticas, coloque la línea de infusión intravenosa a la bolsa intravenosa.
• Asegúrese de que la línea de infusión intravenosa es compatible con la bomba de infusión.
• No utilice un filtro en línea para una bolsa de 7 días.
6. Extraiga el aire de la bolsa intravenosa. Esto es particularmente importante para el uso de una bomba de infusión ambulatoria.
7. Purgue la línea de infusión intravenosa sólo con la bolsa que contiene la solución FINAL de BLINCYTO® preparada para infusión.
8. Almacene de 2 ºC a 8 ºC si no se usa inmediatamente.
Tabla 24. Para la infusión de 7 días: volúmenes para agregar a la bolsa intravenosa para 28 mcg/día y 15 mcg/m2/día
|
Cloruro de sodio bacteriostático al 0.9% inyectable (volumen inicial) |
90 mL |
||||
|
Solución estabilizadora IV (volumen fijo para infusión de 7 días) |
2.2 mL |
||||
|
BLINCYTO® reconstituido |
El volumen específico se enlista en la tabla |
||||
|
Cantidad suficiente (c.s.) de cloruro de sodio inyectable al 0.9%, a un volumen final de 110 mL |
El volumen específico se enlista en la tabla |
||||
|
Duración de la infusión |
7 días |
||||
|
Velocidad de infusión |
0.6 mL/hora |
||||
|
Peso del paciente |
Dosis |
BSA (m2)* |
BLINCYTO® reconstituido |
Volumen de cloruro de sodio inyectable al 0.9% necesario como c.s. para un volumen final de 110 mL |
|
|
Volumen |
Frasco ámpula |
||||
|
Dosis fija |
|||||
|
45 kg o más |
28 mcg/día |
N/A |
16.8 mL |
6 |
1 mL |
|
Dosis basada en BSA |
|||||
|
Menos de 45 kg |
15 mcg/m2/día |
1.5 a 1.59 |
14 mL |
5 |
3.8 mL |
|
1.4 a 1.49 |
13.1 mL |
5 |
4.7 mL |
||
|
1.30 a 1.39 |
12.2 mL |
5 |
5.6 mL |
||
|
1.20 a 1.29 |
11.3 mL |
5 |
6.5 mL |
||
|
1.10 a 1.19 |
10.4 mL |
4 |
7.4 mL |
||
|
1 a 1.09 |
9.5 mL |
4 |
8.3 mL |
||
|
0.9 a 0.99 |
8.6 mL |
4 |
9.2 mL |
||
* No se ha establecido la seguridad de la administración de BLINCYTO® con un BSA de menos de 0.4 m2
Administración de BLINCYTO® como infusión de 7 días:
• Administrar BLINCYTO® como una infusión intravenosa continua con una velocidad de flujo constante usando una bomba de infusión. La bomba deberá ser programable, que se pueda cerrar, no-elastomérica, y tener una alarma.
• El volumen final de la solución de infusión (110 mL) será mayor que el volumen administrado al paciente (100 mL) para considerar el purgado de la línea de infusión intravenosa y para asegurar que el paciente recibirá la dosis completa de BLINCYTO®.
• No utilice un filtro en línea para una bolsa de 7 días.
• Infundir la solución de infusión final de BLINCYTO® preparada acorde a las instrucciones en la etiqueta de la bolsa preparada a una velocidad de infusión de 0.6 mL/hora por una duración de 7 días.
• Nota Importante: No purgar la línea de infusión de BLINCYTO®, o el catéter intravenoso especialmente cuando se cambian las bolsas de infusión. Purgar cuando se cambien las bolsas o al finalizar la infusión puede resultar en exceso de dosificación y complicaciones. Cuando se administra a través de un catéter venoso de múltiples vías, infunda BLINCYTO® a través de un lumen exclusivo.
• Al final de la infusión, deseche cualquier solución no usada de BLINCYTO® en la bolsa intravenosa y en las líneas intravenosas de acuerdo con los requerimientos locales.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Se han observado sobredosis, lo que incluye un paciente adulto que recibió 133 veces la dosis terapéutica recomendada de BLINCYTO® administrado durante un corto periodo.
En la fase de evaluación de la dosis de un estudio en pacientes pediátricos y adolescentes con LLA de precursores de células B en recaída o refractaria, un paciente experimentó un evento de insuficiencia cardiaca fatal en el contexto de síndrome de liberación de citocinas (CRS) potencialmente mortal con una dosis de 30 mcg/m2/día (superior a la dosis máxima tolerada/recomendada) (ver Precauciones generales y Reacciones secundarias y adversas).
Las sobredosis resultaron en reacciones adversas consistentes con las reacciones observadas a la dosis recomendada, e incluyeron fiebre, temblor y cefalea. En caso de sobredosis, interrumpir la infusión y monitorizar al paciente para signos de reacciones adversas, y proporcionar cuidados de soporte (ver Precauciones generales). Considerar el reinicio de BLINCYTO® a la dosis recomendada cuando todas las reacciones adversas se han resuelto y no antes de 12 horas después de la interrupción de la infusión (ver Dosis y vía de administración).
PRESENTACIÓN: Cada empaque de BLINCYTO® contiene un frasco ámpula de blinatumomab (35 mcg) y un frasco ámpula con solución estabilizadora IV.
RECOMENDACIONES SOBRE ALMACENAMIENTO: La información en la Tabla 25 indica el tiempo de almacenamiento para el frasco ámpula de BLINCYTO® reconstituido y la bolsa de infusión preparada.
Tabla 25. Tiempo de almacenamiento para el frasco ámpula de BLINCYTO® reconstituido y la bolsa de infusión preparada de BLINCYTO®
|
Tiempo máximo de almacenamiento |
||
|---|---|---|
|
Temperatura ambiente 23 °C a 27 °C (73 °F a 81 °F) |
Refrigerado 2 °C a 8 °C (36 °F a 46 °F) |
|
|
Frasco ámpula de BLINCYTO® reconstituido |
4 horas |
24 horas |
|
Bolsa de infusión preparada de BLINCYTO® (sin conservador) |
48 horas* |
8 días |
|
Bolsa de infusión preparada de BLINCYTO® (con conservador) |
7 días* |
14 días |
* El tiempo de almacenamiento incluye el tiempo de infusión. Si la bolsa IV que contiene la solución de BLINCYTO® para infusión no es administrada dentro de los marcos de tiempo y temperaturas indicados, debe ser desechada; no deberá ser refrigerada nuevamente.
Almacenar los frascos ámpula de BLINCYTO® y la solución estabilizadora IV en el empaque original refrigerado entre 2 °C a 8 °C y protegerlos de la luz hasta el momento de usarlos. No congelar.
Los frascos ámpula de BLINCYTO® y la solución estabilizadora IV se puede almacenar por un máximo de 8 horas a temperatura ambiente (23 °C a 27 °C) en la caja original para protegerlos de la luz.
LEYENDAS DE PROTECCIÓN:
Manténgase fuera del alcance de los niños. Su venta requiere receta médica. No se use durante el embarazo y la lactancia. Literatura exclusiva para el médico. Este producto deberá ser prescrito por médicos especialistas en oncología o hematología.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx o
farmacovigilanciamx@amgen.com
Representante legal:
AMGEN MÉXICO, S.A. de C.V.
Av. Vasco de Quiroga No. 3000, piso 4, Col. Santa Fe,
C.P. 01210, Álvaro Obregón, Ciudad de México, México.
