EMEND IV®
APREPITANT
Solución inyectable
1 Caja, 1 Frasco(s) ámpula, 150 Miligramos
1 Caja, 10 Frasco(s) ámpula, 150 Miligramos
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Solución
Inyectable
Fórmula:
El frasco ámpula con liofilizado contiene: Fosaprepitant de dimeglumina equivalente a 150 mg
de Fosaprepitant
Excipiente c.s. Fosaprepitant de dimeglumina es el profármaco de aprepitant. Su descripción química es sal de un antagonista de los receptores neurocinina 1 (NK1) de sustancia P estructuralmente nuevo, cuyo nombre químico es 1-deoxi-1- (metilamino)- D-glucitol [3-[[(2R,3S)-2-[(1R)-1-[3,5-bis(trifluorometil)fenil]etoxi]-3-(4-fluorofenil)-4-morfolinil]metil]-2,5-dihidro-5-oxo-1H-1,2,4-triazol-1-yl]fosfonato (2:1)
Su fórmula empírica es C23H22F7N4O6P*2(C7H17NO5), y su fórmula estructural es:
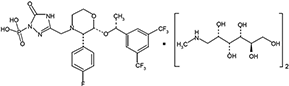
Fosaprepitant de dimeglumina es un polvo amorfo, blanco o blanquecino, con un peso molecular de 1004.83. Es libremente soluble en agua.
Ingredientes activos
EMEND IV se encuentra disponible como solución de 150 mg IV. Cada frasco ámpula de EMEND IV 150 mg para administración intravenosa en la náusea y vómito inducidos por quimioterapia (NVIQ) contiene 245.3 mg de fosaprepitant de dimeglumina equivalente a 150 mg de ácido libre de fosaprepitant.
Ingredientes inactivos
Cada frasco ámpula de EMEND IV 150 mg para la náusea y el vómito inducidos por quimioterapia contiene los siguientes ingredientes inactivos: edetato disódico, polisorbato 80 (75 mg), lactosa anhidra. Hidróxido de sodio y/o ácido clorhídrico (para ajustar el pH).
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 140M2010 SSA IV
Tracer number: MK0517-MEX-2016-014296
IV. INDICACIONES TERAPÉUTICAS
EMEND IV está indicado, en combinación con otros fármacos antieméticos, para la prevención de la náusea y el vómito agudos y tardíos asociados con los ciclos iniciales y siguientes de:
• quimioterapia anticancerosa altamente emetogénica (véase DOSIS Y VÍA DE ADMINISTRACIÓN).
• quimioterapia anticancerosa moderadamente emetogénica (véase DOSIS Y VÍA DE ADMINISTRACIÓN).
V. FARMACOCINÉTICA Y FARMACODINAMIA
Mecanismo de acción
El fosaprepitant es un profármaco de aprepitant y, por consiguiente, sus efectos antieméticos son atribuibles a aprepitant.
El aprepitant tiene un mecanismo de acción único; es un antagonista selectivo de gran afinidad hacia los receptores neurocinina 1 de la sustancia P (NK1). Los análisis de contra detección demostraron que aprepitant fue cuando menos 3,000 veces más selectivo hacia el receptor NK1 que hacia otras enzimas, transportadores, canales iónicos o receptores, incluidos los receptores para dopamina y serotonina, que son los objetivos de los tratamientos disponibles para la náusea y el vómito inducidos por quimioterapia.
En estudios preclínicos se ha demostrado que los antagonistas de los receptores NK1 inhiben el vómito inducido por fármacos quimioterapéuticos citotóxicos, como el cisplatino, mediante efectos centrales. Los estudios preclínicos y en seres humanos con tomografía por emisión de positrones (TEP) con aprepitant han demostrado que penetra en el cerebro y ocupa los receptores NK1 cerebrales. Los estudios preclínicos han demostrado que aprepitant tiene una actividad central de larga duración, inhibe tanto la fase aguda como la tardía del vómito inducido por el cisplatino y aumenta la actividad antiemética de ondansetrón, el antagonista de los receptores de 5-HT3, y del corticosteroide dexametasona contra el vómito inducido por cisplatino.
FARMACOCINÉTICA
Absorción
Después de una dosis intravenosa única de 150 mg de fosaprepitant administrada en infusión durante 20 minutos a voluntarios sanos, la media del ABCo-∞ o de aprepitant fue de 35.0 mcg• hr/mL, y la media de la concentración máxima de aprepitant fue de 4.01 mcg/mL.
Distribución
Fosaprepitant se convierte rápidamente en aprepitant.
El aprepitant se une en más del 95% a las proteínas plasmáticas. La media geométrica del volumen aparente de distribución en estado estable (Vdee) en los seres humanos es de aproximadamente 66 litros.
El aprepitant atraviesa la placenta en las ratas y atraviesa la barrera hematoencefálica en las ratas y los hurones. Los estudios con tomografía por emisión de positrones en seres humanos indican que aprepitant atraviesa la barrera hematoencefálica (véase MECANISMO DE ACCIÓN, arriba).
Metabolismo
El fosaprepitant se convirtió rápidamente en aprepitant en las incubaciones in vitro con preparaciones de hígado de especies no clínicas (rata y perro) y de seres humanos. Además, fosaprepitant sufrió una conversión rápida y casi completa en aprepitant en las preparaciones S9 de varios otros tejidos humanos, incluidos riñón, pulmón e íleon. Así pues, parece que la conversión de fosaprepitant en aprepitant puede llevarse a cabo en varios tejidos extrahepáticos. En humanos, fosaprepitant administrado por vía intravenosa se convirtió rápidamente en aprepitant en los 30 minutos siguientes al término de la infusión.
El aprepitant se metaboliza ampliamente. En adultos jóvenes sanos aprepitant constituye aproximadamente el 24% de la radiactividad en el plasma en las 72 horas siguientes a la administración de una sola dosis por vía oral de 300 mg de [14C]-aprepitant, lo cual indica una presencia sustancial de metabolitos en el plasma. En el plasma humano se han identificado siete metabolitos de aprepitant, los cuales son sólo débilmente activos. Aprepitant se metaboliza en gran medida por oxidación en el anillo morfolínico y en sus cadenas laterales. Los estudios in vitro con microsomas hepáticos humanos indican que aprepitant es metabolizado principalmente por la CYP3A4, con un metabolismo mínimo por la CYP1A2 y la CYP2C19, y nulo por la CYP2D6, la CYP2C9 o la CYP2E1.
Todos los metabolitos observados en orina, heces y plasma tras la administración de una dosis intravenosa de 100 mg de [14C]-fosaprepitant también se observaron después de una dosis por vía oral de [14C] Aprepitant. Con la conversión de 245.3 mg de fosaprepitant de dimeglumina (equivalente a 150 mg de ácido libre de fosaprepitant) en aprepitant, se liberan 23.9 mg de ácido fosfórico y 95.3 mg de meglumina.
Eliminación
Tras la administración de una sola dosis IV de 100 mg de [14C]-aprepitant a sujetos sanos, el 57% de la radiactividad se recuperó en la orina y el 45% en las heces.
El aprepitant se elimina principalmente por metabolismo; aprepitant no se excreta por los riñones. Tras la administración de una sola dosis por vía oral de 300 mg de [14C] -aprepitant a sujetos sanos, el 5% de la radiactividad se recuperó en la orina y el 85% en las heces.
Los límites de la vida media terminal aparente variaron desde 9 hasta 13 horas, aproximadamente.
Características en los pacientes
El fosaprepitant, un profármaco de aprepitant, cuando se administra por vía intravenosa se convierte rápidamente en aprepitant.
Sexo
Tras la administración por vía oral de una sola dosis de aprepitant, el ABC0-24h y la Cmax de aprepitant son 9 y 17% mayor respectivamente en las mujeres que en los hombres. La vida media de aprepitant es aproximadamente 25% menor en las mujeres que en los hombres, y su Tmax se alcanza aproximadamente en el mismo lapso. Estas diferencias no se consideran clínicamente importantes. No es necesario ajustar la dosificación según el sexo del paciente.
Pacientes de edad avanzada
Tras la administración por vía oral de una sola dosis de 125 mg de aprepitant el Día 1 y 80 mg una vez al día los Días 2 a 5, el ABC0.24h de aprepitant fue 21% mayor el Día 1 y 36% mayor el Día 5 en los pacientes de edad avanzada ( de 65 años o mayores) que en adultos de menor edad. La Cmax fue 10% más alta el Día 1 y 24% más alta el Día 5 en los pacientes de edad avanzada. Estas diferencias no se consideran clínicamente importantes. No es necesario ajustar la dosificación en los pacientes de edad avanzada.
Pacientes pediátricos
El fosaprepitant no se ha estudiado en pacientes menores de 18 años de edad.
Raza
Tras la administración de una dosis única de aprepitant, el ABC0-24 hr es aproximadamente 27% y 31% mayor en Hispanos cuando se comparan, respectivamente, con Caucásicos o Negros. La Cmax es 19% y 29% mayor en Hispánicos cuando se compara, respectivamente, con Caucásicos o Negros. Una dosis única de aprepitant administrada por vía oral en Asiáticos resultó en un incremento del ABC0-24hr y Cmax del 74% y 47% respectivamente, al compararse con Caucásicos. Estas diferencias no se consideran clínicamente importantes. No es necesario ajustar la dosificación según la raza del paciente.
Índice de Masa Corporal (IMC)
El Índice de Masa Corporal (IMC) no tuvo un efecto clínicamente significativo en la farmacocinética de aprepitant.
Insuficiencia hepática
El fosaprepitant se metaboliza en diversos tejidos extra-hepáticos; por tal razón, no se prevé que la insuficiencia hepática altere la conversión de fosaprepitant en aprepitant.
El aprepitant por vía oral fue bien tolerado en pacientes con insuficiencia hepática de leve a moderada. Tras la administración por vía oral de una sola dosis de 125 mg de aprepitant el Día 1 y de 80 mg una vez al día los Días 2 y 3 a pacientes con insuficiencia hepática leve (puntuación de Child-Pugh de 5 a 6), el ABC0-24h de aprepitant fue 11% menor el Día 1 y 36% menor el Día 3 en comparación con los sujetos sanos que recibieron esas mismas dosis. En los pacientes con insuficiencia hepática moderada (puntuación de Child- Pugh de 7 a 9), el ABC0-24h de aprepitant fue 10% mayor el Día 1 y 18% mayor el Día 3 en comparación con los sujetos sanos que recibieron ese mismo esquema de dosis. Esas diferencias en el ABC0-24h no se consideran clínicamente importantes; por tal razón, no es necesario ajustar la dosificación en los pacientes con insuficiencia hepática de leve a moderada.
No hay datos clínicos o farmacocinéticos en pacientes con insuficiencia hepática grave (puntuación de Child-Pugh mayor de 9).
Insuficiencia renal
Se administró una sola dosis de 240 mg de aprepitant por vía oral a pacientes con insuficiencia renal grave (depuración de creatinina <30 mL/min) y a pacientes con nefropatía terminal que requerían hemodiálisis.
En los pacientes con insuficiencia renal grave, el ABC0-oo de aprepitant total (libre y unido a las proteínas) disminuyó 21% y la Cmax disminuyó 32%, en comparación con los voluntarios sanos. En los pacientes con nefropatía terminal sometidos a hemodiálisis, el ABC0-oo de aprepitant total disminuyó 42% y la Cmax disminuyó 32%. Debido a pequeñas reducciones de la unión de aprepitant a las proteínas en los pacientes con nefropatía, el ABC de aprepitant libre farmacológicamente activo no cambió significativamente en los pacientes con insuficiencia renal en comparación con los sujetos sanos. La hemodiálisis realizada 4 o 48 horas después de la administración no tuvo un efecto significativo sobre la farmacocinética de aprepitant; en el dializado se recuperó menos del 0.2% de la dosis.
No es necesario ajustar la dosificación en los pacientes con insuficiencia renal grave ni en los pacientes con nefropatía terminal sometidos a hemodiálisis.
FARMACODINAMIA
Electrofisiología cardíaca
En un estudio clínico con distribución al azar, doble ciego, positivamente controlado, con estudio QT completo, una dosis única de 200 mg de fosaprepitant no tuvo efecto en el intervalo QTc.
Evaluación con Tomografía por emisión de Positrones de la unión a receptores cerebrales NK1
Un estudio de tomografía por emisión de positrones en hombres jóvenes sanos a los cuales se les administró una dosis única intravenosa de 150 mg de fosaprepitant (N=8) demostró la ocupación de los receptores NK1 cerebrales de ≥100% en Tmax, y después de 24 horas, de ≥97% a las 48 horas, y entre 41% y 75% a las 120 horas después de la dosificación. En este estudio, se correlaciona bien la ocupación de los receptores NK1 cerebrales, con las concentraciones plasmáticas de aprepitant.
VI. CONTRAINDICACIONES
EMEND IV está contraindicado en los pacientes con hipersensibilidad a EMEND IV, a aprepitant, a polisorbato 80 o a cualquier otro de los componentes del producto.
EMEND IV no debe usarse simultáneamente con pimocida, terfenadina, astemizol o cisaprida. La inhibición de la isoenzima 3A4 del citocromo P450 (CYP3A4) por aprepitant puede aumentar las concentraciones plasmáticas de esos fármacos y causar reacciones graves o potencialmente mortales (véase INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
VII. PRECAUCIONES GENERALES
Ya que fosaprepitant se convierte con rapidez en aprepitant (un inhibidor de débil a moderado de la isoenzima CYP3A4), fosaprepitant debe usarse con precaución en pacientes que están recibiendo medicamentos por vía oral que son metabolizados principalmente por la isoenzima CYP3A4; algunos fármacos quimioterapéuticos son metabolizados por la enzima CYP3A4 (véase INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO). La inhibición débil de CYP3A4 por fosaprepitant 150 mg podría aumentar las concentraciones plasmáticas de esos fármacos administrados por vía oral (véase INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
Durante o poco tiempo después de la infusión de fosaprepitant han ocurrido reportes de reacciones de hipersensibilidad inmediata que incluyeron rubor, eritema, disnea y anafilaxia/choque anafiláctico. Estas reacciones de hipersensibilidad por lo general han respondido a la suspensión de la infusión y a la administración del tratamiento apropiado. No se recomienda reiniciar la infusión en pacientes que experimentan reacciones de hipersensibilidad.
La co-administración de fosaprepitant con warfarina puede ocasionar una reducción clínicamente significativa en la Relación Internacional Normalizada (INR por sus siglas en inglés) del tiempo de protrombina. En los pacientes bajo tratamiento crónico con warfarina, debe vigilarse estrechamente la INR durante un periodo de dos semanas, y en particular entre los 7 y 10 días después de iniciar el régimen de fosaprepitant de cada ciclo de quimioterapia (véase INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO)
La eficacia de los anticonceptivos hormonales puede disminuir durante la administración de fosaprepitant en los 28 días siguientes. Deben usarse métodos anticonceptivos alternativos o de respaldo durante el tratamiento con fosaprepitant y durarte un mes después de la última dosis (véase INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
Uso pediátrico
No se han determinado la seguridad ni la eficacia de EMEND IV en pacientes pediátricos.
Uso en pacientes de edad avanzada
En los estudios clínicos, la eficacia y la seguridad de aprepitant en los pacientes de edad avanzada (≥65 años) fueron comparables a las observadas en pacientes de menor edad (menores de 65 años). No es necesario ajustar la dosificación en los pacientes de edad avanzada.
Efectos Sobre la capacidad de conducir y utilizar maquinaria
No se han realizado estudios sobre los efectos de EMEND IV en la capacidad de conducir y utilizar maquinaria. Sin embargo, ciertos efectos que se han reportado con EMEND IV pueden afectar la capacidad de algunos pacientes para conducir u operar maquinaria. Las respuestas individuales a EMEND IV pueden variar (ver REACCIONES SECUNDARIAS Y ADVERSAS).
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
Embarazo
No hay estudios adecuados y bien controlados en mujeres embarazadas. Sólo debe usarse EMEND IV durante el embarazo si el posible beneficio justifica el riesgo potencial para la madre y el feto.
Lactancia
EMEND IV, cuando se administra por vía intravenosa, se convierte rápidamente en aprepitant.
El aprepitant es excretado en la leche de ratas lactantes. No se sabe si este medicamento es excretado en la leche humana. Debido a que muchos medicamentos son excretados en la leche humana y a los posibles efectos adversos de aprepitant en los lactantes, se debe decidir si se suspende la lactancia o la administración del medicamento, teniendo en cuenta la importancia de éste para la madre.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
La seguridad total de fosaprepitant se evaluó en aproximadamente en 1,600 personas.
PREVENCION DE LA NÁUSEA Y EL VÓMITO INDUCIDOS POR QUIMIOTERAPIA (NVIQ)
Quimioterapia Moderadamente Emetogénica (QME)
En un estudio clínico controlado con activo en pacientes que recibían QME, se evaluó la seguridad en 504 pacientes que recibieron una dosis única de EMEND IV en combinación con ondansetrón y dexametasona (régimen de fosaprepitant), comparado con 497 pacientes que recibieron ondansetrón y dexametasona solas (régimen control). Se reportaron las siguientes experiencias adversas relacionadas con el medicamento clínicamente importantes, en los pacientes tratados con el régimen de fosaprepitant y con una incidencia mayor que en el grupo control.
[Común (≥1/100, <1/10), Poco común (≥1/1,000, <1/100)]
Trastornos cardíacos
Poco común: palpitaciones
Trastornos gastrointestinales:
Común: estreñimiento
Poco común: distensión abdominal, dolor abdominal, dolor en abdomen superior, dispepsia
Trastornos generales y condiciones en el sitio de administración:
Común: dolor en el sitio de infusión
Poco común: astenia
Infecciones e infestaciones:
Poco común: candidiasis oral
Trastornos del metabolismo y nutrición:
Poco común: disminución del apetito
Trastornos respiratorios, torácicos y mediastinales:
Poco común: tos, dolor orofaríngeo, irritación de garganta
Trastornos vasculares:
Poco común: ruboración.
Quimioterapia Altamente Emetogénica (QAE)
En un estudio clínico con control activo en pacientes que recibieron QAE, se evaluó la seguridad en 1,143 pacientes que recibieron una sola dosis de EMEND IV 150 mg comparado con 1,169 pacientes que recibieron el régimen de 3 días de EMEND (aprepitant). El perfil de seguridad fue generalmente similar al observado en el estudio de QME con fosaprepitant.
Las siguientes reacciones adversas clínicamente importantes relacionadas con el medicamento ocurrieron con fosaprepitant 150 mg y no han sido reportadas en estudios clínicos más tempranos con aprepitant por vía oral, o en el estudio de QME con fosaprepitant.
[Poco comunes (≥1/1,000, <1/100), Raras (≥1/10,000, <1/1,000)]
Trastornos generales y del sitio de administración:
Poco comunes: Eritema en el sitio de infusión, prurito en el sitio de infusión
Raros: induración en el sitio de infusión
Análisis de laboratorio:
Poco comunes: aumento en la presión sanguínea
Trastornos cutáneos y subcutáneos:
Poco comunes: eritema
Trastornos vasculares:
Poco frecuentes: rubor, tromboflebitis, (predominantemente, tromboflebitis en el sitio de infusión).
Debido a que fosaprepitant se convierte en aprepitant, las experiencias adversas asociadas con aprepitant también podrían esperarse que ocurran con EMEND IV. Vea la información para prescribir para EMEND para una información de seguridad completa con relación a estudios realizados con aprepitant oral.
Experiencia Post-comercialización:
Las siguientes reacciones adversas han sido identificadas durante la post-comercialización. Debido a que estas reacciones son reportadas voluntariamente por una muestra de población de tamaño incierto, generalmente no es posible una estimación confiable de la frecuencia o establecer una relación causal con el fármaco.
Trastornos cutáneos y subcutáneos: prurito, erupción, urticaria y rara vez síndrome de Stevens-Johnson/Necrólisis epidérmica tóxica.
Trastornos del sistema inmunológico: reacciones de hipersensibilidad, incluyendo reacciones anafilácticas/choque anafiláctico
Las reacciones de hipersensibilidad inmediatas que han sido observadas durante la infusión de fosaprepitant pueden incluir las siguientes: rubor, eritema, disnea (véase PRECAUCIONES GENERALES).
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Cuando se administra por vía intravenosa, fosaprepitant se convierte rápidamente en aprepitant. Por lo tanto, es probable que ocurran interacciones medicamentosas después de la administración de fosaprepitant con fármacos que interactúan con aprepitant oral. La siguiente información se derivó de los estudios realizados con aprepitant oral y estudios llevados a cabo con fosaprepitant co-administrado con dexametasona, midazolam o diltiazem.
Aprepitant actúa como sustrato, inhibidor de débil a moderado e inductor de la isoenzima CYP3A4. Aprepitant también actúa como inductor de la isoenzima CYP2C9.
EMEND IV 150 mg, administrado como dosis única, es un inhibidor débil de CYP3A4 y no induce al CYP3A4. Se anticipa que EMEND IV 150 mg podría causar una inducción menor o no mayor de CYP2C9 que la causada por la administración de aprepitant por vía oral.
EFECTO DE FOSAPREPITANT/APREPITANT SOBRE LA FARMACOCINÉTICA DE OTROS FÁRMACOS
Aprepitant, como un inhibidor de débil a moderado de CYP3A4, y EMEND IV 150 mg, como un inhibidor débil de CYP3A4, pueden aumentar las concentraciones plasmáticas de los medicamentos por vía oral metabolizados a través de CYP3A4 que se administren al mismo tiempo.
Fosaprepitant no debe usarse simultáneamente con pimozida, terfenadina, astemizol o cisaprida. La inhibición de la isoenzima CYP3A4 por aprepitant puede aumentar las concentraciones plasmáticas de esos fármacos y causar potencialmente reacciones graves o mortales (véase CONTRAINDICACIONES).
Se ha demostrado que aprepitant induce el metabolismo de la S (-) warfarina y de la tolbutamida, que se metabolizan por la isoenzima CYP2C9. La co-administración de fosaprepitant con estos u otros medicamentos que son metabolizados por la CYP2C9, como la fenitoína, puede disminuir las concentraciones plasmáticas de esos medicamentos.
Es poco probable que fosaprepitant interactúe con los fármacos que son sustratos del transportador de P-glucoproteínas, como lo demostró la nula interacción de aprepitant por vía oral con digoxina en un estudio clínico sobre interacciones medicamentosas.
Antagonistas de la 5-HT3: En estudios clínicos sobre interacciones medicamentosas, cuando aprepitant fue administrado en un régimen de 125 mg en el Día 1 y 80 mg los Días 2 y 3, no tuvo efectos de importancia clínica sobre la farmacocinética de ondansetrón , granisetrón o hidrodolasetrón (el metabolito activo de dolasetrón) .
Corticosteroides:
Dexametasona: Fosaprepitant 150 mg administrado como una dosis única por vía intravenosa el Día 1 aumentó el ABC0-24hr de dexametasona, un sustrato de CYP3A4, aproximadamente 2.0 veces los Días 1 y 2 cuando se administró dexametasona al mismo tiempo como una dosis única por vía oral de 8 mg los Días 1, 2, y 3. La dosis orales de dexametasona los Días 1 y 2 deben reducirse aproximadamente el 50% cuando se administren al mismo tiempo que fosaprepitant 150 mg IV, el Día 1 para alcanzar exposiciones de dexametasona similares a las obtenidas cuando se administró sin fosaprepitant 150 mg (ver DOSIS Y VÍA DE ADMINISTRACIÓN).
Metilprednisolona: Cuando se administró aprepitant por vía oral en un régimen de 125 mg el Día 1 y 80 mg/día los Días 2 y 3, el ABC de la metilprednisolona (sustrato de CYP3A4), incrementó 1.3 veces el Día 1 y 2.5 veces el Día 3, cuando la metilprednisolona fue administrada por vía intravenosa 125 mg el Día 1 y por vía oral 40 mg los Días 2 y 3. Fármacos quimioterapéuticos: En los estudios clínicos se administró el régimen oral de aprepitant con los siguientes fármacos quimioterapéuticos que son metabolizados principalmente o en parte por la isoenzima CYP3A4: etopósido, vinorelbina, docetaxel, ifosfamida, ciclofosfamida, irinotecán y paclitaxel. Las dosis de estos medicamentos no se ajustaron en virtud de las posibles interacciones farmacológicas. Se recomienda tomar precauciones y realizar un cuidadoso monitoreo en los pacientes que reciben estos agentes u otra quimioterapia con agentes metabolizados principalmente por la CYP3A4. Se han reportado eventos post-comercialización de neurotoxicidad, una potencial reacción adversa de ifosfamida, después de la co-administración de aprepitant e ifosfamida (ver PRECAUCIONES GENERALES).
Docetaxel: En un estudio farmacocinético separado, aprepitant por vía oral (en un régimen para NVIQ) no influyó en la farmacocinética de docetaxel.
Vinorelbina: En un estudio farmacocinético separado, aprepitant por vía oral (en un régimen para NVIQ) no influyó en la farmacocinética de vinorelbina.
Warfarina: Se administró una dosis única de 125 mg de aprepitant por vía oral el Día 1 y 80 mg/día los Días 2 y 3 a sujetos sanos estabilizados bajo tratamiento crónico con warfarina. Aunque aprepitant por vía oral no tuvo ningún efecto sobre el ABC de la warfarina R(+) o S(-) medida el Día 3, cinco días después de terminar la administración de aprepitant por vía oral se observó una disminución del 34% en la concentración valle de warfarina S(-) (un sustrato de la CYP2C9), acompañada de una reducción del 14% en el tiempo de protrombina (reportado como Relación Internacional Normalizada o INR). En los pacientes bajo tratamiento crónico con warfarina, debe vigilarse estrechamente el tiempo de protrombina (INR) durante el periodo de dos semanas, y en particular entre los 7 y 10 días, después de iniciar fosaprepitant en cada ciclo de quimioterapia.
Tolbutamida: La administración de aprepitant por vía oral en dosis de 125 mg el Día 1 y de 80 mg/día los Días 2 y 3 redujo 23% el ABC de la tolbutamida (un sustrato de la isoenzima CYP2C9) el Día 4, 28% el Día 8 y 15% el Día 15, cuando se administró una dosis única de 500 mg de tolbutamida por vía oral antes de administrar el régimen de tres días de aprepitant por vía oral y los Días 4, 8 y 15.
Anticonceptivos por vía oral: La administración de una cápsula de 100 mg de aprepitant por vía oral una vez al día durante 14 días junto con un anticonceptivo por vía oral con 35 mcg de etinilestradiol y 1 mg de noretindrona disminuyó 43% el ABC de etinilestradiol y 8% el ABC de noretindrona.
En otro estudio, se administró un anticonceptivo por vía oral que contenía etinilestradiol y noretindrona en dosis única los Días 1 al 21 junto con aprepitant por vía oral, administrado en un régimen de 125 mg el Día 8 y 80 mg/día los Días 9 y 10 combinado con 32 mg de ondansetrón IV el Día 8 y dexametasona por vía oral, 12 mg el Día 8 y 8 mg/día los Días 9, 1O y 11. En el estudio, el ABC de etinilestradiol disminuyó 19% el Día 10, y las concentraciones valle de etinilestradiol se redujeron hasta 64% durante los Días 9 al 21. Si bien aprepitant por vía oral no tuvo efecto alguno sobre el ABC de la noretindrona el Día 10, hubo una reducción de hasta 60% en las concentraciones mínimas de noretindrona durante los Días 9 al 21.
La eficacia de los anticonceptivos hormonales puede disminuir durante la administración de fosaprepitant o aprepitant y en los 28 días siguientes. Deben usarse métodos anticonceptivos alternativos o de respaldo durante el tratamiento con fosaprepitant o aprepitant y durante un mes después de la administración de fosaprepitant.
Midazolam: Fosaprepitant 150 mg administrado como una dosis única por vía intravenosa el Día 1 aumentó el ABC0-∞ de midazolam aproximadamente 1.8 veces el Día 1 y no tuvo ningún efecto (1.0 Veces) el Día 4, cuando midazolam se administró al mismo tiempo que una dosis única por vía oral de 2 mg los Días 1 y 4. Fosaprepitant 150 mg I.V. es un inhibidor débil de CYP3A4 como dosis única el Día 1 sin evidencia de inhibición o inducción de CYP3A4 observada el Día 4.
EFECTO DE OTROS FÁRMACOS SOBRE LA FARMACOCINÉTICA DE APREPITANT
El aprepitant es un sustrato de la isoenzima CYP3A4; por lo tanto, la co-administración de fosaprepitant con fármacos que Inhiben la actividad de la CYP3A4 puede aumentar las concentraciones plasmáticas de aprepitant. Por lo tanto, se debe tener precaución al co-administrar fosaprepitant con inhibidores potentes de la CYP3A4 (por ejemplo, ketoconazol), pero la co-administración de aprepitant con inhibidores moderados de la CYP3A4 (por ejemplo, diltiazem) no ocasiona cambios de importancia clínica en las concentraciones plasmáticas de aprepitant.
El aprepitant es un sustrato de la isoenzima CYP3A4; por lo tanto, la co-administración de fosaprepitant con fármacos que inducen potentemente la actividad de la CYP3A4 (por ejemplo: rifampicina) puede disminuir las concentraciones plasmáticas de aprepitant y, en consecuencia, la eficacia.
Ketoconazol: Cuando se administró una sola dosis de 125 mg de aprepitant por vía oral el Día 5 de un régimen de diez días con 400 mg/día de ketoconazol, un inhibidor potente de la CYP3A4, el ABC de aprepitant aumentó aproximadamente 5 veces, y su vida media terminal promedio aumentó aproximadamente tres veces. Se debe tener precaución al co-administrar fosaprepitant con inhibidores potentes de la CYP3A4.
Rifampicina: Cuando se administró una sola dosis de 375 mg de aprepitant por vía oral el Día 9 de un régimen de 14 días con 600 mg/día de rifampicina, un inductor potente de la CYP3A4, el ABC de aprepitant se redujo aproximadamente 11 veces, y su vida media terminal promedio disminuyó aproximadamente 3 veces. La co-administración de fosaprepitant con fármacos que inducen la actividad de la CYP3A4 puede disminuir las concentraciones plasmáticas y, en consecuencia, la eficacia.
OTRAS INTERACCIONES
Diltiazem: En pacientes con hipertensión de leve a moderada, la infusión de 100 mg de fosaprepitant en el curso de 15 minutos, simultánea con la administración de 120 mg de diltiazem tres veces al día, aumentó 1.5 veces el ABC de aprepitant y 1.4 veces el ABC de diltiazem. Los efectos farmacocinéticos ocasionaron una reducción ligera, pero clínicamente importante, de la presión arterial diastólica (reducción de 16.8 mmHg con fosaprepitant, comparada con 10.5 mmHg sin fosaprepitant), y pueden ocasionar una reducción ligera, pero clínicamente importante, de la presión arterial sistólica (reducción de 24.4 mmHg con fosaprepitant, comparada con 18.8 mmHg sin fosaprepitant), pero no hubo cambios clínicamente importantes en la frecuencia cardiaca ni en el intervalo PR, más allá de los cambios inducidos por diltiazem solo.
Paroxetina: La co-administración de dosis únicas diarias de aprepitant (en una presentación en tableta comparable con 85 mg o 170 mg de la presentación en cápsula), con 20 mg de paroxetina una vez al día, redujo el ABC aproximadamente 25% y la Cmax aproximadamente 20%, tanto de aprepitant como de paroxetina.
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
En estudios de náusea y vómito postoperatorio e inducido por quimioterapia se ha reportado un incremento de ALT (>1/100, <1/10). En estudios de náusea y vómito inducido por quimioterapia se reportaron reacciones secundarias poco comunes (>1/1,000, <1/100) de incremento en AST y fosfatasa alcalina en sangre. Las reacciones secundarias raras (> 1/10,000, <1/1,000) reportadas incluyeron presencia de eritrocitos en orina, reducción de sodio en sangre, presencia de glucosa en orina y disminución de la cuenta de neutrófilos (Ver REACCIONES SECUNDARIAS Y ADVERSAS).
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
EMEND IV para administración intravenosa es un profármaco liofilizado de aprepitant, que contiene polisorbato 80 (PS80).
EMEND IV 150 mg se administra solamente el Día 1 como una infusión durante 20-30 minutos, iniciando aproximadamente 30 minutos antes de la quimioterapia. EMEND IV debe administrarse al mismo tiempo que un corticosteroide y un antagonista 5-HT3, como se especifica en las tablas de abajo.
Se debe consultar el instructivo del antagonista 5-HT3 co-administrado antes de iniciar el tratamiento con EMEND IV 150 mg.
Dosis recomendada para la prevención de náusea y vómito asociados con la quimioterapia anticancerosa altamente emetogénica:
|
Día 1 |
Día 2 |
Día 3 |
Día 4 |
|
|
EMEND IV |
150 mg IV |
ninguna |
ninguna |
ninguna |
|
Dexametasona** |
12 mg por vía oral |
8 mg por vía oral |
8 mg por vía oral dos veces al día |
8 mg por vía oral dos veces al día |
|
Antagonista 5-HT3 |
Ver el inserto para seleccionar la dosis apropiada de antagonista 5-HT3 |
ninguna |
ninguna |
ninguna |
** La dexametasona debe administrase 30 minutos antes del tratamiento con quimioterapia en el Día 1 y por la mañana del Día 2 al 4. La dexametasona también debe administrase por las noches los Días 3 y 4. La dosis de dexametasona se eligió en virtud de las posibles interacciones farmacológicas.
Dosis recomendada para prevención de náusea y vómito asociados con la quimioterapia anticancerosa moderadamente emetogénica:
|
Día 1 |
|
|
EMEND IV |
150 mg IV |
|
Dexametasona** |
12 mg por vía oral |
|
Antagonista 5-HT3 |
Ver el inserto para seleccionar la dosis apropiada del antagonista 5-TH3 seleccionado |
** La dexametasona debe administrase 30 minutos antes del tratamiento de quimioterapia el Día 1. La dosis de dexametasona se eligió en virtud de las posibles interacciones farmacológicas.
Preparación de EMEND IV 150 mg para inyección
1. Inyectar 5 mL de solución salina en el frasco ámpula. Cuide que la solución salina escurra despacio por las paredes del frasco ámpula, para evitar la formación de espuma. Gire el frasco ámpula suavemente. No sacuda ni agite la solución salina dentro del frasco ámpula.
2. Prepare una bolsa de infusión con 145 mL de solución salina
3. Extraiga todo el volumen del frasco ámpula e inyéctelo en la bolsa de infusión que contiene 145 mL de solución salina para obtener un volumen total de 150 mL. Invierta la bolsa suavemente dos o tres veces.
La solución reconstituida final es estable por 24 horas a temperatura ambiente (a o por debajo de 25°C).
Los productos farmacéuticos parenterales deben someterse a inspección visual en busca de partículas flotantes y cambios de coloración antes de administrarlos, siempre que la solución y el recipiente lo permitan.
EMEND IV es incompatible con cualquier solución que contenga cationes divalentes (por ej., Ca2+, Mg2+), como la solución de Hartman y la solución de Ringer con lactato. EMEND IV no debe reconstituirse ni mezclarse con soluciones con las cuales no se haya demostrado su compatibilidad física y química.
INFORMACIÓN GENERAL
Véase INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO para mayor información sobre la administración de EMEND IV con corticosteroides.
Consulte la información para prescribir amplia para obtener información sobre la co-administración de fármacos antieméticos.
No es necesario ajustar la dosificación según la edad, género, raza o índice de masa Corporal (IMC).
No es necesario ajustar la dosificación en los pacientes con insuficiencia renal grave (depuración de creatinina <30 mL/min) ni en los pacientes con nefropatía terminal sometidos a hemodiálisis.
No es necesario ajustar la dosificación en los pacientes con insuficiencia hepática de leve a moderada (puntuación de Child-Pugh de 5 a 9). No hay datos clínicos relativos a los pacientes con insuficiencia hepática grave (puntuación de Child-Pugh mayor de 9).
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
No hay información específica sobre el tratamiento de las sobredosis. Las dosis únicas de hasta 200 mg de fosaprepitant I V y 600 mg de aprepitant fueron generalmente bien toleradas en los sujetos sanos. Tres de 33 sujetos que recibieron 200 mg de fosaprepitant presentaron trombosis leve en el sitio de la inyección. Aprepitant fue generalmente bien tolerado cuando se administró en dosis de 375 mg una vez al día a pacientes en estudios no relacionados con náusea y vómito inducidos por quimioterapia. En 33 pacientes con cáncer, la administración de una dosis única de 375 mg de aprepitant el Día 1 y de 250 mg una vez al día los Días 2 al 5 fue generalmente bien tolerada.
En un paciente que ingirió 1,440 mg de aprepitant se reportaron somnolencia y cefalea.
En caso de sobredosis, debe suspenderse el empleo de EMEND IV, dar tratamiento general de sostén y mantener al paciente bajo observación. Debido al efecto antiemético de aprepitant, el vómito inducido por medicamentos puede no ser efectivo.
El aprepitant no puede eliminarse mediante hemodiálisis.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
TOXICOLOGÍA EN ANIMALES
Toxicidad aguda
La dosis letal 50 (DL50) después de una dosis por vía oral de aprepitant fue >2,000 mg/kg en ratones y ratas hembras. La DL50 aproximada de fosaprepitant tras la administración intravenosa fue >500 mg/kg en ratones hembra y >200 mg/kg en ratas hembra.
Toxicidad crónica
El fosaprepitant, cuando se administra por vía intravenosa se convierte rápidamente en aprepitant.
La toxicidad potencial de aprepitant se evaluó en una serie de estudios de toxicidad por vía oral de dosis repetidas en ratas y en perros hasta por un año.
En las ratas, la administración por vía oral de aprepitant durante 6 meses, en dosis hasta la máxima factible de 1,000 mg/kg dos veces al día (aproximadamente equivalente [en las hembras] o más baja [en los machos] a la dosis para personas adultas basada en la exposición sistémica después de aprepitant por vía oral de 125 mg) produjo un aumento en el peso del hígado que se correlacionó con hipertrofia hepatocelular, un aumento en el peso de la tiroides que se correlacionó con hipertrofia o hiperplasia (o ambas) de las células foliculares tiroideas, y vacuolización de las células hipofisiarias. Estos efectos son una consecuencia de la inducción de las enzimas hepáticas del citocromo P450 en la rata, específica de la especie, y concuerdan con los cambios observados en las ratas con otros compuestos, disímiles en términos estructurales y farmacológicos, que han demostrado inducción de las enzimas hepáticas del citocromo P450.
En los perros que recibieron aprepitant por vía oral durante nueve meses en dosis ≥5 mg/kg dos veces al día (mayores o equivalentes a 13 veces la dosis para personas adultas con base en la exposición sistémica después de 125 mg de aprepitant por vía oral), la toxicidad se caracterizó por ligeros aumentos de la fosfatasa alcalina en el suero y disminuciones en la relación albúmina/globulina. Se observó una notable reducción en el aumento de peso corporal, degeneración testicular y atrofia prostática con dosis ≥25 mg/kg dos veces al día (mayores o equivalentes a 31 veces la dosis para personas adultas, con base en la exposición sistémica después de 125 mg de aprepitant por vía oral). Se observó un incremento ligero en el peso del hígado, sin correlaciones histológicas, con dosis de 500 mg/kg dos veces al día (70 veces la dosis para personas adultas, con base en la exposición sistémica después de 125 mg de aprepitant por vía oral). No se observó toxicidad alguna en los perros que recibieron dosis de 32 mg/kg/día (6 veces la dosis para personas adultas, con base en la exposición sistémica después de 125 mg de aprepitant por vía oral) durante un año.
Carcinogénesis
Se realizaron estudios de carcinogenicidad en ratones y ratas durante dos años con aprepitant por vía oral. Los ratones hembras desarrollaron adenomas hepatocelulares y/o carcinomas con dosis de 500 a 2,000 mg/kg/día y los ratones macho carcinomas hepatocelulares con dosis de 1,000 a 2,000 mg/kg/día. Con esas dosis la exposición sistémica fue aproximadamente 2.5 a 3.6 veces la exposición en humanos con las dosis recomendadas. Las ratas desarrollaron adenomas hepatocelulares con dosis de 5 a 1,000 mg/kg dos veces al día (en las hembras) y de 125 mg/kg dos veces al día (en los machos); carcinomas hepatocelulares con dosis de 125 a 1,000 mg/kg dos veces al día (hembras), adenomas foliculares tiroideos con dosis de 125 a 1,000 mg/kg dos veces al día (en las hembras y en los machos); y carcinomas foliculares tiroideos con dosis de 125 a 1,000 mg/kg dos veces al día (en los machos). Con esas dosis, la exposición sistémica en las ratas fue menor a o hasta aproximadamente dos veces la exposición en humanos con las dosis recomendadas. Los tumores tiroideos o hepáticos de estos tipos son una consecuencia de la inducción de las enzimas hepáticas del citocromo P450 en la rata, y concuerdan con los cambios observados en las ratas con otros compuestos disímiles en términos estructurales y farmacológicos que han demostrado inducción de las enzimas del citocromo hepático. No se realizaron estudios de carcinogenicidad con fosaprepitant.
Mutagénesis
Ni fosaprepitant ni aprepitant fueron mutagénicos ni genotóxicos en las pruebas realizadas para detectar mutagenicidad, rupturas de la cadena de ADN y aberraciones cromosómicas. Aprepitant no tuvo efecto alguno en el ensayo in vitro de mutagénesis microbiana y de las células linfoblastoides humanas TK6, ensayos de ruptura de la cadena de ADN en hepatocitos de rata en elución alcalina, ensayo de aberraciones cromosómicas en células de ovario de hámster Chino, y en la prueba in vivo de micronúcleos en médula ósea de ratón.
Reproducción
Fosaprepitant, cuando se administra por vía intravenosa, se convierte rápidamente en aprepitant. En los estudios de fertilidad realizados con fosaprepitant y con aprepitant, las exposiciones sistémicas más elevadas con aprepitant se lograron después de la administración por vía oral de aprepitant.
El aprepitant administrado a ratas hembra en dosis de hasta la máxima factible de 1,000 mg/kg dos veces al día (aproximadamente equivalente a la dosis para personas adultas con base en la exposición sistémica después de 125 mg de aprepitant por vía oral) no tuvo efecto alguno sobre el apareamiento, la fertilidad ni la supervivencia de los embriones y los fetos.
El aprepitant administrado a ratas macho en dosis de hasta la máxima factible de 1,000 mg/kg dos veces al día (menor que la dosis para personas adultas con base en la exposición sistémica después de 125 mg de aprepitant por vía oral) no tuvo efecto alguno sobre el apareamiento, la fertilidad, la supervivencia de los embriones y los fetos, el número y la movilidad de los espermatozoides, el peso de los testículos, ni el aspecto microscópico de los testículos y los epidídimos.
Desarrollo
El fosaprepitant, cuando se administra por vía intravenosa, se convierte rápidamente en aprepitant. En los estudios de teratología realizados con fosaprepitant y con aprepitant, las exposiciones sistémicas más elevadas con aprepitant se lograron después de la administración por vía oral de aprepitant.
En ratas y conejos que recibieron dosis por vía oral de aprepitant de hasta 1,000 mg/kg dos veces al día y 25 mg/kg/día, respectivamente (hasta 1.5 veces la exposición sistémica con la dosis para personas adultas después de 125 mg de aprepitant por vía oral), no hubo evidencia alguna de toxicidad del desarrollo, evaluada por la supervivencia de los embriones y los fetos, el peso corporal fetal y la morfología externa, visceral y esquelética de los fetos. Con esas dosis, aprepitant atravesó la placenta en las ratas y las conejas. Las concentraciones de aprepitant en el plasma fetal fueron cercanas al 27% y 56% de las concentraciones en el plasma materno en las ratas y las conejas, respectivamente.
Se observaron concentraciones significativas de aprepitant en la leche materna de las ratas que recibieron 1,000 mg/kg dos veces al día. Con esa dosis, la concentración promedio del medicamento en la leche fue del 90% de la concentración promedio en el plasma materno.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
Schering-Plough, S.A. de C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan, C.P. 16090, Deleg. Xochimilco, Ciudad de México, México.
XV. PRESENTACIÓN
Caja de cartón con 1 o 10 frascos ámpula con liofilizado cada uno con 150 mg de fosaprepitant e Instructivo anexo.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese en refrigeración entre 2°C y 8ºC. No se congele.
Una vez reconstituido el polvo se puede almacenar durante 24 horas a no más de 25°C.
XVII. LEYENDAS DE PROTECCIÓN
Su venta requiere receta médica.
No se deje al alcance de los niños.
El uso durante el embarazo y la lactancia quedan bajo la responsabilidad del médico.
Literatura exclusiva para médicos.
Reporte las sospechas de reacción adversa a: farmacovigilancia@cofepris.gob.mx y
dpoc.mexico@msd.com