
ERANZ
DONEPEZILO
Tabletas
1 Caja, 28 Tabletas, 10 mg
1 Caja, 28 Tabletas, 5 mg
1 Caja, 14 Tabletas, 5 mg
1 Caja, 14 Tabletas, 10 mg
1 Caja, 28 Tabletas, 10 mg
1 Caja, 14 Tabletas, 10 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Clorhidrato de donepezilo 5 y 10 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS:
Clorhidrato de donepezilo está indicado para el tratamiento sintomático de la demencia leve, moderadamente severa y severa del tipo Alzheimer. El diagnóstico de demencia tipo Alzheimer debe realizarse de acuerdo a pautas aceptadas (ejemplo, DSM IV, ICD 10).
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
Absorción:
Aproximadamente 3-4 horas después de la administración oral se alcanzan los niveles plasmáticos máximos. Las concentraciones plasmáticas y área bajo la curva aumentan en proporción con las dosis. La vida media de disposición terminal es aproximadamente de 70 horas. Por lo que la administración de múltiples dosis únicas diarias tiene como resultado una aproximación gradual al estado estacionario. El estado estacionario se alcanza 2 a 3 semanas después de iniciar la terapia. Una vez logrado el estado estacionario, las concentraciones plasmáticas de clorhidrato de donepezilo y actividad farmacodinámica relacionada muestran poca variación en el curso del día.
Los alimentos no afectaron la absorción de clorhidrato de donepezilo.
Distribución:
Donepezilo se une aproximadamente un 95% a proteínas plasmáticas humanas. En un estudio de equilibrio de masa realizado en voluntarios varones sanos, 240 horas después de la administración de una dosis única de 5 mg de clorhidrato de donepezilo radiomarcado con 14C, aproximadamente 28% del material radiomarcado no se recuperó. Esto sugiere que donepezilo y/o sus metabolitos pueden persistir en el organismo durante más de 10 días.
Metabolismo y excreción:
Donepezilo se metaboliza por vía hepática y la vía de eliminación predominante tanto del fármaco base como de sus metabolitos es renal, ya que el 79% de la dosis recuperada se encontró en la orina con el 21% restante en heces. Además, el compuesto base, donepezilo, es el producto de eliminación predominante en la orina. Los principales metabolitos de donepezilo incluyen M1 y M2 (por O-desalquilación e hidroxilación), M11 y M12 (vía glucuronidación de M1 y M2, respectivamente), M4 (vía hidrólisis) y M6 (vía N-oxidación).
Las concentraciones plasmáticas de donepezilo disminuyen con una vida media de aproximadamente 70 horas.
El género, raza y antecedentes de tabaquismo no tienen influencia clínicamente significativa sobre las concentraciones plasmáticas de donepezilo. La farmacocinética de donepezilo en pacientes con Alzheimer es cercana a la de los voluntarios sanos.
Se encontró una relación entre el peso corporal y la eliminación. En el rango de peso corporal y la eliminación. En el rango de peso corporal de 50 kg a 110 kg, la eliminación se incrementa de 7.77 L/h, con un valor de 10 L/hr para individuos de 70 kg.
Propiedades farmacodinámicas:
El clorhidrato de donepezilo es un inhibidor selectivo y reversible de la acetilcolinesterasa, la colinesterasa predominante en el cerebro. El clorhidrato de donepezilo es 1000 veces más potente, un inhibidor de esta enzima, que de la butirilcolinesterasa, una enzima que está presente principalmente fuera del sistema nervioso central.
Enfermedad de Alzheimer leve a moderamente severa:
En pacientes con demencia de Alzheimer que participaron en estudios clínicos, la administración de dosis únicas diarias de 5 mg o 10 mg de clorhidrato de donepezilo, produjeron una inhibición en estado estable de la actividad de la acetilcolinesterasa (medida en membranas de eritrocitos) de 63.6 y 77.3%, respectivamente. La inhibición de la acetilcolinesterasa (AChE) en eritrocitos por donepezilo ha mostrado estar correlacionada con cambios en ADAS-Cog, una escala sensible que analiza aspectos seleccionados de la cognición. El potencial de donepezilo para alterar el curso de la neuropatología subyacente no ha sido estudiado.
Estudios clínicos:
En los ensayos clínicos de pacientes con enfermedad de Alzheimer leve a moderadamente severa, se llevo a cabo un análisis al término de 6 meses de tratamiento con clorhidrato de donepezilo utilizando.
3 criterios de eficacia combinados: La escala ADAS-Cog, impresión del Cambio Basada en la Entrevista con el Médico con Información Aportada por el cuidador (CIBIC-plus, por sus siglas en inglés: una medida de la función global) y las actividades combinadas de los Campos de la Vida Cotidiana de la Escala de Clasificación de Demencia Clínica (CDR, por sus siglas en inglés, una medida de las capacidades en asuntos de la comunidad, hogar y pasatiempos y cuidados personales).
Los pacientes que cumplieron con los criterios abajo listados se consideraron respondedores al tratamiento.
Respuesta = mejora en ADAS-Cog por lo menos de 4 puntos.
Sin deterioro en el puntaje CIBIC-Plus.
Sin deterioro en Actividades Combinadas de los Campos de la Vida Cotidiana de la CDR.
|
Grupo de tratamiento |
% de respuesta |
|
|
Población de intención a tratar n = 365 |
Población de evaluación |
|
|
Placebo |
10% |
10% |
|
Donepezilo 5 mg |
18%* |
18%* |
|
Donepezilo 10 mg |
21%* |
22%** |
* p < 0.05; ** p < 0.01
El clorhidrato de donepezilo produjo un incremento estadísticamente significativo dependiente de la dosis en el porcentaje de pacientes que se consideraron como pacientes que respondieron al tratamiento (Figura 1). Los porcentajes de los pacientes aleatorizados que completaron el estudio fueron: placebo 80%, 5 mg/día 85% y 10 mg/día 86%.
Figura 1. Porcentaje acumulado de pacientes que terminaron el tratamiento doble ciego de 24 semanas con cambios especificados respecto a las puntuaciones ADAS-Cog basales
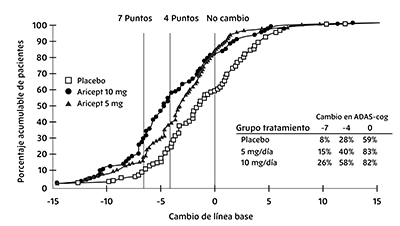
Las curvas demuestran que, tanto los pacientes asignados a placebo como a clorhidrato de donepezilo, tienen diversas respuestas, pero que los grupos de tratamiento activo tienen más probabilidad de mostrar mejorías más notorias. Una curva de un tratamiento eficaz cambiaría hacia la izquierda de la curva para placebo, en tanto que un tratamiento ineficaz o nocivo se sobrepondría o cambiaría hacia la derecha de la curva para placebo, respectivamente.
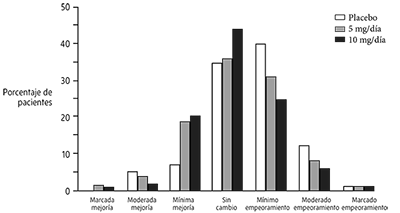
La Figura 2 es un histograma de la frecuencia de distribución de las puntuaciones CIBIC-Plus que alcanzaron los pacientes asignados a cada uno de 3 grupos de tratamiento que terminaron 24 semanas de tratamiento.
Las diferencias promedio entre el fármaco y placebo para estos grupos de pacientes fueron 0.35 unidades y 0.39 unidades para los grupos clorhidrato de donepezilo 5 mg/día y 10 mg/día, respectivamente.
Las diferencias fueron estadísticamente significativas. No hubo ninguna diferencia estadísticamente significativa entre los 2 tratamientos activos.
Figura 2. Frecuencia de distribución de puntuaciones CIBIC-plus en la semana 24 del tratamiento con el clorhidrato de donepezilo
Enfermedad de Alzheimer severa:
Estudio sueco de 6 meses de duración:
Se demostró la efectividad del tratamiento con clorhidrato de donepezilo para el Alzheimer severo, por medio de los resultados de un estudio aleatorizado, doble ciego, con placebo controlado, que se llevó a cabo en Suecia (estudio de seis meses de duración) en pacientes con enfermedad de Alzheimer probable o posible, diagnosticada mediante los criterios de NINCDS-ADRDA y DSM-IV, con un rango de MMSE (Examen Mini Mental) de 1-10. Doscientos cuarenta y ocho pacientes (248) con enfermedad de Alzheimer severa fueron aleatorizados a los grupos de tratamiento de clorhidrato de donepezilo o al placebo. Para los pacientes asignados al grupo de tratamiento de clorhidrato de donepezilo, el tratamiento se inició en 5 mg una vez al día por 28 días y después se incrementó a 10 mg una vez al día. Al final del periodo de seis meses de tratamiento, el 90.5% de los pacientes tratados con clorhidrato de donepezilo estaban recibiendo la dosis de 10 mg. La edad promedio de los pacientes era de 84.9 años con un rango de 59 a 99. Aproximadamente el 77% de los pacientes eran mujeres y el 23% eran hombres. Casi todos los pacientes eran caucásicos. La probable EA fue diagnosticada en la mayoría de los pacientes (83.6% de los pacientes tratados con clorhidrato de donepezilo y el 84.2% de los pacientes tratados con el placebo).
Medidas de resultados del estudio: La efectividad del tratamiento con clorhidrato de donepezilo se determinó mediante una estrategia doble de evaluación de resultados, que evaluó la función cognitiva, mediante un instrumento diseñado para los pacientes más deteriorados y evaluó la función general mediante una evaluación de puntaje asignado por el cuidador. Este estudio mostró que los pacientes tratados con clorhidrato de donepezilo experimentaron una mejoría significativa en ambas medidas comparados con los que recibieron el placebo.
La habilidad del clorhidrato de donepezilo para mejorar el desempeño cognitivo se evaluó mediante la Batería de Discapacidad Severa (SIB, por sus siglas en inglés). La SIB, un instrumento multiítem, ha sido validado para la evaluación de la función cognitiva en pacientes con demencia moderadamente severa a severa. La SIB evalúa aspectos selectos del desempeño cognitivo, incluyendo elementos de memoria, lenguaje, orientación, atención, praxias, habilidad visual-espacial, construcción e interacción social. El rango de puntaje de la SIB es de 0 a 100, los puntajes menores indican una discapacidad cognitiva mayor.
La funcionalidad diaria se evaluó usando el Inventario de las Actividades de la Vida Diaria para la Enfermedad de Alzheimer Severa del Estudio Cooperativo Modificado para la Enfermedad de Alzheimer (ADCS-ADL-grave). La escala ADCS-ADL-grave se deriva del Estudio Cooperativo del Inventario de las Actividades de la Vida Diaria, que es una comprensiva batería de preguntas de ADL que se usan para medir las capacidades funcionales de los pacientes. Cada punto del ADL se califica a partir del nivel más alto de desempeño hasta la pérdida completa. La escala ADCS-ADL-grave es un subconjunto de 19 puntos, que incluye los puntajes de la habilidad del paciente para comer, vestirse, bañarse, usar el teléfono, moverse (o viajar) y llevar a cabo otras actividades de la vida diaria, esta escala se ha validado para la evaluación de pacientes con demencia moderada o moderadamente severa. La escala ADCS-ADL-grave tiene un rango de 0 a 54 en el que los puntajes más bajos indican una discapacidad funcional menor. El investigador lleva a cabo el inventario al entrevistar al cuidador, en este estudio, un enfermero (a), miembro del personal, que esté familiarizado con el funcionamiento del paciente.
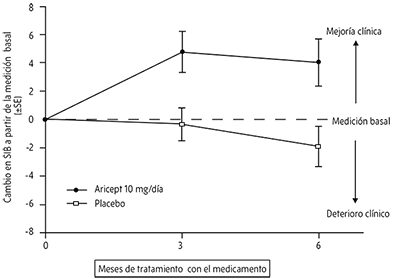
Efectos en el SIB: La Figura 3 muestra el tiempo transcurrido desde la medición basal en el puntaje SIB para los dos grupos de tratamiento en los 6 meses del estudio. A los 6 meses del tratamiento, la diferencia media en los puntajes de cambio de SIB para los pacientes tratados con clorhidrato de donepezilo, comparados con los pacientes que recibieron el placebo fue de 5.9 unidades. El tratamiento ARICEPT fue estadística y significativamente superior al placebo.
Figura 3. Tiempo transcurrido de los cambios desde la basal en la puntuación de la SIB para los pacientes que completaron los 6 meses de tratamiento
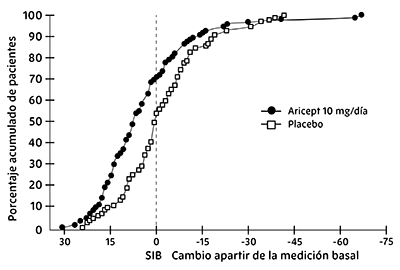
La Figura 4 ilustra los porcentajes acumulados de pacientes de cada uno de los dos grupos de tratamiento que alcanzaron la medida de mejoría en la puntuación de la SIB mostrada en el eje de X. Mientras los pacientes asignados tanto a donepezilo como a placebo tuvieron un amplio rango de respuestas, las curvas muestran que el grupo de clorhidrato de donepezilo es más probable que muestre una mayor mejoría en el desempeño cognitivo.
Figura 4. Porcentaje acumulado de pacientes con cambios en puntajes SIB después del tratamiento con clorhidrato de donepezilo
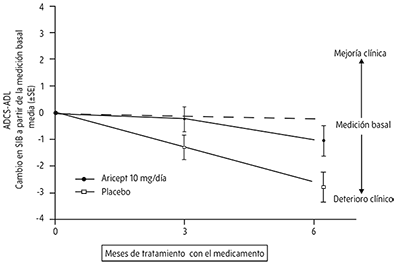
Efectos en la escala ADCS-ADL-severa: La Figura 5 ilustra el tiempo transcurrido para el cambio desde la medición basal en los puntajes de ADCS-ADL-grave para los pacientes en los dos grupos de tratamiento en los 6 meses del estudio. Después de 6 meses de tratamiento, la diferencia media en los puntajes de cambio de ADCS-ADL-grave para clorhidrato de donepezilo comparados con los pacientes que recibieron el placebo fue de 1.8 unidades. El tratamiento con ARICEPT fue estadística y significativamente superior al placebo.
Figura 5. Tiempo transcurrido para el cambio desde la basal en la puntuación de ADCS-ADL-grave
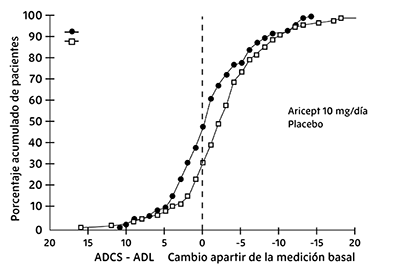
La Figura 6 muestra los porcentajes acumulados de pacientes de cada grupo de tratamiento con cambios especificados desde las puntuaciones ADCS-ADL-grave basales. Mientras tanto, los pacientes asignados a clorhidrato de donepezilo como a placebo tuvieron un amplio rango de respuestas, las curvas muestran que el grupo de clorhidrato de donepezilo es más probable a muestrar un decremento menor o una mejoría.
Figura 6. Porcentaje acumulado de pacientes con cambios en los puntajes ADL tras el tratamiento con clorhidrato de donepezilo
 Estudio japonés de 24 semanas:
Estudio japonés de 24 semanas:
En un estudio de 24 semanas de duración, realizado en Japón, se aleatorizaron 325 pacientes con enfermedad de Alzheimer severa a dosis de 5 mg/día o 10 mg/día de donepezilo, administrado una vez al día o placebo. Los pacientes aleatorizados a tratamiento con clorohidrato de donepezilo tenían que alcanzar sus dosis asignadas mediante ajuste de la misma, empezando con 3 mg/día y extendiéndose durante un máximo de 6 semanas. Doscientos cuarenta y ocho pacientes completaron el estudio con proporciones similares de pacientes en cada grupo de tratamiento. Las medidas primarias de eficacia para este estudio fueron la SIB y CIBIC plus.
A las 24 semanas de tratamiento, se observaron diferencias de tratamiento estadísticamente significativas entre la dosis de 10 mg/día de donepezilo y placebo en SIB y CIBIC plus. La dosis de 5 mg/día de donepezilo mostró una superioridad con significancia estadística versus placebo en la SIB pero no en la CIBIC plus.
Estudio multinacional en pacientes con EA severa:
Se realizó un estudio multinacional, multicéntrico, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos de 24 semanas en pacientes con enfermedad de Alzheimer severa. Se aleatorizaron un total de 343 pacientes, 176 a clorhidrato de donepezilo y 167 a placebo. Los pacientes recibieron 5 mg diarios de donepezilo (liberación inmediata) seguidos de 10 mg diarios de donepezilo durante el resto de la fase doble ciego del estudio.
El clorhidrato de donepezilo fue significativamente superior a placebo en la puntuación de la SIB en el punto final para ambas poblaciones ITT LOCF (diferencia media en LS de 5.32 puntos; P = 0.0001). En la CIBIC-plus, pacientes, la diferencia favoreció al tratamiento con donepezilo pero no alcanzó una diferencia estadística (P = 0.0905). Sin embargo, después de colapsar la escala de 7 puntos a una escala de 3 puntos (mejoró, sin cambio o empeoró), se encontraron diferencias estadísticamente significativas que favorecieron al grupo donepezilo comparado con el grupo placebo para ambas poblaciones ITT LOCF (P = 0.0156).
CONTRAINDICACIONES:
ERANZ está contraindicado en pacientes con hipersensibilidad conocida al clorhidrato de donepezilo, a los derivados de la piperidina, o cualquier excipiente utilizado en la formulación.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
Los estudios teratológicos llevados a cabo en ratas preñadas, a dosis hasta 35 veces la dosis humana (con base en la masa corporal) y conejas preñadas a dosis aproximadamente 22 veces la dosis máxima humana aprobada, no revelaron ninguna evidencia de potencial teratógeno. Sin embargo, en un estudio en el que se administró una dosis 22 veces la dosis humana a ratas preñadas a partir del día 17 de gestación al día 20 posparto, hubo un ligero incremento en mortinatos y una ligera disminución en la supervivencia de las crías hasta el día 4 del posparto. No se observó ningún efecto en la siguiente dosis más baja estudiada, aproximadamente 6.5 veces la dosis humana.
No se cuenta con estudios adecuados o bien controlados en mujeres embarazadas. El clorhidrato de donepezilo debe usarse durante el embarazo solamente si el beneficio potencial justifica el riesgo potencial para el feto.
Lactancia:
No se sabe si clorhidrato de donepezilo es excretado en la leche humana y no existen estudios en mujeres en etapa de lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS:
Eventos adversos en estudios clínicos:
Los eventos adversos más comunes (incidencia > 5% y el doble de la frecuencia de placebo en los pacientes que recibieron 10 mg/día) fueron diarrea, calambre musculares, fatiga, náusea, vómito e insomnio. (Tabla 1).
Otros eventos adversos comunes (incidencia > 5% y > placebo) fueron cefalea, dolor, accidente, resfriado común, malestar abdominal y mareo. Se observaron casos de síncope, bradicardia, bloqueo sinoauricular y auriculoventricular. A excepción de incrementos menores en las concentraciones séricas de creatinina cinasa muscular, no se observaron anomalías notables en los valores de laboratorio asociado con el tratamiento.
Tabla 1. Eventos adversos reportados en estudios clínicos controlados en enfermedad de alzheimer de moderada a moderadamente severa en, por lo menos 2% de los pacientes que recibieron clorhidrato de donepezilo y con una frecuencia más alta que los pacientes tratados con placebo.
|
Sistema corporal/evento adverso |
Placebo |
Donepezilo |
|---|---|---|
|
Porcentaje de pacientes con cualquier evento adverso |
72% |
74% |
|
Cuerpo como un todo |
||
|
Cefalea |
9% |
10% |
|
Dolor, varios lugares |
8% |
9% |
|
Accidente |
6% |
7% |
|
Fatiga |
3% |
5% |
|
Sistema cardiovascular |
||
|
Síncope |
1% |
2% |
|
Sistema digestivo |
||
|
Náuseas |
6% |
11% |
|
Diarrea |
5% |
10% |
|
Vómitos |
3% |
5% |
|
Anorexia |
2% |
4% |
|
Sistema musculoesquelético |
||
|
Calambres musculares |
2% |
6% |
|
Sistema nervioso |
||
|
Insomnio |
6% |
9% |
|
Mareo |
6% |
8% |
|
Sistema psiquiátrico |
||
|
Sueños anormales |
0% |
3% |
Fuente: [información autorizada EE. UU.]
Enfermedad de Alzheimer severa:
Los eventos adversos más comunes (incidencia ≥ 5% y el doble de frecuencia del placebo) fueron diarrea, náusea y agresión.
Tabla 2. Los eventos adversos reportados en los estudios clínicos controlados en enfermedad de Alzheimer severa en por lo menos 5% de los pacientes que reciben clohidrato de donepezilo y a una mayor frecuencia que los pacientes tratados con placebo
|
Sistema corporal/evento adverso |
Donepezilo (N = 573, 477 aleatorizado a 10 mg, 96 aleatorizado a 5 mg) % |
Placebo (N = 465) % |
|
Número total de pacientes con un evento adverso (todas las causas) |
80.8 |
74.0 |
|
Diarrea |
10.3 |
4.1 |
|
Caída |
10.1 |
8.8 |
|
Infección urinaria |
8.2 |
7.1 |
|
Nasofaringitis |
8.2 |
6.2 |
|
Vómito |
7.5 |
3.9 |
|
Agitación |
6.3 |
6.5 |
|
Náusea |
5.6 |
2.6 |
|
Cefalea |
5.1 |
3.0 |
|
Agresión |
5.1 |
2.4 |
Experiencia poscomercialización:
Se han reportado alucinaciones, agitación, comportamiento agresivo, crisis convulsivas, hepatitis, úlcera gástrica, úlcera duodenal y hemorragia gastrointestinal después de la comercialización del producto.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Extensas pruebas en animales experimentales han demostrado que el clorhidrato de donepezilo causa pocos efectos que no sean los efectos farmacológicos pretendidos, consistentes con su acción como un inhibidor de colinesterasa.
Mutagenicidad:
Clorhidrato de donepezilo no es genotóxico en ensayos de mutación inversa bacteriana y linfoma TK de ratón. En un ensayo in vitro de aberración cromosómica, se observaron algunos efectos clastogénicos en concentraciones evidentemente tóxicas para las células y 3,000 veces mayores a las concentraciones plasmáticas de estado estable producidas por la dosis de 10 mg/día. Sin embargo, no se observó ningún potencial clastogénico en el modelo in vivo del micronúcleo de ratón y en el ensayo UDS (Unscheduled DNA synthesis, por sus siglas en inglés) in vivo/in vitro no se observó daño al ADN.
En resumen, el donepezilo resultó negativo en una batería de análisis de genotoxicidad (ensayos de mutación bacteriana reversa y linfoma TK de ratón, aberración cromosómica in vitro y aberración cromosómica in vitro y micronúcleo del modelo in vivo).
Carcinogenicidad:
No se obtuvo evidencia de potencial carcinogénico en un estudio de carcinogenicidad de 88 semanas de clorhidrato de donepezilo realizado en ratones CD-1 a dosis hasta de 180 mg/kg/día (aproximadamente 39 veces la dosis humana máxima recomendada en base a mg/m2) o en un estudio de carcinogenicidad de 104 semanas en ratas Sprague-Dawley a dosis hasta de 30 mg/kg/día (aproximadamente 13 veces la máxima dosis humana recomendada en base a mg/m2).
Fertilidad:
Clorhidrato de donepezilo no tiene ningún efecto sobre la fertilidad a dosis hasta de 10 mg/kg/día (aproximadamente 4 veces la máxima dosis humana recomendada en mg/m2) cuando se administró a hembras y machos antes y durante el apareamiento y que se continuó en las hembras durante la implatación. Clorhidrato de donepezilo no fue teratogénico en las ratas o conejos. Clorhidrato de donepezilo tuvo un ligero efecto en los mortinatos y supervivencia temprana de las crías cuando se administró a ratas preñadas a dosis hasta de 10 mg/kg/día (ver sección Precauciones o Restricciones de uso durante el embarazo y lactancia).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GENÉRO:
Debe evitarse la administración concomitante de clorhidrato de donepezilo con otros inhibidores de colinesterasa.
Clorhidrato de donepezilo y sus metabolitos no inhiben el metabolismo de teofilina, warfarina, cimetidina, digoxina, tioridazina, risperidona y sertralina en humanos.
El metabolismo de clorhidrato de donepezilo no se ve afectado por la administración concomitante de digoxina, cimetidina, tioridazina, risperidona y sertralina. En un estudio de pacientes con enfermedad de Parkinson bajo tratamiento óptimo con L-dopa/carbidopa, la administración de clorhidrato de donepezilo durante 21 días no tuvo efectos sobre los niveles sanguíneos de L-dopa o carbidopa. En este estudio, no se observaron efectos sobre la actividad motora. Estudios in vitro han mostrado que las izoenzimas 3A4 del citocromo P450 y a un grado menor las 2D6 participan en el metabolismo del donepezilo. Estudios de interacciones medicamentosas realizados in vitro muestran que ketoconazol y quinidina, inhibidores de CYP3A4 y 2D6, respectivamente, inhiben el metabolismo del clorhidrato de donepezilo. Por lo tanto, éstos y otros inhibidotes del CYP3A4, como itroconazol y eritromicina, e inhibidores de CYP2D6, como fluoxetina, pueden inhibir el metabolismo de donepezilo. En un estudio en voluntarios sanos, ketoconazol aumentó las concentraciones promedio de donepezilo en casi un 30%. Estos incrementos son más pequeños que aquellos producidos por ketoconazol para otros compuestos que comparten la vía CYP3A4. La administración de donepezilo no tuvo ningún efecto sobre la farmacocinética de ketoconazol.
Se hizo un estudio complementario sobre la influencia del CYP2D6 en la eliminación del donepezilo, mediante un análisis farmacocinético poblacional en un estudio clínico controlado de donepezilo de 10 mg y de 23 mg en pacientes con enfermedad de Alzheimer de moderadamente severa a severa. En la base de datos de farmacocinética para el estudio 326, 31 pacientes fueron clasificados como metabolizadores lentos, 508 como metabolizadores rápidos, 13 como metabolizadores ultrarrápidos y en 298 pacientes el fenotipo CYP2D6 no se clasificó. El subtipo más amplio fue el grupo de metabolizadores rápidos, que se utilizó como grupo de referencia. Se observaron pequeñas diferencias en los valores de eliminación dentro de los subgrupos del CYP2D6. En comparación con los metabolizadores rápidos, el grupo de metabolizadores lentos presentó una eliminación 31.5% más baja y el grupo de metabolizadores ultrarrápidos una eliminación 24% más alta. Aunque las diferencias entre los grupos fueron relativamente pequeñas, los resultados indican que el donepezilo se elimina parcialmente mediante el metabolismo del CYP2D6. En general, estos resultados sugieren que el CYP2D6 no contribuye significativamente al metabolismo del donepezilo.
Basándose en los estudios in vitro, la evidencia de que el donepezilo actúe como inhibidor directo de CYP2B6, CYP2C8 y CYP2C19 en concentraciones de importancia clínica es poca o nula.
Los inductores de enzimas, como rifampicina, fenitoína, carbamacepina y alcohol, pueden reducir los niveles de donepezilo. Debido a que se desconoce la magnitud de un efecto de inhibición o inducción, dichas combinaciones de fármacos deben utilizarse con precaución. El clorhidrato de donepezilo posee el potencial para interferir con medicamentos con actividad anticolinérgica. También existe el potencial para una actividad sinérgica con el tratamiento concomitante que incluya dichos medicamentos como succinilcolina y otros compuestos bloqueadores neuromusculares, pero un estudio in vitro mostró que el clorhidrato de donepezilo tuvo efectos mínimos sobre la hidrólisis de succinilcolina. También existe el potencial para una actividad sinérgica con agonistas colinérgicos o compuestos betabloqueadores que tienen efectos sobre la conducción cardiaca.
En un estudio in vitro el donepezilo no fue un sustrato de la P-glicoproteína.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
No se observaron anormalidades notorias en los valores de laboratorio asociados al tratamiento, excepto por incrementos menores en las concentraciones séricas de creatinina cinasa en el músculo.
PRECAUCIONES GENERALES:
Anestesia:
El clorhidrato de donepezilo, como inhibidor de la colinesterasa, puede intensificar la relajación muscular del tipo de la succinilcolina durante la anestesia. (Ver sección Interacciones medicamentosas y de otro género).
Padecimientos cardiovasculares:
Debido a su acción farmacológica, los inhibidores de la colinesterasa pueden tener efectos vagotónicos sobre la frecuencia cardíaca (ejemplo: bradicardia). El potencial para esta actividad puede ser particularmente importante para pacientes con síndrome de nodo enfermo u otros padecimientos de conducción cardiaca supraventricular, tales como bloqueo sinoauricular o auriculoventricular.
Padecimientos gastrointestinales:
Los colinomiméticos pueden estimular la producción de ácido gástrico. Por lo tanto, los pacientes deberán ser monitoreados estrechamente por síntomas de sangrado intestinal activo u oculto, en especial aquellos que tengan un alto riesgo de desarrollar úlceras, por ejemplo: aquellos con antecedentes de úlcera o que reciben fármacos antiinflamatorios no esteroideos (AINE) concurrentes. Los estudios clínicos de clorhidrato de donepezilo a una dosis de 5 mg/día a 10 mg/día no mostraron ningún incremento, relativo a placebo, en la incidencia ya fuese de enfermedad de úlcera péptica o sangrado gastrointestinal.
Padecimientos neurológicos:
Se cree que los colinomiméticos poseen cierto potencial para causar crisis convulsivas generalizadas. Sin embargo, la actividad de las crisis convulsivas también puede ser una manifestación de la enfermedad de Alzheimer.
Padecimientos pulmonares:
Debido a sus acciones colinomiméticas, los inhibidores de la colinesterasa deben ser prescritos con cautela a pacientes con una historia familiar de asma o de enfermedad pulmonar obstructiva.
Efectos en la habilidad para manejar y operar maquinaria:
La demencia puede provocar una disminución en la capacidad de manejar o puede comprometer la habilidad de operar maquinaria. Lo que es más, clorhidrato de donepezilo puede provocar fatiga, vértigo y calambres musculares, principalmente cuando se inicia el tratamiento o se incrementa la dosis.
DOSIS Y VÍA DE ADMINISTRACIÓN:
El clorhidrato de donepezilo deberá tomarse por vía oral. Una vez al día. Las dosis clínicamente efectivas en la población de pacientes con padecimientos leves a moderadamente severos es de 5 y 10 mg.
El tratamiento debe iniciarse con 5 mg/día y se puede incrementar a 10 mg después de 4 a 6 semanas.
Tratamiento de mantenimiento:
El tratamiento de mantenimiento se puede continuar tanto tiempo como exista beneficio terapéutico para el paciente.
Al suspender el tratamiento, se observa una disminución gradual de los efectos benéficos del clorhidrato de donepezilo. No existe evidencia de un efecto de rebote o abstinencia tras la suspensión abrupta del tratamiento.
Insuficiencia renal y hepática:
En pacientes con insuficiencia renal o hepática de leve a moderada puede seguirse un esquema de dosis similar debido a que estos padecimientos no afectan significativamente la depuración de clorhidrato de donepezilo.
Niños:
No existen estudios adecuados y bien controlados que documenten la seguridad y eficacia de clorhidrato de donepezilo en cualquier enfermedad que ocurra en niños.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Datos de estudio en animales:
La dosis promedio letal estimada o dosis letal de clorhidrato de donepezilo después de la administración de una dosis oral única en ratones, ratas y perros es 45, 32 y 15 mg/kg, respectivamente, o aproximadamente 98, 70 y 33 veces la dosis máxima recomendada en humanos de 23 mg al día. En animales se observaron signos de estimulación colinérgica relacionados con la dosis, e incluyeron respuesta reducida al movimiento espontáneo, posición prona, marcha tambaleante, lagrimeo, crisis convulsivas clónicas, respiración deprimida, salivación, miosis, fasciculación, tremores (temblores) y temperatura superficial corporal disminuida.
Síntomas de sobredosis:
La sobredosis con los inhibidores de colinesterasa pueden tener como consecuencia crisis colinérgicas, caracterizadas por náusea, vómito, salivación, sudación, bradicardia, hipotensión, depresión respiratoria, colapso y convulsiones severas. La debilidad muscular aumentada es una que puede tener como resultado la muerte si se ven afectados los músculos respiratorios.
Tratamiento:
Como en cualquier caso de sobredosis, deben utilizarse medidas de apoyo generales. Los anticolinérgicos terciarios, como atropina, pueden ser eficaces para una sobredosis de clorhidrato de donepezilo. Se desconoce si el clorhidrato de donepezilo y/o sus metabolitos pueden ser eliminados por diálisis (hemodiálisis, diálisis peritoneal o hemofiltración).
PRESENTACIONES:
Caja con 14 o 28 tabletas de 5 mg.
Caja con 14 o 28 tabletas de 10 mg.
RECOMENDACIONES SOBRE EL ALMACENAMIENTO:
Consérvese a temperatura ambiente a no más de 30 °C.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No se deje al alcance de los niños. Su venta requiere receta médica. No se use en el embarazo y la lactancia.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
MEX.AEReporting@pfizer.com
PFIZER, S.A. DE C.V.
Km. 63 Carretera México-Toluca.
Zona Industrial, C.P. 50140.
Toluca, México, México.
Reg. Núm. 386M97 SSA
Clave de IPP: 173300415N0173
®Marca Registrada