ERELZI
ETANERCEPT
Solución
1 Caja, 2 Jeringa(s) prellenada(s), 0.5 mL, 25/0.5 mg/ml
1 Caja, 2 Jeringa(s) prellenada(s), 1 ml, 50 mg/ml
1 Caja, 2 Pluma precargada, 1 ml, 50 mg/ml
1 Caja, 4 Jeringa(s) prellenada(s), 0.5 ml, 25/0.5 mg/ml
1 Caja, 4 Jeringa(s) prellenada(s), 1 ml, 50 mg/ml
1 Caja, 4 Pluma precargada, 1 ml, 50 mg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
La jeringa prellenada contiene:
Etanercept 50 mg o 25 mg
Vehículo cbp 1 mL o 0.5 mL
La pluma precargada contiene:
Etanercept 50 mg
Vehículo cbp 1 mL
Proteína de fusión del receptor del factor de necrosis tumoral humano y la porción Fc de la IgG1 humana de origen ADN recombinante expresado en células de ovario de hámster chino (CHO)
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por 25 mg o 50 mg
INDICACIONES TERAPÉUTICAS:
Artritis reumatoide: Etanercept está indicado para reducir signos y síntomas en pacientes con artritis reumatoide (AR) activa moderada a severa e inhibir la progresión del daño estructural de la articulación. Etanercept puede iniciarse en combinación con metotrexato o utilizarse solo.
Etanercept puede utilizarse solo o en combinación con metotrexato para el tratamiento de AR activa en adultos cuando la respuesta a uno o más medicamentos antirreumáticos modificadores de enfermedad (FARME), incluyendo metotrexato (a menos que esté contraindicado), ha demostrado ser inadecuada.
Artritis idiopática juvenil: En el tratamiento de artritis idiopática juvenil de curso poliarticular (AI J) en niños y adolescentes desde los 4 años de edad cuando la respuesta a uno o más FARME ha demostrado ser inadecuada.
Artritis psoriásica: Etanercept está indicado para reducir signos y síntomas e inhibir la progresión del daño estructural de la artritis activa en pacientes con artritis psoriásica. Etanercept puede usarse en combinación con metotrexato en pacientes adultos que no responden adecuadamente a metotrexato como agente único.
Espondilitis anquilosante: Etanercept está indicado para reducir signos y síntomas en pacientes con espondilitis anquilosante.
Psoriasis en placa: Etanercept está indicado en el tratamiento de psoriasis en placas de moderada a severa en adultos (18 años o mayores) que son candidatos para tratamiento sistémico o fototerapia.
Psoriasis en placas pediátrica: Etanercept está indicado para el tratamiento de la psoriasis en placas crónica severa, en niños y adolescentes desde la edad de 6 años que son controlados inadecuadamente por, o son intolerantes a otras terapias sistémicas o fototerapias.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Inmunosupresores, inhibidores del factor de necrosis tumoral alfa (TNF-α). Código ATC: L04AB01.
ERELZI es un medicamento biocomparable o biosimilar.
Etanercept se une específicamente al factor de necrosis tumoral (TNF) y bloquea su interacción con receptores de TNF de la superficie celular. Etanercept no indujo citólisis mediada por complemento de linfocitos T murinos que expresan TNF en la superficie celular. El TNF es una citocina de origen natural que participa en las respuestas inmunitarias e inflamatorias normales. TNF es una citocina dominante en el proceso inflamatorio de la artritis reumatoide. También se encuentran niveles elevados de TNF en la membrana sinovial y las placas psoriásicas de pacientes con artritis psoriásica y en suero y sinovial tejido de pacientes con espondilitis anquilosante. En la psoriasis en placas, la infiltración por células inflamatorias, incluidas las células T, conduce a niveles aumentados de TNF en las lesiones psoriásicas, en comparación con los niveles en la piel no afectada.
Dos receptores distintos para TNF (TNFR), una proteína de 55 kilodalton (p55) y una proteína de 75 kilodalton (p75), existen de forma natural como moléculas monoméricas en las superficies celulares y en formas solubles. La actividad biológica del TNF depende de la unión al TNFR de la superficie celular. Etanercept es una forma soluble dimérica del receptor de TNF p75 que puede unirse a dos moléculas de TNF. Inhibe la actividad del TNF in vitro y se ha demostrado que afecta a varios modelos animales de inflamación, incluida la artritis inducida por colágeno murino. Etanercept inhibe la unión de TNFα y TNFβ (linfotoxina alfa (LTα]) a los TNFR de la superficie celular, lo que hace TNF biológicamente inactivo. Las células que expresan TNF transmembrana que se unen a etanercept no se lisan in vitro en presencia o ausencia de complemento.
Mecanismo de acción: Las moléculas pro-inflamatorias que están unidas en una red controlada por TNF median gran parte de la patología articular en la artritis reumatoide y la espondilitis anquilosante y la patología cutánea en la psoriasis en placas. Se cree que el mecanismo de acción de etanercept es su inhibición competitiva de la unión del TNF al TNFR de la superficie celular, evitando las respuestas celulares mediadas por TNF al hacer que el TNF sea biológicamente inactivo. Etanercept también puede modular las respuestas biológicas controlado por moléculas adicionales aguas abajo (por ejemplo, citocinas, moléculas de adhesión o proteinasas) que son inducidas o reguladas por TNF.
Propiedades farmacocinéticas:
Absorción: Etanercept se absorbe lentamente en el lugar de la inyección subcutánea (SC), alcanzando el máximo de concentración entre 24 y 96 horas después de una dosis única. La biodisponibilidad absoluta es del 76% calculada en un análisis farmacocinético poblacional de varios estudios. Con dosis dos veces por semana, se prevé que las concentraciones en estado de equilibrio pueden ser de dos a cinco veces mayores que las observadas después de dosis únicas. Después de una sola dosis subcutánea de 25 mg de etanercept, la concentración sérica máxima promedio observada en voluntarios sanos fue de 1,65 ± 0,66 mg/L, y el área bajo la curva fue de 235 ± 96,6 mg• hr/L. La proporcionalidad de la dosis no se ha evaluado formalmente, pero no hay una saturación aparente del aclaramiento en el rango de dosificación.
Distribución: Se requiere una curva biexponencial para describir la curva de concentración-tiempo de etanercept. El volumen de distribución central de etanercept es de 7,6 L, mientras que el volumen de distribución en estado estacionario es de 10,4 L.
Después de la administración continuada de pacientes con AR (n = 25) con etanercept durante 6 meses con 25 mg dos veces por semana, la mediana del nivel observado fue de 3,0 mg/L (rango de 1,7 a 5,6 mg/L).
Eliminación: Etanercept se elimina lentamente del cuerpo. La vida media es de aproximadamente 80 horas. El aclaramiento es de aproximadamente 0,066 l/h en pacientes con AR, algo menor que el valor de 0,11 l/h observado en voluntarios sanos. Además, la farmacocinética de etanercept en pacientes con artritis reumatoide, psoriasis en placas y pacientes con espondilitis anquilosante es similar.
Los perfiles de concentración sérica en estado estacionario fueron comparables entre los pacientes con AR tratados con 50 mg de etanercept polvo para formulación inyectable una vez a la semana y los tratados con 25 mg de etanercept polvo para formulación inyectable dos veces por semana. También se encontró que una sola inyección de 50 mg/ml de etanercept era bioequivalente a dos inyecciones simultáneas de 25 mg/ml. La Cmáx media (± desviación estándar), Cmín y ABC parcial fueron 2,4 ± 1,5 mg/L, 1,2 ± 0,7 mg/L y 297 ± 166 mg• h/L, respectivamente, para los pacientes tratados con 50 mg de etanercept una vez a la semana (n = 21); y 2,6 ± 1,2 mg/L, 1,4 ± 0,7 mg/L y 316 ± 135 mg• h/L para pacientes tratados con 25 mg de etanercept dos veces por semana (n = 16). No se han medido las concentraciones séricas en pacientes con AR durante periodos de dosificación que superan los 6 meses. En un estudio abierto, de dosis única, de dos tratamientos cruzados en voluntarios sanos, se encontró que etanercept administrado como una sola inyección de etanercept 50 mg solución inyectable era bioequivalente a dos inyecciones simultáneas de etanercept 25 mg polvo para formulación inyectable. La media (± desviación estándar) Cmáx y ABC (0-t) se expresan en la siguiente tabla.
|
ABC (0-t) (mg• h/L) |
Cmáx (mg/L) |
|
|
1 x 50 mg solución SC (n = 33) |
535 ± 192 |
535 ± 192 |
|
2 x 25 mg polvo SC (n = 33) |
590 ± 208 |
590 ± 208 |
|
Estimación (%) 90% CI |
91.3 (80.9, 103.1) |
91.3 (80.9, 103.1) |
Aunque hay eliminación de radiactividad en orina después de la administración de etanercept marcado radiactivamente a pacientes y voluntarios, no se observaron concentraciones elevadas de etanercept en pacientes con insuficiencia renal o hepática aguda. La presencia de insuficiencia renal y hepática no debería requerir un cambio de dosis. No existe una diferencia farmacocinética aparente entre hombres y mujeres.
No se han realizado estudios farmacocinéticos formales para examinar el metabolismo de etanercept o los efectos de la insuficiencia renal o hepática. El metotrexato no tiene ningún efecto sobre la farmacocinética de etanercept. No se ha investigado el efecto de etanercept sobre la farmacocinética humana del metotrexato.
Los datos descritos anteriormente se derivaron de estudios que utilizaron etanercept fabricado mediante un proceso a base de suero.
Comparabilidad farmacocinética de Etanercept y el producto de referencia: Etanercept demostró ser bioequivalente al producto de referencia en un estudio cruzado, aleatorizado, de dos secuencias, de dos periodos, en voluntarios sanos. En la siguiente tabla se proporciona un resumen de los parámetros farmacocinéticos primarios.
|
Parámetro |
Medianas geométricas |
Radio medio (%) |
IC 90% del radio |
|
|
Etanercept |
Producto de referencia |
|||
|
Cmáx (μg/mL) |
3.4 |
3.2 |
1.03 |
0.98-1.09 |
|
ABC0-last (h μg/mL) |
619 |
675 |
0.92 |
0.88-0.95 |
|
ABC0-∝ (h μg/mL) |
667 |
741 |
0.90 |
0.87-0.94 |
Cmáx = concentración máxima; ABC0-last = área bajo la curva de concentración-tiempo hasta la última concentración medible; ABC0-∝ = área bajo la curva concentración-tiempo extrapolada al infinito.
Poblaciones especiales:
Edad avanzada (> 65 años): El impacto de la edad avanzada se estudió en el análisis farmacocinético poblacional de las concentraciones séricas de etanercept. Las estimaciones de aclaramiento y volumen en pacientes de 65 a 87 años fueron similares a las estimaciones en pacientes menores de 65 años.
Pacientes con artritis idiopática juvenil: En un ensayo de artritis idiopática juvenil poliarticular (AI J) con etanercept, a 69 pacientes (de 4 a 17 años de edad) se les administró 0,4 mg de etanercept/kg dos veces por semana durante tres meses.
Los perfiles de concentración sérica fueron similares a los observados en pacientes adultos con artritis reumatoide. Los niños más pequeños (4 años de edad) tuvieron un aclaramiento reducido (mayor aclaramiento cuando se normalizó por peso) en comparación con los niños mayores (12 años de edad) y los adultos. La simulación de la dosificación sugiere que mientras que los niños mayores (10-17 años) tendrán niveles séricos cercanos a los observados en los adultos, los niños más pequeños tendrán niveles apreciablemente más bajos.
Pacientes pediátricos con psoriasis en placas: A los pacientes con psoriasis en placas pediátrica (de 4 a 17 años) se les administró 0,8 mg/kg (hasta una dosis máxima de 50 mg por semana) de etanercept una vez a la semana durante un máximo de 48 semanas. Las concentraciones mínimas séricas medias en el estado estacionario oscilaron entre 1,6 y 2,1 mg/L en las semanas 12, 24 y 48. Estas concentraciones medias en pacientes con psoriasis en placas pediátricas fueron similares a las concentraciones observadas en pacientes con artritis idiopática juvenil (tratados con 0,4 mg/kg etanercept dos veces por semana, hasta una dosis máxima de 50 mg por semana). Estas concentraciones medias fueron similares a las observadas en pacientes adultos con psoriasis en placas tratados con 25 mg de etanercept dos veces por semana.
Comparabilidad de Etanercept con producto de referencia:
El estudio GP15-302 fue un estudio aleatorizado, doble ciego, multicéntrico que comparó la eficacia, seguridad e inmunogenicidad de Etanercept y el producto de referencia en pacientes con psoriasis crónica de tipo placa.
El estudio tuvo una duración total de 52 semanas y consistió en tres periodos. En el periodo de tratamiento 1 (TP1), los pacientes recibieron 50 mg de Etanercept (264 pacientes) o el producto de referencia (267 pacientes) dos veces por semana hasta la semana 12. En el periodo de tratamiento 2 (TP2), los pacientes con al menos un 50% de reducción en PASI en la semana 12 se volvieron a aleatorizar para mantener su tratamiento inicialmente aleatorizado o se sometieron a cambios predefinidos entre Etanercept y el producto de referencia a intervalos de 6 semanas hasta la semana 30. Los pacientes fueron tratados con Etanercept o el producto de referencia a una dosis de 50 mg una vez semanal. En el periodo de extensión, los pacientes continuaron el último tratamiento que habían recibido durante TP2, es decir, Etanercept o el producto de referencia a una dosis de 50 mg una vez por semana, hasta la semana 52. La población de pacientes elegibles consisitía en pacientes adultos con enfermedad activa, pero clínicamente estable, que implican al menos el 10% de la superficie corporal, con un PASI mínimo de 10 (que indica psoriasis moderada a severa). Los pacientes habían recibido previamente al menos una fototerapia o terapia sistémica para la psoriasis, o eran candidatos para recibir dicha terapia en opinión del investigador. La asignación al azar al inicio del estudio se estratificó según el peso corporal (< 90 kg; ≥ 90 kg) y la terapia previa para la psoriasis sistémica.
Los resultados de eficacia primaria y secundaria clave después de TP1 cuando los pacientes recibieron Etanercept o el producto de referencia durante 12 semanas indicaron consistentemente la equivalencia terapéutica entre el Etanercept y los grupos de tratamiento del producto de referencia (consulte la tabla 1).
Tabla 1. GP15-302: Resumen de los resultados de eficacia primaria y secundaria clave en la semana 12, según el conjunto de protocolos
|
N |
Tasa de respuesta (%)/Mediana (%) cambios desde la basal |
Diferencia (%) (Etanercept-Producto de referencia) |
95% Intervalo de confianza (%) |
|
|
Respuesta PASI 75* Etanercept |
239 |
73.4 |
-2.3 |
[-9.85, 5.30]** |
|
Producto de referencia |
241 |
75.7 |
||
|
% cambio desde la basal en puntaje PASI (MMRM) Etanercept |
239 |
-56.11 |
-0.64 |
[-3.474, 2.204]*** |
|
Producto de referencia |
241 |
-55.48 |
||
|
% cambio desde la basal en puntaje PASI (ANCOVA) Etanercept |
239 |
-52.99 |
-0.88 |
[-3.610, 1.845]*** |
|
Producto de referencia |
241 |
-52.11 |
N = número total de pacientes dentro de cada grupo de tratamiento.
ANCOVA = análisis de covarianza.
MMRM = medidas repetidas de modelo mixto.
PASI = área de psoriasis e índice de gravedad.
* Punto final primario = Equivalencia en la eficacia de Etanercept y el producto de referencia basado en la respuesta PASI 75. Tasa en la semana 12.
** Se utilizó un margen de equivalencia del 18%.
*** Se utilizó un margen de equivalencia del 15%.
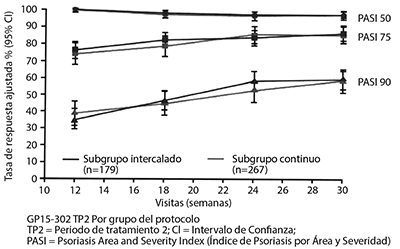
Los resultados clave de eficacia para el segundo periodo de estudio (GP15-302) se proporcionan en la figura 1. Estos datos indican que la eficacia en pacientes que continúan su tratamiento actual (ya sea ETANERCEPT o el producto de referencia) y aquellos que estuvieron sujetos a múltiples interruptores son comparables. Se observaron diferencias significativas en PASI 90, PASI 75 y PASI 50.
Figura 1. Tasas de respuesta PASI 50, 75 y 90 ajustadas para el tratamiento continuo y grupos de tratamiento intercalados en el Segundo periodo de tratamiento del estudio GP15-302
Estudio 2: En un estudio multicéntrico, abierto, de fase 4, de 3 periodos evaluó el retiro y retratamiento de etanercept en pacientes con nr-AxSpa activo que lograron una respuesta adecuada (enfermedad inactiva definida como puntuación de actividad de la enfermedad de espondilitis anquilosante [ASDAS] proteína-C reactiva [PCR] inferior a 1.3) después de 24 semanas de tratamiento.
209 pacientes adultos con nr-AxSpa activo (18 a 49 años de edad), definidos como aquellos pacientes que cumplen con los criterios de clasificación de la Evaluación de la Espondiloartritis de la Sociedad Internacional de Espondiloartritis (ASAS) de espondiloartritis axial (pero que no cumplen con los criterios modificados de Nueva York para EA), hallazgos positivos en la resonancia magnética (inflamación activa en la resonancia magnética altamente sugestiva de sacroileítis asociada con SpA) y/o PCRhs positiva (definida como proteína reactiva de alta sensibilidad [hsCRP]> 3 mg/l), y síntomas activos definidos por una PCR de ASDAS mayor o igual a 2.1 en la visita de selección recibieron etanercept 50 mg semanales de etiqueta abierta más AINE de base estable a la dosis antiinflamatoria tolerada óptima durante 24 semanas en el Periodo 1.
También se requirió que los pacientes tuvieran una respuesta inadecuada o intolerancia a dos o más AINE. En la semana 24, 119 (57%) pacientes lograron la enfermedad inactiva y entraron en la fase de retiro de 40 semanas del Periodo 2 donde los sujetos descontinuaron etanercept, pero mantuvieron el AINE de base. La medida principal de eficacia fue la aparición de exacerbaciones (definidas como una velocidad de sedimentación globular (VSG) de ASDAS mayor o igual a 2,1) dentro de las 40 semanas posteriores a la retirada de etanercept. Los pacientes con exacerbación fueron tratados nuevamente con etanercept 50 mg semanales durante 12 semanas (Periodo 3).
En el Periodo 2, la proporción de pacientes que experimentaron ≥ 1 brote aumentó del 22% (25/112) en la semana 4 al 67% (77/115) en la semana 40. En general, el 75% (86/115) de los pacientes experimentaron un brote en cualquier momento dentro de las 40 semanas siguientes a la retirada de etanercept.
El objetivo secundario clave del Estudio 2 fue estimar el tiempo hasta el brote después de la retirada de etanercept.
La mediana del tiempo transcurrido hasta el brote tras la retirada de etanercept fue de 16 semanas (IC del 95%: 13-24 semanas).
De los 87 pacientes que ingresaron al Periodo 3 y fueron tratados nuevamente con etanercept 50 mg semanales durante 12 semanas, el 62% (54/87) alcanzaron la enfermedad inactiva, y el 50% de ellos la alcanzaron dentro de las 5 semanas (IC del 95%: 4-8 semanas).
Eficacia clínica y seguridad: Esta sección presenta datos de cuatro ensayos controlados aleatorizados en pacientes adultos con artritis reumatoide, un ensayo en pacientes adultos con artritis psoriásica, un ensayo en pacientes adultos con espondilitis anquilosante, dos ensayos en pacientes adultos con espondiloartritis axial no radiográfica, cuatro ensayos en pacientes adultos con psoriasis en placas, tres ensayos en artritis idiopática juvenil y un ensayo en pacientes pediátricos con psoriasis en placas.
Pacientes adultos con artritis reumatoide: La eficacia de Etanercept fue evaluada en un ensayo aleatorizado, doble ciego, controlado con placebo. El ensayo evaluó 234 pacientes adultos con artritis reumatoide (AR) activa, que habían fracasado al tratamiento previo con, al menos, uno, pero no más de cuatro, fármacos antirreumáticos modificadores de la enfermedad (FARME). Se administraron dosis subcutáneas de 10 mg o 25 mg de Etanercept o placebo, dos veces a la semana durante 6 meses consecutivos. Los resultados de este ensayo controlado se expresaron en forma de porcentaje de mejoría de la artritis reumatoide utilizando los criterios de respuesta del Colegio Americano de Reumatología (ACR).
La respuesta ACR20 y 50 a los 3 y 6 meses, fue mayor en los pacientes tratados con Etanercept que en los pacientes tratados con placebo (ACR20: Etanercept 62% y 59%, placebo 23% y 11% a los 3 y 6 meses respectivamente; ACR50: Etanercept 41% y 40%, placebo 8% y 5% a los 3 y 6 meses, respectivamente; p < 0,01 Etanercept vs placebo en todos los puntos de tiempo para las respuestas ACR20 y ACR50).
Aproximadamente, el 15% de los pacientes que recibieron Etanercept alcanzaron una respuesta ACR 70 en el mes 3 y 6, en comparación con menos del 5% de los pacientes en el grupo placebo. Entre los pacientes que recibieron Etanercept, las respuestas clínicas aparecieron, generalmente, entre la primera y segunda semana desde el inicio del tratamiento y prácticamente siempre ocurrieron en tres meses. Se observó una relación dosis respuesta; los resultados con 10 mg fueron intermedios entre el placebo y la dosis de 25 mg. Etanercept fue significativamente mejor que el placebo en todos los componentes de los criterios de la ACR, así como en otras medidas de actividad de la enfermedad en la artritis reumatoide, no incluidas en los criterios de respuesta de la ACR, como la rigidez matutina. Durante el ensayo, cada 3 meses se administró un Cuestionario de Evaluación de la Salud (HAQ) que incluye parámetros de discapacidad, vitalidad, salud mental, estado general de salud y subdominios del estado de salud asociado a la artritis. Todos los subdominios del cuestionario HAQ mejoraron en los pacientes tratados con Etanercept a los 3 y 6 meses en comparación con los pacientes control.
Después de la interrupción de Etanercept, los síntomas de la artritis generalmente reaparecieron en un mes. La reintroducción del tratamiento con Etanercept después de interrupciones de hasta 24 meses resultó en la misma magnitud de respuesta que los pacientes que recibieron Etanercept sin interrupción del tratamiento con base en los resultados de los ensayos abiertos. Se han observado respuestas duraderas continuadas de hasta 10 años en los ensayos abiertos de extensión del tratamiento cuando los pacientes recibieron Etanercept sin interrupción.
La eficacia de Etanercept se comparó con la de metotrexato en un ensayo, aleatorizado, controlado con comparador activo, con evaluaciones radiográficas ciegas como variable primaria de evaluación en 632 pacientes adultos con artritis reumatoide activa (< 3 años de duración), que no habían recibido nunca antes tratamiento con metotrexato. Se administraron dosis de 10 o 25 mg de Etanercept por vía subcutánea (SC) dos veces por semana durante 24 meses. Las dosis de metotrexato se fueron aumentando desde 7,5 mg/semana hasta un máximo de 20 mg/semana durante las primeras 8 semanas del ensayo, manteniéndose hasta los 24 meses. La mejoría clínica, incluyendo un comienzo de acción de 2 semanas conseguida con 25 mg de Etanercept, fue similar a la observada en los ensayos previos, y se mantuvo hasta 24 meses. En la visita de inicio, los pacientes presentaron un grado moderado de discapacidad, con puntuaciones medias de HAQ de 1,4 a 1,5. El tratamiento con Etanercept 25 mg produjo una mejora sustancial a los 12 meses, con un 44% aproximadamente de pacientes que alcanzaron una puntuación normal de HAQ (menor a 0,5). Este beneficio se mantuvo en el segundo año del ensayo.
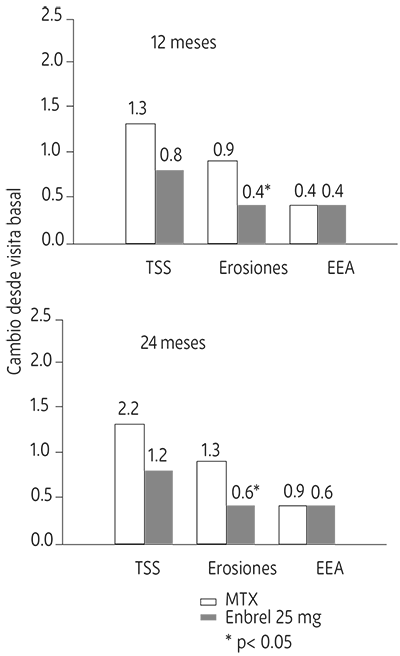
En este ensayo, se evaluó radiográficamente el daño estructural en las articulaciones, expresándose como cambio en la prueba de puntuación total de Sharp (TSS) y en sus componentes, la puntuación de la erosión y la puntuación del Estrechamiento del Espacio Articular (EEA). Las radiografías de manos/muñecas y pies se leyeron en la visita de inicio y a los 6, 12 y 24 meses. La dosis de Etanercept de 10 mg presentó de forma consistente un efecto menor que la de 25 mg sobre el daño estructural. Etanercept 25 mg fue significativamente superior a metotrexato en términos de erosión tanto a los 12 como a los 24 meses. Las diferencias en TSS y EEA no fueron estadísticamente significativas entre metotrexato y Etanercept 25 mg. Los resultados se muestran en la figura 2 que aparece a continuación.
Figura 2. Progresión radiográfica: comparación de Etanercept vs metotrexato en pacientes con AR de < 3 años de duración
En otro ensayo controlado con comparador activo, doble-ciego, aleatorizado, en pacientes con AR tratados con Etanercept en monoterapia (25 mg dos veces por semana), metotrexato en monoterapia (7,5 a 20 mg por semana, siendo 20 mg la dosis media), y la combinación de Etanercept y metotrexato iniciada concomitantemente, se compararon la eficacia clínica, la seguridad y la progresión radiográfica en 682 pacientes adultos con artritis reumatoide activa de 6 meses a 20 años de duración (mediana 5 años) que tuvieron una respuesta no satisfactoria a al menos 1 fármaco modificador de la enfermedad (FARME) distinto de metotrexato. Los pacientes en el grupo de Etanercept en combinación con metotrexato tuvieron respuestas ACR20, ACR50 y ACR70 y mejoras de las escalas DAS y HAQ significativamente mayores, a las 24 y a las 52 semanas, que los pacientes de cualquiera de los grupos de tratamiento en monoterapia (los resultados se muestran en la tabla 2 a continuación). Después de 24 meses de tratamiento, también se observaron ventajas significativas con la administración de Etanercept en combinación con metotrexato, al compararla con la administración de ambos, Etanercept y metotrexato, como monoterapia.
Tabla 2. Resultados de eficacia clínica a los 12 meses: comparación de Etanercept vs metotrexato vs Etanercept en combinación con metotrexato en pacientes con AR de 6 meses a 20 años de duración
|
Variable |
Metotrexato (n = 228) |
Etanercept (n = 223) |
Etanercept + Metotrexato (n = 231) |
|
|
Respuestas ACRa |
ACR 20 ACR 50 ACR 70 |
58,8 % 36,4 % 16,7 % |
65,5 % 43,0 % 22,0 % |
74,5 % †f 63,2 % †,f 39,8 % †,f |
|
DAS |
Visita de iniciob Semana 52bRemisiónc |
5,5 3,0 14 % |
5,7 3,0 18 % |
5,5 2,3 †,f 37 % †,f |
|
HAQ |
Basal Semana 52 |
1,7 1,1 |
1,7 1,0 |
1,8 0,8 †,f |
a Los pacientes que no completaron los 12 meses en el ensayo fueron considerados como pacientes no respondedores.
b Los valores para DAS (escala de actividad de la enfermedad) son valores medios
c La remisión se define como DAS < 1,6
Valores p de comparación de pares: † = p < 0,05 para comparaciones de Etanercept + metotrexato vs metotrexato y f = p < 0,05 para comparaciones de Etanercept + metotrexato vs Etanercept.
La progresión radiográfica a los 12 meses fue significativamente menor en el grupo de Etanercept que en el grupo de metotrexato, mientras que la combinación fue significativamente mejor que cualquiera de los grupos de monoterapia en lo relativo al enlentecimiento de la progresión radiográfica (ver la figura 3).
Figura 3. Progresión radiográfica: comparación de Etanercept vs metotrexato vs Etanercept en combinación con metotrexato en pacientes con AR de 6 Meses a 20 Años de duración (resultados a los 12 Meses)
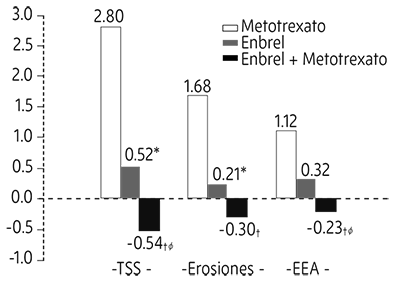
Valores p de comparación de pares: * = p < 0,05 para comparaciones de Etanercept vs metotrexato, † = p < 0,05 para comparaciones de Etanercept + metotrexato vs metotrexato y f = p < 0,05 para comparaciones de Etanercept + metotrexato vs Etanercept.
Después de 24 meses de tratamiento, también se observaron ventajas significativas con la administración de Etanercept en combinación con metotrexato, al compararla con la administración de ambos, Etanercept y metotrexato, en monoterapia. De forma similar, también se observaron, después de 24 meses de tratamiento, ventajas significativas del tratamiento con Etanercept en monoterapia frente al tratamiento con metotrexato en monoterapia. En un análisis, en el que se consideró que todos los pacientes que habían abandonado el ensayo por cualquier motivo habían progresado, el porcentaje de pacientes que no experimentó una progresión (cambio en TSS ≤ 0,5) a los 24 meses fue mayor en el grupo de Etanercept en combinación con metotrexato, comparado con los grupos de Etanercept en monoterapia y de metotrexato en monoterapia (62%, 50% y 36%, respectivamente; p < 0,05). La diferencia entre los grupos de Etanercept en monoterapia y metotrexato en monoterapia también fue significativa (p < 0,05). Las tasas de ausencia de progresión, entre los pacientes del ensayo que completaron el periodo total de 24 meses de tratamiento, fueron de un 78%, 70% y 61%, respectivamente.
La seguridad y eficacia de 50 mg de Etanercept (dos inyecciones subcutáneas de 25 mg) administrados una vez a la semana fue evaluada en un ensayo doble ciego controlado con placebo en 420 pacientes con artritis reumatoide activa. En este ensayo, 53 pacientes recibieron placebo, 214 pacientes recibieron 50 mg de Etanercept una vez a la semana y 153 pacientes recibieron 25 mg de Etanercept dos veces a la semana. Los perfiles de seguridad y eficacia de los dos regímenes de tratamiento de Etanercept fueron comparables en la semana 8 en lo que se refiere a los efectos sobre los signos y síntomas de artritis reumatoide; los datos a 16 semanas no mostraron comparabilidad (ni inferioridad) entre los dos regímenes.
Pacientes adultos con artritis psoriásica:
Se evaluó la eficacia de Etanercept en un ensayo aleatorizado, doble ciego, controlado con placebo en 205 pacientes con artritis psoriásica. Los pacientes tenían entre 18 y 70 años de edad y tenían artritis psoriásica activa (≥ 3 articulaciones inflamadas y ≥ 3 articulaciones dolorosas) en al menos una de las siguientes formas: (1) afectación interfalángica distal (IFD); (2) artritis poliarticular (ausencia de nódulos reumatoides y presencia de psoriasis); (3) artritis mutilante; (4) artritis psoriásica asimétrica; o (5) tipo espondilitis anquilosante. Los pacientes también tenían psoriasis en placas con una lesión valorable ≥ a 2 cm de diámetro. Los pacientes habían sido tratados previamente con AINE (86%), FARME (80%) y corticosteroides (24%). Los pacientes que en ese momento estaban en tratamiento con metotrexato (estables durante 2 o más meses) pudieron continuar a una dosis estable igual o inferior a 25 mg/semana de metotrexato. Se administraron 2 veces a la semana dosis SC de 25 mg de Etanercept (con base en los ensayos de búsqueda de dosis en pacientes con artritis reumatoide) o placebo durante 6 meses. Una vez finalizado el ensayo doble ciego, los pacientes pudieron participar en un ensayo de extensión, abierto, a largo plazo, durante un periodo máximo de 2 años.
Las respuestas clínicas se expresaron como porcentajes de pacientes que consiguieron la respuesta ACR 20, 50 y 70 y porcentajes con mejora en el criterio de respuesta de artritis psoriásica (PsARC). La tabla 3 resume los resultados.
Tabla 3. Respuestas de pacientes con artritis psoriásica en un ensayo controlado con placebo
|
Porcentaje de pacientes |
|||
|
Respuesta artritis psoriásica |
Placebo n = 104 |
Etanercepta n = 101 |
|
|
ACR 20 |
Mes 3 Mes 6 |
15 13 |
59b 50b |
|
ACR 50 |
Mes 3 Mes 6 |
4 4 |
38b 37b |
|
ACR 70 |
Mes 3 Mes 6 |
0 1 |
11b 9c |
|
PsARC |
Mes 3 Mes 6 |
31 23 |
72b 70b |
a 25 mg de etanercept SC dos veces a la semana.
b p < 0,001, etanercept vs. placebo
c p < 0,01, etanercept vs. placebo
Las respuestas clínicas entre pacientes con artritis psoriásica que recibieron Etanercept fueron visibles en la primera visita (4 semanas) y se mantuvieron a lo largo de los 6 meses de tratamiento. Etanercept resultó significativamente mejor que placebo en todas las determinaciones de actividad de la enfermedad (p <0,001), y las respuestas fueron similares con y sin tratamiento concomitante con metotrexato. Se evaluó la calidad de vida de los pacientes con artritis psoriásica en cada momento utilizando el índice de discapacidad del HAQ. El resultado del índice de discapacidad resultó significativamente mejorado en todo momento en los pacientes con artritis psoriásica tratados con Etanercept en relación con los tratados con placebo (p <0,001).
En el ensayo de artritis psoriásica se evaluaron las alteraciones radiográficas. Se obtuvieron radiografías de las manos y de las muñecas al comienzo del ensayo, y a los 6, 12 y 24 meses. En la tabla 4 que se incluye a continuación, se presenta la TSS modificada a los 12 meses. En un análisis, en el que se consideró que todos los pacientes que habían abandonado el ensayo por cualquier motivo habían progresado, el porcentaje de pacientes que no experimentó una progresión (cambio en TSS ≤ 0,5) a los 12 meses fue mayor en el grupo de Etanercept, en comparación con el grupo de placebo (73% vs 47%, respectivamente, p ≤ 0,001). El efecto de Etanercept sobre la progresión radiográfica se mantuvo en los pacientes que continuaron el tratamiento durante el segundo año. En los pacientes con afectación poliarticular simétrica de las articulaciones, se observó un enlentecimiento del desarrollo del daño de las articulaciones periféricas.
Tabla 4. Cambio anual medio (SE), desde la visita de inicio, según la puntuación total de Sharp
|
Periodo |
Placebo (n = 104) |
Etanercepta (n = 101) |
|
Mes 12 |
1,00 (0,29) |
0,03 (0,09)a |
SE = error estándar.
a p = 0,0001.
El tratamiento con Etanercept produjo una mejoría en la función física durante el periodo doble ciego, manteniéndose dicho beneficio durante el periodo máximo de exposición a largo plazo de hasta 2 años.
No existen datos suficientes sobre la eficacia de Etanercept, en los pacientes que presentan artropatías tipo artritis psoriásica mutilante y artropatías tipo espondilitis anquilosante, debido al reducido número de pacientes estudiados.
No se ha realizado ningún ensayo en pacientes con artritis psoriásica, utilizando el régimen de dosificación de 50 mg una vez a la semana. La evidencia sobre la eficacia del régimen de dosificación de una vez a la semana en esta población de pacientes se ha basado en los datos procedentes del ensayo llevado a cabo en pacientes con espondilitis anquilosante.
Pacientes adultos con espondilitis anquilosante:
La eficacia de Etanercept en la espondilitis anquilosante se evaluó en 3 ensayos aleatorizados, doble ciego, en los que se comparó la administración de 25 mg de Etanercept dos veces a la semana frente a placebo. Un total de 401 pacientes fueron incluidos en el ensayo, de los cuales 203 fueron tratados con Etanercept. El mayor de estos ensayos (n = 277) incluyó a pacientes de edades comprendidas entre 18 y 70 años y que tenían espondilitis anquilosante activa definida según los marcadores de la escala analógica visual (EAV) de ≥ 30 para un promedio de duración e intensidad de rigidez matutina y marcadores de la escala analógica visual ≥ 30 para al menos 2 de los siguientes 3 parámetros: evaluación global del paciente; la media de la escala analógica visual para dolor de espalda nocturno y dolor de espalda total; media de 10 preguntas sobre el índice funcional de espondilitis anquilosante (Bath Ankylosing Spondylitis Functional Index: BASFI). Los pacientes que recibieron FARME, AINE o corticosteroides pudieron continuar con ellos a dosis estables. No se incluyeron en el ensayo pacientes con anquilosis completa de la columna. Se administraron por vía subcutánea dosis de 25 mg de Etanercept (con base en los ensayos de búsqueda de dosis en pacientes con artritis reumatoide) o placebo dos veces por semana durante 6 meses en 138 pacientes.
La variable primaria de eficacia (ASAS 20) se definió como mejoría ≥ 20% en al menos 3 de los 4 parámetros (evaluaciones globales del paciente, dolor de espalda, BASFI e inflamación) en la evaluación de espondilitis anquilosante (ASAS) y ausencia de deterioro en el parámetro restante. Las respuestas ASAS 50 y ASAS 70 utilizaron los mismos criterios con mejorías del 50% o del 70%, respectivamente.
Comparado con placebo, el tratamiento con Etanercept dio lugar a mejoras significativas en la respuesta ASAS 20, ASAS 50 y ASAS 70, a las dos semanas del inicio del tratamiento.
Tabla 5. Respuestas de pacientes con espondilitis anquilosante en un ensayo controlado con placebo
|
Porcentaje de pacientes |
||
|---|---|---|
|
Respuesta espondilitis anquilosante |
Placebo N = 139 |
Etanercept N = 138 |
|
ASAS 20 |
||
|
2 semanas |
22 |
46a |
|
3 meses |
27 |
60a |
|
6 meses |
23 |
58a |
|
ASAS 50 |
||
|
2 semanas |
7 |
24a |
|
3 meses |
13 |
45a |
|
6 meses |
10 |
42a |
|
ASAS 70 |
||
|
2 semanas |
2 |
12b |
|
3 meses |
7 |
29b |
|
6 meses |
5 |
28b |
a p < 0,001, etanercept vs. placebo
b p = 0,002, etanercept vs. placebo
Entre los pacientes con espondilitis anquilosante que recibieron Etanercept, las respuestas clínicas fueron evidentes en el momento de la primera visita (2 semanas) y se mantuvieron a lo largo de los 6 meses de tratamiento. Las respuestas fueron similares tanto en los pacientes que estaban recibiendo tratamientos concomitantes al inicio del estudio, como en los que no.
En los dos ensayos más pequeños de espondilitis anquilosante se obtuvieron resultados similares.
En un cuarto ensayo, se evaluó la seguridad y la eficacia de 50 mg de Etanercept (dos inyecciones subcutáneas de 25 mg) administrados una vez a la semana frente a Etanercept 25 mg administrado dos veces a la semana, en un ensayo doble ciego, controlado con placebo en 356 pacientes que padecían espondilitis anquilosante activa. Los perfiles de seguridad y de eficacia de los regímenes de 50 mg una vez a la semana y de 25 mg dos veces a la semana fueron similares.
Pacientes adultos con espondiloartritis axial no radiográfica:
Ensayo 1: La eficacia de Etanercept en pacientes con espondiloartritis axial no radiográfica (SpAax-nr) se evaluó en un ensayo aleatorizado, doble ciego, controlado con placebo, de 12 semanas de duración. En el ensayo se evaluó a 215 pacientes adultos (población por intención de tratar modificada) con SpAax-nr activa (de entre 18 y 49 años), definida como aquellos pacientes que cumplían los criterios de clasificación de ASAS de la espondiloartritis axial, pero no cumplían los criterios de Nueva York modificados para el diagnóstico de EA. Los pacientes también debían presentar una respuesta inadecuada o intoleranciaa dos o más AINE. En el periodo doble ciego, los pacientes recibieron 50 mg semanales de Etanercept o placebo durante 12 semanas. La variable primaria de eficacia (ASAS 40) se definió como mejoría del 40% en al menos tres de los cuatro parámetros de ASAS y ausencia de deterioro en el parámetro restante. Al periodo doble ciego le siguió un periodo abierto en el que todos los pacientes recibieron 50 mg semanales de Etanercept durante un periodo de hasta 92 semanas adicionales. Mediante resonancia magnética (IRM) se obtuvieron imágenes de la articulación sacroilíaca y la columna vertebral con el fin de evaluar la inflamación, en la visita de inicio y en las semanas 12 y 104.
Comparado con placebo, el tratamiento con Etanercept dio como resultado mejorías estadísticamente significativas en las respuestas ASAS 40, ASAS 20 y ASAS 5/6. También se observó una mejoría significativa en las respuestas ASAS remisión parcial y BASDAI 50. En la tabla 6 figuran los resultados de la semana 12.
Tabla 6. Respuesta de eficacia en el ensayo de SpAax-nr controlado con placebo: porcentaje de pacientes que alcanzaron las variables
|
Respuestas clínicas doble ciego en la semana 12 |
Placebo n = entre 106 y 109* |
Etanercept n = entre 103 y 105* |
|
ASAS** 40 |
15,7 |
32,4b |
|
ASAS 20 |
36,1 |
52,4c |
|
ASAS 5/6 |
10,4 |
33,0a |
|
ASAS remisión parcial |
11,9 |
24,8c |
|
BASDAI***50 |
23,9 |
43,8b |
*Algunos pacientes no proporcionaron datos completos para todas las variables
**ASAS = Sociedad Internacional de Evaluación de la Espondiloartritis
***Índice de Bath de Actividad de la Enfermedad de la Espondilitis Anquilosante
a p < 0,001, b: < 0,01 y c: <0,05, respectivamente entre etanercept y placebo
En la semana 12 se produjo una mejoría estadísticamente significativa en la puntuación SPARCC (Consorcio de Investigación de la Espondiloartritis de Canadá) para la articulación sacroilíaca, determinada mediante IRM, en los pacientes que recibían Etanercept. El cambio promedio ajustado desde la visita de inicio fue de 3,8 para los pacientes tratados con Etanercept (n = 95) frente a 0,8 para los pacientes tratados con placebo (n = 105) (p < 0,001). En la semana 104, el cambio promedio desde la visita de inicio en la puntuación SPARCC determinada mediante IRM para los pacientes tratados con Etanercept fue de 4,64 para la articulación sacroilíaca (n = 153) y 1,40 para la columna vertebral (n = 154).
Comparado con placebo, Etanercept mostró una mejoría, desde la visita de inicio hasta la semana 12, estadística y significativamente mayor en la mayoría de las evaluaciones de calidad de vida relacionada con la salud y de la función física, incluyendo el BASFI (Índice Funcional de Bath de la Espondilitis Anquilosante), la puntuación de estado de salud global del cuestionario EuroQol 5D y la puntuación del componente físico del cuestionario SF-36.
Las respuestas clínicas entre los pacientes con SpAax-nr que recibieron Etanercept fueron evidentes en la primera visita (2 semanas) y se mantuvieron a lo largo de los 2 años de tratamiento. La mejoría en la calidad de vida relacionada con la salud y de la función física también se mantuvo a lo largo de los 2 años de tratamiento. Los datos a los 2 años no revelaron nuevos hallazgos sobre la seguridad. En la semana 104, 8 pacientes evolucionaron a una puntuación bilateral de grado 2 por rayos X en columna de acuerdo con el sistema de graduación propuesto por los criterios de Nueva York modificados, indicativo de espondiloartropatía axial.
Ensayo 2: Este ensayo multicéntrico, abierto, en fase 4, de 3 periodos evaluó la retirada y el retratamiento con Etanercept en pacientes con SpAax-nr activa que alcanzaron una respuesta adecuada (enfermedad inactiva definida como proteína C-reactiva [PCR] de la escala de la actividad de la enfermedad en la espondilitis anquilosante [ASDAS, por sus siglas en inglés] inferior a 1,3) después de 24 semanas de tratamiento.
209 pacientes adultos con SpAax-nr activa (de 18 a 49 años de edad), definida como aquellos pacientes que cumplían los criterios de clasificación de la evaluación de la Sociedad Internacional de Evaluación de la Espondiloartritis (ASAS) para la espondiloartritis axial (pero no cumplían los criterios de Nueva York modificados para el diagnóstico de EA), con resultados positivos en la IRM (inflamación activa en la IRM que sugiere fuertemente sacroileítis asociada con SpA) y/o hsPCR positiva (definida como PCR de alta sensibilidad [hsCRP] > 3 mg/l), y síntomas activos definidos como una PCR de la ASDAS mayor o igual a 2,1 en la visita de selección recibieron 50 mg semanales de Etanercept sin enmascaramiento y un AINE de base estable a la dosis antiinflamatoria tolerada óptima durante 24 semanas en el periodo 1. Los pacientes también debían presentar una respuesta inadecuada o intolerancia a dos o más AINE. En la semana 24, 119 (57%) pacientes alcanzaron inactividad de la enfermedad y entraron en el periodo 2, fase de retirada de 40 semanas en la que los pacientes interrumpieron el tratamiento con etanercept, pero mantuvieron el AINE de base. La variable de eficacia primaria fue la aparición de brotes de la enfermedad (definidos como una velocidad de sedimentación globular (VSG) de la ASDAS mayor o igual a 2,1) en las 40 semanas posteriores a la retirada de Etanercept. Los pacientes con brote de la enfermedad se volvieron a tratar con 50 mg semanales de Etanercept durante 12 semanas (periodo 3).
En el periodo 2, la proporción de pacientes que experimentaron ≥ 1 brote de la enfermedad aumentó del 22% (25/112) en la semana 4 al 67% (77/115) en la semana 40. En general, el 75% (86/115) de los pacientes experimentaron un brote de la enfermedad en cualquier momento en las 40 semanas posteriores a la retirada de Etanercept.
La variable secundaria principal del ensayo 2 fue estimar el tiempo hasta el brote de la enfermedad después de la retirada de Etanercept y, además, comparar el tiempo hasta el brote de la enfermedad con los pacientes del ensayo 1 que cumplieron con los requisitos de entrada en la fase de retirada del ensayo 2 y continuaron el tratamiento con Etanercept.
La mediana del tiempo hasta el brote de la enfermedad posterior a la retirada de Etanercept fue de 16 semanas (IC del 95%: 13-24 semanas). Menos del 25% de los pacientes en el ensayo 1 a quienes no se les retiró el tratamiento experimentaron un brote de la enfermedad durante las 40 semanas equivalentes al periodo 2 del ensayo 2. El tiempo hasta el brote de le enfermedad fue más corto y estadísticamente significativo en los pacientes que interrumpieron el tratamiento con Etanercept (ensayo 2) en comparación con los pacientes que recibieron tratamiento continuo con etanercept (ensayo 1), p < 0,0001.
De los 87 pacientes que entraron en el periodo 3 y fueron tratados nuevamente con 50 mg semanales de Etanercept durante 12 semanas, el 62% (54/87) volvieron a alcanzar la inactividad de la enfermedad, y de éstos, el 50% la volvieron a alcanzar en un plazo de 5 semanas (IC del 95%: 4-8 semanas).
Pacientes adultos con psoriasis en placas: Se recomienda el uso de Etanercept en la población de pacientes definida en las indicaciones terapéuticas. En la población de estudio, los pacientes que “no han respondido a” se definen como los que presentan una respuesta insuficiente (PASI < 50 o PGA menos que bueno), o un empeoramiento de la enfermedad durante el tratamiento, y que han recibido una dosis adecuada durante un periodo de tiempo lo suficientemente largo como para evaluar la respuesta de al menos uno de los tres principales tratamientos sistémicos disponibles.
No se ha evaluado la eficacia de Etanercept frente a otras terapias sistémicas en pacientes con psoriasis de moderada a grave (que responden a otras terapias sistémicas) en ensayos que comparen directamente Etanercept con otras terapias sistémicas. En cambio, se evaluó la eficacia y seguridad de Etanercept en cuatro ensayos aleatorizados, doble ciego y controlados con placebo. La variable primaria de eficacia en los cuatro ensayos fue la proporción de pacientes en cada grupo de tratamiento que alcanzaron el PASI 75 (esto es, al menos un 75% de mejoría en la Puntuación de Área de Psoriasis e Índice de Gravedad desde la visita de inicio) a las 12 semanas.
El ensayo 1 fue un ensayo Fase 2 en pacientes con psoriasis en placas activa, pero clínicamente controlada, en los que la superficie corporal afectada era ≥10% y tenían una edad ≥18 años. Se aleatorizaron ciento doce pacientes (112) que recibieron una dosis de 25 mg de Etanercept (n = 57) o placebo (n = 55) dos veces a la semana durante 24 semanas.
El ensayo 2 evaluó 652 pacientes con psoriasis en placas crónica, utilizando los mismos criterios de inclusión que el ensayo 1 con la adición de una puntuación mínima del Área de Psoriasis e Índice de Gravedad (PASI) de 10 en la visita de selección. Se administró Etanercept a dosis de 25 mg una vez a la semana, 25 mg dos veces a la semana o 50 mg dos veces a la semana durante 6 meses consecutivos. Durante las primeras 12 semanas del periodo de tratamiento doble ciego, los pacientes recibieron placebo o una de las tres dosis de Etanercept antes mencionadas. Después de 12 semanas de tratamiento, los pacientes del grupo placebo comenzaron el tratamiento ciego con Etanercept (25 mg dos veces a la semana); los pacientes de los grupos de tratamiento con fármaco activo continuaron tratados hasta la semana 24 con la dosis a la que inicialmente fueron aleatorizados.
El ensayo 3 evaluó 583 pacientes y tuvo los mismos criterios de inclusión que el ensayo 2. Los pacientes en este ensayo recibieron una dosis de 25 mg o 50 mg de Etanercept, o placebo dos veces a la semana durante 12 semanas; posteriormente todos los pacientes del ensayo pasaron a una fase abierta en la que recibieron 25 mg de Etanercept dos veces a la semana durante 24 semanas adicionales.
El ensayo 4 evaluó 142 pacientes y tuvo los mismos criterios de inclusión que los ensayos 2 y 3. Los pacientes en este ensayo recibieron una dosis de 50 mg de Etanercept o placebo una vez a la semana, durante 12 semanas; posteriormente todos los pacientes del ensayo pasaron a una fase abierta en la que recibieron 50 mg de Etanercept una vez a la semana durante 12 semanas adicionales.
En el ensayo 1, el grupo tratado con Etanercept tuvo una proporción de pacientes con una respuesta PASI 75 significativamente mayor en la semana 12 (30%) en comparación con el grupo tratado con placebo (2%) (p < 0.0001). A las 24 semanas, el 56% de los pacientes del grupo tratado con Etanercept había alcanzado el PASI 75 en comparación con el 5% de los pacientes tratados con placebo. A continuación, se muestran los resultados de los ensayos 2, 3 y 4.
Tabla 7. Respuestas de pacientes con psoriasis en los Ensayos 2, 3 y 4
|
Respuesta (%) |
Ensayo 2 |
Ensayo 3 |
Ensayo 4 |
||||||||
|
Placebo |
Etanercept |
Placebo |
Etanercept |
Placebo |
Etanercept |
||||||
|
25 mg bisemanales |
50 mg bisemanales |
25 mg bisemanales |
50 mg bisemanales |
50 mg semanales |
50 mg semanales |
||||||
|
n = 166 |
n = 162 |
n = 162 |
n = 164 |
n = 164 |
n = 193 |
n = 196 |
n = 196 |
n = 46 |
n = 96 |
n = 90 |
|
|
1 sem 12 |
1 sem 12 |
1 sem 24a |
1 sem 12 |
1 sem 24a |
1 sem 12 |
1 sem 12 |
1 sem 12 |
4 sem 12 |
9 sem 12 |
9 sem 24a |
|
|
PASI 50 |
14 |
58* |
70 |
74* |
77* |
9 |
64* |
77* |
9 |
69* |
83 |
|
PASI 75 |
4 |
34* |
44 |
49* |
59* |
3 |
34* |
49* |
2 |
38* |
71 |
|
DSGAb, aclaramiento o casi aclaramiento |
5 |
34* |
39 |
49* |
55* |
4 |
39* |
57* |
4 |
39* |
64 |
* p ≤ 0,0001 comparado con placebo
a No se realizaron comparaciones estadísticas frente a placebo en la semana 24 en los ensayos 2 y 4 porque el grupo placebo original comenzó recibiendo 25 mg administrados dos veces a la semana o 50 mg semanales de etanercept desde la semana 13 a la semana 24.
b Evaluación Global Estática Dermatológica. Aclaramiento o casi aclaramiento definido como 0 o 1 sobre una escala de 0 a 5.
Entre los pacientes con psoriasis en placas que recibieron Etanercept, respuestas significativas respecto a placebo fueron evidentes en el momento de la primera visita (2 semanas) y se mantuvieron a lo largo de las 24 semanas de terapia.
El ensayo 2 tuvo también un periodo de retirada del fármaco durante el cual a los pacientes que alcanzaron una mejoría de PASI de al menos un 50% en la semana 24 se les suspendió el tratamiento.
Durante el periodo sin tratamiento, se evaluó la incidencia de rebrotes (PASI ≥150% desde la visita de inicio) y el tiempo hasta la recaída (definido como una pérdida de al menos la mitad de la mejoría alcanzada entre la visita de inicio y la semana 24). Durante el periodo de retirada, los síntomas de psoriasis volvieron gradualmente con una media de recurrencia de la enfermedad de 3 meses. No se observó ningún efecto adverso grave relativo a la psoriasis ni empeoramiento de la enfermedad. Se observaron indicios que permiten avalar el beneficio del retratamiento con Etanercept en pacientes que inicialmente respondieron al tratamiento.
En el ensayo 3, la mayoría de los pacientes (77%) que fueron aleatorizados inicialmente a recibir 50 mg dos veces por semana y a los que se les redujo su dosis de Etanercept en la semana 12 a 25 mg dos veces a la semana mantuvieron su respuesta PASI 75 a lo largo de la semana 36. En los pacientes que recibieron 25 mg de Etanercept dos veces a la semana a lo largo del ensayo, la respuesta PASI 75 continuó mejorando entre las semanas 12 a 36.
En el ensayo 4, el grupo tratado con Etanercept tuvo una proporción superior de pacientes con PASI 75 en la semana 12 (38%) en comparación con el grupo tratado con placebo (2%) (p < 0,0001). Para pacientes que recibieron 50 mg una vez a la semana a lo largo del ensayo, las respuestas de eficacia siguieron mejorando y el 71% alcanzaron el PASI 75 en la semana 24.
En los ensayos abiertos a largo plazo (de hasta 34 meses) en los que se administró Etanercept sin interrupción, las respuestas clínicas fueron mantenidas y la seguridad fue comparable a la observada en ensayos a corto plazo.
Un análisis de los datos de los ensayos clínicos no reveló ninguna característica basal de la enfermedad que ayudara a los médicos a seleccionar la opción de dosificación más apropiada (intermitente o continua). En consecuencia, la elección de la terapia intermitente o continua deberá basarse en el juicio del médico y las necesidades individuales del paciente.
Anticuerpos frente a Etanercept: Se detectaron anticuerpos frente a etanercept en el suero de algunos sujetos tratados con etanercept. Estos anticuerpos eran todos no neutralizantes y generalmente transitorios. No parece que exista relación entre el desarrollo de anticuerpos y la respuesta clínica o los efectos adversos.
Población pediátrica:
Pacientes pediátricos con artritis idiopática juvenil:
La seguridad y eficacia de Etanercept fue evaluada en un ensayo clínico en dos fases en 69 niños con artritis idiopática juvenil de curso poliarticular que presentaban una variedad de formas de inicio de artritis idiopática juvenil (poliartritis, oligoartritis y de aparición sistémica). Se incluyeron pacientes entre 4 y 17 años de edad con artritis idiopática juvenil de curso poliarticular de moderada o grave, no respondedores o intolerantes a metotrexato; los pacientes permanecieron con una dosis estable de un único fármaco antiinflamatorio no esteroideo y/o prednisona (< 0,2 mg/kg/día o máximo de 10 mg).
En la primera fase, todos los pacientes recibieron 0,4 mg/kg (máximo 25 mg por dosis) de Etanercept por vía subcutánea dos veces a la semana. En la segunda fase, los pacientes con respuesta clínica al día 90 fueron aleatorizados para continuar recibiendo Etanercept o recibir placebo durante cuatro meses y evaluar el brote de enfermedad. Las respuestas se midieron utilizando la escala ACR Pedi 30, definida como mejoría ≥ 30% en al menos 3 de los 6 criterios y empeoramiento ≥ 30% en no más de uno de los 6 criterios principales de respuesta en la AIJ, incluyendo el recuento de articulaciones activas, limitación de la movilidad, evaluación global del médico y del paciente/padre, evaluación funcional y velocidad de sedimentación globular (VSG). El brote de la enfermedad se definió como un empeoramiento ≥ 30% en 3 de los 6 criterios principales de la AI J y mejoría ≥ 30% en no más de uno de los 6 criterios principales y un mínimo de 2 articulaciones activas.
En la primera fase del ensayo, 51 de 69 pacientes (74%) demostraron respuesta clínica y entraron en la segunda fase. En la segunda fase, 6 de 25 pacientes (24%) de los que continuaron con Etanercept experimentaron un brote de la enfermedad comparado con 20 de 26 pacientes (77%) de los que recibieron placebo (p = 0,007). Desde el inicio de la segunda fase, el tiempo medio hasta el brote de la enfermedad fue ≥ a 116 días para los pacientes que recibieron Etanercept y de 28 días para los pacientes que recibieron placebo. De los pacientes que demostraron respuesta clínica a los 90 días y entraron en la segunda fase del ensayo algunos de los que continuaron con Etanercept siguieron mejorando desde el mes 3 hasta el 7, mientras que los que recibieron placebo no mejoraron.
En un estudio de extensión de seguridad abierto, 58 pacientes pediátricos provenientes del estudio anteriormente descrito (de 4 años de edad en el momento de su inclusión en el estudio) continuaron recibiendo Etanercept durante un periodo de hasta 10 años. La tasa de efectos adversos y de infecciones graves no aumentó con la exposición a largo plazo.
La seguridad a largo plazo del tratamiento con Etanercept en monoterapia (n = 103), Etanercept en combinación con metotrexato (n = 294), o metotrexato en monoterapia (n = 197) fue evaluada durante un periodo de 3 años a partir de un registro de 594 niños con artritis idiopática juvenil de edades comprendidas entre 2 y 18 años, 39 de los cuales tenían de 2 a 3 años. En general, se notificaron más frecuentemente infecciones en los pacientes tratados con etanercept en comparación con aquellos que estaban en tratamiento con metotrexato en monoterapia (3,8% frente a un 2%), siendo las infecciones asociadas con el uso de etanercept de naturaleza más grave.
En otro estudio de fase abierta y de un solo grupo (n = 127), 60 pacientes con oligoartritis extendida (OE) (15 pacientes de edades entre 2 y 4 años, 23 pacientes de edades entre 5 y 11 años y 22 pacientes de edades entre 12 y 17 años), 38 pacientes con artritis relacionada con entesitis (de edades entre 12 y 17 años), y 29 pacientes con artritis psoriásica (de edades entre 12 y 17 años) fueron tratados con Etanercept a dosis de 0,8 mg/kg (hasta un máximo de 50 mg por dosis) una vez a la semana y durante un periodo de 12 semanas. En cada uno de los subtipos de AI J, la mayoría de los pacientes cumplieron los criterios ACR Pedi 30 y demostraron una mejoraría clínica en las variables secundarias, tales como el número de articulaciones dolorosas y la evaluación global del médico. El perfil de seguridad fue consistente con el observado en otros estudios de AI J.
De los 127 pacientes del estudio original, 109 participaron en el estudio de extensión abierto y fueron seguidos durante 8 años adicionales durante un total de 10 años. Al final del estudio de extensión, 84/109 (77%) pacientes habían completado el estudio, de los cuales 27 (25%) seguían recibiendo Etanercept; 7 (6%) se habían retirado del tratamiento debido a baja actividad/inactividad de la enfermedad; 5 (5%) habían reiniciado el tratamiento con Etanercept después de una retirada anterior del tratamiento; y 45 (41%) habían parado la administración de Etanercept (pero permanecían bajo observación); mientras que 25/109 (23%) pacientes abandonaron de forma permanente el estudio. Las mejoras en el estado clínico alcanzadas en el estudio original generalmente se mantuvieron en todas las variables de eficacia durante todo el periodo de seguimiento. Los pacientes a los que se administraba Etanercept podían acceder a un periodo de retirada y retratamiento opcional una vez durante el estudio de extensión con base en la opinión del investigador sobre la respuesta clínica. Treinta pacientes entraron en el periodo de retirada. Se notificó que 17 pacientes tuvieron un brote (definido como ≥ 30% de empeoramiento en al menos 3 de los 6 criterios de la ACR Pedi con ≥ 30% de mejora en no más de 1 de los 6 criterios restantes y un mínimo de 2 articulaciones activas); el tiempo medio hasta el brote después de la retirada de Etanercept fue de 190 días. Trece pacientes tuvieron un retratamiento y el tiempo medio hasta el retratamiento desde la retirada se estimó en 274 días. Debido a la pequeña cantidad de datos en estos puntos, estos resultados deberían interpretarse con precaución.
El perfil de seguridad fue consistente con el observado en el estudio original.
En pacientes con artritis idiopática juvenil, no se han realizado ensayos para evaluar los efectos de la continuación del tratamiento con Etanercept en aquellos que no respondieron después de 3 meses de tratamiento. Además, tampoco se han realizado estudios para evaluar los efectos de la reducción de la dosis recomendada de Etanercept tras su uso a largo plazo en pacientes con AI J.
Pacientes pediátricos con psoriasis en placas: La eficacia de Etanercept se evaluó en un ensayo aleatorizado, doble ciego, controlado con placebo, en 211 pacientes pediátricos de edades entre 4 y 17 años, con psoriasis en placas de moderada a grave (definido por una puntuación sPGA ≥ 3, BSA ≥ 10% y PASI ≥ 12). Los pacientes que entraron en el estudio presentaban antecedentes de tratamiento con fototerapia o terapia sistémica, o no habían sido controlados adecuadamente con terapia tópica.
Los pacientes recibieron Etanercept 0,8 mg/kg (hasta un máximo de 50 mg) o placebo una vez a la semana durante 12 semanas. En la semana 12, un mayor número de pacientes aleatorizados a tratamiento con Etanercept presentaron respuestas de eficacia positiva (Ej, PASI 75) frente a los pacientes aleatorizados a placebo.
Tabla 8. Resultados a las 12 semanas en psoriasis pediátrica en placas
|
Etanercept 0,8 mg/kg Una vez a la semana (N = 106) |
Placebo (N = 105) |
|
|
PASI 75, n (%) |
60 (57%)a |
12 (11%) |
|
PASI 50, n (%) |
79 (75%)a |
24 (23%) |
|
sPGA “aclaramiento” o “mínimo”, n (%) |
56 (53%) |
14 (13%) |
Abreviaturas: sPGA-static Physician Global Assessment
a p < 0,0001 comparado con placebo
Después del periodo de tratamiento doble ciego de 12 semanas, todos los pacientes recibieron 0,8 mg/kg (hasta un máximo de 50 mg) de Etanercept una vez a la semana durante 24 semanas adicionales. Las respuestas observadas durante la fase abierta son similares a las observadas en el periodo doble ciego.
Durante el periodo aleatorizado de retirada, experimentaron recaída de la enfermedad (pérdida de respuesta PASI 75) un número significativamente mayor de pacientes realeatorizados a placebo frente a los pacientes realeatorizados a Etanercept. Con tratamiento continuado, las respuestas se mantuvieron hasta 48 semanas.
La seguridad y eficacia a largo plazo de Etanercept 0,8 mg/kg (hasta 50 mg) una vez a la semana, fue evaluada en un ensayo de extensión de fase abierta con 181 pacientes pediátricos con psoriasis en placas durante un periodo de 2 años, así como en el estudio de 48 semanas descrito anteriormente. La experiencia a largo plazo con Etanercept fue generalmente comparable a la del estudio original de 48 semanas, y no reveló ningún hallazgo nuevo de seguridad.
CONTRAINDICACIONES:
Etanercept está contraindicado en pacientes con:
• Hipersensibilidad al principio activo o a alguno de los excipientes.
• Sepsis o riesgo de sepsis.
• No se debe iniciar el tratamiento con ERELZI® en pacientes con infecciones activas, incluyendo infecciones crónicas o localizadas.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Debido a que no se cuenta con información suficiente acerca del uso de Etanercept durante el embarazo, por lo que no se le deberá de prescribir a mujeres embarazadas.
La toxicidad peri y posnatal de Etanercept no se ha podido establecer, ya que no se cuenta con datos clínicos o preclínicos al respecto, tampoco de los efectos de este medicamento sobre la fertilidad y, en general, sobre el rendimiento reproductivo.
En estudios de desarrollo toxicológico llevados a cabo en ratas y conejos, utilizando una dosis terapéutica de 50 mg una vez por semana, las exposiciones sistémicas basadas en las ABC de Etanercept fueron 21 y 25 veces mayores en los animales que en los humanos; y de 10 a 13 veces mayores en los animales en comparación con los humanos utilizando una dosis máxima de 50 mg dos veces por semana.
No se observó evidencia de daño fetal en ratas o conejos neonatales, sin embargo, estos estudios no siempre predicen la respuesta humana.
Etanercept atraviesa la placenta y se ha detectado en el suero de lactantes nacidos de pacientes de sexo femenino tratadas con Enbrel durante el embarazo.
Se desconoce el impacto clínico de esto, sin embargo, los lactantes pueden tener un mayor riesgo de infección. Generalmente no se recomienda la administración de vacunas vivas a lactantes por 16 semanas después de la última dosis de etanercept administrada a la madre.
Lactancia: En ratas lactantes, tras la administración subcutánea, etanercept se excretó en la leche y se detectó en el suero de las crías. La información limitada de las publicaciones médicas indica que se ha detectado etanercept a niveles bajos en la leche humana. Se podría considerar el uso de etanercept durante la lactancia teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento para la mujer.
Si bien se espera que la exposición sistémica en lactantes sea baja debido a que etanercept se degrada en gran medida en el tracto gastrointestinal, se dispone de datos limitados sobre la exposición sistémica en lactantes. Por lo tanto, se podría considerar la administración a lactantes de vacunas de microorganismos vivos (por ejemplo, la vacuna BCG) de madres en tratamiento con Etanercept, a las 16 semanas tras la interrupción de la lactancia (o en un momento anterior si los niveles séricos de etanercept del lactante son indetectables).
REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad: Las reacciones adversas notificadas con mayor frecuencia son reacciones en la zona de inyección (tales como dolor, hinchazón, picor, enrojecimiento y sangrado en el lugar de punción), infecciones (tales como infecciones del tracto respiratorio alto, bronquitis, infecciones vesicales e infecciones cutáneas), cefalea, reacciones alérgicas, desarrollo de autoanticuerpos, picor y fiebre.
Se han notificado también reacciones adversas graves con Etanercept. Los antagonistas de TNF, como Etanercept, afectan al sistema inmune, y su utilización puede afectar a las defensas del organismo frente a infecciones y cáncer. Las infecciones graves afectan a menos de 1 de cada 100 pacientes tratados con Etanercept. Las notificaciones incluyen infecciones mortales y potencialmente mortales y sepsis. También se han notificado varias neoplasias con el uso de Etanercept, incluyendo cánceres de mama, pulmón, piel y ganglios linfáticos (linfoma).
Asimismo, se han notificado reacciones hematológicas, neurológicas y autoinmunes graves. Éstas incluyen casos raros de pancitopenia, y casos muy raros de anemia aplásica. Con el uso de Etanercept, también se han observado casos raros o muy raros de desmielinización central y periférica, respectivamente. También ha habido notificaciones de lupus, enfermedades relacionadas con lupus y vasculitis.
Pacientes adultos: Se observó el mismo grado de deserción en pacientes con artritis reumatoide, artritis psoriásica y espondilitis anquilosante tratados durante estudios clínicos controlados con Etanercept y placebo debido a reacciones adversas.
Reacciones en la zona de inyección: En cuanto a las reacciones observadas en la zona de inyección, la frecuencia fue más alta en el primer mes de tratamiento y fue disminuyendo subsecuentemente. Durante el estudio clínico fue significativamente mayor la reacción en la zona de inyección (eritema y/o comezón, dolor o inflamación) presentada en el grupo tratado con placebo frente al grupo tratado con Etanercept.
En la experiencia de la fase de mercadeo controlado para el tratamiento con Etanercept, se ha observado sangrado en el sitio de inyección y equimosis concomitantes.
Los pacientes con enfermedades reumatológicas tratados con Etanercept tuvieron una incidencia de reacciones en la zona de inyección significativamente mayor que los pacientes tratados con placebo (36% frente a 9%).
En los ensayos controlados en pacientes con psoriasis en placas, aproximadamente el 13,6% de los pacientes tratados con Etanercept desarrollaron reacciones en la zona de inyección durante las primeras 12 semanas de tratamiento frente al 3,4% de los pacientes tratados con placebo.
Infecciones: Se han reportado infecciones serias y mortales. Los patógenos reportados incluyen bacterias, micobacterias (incluyendo tuberculosis), virus y hongos. También se han reportado infecciones oportunistas (véase Precauciones generales).
Las tasas de infecciones serias (fatales, amenazas para la vida o que requirieron hospitalización o antibióticos intravenosos) y no serias fueron similares para Etanercept y placebo cuando se ajustó para la duración de la exposición, realizada a través de estudios controlados en pacientes con artritis reumatoide y artritis psoriásica.
Las infecciones respiratorias en vías aéreas superiores fueron las infecciones no serias más comúnmente reportadas. En los estudios controlados con placebo de espondilitis anquilosante, no hubo diferencias en las tasas de infección entre los pacientes tratados con Etanercept y el placebo.
En el caso de riesgo de muerte en pacientes tratados con Etanercept y que, de acuerdo con su historial clínico, presentaban sepsis establecida, los datos sugieren que sí hay posibilidad de incremento.
Tumores malignos: Se han presentado reportes de cáncer en varios sitios durante la poscomercialización de Etanercept.
Se detectaron casos de tumores malignos tras el tratamiento con Etanercept en un estudio clínico que incluyó pacientes con enfermedad de granulomatosis de Wegener.
En estudios doble ciego controlados con placebo llevados a cabo en 203 pacientes con espondilitis anquilosante, tratados con Etanercept durante un periodo máximo de 6 meses, no se desarrollaron tumores malignos.
Enfermedad pulmonar intersticial: En los ensayos clínicos controlados de etanercept para todas las indicaciones, la frecuencia (porcentaje de incidencia) de enfermedad pulmonar intersticial en pacientes que estaban recibiendo etanercept sin tratamiento concomitante con metotrexato fue del 0,06% (frecuencia rara). En los ensayos clínicos controlados que permitieron el tratamiento concomitante con etanercept y metotrexato, la frecuencia (porcentaje de incidencia) de enfermedad pulmonar intersticial fue del 0,47% (frecuencia poco frecuente). Durante el periodo poscomercialización, se han notificado casos de enfermedad pulmonar intersticial (incluyendo neumonitis y fibrosis pulmonar), algunos de los cuales tuvieron desenlace de muerte.
Enzimas hepáticas aumentadas: En los periodos de doble ciego de los ensayos clínicos controlados de etanercept para todas las indicaciones, la frecuencia (porcentaje de incidencia) de acontecimientos adversos de enzimas hepáticas aumentadas en pacientes que estaban recibiendo etanercept sin tratamiento concomitante con metotrexato fue del 0,54% (frecuencia poco frecuente). En los periodos de doble ciego de los ensayos clínicos controlados que permitieron el tratamiento concomitante con etanercept y metotrexato, la frecuencia (porcentaje de incidencia) de acontecimientos adversos de enzimas hepáticas aumentadas fue del 4,18% (frecuencia frecuente).
Hepatitis autoinmune: En los ensayos clínicos controlados de etanercept para todas las indicaciones, la frecuencia (porcentaje de incidencia) de hepatitis autoinmune en pacientes que estaban recibiendo etanercept sin tratamiento concomitante con metotrexato fue del 0,02% (frecuencia rara). En los ensayos clínicos controlados que permitieron el tratamiento concomitante con etanercept y metotrexato, la frecuencia (porcentaje de incidencia) de hepatitis autoinmune fue del 0,24% (frecuencia poco frecuente).
Formación de anticuerpos antifármaco: Es desconocido el impacto a largo plazo del uso de Etanercept con respecto a las enfermedades autoinmunes, se ha observado a través de estudios controlados, que la generación de nuevos anticuerpos nucleares (AAN) positivos (≥ 1:40), nuevos anticuerpos positivos antiADN de doble hélice y nuevos anticuerpos anticardiolipina, fue superior en los pacientes que fueron tratados con Etanercept frente a los pacientes del grupo tratado con placebo.
Raramente se han descrito reportes de pacientes (incluyendo aquellos que presentan factor reumatoide positivo) que han desarrollado por presentación clínica y biopsia autoanticuerpos adicionales en combinación con un síndrome similar al lupus o sarpullidos compatibles con lupus cutáneo o lupus discoide subagudo.
Entre los 175 pacientes con espondilitis anquilosante tratados con Etanercept, tres desarrollaron anticuerpos contra Etanercept, ninguno de ellos neutralizante.
Pancitopenia y anemia aplásica: Durante el periodo poscomercialización, se han notificado casos de pancitopenia y anemia aplásica, algunos de los cuales tuvieron desenlace de muerte (ver Precauciones generales).
Otros reportes de reacciones adversas:
Artritis reumatoide y artritis psoriásica: Se han observado reacciones adversas similares en pacientes con artritis psoriásica y pacientes con artritis reumatoide.
Las reacciones adversas se enlistan en la tabla 10 en categorías de frecuencia CIOMS:
Muy común: ≥ 1 de cada 10.
Común: ≥.1 de cada 100 a < 1 de cada 10.
Poco común: ≥.1 de cada 1,000 a < 1 de cada 100
Rara: ≥.1 de cada 10,000 a < 1 de cada 1,000.
Muy rara: ≤ 1 de cada 10,000.
No conocida: la frecuencia no puede ser estimada con precisión a partir de los estudios clínicos.
Tabla 9. Reacciones adversas asociadas al tratamiento con Etanercept en pacientes con artritis reumatoide y artritis psoriásica
|
Frecuencia |
Reacción adversa |
|
Infecciones e infestaciones |
|
|
Muy común |
Infección (incluyendo infección del tracto respiratorio alto, bronquitis, cistitis, infección cutánea)*. |
|
Poco común |
Infecciones graves (incluyendo neumonía, celulitis, artritis bacteriana, sepsis e infecciones parasitarias)*. |
|
Rara |
Tuberculosis, infección oportunista (incluyendo infecciones fúngicas invasivas, protozoarias, bacterianas, por micobacterias atípicas, infecciones víricas e infección por Legionella)* (ver sección de Precauciones generales). |
|
No conocida |
Reactivacion de la hepatitis B, infección por Listeria*. |
|
Neoplasia benignos, malignos y no especificadas (incluyendo quistes y pólipos) |
|
|
Poco común |
Cáncer de piel no melanoma (véase Precauciones generales). |
|
Rara |
Melanoma maligno (véase Precauciones generales), linfoma, leucemia*. |
|
No conocida |
Carcinoma de célula de Merkel* (véase Precauciones generales). |
|
Trastornos hemáticos y del sistema linfático |
|
|
Poco común |
Trombocitopenia, anemia, leucopenia, neutropenia. |
|
Rara |
Pancitopenia (véase Precauciones generales). |
|
Muy rara |
Anemia aplásica (véase Precauciones generales). |
|
No conocida |
Histiocitosis hematofágica (síndrome de activación macrofágica)*. |
|
Trastornos del sistema inmunológico |
|
|
Común |
Reacciones alérgicas (véase trastornos de piel y tejido subcutáneo), formación de autoanticuerpos. |
|
Poco común |
Vasculitis, incluyendo vasculitis ANCA positiva (vasculitis anticuerpo anticitoplasma de neutrófilo positiva). |
|
Rara |
Reacciones alérgicas serias, anafilácticas, incluyendo angioedema y broncoespasmos. |
|
Trastornos generales y alteraciones en el lugar de administración |
|
|
Muy común |
Reacciones en la zona de inyección (incluyendo hemorragia, hematomas, eritema, picor, dolor, hinchazón). |
|
Común |
Pirexia. |
|
Trastornos del sistema nervioso |
|
|
Muy común |
Dolor de cabeza |
|
Rara |
Eventos desmielinizantes del SNC, incluida esclerosis múltiple y afecciones desmielinizantes localizadas tales como neuritis óptica y mielitis transversa (ver sección de Precauciones generales), eventos desmielinizantes periféricos, incluido el síndrome de Guillain-Barré, polineuropatía desmielinizante inflamatoria crónica, polineuropatía desmielinizante, y neuropatía motora multifocal (ver sección Precauciones generales, convulsiones) |
|
Trastornos oculares |
|
|
Poco común |
Uveítis, escleritis. |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Rara |
Enfermedad pulmonar intersticial (incluida fibrosis pulmonar y neumonitis). |
|
Transtornos gastrointestinales |
|
|
Poco común |
Enfermedad inflamatoria intestinal. |
|
Trastornos de piel y tejido subcutáneo |
|
|
Común |
Prurito, erupción. |
|
Poco común |
Angioedema, psoriasis (nuevo comienzo o exacerbación, incluido todos los subtipos), urticaria, erupción psoriasiforme*. |
|
Rara |
Vasculitis cutánea (incluyendo vasculitis leucocitoclástica), Síndrome de Stevens-Johnson, eritema multiforme. |
|
Muy rara |
Necrólisis epidérmica tóxica. |
|
Trastornos musculoesqueléticos, del tejido conjuntivo y óseos |
|
|
Rara |
Lupus eritematoso cutáneo subagudo, lupus eritematoso discoide, síndrome similar al lupus |
|
Trastornos renales y urinarios |
|
|
Desconocido |
Glomerulonefritis |
|
Trastornos cardiacos |
|
|
Poco común |
Empeoramiento de la insuficiencia cardiaca congestiva |
|
Rara |
Insuficiencia cardiaca congestiva de reciente diagnóstico |
|
Trastornos hepatobiliares |
|
|
Poco común |
Enzimas hepáticas elevadas, (véase Precauciones generales) |
|
Rara |
Enzimas hepáticas elevadas, (véase Precauciones generales) Hepatitis autoinmune* |
* RAM Identificadas posterior a la comercialización
Descripción de ciertas reacciones adversas:
Neoplasias y trastornos linfoproliferativos:
Se observaron ciento veintinueve (129) nuevas neoplasias de distintos tipos en 4.114 pacientes con artritis reumatoide tratados con Etanercept en ensayos clínicos de hasta 6 años de duración aproximadamente, incluyendo 231 pacientes tratados con Etanercept en combinación con metotrexato en el ensayo de 2 años controlado con comparador activo. Los porcentajes e incidencias en estos ensayos clínicos fueron similares a los esperados para la población estudiada. Se notificaron un total de dos casos de neoplasias en los ensayos clínicos de aproximadamente 2 años de duración, en los que había 240 pacientes con artritis psoriásica tratados con Etanercept. En los ensayos clínicos llevados a cabo durante más de dos años con 351 pacientes con espondilitis anquilosante, se notificaron 6 casos de neoplasias en pacientes tratados con Etanercept. En un grupo de 2.711 pacientes con psoriasis en placas tratados con Etanercept, en ensayos doble ciego y abiertos de hasta 2,5 años de duración, se notificaron 30 neoplasias y 43 cánceres de piel no-melanoma.
En un grupo de 7,416 pacientes tratados con Etanercept en ensayos clínicos de artritis reumatoide, artritis psoriásica, espondilitis anquilosante y psoriasis, se notificaron 18 linfomas.
Durante el periodo poscomercialización, se han recibido notificaciones de varias neoplasias (incluyendo cáncer de mama y pulmón y linfoma). (Ver Precauciones Generales)
Población pediátrica: Se observa similitud en frecuencia y tipo de efectos adversos que se observan en pacientes adultos y en pacientes pediátricos.
Reacciones adversas en pacientes pediátricos con artritis idiopática juvenil: Se reportó una incidencia significativamente mayor en las reacciones en el sitio de inyección, incluyeron eritema y/o prurito, dolor o tumefacción reportadas en estudios clínicos controlados en el que participaron pacientes con artritis juvenil crónica y que fueron tratados con Etanercept frente al grupo tratado con placebo.
En pacientes con artritis juvenil idiopática, las infecciones fueron el efecto adverso más común reportado, así como los tipos de infecciones reportados fueron, en general, leves y semejantes a las infecciones observadas comúnmente en pacientes pediátricos ambulatorios.
En cuanto a la incidencia, se observó un comportamiento similar entre los pacientes tratados con Etanercept y los pacientes tratados con placebo.
Estudios clínicos que incluyeron a pacientes pediátricos con artritis juvenil idiopática tratados con Etanercept reportaron dos casos de infección por varicela con signos y síntomas urgentes de meningitis aséptica (ver Precauciones Generales).
En otro estudio, se reportaron 4 pacientes con síndrome de activación de macrófagos.
Reacciones adversas en pacientes pediátricos con Psoriasis en placas: En un estudio realizado a pacientes con psoriasis pediátrica en placas , realizado durante 48 semanas en 211 niños de edades entre 4 y 17 años, los eventos adversos notificados fueron similares a los observados en estudios previamente realizados en adultos con psoriasis en placas.
Comparabilidad de Etanercept con el producto de referencia en términos de seguridad: En varios estudios de dosis única de PK en voluntarios sanos, la proporción de sujetos y tipos de efectos adversos emergentes del tratamiento (TEAE) informados después de la administración de Etanercept fueron comparables a los informados con el producto de referencia.
En el Estudio GP15-302 en pacientes con psoriasis crónica de tipo placa, la incidencia de AET de los dos grupos de tratamiento fue generalmente comparable. En la tabla 10 se presentan las AET con sospecha de relación causal con el tratamiento del estudio durante TP1.
Tabla 10. TEAE sospechosos de estar relacionados con el fármaco del estudio durante TP1, por término preferido (1% o más de incidencia total de clasificación de órganos del sistema (SOC) o término preferido (PT), estudio GP15-302
|
Término preferido |
Etanercept N = 264 n (%) |
Producto de referencia N = 267 n(%) |
|
Número de pacientes con por lo menos un TEAE |
35 (13.3) |
37 (13.9) |
|
Nasofaringitis |
2 (0.8) |
4 (1.5) |
|
Infección del tracto respiratorio superior |
3 (1.1) |
3 (1.1) |
|
Aumento de peso |
3 (1.1) |
3 (1.1) |
n (%) = número de sujetos (porcentaje) con eventos adversos; N = número de sujetos estudiados; PT = término preferido; SOC = sistema de clasificación de órganos; TEAE = evento adverso emergente del tratamiento; TP1 = Periodo de tratamiento 1.
La incidencia general de SAE fue baja y comparable, sin que ocurriera SAE en más de un paciente.
Se observaron perfiles de seguridad y comparaciones similares en TP2 y periodo de extensión. La siguiente tabla proporciona una lista de los TEAE con una relación causal sospechada para estudiar el tratamiento desde el inicio hasta la semana 52, en aquellos pacientes que recibieron continuamente Etanercept o el medicamento de referencia.
Tabla 11. TEAE sospechosos de estar relacionados con el fármaco del estudio (línea de base hasta la semana 52), por término preferido (1% o mayor incidencia total)
|
Término preferido |
Etanercept N = 164 n (%) |
Producto de referencia N = 171 n (%) |
|
Número de pacientes con al menos un TEAE |
34 (20.7) |
33 (19.3) |
|
Nasofaringitis |
4 (2.4) |
2 (1.2) |
|
Infección viral del tracto respiratorio superior |
2 (1.2) |
4 (2.3) |
|
Infección del tracto respiratorio superior |
2 (1.2) |
3 (1.8) |
|
Faringitis bacteriana |
2 (1.2) |
0 |
|
Rinitis |
0 |
2 (1.2) |
|
Infección bacteriana del tracto respiratorio superior |
2 (1.2) |
0 |
|
Peso aumentado |
2 (1.2) |
3 (1.8) |
|
Gamma-glutamiltransferasa incrementada |
2 (1.2) |
0 |
|
Psoriasis |
0 |
3 (1.8) |
|
Prurito |
0 |
2 (1.2) |
|
Linfadenopatía |
2 (1.2) |
0 |
|
Neutropenia |
2 (1.2) |
0 |
|
Cefalea |
0 |
2 (1.2) |
n (%) = número de sujetos (porcentaje) con eventos adversos; N = número de sujetos estudiados; TEAE = evento adverso emergente del tratamiento.
También se registraron perfiles de seguridad comparables en TP 2 en aquellos pacientes que continuaron con su tratamiento original y aquellos que recibieron 6 interruptores alternos semanales entre las semanas 12 y 30.
Tabla 12. TEAEs independientemente de la causalidad durante TP2, por grupos de tratamiento agrupados, por término preferido (conjunto de seguridad de TP2) (≥ 2% o mayor incidencia)
|
Término |
Tratamientos acumulados N = 196 n (%) |
Tratamientos continuados N = 301 n (%) |
|
Reacciones en la zona de inyección |
9 (4.6) |
13 (4.3) |
|
Dolor de cabeza |
5 (2.6) |
5 (1.7) |
|
Faringitis |
5 (2.6) |
10 (3.3) |
|
Infecciones virales en el tracto respiratorio |
5 (2.6) |
4 (1.3) |
|
Dolor de espalda |
4 (2.0) |
4 (1.3) |
|
Nasofaringitis |
4 (2.0) |
8 (2.7) |
|
Psoriasis |
4 (2.0) |
4 (1.3) |
n (%) = número de sujetos (porcentaje) con eventos adversos; N = número de sujetos estudiados; TEAE = evento adverso emergente del tratamiento.
lnmunogenicidad: La inmunogenicidad de Etanercept y el producto de referencia se evaluó para los 531 pacientes con psoriasis en el estudio GP15-302. Hasta la semana 12, 5 pacientes (1.9%) fueron confirmados positivos para ADA de unión en el grupo de productos de referencia, mientras que todos los pacientes en el grupo Etanercept fueron negativos para ADA de unión. Al final del estudio en la semana 52, un paciente adicional había dado positivo por unión a ADA mientras estaba en tratamiento con Etanercept. Todos los resultados positivos de ADA tuvieron títulos bajos, fueron transitorios y negativos para la capacidad neutralizante.
Los datos de seguridad informados en el estudio clínico fundamental Etanercept indican un perfil de eventos adversos consistente con el del medicamento de referencia.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogénesis: Debido a que Etanercept es una proteína humana y por ello los animales pueden desarrollar anticuerpos contra él, no se han realizado estudios a largo plazo en animales que permitan evaluar el potencial carcinógeno de Etanercept.
Mutagénesis: En los estudios realizados de mutagénesis in vivo e in vitro, no se observaron evidencias de actividad mutagénica.
Fertilidad: No se dispone de datos preclínicos sobre la toxicidad peri- y post-natal de Etanercept, ni tampoco de los efectos de Etanercept sobre la fertilidad y capacidad reproductiva.
Deterioro de la fertilidad: No se han realizado estudios a largo plazo en animales que permitan evaluar el efecto de Etanercept sobre la fertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Tratamiento concomitante con anakinra: Se tienen reportes de una tasa superior de infecciones graves cuando los pacientes son tratados al mismo tiempo con Etanercept y anakinra en comparación a las infecciones presentadas en pacientes que son tratados solamente con Etanercept (datos históricos). En un estudio doble ciego, controlado con placebo realizado en pacientes que estaban en tratamiento con metotrexato, se observó que los pacientes tratados con Etanercept y anakinra la tasa de infecciones graves y neutropenia fue superior a la de los pacientes en tratamiento con Etanercept (véase Precauciones generales).
Tratamiento concomitante con abatacept: No se recomienda el uso concomitante de Etanercept y abatacept debido a que en el caso del tratamiento concomitante de abatacept y Etanercept dio como resultado un incremento de la incidencia de las reacciones adversas graves de acuerdo con los estudios clínicos disponibles, por lo que esta combinación no ha demostrado un beneficio clínico mayor (ver Precauciones generales).
Tratamiento concomitante con sulfasalacina: En un estudio clínico, en el que los pacientes además de ser tratados con sulfasalacina, fueron tratados con Etanercept presentaron una disminución estadísticamente significativa en el recuento medio de glóbulos blancos en comparación con los grupos tratados con Etanercept o sulfasalacina en monoterapia. El significado clínico de esta interacción es desconocido. Sin embargo, no se recomienda el uso concomitante.
Sin interacción: Con excepción de la sulfasalacina, los salicilatos, glucorticoides, antiinflamatorios no esteroideos, analgésicos (AINE) o metotrexato no han presentado interacción durante el tratamiento con Etanercept en los estudios clínicos realizados en pacientes adultos con artritis reumatoide.
Se sabe que el metotrexato no tiene ningún efecto sobre la farmacocinética de Etanercept. No se han observado interacciones farmacocinéticas clínicamente significativas entre medicamentos en estudios digoxina o Warfarina.
Por motivos de ausencia de estudios de incompatibilidad, este medicamento no debe de ser mezclado con otros medicamentos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Hasta el momento no se han reportado alteraciones en los resultados de pruebas de laboratorio causados por el tratamiento con Etanercept.
PRECAUCIONES GENERALES:
Reacciones alérgicas: La administración de Etanercept con frecuencia puede producir reacciones alérgicas asociadas. Se han observado con frecuencia reacciones alérgicas asociadas a la administración de Etanercept. Las reacciones alérgicas han incluido angioedema y urticaria: se han producido reacciones graves. Si se produce cualquier reacción alérgica o anafiláctica grave, la terapia con Etanercept debe interrumpirse inmediatamente y comenzar una terapia apropiada.
En caso que el paciente presente cualquier reacción alérgica o anafiláctica grave, el tratamiento con Etanercept deberá ser interrumpido inmediatamente (véase Reacciones secundarias y adversas).
lnmunodepresión: Debido a que el TNF es un mediador de la inflamación y modula la respuesta inmunológica de las células, es posible que los antagonistas TNF, como Etanercept, afecten al sistema inmunológico del paciente frente a infecciones y tumores malignos. Se han reportado pacientes con cáncer en varios sitios durante la vida comercial del producto. No está establecida la influencia de Etanercept en el desarrollo y curso de tumores malignos e infecciones activas y/o crónicas.
Se ha observado una mayor incidencia de linfoma en pacientes que han sido tratados con antagonistas de TNF en comparación con pacientes control, en las porciones controladas de los estudios clínicos, sin embargo, la ocurrencia fue rara y el periodo de seguimiento de los pacientes con placebo fue menor que la de los pacientes que recibieron la terapia. Además, existe un incremento en el riesgo de linfoma en pacientes con artritis reumatoide de larga permanencia muy activa, enfermedad inflamatoria que complica la estimación del riesgo. Con este conocimiento, no se puede excluir un posible riesgo para el desarrollo de linfomas y otras malignidades en pacientes tratados con antagonistas TNF.
Hay reportes de que dos pacientes con artritis idiopática juvenil desarrollaron infección por varicela y signos y síntomas de meningitis aséptica que se resolvieron sin secuelas. Los pacientes con una exposición significativa al virus de la varicela deben interrumpir temporalmente el tratamiento con ERELZI® y considerarse el tratamiento profiláctico con inmunoglobulina de varicela zóster.
La seguridad y eficacia de etanercept en pacientes con inmunosupresión no han sido evaluadas.
En un ensayo con 49 pacientes adultos con artritis reumatoide tratados con Etanercept, no hubo evidencia de disminución de la hipersensibilidad de tipo retardado, disminución de los niveles de inmunoglobulinas o cambio en el número de poblaciones de células efectoras.
Dos pacientes con artritis idiopática juvenil desarrollaron infección por varicela y signos y síntomas de meningitis aséptica que se resolvieron sin secuelas. Los pacientes con una exposición significativa al virus de la varicela deben interrumpir temporalmente el tratamiento con Etanercept y debe considerarse el tratamiento profiláctico con inmunoglobulina de varicela zóster.
Cáncer y trastornos linfoproliferativos:
Tumores sólidos y hematopoyéticas (excluyendo cánceres de piel): A lo largo de la comercialización de Etanercept, se han notificado varias neoplasias afectando varios sitios (incluyendo cáncer de mama y pulmón y linfoma). (Ver Reacciones secundarias y adversas).
Se ha observado una mayor incidencia de linfoma en pacientes que han sido tratados con antagonistas de TNF en comparación con pacientes control. Sin embargo, la incidencia fue rara, y el periodo de seguimiento de los pacientes con placebo fue más corto que el de los pacientes que recibían el tratamiento con el antagonista del TNF. Los pacientes con artritis reumatoide, con enfermedad muy inflamatoria y de alta actividad, presentan mayor riesgo basal de linfomas, debido a lo anterior, es complejo estimar el riesgo.
De acuerdo con lo reportado en los análisis de los estudios clínicos de artritis reumatoide utilizando Etanercept no han confirmado o excluido un incremento en el riesgo de cáncer.
En niños y adolescentes que fueron tratados con antagonistas del TNF (como Etanercept), fue notificada la presencia de cáncer (particularmente linfomas tipo Hodgkin y no Hodgkin). Muchos de los pacientes estuvieron recibiendo tratamiento con inmunosupresores concomitantemente. En algunos casos fue causa de muerte.
De acuerdo con lo actualmente reportado, no se puede excluir el riesgo de desarrollo de linfomas u otros tumores en pacientes tratados con un antagonista del TNF.
En el periodo de poscomercialización, se han notificado neoplasias, algunas mortales, en niños, adolescentes y adultos jóvenes (hasta 22 años de edad) tratados con antagonistas del TNF (inicio de la terapia ≤ 18 años de edad), incluyendo Etanercept. Aproximadamente la mitad de los casos eran linfomas.
Los otros casos representaban una variedad de diferentes neoplasias e incluían neoplasias raras normalmente asociadas con inmunosupresión. No puede excluirse un riesgo de desarrollo de neoplasias en niños y adolescentes tratados con antagonistas del TNF.
Cánceres de piel: Se han notificado melanomas y cáncer de piel no melanoma (CPNM) en pacientes tratados con antagonistas del TNF, incluyendo Etanercept. Es atípico el reporte de carcinoma de células de Merkel en pacientes tratados con Etanercept, sin embargo, es recomendable mantener vigilancia médica que incluya exámenes cutáneos durante el tratamiento con Etanercept, especialmente de aquellos con factores de riesgo de cáncer de piel.
Combinando los resultados de estudios clínicos controlados, se observaron más casos de CPNM en los pacientes que recibieron Etanercept en comparación con los pacientes control, particularmente en los pacientes con psoriasis.
Reacciones hematológicas: En pacientes tratados con Etanercept se han notificado raramente casos de pancitopenia y muy raramente casos de anemia aplásica, algunos con resultado mortal. Se debe tener precaución en pacientes tratados con Etanercept, los cuales tengan un historial de discrasias sanguíneas. Todos los pacientes y los padres/cuidadores deben ser advertidos de que si el paciente desarrolla signos y síntomas que sugieren la existencia de discrasias sanguíneas o infecciones (por ejemplo, fiebre persistente, odinofagia, hematomas, sangrado, palidez), mientras están tratándose con Etanercept deben informar inmediatamente a su médico. Será necesario realizar análisis sanguíneos para determinar el recuento de células sanguíneas completo. En caso que la discrasia sanguínea se confirme, no podrá continuar con el tratamiento con Etanercept.
Formación de anticuerpos antifármaco: La estrecha vigilancia médica es relevante, ya que el tratamiento con Etanercept puede producir la formación de anticuerpos autoinmunes (ver Reacciones secundarias y adversas).
Vacunas: En un estudio clínico doble ciego, aleatorizado, controlado con placebo 184 pacientes con artritis psoriásica también recibieron una vacuna polisacárida neumocócica multivalente en la semana 4. En este estudio la mayoría de los pacientes con artritis psoriásica que recibieron Etanercept fueron capaces de generar una respuesta inmune efectiva de células B a la vacuna polisacárida neumocócica, pero los títulos en conjunto fueron moderadamente inferiores y pocos pacientes duplicaron los títulos en comparación con pacientes que no recibieron Etanercept, de lo cual se desconoce el significado clínico. No deben administrarse vacunas vivas simultáneamente con Etanercept.
Eventos del Sistema Nervioso Central (SNC): En el caso de pacientes con esclerosis múltiple, no se han realizado estudios con Etanercept, sin embargo, otros estudios clínicos realizados con diferentes antagonistas del TNF han demostrado un incremento en la actividad de la enfermedad.
Se han presentado de forma ocasional el reporte de trastornos desmielinizantes del SNC en pacientes tratados con Etanercept (ver Reacciones secundarias y adversas). Muy atípicamente se han presentado reportes de polineuropatías desmielinizantes periféricas (incluido síndrome de Guillain-Barré).
En el caso de pacientes que se tenga conocimiento de alguna enfermedad desmielinizante preexistente, riesgo de presentar la enfermedad o de recién inicio de la enfermedad, antes de indicar el tratamiento con Etanercept, deberá realizarse la evaluación del riesgo/beneficio del tratamiento, dicha evaluación deberá incluir una evaluación neurológica.
Terapia combinada: En un ensayo clínico controlado de dos años de duración en pacientes adultos con artritis reumatoide, la combinación de Etanercept y metotrexato, no evidenció hallazgos inesperados sobre la seguridad, y el perfil de seguridad de Etanercept cuando se administra con metotrexato fue similar a los perfiles notificados en los ensayos de Etanercept y metotrexato solos. Están en marcha ensayos a largo plazo para evaluar la seguridad de la combinación. La seguridad a largo plazo cuando Etanercept se administra en combinación con otros fármacos antirreumáticos modificadores de la enfermedad (FARME), no ha sido establecida.
No se ha estudiado el uso de Etanercept en combinación con otras terapias sistémicas o fototerapia para el tratamiento de la psoriasis.
Insuficiencia renal y hepática: Basado en datos farmacocinéticos (ver Farmacocinética y farmacodinamia), en pacientes con insuficiencia renal o hepática, no se requiere ajuste de dosis; la experiencia clínica en este tipo de pacientes es limitada.
Insuficiencia cardiaca congestiva: Los médicos deben tener precaución cuando se use Etanercept en pacientes que tienen insuficiencia cardiaca congestiva (ICC). Ha habido informes poscomercialización sobre empeoramiento de la ICC, con y sin factores de precipitación identificables, en pacientes que están tomando Etanercept. También se han observado casos raros (< 0,1%) de ICC de novo, incluyendo ICC en pacientes sin enfermedad cardiovascular preexistente conocida. Algunos de estos pacientes tenían menos de 50 años de edad.
Dos grandes ensayos clínicos en los que se estaba evaluando el uso de Etanercept en el tratamiento de la ICC terminaron antes de tiempo debido a la falta de eficacia. Aunque no son concluyentes, los datos de uno de estos ensayos sugieren una posible tendencia al empeoramiento de la ICC en aquellos pacientes asignados al tratamiento con Etanercept.
Trastornos cardiacos: En pacientes con dosificación de Etanercept se han notificado casos de empeoramiento de la insuficiencia cardiaca congestiva (ICC), con y sin factores de precipitación identificables.
Dos grandes estudios clínicos en los que se estaba evaluando el uso de Etanercept en el tratamiento de la ICC terminaron antes de tiempo debido a la falta de eficacia. Aunque no es concluyente, los datos de uno de estos estudios sugieren una posible tendencia al empeoramiento de la ICC en aquellos pacientes asignados al tratamiento con Etanercept. Además, un estudio clínico evaluando el uso de infliximab (un anticuerpo monoclonal que se une al TNFα) en el tratamiento de ICC fue terminado tempranamente debido al incremento de mortalidad en pacientes tratados con infliximab. Los médicos deberán utilizar con precaución Etanercept en pacientes con ICC.
Trazabilidad: Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados (o indicados) en la historia clínica del paciente.
Infecciones: El monitoreo médico para determinar si el paciente presenta o pudiera tener riesgo de presentar infecciones antes, durante y después del tratamiento con Etanercept, considerando que tiene una media de semivida de eliminación de aproximadamente 80 horas (rango de 7 a 300 horas), es muy relevante.
Se han notificado infecciones oportunistas, incluyendo infecciones micóticas invasivas, con el uso de Etanercept (ver Reacciones secundarias y adversas). En algunos casos no se han detectado infecciones fúngicas particulares y otras infecciones oportunistas, dando como resultado el retraso en el tratamiento apropiado y en ocasiones la muerte. Es relevante destacar que, en muchos reportes, los pacientes han recibido tratamiento concomitante con otros medicamentos que incluyen inmunosupresores. En la valoración de los pacientes para determinar la presencia de infecciones, debe considerarse el riesgo para el paciente de padecer infecciones oportunistas relevantes (por ejemplo, exposición a micosis endémicas).
Se debe monitorear estrechamente a los pacientes que desarrollen una nueva infección mientras están en tratamiento con Etanercept. Debe suspenderse la administración de Etanercept si un paciente desarrolla una infección grave. No han sido evaluadas la seguridad y eficacia de Etanercept en pacientes con infecciones crónicas. Los médicos deben extremar las precauciones cuando consideren el uso de Etanercept en pacientes con historial de infecciones crónicas o recurrentes o con trastornos subyacentes que pudieran predisponer a los pacientes a infecciones, tales como diabetes avanzada o mal controlada.
Tuberculosis: Se han notificado casos de tuberculosis activa, incluyendo tuberculosis miliar, y tuberculosis con localización extrapulmonar en pacientes en tratamiento con Etanercept.
En pacientes que han sido sometidos a tratamiento con antagonistas de FNT, incluyendo Etanercept, se han presentado casos de tuberculosis (incluyendo la tuberculosis diseminada o extrapulmonar). Es posible que la tuberculosis sea resultado de la reactivación de una infección latente o bien puede ser resultado de una nueva infección. Es importante realizar al paciente una evaluación inicial para poder establecer si tiene un riesgo incrementado a contraer Tuberculosis, ya sea por una infección activa o alguna infección latente, todo esto, previo al tratamiento con Etanercept. Deberá iniciarse una profilaxis si se presenta una infección latente por tuberculosis antes de iniciar la terapia con Etanercept. Los estudios de detección adecuados, por ejemplo, análisis de tuberculina en piel y radiografía de tórax, deben realizarse a todos los pacientes (deben aplicarse las recomendaciones locales). Se recomienda que se registre en la Tarjeta de Información del Paciente la realización de estas pruebas. Se recuerda a los prescriptores del riesgo de un resultado falso negativo en la prueba de tuberculina en piel, especialmente en pacientes que están gravemente enfermos o inmunocomprometidos.
De acuerdo con la información actual, se sabe que los pacientes con artritis reumatoide muestran una tasa incrementada a contraer tuberculosis, debido a esto, los médicos deberán monitorear a los pacientes que reciben Etanercept en búsqueda de signos y síntomas de tuberculosis activa, incluyendo pacientes con resultado negativo para infección de tuberculosis latente, esto debido a que algunos pacientes con resultado negativo a tuberculosis latente desarrollaron tuberculosis activa después de ser tratados con Etanercept.
No se debe iniciar la terapia con Etanercept si se diagnostica una tuberculosis activa. Si se diagnostica una tuberculosis inactiva (“latente”), debe iniciarse un tratamiento para la tuberculosis latente con una terapia anti-tuberculosis antes del inicio del tratamiento con Etanercept, y de acuerdo con las recomendaciones locales. En esta situación, el balance riesgo/beneficio de la terapia con Etanercept debe ser considerado cuidadosamente.
Se debe informar a todos los pacientes que deben consultar con su médico si aparecen signos o síntomas que sugieran tuberculosis (por ejemplo, tos persistente, pérdida de peso, febrícula) durante o después del tratamiento con Etanercept.
Reactivación de la hepatitis B: En tratamiento con antagonistas del TNF (incluido Etanercept), se ha notificado la reactivación de hepatitis B en portadores crónicos del virus de la hepatitis B (VHB). Estas notificaciones incluyen casos de reactivación de hepatitis B en pacientes que eran anticuerpos antiHBc positivos, pero antígeno HBs negativos. En el caso de los pacientes cuyo resultado para la infección por VHB sea positivo, se recomienda consultar a un médico especialista en el tratamiento de la hepatitis B. Debe actuarse con precaución cuando se administre Etanercept a pacientes previamente infectados por el VHB. Se debe monitorizar a estos pacientes durante todo el tratamiento, y durante varias semanas después de finalizarlo, para detectar síntomas y signos de una infección activa por VHB. Cabe resaltar que en su mayoría se trató de pacientes que recibieron tratamiento concomitante con inmunosupresores, que se sabe, pueden contribuir a la reactivación del virus. Debido a esto, el monitoreo médico (con especial atención en contar con evidencia de infección de VHB) para los pacientes con riesgo de infección es relevante, de este modo es posible determinar si son aptos para recibir la terapia anti-TNF. En caso de tener un paciente identificado como portador de VHB, deberá tener precaución al indicar el tratamiento con Etanercept, ya que aun cuando no está establecida una relación causal, existe el riesgo de infección activa durante el tratamiento.
No se dispone de datos adecuados de pacientes infectados por VHB y tratados con antivirales en combinación con antagonistas TNF. En los pacientes que desarrollen una infección por VHB, se debe interrumpir el tratamiento con Etanercept e iniciarse un tratamiento antiviral efectivo junto con el tratamiento de apoyo apropiado.
Empeoramiento de la hepatitis C: Aun cuando no se ha establecido una relación causal entre el uso de Etanercept y el empeoramiento de la hepatitis C, deberá monitorear al paciente.
Hipoglucemia en pacientes tratados para la diabetes: Durante el tratamiento con Etanercept en pacientes diabéticos, se han observado casos de hipoglucemia tras el inicio del tratamiento, esto pudiera implicar la necesidad de reducir la dosis de los medicamentos antidiabéticos en algunos de estos pacientes.
Advertencias especiales: Se han reportado infecciones de serias a mortales, incluyendo sepsis y tuberculosis, durante el tratamiento con Etanercept (véase Reacciones secundarias y adversas). Algunas de estas infecciones pueden estar relacionadas con bacterias, micobacterias, hongos y virus. Asimismo, se han reportado infecciones por oportunistas, los pacientes que desarrollen una nueva infección mientras sean tratados con Etanercept, deberán ser monitoreados de cerca. La administración de Etanercept deberá suspenderse si el paciente desarrolla una infección seria. Deberá tenerse precaución al considerar el uso de este medicamento en pacientes con antecedentes de infecciones recurrentes o crónicas o con padecimientos subyacentes que pueden predisponerlos a infecciones (véase Precauciones generales, Contraindicaciones y Reacciones secundarias y adversas).
Tratamiento concomitante con anakinra: Existe alto riesgo de contraer infecciones graves y neutropenia, si se administra de forma concomitante Etanercept y anakinra. No se recomienda el tratamiento simultáneo de Etanercept y anakinra, debido a que no se tienen reportes que indiquen un aumento en el beneficio para el paciente. (Ver las secciones Interacciones medicamentosas y de otro género y Reacciones secundarias y adversas).
Tratamiento concomitante con abatacept: En el tratamiento concomitante de Etanercept y abatacept, se observó que hay un incremento de la incidencia de las reacciones adversas graves. No se recomienda el tratamiento simultáneo de Etanercept y abatacept, debido a que no se tienen reportes que indiquen un aumento en el beneficio para el paciente (ver Interacciones medicamentosas y de otro género).
Granulomatosis de Wegener: No se recomienda el uso de Etanercept para el tratamiento de granulomatosis de Wegener, debido a que en un estudio controlado con placebo para 180 pacientes con granulomatosis de Wegener en el que fueron tratados con terapia convencional (incluyendo ciclofosfamida y esteroides de dosis altas) y Etanercept, no se observó mejora o mayor eficacia al compararlo con la terapia convencional.
Inclusive se observó un aumento significativo en la incidencia de enfermedades malignas no cutáneas de diferentes tipos en pacientes tratados con Etanercept al comparar con pacientes que recibieron únicamente el tratamiento habitual que no incluye Etanercept.
Hepatitis alcohólica: Los médicos deben tener cuidado cuando utilicen Etanercept en pacientes que padecen hepatitis alcohólica (moderada a grave), ya que de acuerdo con un estudio que incluyó 48 pacientes hospitalizados tratados con Etanercept o placebo para hepatitis alcohólica de moderada a grave (media de modelo de enfermedad hepática en estado terminal, puntuación = 25). Etanercept no sólo no fue eficaz, sino que después de 6 meses de tratamiento se observó un aumento significativo en la tasa de mortalidad en los pacientes tratados. Adicionalmente, se observó que las infecciones también fueron mayores en el grupo tratado con Etanercept. Por lo tanto, no debe usarse Etanercept en pacientes para el tratamiento de la hepatitis alcohólica.
Los médicos deberán tener precauciones cuando utilicen etanercept en pacientes que también tienen hepatitis alcohólica moderada o severa.
Poblaciones especiales:
Población pediátrica:
Vacunas: Antes de iniciar el tratamiento con Etanercept, en caso de ser posible, es ideal que los pacientes pediátricos cuenten con el esquema de vacunación previsto (ver Vacunas).
Efectos sobre la capacidad para conducir y utilizar máquinas: No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
Contiene sodio: Este medicamento contiene menos de 1 mmol de sodio (23 mg) por 25 mg o 50 mg.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Subcutánea.
Uso en adultos (pacientes de 18 años de edad o mayores):
Artritis reumatoide, artritis psoriásica y espondilitis anquilosante activa: Administrar 50 mg de ERELZI una vez por semana (como inyección subcutánea utilizando una jeringa de 50 mg/mL) o 25 mg de ERELZI dos veces a la semana (como inyección subcutánea utilizando una jeringa de 25 mg/0.5 mL), dejando un intervalo de tiempo de 72 a 96 horas.
Cabe mencionar que la administración de Etanercept 25 mg/0.5 mL vía subcutánea una vez por semana logra una respuesta más lenta y puede ser menos efectivo.
Debido a que no se han presentado interacciones, la administración de metotrexato, glucocorticoides, salcilatos (excepto sulfasalacina), fármacos antiinflamatorios no esteroideos (AINE) o analgésicos puede continuarse durante el tratamiento con Etanercept.
Etanercept se utiliza para reducir signos y síntomas en pacientes con artritis reumatoide activa moderada o grave e inhibir la progresión del daño estructural de la articulación.
Etanercept puede utilizarse solo o en combinación con metotrexato para el tratamiento de la artritis reumatoide activa (AR) en adultos cuando la respuesta a uno o más medicamentos antirreumáticos modificadores de la enfermedad (DMARDs), incluyendo al metotrexato (a menos que esté contraindicado), han demostrado ser inadecuados.
Etanercept puede ser usado en combinación con metotrexato en pacientes adultos que no responden adecuadamente a metotrexato en monoterapia.
Psoriasis en placas: La dosis recomendada de Etanercept es de 50 mg/mL vía subcutánea una vez por semana o bien dos inyecciones subcutáneas de Etarnecept de 25 mg/ 0.5 mL una vez por semana aplicadas aproximadamente al mismo tiempo. También puede administrar Etanercept de 25 mg/ 0.5 mL dos veces por semana mediante dos inyecciones administradas con una separación de 72 a 96 horas.
Las respuestas más altas pueden alcanzarse con el esquema terapéutico siguiente: administrar desde el inicio del tratamiento y hasta por 12 semanas Etanercept de 50 mg/mL dos veces por semana, seguido, en caso de ser necesario, de una dosis de Etanercept de 50 mg/mL una vez por semana o Etanercept de 25 mg/0.5 mL dos veces a la semana.
En el caso de pacientes adultos, es posible administrar el tratamiento de forma intermitente o bien de forma continua, queda a consideración del médico tratante. Si Etanercept se administra intermitentemente, en los ciclos de tratamiento subsecuentes al ciclo inicial, se deberá administrar Etanercept de 50 mg/mL una vez por semana o de 25 mg/0.5 mL dos veces por semana.
Se deberá suspender la administración de Etanercept en pacientes que no muestren respuesta después de las 12 semanas de tratamiento.
Etanercept puede usarse en monoterapia o bien en combinación con metotrexato en el caso de pacientes adultos que no responden adecuadamente al tratamiento de metotrexato en monoterapia.
Poblaciones especiales:
Poblaciones pediátricas:En el caso de los pacientes pediátricos, la dosis de Etanercept se establece de acuerdo con el peso corporal. Por lo tanto, es recomendable que los pacientes con un peso inferior a 62.5 kg sean dosificados adecuadamente con base en la proporción mg/kg. Cabe mencionar que Etanercept sólo está disponible como jeringa prellenada de 25 mg/0.5 mL y como jeringa prellenada y pluma precargada de 50 mg/mL, por lo que no es posible administrar Etanercept a los pacientes pediátricos que necesitan una dosis inferior a la dosis completa (25 mg/0.5 mL o 50 mg/mL). En caso que el paciente pediátrico requiera una dosis distinta, no podrá ser tratado con Etanercept. La opción terapéutica alternativa deberá ser con otro medicamento que contenga Etanercept en la presentación y dosis requerida. A los pacientes con un peso igual o superior a 62.5 kg se les puede administrar Etanercept utilizando la dosis fija de la jeringa prellenada (25 mg/0.5 mL o 50 mg/mL o la pluma precargada (50 mg/mL).
No existen estudios disponibles para el tratamiento en niños menores de 4 años con Etanercept (véase Indicaciones terapéuticas). Para consultar información específica de seguridad con respecto a tumores malignos, vacunas y enfermedad inflamatoria intestinal, consulte la sección de Precauciones generales.
La seguridad y eficacia de Etanercept en niños menores a 4 años de edad no ha sido establecida. No existen datos disponibles.
Artritis idiopática juvenil: La dosis recomendada es de 0.4 mg/kg (hasta un máximo de 25 mg por dosis) dos veces a la semana (con una separación de 72 a 96 horas). Debido a que no se han presentado interacciones, la administración de glucocorticoides, fármacos anti-inflamatorios no esteroideos (AINE), o analgésicos, puede continuarse durante el tratamiento con Etanercept.
No existen estudios disponibles para el tratamiento en niños menores de 4 años con Etanercept (véase Indicaciones terapéuticas). Para consultar información específica de seguridad con respecto a tumores malignos, vacunas y enfermedad inflamatoria intestinal, consulte la sección de Precauciones generales.
Psoriasis pediátrica en placas (a partir de 8 años): La dosis recomendada es de 0.8 mg/kg (hasta un máximo de 50 mg por dosis) una vez a la semana durante un periodo máximo de 24 semanas. El tratamiento debe ser descontinuado en pacientes en los que no se observe respuesta después de 12 semanas.
Pacientes con insuficiencia renal y hepática: No se requiere ajuste de la dosis.
Personas de edad avanzada: No se requiere ajuste de la dosis.
Metódo de administración: Etanercept debe administrarse a través de inyecciones subcutáneas en las siguientes zonas: el muslo, abdomen o parte superior del brazo. Cada nueva inyección deberá aplicarse al menos a 3 cm de distancia del sitio de inyección previo. No deberá aplicar Etanercept en áreas en las que la piel esté sensible, tenga moretones, esté enrojecida o dura.
Antes de aplicar Etanercept, saque el medicamento del refrigerador, una vez fuera del refrigerador, espere aproximadamente 15-30 minutos para que la solución alcance temperatura ambiente, no la caliente de ninguna otra forma. A continuación, se recomienda su uso inmediato. Deséchese inmediatamente después de su uso.
Etanercept se puede conservar fuera de refrigeración a una temperatura máxima de 25 °C, y durante un único periodo de hasta 4 semanas; tras el cual, el medicamento no se puede refrigerar de nuevo. Etanercept se debe desechar si no ha sido usado en las 4 semanas siguientes a su retirada de refrigeración.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La dosis máxima tolerada de Etanercept no ha sido establecida en humanos. En un estudio de endotoxemia, en voluntarios sanos se administraron dosis únicas IV de hasta 60 mg/m2 sin reportarse evidencia de toxicidades dosis-limitante. El nivel de dosis más alto evaluado en pacientes con artritis reumatoide ha sido una dosis IV de 32 mg/m2 seguida por una dosis subcutánea de 16 mg/m2 (aproximadamente 25 mg/0.5 ml) administradas dos veces por semana.
No se observó toxicidad dosis-limitante de la dosis durante los estudios clínicos en pacientes con artritis reumatoide. Actualmente, no se conoce de algún antídoto para Etanercept.
PRESENTACIONES:
Caja de cartón con un blíster con 2 o 4 jeringas prellenadas con 0.5 mL (25mg/0.5mL).
Caja de cartón con un blíster con 2 o 4 jeringas prellenadas con 1 mL (50mg/mL).
Caja de cartón con un blíster con 2 o 4 plumas precargadas (SensoReady) con 1 mL (50mg/mL).
Todas las presentaciones con instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese en refrigeración entre 2 ºC y 8 ºC. No se congele.
Conservar la jeringa prellenada o la pluma precargada en la caja para protegerla de la luz. Consérvese la caja bien cerrada.
Una vez fuera del refrigerador, espere aproximadamente 15-30 minutos para que la solución alcance temperatura ambiente, no la caliente de ninguna otra forma. A continuación, se recomienda su uso inmediato. Deséchese inmediatamente después de su uso.
Etanercept se puede conservar fuera de refrigeración a una temperatura máxima de 25 ºC y durante un único periodo de hasta 4 semanas; tras el cual el medicamento no se puede refrigerar de nuevo. Etanercept se debe desechar si no ha sido usado en las 4 semanas siguientes a su retirada de refrigeración.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para el médico. No se administre si la solución no es transparente o ligeramente opalescente, de incolora a ligeramente amarillenta. La solución puede contener pequeñas partículas de proteínas blancas o casi translúcidas. No se administre si el cierre ha sido violado. Si no se administra todo el producto, deséchese el sobrante. Deséchese inmediatamente después de su uso. No se use durante el embarazo y lactancia. Su venta requiere receta médica. Prohibida la venta fraccionada del producto. No se deje al alcance de los niños.
Reporte las sospechas de reacción adversa al correo farmacovigilancia@cofepris.gob.mx
Titular del registro:
Sandoz GmbH
Biochemiestraße 10, 6250 Kundl
Austria
Representante legal:
SANDOZ, S.A. de C.V.
La Candelaria No. 186,
Col. Atlántida, C.P. 04370,
Coyoacán,
Ciudad de México, México.
Reg. Núm. 061M2021 SSA IV
24330022130643/22Jul2024/IPPA_DRA-Sandoz
®Marca Registrada