
FIRMAGON FERRING
DEGARELIX
Solución inyectable
1 Caja, 2 Frasco(s) ámpula con liofilizado, 120 mg,
1 Caja, 1 Frasco ámpula con liofilizado, 80 mg,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada frasco ámpula contiene:
Degarelix 80 mg y 120 mg Excipiente cs
INDICACIONES TERAPÉUTICAS: FIRMAGON® FERRING es un bloqueador de los receptores de GnRH indicado para el tratamiento de pacientes con cáncer de próstata cuyo bloqueo androgénico está justificado. Esto incluye pacientes con incremento del PSA (antígeno prostático específico) después de ser sometidos a una prostatectomía o radioterapia.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacológicas:
Grupo farmacoterapéutico: Terapia endocrina. Otras hormonas antagonistas y agentes relacionados, código ATC: L02BX02.
Mecanismo de acción: Degarelix es un antagonista selectivo del receptor de GnRH (bloqueador) que se une competitiva y reversiblemente con los receptores de GnRH, reduciendo rápidamente la liberación de las gonadotropinas y en consecuencia la testosterona (T). El cáncer de próstata es sensible a la deprivación de la testosterona, un principio básico en el tratamiento del cáncer de próstata hormono-sensible. A diferencia de los agonistas de GnRH, los bloqueadores de los receptores de GnRH no inducen un incremento en la hormona luteinizante (LH) con la subsecuente elevación de la testosterona/estimulación tumoral y del empeoramiento sintomático potenciado flare después del inicio del tratamiento.
Una dosis única de 240 mg de FIRMAGON® FERRING, seguida por una dosis de mantenimiento mensual de 80 mg, causa de manera rápida, una disminución en las concentraciones de la hormona luteinizante (LH), de la hormona folículo estimulante (FSH) y subsecuentemente de la testosterona. La concentración plasmática de dihidrotestosterona (DHT) disminuye de manera similar a la testosterona.
FIRMAGON® FERRING es eficaz en el logro y mantenimiento de la supresión de la testosterona por debajo del nivel de castración médica de 0.5 ng/mL. Una dosis de mantenimiento mensual de 80 mg da como resultado una supresión sostenida de la testosterona en un 97% de los pacientes en por lo menos un año. La mediana de los niveles de testosterona después de un año de tratamiento fueron de 0.087 ng/mL (intervalo intercuartil 0.06-0.15) N = 167.
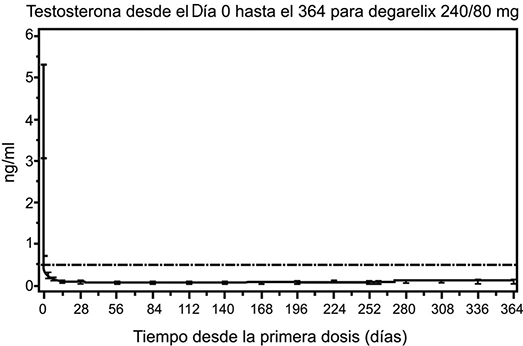
Figura 1. Niveles plasmáticos de testosterona desde el día 0 hasta el 364 para degarelix 240 mg/80 mg (medianas con intervalos intercuartil).
Resultados del estudio de confirmación Fase 3: La eficacia y seguridad de FIRMAGON® FERRING fue evaluada en un estudio de grupo paralelo abierto, aleatorizado con activo comparador controlado. El estudio investigó la eficacia y seguridad de FIRMAGON® FERRING con esquemas de dosificación de una dosis mensual; una dosis subcutánea de inicio de 240 mg (40 mg/mL) seguida por dosis mensuales de 160 mg (40 mg/mL) o de 80 mg (20 mg/mL), en comparación con 7.5 mg intramusculares de leuprorelina mensual en pacientes con cáncer de próstata que requieren de terapia de deprivación androgénica. En total 620 pacientes fueron aleatorizados a uno de los tres grupos de tratamiento.
De los pacientes tratados:
• 31% tenían cáncer de próstata localizado.
• 29% tenían cáncer de próstata localmente avanzado.
• 20% tenían cáncer de próstata metastásico.
• 7% se desconocía el estado metastásico.
• 13% tenían una cirugía previa o radiación como intento de curación con una elevación del PSA (antígeno prostático específico).
La demografía basal fue similar entre los brazos. El objetivo primario fue demostrar que FIRMAGON® FERRING es eficaz en alcanzar y mantener la supresión de la testosterona por debajo de 0.5 ng/mL, durante 12 meses de tratamiento. En total 504 pacientes (81%) completaron el estudio. En el grupo de tratamiento con degarelix 240/80 mg 41 pacientes (20%) y en el grupo de tratamiento con leuprorelina 32 (16%) de los pacientes abandonaron el estudio.
Logros de testosterona sérica (T) ≤ 0.5 ng/mL: FIRMAGON® FERRING es eficaz en alcanzar una rápida supresión de testosterona, ver Tabla 2.
Tabla 2. Porcentaje de pacientes que alcanzaron
T ≤ 0.5 ng/mL después del inicio del tratamiento
|
Tiempo |
FIRMAGON 240/80 mg vía subcutánea |
Leuprorelina 7.5 mg vía intramuscular |
|
Día 1 |
52% |
0% |
|
Día 3 |
96% |
0% |
|
Día 7 |
99% |
1% |
|
Día 14 |
100% |
18% |
|
Día 28 |
100% |
100% |
Evitar picos de testosterona: Ninguno de los pacientes tratados con FIRMAGON® FERRING experimentó micropicos de testosterona; existió una disminución promedio de 94% de la testosterona al día 3.
La mayoría de los pacientes tratados con leuprorelina experimentaron micropicos de testosterona; existió un incremento promedio de 65% de la testosterona al día 3. El micropico se definió como la testosterona que excedió la basal en ≥ 15% dentro de las 2 primeras semanas. La diferencia fue estadísticamente significativa (p < 0.001).
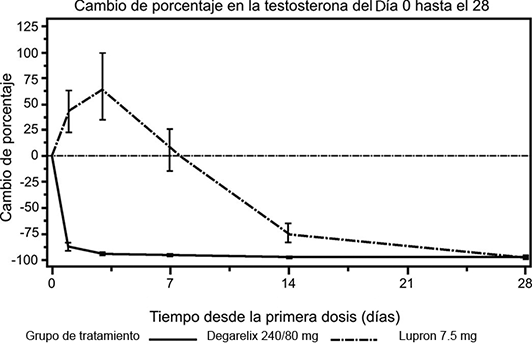
Figura 2. Cambio en el porcentaje de la testosterona con respecto a la basal por grupo de tratamiento hasta el día 28 (mediana con intervalos intercuartil).
Reversibilidad de testosterona: En un estudio con pacientes con un aumento de antígeno prostático específico (PSA) después de una terapia localizada (principalmente prostatectomía y radiación) se administró FIRMAGON® FERRING durante siete meses seguido por un periodo de monitoreo de siete meses. El tiempo medio de recuperación de testosterona (> 0.5 ng/mL) por arriba del nivel de castración), después de descontinuar el tratamiento fue de 112 días (a partir del periodo de monitoreo, por ejemplo 28 días después de la última inyección). El tiempo medio para la testosterona > 1.5 ng/mL (por debajo del límite del rango normal) fue de 168 días.
Efecto a largo plazo: Una respuesta exitosa en el estudio se definió como el logro de la castración médica al día 28 y el mantenimiento hasta el día 364, en donde ninguna concentración de testosterona fue mayor a 0.5 ng/mL.
Tabla 3. Probabilidad Acumulada de Testosterona ≤ 0.5 ng/mL del Día 28 al Día 364
|
FIRMAGON 240/80 mg N=207 |
Leuprorelina 7.5 mg N=201 |
|
|
Número de respondedores |
202 |
194 |
|
Frecuencia de Respuesta (intervalos de confianza)* |
97.2% (93.5; 98.8%) |
96.4% (92.5; 98.2%) |
* Estimados del método Kaplan Meier dentro del grupo.
Logro de reducción del antígeno prostático específico (PSA): El tamaño del tumor no fue medido de manera directa durante el estudio clínico programado, pero existió una respuesta tumoral benéfica indirecta como se demuestra por una reducción de 95% después de 12 meses en la mediana del antígeno prostático específico (PSA) para FIRMAGON® FERRING.
La mediana del antígeno prostático específico (PSA) basal en el estudio fue:
• Para el grupo de tratamiento con FIRMAGON® FERRING 19.8 ng/mL (intervalo intercuartil: P25 9.4 ng/mL, P75 46.4 ng/mL).
• Para el grupo de tratamiento con leuprorelina 7.5 mg 17.4 ng/mL (intervalo intercuartil: P25 8.4 ng/mL, P75 56.5 ng/mL).
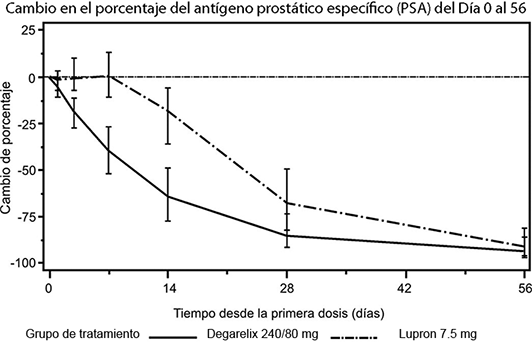
Figura 3. Cambio en el porcentaje del antígeno prostático específico PSA (PSA) con respecto a la basal por grupo de tratamiento hasta el día 56 (media con intervalos intercuartil).
Esta diferencia fue estadísticamente significativa (p< 0.001) en el análisis pre-específico en el día 14 y en el día 28.
Los niveles del antígeno prostático específico (PSA) bajaron a 64% dos semanas después de la administración de FIRMAGON® FERRING, 85% después del mes, y 95% después de tres meses, y se mantuvieron en supresión (aproximadamente 97%) a lo largo de un año de tratamiento.
Desde el día 56 hasta el día 364 no existieron diferencias significativas entre FIRMAGON® FERRING y el comparador en el porcentaje de cambió de la basal.
Efecto en el volumen de próstata: Tres meses de terapia con FIRMAGON® FERRING (240/80 mg régimen de dosificación) resultó en una reducción de 37% en el volumen de próstata medido por un ecografía transrectal (ETR) en pacientes que lo requieren terapia hormonal antes de la radioterapia o en pacientes que son candidatos para una castración. La reducción del volumen de próstata fue similar a la obtenida con Goserelina más protección anti-andrógeno.
Efecto en intervalos QT/QTc: En el estudio de confirmación comparando FIRMAGON® FERRING con leuprorelina, se llevaron a cabo electrocardiogramas periódicos. Ambas terapias mostraron que los intervalos QT/QTc excedieron 450 mseg en aproximadamente 20% de los pacientes. Desde la basal hasta el final del estudio la mediana del cambio para FIRMAGON® FERRING fue de 12.3 mseg (3.2%) y para leuprorelina fue de 16.7 mseg (3.5%). Un minucioso estudio QT mostró que no había un efecto intrínseco de FIRMAGON® FERRING en el intervalo QT/QTc. La falta de un efecto intrínseco de FIRMAGON® FERRING en una repolarización cardiaca (QTcF), frecuencia cardiaca, conducción AV, despolarización cardiaca, o la morfología T o U fue confirmada en hombres sanos (N = 80) recibiendo una infusión intravenosa de FIRMAGON® FERRING por 60 minutos, alcanzando una Cmax de 222 ng/mL, aproximadamente, 3-4 veces la Cmax obtenida durante el tratamiento de cáncer de próstata.
Anticuerpos anti-degarelix: Se observó un desarrollo de anticuerpos anti-degarelix en 10% de los pacientes después del tratamiento con FIRMAGON® FERRING durante 1 año y 29% de los pacientes después del tratamiento con FIRMAGON® FERRING hasta 5.5 años. No existe ninguna indicación de que la eficacia o la seguridad del tratamiento con FIRMAGON® FERRING se afecten por la formación de anticuerpos después del tratamiento por 5.5 años.
Propiedades farmacocinéticas: La concentración de la solución inyectable influye considerablemente en la farmacocinética.
Por lo tanto, no debe usarse otra concentración que la recomendada.
Absorción: FIRMAGON® FERRING forma un depósito durante su administración subcutánea, desde el cual se libera degarelix a la circulación. Los resultados farmacocinéticos relevantes de FIRMAGON® FERRING evaluados en pacientes con cáncer de próstata se encuentran resumidos en la Tabla 4. La mediana de degarelix a través de sus concentraciones en la fase de mantenimiento con 80 mg a una concentración de 20 mg/mL fue de 10.9 ng/mL.
Tabla 4. Parámetros farmacocinéticos después de la administración subcutánea de FIRMAGON® FERRING 240 a una concentración de 40 mg/mL
|
Parámetro farmacocinético |
FIRMAGON® FERRING 240 mg |
|
Cmax (ng/mL) |
53.4 |
|
Tmax (días) |
1.4 |
|
T½ (días) |
43 |
|
ABc (día*ng/mL) |
1240 |
Después de la administración subcutánea de 240 mg de FIRMAGON® FERRING a una concentración de 40 mg/mL a pacientes con cáncer de próstata, degarelix es eliminado en un modo bifásico, con una mediana de vida media terminal de aproximadamente 43 días para la dosis inicial de 240 mg (40 mg/mL) y 28 días para la dosis de mantenimiento de 80 mg (20 mg/mL). La vida media después de la administración subcutánea es una consecuencia de una liberación muy lenta del degarelix desde el depósito de FIRMAGON® FERRING formado en el(los) sitio(s) de la inyección. El comportamiento farmacocinético del medicamento se ve fuertemente influenciado por su concentración en la suspensión de la inyección.
Distribución: El volumen de distribución en hombres adultos mayores sanos es de aproximadamente 1 L/kg. La unión a proteínas plasmáticas se estima es de aproximadamente 90%.
Biotransformación: Degarelix está sujeto a una degradación peptídica común durante el paso por el sistema hepatobiliar y es principalmente excretado como fragmentos peptídicos en las heces. No se detectaron metabolitos significativos en las muestras de plasma después de su administración subcutánea. Estudios in vitro han demostrado que el degarelix no es un sustrato para el sistema CYP450 humano.
Excreción: En hombres sanos, aproximadamente 20-30% de una dosis administrada de degarelix fue excretada renalmente, sugiriendo que aproximadamente 70-80% es excretada vía el sistema hepatobiliar en los humanos. La depuración en hombres adultos mayores sanos es de 35-50 mL/h/kg.
Poblaciones especiales:
Pacientes con deterioro renal: No se han llevado a cabo estudios farmacocinéticos en pacientes con deterioro renal. Únicamente cerca del 20% de la dosis administrada de degarelix es excretada sin cambio por los riñones. Un análisis farmacocinético poblacional de la información del estudio Fase 3 de confirmación ha demostrado que la depuración de degarelix en pacientes con deterioro renal de leve a moderado es reducido en 20-30%; por esta razón, no se recomienda un ajuste en la dosis de los pacientes con deterioro renal de leve a moderado. La información en los pacientes con deterioro renal severo es escasa y se debe tener precaución en este tipo de pacientes.
Pacientes con deterioro hepático: Se ha estudiado Degarelix en un estudio farmacocinético en pacientes con un deterioro hepático de leve a moderado. No se observó ningún signo de incremento en la exposición en pacientes con deterioro hepático comparado con sujetos sanos. No se observaron cambios en las pruebas de funcionamiento hepático 24 horas después de la dosis en comparación con la basal en pacientes con deterioro hepático. El ajuste de dosis no es necesario en pacientes con deterioro hepático de leve a moderado. Pacientes con deterioro hepático severo no han sido estudiados y por lo tanto se debe tener precaución en este grupo.
Adultos Mayores: La población de pacientes estudiados en el programa clínico fue típica de la población blanco a tratar de pacientes con cáncer de próstata. La edad promedio fue de 74 años (intervalo de 47 a 98 años).
CONTRAINDICACIONES: Hipersensibilidad al degarelix o a cualquiera de sus excipientes.
FIRMAGON® FERRING no está indicado en mujeres o pacientes pediátricos. Además, debido a sus efectos farmacológicos FIRMAGON® FERRING puede causar daño fetal si es administrado a una mujer embarazada.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: FIRMAGON® FERRING no debe ser utilizado en mujeres embarazadas (Véase Contraindicaciones).
REACCIONES SECUNDARIAS Y ADVERSAS: Las reacciones adversas observadas más frecuentemente durante la terapia con FIRMAGON® FERRING en el estudio de confirmación fase 3 se debieron a los efectos fisiológicos esperados por la supresión de la testosterona, incluyendo bochornos e incremento en el peso (reportados en 25% y 7% respectivamente, de los pacientes que recibieron tratamiento durante un año) y eventos adversos en los sitios de la inyección.
Los eventos adversos en el sitio de la inyección reportados fueron principalmente dolor y eritema, reportados en 28% y 17% de los pacientes, respectivamente, menos frecuentemente reportados fueron inflamación (6%), induración (4%) y nódulo (3%). Estos eventos se presentaron principalmente con la dosis de inicio, mientras que durante la terapia de mantenimiento la incidencia de estos eventos por cada 100 inyecciones fueron: 3 por dolor y < 1 por eritema, inflamación, nódulo e induración. Los eventos reportados fueron en su mayoría transitorios, con intensidad de leve a moderada y llevó a muy pocas discontinuaciones (< 1%). Reacciones serias del sitio de inyección fueron raramente reportadas como infección en el sitio de inyección, abscesos en el sitio de inyección o necrosis en el sitio de inyección que pueden requerir tratamiento quirúrgico/drenado.
La frecuencia de los eventos no deseados se listan a continuación usando la siguiente convención: muy comunes (≥ 1/10), comunes (≥1/100 a < 1/10), no comunes (≥ 1/1,000 a < 1/100), raros (≥ 1/10,000 a < 1/1,000) y muy raros (< 1/10,000).
Tabla 1. Frecuencia de eventos adversos
|
Clasificación de Órganos por Sistema MedDRA |
Muy común ≥ 1/10 |
Común ≥ 1/100 y < 1/10 |
No común ≥ 1/1000 y < 1/100 |
|
Trastornos del sistema linfático y de la sangre |
Disminución de hemoglobina |
||
|
Trastornos del sistema inmune |
Hipersensibilidad |
||
|
Trastornos psiquiátricos |
Insomnio |
Pérdida de libido |
|
|
Trastornos del sistema nervioso |
Mareos, cefalea |
||
|
Trastornos vasculares |
Bochornos * |
Hipertensión |
|
|
Trastornos gastrointestinales |
Náuseas Constipación |
Diarrea |
|
|
Trastornos Hepatobiliares |
Incremento de las transaminasas hepáticas |
||
|
Trastornos de la piel y del tejido subcutáneo |
Sudoración nocturna |
Urticaria, hiperhidrosis, hiperpigmentación de la piel |
|
|
Sistema reproductivo y trastornos de los senos |
Disfunción eréctil Atrofia testicular Ginecomastia |
||
|
Trastornos generales y del sitio de administración |
Efectos adversos en el sitio de inyección |
Escalofríos, pirexia, astenia, fatiga |
Influenza como enfermedad |
|
Investigaciones |
Aumento de peso* |
* Consecuencia fisiológica de la supresión de testosterona.
Hipersensibilidad: Reacciones de hipersensibilidad, incluyendo anafilaxia, urticaria y angioedema, han sido raramente reportadas durante la post-comercialización con FIRMAGON® FERRING.
Cambios en la densidad ósea: En la literatura médica se ha reportado una disminución de la densidad ósea en hombres que han tenido orquiectomía o han sido tratados con agonistas GnRH. Se puede anticipar que los largos periodos de supresión de testosterona en los hombres puede tener efecto en la densidad ósea.
Efectos sobre la capacidad para conducir y utilizar maquinaria.
No se han realizado estudios del efecto de FIRMAGON® FERRING sobre la capacidad para conducir y utilizar maquinaria.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Información preclínica de seguridad: Estudios en reproducción animal mostraron que el degarelix causa infertilidad en los animales machos. Esto es debido al efecto farmacológico; siendo éste reversible.
En estudios de toxicidad reproductiva en hembras, degarelix reveló hallazgos esperados por sus propiedades farmacológicas. Causó una prolongación en el tiempo para el apareamiento y el embarazo dependiente de la dosis, un número reducido de cuerpos lúteos, incrementó el número de pérdidas pre y post-implantación, un incremento en el número de abortos, un incremento en el número de muertes en embriones jóvenes y fetos, un incremento en el número de partos prematuros e incremento en la duración del parto.
La información obtenida en estudios convencionales de seguridad farmacológica, en estudios de toxicidad con dosis repetidas, de genotoxicidad y de potencial carcinogénico, no reveló peligro especial para los humanos.
En estudios de toxicidad aguda, subaguda y crónica, en ratas y monos no se observó toxicidad en el órgano blanco después de la administración subcutánea de degarelix. Cuando se administró degarelix vía subcutánea a dosis altas en animales se observó una irritación local relacionada con el fármaco.
Degarelix no mostró potencial mutagénico.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacción con otros productos farmacéuticos y otras formas de interacción: No se han llevado a cabo estudios de interacción fármaco-fármaco.
Degarelix no es un sustrato para el sistema CYP450 humano y no ha demostrado inducir o inhibir los CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 o el CYP3A4/5 a un alto grado in vitro. Además, degarelix no interacciona con ninguno de los eflux relevantes y con ninguno de los transportadores de fármaco probados. En consecuencia, las interacciones farmacocinéticas fármaco-fármaco clínicamente significativas son poco probables. FIRMAGON® FERRING no debe mezclarse en el mismo vial o jeringa con otros productos, dado que no existen datos de compatibilidad fisicoquímica.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han reportado.
PRECAUCIONES GENERALES:
Efecto sobre el intervalo QT/QTc: La terapia de deprivación androgénica a largo plazo puede prolongar el intervalo QT (Véase Farmacocinética y farmacodinamia). El médico debe considerar si los beneficios de la terapia de deprivación androgénica sobrepasan el riesgo potencial en pacientes con valores basales QTc > 450 mseg (por ejemplo, síndrome QT congénito) y en pacientes tomando medicamentos clase IA (por ejemplo, quinidina, procainamida) o clase III (por ejemplo, amiodarona, sotalol) medicamentos antiarrítmicos. Un minucioso estudio QT mostró que no había un efecto intrínseco de FIRMAGON® FERRING en el intervalo QT/QTc.
Vía de administración: FIRMAGON® FERRING es sólo para administración subcutánea y no debe ser administrada por vía intravenosa.
Tolerancia a la Glucosa: Se ha observado una reducción en la tolerancia a la glucosa en hombres que han sido sometidos a orquiectomía o quienes han sido tratados con un agonista GnRH. Puede ocurrir el desarrollo o aumento de la gravedad de la diabetes; por tal motivo pacientes diabéticos pueden requerir un monitoreo más frecuente de la glucosa sanguínea al recibir terapia de privación de andrógenos. El efecto de FIRMAGON® FERRING en la insulina y los niveles de glucosa no ha sido estudiado.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y método de administración:
|
Dosis de Inicio |
Dosis de mantenimiento- administración mensual |
|
240 mg administrados en dos inyecciones s.c. (subcutáneas) de 120 mg cada una |
80 mg administrados en una sola inyección s.c. (subcutánea) |
La primera dosis de mantenimiento debe ser administrada un mes después de la dosis de inicio.
El efecto terapéutico de FIRMAGON® FERRING debe ser monitoreado por medio de parámetros clínicos y midiendo los niveles séricos del antígeno prostático específico (PSA). Estudios clínicos han demostrado que la supresión de la testosterona (T) ocurre inmediatamente después de la administración de la dosis de inicio en 96% de los pacientes que tienen la testosterona plasmática a niveles de castración médica (T ≤ 0.5 ng/ml) después de tres días y en 100% después de un mes. El tratamiento a largo plazo con la dosis de mantenimiento hasta 1 año, muestra que 97% de los pacientes tienen niveles de testosterona suprimidos y sostenidos (T ≤ 50 ng/mL).
En caso de que la respuesta clínica del paciente pareciera subóptima, debe de confirmarse que los niveles de testosterona sérica permanezcan suficientemente inhibidos.
Ya que FIRMAGON® FERRING no induce pico de testosterona, no es necesario añadir un antiandrógeno como protección al inicio de la terapia.
Método de administración: FIRMAGON® FERRING solamente se administra por vía subcutánea y no debe administrarse por vía intravenosa.
FIRMAGON® FERRING se administra por medio de una inyección subcutánea en la región abdominal. Al igual que otros productos farmacéuticos administrados por inyección subcutánea, el sitio de la inyección debe variar de manera periódica. Las inyecciones deben aplicarse en áreas, en donde el paciente no sea expuesto a presión, por ejemplo, no cerca de la cintura o a la altura del cinturón y tampoco cerca de las costillas.
FIRMAGON® FERRING se encuentra disponible como un polvo para ser reconstituido con agua inyectable.
El procedimiento de reconstitución debe seguirse de manera cuidadosa. No se recomienda la administración de otras concentraciones. La suspensión reconstituida debe ser un líquido claro, libre de cualquier partícula no disuelta.
Ajuste de la dosis en poblaciones específicas de pacientes:
Adultos mayores, con deterioro Hepático y Renal: No existe necesidad de ajustar la dosis para los adultos mayores o en pacientes con deterioro leve a moderado en la función renal o hepática (Véase Farmacocinética y farmacodinamia). No se han estudiado pacientes con disfunción renal o hepática severa por lo que se deberá tener precaución en éstos.
No existe una indicación relevante para usar FIRMAGON® FERRING en mujeres, niños y adolescentes.
Precauciones especiales para su deshecho y otros manejos: No existen requerimientos especiales para su deshecho.
Instrucciones de uso: Las instrucciones para su reconstitución deben ser seguidas cuidadosamente (Instructivo incluido en la caja del producto).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis: No existe experiencia clínica de los efectos de una sobredosis aguda con FIRMAGON® FERRING. En caso de una sobredosis, el paciente debe ser monitoreado y proporcionarle un tratamiento de soporte adecuado, si se considera necesario.
PRESENTACIONES:
Naturaleza y contenidos del envase: Las siguientes presentaciones se encuentran disponibles:
Dosis de inicio (240 mg): Caja con 2 frascos ámpula con 120 mg de liofilizado, 2 jeringas pre-llenadas con 3.0 ml de diluyente, 2 adaptadores, 2 émbolos, 2 agujas estériles e instructivo anexo.
Dosis de mantenimiento (80 mg): Caja con 1 frasco ámpula con 80 mg de liofilizado, 1 jeringa pre-llenada con 4.2 ml de diluyente, 1 adaptador, 1 émbolo, 1 aguja estéril e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C y en lugar seco. Protéjase de la luz.
Precauciones especiales para almacenamiento: No se congele.
Para las condiciones de almacenamiento del producto farmacéutico reconstituido: Una vez reconstituido el producto, adminístrese inmediatamente.
LEYENDAS DE PROTECCIÓN:
Vía de administración: subcutánea. Dosis: La que el médico señale. Su venta requiere receta médica. Léase instructivo anexo. Literatura exclusiva de médicos. No se administre este medicamento sin leer el instructivo anexo. Consérvese a no más de 30°C y en lugar seco, protéjase de la luz. Hecha la mezcla no agitar. Si no se administra todo el producto deséchese el sobrante. No se administre si el cierre ha sido violado. No se deje al alcance de los niños. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. Deséchese la jeringa y las agujas después de su uso.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
safety.mailbox.mexico@ferring.com o al tel. 018006241414.
Hecho en Alemania en:
(1) Rentschler Biotechnologie GmbH
(2) Ferring GmbH
Frasco ámpula con Liofilizado:
(1) Erwin-Rentschler-Strasse 21, 88471 Laupheim, Baden-Württemberg, Alemania.
Frasco ámpula y diluyente jeringa pre-llenada:
(1) Wittland 11, 24109 Kiel, Alemania.
Para:
Ferring GmbH
Wittland 11, 24109 Kiel, Alemania.
Acondicionado por:
(1) Ferring International Center SA
(2) Ferring - Léciva, a.s.
(3) FERRING, S.A. de C.V.
(1) Chemin de la Vergognausaz 50, 1162 St-Prex, Suiza
(2) K Rybniku 475, Jesenice u Prahy. 252 42, República Checa.
(3) Av. Nemesio Diez Riega, Mz. 2, Lote 15, No. 15, Parque Industrial Cerrillo II, C.P. 52000, Lerma, México, México.
Reg. Núm. 143M2009, SSA IV
173300416T0194