
FLUENZ
VACUNA VIVA
Vacuna oral
Paquete , 10 Aspersores prellenados
FORMA FARMACÉUTICA Y FORMULACIÓN:
Aspersor intranasal prellenado de uso único de 0.2 mL.
Cada dosis de 0.2 mL FLUENZ® está formulada de modo que contenga 106.5-7.5 FFU (unidades de focos de fluorescencia) de cada una de tres cepas de virus reordenantes de influenza vivos atenuados para la estación 2011-2012: A/California/7/2009 (H1N1); A/Perth/16/2009 (H3N2) y B/Brisbane/60/2008.
FLUENZ® (vacuna de virus vivos atenuados contra influenza, intranasal) es una vacuna trivalente viva para administración por aspersión intranasal. Las cepas de virus de la influenza de FLUENZ® (a) están adaptadas al frío (af) (es decir, se replican eficientemente a 25ºC, una temperatura que restringe la replicación de muchos virus silvestres de influenza); (b) son sensibles a la temperatura (st) (esto es, su replicación es restringida a 37°C [cepas de Tipo B] o a 39ºC [cepas de Tipo A), temperaturas a las que muchos virus silvestres de la influenza crecen eficientemente); y (c) están atenuadas (at) (no producen una enfermedad semejante a la influenza clásica en el modelo de hurón de la infección humana de influenza). El efecto acumulativo de las propiedades antigénicas y de los fenotipos af, st y at es que los virus atenuados de la vacuna se replican en la nasofaringe para inducir inmunidad protectora.
No se ha observado ningún indicio de reversión en las cepas de la vacuna recuperadas que se analizaron (135 de 250 aislamientos recuperados posibles) (véase Estudios clínicos). En cada una de las tres cepas reordenantes de FLUENZ®, los seis segmentos internos de genes que dan lugar a los fenotipos af, st y at proceden de un virus donador patrón (VDP), y los dos segmentos que codifican las dos glucoproteínas superficiales, hemaglutinina (HA) y neuraminidasa (NA), proceden de los correspondientes virus de la influenza tipo silvestre antigénicamente correspondientes cuya inclusión en la fórmula anual de la vacuna fue recomendada por el USPHS (Servicio de Salud Pública de EUA). Por lo tanto, los tres virus presentes en FLUENZ® conservan las características de replicación y las propiedades fenotípicas del VDP, y expresan la HA y NA de virus silvestres relacionados con cepas que se espera circulen durante la temporada de influenza 2011-2012. En el caso del VDP de Tipo A, al menos cinco locus genéticos de tres segmentos internos de genes contribuyen a los fenotipos st y at. En el caso del VDP de Tipo B, al menos tres locus genéticos de dos segmentos internos de genes contribuyen a las propiedades st y at; cinco locus genéticos de tres segmentos de genes contribuyen a la propiedad af.
Se inoculan huevos específicos libres de patógenos (ELP) con cada una de las cepas reordenantes y se incuban para permitir la replicación de los virus de la vacuna. Se cosecha el líquido alantoideo de estos huevos, se combina y luego se clarifica por filtración. Se concentra el virus por ultracentrifugación y se diluye con solución amortiguadora estabilizante para obtener las concentraciones finales de sacarosa y fosfato de potasio. Se añade ácido etilendiaminotetraacético (EDTA) a la solución amortiguadora de dilución para las cepas H3N2. La cosecha viral se filtra asépticamente para producir los graneles monovalentes. Se hacen pruebas de fenotipos af, st y at a cada lote, que también se examina extensamente por métodos in vitro e in vivo para detectar agentes adventicios. A continuación se mezclan graneles monovalentes de las tres cepas y se diluyen según se requiera para alcanzar la potencia deseada con soluciones amortiguadoras estabilizantes, para producir la vacuna trivalente a granel. En seguida se llenan directamente aspersores individuales para administración nasal con la vacuna a granel.
Cada aspersor prellenado y refrigerado de FLUENZ® contiene una sola dosis de 0.2 mL. Cada dosis de 0.2 mL contiene 106.5-7.5 FFU de virus reordenantes de la influenza vivos atenuados de cada una de las tres cepas: A/California/7/2009 (H1N1); A/Perth/16/2009 (H3N2) y B/Brisbane/60/2008. Cada dosis de 0.2 mL contiene además 0.188 mg/dosis de glutamato monosódico, 2.00 mg/dosis de gelatina porcina hidrolizada, 2.42 mg/dosis de arginina, 13.68 mg/dosis de sacarosa, 2.26 mg/dosis de fosfato dibásico de potasio, 0.96 mg/dosis de fosfato monobásico de potasio y < 0.015 mcg/mL de sulfato de gentamicina. FLUENZ® no contiene conservadores.
La punta acoplada al aspersor está provista de una boquilla que produce una bruma fina que se deposita principalmente en la nariz y la nasofaringe. FLUENZ® es un líquido que va de incoloro a amarillo pálido, y de transparente a ligeramente turbio.
INDICACIONES TERAPÉUTICAS: FLUENZ® es una vacuna indicada para la inmunización activa de individuos de 2 a 49 años contra la enfermedad de influenza causada por los subtipos A y el tipo B del virus de la influenza que la vacuna contiene.
FARMACOCINÉTICA Y FARMACODINAMIA:
Mecanismo de acción: No se comprenden del todo los mecanismos de inmunidad que confieren protección contra la influenza después de recibir la vacuna FLUENZ®. Asimismo, no se ha dilucidado en su totalidad la inmunidad contra la influenza tipo silvestre que se adquiere de manera natural. Es posible que anticuerpos séricos, anticuerpos mucosales y células T específicas de la influenza desempeñen un papel en la prevención y recuperación de la infección.
La enfermedad de la influenza y sus complicaciones son consecuencia de la infección con virus de la influenza. La vigilancia mundial de la influenza identifica variantes antigénicas anuales. Por ejemplo, desde 1977 han estado circulando en el mundo variantes antigénicas de virus de la influenza A (H1N1 y H3N2) y virus de la influenza B. Los anticuerpos para un tipo o subtipo de virus de la influenza confieren poca o ninguna protección contra otros. Además, puede ser que los anticuerpos para una variante antigénica de virus de la influenza no lo protejan contra una nueva variante antigénica del mismo tipo o subtipo. El desarrollo frecuente de variantes antigénicas por desviación antigénica es la base virológica de las epidemias estacionales y el motivo del cambio habitual de una o más cepas nuevas en la vacuna contra la influenza de cada año. Por consiguiente, las vacunas contra la influenza se estandarizan de modo que contengan las cepas (típicamente dos de tipo A y una de tipo B) que representan los virus de la influenza que probablemente circularán en Estados Unidos en el siguiente invierno.
Se recomienda la revacunación anual con la vacuna vigente porque la inmunidad decae durante el año siguiente a la vacunación, y porque las cepas de virus de la influenza en circulación cambian año con año.
Farmacocinética:
Biodistribución: Se llevó a cabo un estudio de la biodistribución de un placebo marcado radiactivamente administrado por vía intranasal en 7 voluntarios adultos sanos. El porcentaje medio de las dosis suministradas que se detectó fue como sigue: cavidad nasal 89.7%, estómago 2.6%, cerebro 2.4% y pulmón 0.4%. Se desconoce la importancia clínica de estos resultados.
Estudios clínicos: FLUENZ®, formulaciones refrigerada y congelada, fue administrado a aproximadamente 35,000 sujetos en estudios clínicos controlados. FLUENZ® ha sido estudiado a lo largo de diferentes años en estudios controlados con placebo, utilizando diferentes cepas de la vacuna. La eficacia se ha estudiado comparando FLUENZ® con una vacuna contra la influenza inactivada fabricada por Sanofi Pasteur lnc.
Estudios en niños y adolescentes:
Estudio MI-CPP111: Estudio comparativo pediátrico.
Se realizó un ensayo multinacional, aleatorio, doble ciego y de control activo (MI-CP111) para evaluar la eficacia y seguridad de FLUENZ®, en comparación con una vacuna contra la influenza inyectable elaborada por Sanofi Pasteur lnc. (control activo), en niños de menos de 5 años y empleando la fórmula refrigerada. Durante la temporada de influenza 2004-2005, un total de 3,916 niños de menos de 5 años y sin asma grave, sin uso de broncodilatador ni de esteroides y sin sibilancia dentro de las 6 semanas precedentes fueron asignados al azar a FLUENZ®, y otros 3,936 fueron asignados al azar a control activo. Se hizo luego el seguimiento de los participantes a lo largo de la temporada de influenza para identificar la enfermedad producida por virus de la influenza. Como criterio principal de valoración, se definió la ESI-CDC (enfermedad similar a influenza definida por CDC) modificada y confirmada por cultivo como un cultivo positivo de un virus de influenza silvestre asociado dentro de un margen de ±7 días de la ESI-CDC modificada. La ESI-CDC modificada se definió como fiebre (temperatura oral o equivalente ³ 37.8ºC) más tos, dolor de garganta o flujo nasal/congestión nasal el mismo día o en días consecutivos.
En el análisis principal de la eficacia, FLUENZ® puso de manifiesto una reducción del 44.5% (IC del 95%: 22.4, 60.6) de la tasa de influenza en comparación con el control activo, medida en términos de ESI-CDC modificada y confirmada por cultivo producida por cepas silvestres antigénicamente similares a las incluidas en la vacuna. Véase en la tabla 1 una descripción de los resultados por cepa y semejanza antigénica.
Tabla 1. Comparación de la eficacia contra ESI-CDCa modificada y confirmada por cultivo producida por cepas naturales en niños de < 5 años
|
FLUENZ® |
Control activob |
Reducción de la tasa c/FLUENZ® (%)c |
IC del 95% |
|||||
|
n |
# de casos |
Tasa (casos/N) |
n |
# de casos |
Tasa (casos/N) |
|||
|
Cepas concordantes |
||||||||
|
Todas las cepas |
3,916 |
53 |
1.4% |
3,936 |
93 |
2.4% |
44.5% |
22.4, 60.6 |
|
A/H1N1 |
3,916 |
3 |
0.1% |
3,936 |
27 |
0.7% |
89.2% |
67.7, 97.4 |
|
A/H3N2 |
3,916 |
0 |
0.0% |
3,936 |
0 |
0.0% |
– |
– |
|
B |
3,916 |
50 |
1.3% |
3,936 |
67 |
1.7% |
27.3% |
-4.8, 49.9 |
|
Cepas discordantes |
||||||||
|
Todas las cepas |
3,916 |
102 |
2.6% |
3,936 |
245 |
6.2% |
58.2% |
47.4, 67.0 |
|
A/H1N1 |
3,916 |
0 |
0.0% |
3,936 |
0 |
0.0% |
– |
– |
|
A/H3N2 |
3,916 |
37 |
0.9% |
3,936 |
178 |
4.5% |
79.2% |
70.6, 85.7 |
|
B |
3,916 |
66 |
1.7% |
3,936 |
71 |
1.8% |
6.3% |
-31.6, 33.3 |
|
Sin considerar concordancia |
||||||||
|
Todas las cepas |
3,916 |
153 |
3.9% |
3,936 |
338 |
8.6% |
54.9% |
45.4, 62.9 |
|
A/H1N1 |
3,916 |
3 |
0.1% |
3,936 |
27 |
0.7% |
89.2% |
67.7, 97.4 |
|
A/H3N2 |
3,916 |
37 |
0.9% |
3,936 |
178 |
4.5% |
79.2% |
70.6, 85.7 |
|
B |
3,916 |
115 |
2.9% |
3936 |
136 |
3.5% |
16.1% |
-7.7, 34.7 |
Población por protocolo.
a La ESI-CDC modificada se definió como fiebre (temperatura oral o equivalente ³ 37.8ºC) más tos, dolor de garganta o flujo nasal/congestión nasal en el mismo día o en días consecutivos.
b Vacuna contra la influenza inyectable elaborada por Sanofi Pasteur lnc.
c Se ajustó la reducción de la tasa por país, edad, estado de vacunación previa contra la influenza y situación en cuanto a historial de sibilancia.
Estudio D153-P501: Estudio pediátrico.
Se llevó a cabo un ensayo aleatorio, doble ciego y controlado con placebo (D153-P501) para evaluar la eficacia de FLUENZ® en niños de 12 a 35 meses de edad, sin afecciones médicas de alto riesgo, contra enfermedad de influenza confirmada por cultivo, empleando la fórmula refrigerada. Un total de 3,174 niños fueron asignados al azar 3:2 (vacuna: placebo) para recibir dos dosis de vacuna de estudio o placebo separadas por al menos 28 días en el Año 1. Véase una descripción de los resultados en la tabla 2.
Estudio AV006: Estudio pediátrico.
AV006 fue un ensayo multicéntrico, aleatorio, doble ciego y controlado con placebo que se llevó a cabo en niños estadounidenses sin afecciones médicas de alto riesgo para evaluar la eficacia de FLUENZ® contra enfermedad de influenza confirmada por cultivo a lo largo de dos temporadas sucesivas, empleando la fórmula congelada. El criterio principal de valoración del ensayo fue la prevención de enfermedad de influenza confirmada por cultivo y debida a influenza natural antigénicamente concordante en niños que recibieron dos dosis de vacuna en el primer año y una sola dosis de revacunación en el segundo año. Durante el primer año del estudio, 1,602 niños de 15 a 71 meses fueron asignados al azar 2:1 (vacuna: placebo). Aproximadamente el 85% de los participantes en el primer año regresaron para el segundo año del estudio. En el Año 2, los niños continuaron en el mismo grupo de tratamiento que en el Año 1, y recibieron una sola dosis de FLUENZ® o placebo. Véase una descripción de los resultados en la tabla 2.
Tabla 2. Eficaciaa de FLUENZ® vs. placebo contra la enfermedad de influenza confirmada por cultivo debida a cepas silvestres antigénicamente concordantes (D153-P501 & AV006, Año 1)
|
D153-P501 |
AV006 |
|||||
|
FLUENZ® nb (%) |
Placebo nb (%) |
% de eficacia (IC del 95%) |
FLUENZ® nb (%) |
Placebo nb (%) |
% de eficacia (IC del 95%) |
|
|
nc = 1,653 |
nc = 1,111 |
nc = 849 |
nc = 410 |
|||
|
Cualquier cepa |
56 (3.4%) |
139 (12.5%) |
72.9%d |
10 (1%) |
73 (18%) |
93.4% (87.5, 96.5) |
|
A/H1N1 |
23 (1.4%) |
81 (7.3%) |
80.9% (69.4, 88.5)e |
0 |
0 |
– |
|
A/H3N2 |
4 (0.2%) |
27 (2.4%) |
90.0% |
4 (0.5%) |
48 (12%) |
96.0% |
|
B |
29 (1.8%) |
35 (3.2%) |
44.3% |
6 (0.7%) |
31 (7%) |
90.5% (78.0, 95.9) |
a Los datos de D153-P501 y AV006 corresponden a sujetos que recibieron dos dosis de vacuna de estudio.
b Número y porcentaje de sujetos de la población de análisis de la eficacia por protocolo con enfermedad de influenza confirmada por cultivo.
c Número de sujetos de la población de análisis de la eficacia por protocolo de cada grupo de tratamiento de cada estudio, para el análisis de "cualquier cepa".
d En el caso de D153-P501, la influenza circuló durante los 12 meses siguientes a la vacunación.
e La estimación incluye cepas A/H1N1 y A/H1N2. Ambas fueron consideradas antigénicamente similares a la vacuna.
Durante el segundo año del Estudio AV006, la cepa principal en circulación fue la cepa H3N2 A/Sydney/05/97, antigénicamente desemejante respecto a la cepa H3N2 representada en la vacuna, A/Wuhan/359/95; FLUENZ® mostró una eficacia del 87.0% (IC del 95%: 77.0, 92.6) contra enfermedad de influenza confirmada por cultivo.
Estudio en adultos: AV009 fue un ensayo multicéntrico, aleatorio, doble ciego y controlado con placebo para evaluar la efectividad en adultos de 18 a 64 años sin afecciones médicas de alto riesgo. Los participantes fueron asignados al azar 2:1 (vacuna: placebo). No se obtuvieron cultivos de virus de la influenza de los sujetos del ensayo, por lo que no se evaluó la eficacia contra influenza confirmada por cultivo.
La cepa A/Wuhan/359/95 (H3N2), presente en FLUENZ® era antigénicamente distinta de la cepa predominante en circulación de virus de la influenza durante el período del ensayo, A/Sydney/05/97 (H3N2). Durante el periodo del estudio también circularon cepas de Tipo A/Wuhan (H3N2) y Tipo B en EUA. El criterio principal de valoración del ensayo fue la reducción de la proporción de participantes con uno o más episodios de enfermedad febril, y los criterios secundarios de valoración prospectivos fueron enfermedad febril grave, y enfermedad febril de vías respiratorias altas. No se demostró efectividad respecto a ninguno de los tres criterios de valoración en un subgrupo de adultos de 50 a 64 años. En la tabla 3 se presentan los criterios principal y secundarios de valoración del grupo etario de 18 a 49 años. No se demostró efectividad respecto al criterio principal de valoración en adultos de 18 a 49 años.
Tabla 3. Efectividad de FLUENZ®a en adultos de 18 a 49 años durante el periodo de brote de 7 semanas específico del lugar
|
Criterio de valoración |
FLUENZ® n = 2,411b n (%) |
Placebo n = 1,226b n (%) |
Reducción porcentual |
(IC del 95%) |
|
Participantes con uno o más eventos de:c |
||||
|
Criterio principal de valoración: |
||||
|
Cualquier enfermedad febril |
331 (13.73) |
189 (15.42) |
10.9 |
(-5.1, 24.4) |
|
Criterios secundarios de valoración: |
||||
|
Enfermedad febril grave |
250 (10.37) |
158 (12.89) |
19.5 |
(3.0, 33.2) |
|
Enfermedad febril de vías respiratorias altas |
213 (8.33) |
142 (11.58) |
23.7 |
(6.7, 37.5) |
a Se utilizó fórmula congelada.
b Número de sujetos evaluables (92.7% y 93.0% de los que recibieron FLUENZ® y placebo, respectivamente).
c El virus predominantemente en circulación durante el periodo del ensayo fue A/Sydney/05/97 (H3N2), una variante antigénica no incluida en la vacuna.
Se demostró efectividad en un análisis post-hoc utilizando ESI-CDC en el grupo etario de 18 a 49 años.
Estudio en adultos infectados con el virus de la inmunodeficiencia humana (VIH): Se evaluó la seguridad y el derrame de virus de la vacuna después de la administración de FLUENZ® en 57 adultos infectados con VIH (mediana de recuento de células CD4 de 541 células/mm3) y en 54 adultos VIH negativos de 18 a 58 años en un ensayo aleatorio, doble ciego, controlado con placebo en el que se utilizó la fórmula congelada. No se notificó ningún evento adverso serio durante el periodo de seguimiento de un mes. Se detectó cepa de vacuna (tipo B) en sólo uno de 28 sujetos infectados con VIH en el día 5, y en ninguno de los sujetos VIH negativos que recibieron FLUENZ®. No se identificó ningún efecto adverso sobre la carga viral de VIH ni sobre los recuentos de CD4 después de administrar FLUENZ®. No se ha evaluado la efectividad de FLUENZ® para prevenir la enfermedad de influenza en individuos infectados con VIH.
Estudio de la fórmula refrigerada: Se realizó un estudio multicéntrico, aleatorio y doble ciego para evaluar la inmunogenicidad y seguridad comparativas de las fórmulas refrigerada y congelada de FLUENZ® en individuos de 5 a 49 años de edad sin afecciones médicas de alto-riesgo. Se asignaron al azar 981 sujetos a recibir una u otra fórmula de la vacuna, en proporción de 1:1. Los sujetos de 5 a 8 años recibieron dos dosis de vacuna de estudio separadas por un intervalo de 46 a 60 días; los sujetos de 9 a 49 años recibieron una dosis de vacuna de estudio. El estudio satisfizo su criterio principal de valoración.
Las razones de medias geométricas de títulos (MGT) de las fórmulas refrigerada y congelada (ajustadas por seroestado inicial) en cuanto a las cepas H1N1, H3N2 y B, respectivamente, fueron de 1.24, 1.02, y 1.00 en el grupo de dos dosis, y de 1.14, 1.12, y 0.96 en el grupo de una dosis.
Estudio de transmisión: FLUENZ® contiene virus de la influenza vivos atenuados que deben infectar y replicarse en células que recubren la nasofaringe del sujeto vacunado para inducir inmunidad. Es posible cultivar virus de vacuna capaces de infectar y multiplicarse a partir de secreciones nasales obtenidas de receptores de la vacuna. No se ha establecido la relación entre la multiplicación viral en un receptor de la vacuna y la transmisión de virus de vacuna a otras personas.
Empleando la fórmula congelada, se llevó a cabo un ensayo prospectivo, aleatorio, doble ciego y controlado con placebo en un entorno de guardería, en niños de menos de 3 años de edad, para evaluar la transmisión de virus de vacuna de una persona vacunada a otra no vacunada. Ciento noventa y siete niños de 8 a 36 meses fueron asignados al azar para recibir una dosis de FLUENZ® (n = 98) o de placebo (n = 99). Se evaluó el derrame de virus por 21 días mediante el cultivo de muestras nasales tomadas con hisopo. Se documentó que el virus de la influenza natural Tipo A (H3N2) circuló en la comunidad y en la población de estudio durante el ensayo, en tanto que las cepas de Tipo A (H1N1) y de Tipo B no circularon.
Se aisló al menos una cepa de vacuna del 80% de los sujetos vacunados; se recuperaron cepas de 1 a 21 días después de la vacunación (duración media de 7.6 días ± 3.4 días). Se preservaron los fenotipos adaptado al frío (af) y sensible a la temperatura (st) en 135 cepas analizadas de 250 cepas aisladas en el laboratorio local. Se cultivaron diez cepas aisladas de influenza (9 de influenza A, 1 de influenza B) de un total de siete sujetos de placebo. Un sujeto de placebo tuvo una infección leve sintomática de virus de Tipo B confirmado como virus de vacuna transmitido por un niño vacunado con FLUENZ® del mismo grupo de juego. Esta cepa aislada de Tipo B retuvo los fenotipos af, st y at de la cepa de vacuna, y tuvo la misma secuencia genética en comparación con un virus de Tipo B cultivado de un niño vacunado del mismo grupo de juego. Se confirmó que cuatro de las cepas aisladas de influenza Tipo A eran del tipo natural A/Panamá (H3N2). No se pudo caracterizar más a fondo las cepas aisladas restantes.
Suponiendo un solo caso de transmisión (aislamiento de la cepa de vacuna de Tipo B), la probabilidad de que un niño pequeño adquiriese el virus de vacuna después de estar en contacto estrecho con un solo niño vacunado con FLUENZ® en este entorno de guardería fue de 0.58% (IC del 95%: 0, 1.7) con base en el modelo de Reed-Frost. Con transmisión documentada de un virus Tipo B en un sujeto de placebo y la posible transmisión de virus de Tipo A en cuatro sujetos de placebo, se estimó que la probabilidad de adquirir un virus de vacuna transmitido era de 2.4% (IC del 95%: 0.13, 4.6) con base en el modelo de Reed-Frost.
CONTRAINDICACIONES:
Hipersensibilidad: FLUENZ® está contraindicada en personas con antecedentes de hipersensibilidad, especialmente reacciones anafilácticas, a huevo, proteínas de huevo, gentamicina, gelatina o arginina o con reacciones que ponen en peligro la vida en vacunaciones anteriores contra la influenza.
Tratamiento concomitante con ácido acetilsalicílico en niños y adolescentes y síndrome de Reyé: FLUENZ® está contraindicada en niños y adolescentes (de 2 a 17 años) que reciben tratamiento con ácido acetilsalicílico o un tratamiento que contenga ácido acetilsalicílico, debido a la asociación del síndrome de Reyé con el ácido acetilsalicílico y la infección de influenza natural.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
Embarazo de categoría C: No se han realizado estudios de reproducción animal con FLUENZ®. No se sabe si FLUENZ® puede provocar daño fetal cuando se administra a una mujer embarazada o afectar la capacidad de reproducción. Se debe administrar FLUENZ® a una mujer embarazada sólo si es claramente necesario.
Se evaluó el efecto de la vacuna sobre el desarrollo embriofetal y previo al destete en un estudio de toxicidad del desarrollo en ratas gestantes que recibieron la fórmula congelada: se administró la vacuna a grupos de animales ya sea una vez (durante el periodo de organogénesis en el día 6 de gestación) o dos veces (antes de la gestación y durante el periodo de organogénesis en el día 6 de gestación), 250 microlitros/rata/ocasión (aproximadamente de 110 a 140 equivalentes de la dosis humana), por instilación intranasal. No se observó ningún efecto adverso sobre el embarazo, el parto, la lactancia o el desarrollo embriofetal o previo al destete. En este estudio no se advirtió ninguna malformación fetal ni otros indicios de teratogénesis relacionados con la vacuna.
Madres lactantes: No se sabe si FLUENZ® se excreta en la leche humana. Por consiguiente, dado que ciertos virus se excretan en la leche humana se debe actuar con precaución si se administra FLUENZ® a madres lactantes.
REACCIONES SECUNDARIAS Y ADVERSAS: FLUENZ® no está indicada en niños de menos de 24 meses de edad. En un estudio clínico, entre niños de 6 a 23 meses, se presentó sibilancia con síntomas respiratorios importantes o que requirió tratamiento con broncodilatador en el 5.9% de los que recibieron FLUENZ®, en comparación con el 3.8% de los que recibieron control activo (vacuna contra la influenza inyectable elaborada por Sanofi Pasteur lnc.) (Riesgo Relativo 1.5, IC del 95%: 1.2, 2.1). La sibilancia no aumentó en los niños ³ 24 meses.
Se ha reportado hipersensibilidad, incluso reacción anafiláctica, después de la comercialización (véase Precauciones generales).
Reacciones adversas en estudios clínicos: Debido a que los estudios clínicos se realizan en condiciones que varían ampliamente, no se pueden comparar directamente las tasas de reacciones adversas observadas en los estudios clínicos de un medicamento con las tasas de otro medicamento, y es posible que no reflejen las tasas que se observan en la práctica.
Un total de 9,537 niños y adolescentes de 1 a 17 años y 3,041 adultos de 18 a 64 años recibieron FLUENZ® en los Estudios D153-P501, AV006, D153-P526, AV019, y AV009 aleatorios y controlados con placebo que se describen en seguida. Además, 4,179 niños de 6 a 59 meses recibieron FLUENZ® en el estudio MI-CP111, un ensayo aleatorio controlado con activo. De los sujetos pediátricos de 6 meses a 17 años que recibieron FLUENZ®, el 50% eran de sexo femenino; en el estudio de adultos, el 55% eran de sexo femenino. En el MI-CP111, AV006, D153-P526, AV019, y AV009 los sujetos eran blancos (71%), hispanos (11%), asiáticos (7%), negros (6%) y otros (5%), en tanto que en el D153-P501, el 99% de los sujetos eran asiáticos.
Reacciones adversas en niños y adolescentes: En un estudio de seguridad controlado con placebo (AV019), realizado en una Organización grande para la Conservación de la Salud (OCS) en niños y adolescentes de 1 a 17 años (n = 9,689), se observó un aumento de casos de asma, captado mediante un examen de códigos de diagnóstico, en niños de menos de 5 años (Riesgo Relativo 3.53, IC del 90%: 1.1, 15.7). Esta observación fue evaluada prospectivamente en el Estudio MI-CP111.
En el MI-CP111, un estudio controlado con activo, se observaron aumentos de sibilancia y hospitalización (por cualquier causa) en niños de menos de 24 meses de edad, como se muestra en la tabla 4.
Tabla 4. Porcentajes de niños con hospitalizaciones y sibiIancia en el MI-CP111
|
Reacción adversa |
Grupo etario |
FLUENZ® |
Control activoa |
|
Hospitalizacionesb |
6 a 23 meses (n = 3,967) |
4.2% |
3.2% |
|
24 a 59 meses (n = 4,385) |
2.1% |
2.5% |
|
|
Sibilanciac |
6 a 23 meses (n = 3,967) |
5.9% |
3.8% |
|
24 a 59 meses (n = 4,385) |
2.1% |
2.5% |
a Vacuna contra la influenza inyectable elaborada por Sanofi Pasteur lnc.
b Desde la asignación aleatoria hasta 180 después de la última vacunación.
c Sibilancia con síntomas respiratorios importantes o que requirió tratamiento con broncodilatador, evaluada desde la asignación aleatoria hasta 42 días después de la última vacunación.
En su mayoría, las hospitalizaciones observadas fueron por infecciones gastrointestinales y de vías respiratorias, y ocurrieron más de 6 semanas después de la vacunación. En el análisis post-hoc, las tasas de hospitalización de niños de 6 a 11 meses (n = 1,376) fueron de 6.1% entre los que recibieron FLUENZ® y de 2.6% entre los que recibieron control activo.
La tabla 5 muestra un análisis de los eventos solicitados combinados que se presentaron en al menos el 1% de los sujetos que recibieron FLUENZ® y a una tasa más alta en comparación con el placebo, después de la dosis 1 en los Estudios D153-P501 y AV006, y de los eventos solicitados después de la Dosis 1 en el Estudio MI-CP111. Los eventos solicitados fueron aquéllos respecto a los cuales se preguntó específicamente a los padres o tutores después de la vacunación con FLUENZ®. En estos estudios, los eventos solicitados se documentaron 10 días después de la vacunación. Los eventos solicitados después de la Dosis 2 de FLUENZ® fueron similares a los observados después de la Dosis 1, y por lo general se observaron con menor frecuencia.
Tabla 5. Resumen de eventos solicitados observados dentro de los 10 días siguientes a la dosis 1 en los sujetos que recibieron vacunaa y ya sea placebo o control activo, niños de 2 a 6 años
|
D153-P501 y AV006 |
Ml-CP111 |
|||
|
FLUENZ® n = 876-1,759c |
Placebo n = 424-1,034c |
FLUENZ® n = 2,170c |
Control activob n = 2,165c |
|
|
Evento |
% |
% |
% |
% |
|
Flujo nasal/ congestión nasal |
58 |
50 |
51 |
42 |
|
Disminución del apetito |
21 |
17 |
13 |
12 |
|
Irritabilidad |
21 |
19 |
12 |
11 |
|
Disminución de la actividad (letargo) |
14 |
11 |
7 |
6 |
|
Dolor de garganta |
11 |
9 |
5 |
6 |
|
Dolor de cabeza |
9 |
7 |
3 |
3 |
|
Dolores musculares |
6 |
3 |
2 |
2 |
|
Escalofríos |
4 |
3 |
2 |
2 |
|
Fiebre |
||||
|
37.8-38.3ºC oral |
9 |
6 |
6 |
4 |
|
38.3-38.9ºC oral |
4 |
3 |
4 |
3 |
a Se usó fórmula congelada en AV006; se usó fórmula refrigerada en D153-P501 y MI-CP111.
b Vacuna contra la influenza inyectable elaborada por Sanofi Pasteur lnc.
c Número de sujetos evaluables (los que devolvieron registros diarios) respecto a cada evento. El rango refleja diferencias en la recolección de datos entre los dos estudios combinados.
En los estudios clínicos D153-P501 y AV006, otras reacciones adversas en niños que se presentaron en al menos el 1% de los que recibieron FLUENZ® y a una tasa mayor en comparación con el placebo fueron: dolor abdominal (2% con FLUENZ®, 0% con placebo) y otitis media (3% con FLUENZ®, 1% con placebo).
Una reacción adversa adicionalmente identificada en el estudio clínico controlado con activo MI-CP111, se presentó en al menos 1% de los receptores de FLUENZ® y, en una tasa mayor en comparación con el control activo fue el estornudo (2% con FLUENZ®, 1% con control activo).
En un ensayo por separado (MI-CP112) que comparó las fórmulas refrigerada y congelada de FLUENZ® en niños y adultos de 5 a 49 años, los eventos solicitados y otros eventos adversos coincidieron con las observaciones de estudios anteriores. Se observó fiebre de > 39.4ºC en el 1 a 2% de los niños de 5 a 8 años.
En un estudio separado controlado con placebo (D153-P526) que utilizó la fórmula refrigerada en un subconjunto de niños mayores y adolescentes de 9 a 17 años que recibieron una dosis de FLUENZ®, los eventos solicitados y otros eventos adversos coincidieron en general con las observaciones de ensayos anteriores. Se refirió dolor abdominal en el 12% de quienes recibieron FLUENZ®, en comparación con el 4% de quienes recibieron placebo, y se informó de reducción de la actividad en el 6% de los que recibieron FLUENZ®, en comparación con el 0% de los que recibieron placebo.
Reacciones adversas en adultos: En los adultos de 18 a 49 años del Estudio AV009, el resumen de eventos solicitados que ocurrieron en al menos el 1% de los que recibieron FLUENZ® y a una tasa más alta en comparación con el placebo incluye flujo nasal (44% con FLUENZ, 27% con placebo), dolor de cabeza (40% con FLUENZ®, 38% con placebo), dolor de garganta (28% con FLUENZ®, 17% con placebo), cansancio/debilidad (26% con FLUENZ®, 22% con placebo), dolores musculares (17% con FLUENZ®, 15% con placebo), tos (14% con FLUENZ®, 11% con placebo) y escalofríos (9% con FLUENZ®, 6% con placebo).
Además de los eventos solicitados, otras reacciones adversas del Estudio AV009 que ocurrieron en al menos el 1% de quienes recibieron FLUENZ® y a una tasa más alta en comparación con el placebo fueron: congestión nasal (9% con FLUENZ®, 2% con placebo) y sinusitis (4% con FLUENZ®, 2% con placebo).
Experiencia posterior a la comercialización en Estados Unidos: Las siguientes reacciones adversas han sido identificadas durante el uso de FLUENZ® después de su aprobación en Estados Unidos. Debido a que estas reacciones son notificadas espontáneamente a partir de una población de tamaño incierto, no siempre es posible estimar de forma confiable su frecuencia o establecer una relación causal con la exposición a la vacuna.
Trastornos congénito, familiar y genético: Exacerbación de síntomas de encefalomiopatía mitocondrial (síndrome de Leigh).
Trastornos gastrointestinales: Náuseas, vómito, diarrea.
Trastornos del sistema inmune: Reacciones de hipersensibilidad (inclusive reacción anafiláctica, edema facial y urticaria).
Trastornos del sistema nervioso: Síndrome de Guillain-Barré, parálisis de Bell.
Trastornos respiratorios, torácicos y del mediastino: Epistaxis.
Trastornos de la piel y del tejido subcutáneo: Erupción.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No se ha evaluado el potencial carcinogénico ni mutagénico de FLUENZ® ni su potencial para crear problemas de fertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Tratamiento con ácido acetilsalicílico: No se administre FLUENZ® a niños o adolescentes que estén recibiendo tratamiento con ácido acetilsalicílico o un tratamiento que contenga ácido acetilsalicílico (véase Contraindicaciones). No se administre tratamiento que contenga ácido acetilsalicílico a niños y adolescentes durante 4 semanas después de vacunarlos con FLUENZ® a menos que esté indicado por el médico.
Agentes antivirales contra la influenza A o B: No se ha evaluado el uso simultáneo de FLUENZ® con agentes antivirales activos contra virus de la influenza A o B. Sin embargo, con base en la posibilidad de que los agentes antivirales reduzcan la efectividad de FLUENZ®, no se administre FLUENZ® en tanto no hayan transcurrido 48 horas del cese del tratamiento antiviral, y no se debe administrar agentes antivirales en las dos semanas siguientes a la administración de FLUENZ®, a menos que sea medicamento indicado. Si se administra FLUENZ® y agentes antivirales de manera concomitante, se debe considerar una posible revacunación cuando sea apropiado.
Vacunas inactivadas concomitantes: No se ha establecido la seguridad ni la inmunogenicidad de FLUENZ® cuando se administra conjuntamente con vacunas inactivadas. Los estudios de FLUENZ® excluyeron a los sujetos que recibieron alguna vacuna inactivada o de subunidades en las dos semanas previas a la inclusión. Por consiguiente, los proveedores de servicios médicos deben tener en cuenta los riesgos y beneficios de la administración concomitante de FLUENZ® con vacunas inactivadas.
Vacunas vivas concomitantes: Se estudió la administración conjunta de FLUENZ® con la vacuna contra sarampión, paperas y rubeola, y la vacuna contra varicela en 1,245 niños de 12 a 15 meses de edad. Los eventos adversos fueron similares a los vistos en otros ensayos clínicos con FLUENZ® (véase Reacciones secundarias y adversas). No se observó ningún indicio de interferencia con las respuestas inmunitarias a las vacunas contra sarampión, paperas, rubeola y FLUENZ®. No se ha estudiado la administración concomitante de FLUENZ® con las vacunas de sarampión, paperas, rubeola y varicela en niños de más de 15 meses.
Productos intranasales: No existen datos respecto a la administración conjunta de FLUENZ® y otros preparados intranasales.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Los receptores de la vacuna pueden ser positivos a los virus de la vacuna de la influenza en secreciones nasofaríngeas o muestras en hisopos hasta por 3 semanas después de la vacunación.
PRECAUCIONES GENERALES:
Riesgos en niños de < 24 meses de edad: No se administre FLUENZ® a niños de menos de 24 meses de edad. En estudios clínicos se observó un aumento del riesgo de sibilancia después de la vacunación en los niños de menos de 24 meses que recibieron FLUENZ®. Se observó un aumento de hospitalizaciones en los niños de menos de 24 meses después de la vacunación con FLUENZ®. (Véase Reacciones secundarias y adversas).
Asma/sibilancia recurrente: No se debe administrar FLUENZ® a personas con asma ni a niños de menos de 5 años de edad con sibilancia recurrente porque puede aumentar el riesgo de sibilancia después de la vacunación, a menos que el beneficio potencial supere al riesgo potencial.
No se administre FLUENZ® a personas con asma grave o sibilancia activa, pues no se ha estudiado a estos individuos en ensayos clínicos.
Síndrome de Guillain-Barré: Si se ha presentado el síndrome de Guillain Barré dentro de las 6 semanas siguientes a cualquier vacunación previa contra la influenza, la decisión de administrar FLUENZ® debe basarse en una consideración cuidadosa de los beneficios y riesgos potenciales (véase Reacciones secundarias y adversas).
lnmunocompetencia alterada: La administración de FLUENZ®, una vacuna de virus vivos, a personas inmunocomprometidas debe basarse en una consideración cuidadosa de los beneficios y riesgos potenciales. Aunque se estudió FLUENZ® en 57 adultos asintomáticos o moderadamente sintomáticos con infección de VIH (véase Estudios clínicos), los datos que sustentan la seguridad y eficacia de la administración de FLUENZ® en individuos inmunocomprometidos son limitados.
Afecciones médicas que predisponen a complicaciones de la influenza: No se ha establecido la seguridad de FLUENZ® en individuos con afecciones médicas subyacentes que podrían predisponerlos a complicaciones subsiguientes a la infección de influenza natural. No se debe administrar FLUENZ® a menos que el beneficio potencial supere al riesgo potencial.
Manejo de las reacciones alérgicas agudas: Debe estar disponible el tratamiento médico y la supervisión apropiados para manejar posibles reacciones anafilácticas después de la administración de la vacuna (véase Contraindicaciones).
Limitaciones de la efectividad de la vacuna: Es posible que FLUENZ® no proteja a todos los individuos que reciban la vacuna.
Uso pediátrico: Se ha demostrado la seguridad y efectividad de la vacuna en niños de 2 años en adelante, con reducción en las tasas de influenza confirmada por cultivo en comparación con el control activo (vacuna contra la influenza inyectable elaborada por Sanofi Pasteur lnc.) y el placebo (véase Estudios clínicos). FLUENZ® no está indicada para niños de menos de 24 meses. Se ha asociado el uso de FLUENZ® en niños de menos de 24 meses con un aumento del riesgo de hospitalización y sibilancia en ensayos clínicos (véase Precauciones generales y Reacciones secundarias y adversas).
Uso geriátrico: FLUENZ® no está indicada para personas de ³ 65 años. Se estudió la seguridad en sujetos con afecciones médicas subyacentes de alto riesgo (n = 200). En comparación con los controles, los sujetos que recibieron FLUENZ® presentaron una tasa más alta de dolor de garganta.
Uso en personas de 50 a 64 años de edad: FLUENZ® no está indicada para personas de 50 a 64 años. En el estudio AV009 no se demostró efectividad en personas de 50 a 64 años (n = 641). Los eventos adversos solicitados fueron similares en cuanto a tipo y frecuencia a los referidos en adultos más jóvenes.
DOSIS Y VÍA DE ADMINISTRACIÓN: Para administración intranasal por un médico.
FLUENZ® debe ser administrado conforme al siguiente esquema:
|
Grupo por edad |
Estado de vacunación |
Esquema de dosificación |
|
Niños de 2 hasta 8 años de edad |
Nunca antes vacunados con vacuna contra la influenza estacional |
2 dosis (0.2 mL* cada una, separadas por al menos 1 mes). |
|
Niños de 2 hasta 8 años de edad |
Ya antes vacunados con vacuna contra la influenza estacional |
1 dosis (0.2 mL*). |
|
Niños, adolescentes y adultos de 9 hasta 49 años de edad |
No es aplicable |
1 dosis (0.2 mL*). |
* Administrar 0.1 mL por fosa nasal.
Para niños de 2 hasta 8 años de edad que no han recibido previamente vacuna contra la influenza estacional, el esquema de dosificación recomendado para administración nasal es una dosis de 0.2 mL (0.1 mL por fosa nasal) seguida de una segunda dosis de 0.2 mL (0.1 mL por fosa nasal), administrada al menos un mes después.
Para todas las demás personas, inclusive niños de 2 a 8 años que ya han recibido antes vacuna contra la influenza estacional, el esquema de dosificación recomendado es de una dosis de 0.2 mL (0.1 mL por fosa nasal).
FLUENZ® debe ser administrado antes de la exposición a la influenza. Se recomienda la revacunación anual con vacuna contra la influenza.
Instrucciones para la administración: Cada atomizador contiene una sola dosis de FLUENZ®, se debe administrar aproximadamente la mitad del contenido en cada fosa nasal. Consulte en el diagrama de administración (figura 1) las instrucciones de administración paso a paso. Después de administrar FLUENZ®, se debe desechar el atomizador conforme a los procedimientos normales para desperdicios médicos (por ejemplo, recipiente para objetos afilados o recipiente para material biológico peligroso).
Figura 1.
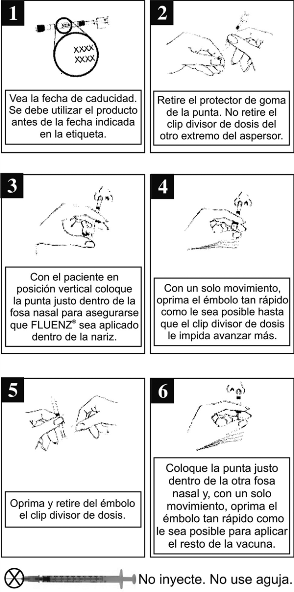
Nota: No es necesario que el paciente inhale activamente (aspire) durante la administración de FLUENZ®.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Ha habido reportes ocasionales de administración de dosis mayores a las recomendadas de FLUENZ® en la etapa de comercialización. El perfil de eventos adversos reportados fue comparable con las dosis recomendadas de FLUENZ®.
PRESENTACIÓN: FLUENZ® se suministra para aplicación intranasal en un paquete de 10 aspersores prellenados de uso único.
RECOMENDACIONES SOBRE ALMACENAMIENTO: FLUENZ® se debe almacenar en refrigerador entre 2 y 8°C a partir de su recepción y hasta su uso. El producto debe ser utilizado antes de la fecha de caducidad indicada en la etiqueta del aspersor. No se congele.
Durante el transporte de FLUENZ®, se debe mantener la cadena fría (2 a 8ºC).
LEYENDAS DE PROTECCIÓN:
Una vez que se ha administrado FLUENZ®, se debe desechar el aspersor conforme a los procedimientos normales para desperdicios médicos (por ejemplo, recipiente para objetos afilados o recipiente para material biológico peligroso). No se recomienda su uso durante el embarazo. No se deje al alcance de los niños. Su venta requiere receta médica. Literatura exclusiva para médicos.
Información de asesoramiento para el paciente: Vacunación con una vacuna de virus vivo.
Los receptores de la vacuna o sus padres/tutores deben ser informados, por el proveedor de servicios médicos, de que FLUENZ® es una vacuna de virus vivos atenuados y que tiene el potencial de transmitirse a los contactos inmunocomprometidos que viven con el receptor de la vacuna.
Los receptores de la vacuna deben tratar, siempre que sea posible, de evitar el contacto cercano con individuos seriamente inmunocomprometidos (es decir, receptores de trasplante de médula ósea que requieren aislamiento) por 1-2 semanas siguientes a la vacunación.

ASTRAZENECA, S. A. de C. V.
Súper Avenida Lomas Verdes No. 67
Fracc. Lomas Verdes
C.P. 53120, Naucalpan de Juárez, Edo. de México
Reg. Núm. 075M2011, SSA