
JANUVIA
SITAGLIPTINA
Comprimidos
1 Caja,14 Comprimidos,100 mg
1 Caja,14 Comprimidos,25 mg
1 Caja,14 Comprimidos,50 mg
1 Caja,28 Comprimidos,100 mg
1 Caja,28 Comprimidos,25 mg
1 Caja,28 Comprimidos,50 mg
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Forma Farmacéutica:
Comprimido
Formulación:
Cada comprimido contiene:
Fosfato de Sitagliptina Monohidratada equivalente a 25 mg de Sitagliptina
Excipiente c.b.p. 1 comprimido
Cada comprimido contiene:
Fosfato de Sitagliptina Monohidratada equivalente a 50 mg de Sitagliptina
Excipiente c.b.p. 1 comprimido
Cada comprimido contiene:
Fosfato de Sitagliptina Monohidratada equivalente a 100 mg de Sitagliptina
Excipiente c.b.p. 1 comprimido
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 238M2006 SSA
Versión: S-WPC-MK0431-T-052020
RCN: 000013427-MX
IV. INDICACIONES TERAPÉUTICAS
Monoterapia
JANUVIA está indicado como un complemento de la dieta y el ejercicio para mejorar el control de la glucemia en los pacientes con diabetes mellitus tipo 2.
Combinación con metformina
JANUVIA está indicado en pacientes con diabetes mellitus tipo 2 para mejorar el control de la glucemia en combinación con metformina como tratamiento inicial o cuando un solo agente con dieta y ejercicio, no proporcionan control suficiente de la glucemia.
Combinación con una sulfonilurea
JANUVIA está indicado en los pacientes con diabetes mellitus tipo 2 para mejorar el control de la glucemia en combinación con una sulfonilurea cuando el tratamiento con un solo agente con dieta y ejercicio, no proporciona control suficiente de la glucemia.
Combinación con un agonista del PPARℽ
JANUVIA está indicado en los pacientes con diabetes mellitus tipo 2 para mejorar el control de la glucemia en combinación con un agonista del PPARℽ (p. ej., tiazolidinedionas) cuando el tratamiento con un solo agente con dieta y ejercicio, no proporciona control suficiente de la glucemia.
Combinación con metformina y una sulfonilurea
JANUVIA está indicado en pacientes con diabetes mellitus tipo 2 para mejorar el control de la glucemia en combinación con metformina y una sulfonilurea cuando el tratamiento dual con esos agentes, con dieta y ejercicio, no proporciona control suficiente de la glucemia.
Combinación con metformina y un agonista del PPARℽ
JANUVIA está indicado en los pacientes con diabetes mellitus tipo 2 para mejorar el control de la glucemia en combinación con metformina y un agonista del PPARℽ (p. ej., tiazolidinediona) cuando el tratamiento dual con esos agentes con dieta y ejercicio no proporciona control suficiente de la glucemia.
Combinación con insulina
JANUVIA está indicado en pacientes con diabetes mellitus tipo 2 como complemento a la dieta y el ejercicio para mejorar el control de la glucemia en combinación con insulina (con o sin metformina).
V. FARMACOCINÉTICA Y FARMACODINAMIA
Mecanismo de Acción
JANUVIA es un miembro de una clase de agentes hipoglucemiantes llamados inhibidores de la dipeptidil peptidasa 4 (DPP-4), que mejoran el control de la glucemia en pacientes con diabetes tipo 2, aumentando las concentraciones de las hormonas incretinas. Estas hormonas, que incluyen el péptido-1 similar al glucagón (GLP-1, por las siglas en inglés para glucagon-like peptide-1) y el polipéptido insulinotrópico dependiente de la glucosa (GIP, por las siglas en inglés para glucose-dependent insulinotropic polypeptide), son liberadas por el intestino durante todo el día y sus concentraciones aumentan en respuesta a la ingestión de alimentos. Las incretinas forman parte de un sistema endógeno que participa en la regulación fisiológica de la homeostasis de la glucemia. Cuando la glucemia está normal o elevada, el GLP-1 y el GIP aumentan la síntesis y la liberación de insulina por las células beta del páncreas a través de vías intracelulares en las que interviene el monofosfato de adenosina cíclico (cAMP, por las siglas en inglés para cyclic adenosine monophosphate). Se ha demostrado que el tratamiento con GLP-1 o con inhibidores de la DPP-4 en modelos animales de diabetes de tipo 2 mejora la capacidad de respuesta de las células beta a la glucosa y estimula la biosíntesis y la liberación de insulina. Con concentraciones mayores de insulina, aumenta la captación tisular de glucosa. Además, el GLP-1 disminuye la secreción de glucagón por las células alfa del páncreas. Las concentraciones disminuidas de glucagón y el aumento de las concentraciones de insulina hacen que disminuya la producción hepática de glucosa, resultado en una disminución de la concentración de glucosa en la sangre. Los efectos del GLP-1 y del GIP son dependientes de la glucosa, de tal suerte que cuando la glucemia está baja no se observan la estimulación de la liberación de insulina ni la inhibición de la secreción de glucagón por GLP-1. La estimulación de liberación de insulina, tanto por GLP-1 como por GIP, se potencializa cuando los niveles de glucosa están por arriba de lo normal. Más aún, el GLP-1 no afecta la respuesta normal del glucagón a la hipoglucemia. La actividad del GLP-1 y del GIP está limitada por la enzima DPP-4, que hidroliza rápidamente las incretinas y las transforma en productos inactivos. La sitagliptina impide esa hidrólisis de las incretinas por la DPP-4, por lo que aumentan las concentraciones de las formas activas de GLP-1 y de GIP en el plasma. Como consecuencia de este aumento en las concentraciones de las incretinas, la sitagliptina aumenta la liberación de insulina y disminuye la concentración de glucagón de manera dependiente de la glucosa. En pacientes con diabetes tipo 2 con hiperglucemia, estos cambios en las concentraciones de insulina y de glucagón hacen que disminuyan las concentraciones de hemoglobina A1c (HbA1c) y la glucemia en ayunas y post-prandial. El mecanismo dependiente de glucosa de sitagliptina es diferente al de las sulfonilureas, ya que éstas incrementan la secreción de insulina aun cuando los niveles de glucosa estén bajos, lo que puede causar hipoglucemia en pacientes con diabetes tipo 2 y en sujetos normales. Aunque la sitagliptina es un inhibidor potente y sumamente selectivo de la enzima DPP-4, no inhibe las enzimas estrechamente relacionadas DPP-8 y DPP-9, a concentraciones terapéuticas.
FARMACOCINÉTICA
La farmacocinética de sitagliptina ha sido determinada extensamente en sujetos sanos y en pacientes con diabetes tipo 2. Tras la administración oral de una dosis de 100 mg a sujetos sanos, la sitagliptina fue absorbida rápidamente y alcanzó concentraciones máximas en el plasma (Tmáx medio) una a cuatro horas después de la dosis. El área bajo la curva (AUC, por las siglas en inglés para Area Under the Curve) de concentración plasmática aumentó en proporción con la dosis. Tras una dosis oral única de 100 mg a voluntarios sanos, el AUC plasmática promedio de la sitagliptina fue de 8.52 μM• h, la concentración máxima (Cmáx) fue de 950 nM, y la vida media (t½)terminal aparente fue de 12.4 horas. En el estado de equilibrio tras la administración de dosis de 100 mg, el AUC plasmática de la sitagliptina aumentó 14% aproximadamente en comparación con la primera dosis. Los coeficientes de variación del AUC de la sitagliptina en un mismo sujeto y entre sujetos fueron pequeños (5.8% y 15.1%, respectivamente). La farmacocinética de la sitagliptina fue generalmente similar en los sujetos sanos y en los pacientes con diabetes tipo 2.
Absorción
La biodisponibilidad absoluta de la sitagliptina es de 87% aproximadamente. Como la administración concomitante de JANUVIA con una comida alta en grasas no tuvo ningún efecto sobre su farmacocinética, JANUVIA se puede administrar con o sin alimentos.
Distribución
El volumen de distribución promedio en estado de equilibrio después de una dosis intravenosa única de 100 mg de sitagliptina a sujetos sanos es de aproximadamente 198 litros. El porcentaje de sitagliptina que se une reversiblemente a las proteínas plasmáticas es bajo (38%).
Metabolismo
La sitagliptina es eliminada principalmente sin cambio en la orina, y su metabolismo es una vía menor. Aproximadamente 79% de la sitagliptina es excretada sin cambio en la orina.
Después de una dosis oral de sitagliptina marcada con 14C, aproximadamente 16% de la radiactividad fue excretada como metabolitos de la sitagliptina. Se detectaron sólo trazas de seis metabolitos, y no se prevé que contribuyan a la actividad inhibitoria de la sitagliptina sobre la DPP-4 plasmática. Los estudios in vitro indicaron que la principal enzima causante del metabolismo limitado de la sitagliptina fue la CYP3A4, secundada por la CYP2C8.
Eliminación
Tras la administración de una dosis oral de sitagliptina marcada con 14C a sujetos sanos, aproximadamente 100% de la radiactividad administrada fue eliminada en las heces (13%) y en la orina (87%) durante la semana siguiente. Después de una dosis oral de 100 mg, la t½ terminal aparente de la sitagliptina fue de 12.4 horas aproximadamente y la depuración renal fue de 350 mL/min aproximadamente.
La eliminación de la sitagliptina ocurre principalmente por excreción renal, con secreción tubular activa. La sitagliptina es un sustrato para el transportador 3 de aniones orgánicos humano (hOAT-3, por las siglas en inglés para human organic anion transporter-3), el cual podría intervenir en su eliminación renal. No se ha determinado la importancia clínica del hOAT-3 en el transporte de la sitagliptina. La sitagliptina es también un sustrato de la glucoproteína-p, que también podría mediar en su eliminación renal. Sin embargo, la ciclosporina, que es un inhibidor de la glucoproteína-p, no disminuyó la depuración renal de la sitagliptina.
Características en los Pacientes
Insuficiencia renal:
Se hizo un estudio abierto con dosis única para evaluar la farmacocinética de JANUVIA (dosis de 50 mg) en pacientes con diversos grados de insuficiencia renal crónica en comparación con testigos sanos. El estudio incluyó pacientes con insuficiencia renal leve, moderada, grave, y pacientes con nefropatía en etapa terminal (ESRD, por las siglas en inglés para end-stage renal disease) en hemodiálisis. También se evaluó los efectos de la insuficiencia renal en la farmacocinética de la sitagliptina en pacientes con diabetes tipo 2 y con insuficiencia renal leve, moderada, grave (incluyendo ESRD), utilizando el análisis farmacocinético poblacional.
El AUC en plasma de la sitagliptina se incrementó aproximadamente 1.2 y 1.6 veces en pacientes con insuficiencia renal leve (eGFR [por las siglas en inglés para estimated glomerufar filtration rate] ≥ 60 mL/min/1.73 m2 a < 90 mL/min/1.73 m2) y en pacientes con insuficiencia renal moderada (eGFR ≥ 45 mL/min/1.73 m2 a < 60 mL/min/1.73 m2) respectivamente. Los ajustes de dosis en estos pacientes no son necesarios debido a que la magnitud del incremento del AUC no son clínicamente relevantes.
El AUC en plasma de la sitagliptina aumentó aproximadamente 2 veces en los pacientes con insuficiencia renal moderada (eGFR ≥ 30 mL/min/1.73 m2 a < 45 mL/min/1.73 m2), y aproximadamente 4 veces en pacientes con insuficiencia renal grave (eGFR < 30 mL/min/1.73 m2), incluyendo a los pacientes con ESRD bajo tratamiento con hemodiálisis. La hemodiálisis extrae poca sitagliptina de la sangre (13.5% en el transcurso de 3 a 4 horas, iniciándola cuatro horas después de administrar la dosis). Se recomienda utilizar dosis menores en pacientes con eGFR <45 mL/min/1.73 m2 para obtener concentraciones plasmáticas de sitagliptina similares a las obtenidas en pacientes con función renal normal. (Ver DOSIS Y VÍA DE ADMINISTRACIÓN, Pacientes con Insuficiencia Renal).
Insuficiencia hepática
En los pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9), tras la administración de una dosis única de 100 mg de JANUVIA los promedios de AUC y de Cmáx. de sitagliptina fueron aproximadamente 21% y 13% mayores, respectivamente, comparado con los testigos sanos. Esas diferencias no se consideran clínicamente importantes. No es necesario hacer ningún ajuste de la dosificación en los pacientes con insuficiencia hepática leve o moderada.
No se tiene ninguna experiencia clínica en pacientes con insuficiencia hepática grave (puntuación de Child-Pugh > 9). Sin embargo, como la sitagliptina se elimina principalmente por vía renal, no se prevé que la insuficiencia hepática grave afecte la farmacocinética de la sitagliptina.
Pacientes de edad avanzada: No es necesario ajustar la dosificación de JANUVIA según la edad del paciente. Según un análisis farmacocinético de población de las Fases I y II, la edad no tuvo un efecto de importancia clínica sobre la farmacocinética de la sitagliptina. Las personas de edad avanzada (65 a 80 años) tuvieron concentraciones plasmáticas de sitagliptina aproximadamente 19% mayores que las de sujetos de menor edad.
Niños: Se investigó la farmacocinética de sitagliptina (dosis única de 50 mg, 100 mg o 200 mg) en pacientes pediátricos (de 10 a 17 años de edad) con diabetes tipo 2. En esta población, el AUC ajustado a la dosis de sitagliptina en plasma fue aproximadamente un 18% menor en comparación con los pacientes adultos con diabetes tipo 2 para una dosis de 100 mg. Esto no se considera una diferencia clínicamente significativa basada en Ia relación farmacocinética (PK)/ farmacodinamia (PD) plana entre la dosis de 50 mg y 100 mg en adultos.
No se han realizado estudios con sitagliptina en pacientes pediátricos < 10 años.
Sexo: No es necesario ajustar la dosificación según el sexo del paciente. Basándose en un análisis compuesto de los datos farmacocinéticos de Fase I y en un análisis farmacocinético de población de los datos de las Fases I y II, el sexo no tuvo ningún efecto de importancia clínica sobre la farmacocinética de la sitagliptina.
Raza: No es necesario ningún ajuste de la dosificación según la raza del paciente. Basándose en un análisis compuesto de los datos farmacocinéticos de Fase I y en un análisis farmacocinético de población de los datos de las Fases I y II que incluyó personas de razas blanca y negra, Hispanoamericanos, Asiáticos y de otros grupos raciales, la raza no tuvo ningún efecto de importancia clínica sobre la farmacocinética de la sitagliptina.
Índice de masa corporal (IMC o BMI por las siglas en inglés para Body Mass lndex):
No es necesario hacer ningún ajuste de la dosificación basado en el IMC. Basándose en un análisis compuesto de los datos farmacocinéticos de Fase I y en un análisis farmacocinético de población de los datos de las Fases I y II, el índice de masa corporal no tuvo ningún efecto de importancia clínica sobre la farmacocinética de la sitagliptina.
Diabetes tipo 2
La farmacocinética de la sitagliptina es generalmente similar en los pacientes con diabetes tipo 2 y en los sujetos sanos.
FARMACODINAMIA
En pacientes con diabetes tipo 2 la administración oral de dosis únicas de JANUVIA inhibió la enzima DPP-4 activa por un periodo de 24 horas, resultando en un aumento de 2 a 3 veces en los niveles circulantes de GLP-1 y de GIP activos, aumento en los niveles plasmáticos de insulina y del péptido C, disminución en las concentraciones de glucagón, disminución de la glucosa en ayunas y reducción de la excursión de glucosa posterior a cargas orales de glucosa o a alimentos.
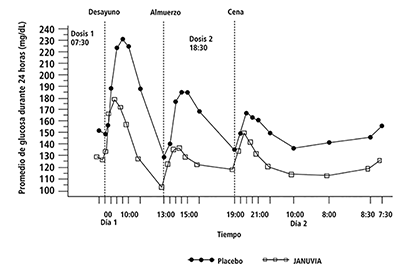
En un estudio en pacientes con diabetes tipo 2 no controlados adecuadamente con monoterapia con metformina, los niveles de glucosa vigilados durante el día estuvieron significativamente reducidos en pacientes que recibieron sitagliptina 100 mg al día (50 mg dos veces al día) en combinación con metformina en comparación con quienes recibieron metformina más placebo (véase Figura 1).
Figura 1. Perfil de glucosa plasmática después de 24 horas de tratamiento con JANUVIA 100 mg más metformina y placebo más metformina
En estudios clínicos de Fase III de 18 y 24 semanas el tratamiento con JANUVIA 100 mg al día en pacientes con diabetes tipo 2 mejoró significativamente la función de las células beta, según se confirmó por diferentes marcadores, incluyendo el Modelo β de Evaluación de la homeostasis (HOMA-β, por las siglas en inglés para Homeostasis Model Assessment-β), relación proinsulina a insulina y medición de la respuesta de las células beta a partir de muestras repetidas de la prueba de tolerancia a los alimentos.
En estudios de Fase II, JANUVIA 50 mg dos veces al día no mejoró la eficacia glucémica comparado con la dosis de 100 mg una vez al día.
En un estudio doble ciego de dos días, cruzado, de cuatro periodos, aleatorizado, controlado con placebo y de doble enmascaramiento en adultos sanos, se compararon los efectos de la administración concomitante de sitagliptina y metformina sobre las concentraciones del GLP-1 plasmático activo y total y la glucemia postprandiales con los de la administración de sitagliptina sola, metformina sola o placebo. El aumento del promedio ponderado de las concentraciones de GLP-1 activo 4 horas después de la comida fue aproximadamente 2 veces mayor con la sitagliptina sola o la metformina sola comparado con placebo. La administración concomitante de sitagliptina y metformina tuvo un efecto aditivo sobre las concentraciones de GLP-1 activo, que aumentaron aproximadamente 4 veces más que con placebo. La sitagliptina sola también aumentó las concentraciones de GLP-1 activo, debido muy probablemente a la inhibición de la DPP-4, mientras que la metformina sola aumentó en grado similar las concentraciones de GLP-1 activo y total, lo cual sugiere un mecanismo diferente para el aumento del GLP-1 activo. Estos datos son consistentes con un mecanismo diferente, debido principalmente a un aumento de las concentraciones del GLP-1 total. Los resultados de ese estudio también demostraron que la sitagliptina, pero no la metformina, aumenta las concentraciones de GIP activo.
En estudios con sujetos sanos la sitagliptina no disminuyó la glucemia ni provocó hipoglucemia, lo cual sugiere que sus acciones insulinotrópica y supresora del glucagón son dependientes de la glucosa.
Efectos en la presión arterial
En un estudio controlado con placebo, aleatorizado, cruzado, en pacientes hipertensos con uno o más antihipertensivos (incluyendo inhibidores de la enzima convertidora de angiotensina (ECA o ACE por las siglas en inglés para angiotensin-converting enzyme), antagonistas de angiotensina II, bloqueadores de canales de calcio, bloqueadores beta y diuréticos) la administración concomitente de JANUVIA fue generalmente bien tolerada. En esos pacientes, JANUVIA tuvo un efecto modesto en la disminución de la presión arterial: 100 mg por día de JANUVIA redujeron la presión arterial sistólica ambulatoria en 24 horas aproximadamente 2 mmHg comparado con placebo. Esas reducciones no se han observado en pacientes con presión arterial normal.
Electrofisiología cardiaca
En un estudio controlado con placebo, aleatorizado, cruzado, en 79 sujetos sanos se administró una sola dosis oral de JANUVIA de 100 mg, JANUVIA 800 mg (8 veces la dosis recomendada) o placebo. La dosis recomendada de 100 mg no afectó el intervalo QTc cuando se alcanzaron las concentraciones plasmáticas pico ni en ningún otro momento del estudio. Después de la dosis de 800 mg el máximo aumento 3 horas después de la dosis fue 8.0 mseg en el intervalo QTc. Este pequeño aumento no se consideró clínicamente significativo. Las concentraciones plasmáticas pico de sitagliptina de la dosis de 800 mg fueron 11 veces mayores que las obtenidas con la dosis de 100 mg.
En pacientes con diabetes tipo 2 la administración de JANUVIA 100 mg (n = 81) o JANUVIA 200 mg (n = 63) diarios no aumentó significativamente el intervalo QT según datos obtenidos por electrocardiograma (EKG) al momento que se esperaban las concentraciones plasmáticas pico.
Estudios clínicos
Se aleatorizó aproximadamente a 5,200 pacientes con diabetes tipo 2 en nueve estudios clínicos Fase III, doble ciegos y controlados con un placebo, para evaluar los efectos de la sitagliptina sobre el control glucémico. Las enfermedades concomitantes, incluyendo dislipidemia e hipertensión, fueron comunes en los pacientes estudiados y más de 50% eran obesos (IMC ≥30 kg/m2). La mayoría de los pacientes satisfacían los criterios del National Cholesterol Education Program (NCEP) de Estados Unidos para establecer el diagnóstico de síndrome metabólico. Estos estudios incluyeron grupos de raza blanca, Hispanoamericanos, negra, Asiática y de otros grupos raciales y étnicos, en general, los pacientes tenían una edad promedio de 55 años.
Se hicieron otros estudios clínicos doble ciego controlados con placebo: Uno en 151 pacientes Japoneses con diabetes tipo 2 y otro en 91 pacientes con diabetes tipo 2 e insuficiencia renal moderada a grave.
Se realizó un estudio controlado con tratamiento activo (glipizida) de 52 semanas de duración en 1,172 pacientes con diabetes tipo 2 no controlados adecuadamente con metformina. Además, se realizó un estudio controlado con tratamiento activo (metformina) de 24 semanas de duración en 1,050 pacientes no controlados adecuadamente solo con dieta y ejercicio.
En pacientes con diabetes tipo 2, el tratamiento con JANUVIA produjo mejorías clínicamente significativas en la hemoglobina A1c (HbA1c), la glucemia en ayunas (FPG, por las siglas en inglés para fasting plasma glucose) y la glucemia postprandial a las dos horas (PPG, por las siglas en inglés para postprandial glucose) en comparación con placebo. En el estudio controlado con tratamiento activo (glipizida) se mantuvieron mejorías clínicamente significativas en el control glucémico durante 52 semanas. JANUVIA mejoró el funcionamiento de las células beta (ver FARMACOCINÉTICA Y FARMACODINAMIA).
Estudios Clínicos en Monoterapia
Un total de 1,262 pacientes con diabetes tipo 2 participaron en dos estudios doble ciego controlados con placebo, uno de 18 semanas y el otro de 24 semanas, para evaluar la eficacia y la seguridad de la monoterapia con JANUVIA. Se aleatorizó a los pacientes con control insuficiente de la glucemia (HbA1c 7% a 10%) para recibir una dosis diaria de 100 mg o 200 mg de JANUVIA o de un placebo.
El tratamiento con 100 mg diarios de JANUVIA mejoró significativamente en comparación con placebo la HbA1c, la FPG y la PPG a las dos horas (tablas 1 y 2). Estos estudios incluyeron pacientes con un amplio rango de valores iniciales de HbA1c. La mejoría en HbA1c, en comparación con placebo, no fue afectada por el sexo, la edad, la raza antes del tratamiento hipoglucemiante, el IMC basal, la presencia de síndrome metabólico o un índice estándar de resistencia a la insulina (HOMA-IR). Los pacientes con menos tiempo desde el diagnóstico de su diabetes (<3 años) o con mayor HbA1c basal tuvieron mayores disminuciones de la HbA1c. Los pacientes que no estaban bajo tratamiento hipoglucemiante antes de entrar a los estudios de 18 y 24 semanas, la disminución de HbA1C fue -0.67% y -0.85%, respectivamente, para quienes recibieron JANUVIA y -0.10% y -0.18% para quienes recibieron placebo. En ambos estudios JANUVIA disminuyó significativamente en comparación con placeboFPG (-19.3 mg/dL en el estudio de 18 semanas y -15.8 mg/dL en el de 24 semanas) a las tres semanas, que fue cuando se hizo la primera medición de la FPG. En general, la dosis diaria de 200 mg no fue más eficaz en el control de la glucemia que la de 100 mg. El efecto de JANUVIA sobre los parámetros lipídicos fue similar al placebo. El peso corporal inicial no aumentó con el tratamiento con JANUVIA en ninguno de los dos estudios, en comparación con una pequeña disminución en los pacientes que recibieron placebo (tabla 2). La incidencia observada de hipoglucemia fue similar en los pacientes tratados con JANUVIA y en los que recibieron placebo.
Tabla 1
Resultados de la HbA1c en los estudios controlados con placebo de JANUVIA de 18 y de 24 semanas en pacientes con diabetes tipo 2†, incluyendo la estratificación según la HbA1c basal
|
Estudio de 18 semanas |
Estudio de 24 semanas |
|||
|
JANUVIA 100 mg |
Placebo |
JANUVIA 100 mg |
Placebo |
|
|
HbA1c (%) |
N = 193 |
N = 103 |
N = 229 |
N = 244 |
|
Basal (promedio) |
8.04 |
8.05 |
8.01 |
8.03 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.48 |
0.12 |
-0.61 |
0.18 |
|
Diferencia con placebo (promedio ajustado‡) |
-0.60§ |
-0.79§ |
||
|
Pacientes (%) que lograron HbA1c <7% |
69 (35.8) |
16 (15.5) |
93 (40.6) |
41 (16.8) |
|
Estrato de HbA1c basal |
||||
|
HbA1c basal ≥9% (%) |
N = 27 |
N = 20 |
N = 37 |
N = 35 |
|
Inicial (promedio) |
9.48 |
9.48 |
9.59 |
9.46 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.83 |
0.37 |
-1.27 |
0.25 |
|
Diferencia con placebo (promedio ajustado‡) |
-1.20 |
-1.52 |
||
|
HbA1c basal ≥8% a <9% (%) |
N = 70 |
N = 25 |
N = 62 |
N = 82 |
|
Basal (promedio) |
8.40 |
8.38 |
8.36 |
8.41 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.42 |
0.19 |
-0.64 |
0.16 |
|
Diferencia con placebo (promedio ajustado‡) |
-0.61 |
-0.80 |
||
|
HbA1c basal <8% (%) |
N = 96 |
N = 58 |
N = 130 |
N = 127 |
|
Basal (promedio) |
7.37 |
7.41 |
7.39 |
7.39 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.42 |
0.02 |
-0.40 |
0.17 |
|
Diferencia con placebo (promedio ajustado‡) |
-0.44 |
-0.57 |
||
† Población de todos los pacientes tratados (análisis por intención de tratar).
‡ Promedios de los cuadrados mínimos ajustados según el tratamiento hipoglucemiante anterior y el valor basal.
§ p<0.001 en la comparación con placebo.
Tabla 2
Parámetros glucémicos adicionales y peso corporal en los estudios controlados con placebo de JANUVIA de 18 y de 24 semanas en pacientes con diabetes tipo 2†
|
Estudio de 18 semanas |
Estudio de 24 semanas |
|||
|
JANUVIA 100 mg |
Placebo |
JANUVIA 100 mg |
Placebo |
|
|
FPG (mg/dL) |
N = 201 |
N = 107 |
N = 234 |
N = 247 |
|
Basal (promedio) |
179.8 |
183.6 |
170.2 |
176.1 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-12.7 |
7.0 |
-12.4 |
4.7 |
|
Diferencia con placebo (promedio ajustado‡) |
-19.7§ |
-17.1§ |
||
|
PPG a las 2 horas (mg/dL) |
* |
* |
N = 201 |
N = 204 |
|
Basal (promedio) |
257.2 |
270.8 |
||
|
Cambio desde el valor basal (promedio ajustado‡) |
-48.9 |
-2.2 |
||
|
Diferencia con placebo (promedio ajustado‡) |
-46.7§ |
|||
|
Peso corporal (kg)¶ |
N = 172 |
N = 77 |
N = 193 |
N = 174 |
|
Basal (promedio) |
89.5 |
91.3 |
83.9 |
83.3 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.6 |
-0.7 |
-0.2 |
-1.1 |
|
Diferencia con placebo (promedio ajustado‡) |
0.1# |
0.9†† |
||
† Población de Todos los pacientes tratados (análisis por intención de tratar).
‡ Promedios de los cuadrados mínimos ajustados según el tratamiento hipoglucemiante anterior y el valor basal.
§ p<0.001 en la comparación con placebo.
* Datos no disponibles.
¶ Todos los pacientes tratados, excluyendo los que recibieron tratamiento glucémico de rescate.
# No estadísticamente significativo (p≥0.05) comparado con placebo.
†† p<0.01 comparado con placebo.
Estudios adicionales en monoterapia
Se hizo un estudio doble ciego controlado con placebo en pacientes Japoneses con diabetes tipo 2 para evaluar la eficacia del tratamiento con 100 mg de JANUVIA una vez al día en comparación con placebo. Se estudiaron 151 pacientes (75 tratados con JANUVIA y 76 con placebo) con promedio de edad de 55.3 años, IMC de 25.2 kg/m2, promedio de HbA1c basal de 7.6% y promedio de PG de 163 mg/dL. Después de 12 semanas de tratamiento, JANUVIA disminuyó -1.05% la HbA1c en comparación con placebo (cambio del valor basal, -0.65% con JANUVIA y 0.41% con placebo, p<0.001). La FPG disminuyó -31.9 mg/dL en comparación con placebo (cambio del valor basal, -22.5mg/dL con JANUVIA y 9.4 mg/dL con placebo, p<0.001).
También se hizo un estudio multinacional, aleatorizado y controlado con placebo para evaluar la seguridad y la tolerabilidad de JANUVIA en 91 pacientes con diabetes tipo 2 e insuficiencia renal crónica (depuración de creatinina <50 mL/min). Los pacientes con insuficiencia renal moderada recibieron 50 mg diarios de JANUVIA, y los que tenían insuficiencia renal grave o ESRD tratados con hemodiálisis o diálisis peritoneal recibieron 25 mg diarios. En este estudio, la seguridad y la tolerabilidad de JANUVIA fueron generalmente similares a las de placebo. Además, las disminuciones de la HbA1c y de la FPG producidas por JANUVIA en comparación con placebo fueron generalmente similares a las observadas en otros estudios con monoterapia. (Ver FARMACOCINÉTICA Y FARMACODINAMIA, Características en los pacientes, Insuficiencia renal.)
Tratamiento inicial combinado con metformina
Un total de 1,091 pacientes con diabetes tipo 2 y un control glucémico inadecuado con dieta y ejercicio participaron en un estudio de diseño factorial, doble ciego, aleatorizado, controlado con placebo de 24 semanas que evaluó la eficacia y seguridad del tratamiento inicial con la combinación de sitagliptina y metformina. Aproximadamente un número equivalente de pacientes fueron aleatorizados a recibir tratamiento inicial con placebo, sitagliptina 100 mg una vez al día (JANUVIA), 500 o 1,000 mg dos veces al día de metformina o 50 mg de sitagliptina combinados con 500 o 1,000 mg de metformina dos veces al día.
El tratamiento inicial con la combinación de sitagliptina y metformina brindó mejorías significativas en HbA1c, FPG y PPG a las 2 horas en comparación con placebo, con metformina sola y con sitagliptina sola (p<0.001; Tabla 3). Una mejoría en FPG, con una reducción cercana al máximo, se logró en el punto temporal de 3 semanas (la primera evaluación después de iniciado el tratamiento) y se mantuvo a lo largo de las 24 semanas del estudio. Las mediciones de la función de las células beta, HOMA-β y la relación proinsulina a insulina también mostraron mayor mejoría con la administración concomitante de sitagliptina y metformina en comparación con la monoterapia de ambos medicamentos. En general, los efectos en los lípidos fueron neutrales. La disminución en el peso corporal en el grupo de sitagliptina y metformina fue similar al de los grupos de metformina sola o de placebo. Las reducciones promedio de HbA1c respecto al valor basal, comparado con placebo fueron en general mayores en los pacientes que al inicio tenían un valor de HbA1c mayor. La mejoría en HbA1c fue generalmente consistente entre los grupos definidos por sexo, edad, raza o IMC basal. Las reducciones promedio respecto al valor basal en HbA1c de los pacientes que no estaban bajo tratamiento hipoglucemiante antes del estudio fueron: JANUVIA 100 mg una vez al día, -1.06%; metformina 500 mg dos veces al día, -1.09%; metformina 1,000 mg dos veces al día, -1.24%; sitagliptina 50 mg dos veces al día más metformina 500 mg dos veces al día, -1.59%; sitagliptina 50 mg dos veces al día más metformina 1,000 mg dos veces al día, -1.94% y; para quienes recibieron placebo, -0.17%.
Tabla 3
Parámetros glucémicos y peso corporal en la última visita (semana 24) para sitagliptina y metformina como tratamiento inicial, solas o en combinación†
|
Placebo |
Sitagliptina (JANUVIA) 100 mg una vez al día |
Metformina 500 mg 2/día |
Sitagliptina 50 mg 2/día + Metformina 500 mg 2/día |
Metformina 1000 mg 2/día |
Sitagliptina 50 mg 2/día + Metformina 1000 mg 2/día |
|
|
HbA1c (%) |
N = 165 |
N = 175 |
N = 178 |
N = 183 |
N = 177 |
N = 178 |
|
Basal (promedio) |
8.68 |
8.87 |
8.90 |
8.79 |
8.68 |
8.76 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.17 |
-0.66 |
-0.82 |
-1.40 |
-1.13 |
-1.90 |
|
Diferencia con placebo (promedio ajustado‡) |
- |
-0.83§ |
-0.99§ |
-1.57§ |
-1.30§ |
-2.07§ |
|
Pacientes (%) que lograron HbA1c <7% |
15 (9.1) |
35 (20.0) |
41 (23.0) |
79 (43.2) |
68 (38.4) |
118 (66.3) |
|
FPG (mg/dL) |
N = 169 |
N = 178 |
N = 179 |
N = 183 |
N = 179 |
N = 180 |
|
Basal (promedio) |
196.3 |
201.4 |
205.2 |
203.9 |
197.0 |
196.7 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
5.8 |
-17.5 |
-27.3 |
-47.1 |
-29.3 |
-63.9 |
|
Diferencia con placebo (promedio ajustado‡) |
- |
-23.3§ |
-33.1§ |
-52.9§ |
-35.1§ |
-69.7§ |
|
PPG a 2 horas (mg/dL) |
N = 129 |
N = 136 |
N = 141 |
N = 147 |
N = 138 |
N = 152 |
|
Basal (promedio) |
276.8 |
285.4 |
292.7 |
291.8 |
283.4 |
286.9 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.3 |
-51.9 |
-53.4 |
-92.5 |
-78.0 |
-116.6 |
|
Diferencia con placebo (promedio ajustado‡) |
-52.2§ |
-53.7§ |
-92.8§ |
-78.3§ |
-116.9§ |
|
|
Peso corporal (kg)% |
N = 167 |
N = 175 |
N = 179 |
N = 184 |
N = 175 |
N = 178 |
|
Basal (promedio) |
90.1 |
85.9 |
88.1 |
90.0 |
89.4 |
88.2 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.9 |
0.0 |
-0.9 |
-0.6 |
-1.1 |
-1.3 |
|
Diferencia con placebo (promedio ajustado‡) |
0.9¶ |
0.1# |
0.4# |
-0.1# |
-0.3# |
† Población de todos los pacientes tratados (análisis según la intención de tratar).
‡ Promedios de los cuadrados mínimos ajustados según el tratamiento hipoglucemiante anterior y el valor basal.
§ p<0.001 comparado con placebo.
% Todos los pacientes tratados, excepto los que recibieron tratamiento hipoglucemiante de rescate.
¶ p=0.005 comparado con placebo.
# No estadísticamente significativo comparado con placebo (p≥0.05).
Además, este estudio incluyó pacientes (N=117) con hiperglucemia más grave (HbA1c >11% o glucosa sanguínea >280 mg/dL) que fueron tratados en forma abierta con sitagliptina 50 mg y metformina 1,000 mg dos veces al día. En este grupo de pacientes la HbA1c basal fue 11.15%, la FPG fue 314.4 mg/dL, y PPG a las 2 horas fue 441.0 mg/dL. Después de 24 semanas las disminuciones observadas respecto al inicio de HbA1c, fueron -2.94%, -126.7 mg/dL para GPPA y -207.9 mg/dL para PPG a las 2 horas. En esta población abierta se observó un modesto aumento en el peso corporal de 1.3 kg a las 24 semanas.
Tratamiento combinado de adición a metformina
Un total de 701 pacientes con diabetes tipo 2 participó en un estudio de 24 semanas doble ciego, aleatorizados y controlados con placebo, para evaluar la eficacia de JANUVIA en combinación con metformina. Todos los pacientes iniciaron monoterapia con metformina, la dosis de ésta se aumentó hasta por lo menos 1,500 mg diarios. A los pacientes se les aleatorizó para añadirles 100 mg de JANUVIA o un placebo una vez al día.
En combinación con metformina, JANUVIA produjo mejorías significativas en HbA1C, FPG y PGG a las dos horas en comparación con placebo más metformina (tabla 4). Comparado con placebo, la mejoría de la HbA1C no fue afectada por su valor basal, el tratamiento hipoglucemiante anterior, el sexo, la edad, el IMC basal, el tiempo transcurrido desde que se diagnosticó la diabetes, la presencia de síndrome metabólico o los índices estándares de resistencia a la insulina (HOMA-IR) o de secreción de insulina (HOMA-β). Comparado con los pacientes que tomaron placebo, los pacientes que recibieron JANUVIA presentaron ligeras disminuciones en colesterol total, colesterol no HDL y en los triglicéridos. En ambos grupo de tratamiento se obtuvieron disminuciones similares en el peso corporal.
Tabla 4
Parámetros glucémicos y peso corporal en la última visita (estudio de 24 semanas) con JANUVIA en el tratamiento combinado de adición a metformina†
|
JANUVIA 100 mg + metformina |
Placebo + metformina |
|
|
HbA1c (%) |
N = 453 |
N = 224 |
|
Basal (promedio) |
7.96 |
8.03 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.67 |
-0.02 |
|
Diferencia con placebo + metformina (promedio ajustado‡) |
-0.65§ |
|
|
Pacientes (%) que lograron HbA1c <7% |
213 (47.0) |
41 (18.3) |
|
FPG (mg/dL) |
N = 454 |
N = 226 |
|
Basal (promedio) |
170.0 |
173.5 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-16.9 |
8.5 |
|
Diferencia con placebo + metformina (promedio ajustado‡) |
-25.4§ |
|
|
PPG a 2 horas (mg/dL) |
N = 387 |
N = 182 |
|
Basal (promedio) |
274.5 |
272.4 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-62.0 |
-11.4 |
|
Diferencia con placebo + metformina (promedio ajustado‡) |
-50.6§ |
|
|
Peso corporal (kg)* |
N = 399 |
N = 169 |
|
Basal (promedio) |
86.9 |
87.6 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.7 |
-0.6 |
|
Diferencia con placebo + metformina (promedio ajustado‡) |
-0.1¶ |
† Población de todos los pacientes tratados (análisis por intención de tratar).
‡ Promedios de los cuadrados mínimos ajustados según el tratamiento hipoglucemiante anterior y el valor basal.
§ p<0.001 comparado con placebo + metformina.
* Todos los pacientes tratados, excluyendo los que recibieron tratamiento glucémico de rescate.
¶ No estadísticamente significativo (p≥0.05) comparado con placebo.
Estudio Controlado con Activo con Metformina
La eficacia de JANUVIA comparado con la de metformina se evaluó en un estudio de 24 semanas, doble ciego, controlado con metformina, en pacientes con diabetes tipo 2 y control glucémico inadecuado con dieta y ejercicio, y que no tenían un tratamiento hipoglucemiante (sin tratamiento durante al menos 4 meses). En este estudio, se aleatorizó a los pacientes para recibir ya sea 100 mg diarios de JANUVIA (N=528) o metformina (N=522) durante 24 semanas. Los pacientes que recibieron metformina se les dio una dosis inicial de 500 mg/día y entonces el investigador los tituló hasta una dosis de 1,500 a 2,000 mg/día durante un periodo de hasta 5 semanas, basado en la tolerabilidad. La dosis promedio de metformina después del periodo de titulación fue de aproximadamente 1,900 mg/día. Los puntos finales glucémicos incluyeron HbA1c y glucosa en ayuno.
Ambos tratamientos resultaron en una mejoría estadísticamente significativa en el control glucémico desde el nivel basal. El valor basal promedio de Hba1c fue de 7.2% en la población según el protocolo. A las 24 semanas, la reducción desde el valor basal en HbA1c fue de -0.43% para JANUVIA 100 mg diarios y de -0.57% para metformina. La diferencia cumplió los criterios preespecificados para confirmar la eficacia comparable de los dos agentes. En un análisis preespecificado de subgrupos, pacientes con HbA1c basal ≥8% también tuvieron reducciones similares en ambos grupos (JANUVIA, -1.13%, metformina, -1.24%).
La reducción en FPG fue de -11.5 mg/dL para JANUVIA y de -19.4 mg/dL para metformina. Los índices estándar de resistencia a la insulina (HOMA-IR) y de secreción de insulina (HOMA-β) mostraron una mejoría similar en ambos grupos. La incidencia global de reacciones adversas gastrointestinales en pacientes tratados con JANUVIA fue de 11.6%, comparado con 20.7% en pacientes tratados con metformina. La incidencia de experiencias adversas gastrointestinales seleccionadas fue: diarrea (JANUVIA, 3.6%; metformina, 10.9%), náusea (1.1%, 3.1%), dolor abdominal (2.1%, 3.8%) y vómito (0.4%, 1.3%). La incidencia de hipoglucemia no fue significativamente diferente entre los grupos de tratamiento (JANUVIA, 1.7%; metformina, 3.4%). El peso corporal disminuyó desde el nivel basal en ambos grupos de tratamiento (JANUVIA, -0.6 kg; metformina -1.9 kg).
Estudio controlado con activo con Glipizida
El efecto del tratamiento de mantenimiento a largo plazo se evaluó en un estudio de 52 semanas, doble ciego, controlado con glipizida en pacientes con diabetes tipo 2 con control glucémico inadecuado con metformina sola ≥1,500 mg/día. En este estudio los pacientes fueron aleatorizados a la adición de JANUVIA 100 mg diarios (N=588) o glipizida (N=584) por 52 semanas. Los pacientes que recibieron glipizida iniciaron con una dosis de 5 mg al día y después se les ajustó la dosis a criterio del investigador hasta alcanzar una FPG objetivo de <110 mg/dL, sin hipoglucemia significativa durante las siguientes 18 semanas. Como dosis máxima se permitió una dosificación de 20 mg al día para optimizar el control glucémico. Posteriormente, la dosis de glipizida debía mantenerse constante. La dosis promedio de glipizida después del periodo de titulación de 10.3 mg.
Ambos tratamientos resultaron en una mejoría estadísticamente significativa en el control de la glucemia respecto al nivel basal. Después de 52 semanas, la reducción en HbA1c respecto al inicio fue -0.67% con JANUVIA 100 mg diarios y -0.67% con glipizida, lo cual confirmó una eficacia comparable de estos dos medicamentos. La reducción en FPG fue de -10.0 mg/dL con JANUVIA y -7.5 mg/dL con glipizida. En un análisis post hoc, los pacientes con una HbA1c basal mayor (≥9%) en ambos grupos, tuvieron mayores reducciones respecto al inicio en HbA1c (JANUVIA, 1.68%; glipizida, 1.76%). En este estudio, la relación proinsulina a insulina, un marcador de la eficiencia en la síntesis y liberación de insulina, mejoró con JANUVIA y se deterioró con el tratamiento con glipizida. La incidencia de hipoglucemia en el grupo tratado con JANUVIA (4.9%) fue significativamente menor que con el grupo con glipizida (32.0%). Los pacientes tratados con JANUVIA presentaron una pérdida de peso corporal promedio significativa comparado con un aumento de peso significativo en los pacientes a quienes se les administró glipizida (-1.5 kg vs. +1.1 kg).
Tratamiento inicial combinado con Pioglitazona
Un total de 520 pacientes con diabetes tipo 2 y con control glucémico inadecuado con dieta y ejercicio participaron en un estudio de 24 semanas, aleatorizado, doble ciego, diseñado para evaluar la eficacia de JANUVIA como tratamiento inicial en combinación con pioglitazona. Se aleatorizó un número aproximadamente igual de pacientes para recibir tratamiento combinado inicial con JANUVIA 100 mg y pioglitazona 30 mg una vez al día o monoterapia con pioglitazona 30 mg una vez al día.
El tratamiento inicial con la combinación de JANUVIA y pioglitazona proporcionó mejorías significativas en HbA1c, FPG y PPG a las 2 horas en comparación con la monoterapia con pioglitazona (tabla 5). En un análisis predefinido de subgrupos, los pacientes con HbA1c basal de ≥10% tuvieron reducciones de la HbA1c de -3.00% en el grupo que recibió JANUVIA con pioglitazona y de -2.06% en el grupo que recibió pioglitazona sola. En los pacientes con HbA1c basal de <10% las reducciones fueron -1.99% y -1.14% en ambos grupos, respectivamente. La mejoría en HbA1c en general fue consistente entre los subgrupos definidos por sexo, edad, raza, IMC basal o duración de la enfermedad. Los índices estándar de resistencia a la insulina (HOMA-IR) y de sensibilidad a la insulina (QUICKI) mostraron mejorías similares en ambos grupos. La mejoría en la medición de la función post-prandial de las células beta fue mayor con la administración concomitante de JANUVIA y pioglitazona que con pioglitazona sola. Los pacientes con JANUVIA con pioglitazona tuvieron un modesto incremento del peso corporal en comparación con pioglitazona sola. Los cambios en los parámetros de lípidos se resumen en la Tabla 6.
Tabla 5
Parámetros glucémicos y peso corporal en la Visita Final (Estudio de 24 semanas) para JANUVIA en combinación con pioglitazona como tratamiento inicial†
|
JANUVIA 100 mg + Pioglitazona |
Pioglitazona |
|
|
HbA1c (%) |
N = 251 |
N = 246 |
|
Basal (promedio) |
9.50 |
9.44 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-2.38 |
-1.49 |
|
Diferencia con pioglitazona (promedio ajustado‡) |
-0.89§ |
|
|
Pacientes (%) que alcanzó A1C <7% |
151 (60%) |
68 (28%) |
|
FPG (mg/dL) |
N = 256 |
N = 253 |
|
Basal (promedio) |
203.3 |
200.7 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-63.0 |
-40.2 |
|
Diferencia con pioglitazona (promedio ajustado‡) |
-22.8§ |
|
|
PPG de 2 horas (mg/dL) |
N = 216 |
N = 211 |
|
Basal (promedio) |
282.7 |
284.1 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-113.6 |
-68.9 |
|
Diferencia con pioglitazona (promedio ajustado‡) |
-44.7§ |
|
|
Peso corporal (kg)% |
N = 232 |
N = 218 |
|
Basal (promedio) |
80.4 |
80.7 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
3.0 |
1.9 |
|
Diferencia con pioglitazona (promedio ajustado‡) |
1.1¶ |
† Población de todos los pacientes tratados (análisis de intención de tratar).
‡ Promedio de cuadrados mínimos ajustados al valor basal.
§ p<0.001 comparado con pioglitazona.
% Todos los pacientes como población tratada.
¶ p<0.01 comparado con pioglitazona.
Tabla 6
Parámetros de lípidos al final de la visita (semana 24 del estudio) para JANUVIA en combinación con pioglitazona como tratamiento inicial†
|
JANUVIA 100 mg + Pioglitazona |
Pioglitazona |
|
|
Triglicéridos (mg/dL) |
N = 237 |
N = 231 |
|
Basal (mediana) |
165.0 |
163.0 |
|
Porcentaje de cambio respecto al valor basal (mediana %) (95% IC) |
-19.9 (-24.8, -15.1) |
-12.0 (-17.5, -6.6) |
|
Diferencia con pioglitazona (mediana %) |
-7.6‡ |
|
|
C-HDL (mg/dL) |
N = 236 |
N = 231 |
|
Basal (promedio) |
42.5 |
43.0 |
|
Porcentaje de cambio respecto al valor basal (promedio ajustado %§) (95% IC) |
11.3 (8.6, 13.9) |
12.1 (9.5, 14.8) |
|
Diferencia con pioglitazona (promedio ajustado %§) |
-0.8% |
|
|
C-LDL (mg/dL) |
N = 217 |
N = 217 |
|
Basal (promedio) |
127.0 |
129.1 |
|
Porcentaje de cambio respecto al valor basal (promedio ajustado %§) (95% IC) |
2.8 (-1.4, 7.0) |
3.1 (-1.1, 7.3) |
|
Diferencia con pioglitazona (promedio ajustado %§) |
-0.3% |
|
|
Colesterol total (mg/dl) |
N = 237 |
N = 231 |
|
Basal (promedio) |
207.2 |
208.6 |
|
Porcentaje de cambio respecto al valor basal (promedio ajustado %§) (95% IC) |
-0.2 (-2.3, 2.0) |
1.6 (-0.6, 3.7) |
|
Diferencia con pioglitazona (promedio ajustado %§) |
-1.7% |
† Población de todos los pacientes tratados (análisis de intención de tratar).
‡ p<0.05 comparado con pioglitazona.
§ Promedio de cuadrados mínimos ajustados al valor basal.
% No estadísticamente significativo (p≥0.05) comparado con pioglitazona.
Tratamiento combinado de adición a pioglitazona
Un total de 353 pacientes con diabetes tipo 2 participó en un estudio de 24 semanas con aleotorización, doble ciego y controlado con placebo, para evaluar la eficacia de JANUVIA en combinación con pioglitazona. Todos los pacientes iniciaron monoterapia con pioglitazona a dosis de 30-45 mg diarios, y después se les aleatorizó para añadirles 100 mg de JANUVIA o un placebo una vez al día. Los puntos finales glucémicos medidos incluyeron HbA1C y glucemia en ayunas.
En combinación con pioglitazona, JANUVIA mejoró significativamente la HbA1C y la FPG en comparación con placebo más pioglitazona (tabla 7). Comparado con placebo, la mejoría en HbA1C no fue afectada por su valor basal, el tratamiento hipoglucemiante anterior, el sexo, la edad, el IMC basal, el tiempo transcurrido desde que se diagnosticó la diabetes, la presencia de síndrome metabólico o los índices estándares de resistencia a la insulina (HOMA-IR) o de secreción de insulina (HOMA-β). Comparado con los pacientes que tomaron placebo, los pacientes que tomaron JANUVIA presentaron ligeras disminuciones en los triglicéridos. No hubo diferencia significativa entre placebo y JANUVIA en el peso corporal.
Tabla 7
Parámetros glucémicos y peso corporal en la última visita (estudio de 24 semanas) con JANUVIA en el tratamiento combinado de adición a pioglitazona†
|
JANUVIA 100 mg + pioglitazona |
Placebo + pioglitazona |
|
|
HbA1c (%) |
N = 163 |
N = 174 |
|
Basal (promedio) |
8.05 |
8.00 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-0.85 |
-0.15 |
|
Diferencia con placebo + pioglitazona (promedio ajustado‡) |
-0.70§ |
|
|
Pacientes (%) que lograron HbA1c <7% |
74 (45.4) |
40 (23.0) |
|
FPG (mg/dL) |
N = 163 |
N = 174 |
|
Basal (promedio) |
168.3 |
165.6 |
|
Cambio desde el valor basal (promedio ajustado‡) |
-16.7 |
1.0 |
|
Diferencia con placebo + pioglitazona (promedio ajustado‡) |
-17.7§ |
|
|
Peso corporal (kg)* |
N = 133 |
N = 136 |
|
Basal (promedio) |
90.0 |
85.6 |
|
Cambio (promedio ajustado‡) |
1.8 |
1.5 |
|
Diferencia con placebo + pioglitazona (promedio ajustado‡) |
0.2¶ |
† Todos los pacientes tratados (análisis según el tratamiento intentado).
‡ Promedios de los cuadrados mínimos ajustados según el tratamiento hipoglucemiante anterior y el valor basal.
§ p<0.001 en la comparación con placebo + pioglitazona.
* Todos los pacientes tratados, excluyendo datos posteriores al tratamiento glucémico de rescate.
¶ No estadísticamente significativo (p≥0.05) comparado con placebo + pioglitazona.
Tratamiento combinado de adición a glimepirida o glimepirida más metformina
Un total de 441 pacientes con diabetes tipo 2 participaron en un estudio de 24 semanas, aleatorizado, doble ciego, controlado con placebo, que se diseñó para evaluar la eficacia de JANUVIA en combinación con glimepirida (≥4 mg diarios) o glimepirida con metformina (≥1,500 mg diarios). Los pacientes fueron aleatorizados a recibir 100 mg de JANUVIA o placebo, administrados una vez al día. Los puntos finales de glucemia incluyeron HbA1c y glucosa en ayunas.
En combinación con glimepirida o con glimepirida más metformina, JANUVIA produjo mejorías significativas en HbA1c y FPG comparado con placebo (Tabla 8). En toda la población del estudio (tanto los pacientes con glimepirida, como los pacientes con glimepirida con metformina), se observó una reducción respecto al inicio en HbA1c (-0.74%) y en FPG (-20.1 mg/dL), con relación a placebo. Comparado con placebo, la mejoría en HbA1c fue generalmente consistente en los subgrupos definidos por sexo, edad, raza, IMC basal, duración de la diabetes desde el diagnóstico, presencia de síndrome metabólico, o índices estándar de resistencia a la insulina (HOMA-IR) o de secreción de insulina (HOMA-β). Los pacientes tratados con JANUVIA tuvieron un modesto incremento en el peso corporal respecto a quienes recibieron placebo.
Tabla 8
Parámetros glucémicos y peso corporal en la última visita (semana 24) con JANUVIA en el tratamiento combinado de
adición a glimepirida o glimepirida más metformina†
|
JANUVIA 100 mg + Glimepirida |
Placebo + Glimepirida |
JANUVIA 100 mg + Glimepirida + Metformina |
Placebo + Glimepirida + Metformina |
|
|
HbA1c (%) |
N = 102 |
N = 103 |
N = 115 |
N = 105 |
|
Basal (promedio) |
8.41 |
8.46 |
8.27 |
8.28 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.30 |
0.27 |
-0.59 |
0.30 |
|
Diferencia vs. placebo (promedio ajustado‡) |
-0.57§ |
-0.89§ |
||
|
Pacientes (%) que lograron la meta de HbA1c <7% |
11 (10.8) |
9 (8.7) |
26 (22.6) |
1 (1.0) |
|
FPG (mg/dL) |
N = 104 |
N = 104 |
N = 115 |
N = 109 |
|
Basal (promedio) |
183.5 |
184.6 |
179.3 |
178.9 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.9 |
18.4 |
-7.8 |
12.9 |
|
Diferencia vs. placebo (promedio ajustado‡) |
-19.3¶ |
-20.7§ |
||
|
Peso corporal(kg)% |
N = 76 |
N = 73 |
N = 102 |
N = 74 |
|
Basal (promedio) |
85.7 |
81.5 |
86.5 |
84.6 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
1.1 |
0.0 |
0.4 |
-0.7 |
|
Diferencia vs. placebo (promedio ajustado‡) |
1.1# |
1.1†† |
† Todos los pacientes tratados (análisis según el tratamiento intentado).
‡ Promedios de los cuadrados mínimos ajustados según el tratamiento hipoglucemiante anterior y el valor basal.
§ p<0.001 comparado con placebo.
% Todos los pacientes tratados APa 1. por las siglas en inglés para AII Patients as treated), excluyendo datos posteriores al tratamiento glucémico de rescate.
¶ p=0.003 comparado con placebo.
# p=0.016 comparado con placebo.
†† p=0.007 comparado con placebo.
Tratamiento combinado de adición a metformina más Rosiglitazona
Un total de 262 pacientes con diabetes tipo 2 participaron en un estudio controlado con placebo, de 54 semanas, doble ciego, aleatorizado, diseñado para evaluar la eficacia de JANUVIA en combinación con metformina y rosiglitazona. Pacientes con control glucémico inadecuado con un esquema estable de metformina (≥1,500 mg diarios) y rosiglitazona (≥4 mg diarios) fueron aleatorizados a la adición de JANUVIA 100 mg o de placebo administrados una vez al día. Los parámetros glucémicos fueron evaluados en el primer punto en el tiempo de la Semana 18 y a la Semana 54.
En combinación con metformina y rosiglitazona, JANUVIA brindó mejorías significativas en HbA1c, FPG y PPG a las 2 horas en comparación a placebo con metformina y rosiglitazona (Tabla 9, Figura 2) a la Semana 18, con mejorías sostenidas hasta el final del estudio. Los efectos en los lípidos fueron generalmente neutrales. No hubo diferencias significativas entre JANUVIA y placebo en el cambio en el peso corporal.
Tabla 9
Parámetros glucémicos y peso corporal en las semanas 18 y 54 (visita final)
para JANUVIA en tratamiento combinado de adición a metformina y rosiglitazona†
|
Semana 18 |
Semana 54 |
|||
|
JANUVIA 100 mg + Metformina + Rosiglitazona |
Placebo + Metformina + Rosiglitazona |
JANUVIA 100 mg + Metformina + Rosiglitazona |
Placebo + Metformina + Rosiglitazona |
|
|
HbA1c (%) |
N = 168 |
N = 88 |
N = 168 |
N = 88 |
|
Basal (promedio) |
8.81 |
8.73 |
8.81 |
8.73 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-1.03 |
-0.31 |
-1.05 |
-0.28 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
-0.72§ |
-0.77§ |
||
|
Pacientes (%) que lograron A1C <7% |
37 (22%) |
8 (9%) |
44 (26%) |
12 (14%) |
|
FPG (mg/dL) |
N = 169 |
N = 89 |
N = 169 |
N = 89 |
|
Basal (promedio) |
182.1 |
183.5 |
182.1 |
183.5 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-30.7 |
-11.7 |
-28.0 |
-10.7 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
-19.0§ |
-17.4§ |
||
|
PPG 2 horas (mg/dL) |
N = 142 |
N = 75 |
N = 147 |
N = 77 |
|
Basal (promedio) |
257.8 |
249.5 |
256.6 |
247.7 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-59.9 |
-22.0 |
-50.7 |
-16.6 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
-37.9§ |
-34.1§ |
||
|
Peso corporal (kg)% |
N = 157 |
N = 79 |
N = 115 |
N = 40 |
|
Basal (promedio) |
82.1 |
87.0 |
82.0 |
85.6 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.5 |
0.2 |
1.9 |
1.3 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
0.3¶ |
0.6¶ |
||
† Población de todos los pacientes tratados (análisis de intención de tratar).
‡ Promedio de cuadrados mínimos ajustado según el tratamiento hipoglucemiante anterior y el valor basal.
§ p<0.001 comparado con placebo + metformina + rosiglitazona.
% Todos los pacientes tratados (APaT, por las siglas en inglés para AII Patients as Treated), excluyendo datos posteriores al tratamiento glucémico de rescate.
¶ Sin diferencia estadística significativa (p≥0.05) comparado con placebo + metformina + rosiglitazona.
Figura 2: Cambio promedio en HbA1c (%) respecto al inicio durante 54 semanas en un estudio de adición de JANUVIA al tratamiento de pacientes controlados inadecuadamente con metformina y rosiglitazona†
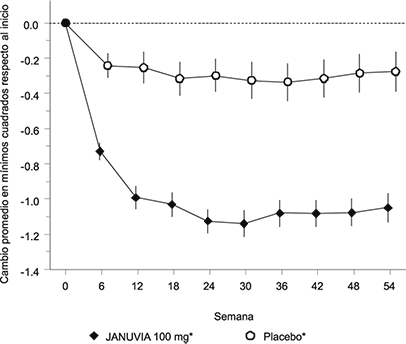
† Población de todos los pacientes tratados; Promedio de cuadrados mínimos ajustado según el tratamiento hipoglucemiante anterior y el valor basal (error barras = error estándar).
* Adición al tratamiento en curso con metformina y rosiglitazona.
Tratamiento combinado de adición con insulina (con o sin metformina)
Un total de 641 pacientes con diabetes tipo 2 participaron en un estudio controlado con placebo, doble ciego, aleatorizado, de 24 semanas, diseñado para evaluar la eficacia de JANUVIA como tratamiento combinado de adición al tratamiento con una dosis estable de insulina (con o sin metformina). Pacientes con insulina premezclada, de acción larga o de acción intermedia, con o sin metformina (≥1,500 mg al día), fueron aleatorizados para que se les añadiera JANUVIA 100 mg o placebo administrados una vez al día. Los puntos finales glucémicos incluyeron HbA1c, glucosa en ayunas y glucosa postprandial de 2 horas.
En combinación con insulina (con o sin metformina), JANUVIA proporcionó mejorías significativas en HbA1c, FPG y PPG a las 2 horas comparado con placebo (Tabla 10). La mejoría en HbA1c comparado con placebo fue generalmente consistente entre los subgrupos definidos por sexo, edad, raza, IMC basal, duración desde el diagnóstico de diabetes, presencia de síndrome metabólico, e índices estándar de resistencia la insulina (HOMA-IR) y de secreción de insulina (HOMA-β). No hubo diferencias significativas entre JANUVIA y placebo respecto a cambio en el peso corporal.
Tabla 10
Parámetros glucémicos y peso corporal al final de la visita (semana 24 del estudio) para JANUVIA en tratamiento combinado de adición con una dosis estable de insulina con o sin metformina†
|
JANUVIA 100 mg + Insulina (+/- Metformina) |
Placebo + Insulina (+/- Metformina) |
|
|
HbA1c (%) |
N = 305 |
N = 312 |
|
Basal (promedio) |
8.72 |
8.64 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.59 |
-0.03 |
|
Diferencia vs. placebo (promedio ajustado‡,§) |
-0.56% |
|
|
Pacientes (%) que lograron la meta HbA1c <7% |
39 (12.8) |
16 (5.1) |
|
FPG (mg/dL) |
N = 310 |
N = 313 |
|
Basal (promedio) |
175.8 |
179.1 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-18.5 |
-3.5 |
|
Diferencia vs. placebo (promedio ajustado‡) |
-15.0% |
|
|
PPG de 2 horas (mg/dL) |
N = 240 |
N = 257 |
|
Basal (promedio) |
290.9 |
292.1 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-30.9 |
5.2 |
|
Diferencia vs. placebo (promedio ajustado‡) |
-36.1% |
|
|
Peso corporal (kg)¶ |
N = 266 |
N = 266 |
|
Basal (promedio) |
86.6 |
87.4 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.1 |
0.1 |
|
Diferencia vs. placebo (promedio ajustado‡) |
0.0# |
† Población de todos los pacientes tratados (análisis de intención de tratar).
‡ Promedio de cuadrados mínimos ajustado a uso de metformina en la Visita 1 (sí/no), insulina usada en la Visita 1 (premezclada vs. no premezclada [acción intermedia o larga]), y valor basal.
§ El tratamiento por interacción de estratos no fue significativo (p>0.10) para el estrato metformina y para el estrato insulina.
% p<0.001 comparado con placebo.
¶ Todos los pacientes tratados (APaT, por las siglas en inglés para AII Patients as Treated), excluyendo datos posteriores al tratamiento glucémico de rescate.
# Sin diferencia estadística significativa (p≥0.05) comparado con placebo.
En otro estudio de 24 semanas aleatorizado, doble ciego, controlado con placebo, diseñado para evaluar la eficacia de JANUVIA añadida a la insulina, como terapia combinada, 660 pacientes con control glucémico inadecuado usando insulina glargina con o sin metformina (≥1,500 mg al día) fueron aleatorizados a la adición ya sea de 100 mg de JANUVIA (N=330) o placebo (N=330), administrados una vez al día mientras experimentaban intensificación de la terapia con insulina. El valor inicial de HbA1c era 8.74% y la dosis inicial de JANUVIA era 37 UI/día. Los pacientes recibieron instrucciones para calibrar su dosis de insulina glargina con base en los valores obtenidos de glucosa en ayuno con pruebas de punción digital. Los puntos finales glucémicos medidos incluyeron HbA1c y FPG.
En la Semana 24, el aumento en la dosis diaria de insulina fue 20% menor en los pacientes tratados con JANUVIA (19 UI/día) que en los pacientes tratados con placebo (24 UI/día). La diferencia en la dosis de insulina (-5 UI/día) fue estadísticamente significativa (p=0.009). La reducción de HbA1c para pacientes tratados con JANUVIA e insulina (con o sin metformina) fue -1.31% comparado con -0.87% para pacientes tratados con placebo e insulina (con o sin metformina) una diferencia de -0.45% [95% de intervalo de confianza [CI, por las siglas en inglés para Confidence lnterval]:-0.60, -0.29]. La reducción de FPG para pacientes tratados con JANUVIA e insulina (con o sin metformina) fue -55.5 mg/dL comparada con -44.8 mg/dL para pacientes tratados con placebo, e insulina (con o sin metformina), una diferencia de -10.7 mg/dL [95% CI: -17.2, -4.3]. La incidencia de hipoglucemia fue 25.2% para pacientes tratados con JANUVIA e insulina (con o sin metformina) y 36.8% para pacientes tratados con placebo e insulina (con o sin metformina). La diferencia en la incidencia de hipoglucemia (-11.6%) fue estadísticamente significativa (p<0.001).
Estudio de Seguridad Cardiovascular TECOS
El Estudio de Evaluación de Desenlaces Cardiovasculares (TECOS, por las siglas en inglés para Trial Evaluating Cardiovascular Outcomes with Sitagliptin) fue un estudio aleatorizado en 14,671 pacientes en la población con intención de tratar con una HbA1c de ≥6.5 a 8.0% con enfermedad cardiovascular (CV) establecida, que recibieron sitagliptina (7,332), 100 mg diarios (o 50 mg diarios si la eGER basal era ≥30 y <50 mL/min/1.73 m2) o placebo (7,339) añadidos al cuidado usual, apuntando a estándares regionales para HbA1c y factores de riesgo CV. No se incluyeron en el estudio pacientes con una eGFR <30 mL/min/1.73 m2. La población de estudio incluyó a 2,004 pacientes ≥75 años de edad y 3,324 pacientes con insuficiencia renal (eGFR <60 mL/min/1.73 m2).
Durante el curso del estudio, la diferencia promedio global estimada (SD) en HbA1c entre los grupos sitagliptina y placebo fue de 0.29% (0.01), 95% IC (-0.32, -0.27); p<0.001. Los pacientes en el grupo sitagliptina recibieron menos agentes hipoglucemiantes que los del grupo placebo (razón de riesgo 0.72, 95% CI, 0.68 a 0.77; p≤0.001) y, entre los pacientes sin insulina a la entrada al estudio, hubo menor probabilidad de iniciar tratamiento crónico con insulina (razón de riesgo 0.70, 95% CI, 0.63 a 0.79; p<0.001).
El punto final cardiovascular primario fue una composición de la primera ocurrencia de muerte cardiovascular, infarto al miocardio no fatal, apoplejía no fatal, u hospitalización por angina inestable. Los puntos finales cardiovasculares secundarios incluyeron la primera ocurrencia de muerte cardiovascular, infarto al miocardio no fatal, o apoplejía no fatal, la primera ocurrencia de los componentes individuales de composición primaria; mortalidad por cualquier causa y admisiones hospitalarias por insuficiencia cardíaca congestiva.
Después de un seguimiento mediano de hasta 3 años, añadir JANUVIA al cuidado usual, no incrementó el riesgo de eventos adversos cardiovasculares mayores, o el riesgo de hospitalización por insuficiencia cardíaca, comparado con el cuidado usual sin JANUVIA en pacientes con diabetes tipo 2 (Tabla 11).
Tabla 11
Tasas de Desenlaces Cardiovasculares Compuestos y Desenlaces Secundarios Clave
|
Sitagliptina 100 mg |
Placebo |
Razón de Riesgo (95% CI) |
Valor de p† |
|||
|
N (%) |
Tasa de Incidencia por 100 Pacientes-Años* |
N (%) |
Tasa de Incidencia por 100 Pacientes-Años* |
|||
|
Análisis en la Población por Protocolo |
||||||
|
Número de Pacientes |
7,257 |
7,266 |
0.98 (0.88-1.09) |
<0.001 |
||
|
Punto Final Primario Compuesto (Muerte cardiovascular, infarto al miocardio no fatal, apoplejía no fatal, u hospitalización por angina inestable) |
695 (9.6) |
3.7 |
695 (9.6) |
3.8 |
||
|
Punto Final Secundario Compuesto (Muerte cardiovascular, infarto al miocardio no fatal, o apoplejía no fatal) |
609 (8.4) |
3.2 |
602 (8.3) |
3.3 |
0.99 (0.89-1.11) |
<0.001 |
|
Análisis en la Población de Intención de Tratar |
||||||
|
Número de Pacientes |
7,332 |
7,339 |
0.98 (0.89-1.08) |
<0.001 |
||
|
Punto Final Primario Compuesto (Muerte cardiovascular, infarto al miocarido no fatal, apoplejía no fatal, u hospitalización por angina inestable) |
839 (11.4) |
4.1 |
851 (11.6) |
4.2 |
||
|
Punto Final Secundario Compuesto (Muerte cardiovascular, infarto al miocardio no fatal, o apoplejía no fatal) |
745 (10.2) |
3.6 |
746 (10.2) |
3.6 |
0.99 (0.89-1.10) |
<0.001 |
|
Desenlace Secundario |
||||||
|
Muerte cardiovascular |
380 (5.2) |
1.7 |
366 (5.0) |
1.7 |
1.03 (0.89-1.19) |
0.711 |
|
Todos los infartos al miocardio (fatales y no fatales) |
300 (4.1) |
1.4 |
316 (4.3) |
1.5 |
0.95 (0.81-1.11) |
0.487 |
|
Todas las apoplejías (fatales y no fatales) |
178 (2.4) |
0.8 |
183 (2.5) |
0.9 |
0.97 (0.79-1.19) |
0.760 |
|
Hospitalización por angina inestable |
116 (1.6) |
0.5 |
129 (1.8) |
0.6 |
0.90 (0.70-1.16) |
0.419 |
|
Muerte por cualquier causa |
547 (7.5) |
2.5 |
537 (7.3) |
2.5 |
1.01 (0.90-1.14) |
0.875 |
|
Hospitalización por insuficiencia cardíaca‡ |
228 (3.1) |
1.1 |
229 (3.1) |
1.1 |
1.00 (0.83-1.20) |
0.983 |
* Tasa de incidencia por 100 pacientes-años calculada como 100 × (número total de pacientes con ≥1 evento durante el periodo de exposición elegible por total de pacientes-años de seguimiento).
† Basado en un modelo estratificado de Cox por región. Para puntos finales compuestos, el valor de p corresponde a una prueba de no inferioridad que buscó mostrar que la razón de riesgo es menor de 1.3. Para los demás puntos finales, los valores de p corresponden a una prueba de diferencias en las razones de riesgo.
‡ El análisis de hospitalización por insuficiencia cardíaca se ajustó por antecedentes de insuficiencia cardíaca a nivel basal.
JANUVIA en pacientes pediátricos con diabetes tipo 2 y control glucémico inadecuado
Se realizó un estudio doble ciego de 54 semanas para evaluar la eficacia y seguridad de JANUVIA 100 mg una vez al día en pacientes pediátricos (de 10 a 17 años de edad) con diabetes tipo 2, diabético que no recibieron terapia hipoglucemiante durante al menos 12 semanas (con HbA1c del 6% al 10%) o que recibieron una dosis estable de insulina durante al menos 12 semanas (con HbA1c del 7% al 10%). Los pacientes fueron aleatorizados para recibir JANUVIA 100 mg o placebo una vez al día durante 20 semanas.
La HbA1c basal media fue del 7,5%. El tratamiento con JANUVIA 100 mg no proprcionó una mejoría significativa en la HbA1c, a las 20 semanas. La reducción de HbA1c en los pacientes tratados con JANUVIA (N = 95) fue del 0.0% en comparación con el 0.2% en los pacientes tratados con placebo (N = 95), una diferencia de -0.2% (95% CI: -0,7, 0,3).
VI. CONTRAINDICACIONES
JANUVIA está contraindicado en pacientes hipersensibles a cualquiera de sus componentes (Ver PRECAUCIONES GENERALES, Reacciones de hipersensibilidad y REACCIONES SECUNDARIAS Y ADVERSAS, Experiencia posterior a la comercialización).
VII. PRECAUCIONES GENERALES
General
No se debe usar JANUVIA en pacientes con diabetes tipo 1 ni para tratar la cetoacidosis diabética.
Pancreatitis: Ha habido reportes de pancreatitis aguda, incluyendo pancreatitis necrotizante o hemorrágica fatal y no fatal (ver REACCIONES SECUNDARIAS Y ADVERSAS), en pacientes que toman sitagliptina. Se debe advertir a los pacientes sobre los síntomas característicos de la pancreatitis aguda: dolor abdominal persistente y severo. Se ha observado resolución de la pancreatitis tras la suspensión de sitagliptina. Si se sospecha pancreatitis, se debe descontinuar JANUVIA o cualquier otro medicamento que se sospeche pueda causarla.
Uso en pacientes con insuficiencia renal: JANUVIA se excreta por vía renal. En pacientes con eGFR < 45 mL/min/1.73 m2 y en pacientes con ESRD que requieren hemodiálisis o diálisis peritoneal, se recomienda dosis menores para lograr concentraciones plasmáticas de JANUVIA similares a las de los pacientes con función renal normal. (Ver Dosis y Vía de Administración, Pacientes con insuficiencia renal).
Hipoglucemia en combinación con una sulfonilurea o con insulina: En estudios clínicos de JANUVIA como monoterapia y como parte del tratamiento combinado con medicamentos que suelen causar hipoglucemia (p. ej. metformina o un agonista del PPARℽ [tiazolidinediona]), las tasas de hipoglucemia reportadas con JANUVIA fueron similares a las observadas en los pacientes que recibieron placebo. Como es típico con otros medicamentos hipoglucemiantes, se ha observado hipoglucemia en pacientes que son tratados con JANUVIA en combinación con sitagliptina y metformina con insulina o una sulfonilurea (ver REACCIONES SECUNDARIAS Y ADVERSAS). Por ello, para reducir el riesgo de hipoglucemia inducida por sulfonilureas o por insulina, se debe considerar una dosis menor de la sulfonilurea o de la insulina (ver DOSIS Y VÍA DE ADMINISTRACIÓN).
Reacciones de hipersensibilidad: Ha habido reportes posteriores a la comercialización de reacciones graves de hipersensibilidad en pacientes tratados con JANUVIA. Estas reacciones incluyen anafilaxis, angioedema y condiciones cutáneas exfoliativas, incluyendo síndrome de Stevens-Johnson. Como estas reacciones son reportadas voluntariamente por una población de tamaño desconocido, generalmente no es posible evaluar con certidumbre su frecuencia o establecer la relación causal con el medicamento. El inicio de estas reacciones ocurrió durante los tres primeros meses de tratamiento con JANUVIA, con algunos reportes ocurridos después de la primera dosis. Si se sospecha alguna reacción de hipersensibilidad, descontinúe JANUVIA, evalúe otras posibles causas del evento e instituya una alternativa de tratamiento para la diabetes. (Ver CONTRAINDICACIONES y REACCIONES ADVERSAS, Experiencia posterior a la comercialización).
Penfigoide ampolloso: En contexto posterior a la comercialización se han reportado casos de penfigoide ampolloso que requirieron hospitalización con el uso de inhibidores de la DPP-4. En estos casos reportados, los pacientes típicamente se recuperaron con tratamiento inmunosupresor tópico o sistémico y suspendiendo el tratamiento con el inhibidor de la DPP-4. Pida a sus pacientes reportar la aparición de ampollas o erosiones cuando estén bajo tratamiento con JANUVIA. En caso de sospecha de penfigoide ampolloso se debe suspender el tratamiento con JANUVIA y se debe considerar referir al paciente con el dermatólogo para diagnóstico y tratamiento apropiado.
Empleo en niños
Se realizó un estudio doble ciego de 54 semanas para evaluar la eficacia y seguridad de JANUVIA en pacientes pediátricos (de 10 a 17 años de edad) con diabetes tipo 2 que no estaban en tratamiento hipoglucémico durante al menos 12 semanas o una dosis estable de insulina durante al menos 12 semanas. Los pacientes fueron aleatorizados y tratados con JANUVIA 100 mg (N = 95) o placebo (N = 95) una vez al día durante 20 semanas.
El tratamiento con JANUVIA 100 mg no proporcionó una mejora significativa en la HbA1c a las 20 semanas.
En pacientes pediátricos de 10 a 17 años con diabetes tipo 2, el perfil de reacciones adversas fue comparable al observado en adultos.
JANUVIA no se ha estudiado en pacientes pediátricos menores de 10 años.
Empleo en personas de edad avanzada
En los estudios clínicos, la seguridad y la eficacia de JANUVIA en pacientes de edad avanzada (≥65 años) fueron similares a las observadas en pacientes de menor edad (<65 años). No es necesario hacer ningún ajuste de la dosificación basado en la edad. La insuficiencia renal es más frecuente en los pacientes de edad avanzada; como en otros pacientes, pudiendo ser necesario ajustar la dosificación si existe insuficiencia renal importante (ver DOSIS Y VÍA DE ADMINISTRACIÓN, Pacientes con Insuficiencia Renal).
Efectos sobre la Capacidad de Conducir y utilizar Maquinaria
No se han realizado estudios de los efectos de JANUVIA sobre la capacidad para conducir y utilizar máquinas. Sin embargo, no se espera que JANUVIA afecte la capacidad de conducir y usar máquinas.
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
Embarazo
La sitagliptina no fue teratogénica en ratas a dosis orales de hasta 250 mg/kg ni en conejas que recibieron hasta 125 mg/kg durante la organogénesis (hasta 32 y 22 veces más, respectivamente, que la exposición en seres humanos, basándose en la dosis diaria recomendada en adultos de 100 mg diarios). En las ratas aumentó ligeramente la incidencia de malformaciones costales en los fetos (costillas ausentes, hipoplásicas u onduladas) con la dosificación de 1,000 mg/kg/día (aproximadamente 100 veces mayor que la exposición en seres humanos, basándose en la dosis diaria recomendada en adultos de 100 mg diarios). En las crías de las ratas que recibieron dosis orales de 1,000 mg/kg/día se observaron pequeñas disminuciones del promedio de peso corporal antes del destete en ambos sexos y del promedio de aumento de peso después del destete en los machos. Sin embargo, los estudios de reproducción en animales no siempre pronostican la respuesta en los seres humanos.
No hay estudios suficientes y bien controlados en mujeres embarazadas; por lo tanto, no se conoce la seguridad de JANUVIA en ellas. Como otros agentes hipoglucemiantes orales, no se recomienda emplear JANUVIA durante el embarazo.
Lactancia
La sitagliptina es secretada en la leche de las ratas lactantes. No se sabe si también es secretada en la leche humana, por lo que no se debe usar JANUVIA en mujeres que están amamantando.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
JANUVIA fue generalmente bien tolerado en los estudios clínicos comparativos tanto en monoterapia y en tratamiento combinado, con una incidencia de descontinuaciones del tratamiento a causa de reacciones adversas clínicas similar a placebo.
En cuatro estudios clínicos de monoterapia controlados con placebo (uno de 18 semanas de duración y otro de 24) y de tratamiento combinado de adición con metformina o pioglitazona (ambos de 24 semanas de duración) 1,082 pacientes fueron tratados con 100 mg una vez al día de JANUVIA y 778 recibieron placebo. (Dos de esos estudios incluyeron también 456 pacientes tratados con 200 mg diarios de JANUVIA, el doble de la dosis diaria recomendada). No se reportó ninguna reacción adversa relacionada con el medicamento en ≥1% de los pacientes que recibieron 100 mg de JANUVIA. En general, el perfil de seguridad de la dosis de 200 mg diarios fue similar al de la dosis de 100 mg diarios.
En un análisis conjunto preespecificado de esos estudios, la incidencia total de reacciones adversas de hipoglucemia fue similar en los pacientes tratados con JANUVIA y en los que recibieron placebo (1.2% vs. 0.9%). La incidencia de determinadas reacciones adversas gastrointestinales también fue similar con JANUVIA y con placebo: dolor abdominal (2.3% con JANUVIA y 2.1% con placebo), náusea (1.4% y 0.6%), vómito (0.8%, 0.9%), y diarrea (3.0%, 2.3%).
En todos esos estudios, las reacciones adversas de hipoglucemia se basaron en todos los reportes de hipoglucemia sintomática; no fue necesario hacer una medición de glucosa.
Tratamiento combinado de adición a sulfonilurea: En un estudio controlado con placebo de 24 semanas de JANUVIA 100 mg en combinación con glimepirida o con glimepirida con metformina (JANUVIA n=222; placebo n=219) la reacción adversa relacionada con el medicamento reportada en ≥1% de los pacientes tratados con JANUVIA y más común que en los pacientes tratados con placebo fue hipoglucemia (JANUVIA 9.5%, placebo 0.9%).
Tratamiento combinado de adición a metformina y un agonista del PPARℽ: En un estudio controlado con placebo de JANUVIA 100 mg en combinación con metformina y rosiglitazona (JANUVIA n = 170; placebo n = 92) el reporte de reacciones adversas relacionadas con el medicamento desde el primer punto en el tiempo hasta la Semana 18 en ≥1% de los pacientes tratados con JANUVIA y más frecuentemente que en los pacientes tratados con placebo fueron: cefalea (JANUVIA 2.4%; placebo 0.0%), diarrea (1.8%, 1.1%), náusea (1.2%, 1.1%), hipoglucemia (1.2%, 0.0%) y vómito (1.2%, 0.0%). Las reacciones adversas relacionadas con el medicamento reportadas hasta la Semana 54 en ≥1% de los pacientes tratados con JANUVIA y más frecuentemente que en los pacientes tratados con placebo fueron: cefalea (2.4%, 0.0%), hipoglucemia (2.4%, 0.0%), infecciones del tracto respiratorio superior (1.8%, 0.0%), náusea (1.2%, 1.1%), tos (1.2%, 0.0%), infecciones fúngicas cutáneas (1.2%, 0.0%), edema periférico (1.2%, 0.0%) y vómito (1.2%, 0.0%).
Tratamiento combinado inicial con metformina: En un estudio factorial, controlado con placebo de 24 semanas de tratamiento inicial con sitagliptina 100 mg en combinación con metformina 1,000 mg o 2,000 mg diarios (administrados como sitagliptina 50 mg/metformina 500 mg o 1,000 mg dos veces al día), las reacciones adversas relacionadas con el medicamento reportadas en ≥1% de los pacientes tratados con sitagliptina más metformina (n = 372) y más comúnmente que en los pacientes tratados con metformina sola (n= 364), fueron: diarrea (sitagliptina más metformina, 3.5%; metformina, 3.3%), dispepsia (1.3%; 1.1%), flatulencia (1.3%; 0.5%), vómito (1.1%; 0.3%) y cefalea (1.3%; 1.1%). La incidencia de hipoglucemia fue 1.1% en los pacientes con sitagliptina combinada con metformina y 0.5% en los pacientes con metformina sola.
Tratamiento inicial en combinación con un agonista del PPARℽ: En un estudio de 24 semanas de tratamiento inicial con JANUVIA a dosis de 100 mg diarios en combinación con pioglitazona 30 mg diarios, la única reacción adversa relacionada con el medicamento reportada en ≥1% de los pacientes tratados con JANUVIA más pioglitazona (n= 261) y más comúnmente que en los pacientes tratados solo con pioglitazona (n= 259) fue disminución (asintomática) de la glucosa sanguínea (JANUVIA con pioglitazona, 1.1%; pioglitazona, 0.0%). La incidencia de hipoglucemia (sintomática) fue 0.4% en los pacientes que recibieron JANUVIA en combinación con pioglitazona y 0.8% en los pacientes que recibieron pioglitazona.
Tratamiento de combinación con insulina: En un estudio de 24 semanas, controlado con placebo, de JANUVIA 100 mg en combinación con una dosis estable de insulina (con o sin metformina), las reacciones adversas relacionadas con el medicamento reportadas en ≥1% de los pacientes tratados con JANUVIA (n= 322) y más comúnmente que en los pacientes tratados con placebo (n= 319) fueron: hipoglucemia (JANUVIA, 9.6%; placebo, 5.3%), influenza (1.2%, 0.3%), y cefalea (1.2%, 0.0%). En otro estudio de 24 semanas los pacientes recibieron JANUVIA como tratamiento adicional mientras se intensificaba la insulina (con o sin metformina), hubo reacciones adversas no relacionadas con el fármaco, se reportó una incidencia ≥ 1% en pacientes tratados con JANUVIA 100 mg y más comúnmente que en pacientes tratados con placebo.
Pancreatitis: En un análisis agrupado de 19 estudios clínicos doble ciego que incluyó datos de 10,246 pacientes aleatorizados a recibir sitagliptina 100 mg/día (N=5,429) o el correspondiente control, tratamiento activo o placebo, (N=4,817), la incidencia de eventos de pancreatitis aguda no adjudicados fue de 0.1 por 100 años-paciente en cada grupo (4 pacientes con un evento en 4,708 años-paciente para sitagliptina y 4 pacientes con un evento en 3,942 años-paciente para el grupo control) (Ver PRECAUCIONES GENERALES Pancreatitis).
No se observaron cambios clínicamente significativos en los signos vitales o en el EKG (incluyendo en el intervalo QTc) en los pacientes tratados con JANUVIA.
Estudio de Seguridad Cardiovascular TECOS
El Estudio para Evaluar los Desenlaces Cardiovasculares con Sitagliptina (TECOS, por las siglas en inglés para The Trial Evaluating Cardiovascular Outcomes with Sitagliptin), incluyó a 7,332 pacientes tratados con JANUVIA, a 100 mg diarios (o 50 mg diarios si la tasa de filtración glomerular basal estimada (eGFR) era ≥30 y <50 mL/min/1.73 m2), y 7,339 pacientes tratados con placebo en la población con intención de tratar. Ambos tratamientos se añadieron al cuidado usual, apuntando a estándares regionales para HbA1c y factores de riesgo CV. La población de estudio incluyó un total de 2,004 pacientes ≥75 años de edad (970 tratados con JANUVIA y 1,034 tratados con placebo). La incidencia global de reacciones adversos graves en los pacientes que recibieron JANUVIA fue similar a la de los pacientes que recibieron placebo. La evaluación de complicaciones relacionadas con la diabetes preespecificadas reveló incidencias similares entre los grupos, incluyendo infecciones (18.4% de los pacientes tratados con JANUVIA y 17.7% de los pacientes tratados con placebo) e insuficiencia renal (1.4% de los pacientes tratados con JANUVIA y 1.5% de los pacientes tratados con placebo). El perfil de eventos adversos en los pacientes ≥75 años de edad fue generalmente similar al de la población general.
En la población de intención de tratar, entre los pacientes que estaban usando insulina y/o una sulfonilurea a nivel basal, la incidencia de hipoglucemia grave fue de 2.7% en los pacientes tratados con JANUVIA y 2.5% en los pacientes tratados con placebo, entre los pacientes que no estaban utilizando insulina y/o una sulfonilurea a nivel basal, la incidencia de hipoglucemia grave fue de 1.0% en los pacientes tratados con JANUVIA y de 0.7% en los pacientes tratados con placebo. La incidencia de eventos de pancreatitis con adjudicación confirmada fue de 0.3% en los pacientes tratados con JANUVIA y de 0.2% en los pacientes tratados con placebo. La incidencia de eventos de malignidad con adjudicación confirmada fue de 3.7% en los pacientes tratados con JANUVIA y de 4.0% en los pacientes tratados con placebo.
Población pediátrica: En un estudio clínico con JANUVIA 100 mg en pacientes pediátricos de 10 a 17 años con diabetes tipo 2, no se notificaron reacciones adversas relacionadas con el fármaco durante el período de tratamiento de 54 semanas en más de 1 paciente del grupo JANUVIA (N = 95) y con mayor frecuencia que en los pacientes del grupo placebo (N = 90).
No hubo diferencias clínicamente relevantes entre los grupos de JANUVIA y placebo hasta la semana 54 en los puntos finales de seguridad de laboratorio, signos vitales, índices de adiposidad o puntos finales de crecimiento y desarrollo.
Experiencia posterior a la comercialización:
Reacciones adversas adicionales se han identificado posterior a la comercialización de JANUVIA como monoterapia y/o en combinación con otros medicamentos hipoglucemiantes. Como estas reacciones se han reportado voluntariamente de una población de tamaño incierto, en general, no es posible calcular con seguridad su frecuencia o establecer una relación causal con el medicamento.
Reacciones de hipersensibilidad incluyendo anafilaxis, angioedema, erupción cutánea, urticaria, vasculitis cutánea, y condiciones cutáneas exfoliativas, incluyendo síndrome de Stevens-Johnson (ver CONTRAINDICACIONES y PRECAUCIONES GENERALES, Reacciones de hipersensibilidad); pancreatitis aguda, incluyendo pancreatitis necrotizante o hemorrágica fatal y no fatal (ver PRECAUCIONES GENERALES, Pancreatitis); empeoramiento de la función renal, incluyendo insuficiencia renal aguda (que algunas veces requirió diálisis); penfigoide ampolloso (ver PRECAUCIONES GENERALES, penfigoide ampolloso); infección de vías respiratorias superiores; nasofaringitis; estreñimiento, vómito, cefalea, artralgia, mialgia, dolor en extremidad, dolor de espalda, prurito.
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
En los estudios de interacciones farmacológicas, sitagliptina no tuvo efectos de importancia clínica sobre la farmacocinética de los siguientes medicamentos: Metformina, rosiglitazona, gliburida, simvastatina, warfarina y anticonceptivos orales. Según esos datos, sitagliptina no inhibe las isoenzimas CYP3A4, 2C8 y 2C9 del citocromo (CYP) P-450. Basándose en los datos in vitro, no es de esperarse que sitagliptina inhiba las isoenzimas CYP2D6, 1A2, 2C19 y 2B6, ni que induzca la CYP3A4.
Administrar concomitantemente dosis múltiples de metformina dos veces al día con sitagliptina no alteró de manera importante la farmacocinética de sitagliptina en pacientes con diabetes tipo 2.
Se ha realizado análisis de farmacocinética de población realizado en pacientes con diabetes tipo 2 los medicamentos administrados concomitantemente no tuvieron un efecto clínicamente importante en la farmacocinética de sitagliptina. Los medicamentos evaluados fueron aquellos que comúnmente se administran en pacientes con diabetes tipo 2, incluyendo reductores de colesterol (p. ej., estatinas, fibratos, ezetimiba), antiplaquetarios (p. ej., clopidogrel), antihipertensivos (p. ej., inhibidores de la ECA, antagonistas de receptores de angiotensina, bloqueadores beta, bloqueadores de canales del calcio, hidroclorotiazida), analgésicos y antiinflamatorios no esteroides (p. ej., naproxeno, diclofenaco, celecoxib), antidepresivos (p. ej., bupropión, fluoxetina, sertralina), antihistamínicos (cetrizina), inhibidores de la bomba de protones (p. ej., omeprazol, lansoprazol) y medicamentos para disfunción eréctil (p. ej., sildenafil).
Al administrar concomitantemente sitagliptina y digoxina, aumentaron ligeramente el área bajo la curva de concentración (AUC, 11%) y el promedio de concentración máxima (Cmáx, 18%) de la digoxina. No se considera probable que esos aumentos tengan importancia clínica. Se debe vigilar apropiadamente a los pacientes que estén recibiendo digoxina. No se recomienda hacer ningún ajuste de la dosificación de la digoxina ni de JANUVIA.
El AUC y la Cmáx de sitagliptina aumentaron aproximadamente 29% y 68%, respectivamente, al administrar concomitantemente dosis orales únicas de 100 mg de JANUVIA y de 600 mg de ciclosporina, que es un potente inhibidor de prueba de la glucoproteína-p. No se considera probable que los cambios observados en la farmacocinética de la sitagliptina tengan importancia clínica. No se recomienda hacer ningún ajuste de la dosificación de JANUVIA cuando se administra concomitantemente con ciclosporina o con otros inhibidores de la p-glucoproteína (p. ej., ketoconazol).
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
La incidencia de reacciones adversas de laboratorio fue similar en los pacientes tratados con JANUVIA 100 mg en comparación con los pacientes que recibieron placebo.
A lo largo de los estudios clínicos se encontró un pequeño incremento en el número de leucocitos (aproximadamente 200 leucocitos/μL en comparación con placebo; promedio basal, aproximadamente 6,600 leucocitos/μL), debido a un aumento de los neutrófilos. Este cambio en los parámetros de laboratorio no se considera clínicamente importante.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
La dosificación recomendada de JANUVIA es de 100 mg una vez al día como monoterapia o en tratamiento combinado con metformina, una sulfonilurea, insulina (con o sin metformina), un agonista del PPARℽ (p. ej., tiazolidinedionas), metformina más una sulfonilurea, o metformina más un agonista del PPARℽ. JANUVIA se puede tomar con o sin alimentos.
Cuando se usa JANUVIA en combinación con una sulfonilurea o con insulina se debe considerar emplear una dosis baja de la sulfonilurea o de la insulina para reducir el riesgo de hipoglucemia inducida por sulfonilurea o insulina. (Ver PRECAUCIONES GENERALES, Hipoglucemia en combinación con una sulfonilurea o con insulina).
Pacientes con insuficiencia renal
Se recomienda realizar una evaluación de la función renal antes de iniciar el tratamiento con JANUVIA, y periódicamente después de iniciarlo, debido al ajuste de dosis basado en la función renal.
En los pacientes con insuficiencia renal leve (Tasa de Filtración Glomerular estimada (eGFR) ≥60 mL/min/1.73 m2 a < 90 mL/min/1.73 m2) no se requiere ajustar la dosis de JANUVIA.
En los pacientes con insuficiencia renal moderada (eGFR ≥ 45 mL/min. 1.73 m2 a < 60 mL/min. 1.73 m2), no se requiere ajustar la dosis de JANUVIA.
En los pacientes con insuficiencia renal moderada (eGFR ≥ 30 mL/min/1.73 m2 a < 45 mL/min/1.73 m2) la dosificación de JANUVIA es de 50 mg una vez al día.
En los pacientes con insuficiencia renal grave (eGFR ≥ 15 mL/min/1.73 m2 a < 30 mL/min/1.73 m2) o en pacientes con ESRD (eGFR < 15 mL/min/1.73 m2), que necesitan hemodiálisis o diálisis peritoneal, la dosificación de JANUVIA es de 25 mg una vez al día. JANUVIA se puede administrar independientemente de la hora de la diálisis.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
Durante los estudios clínicos controlados en sujetos sanos, las dosis únicas de hasta 800 mg de JANUVIA fueron generalmente bien toleradas. En un estudio se observaron aumentos mínimos del QTc, que no se consideraron clínicamente importantes, con la dosis de 800 mg de JANUVIA (ver FARMACOCINÉTICA Y FARMACODINAMIA, Electrofisiología Cardiaca). No hay ninguna experiencia con dosis mayores de 800 mg en estudios clínicos. En los estudios de Fase I de dosis múltiples, no se observaron reacciones adversas clínicas relacionadas con el medicamento con dosis de JANUVIA de hasta 600 mg diarios por periodos de hasta 10 días y 400 mg diarios por periodos de hasta 28 días.
Si ocurre una sobredosis, es razonable emplear las medidas de soporte usuales, como retirar del conducto digestivo el medicamento no absorbido, aplicar monitoreo clínico (incluyendo electrocardiograma) y establecer tratamiento de sostén si es necesario.
La sitagliptina es poco dializable. En los estudios clínicos, se extrajo aproximadamente 13.5% de la dosis durante una sesión de hemodiálisis de tres a cuatro horas. Se puede considerar la hemodiálisis prolongada si es clínicamente adecuado. No se sabe si la sitagliptina es dializable por diálisis peritoneal.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
TOXICOLOGÍA ANIMAL
Carcinogénesis
Se realizó un estudio de dos años de carcinogénesis en ratas hembra y macho con dosis orales de sitagliptina 50, 150 y 500 mg/kg/día. Hubo un aumento en la incidencia de adenomas hepáticos y de carcinomas con las dosis altas en los machos y carcinomas hepáticos con las dosis altas en las hembras. Las dosis en ratas representan aproximadamente 58 veces la exposición con la dosis recomendada en humanos de 100 mg diarios. El nivel de esta dosis se asoció con hepatotoxicidad en ratas. El nivel de efecto no observado por inducción de neoplasia hepática fue 150 mg/kg/día, aproximadamente 19 veces la exposición en humanos con la dosis recomendada de 100 mg. Como se ha observado que la hepatotoxicidad se correlaciona con la inducción de neoplasia hepática en ratas, este aumento en la incidencia de tumores hepáticos en ratas fue probablemente secundario a toxicidad hepática crónica con las dosis altas. Se desconoce el significado clínico en humanos de este hallazgo.
Un estudio de carcinogenicidad de dos años se realizó en ratones macho y hembra con dosis orales de 50, 125, 250 y 500 mg/kg/día. La sitagliptina no aumentó la incidencia de tumores en órganos de ratones con dosis de hasta 500 mg/kg/día (aproximadamente 68 veces la exposición en humanos con base en la dosis diaria recomendada de 100 mg al día).
Mutagénesis
La sitagliptina no fue mutagénica ni clastogénica en una serie de estudios de toxicología genética, incluyendo el ensayo bacteriológico de Ames (prueba de mutagénesis microbiológica), pruebas de aberración cromosómica en células de ovario de hámster Chino (CHO, por las siglas en inglés para Chinese hamster ovary cells) y una prueba citogenética in vitro con células CHO, un ensayo de dilución alcalina en ADN (o DNA por las siglas en inglés para deoxyribonucleic acid) de hepatocitos de rata (es un ensayo que mide la capacidad del compuesto para inducir roturas de cadena simple de ADN) y un ensayo de micronúcleos in vivo.
Reproducción
No se observaron efectos adversos en la fertilidad en ratas hembra y macho que recibieron sitagliptina oral a dosis de hasta 1,000 mg/kg/día (aproximadamente 100 veces la dosis recomendada en humanos) antes y durante todo el tiempo de apareamiento.
Desarrollo
La sitagliptina no fue teratogénica en ratas a dosis orales de hasta 250 mg/kg/día o en conejas que recibieron hasta 125 mg/kg/día (hasta 32 y 22 veces la exposición en humanos con base a la dosis recomendada en humanos adultos de 100 mg al día) durante la organogénesis. Se observó un leve aumento en la incidencia de malformaciones en las costillas fetales (ausencia, hipoplásicas u onduladas) relacionadas con el tratamiento, en la descendencia de ratas que recibieron 1000 mg/kg/día (aproximadamente 100 veces la exposición en humanos con base a la dosis recomendada en humanos adultos de 100 mg al día). El nivel de efecto no observado en el desarrollo fue 250 mg/kg/día, aproximadamente 32 veces la exposición en humanos con la dosis recomendada de 100 mg. En crías de ratas que recibieron dosis orales de 1,000 mg/kg, se observaron disminuciones relacionadas con el tratamiento en el promedio del peso corporal antes del destete en ambos sexos y aumentos después del destete en los machos.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
Representante legal en México:
Merck Sharp & Dohme Comercializadora, S. de R.L. de C.V.
Av. San Jerónimo No. 369,
Piso 8, Col. La Otra Banda,
C.P. 01090, Álvaro Obregón,
Ciudad de México, México.
XV. PRESENTACIONES
Caja de cartón con 14 o 28 comprimidos de 25 mg, 50 mg o 100 mg.
Nota: No todas las presentaciones podrían estar disponibles en el mercado.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese a no más de 30° C.
Consérvese la caja bien cerrada.
XVII. LEYENDAS DE PROTECCIÓN
Literatura exclusiva para profesionales de la salud.
Su venta requiere receta médica.
Prohibida la venta fraccionada del producto.
No se deje al alcance de los niños.
No use durante el embarazo ni lactancia.
No se use en menores de 18 años.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx e "Incluir correo DPOC"
Prohibida su reproducción parcial o total.