
KELZY
DIENOGEST, ETINILESTRADIOL
Tableta
1 Caja, 28 Tabletas,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA de liberación prolongada contiene:
Dienogest 2.0 mg
Etinilestradiol 0.02 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS:
Anticonceptivo hormonal que contrarresta la acción androgénica, lo cual confiere beneficios adicionales a mujeres con acné, seborrea, hirsutismo y alopecia androgénica. La progestina que contiene se ha utilizado en el tratamiento de la endometriosis debido a su efecto antiproliferativo en el tejido endometrial, por lo que este anticonceptivo ofrece beneficios adicionales en trastornos menstruales como sangrado prolongado, sangrado abundante y dismenorrea manteniendo la regularidad menstrual por su bajo contenido estrogénico y su liberación modificada.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Hormonas sexuales y moduladores del aparato genital, anticonceptivos hormonales de uso sistémico, progestágenos y estrógenos, combinaciones fijas.
Mecanismo de acción: KELZY® es un anticonceptivo oral combinado antiandrogénico y con efecto antiproliferativo endometrial que contiene etinilestradiol y el progestágeno dienogest.
El etinilestradiol es un potente estrógeno sintético activo por vía oral. Al igual que el estradiol natural, el etinilestradiol tiene un efecto proliferativo en los epitelios de los órganos genitales femeninos. Estimula la producción de moco cervical, reduce su viscosidad y aumenta su espinabilidad. El etinilestradiol favorece el crecimiento del conducto galactóforo e inhibe la lactancia. El etinilestradiol estimula la retención de líquido extracelular. El etinilestradiol influye en los parámetros del metabolismo de las grasas y los hidratos de carbono, la hemostasia, el sistema renina-angiotensina-aldosterona y las proteínas de unión al suero.
El dienogest es un derivado de la 19-nortestosterona, con una afinidad in vitro por el receptor de progesterona 10-30 veces inferior a la de otros progestágenos sintéticos. Los datos in vivo en animales demostraron una fuerte actividad progestacional y actividad antiandrogénica. Dienogest no tiene actividad androgénica, mineralocorticoide o glucocorticoide significativa in vivo. Dienogest es eficaz para transformar el endometrio en un estado secretor/inactivo o atrófico. La seguridad endometrial de dienogest se ha demostrado en estudios experimentales y en estudios clínicos.
Efectos farmacodinámicos: El efecto anticonceptivo de KELZY® se basa en la interacción de diversos factores, entre los que destacan la inhibición de la ovulación y los cambios en la secreción cervical.
El claro efecto antiandrogénico de la combinación de etinilestradiol y dienogest se basa, entre otras cosas, en la reducción de la concentración de andrógenos en el suero. En un estudio multicéntrico con etinilestradiol/dienogest, se observó una mejora significativa de los síntomas del acné leve a moderado y una influencia favorable sobre la seborrea.
Eficacia clínica y seguridad: Se realizaron dos estudios de fase II (LPRl-421/201 y LPRl-421/202). Los resultados del estudio LPRl-421/201 mostraron que el tratamiento con LPRl-421 a 2 mg/20 μg inhibía la actividad ovárica con mayor eficacia en comparación con las otras dos combinaciones de dosis probadas (1 mg/10 μg y 2 mg/10 μg).
El estudio LPRl-421/201 demostró que el 76% de las mujeres del grupo EE/DNG 20 μg/2 mg en un régimen prolongado de 87 días con píldoras activas seguidos de 4 días de placebo habían recuperado la ovulación al final del ciclo posterior al tratamiento.
En dos ensayos clínicos multicéntricos de fase III, un estudio de un solo brazo y un estudio controlado aleatorizado doble ciego (5:2) frente a drospirenona 3 mg/etinilestradiol 0,02 mg, se trató a 1309 mujeres en un régimen estándar de ciclos consistente en una dosis diaria durante 24 días seguida de 4 días libres de hormonas en un tratamiento anticonceptivo eficaz. En el análisis conjunto de estos dos estudios, se calcularon los siguientes Índices de Pearl:
• Índice de Pearl (18-45 años), usuario + fallo del método: 0,2 (límite superior, intervalo de confianza del 95%: 0,64).
• Índice de Pearl (18-35 años), usuario + fallo del método: 0,2 (límite superior, intervalo de confianza del 95%: 0,77).
Patrón de sangrado: El patrón de sangrado durante el uso de KELZY® se evaluó en un ensayo comparativo de 9 ciclos (5:2), doble ciego y doble simulación frente a drospirenona 3 mg/etinilestradiol 0,02 mg, utilizados de forma continua.
Durante los ciclos 2-9, la proporción de sujetos con sangrado/manchado no programado (definido como cualquier sangrado/manchado que ocurre fuera de los intervalos libres de hormonas (días 25-28 ± 1 día), independientemente de la duración del régimen y que puede continuar en los primeros 4 días (días 1-4) del ciclo siguiente) fue significativamente menor (valor p: < 0,0001) en el grupo LPRl-424 que en el grupo DRSP/EE (55,1% frente a 75,2%).
Durante los ciclos 2-9, el número medio (DE) de días de hemorragia/manchado no programados fue significativamente menor en el grupo LPRl-424 que en el grupo DRSP/EE (5,6 [10,76] días frente a 8,7 [10,59] días; Wilcoxon-rank-sum-test p-value < 0,0001). La reducción del número medio de días de hemorragia no programada en el grupo LPRl-424 es aproximadamente 3 veces mayor que en el grupo DRSP/EE y la reducción del número medio de días de manchado no programado en el grupo LPRl-424 es el doble que en el grupo DRSP/EE.
Durante los ciclos 2-9, proporciones similares de sujetos de ambos grupos de tratamiento notificaron sangrados/manchados programados: 86,6% en el grupo LPRl-424 y 86,0% en el grupo DRSP/EE. Durante los ciclos 2-9, la proporción de sujetos con hemorragia prolongada (que duró más de 10 días consecutivos) fue significativamente inferior desde el punto de vista estadístico en el grupo de LPRl-424 que en el grupo de DRSP/EE (5,6% frente a 10,3%; valor p: 0,0154).
Durante los ciclos 2-9, la proporción de sujetos con ausencia de días de sangrado/manchado fue ligeramente superior en el grupo LPRl-424 en comparación con el grupo DRSP/EE (10,5% frente a 7,9%).
La tasa de sujetos que se retiraron de los estudios debido a acontecimientos adversos relacionados con hemorragias fue del 1,8% (LPRl-424/301) y del 1,7% (LPRl-424/302).
Propiedades farmacocinéticas:
Etinilestradiol:
Absorción: El etinilestradiol administrado por vía oral se absorbe rápida y completamente. La biodisponibilidad oral media del etinilestradiol es de alrededor del 45%, con una gran variación interindividual de alrededor del 20-65%.
Distribución: El etinilestradiol está muy unido a la albúmina sérica, aunque de forma inespecífica (aproximadamente el 98%), e induce un aumento de las concentraciones séricas de SHBG (globulina fijadora de hormonas sexuales). El volumen aparente de distribución para una dosis oral de 0,03 mg es de 625,3 ± 228,7 L.
Biotransformación: El etinilestradiol está sujeto a conjugación presistémica tanto en la mucosa del intestino delgado como en el hígado. El etinilestradiol se metaboliza principalmente por hidroxilación aromática, pero se forma una amplia variedad de metabolitos hidroxilados y metilados. Éstos están presentes como metabolitos libres y como conjugados con glucurónidos y sulfato.
Eliminación: Los niveles séricos de etinilestradiol disminuyen en 2 fases caracterizadas por vidas medias de aproximadamente 1 hora y 10-20 horas, respectivamente. El etinilestradiol no se excreta en forma inalterada. Los metabolitos de etinilestradiol se excretan en una proporción urinaria a biliar de 4:6.
La vida media de eliminación de los metabolitos es de aproximadamente un día.
Dienogest:
Absorción: Dienogest, administrado por vía oral, se absorbe rápida y casi completamente. Dienogest tiene una elevada biodisponibilidad oral de más del 90%. Las concentraciones séricas máximas se alcanzan generalmente al cabo de 1-3 horas en combinación con el etinilestradiol.
Distribución: Dienogest se une a la albúmina sérica y no se une a la SHBG ni a la globulina fijadora de corticoides (CBG). Alrededor del 10% de las concentraciones séricas totales del fármaco están presentes como esteroide libre. El 90% se une de forma inespecífica a la albúmina. El aumento de la SHBG inducido por el etinilestradiol no influye en la unión a proteínas séricas de dienogest. El volumen aparente de distribución de dienogest es de unos 40 L tras una dosis oral única de 1 mg.
Biotransformación: Dienogest se metaboliza principalmente por hidroxilación y conjugación, con formación de metabolitos endocrinológicamente inactivos en su mayor parte. Estos metabolitos se eliminan muy rápidamente del plasma, de modo que en el plasma humano no se observa ningún metabolito importante aparte de dienogest inalterado. La influencia del etinilestradiol sobre el metabolismo del dienogest es mucho menor que sobre el metabolismo de otros progestágenos.
Eliminación: Dienogest se excreta en una proporción urinaria/fecal de aproximadamente 3:1 tras la administración oral de 0,1 mg/kg, principalmente tras la conjugación de glucurónido y sulfato. Como los metabolitos no son hormonalmente activos y se excretan muy rápidamente, dienogest es la fracción predominante en plasma. Una fracción de ~20-30% del total excretado en la orina se libera como esteroide libre. El aclaramiento sérico de dienogest es de ~64 ml/min, y el T½ para la excreción de metabolitos urinarios es de ~14 h. La mayoría de los metabolitos se eliminan en las primeras 24 h, y aproximadamente el 86% de la dosis administrada se elimina en 6 días.
Combinación de dienogest y etinilestradiol en formulación de liberación prolongada: Los resultados de un ensayo clínico demostraron que las tabletas de liberación prolongada tienen un perfil PK comparable al de la formulación de liberación inmediata, pero con una menor fluctuación de los niveles sistémicos de los principios activos. El AUC(0-24h) fue estrictamente proporcional tanto para dienogest como para etinilestradiol en comparación con el producto de referencia de liberación inmediata. La Tmáx, tanto para dienogest como para etinilestradiol, pasó de 1,5 horas para las formulaciones de liberación inmediata a aproximadamente 4 horas para las formulaciones de liberación prolongada, logrando un comportamiento PK más fisiológico y 25% menor exposición hormonal.
Las condiciones de estado estacionario se alcanzan en el día 5 tras el tratamiento con KELZY®. Los alimentos no tienen ningún efecto sobre el perfil PK y la tolerabilidad general de KELZY®.
CONTRAINDICACIONES:
Los anticonceptivos hormonales combinados (AOC) no deben utilizarse en las siguientes condiciones. Si cualquiera de las condiciones enumeradas aparece por primera vez durante el uso de AOC, el producto debe interrumpirse inmediatamente.
• Hipersensibilidad a los principios activos o a cualquiera de los componentes de la formulación.
• Presencia o riesgo de tromboembolismo venoso (TEV).
• Tromboembolismo venoso-TEV actual (con anticoagulantes) o antecedentes de (por ejemplo, trombosis venosa profunda [TVP] o embolia pulmonar [EP]).
• Predisposición hereditaria o adquirida conocida a la tromboembolia venosa, como resistencia a APC (incluido el factor V Leiden), deficiencia de antitrombina III, deficiencia de proteína C, deficiencia de proteína S.
• Cirugía mayor con inmovilización prolongada (ver sección Precauciones generales).
• Riesgo elevado de tromboembolismo venoso debido a la presencia de múltiples factores de riesgo (ver sección Precauciones generales).
• Presencia o riesgo de tromboembolismo arterial (TEA).
• Tromboembolia arterial: TEA actual, antecedentes de TEA (por ejemplo, infarto de miocardio) o afección prodrómica (por ejemplo, angina de pecho).
• Enfermedad cerebrovascular: ictus actual, antecedentes de ictus o afección prodrómica (por ejemplo, accidente isquémico transitorio, AIT).
• Predisposición hereditaria o adquirida conocida a la tromboembolia arterial, como hiperhomocisteinemia y anticuerpos antifosfolípidos (anticuerpos anticardiolipinas, anticoagulante lúpico).
• Antecedentes de migraña con síntomas neurológicos focales.
• Alto riesgo de tromboembolismo arterial debido a múltiples factores de riesgo o a la presencia de un factor de riesgo grave como:
- Diabetes mellitus con síntomas vasculares.
- Hipertensión grave.
- Dislipoproteinemia grave.
• Presencia o antecedentes de enfermedad hepática grave mientras los valores de la función hepática no hayan vuelto a la normalidad.
• Presencia o antecedentes de tumores hepáticos (benignos o malignos).
• Neoplasias conocidas o sospechadas influidas por esteroides sexuales (por ejemplo, de los órganos genitales o las mamas)
• Hemorragia vaginal no diagnosticada.
• Embarazo conocido o sospechado.
KELZY® está contraindicado en el embarazo y lactancia, así como en pacientes menores de 18 años.
KELZY® está contraindicado para uso concomitante con los medicamentos que contienen ombitasvir/paritaprevir/ritonavir, dasabuvir, glecaprevir/pibrentasvir y sofosbuvir/ velpatasvir/voxilaprevir (ver Interacciones medicamentosas y de otro género).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: KELZY® no está indicado durante el embarazo.
Si se produce un embarazo durante el uso de KELZY® el tratamiento debe suspenderse inmediatamente. Amplios estudios epidemiológicos no han revelado ni un aumento del riesgo de defectos congénitos en niños nacidos de mujeres que utilizaron AOC antes del embarazo, ni un efecto teratogénico cuando los AOC se tomaron inadvertidamente durante el embarazo.
Los estudios en animales han mostrado efectos adversos durante el embarazo y la lactancia (ver Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad). Con base en estos datos en animales, no puede excluirse un efecto adverso debido a la acción hormonal de los compuestos activos. Sin embargo, la experiencia general con AOC durante el embarazo no aportó pruebas de un efecto adverso real en humanos.
El aumento del riesgo de TEV durante el puerperio debe tenerse en cuenta al reiniciar el tratamiento con KELZY® (ver Dosis y vía de administración y Precauciones generales).
Lactancia: La lactancia puede verse influenciada por los AOC, ya que pueden reducir la cantidad y cambiar la composición de la leche materna. Pequeñas cantidades de esteroides anticonceptivos y/o sus metabolitos pueden excretarse con la leche durante el uso de AOC. Estas cantidades pueden afectar al niño. Por lo tanto, KELZY® no debe utilizarse hasta que la madre lactante haya destetado completamente a su hijo.
REACCIONES SECUNDARIAS Y ADVERSAS:
Las reacciones adversas notificadas con más frecuencia con dienogest/etinilestradiol durante los ensayos clínicos (1719 mujeres) fueron metrorragia (8,4%), cefalea (3,7%) y dolor mamario (3,5%).
Los cambios en el patrón hemorrágico fueron una reacción adversa frecuentemente notificada en los ensayos clínicos (ver sección Propiedades farmacocinéticas).
Lista tabulada de reacciones adversas: La siguiente tabla recoge las reacciones adversas (RAM) por clases de órganos del sistema MedDRA (MedDRA SOCs). Las frecuencias se basan en datos de ensayos clínicos. Se enumeran todas las reacciones adversas que se han notificado en ensayos clínicos con dienogest/etinilestradiol. Todas las reacciones adversas enumeradas en la categoría "raras" se produjeron sólo una vez (en 1 voluntaria), lo que supone < 0,1%.
Las frecuencias de las reacciones adversas se basan en las siguientes categorías:
Muy frecuentes (≥ 1/10), Común (≥ 1/100 a < 1/10), Poco común (≥ 1/1.000 a < 1/100), Rara (≥ 1/10.000 a < 1/1.000), Muy rara(< 1/10.000), No se conoce (no puede estimarse a partir de los datos disponibles).
|
Clasificación por órganos y sistemas (MedDRA) |
Común (≥ 1/100 a < 1/10) |
Poco común (≥ 1/1.000 a < 1/100) |
Rara (≥ 1/10.000 a < 1/1000) |
No conocida |
|---|---|---|---|---|
|
Infecciones e infestaciones |
Infección vaginal1 |
Infección del tracto urinario2 |
Herpes genital Meningitis |
|
|
Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos) |
Fibroadenoma mamario |
|||
|
Trastornos de la sangre y sistema linfático |
Leucopenia |
|||
|
Trastornos del sistema inmunológico |
Exacerbación de los síntomas del angioedema hereditario y adquirido |
|||
|
Trastornos endocrinos |
Hipotiroidismo |
Hipertiroidismo |
||
|
Trastornos del metabolismo y nutrición |
Alteraciones del apetito3 |
Dislipidemia Retención de fluidos |
||
|
Trastornos psiquiátricos |
Alteraciones de la libido4 Alteraciones del estado de ánimo5 |
Ansiedad6 Estado depresivo Depresión Alteraciones mentales7 Alteraciones del sueño8 |
||
|
Trastornos del sistema nervioso |
Dolor de cabeza9 |
Migraña10 Mareos |
Disgeusia Hipoestesia Parestesia |
|
|
Trastornos visuales |
Prurito ocular Deterioro visual |
|||
|
Trastornos del oído y del laberinto |
Vértigo |
|||
|
Trastornos cardiacos |
Palpitaciones |
|||
|
Trastornos vasculares |
Hipertensión11 Trombosis venosa profunda |
Fluctuación de la presión arterial Hematoma Sofoco Vena araña Vena varicosa Trombosis venosa |
||
|
Trastornos respiratorios, torácicos y del mediastino |
Epistaxis Embolia pulmonar |
|||
|
Trastornos gastrointestinales |
Náusea Dolor abdominal12 |
Vómito Diarrea Flatulencia Distensión abdominal |
Constipación Dispepsia Enfermedad por reflujo gastroesofágico Hiperestesia dental |
|
|
Trastornos de la piel y tejidos subcutáneos |
Acné |
Alopecia Prurito Dermatitis13 Hiperhidrosis14 Salpullido15 |
Cloasma Piel seca Trastornos cutáneos Urticaria |
|
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor en extremidades |
Artralgia |
||
|
Trastornos renales y urinarios |
Hematuria Leucocituria |
|||
|
Trastornos del aparato reproductor y mama |
Metrorragia16 Molestias mamarias17 Dismenorrea18 |
Amenorrea Hemorragia vaginal Quiste ovárico Sequedad vulvovaginal Dolor pélvico Prurito vulvovaginal Displasia cervical Dispareunia Trastornos menstruales19 Secreción vaginal Inflamación vulvovaginal |
Hiperplasia endometrial Molestias genitales |
|
|
Trastornos generales y del sitio de administración |
Fatiga Edema periférico Hinchazón20 |
Malestar Pereza Deterioro general de la salud física |
||
|
Investigaciones |
Aumento de peso21 Aumento de la hormona estimulante de la tiroides en sangre Aumento de los triglicéridos en sangre22 |
Aumento de la creatinfosfocinasa en sangre Aumento del colesterol en sangre23 Aumento de las enzimas hepáticas24 Disminución del peso |
Aumento de la deshidrogenasa láctica en sangre Aumento del potasio en sangre Tensión arterial anormal Aumento de prolactina en sangre Dímero de fibrina D aumentado Prueba resistencia a la insulina |
1 Incluida la infección micótica vulvovaginal, la candidiasis vulvovaginal y la vaginosis bacteriana.
2. Incluida la bacteriuria.
3. Incluida la disminución del apetito y el aumento del apetito.
4. Incluida la pérdida de libido y el trastorno de aversión sexual.
5. Incluyendo cambios de humor, humor alterado, Irritabilidad, labilidad afectiva, trastorno afectivo, apático y apatía.
6. Incluyendo trastorno de ansiedad, nerviosismo, inquietud, disforia y tensión.
7. Incluyendo trastorno mental, trastorno límite de la personalidad y ataque de pánico.
8. Incluidos insomnio y somnolencia.
9. Incluida la cefalea tensional.
10. Incluida la migraña con aura.
11. Incluido el aumento de la presión arterial.
12. Incluido dolor abdominal inferior y dolor abdominal superior.
13. Inclui da dermatitis atópica, dermatitis alérgica, dermatitis perioral.
14. Incluidos sudores nocturnos.
15. Incluida la erupción macular.
16. Incluida la hemorragia uterina.
17. Incluidos dolor mamario, congestión mamaria, aumento del tamaño de las mamas y sensibilidad mamaria.
18. Incluido el dolor premenstrual.
19. Incluida oligomenorrea, menstruación irregular, menorragia, polimenorrea.
20.Incluidos edema periférico, edema generalizado e hinchazón.
21. Incluida la obesidad.
22. Incluida la hipertrigliceridemia.
23. Incluida la hipercolesterolemia.
24.Incluidas ALT elevada, AST elevada, GGT elevada.
Descripción de reacciones adversas seleccionadas:
Se ha observado un aumento del riesgo de acontecimientos trombóticos y tromboembólicos arteriales y venosos, incluyendo infarto de miocardio, ictus, accidentes isquémicos transitorios, trombosis venosa y embolia pulmonar en mujeres que utilizan AOC, que se discuten con más detalle en Precauciones generales.
Se han notificado los siguientes acontecimientos adversos graves en mujeres que utilizan AOC, que se comentan en Precauciones generales.
Tumores:
• La frecuencia de diagnóstico de cáncer de mama aumenta ligeramente entre las usuarias de AOC. Dado que el cáncer de mama es poco frecuente en mujeres menores de 40 años, el riesgo adicional es pequeño en relación con el riesgo global de desarrollar cáncer de mama. Se desconoce la relación causal con el uso de AOC.
• Tumores hepáticos.
• Cáncer de cuello uterino.
Otras afecciones:
• Mujeres con hipertrigliceridemia (mayor riesgo de pancreatitis al utilizar AOC).
• Hipertensión.
• Aparición o empeoramiento de enfermedades cuya asociación con el uso de AOC no es concluyente: ictericia colestásica, formación de cálculos biliares, porfiria, lupus eritematoso sistémico, síndrome urémico hemolítico, corea de Sydenham, herpes gestacional, pérdida de audición relacionada con otosclerosis.
• Alteraciones de la función hepática.
• Alteraciones de la tolerancia a la glucosa o efecto sobre la resistencia periférica a la insulina.
• Enfermedad de Crohn, colitis ulcerosa.
• Cloasma.
Interacciones: Pueden producirse hemorragias imprevistas y/o fallo anticonceptivo por interacciones de otros medicamentos (inductores enzimáticos) con los anticonceptivos orales (ver lnteracciones medicamentosas y de otro género).
Efectos sobre la capacidad para conducir y utilizar máquinas: No se han realizado estudios sobre los efectos en la capacidad para conducir y utilizar máquinas.
No se han observado efectos sobre la capacidad para conducir y utilizar máquinas en usuarios de AOC.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Los estudios preclínicos con etinilestradiol y dienogest revelaron los efectos estrogénicos y progestagénicos esperados.
Los datos preclínicos no revelaron ningún riesgo especial para el ser humano según los estudios convencionales de toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción. No obstante, debe tenerse en cuenta que los esteroides sexuales pueden favorecer el crecimiento de determinados tejidos y tumores hormonodependientes.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Debe consultarse la información de prescripción de los medicamentos concomitantes para identificar posibles interacciones.
Efectos de otros medicamentos sobre KELZY®: Pueden producirse interacciones con medicamentos que inducen enzimas microsomales que pueden dar lugar a un aumento del aclaramiento de hormonas sexuales y que pueden provocar hemorragias intermenstruales y/o fallo anticonceptivo.
Manejo: La inducción enzimática puede observarse a los pocos días de tratamiento. La inducción enzimática máxima suele observarse al cabo de unas semanas. Tras el cese del tratamiento farmacológico, la inducción enzimática puede mantenerse durante unas 4 semanas.
Tratamiento a corto plazo: Las mujeres en tratamiento con fármacos inductores de enzimas hepáticas deben utilizar temporalmente un método de barrera u otro método anticonceptivo además del AOC. El método de barrera debe utilizarse durante todo el tiempo de administración concomitante del fármaco y durante 28 días después de su interrupción. Si el tratamiento farmacológico se prolonga más allá del final de las tabletas del envase de AOC, el siguiente envase de AOC debe iniciarse justo después del anterior sin el intervalo habitual sin tabletas.
Tratamiento a largo plazo: En mujeres en tratamiento prolongado con sustancias activas inductoras de enzimas hepáticas, se recomienda otro método anticonceptivo no hormonal fiable.
Sustancias que aumentan el aclaramiento de los AOC (disminución de la eficacia de los AOC por inducción enzimática), por ejemplo: barbitúricos, carbamazepina, fenitoína, primidona, rifampicina y posiblemente también oxcarbazepina, topiramato, felbamato, griseofulvina y productos que contengan la hierba de San Juan (Hypericum perforatum).
Sustancias con efectos variables sobre el aclaramiento de los AOC: Cuando se administran conjuntamente con AOC, muchos de los inhibidores de la proteasa del VIH/VHC e inhibidores no nucleósidos de la transcriptasa inversa, así como las combinaciones de ambos, pueden aumentar o disminuir las concentraciones plasmáticas de estrógenos o progestágenos. Estos cambios pueden ser clínicamente relevantes en algunos casos.
Por lo tanto, debe consultarse la información de prescripción de los medicamentos concomitantes contra el VIH/VHC para identificar posibles interacciones y cualquier recomendación relacionada. En caso de duda, las pacientes en tratamiento con inhibidores de la proteasa o inhibidores no nucleósidos de la transcriptasa inversa deben utilizar un método anticonceptivo de barrera adicional.
Sustancias que disminuyen el aclaramiento de AOC (inhibidores enzimáticos): Dienogest es un sustrato del citocromo P450 (CYP) 3A4. Se desconoce la relevancia clínica de las posibles interacciones con inhibidores enzimáticos. La administración concomitante de inhibidores fuertes y moderados del CYP3A4 (por ejemplo, antifúngicos azólicos [ketoconazol, itraconazol, voriconazol y fluconazol], macrólidos [claritromicina, eritromicina], diltiazem verapamilo y zumo de pomelo) pueden aumentar las concentraciones plasmáticas del estrógeno o del progestágeno o de ambos. Se ha demostrado que dosis de etoricoxib de 60 a 120 mg/día aumentan las concentraciones plasmáticas de etinilestradiol entre 1,4 y 1,6 veces, respectivamente, cuando se toma concomitantemente con unAOC que contiene 0,035 mg de etinilestradiol.
Efectos de KELZY® sobre otros medicamentos: Los AOC pueden afectar al metabolismo de algunos otros principios activos. En consecuencia, las concentraciones plasmáticas y tisulares pueden aumentar (por ejemplo, ciclosporina) o disminuir (por ejemplo, lamotrigina).
Sin embargo, basándose en los datos in vitro, la inhibición de las enzimas CYP por dienogest es poco probable a la dosis terapéutica.
Los datos clínicos sugieren que el etinilestradiol inhibe el aclaramiento de los sustratos del CYP1A2, lo que conduce a un aumento débil (por ejemplo, teofilina) o moderado (por ejemplo, tizanidina) de su concentración plasmática.
Durante los ensayos clínicos con pacientes tratados por infecciones del virus de la hepatitis C (VHC) con medicamentos que contenían ombitasvir/paritaprevir/ritonavir y dasabuvir con o sin ribavirina, se produjeron elevaciones de las transaminasas (ALT) superiores a 5 veces el límite superior de la normalidad (LSN) con una frecuencia significativamente mayor en mujeres que utilizaban medicamentos que contenían etinilestradiol, como los anticonceptivos hormonales combinados (AOC). Además, también en pacientes tratados con glecaprevir/pibrentasvir o sofosbuvir/velpatasvir/voxilaprevir, se observaron elevaciones de ALT en mujeres que utilizaban medicamentos que contenían etinilestradiol como los anticonceptivos hormonales combinados (ver Contraindicaciones).
Por lo tanto, las pacientes que usan KELZY® deben cambiar a un método anticonceptivo alternativo (por ejemplo, anticoncepción con progestágeno solo o métodos no hormonales) antes de iniciar el tratamiento con estos regímenes farmacológicos combinados.
KELZY® puede reiniciarse 2 semanas después de finalizar el tratamiento con estos regímenes farmacológicos combinados.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Pruebas de laboratorio: El uso de esteroides anticonceptivos puede influir en los resultados de ciertas pruebas de laboratorio, incluyendo parámetros bioquímicos de la función hepática, tiroidea, suprarrenal y renal, niveles plasmáticos de proteínas (transportadoras), por ejemplo, globulina fijadora de corticosteroides y fracciones de lípidos/lipoproteínas, parámetros del metabolismo de los carbohidratos y parámetros de coagulación y fibrinólisis. Por lo general, los cambios se mantienen dentro de los valores normales de laboratorio.
PRECAUCIONES GENERALES:
Si está presente alguna de las condiciones o factores de riesgo mencionados a continuación, debe discutirse con la paciente la idoneidad de KELZY®
En caso de agravamiento, o primera aparición de cualquiera de estas condiciones o factores de riesgo, se debe aconsejar a la paciente que se ponga en contacto con su médico para determinar si se debe interrumpir el uso de KELZY®.
En caso de sospecha o confirmación de trombosis, debe interrumpirse el uso del AOC. En caso de iniciarse un tratamiento anticoagulante, debe iniciarse una anticoncepción alternativa adecuada debido a la teratogenicidad del tratamiento anticoagulante (cumarinas).
Trastornos circulatorios:
Riesgo de tromboembolismo venoso (TEV): El uso de cualquier anticonceptivo hormonal combinado (AOC) aumenta el riesgo de tromboembolismo venoso (TEV) en comparación con la no utilización. Los productos que contienen levonorgestrel, norgestimato o noretisterona son los que presentan menor riesgo de TEV. Otros productos AOC, incluido KELZY®, pueden tener un nivel de riesgo ligeramente superior. La decisión de utilizar cualquier producto que no sea el de menor riesgo de TEV debe tomarse sólo después de una discusión con la paciente para asegurarse de que entiende el riesgo de tromboembolismo venoso con KELZY®, cómo sus factores de riesgo actuales influyen en este riesgo, y que su riesgo de TEV es mayor en el primer año de uso. También hay algunas pruebas de que el riesgo aumenta cuando se reinicia un AOC después de una interrupción de uso de 4 semanas o más.
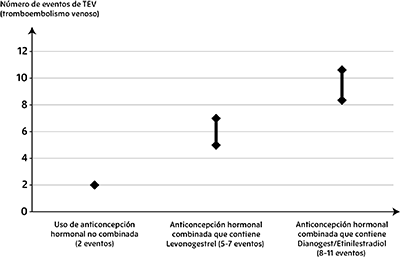
En las mujeres que no utilizan un AOC y no están embarazadas, aproximadamente 2 de cada 10.000 desarrollarán TEV a lo largo de un año. Sin embargo, en una mujer concreta el riesgo puede ser mucho mayor, dependiendo de sus factores de riesgo subyacentes (véase más adelante).
Los estudios epidemiológicos en mujeres que utilizan anticonceptivos hormonales combinados de baja dosis (< 50 μg de etinilestradiol) han revelado que, de cada 10.000 mujeres, entre 6 y 12 desarrollarán TEV en un año.
Se estima que de cada 10.000 mujeres que utilizan un anticonceptivo hormonal combinado de dosis baja que contiene levonorgestrel, unas 61 desarrollarán TEV en un año.
Los datos de estudios de mujeres que utilizan AOC que contienen dienogest y etinilestradiol 2 mg/0,03 mg y diferente posología con una dosis de etinilestradiol superior a KELZY® estiman2 que de cada 10.000 mujeres entre 8 y 11 desarrollarán TEV en un año. Este número de TEV por año es menor que el número esperado durante el embarazo o en el periodo posparto.
1 Punto medio del intervalo de 5-7 por 10.000 SJ, basado en un riesgo relativo para los AOC que contienen levonorgestrel frente a la no utilización de aproximadamente 2,3 a 3,6.
2 Los datos de un metaanálisis estiman que el riesgo de TEV para las usuarias de dienogest/etinilestradiol 2 mg/0,03 mg es ligeramente superior en comparación con las usuarias de AOC que contienen levonorgestrel (Hazard Ratio de 1,57 con el riesgo oscilando entre 1,07 y 2,30)
El riesgo de tromboembolismo venoso puede ser mortal en el 1-2% de los casos.
Número de TEV por 10.000 mujeres en un año
En casos extremadamente raros, se han notificado trombosis en usuarios de AOC en otros vasos sanguíneos, por ejemplo, venas y arterias hepáticas, mesentéricas, renales o retinianas.
Factores de riesgo de TEV: El riesgo de complicaciones tromboembólicas venosas en usuarias de AOC puede aumentar sustancialmente en una mujer con factores de riesgo adicionales, particularmente si existen múltiples factores de riesgo (ver Tabla 1).
KELZY® está contraindicado si una mujer tiene múltiples factores de riesgo que la ponen en alto riesgo de trombosis venosa (ver Contraindicaciones). Si una mujer tiene más de un factor de riesgo, es posible que el aumento del riesgo sea mayor que la suma de los factores individuales —en este caso debe considerarse su riesgo total de TEV. Si el balance de beneficios y riesgos se considera negativo, no debe prescribirse un AOC (ver Contraindicaciones).
Tabla 1: Factores de riesgo de TEV
|
Factor de riesgo |
Comentario |
|
Obesidad (índice de masa corporal superior a 30 kg/m2) |
El riesgo aumenta sustancialmente a medida que aumenta el IMC. Especialmente importante si existen otros factores de riesgo. |
|
Inmovilización prolongada, cirugía mayor, cualquier intervención quirúrgica en las piernas o la pelvis, neurocirugía o traumatismo grave. Nota: la inmovilización temporal, incluidos los viajes en avión de más de 4 horas, también puede ser un factor de riesgo de TEV, especialmente en mujeres con otros factores de riesgo. |
En estas situaciones es aconsejable interrumpir el uso de la tableta (en el caso de cirugía electiva con al menos cuatro semanas de antelación) y no reanudarlo hasta dos semanas después de la completa removilización. Debe utilizarse otro método anticonceptivo para evitar embarazos no deseados. Debe considerarse el tratamiento antitrombótico si KELZY® no se ha suspendido con antelación |
|
Antecedentes familiares positivos (tromboembolismo venoso alguna vez en un hermano o padre, especialmente a una edad relativamente temprana, por ejemplo, antes de los 50 años) |
Si se sospecha una predisposición hereditaria, la mujer debe ser remitida a un especialista para que la asesore antes de decidir sobre cualquier uso de AOC |
|
Otras afecciones médicas asociadas a la TEV |
Cáncer, lupus eritematoso sistémico, síndrome urémico hemolítico, enfermedad inflamatoria intestinal crónica (enfermedad de Crohn o colitis ulcerosa) y drepanocitosis |
|
Aumento de la edad |
Especialmente mayores de 35 años |
No existe consenso sobre el posible papel de las várices y la tromboflebitis superficial en la aparición o progresión de la trombosis venosa.
Debe tenerse en cuenta el aumento del riesgo de tromboembolismo en el embarazo y, en particular, en el periodo de 6 semanas del puerperio (para información sobre "Embarazo y lactancia", ver Restricciones de uso durante el embarazo y la lactancia).
Síntomas de TEV (trombosis venosa profunda y embolia pulmonar): En caso de síntomas, se debe aconsejar a las pacientes que busquen atención médica urgente y que informen a su médico de que están tomando un AOC.
Los síntomas de la trombosis venosa profunda (TEV) pueden incluir:
• Hinchazón unilateral de la pierna y/o el pie o a lo largo de una vena de la pierna.
• Dolor o sensibilidad en la pierna que puede sentirse sólo al ponerse de pie o caminar.
• Aumento del calor en la pierna afectada; enrojecimiento o decoloración de la piel de la pierna.
Los síntomas de la embolia pulmonar (EP) pueden incluir:
• Aparición súbita de dificultad respiratoria inexplicable o respiración rápida.
• Tos repentina que puede asociarse a hemoptisis.
• Dolor torácico agudo.
• Aturdimiento o mareo intensos.
• Ritmo cardiaco rápido o irregular.
Algunos de estos síntomas (por ejemplo, "falta de aire", "tos") son inespecíficos y podrían interpretarse erróneamente como acontecimientos más comunes o menos graves (por ejemplo, infecciones de las vías respiratorias).
Otros signos de oclusión vascular pueden ser: dolor repentino, hinchazón y ligera coloración azulada de una extremidad.
Si la oclusión se produce en el ojo, los síntomas pueden ir desde una visión borrosa indolora que puede progresar hasta la pérdida de visión. En ocasiones, la pérdida de visión puede ser casi inmediata.
Riesgo de tromboembolismo arterial (TEA): Los estudios epidemiológicos han asociado el uso de AOC con un mayor riesgo de tromboembolismo arterial (infarto de miocardio) o de accidente cerebrovascular (por ejemplo, accidente isquémico transitorio, ictus). Los episodios tromboembólicos arteriales pueden ser mortales.
Factores de riesgo de TEA: El riesgo de complicaciones tromboembólicas arteriales o de un accidente cerebrovascular en usuarias de AOC aumenta en mujeres con factores de riesgo (ver Tabla 2). KELZY® está contraindicado si una mujer tiene uno o múltiples factores de riesgo de TEA que la sitúan en alto riesgo de trombosis arterial (ver Contraindicaciones). Si una mujer tiene más de un factor de riesgo, es posible que el aumento del riesgo sea mayor que la suma de los factores individuales —en este caso debe considerarse su riesgo total. Si el balance de beneficios y riesgos se considera negativo, no debe prescribirse un AOC (ver Contraindicaciones).
Tabla 2: Factores de riesgo de TEA
|
Factor de riesgo |
Comentario |
|
Aumento de la edad |
Especialmente mayores de 35 años |
|
Fumar |
Se debe aconsejar a las mujeres que no fumen si desean utilizar un AOC. A las mujeres mayores de 35 años que sigan fumando se les debe recomendar encarecidamente que utilicen otro método anticonceptivo. |
|
Hipertensión |
|
|
Obesidad (índice de masa corporal superior a 30 kg/m2) |
El riesgo aumenta sustancialmente a medida que aumenta el IMC. Especialmente importante en mujeres con factores de riesgo adicionales |
|
Antecedentes familiares positivos (tromboembolismo arterial en algún hermano o progenitor, especialmente a una edad relativamente temprana, por ejemplo, por debajo de los 50 años . |
Si se sospecha una predisposición hereditaria, la mujer debe ser remitida a un especialista para que la asesore antes de decidir sobre cualquier uso de AOC |
|
Migraña |
Un aumento de la frecuencia o gravedad de la migraña durante el uso de AOC (que puede ser prodrómico de un acontecimiento cerebrovascular) puede ser motivo de interrupción inmediata |
|
Otras condiciones médicas asociadas con eventos vasculares adversos |
Diabetes mellitus, hiperhomocisteinemia, cardiopatía valvular y fibrilación auricular, dislipoproteinemia y lupus eritematoso sistémico |
Síntomas de TEA: En caso de síntomas, se debe aconsejar a las pacientes que busquen atención médica urgente y que informen a su médico de que están tomando un AOC.
Los síntomas de un accidente cerebrovascular pueden incluir:
• Entumecimiento o debilidad repentinos de la cara, el brazo o la pierna, especialmente en un lado del cuerpo.
• Dificultad repentina para caminar, mareos, pérdida de equilibrio o coordinación.
• Confusión repentina, dificultad para hablar o entender.
• Dificultad repentina para ver con uno o ambos ojos.
• Dolor de cabeza repentino, intenso o prolongado sin causa conocida.
• Pérdida de conciencia o desmayo con o sin convulsiones.
Los síntomas temporales sugieren que se trata de un accidente isquémico transitorio (AIT).
Los síntomas del infarto de miocardio (IM) pueden incluir:
• Dolor, malestar, presión, pesadez, sensación de opresión o plenitud en el pecho, el brazo o debajo del esternón.
• Molestias que se irradian a la espalda, la mandíbula, la garganta, el brazo o el estómago.
• Sensación de saciedad, indigestión o ahogo.
• Sudoración, náuseas, vómitos o mareos.
• Debilidad extrema, ansiedad o dificultad para respirar.
• Latidos cardiacos rápidos o irregulares.
Tumores: En algunos estudios epidemiológicos se ha notificado un aumento del riesgo de cáncer de cuello uterino en usuarias de AOC a largo plazo, pero sigue habiendo controversia sobre hasta qué punto este hallazgo es atribuible a los efectos de confusión del comportamiento sexual y otros factores como el virus del papiloma humano (VPH).
Un metaanálisis de 54 estudios epidemiológicos informó de que existe un riesgo relativo ligeramente mayor (RR = 1,24) de que se diagnostique cáncer de mama en mujeres que actualmente utilizan AOC. Durante los 1O años posteriores al cese del uso de AOC, este aumento del riesgo vuelve gradualmente al riesgo de fondo relacionado con la edad. Dado que el cáncer de mama es poco frecuente en mujeres menores de 40 años, el exceso de diagnósticos de cáncer de mama en usuarias actuales y recientes de AOC es pequeño en relación con el riesgo global de cáncer de mama. Estos estudios no aportan pruebas de causalidad. El patrón observado de mayor riesgo puede deberse a un diagnóstico más precoz del cáncer de mama en usuarias de AOC, a los efectos biológicos de los AOC o a una combinación de ambos. Los cánceres de mama diagnosticados en las usuarias habituales tienden a estar clínicamente menos avanzados que los diagnosticados en las no usuarias.
En casos aislados, estos tumores han provocado hemorragias intraabdominales potencialmente mortales. En casos aislados, estos tumores han provocado hemorragias intraabdominales potencialmente mortales. Debe considerarse un tumor hepático en el diagnóstico diferencial cuando se produzca dolor abdominal superior, aumento del tamaño del hígado o signos de hemorragia intraabdominal en mujeres que toman AOC.
Los tumores malignos pueden poner en peligro la vida o ser mortales.
Otras afecciones: Las mujeres con hipertrigliceridemia o antecedentes familiares de la misma pueden tener un mayor riesgo de pancreatitis al utilizar AOC.
Aunque se han notificado pequeños aumentos de la tensión arterial en muchas mujeres que toman AOC, son raros los aumentos clínicamente relevantes. Sin embargo, si durante el uso de un AOC se produce una elevación constante de la tensión arterial, es preferible que el médico interrumpa el anticonceptivo oral combinado y trate la hipertensión como medida de precaución. Cuando se considere apropiado, puede reanudarse el uso de AOC si pueden alcanzarse valores normotensos con terapia antihipertensiva.
Se ha notificado la aparición o el empeoramiento de las siguientes afecciones tanto con el embarazo como con el uso de AOC, pero las pruebas de una asociación con el uso de AOC no son concluyentes: ictericia y/o prurito, relacionados con colestasis, porfiria, lupus eritematoso sistémico, síndrome urémico hemolítico, corea de Sydenham, herpes gestacional, pérdida de audición relacionada con otosclerosis.
Los estrógenos exógenos pueden inducir o exacerbar los síntomas del angioedema hereditario y adquirido.
Las alteraciones agudas o crónicas de la función hepática pueden requerir la interrupción del uso de AOC hasta que los marcadores de la función hepática vuelvan a la normalidad. La recurrencia de ictericia colestásica que ocurrió previamente durante el embarazo o durante el uso previo de esteroides sexuales requiere la interrupción del uso de AOC.
Aunque los AOC pueden tener un efecto sobre la resistencia periférica a la insulina y la tolerancia a la glucosa, no existen pruebas de la necesidad de alterar el régimen terapéutico en mujeres diabéticas que utilicen AOC a dosis bajas (< 0,05 mg de etinilestradiol). Sin embargo, las mujeres diabéticas deben ser observadas cuidadosamente.
La enfermedad de Crohn y la colitis ulcerosa pueden asociarse al uso de AOC.
Ocasionalmente puede aparecer cloasma, especialmente en mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia al cloasma deben evitar la exposición al sol o a la radiación ultravioleta mientras toman este preparado.
El estado de ánimo depresivo y la depresión son efectos indeseables bien conocidos del uso de anticonceptivos hormonales (ver Reacciones secundarias y adversas). La depresión puede ser grave y es un conocido factor de riesgo de comportamiento suicida y suicidio. Se debe aconsejar a las pacientes que se pongan en contacto con su médico en caso de cambios de humor y síntomas depresivos, incluso poco después de iniciar el tratamiento.
Exámenes médicos/consulta: Antes de iniciar o reinstaurar KELZY® se debe realizar un historial médico completo (incluyendo antecedentes familiares) y descartar un embarazo. Se debe medir la presión arterial y realizar un examen físico, guiándose por las Contraindicaciones y Precauciones generales. Es importante concientizar a la paciente sobre la información relativa a la trombosis venosa y arterial, incluyendo el riesgo de DENOMINACIÓN DISTINTIVA® en comparación con otros AOC, los síntomas de TEV y TEA, los factores de riesgo conocidos y qué hacer en caso de sospecha de trombosis.
También se debe instruir a la paciente para que lea detenidamente el instructivo y siga los consejos que se le den. La frecuencia y la naturaleza de los exámenes deben basarse en directrices prácticas establecidas y adaptarse a cada paciente.
Debe advertirse a las pacientes que los anticonceptivos hormonales no protegen contra las infecciones por VIH (SIDA) y otras enfermedades de transmisión sexual.
Reducción de la eficacia: La eficacia de los AOC puede verse reducida en caso de, por ejemplo, olvido de tabletas (ver Dosis y vía de administración), alteraciones gastrointestinales (ver Dosis y vía de administración), o cuando se toman concomitantemente algunos otros medicamentos (ver Interacciones medicamentosas y de otro género).
Control del ciclo: Con todos los AOC pueden producirse hemorragias irregulares (manchado o hemorragias no programadas), especialmente durante los primeros meses de uso. Por lo tanto, la evaluación de cualquier sangrado irregular sólo tiene sentido después de un intervalo de adaptación de unos tres ciclos.
Si la hemorragia o las irregularidades hemorrágicas persisten o se producen después de ciclos previamente regulares, deben considerarse causas no hormonales y están indicadas medidas diagnósticas adecuadas para excluir malignidad o embarazo. Éstas también pueden incluir el legrado uterino.
Es posible que en algunas mujeres no se produzca la hemorragia programada durante el intervalo libre de tratamiento. Si el AOC se ha tomado de acuerdo con las instrucciones descritas en Dosis y vía de administración es improbable que se produzca un embarazo. Sin embargo, si la toma no se ha realizado de acuerdo con estas instrucciones antes de la primera hemorragia por deprivación o si se omiten dos hemorragias por deprivación, debe descartarse un embarazo antes de continuar con el uso del AOC.
KELZY® contiene lactosa: Los pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia total de lactasa o malabsorción de glucosa-galactosa no deben tomar este medicamento.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
Dosis: Tomar una tableta al día, aproximadamente a la misma hora, durante 28 días consecutivos (una tableta blanca, activa, durante los primeros 24 días, una tableta verde, inactiva, durante los 4 días siguientes) sin intervalo libre entre cada blíster. Las tabletas deben tomarse aproximadamente a la misma hora del día cada día, si es necesario con algo de líquido.
Una hemorragia programada suele comenzar el día 2-3 después de la última tableta activa y puede continuar durante los 4 primeros días (Días 1-4) del ciclo siguiente.
Cómo empezar KELZY®:
Sin uso previo de anticonceptivos hormonales en el último mes: El primer día del ciclo (primer día de la hemorragia menstrual) comenzará con la toma. Si se toma correctamente, la anticoncepción comienza el primer día de la toma. Si la toma comienza entre los días 2 y 5, durante los primeros 7 días de toma de la tableta se debe utilizar adicionalmente un método anticonceptivo no hormonal (métodos de barrera).
Cambio de un anticonceptivo hormonal combinado (anticonceptivo oral combinado (AOC), anillo vaginal, parche transdérmico): La mujer debe empezar con KELZY® preferiblemente al día siguiente de la última tableta intervalo habitual sin tabletas o de la última tableta sin sustancias activas (placebo) de su AOC anterior. En caso de que se haya utilizado un anillo vaginal o un parche transdérmico, la mujer deberá empezar a utilizar KELZY® preferentemente el día de su retirada, pero a más tardar cuando le hubiera correspondido la siguiente aplicación.
Cambio desde un método de progestágeno solo (píldora de progestágeno solo, implantes, inyectables) o desde un sistema intrauterino liberador de progestágeno (SIU):
La mujer puede cambiar cualquier día de la píldora de progestágeno solo (el cambio de un implante o del SIU debe ser el día de la retirada y el cambio de un inyectable cuando le correspondería la siguiente inyección). En cualquier caso, se exige además el uso de un método de barrera durante los 7 primeros días de toma de las tabletas.
Después de un aborto en el primer trimestre: La mujer puede empezar a tomar KELZY® inmediatamente. Al hacerlo, no necesita medidas anticonceptivas adicionales.
Después del parto o aborto del segundo trimestre: Se debe aconsejar a la mujer que inicie la toma de anticonceptivos orales entre 21 y 28 días después del parto en el caso de madres no lactantes o después de un aborto en el segundo trimestre. Durante los primeros 7 días de toma, debe utilizarse adicionalmente un método anticonceptivo no hormonal (método de barrera). Si ya ha habido relaciones sexuales, debe excluirse el embarazo o es necesario esperar hasta la primera menstruación espontánea antes de empezar a tomar el medicamento.
Para el uso durante el periodo de lactancia, ver Restricciones de uso durante el embarazo y la lactancia.
Toma de las tabletas olvidadas: La fiabilidad anticonceptiva puede disminuir si se omiten las tabletas blancas y en particular si las tabletas se omiten durante los primeros días del envase.
Si la mujer se retrasa menos de 24 horas en la toma de la tableta blanca (fármaco), la tableta debe tomarse inmediatamente y el tratamiento debe continuar normalmente, tomando la siguiente tableta a la hora habitual. La protección anticonceptiva no se reduce.
Si la mujer se retrasa más de 24 horas en la toma de cualquier tableta blanca (fármaco), puede reducirse la protección anticonceptiva. La última tableta olvidada debe tomarse inmediatamente aunque esto signifique tomar dos tabletas en un día. A continuación, siga tomando las tabletas a la hora habitual. Además, debe utilizar un método de barrera (preservativos, espermicidas, etc.) hasta que haya completado 7 días ininterrumpidos de toma de tabletas blancas. Si estos siete días se prolongan más allá de la última tableta blanca del envase actual, el siguiente envase debe iniciarse al día siguiente de la toma de la última tableta blanca del envase actual y deben desecharse todas las tabletas verdes inactivas (placebo). Es poco probable que la paciente tenga una hemorragia programada hasta el intervalo de tabletas verdes inactivas del segundo envase, pero puede experimentar manchado o hemorragia intermenstrual.
Si la paciente no tiene una hemorragia programada al final del segundo envase, debe excluirse la posibilidad de embarazo antes de reanudar la toma de las tabletas.
Los errores en la toma de una o varias tabletas verdes no tienen consecuencias, siempre que el intervalo entre la última tableta blanca del envase en curso y la primera tableta blanca del envase siguiente no sea superior a cuatro días.
Toma durante trastornos gastrointestinales: En caso de trastornos gastrointestinales graves (por ejemplo, vómitos o diarrea), la absorción puede no ser completa y deben tomarse medidas anticonceptivas adicionales. Si se producen vómitos en las 3-4 horas siguientes a la toma de la tableta blanca, debe tomarse una nueva tableta (de sustitución) lo antes posible. Si es posible, la nueva tableta blanca debe tomarse en las 24 horas siguientes a la toma habitual. Si transcurren más de 24 horas, se aplicarán los consejos relativos a las tabletas olvidadas que figuran en la Dosis y vía de administración "Toma de las tabletas olvidadas". Si la paciente no desea modificar su horario habitual de toma de tabletas, deberá tomar la tableta o tabletas blancas sobrantes de otro blíster.
Aplazamiento de un sangrado programado: Para retrasar una menstruación la paciente debe continuar con el siguiente blíster de KELZY® sin intervalo sin tabletas. La toma puede prolongarse tanto como se desee, como máximo hasta el final del segundo envase. Durante la toma del segundo envase la paciente puede experimentar sangrado o manchado no programado. La toma regular de KELZY® se reanuda entonces tras el intervalo habitual de toma de placebo de 4 días.
Para trasladar la menstruación a otro día de la semana distinto al que la paciente está acostumbrada con su esquema actual, se le puede aconsejar que acorte su próximo intervalo sin tabletas tantos días como desee. Cuanto más corto sea el intervalo, mayor será el riesgo de que no tenga una hemorragia programada y experimente una hemorragia no programada o manchado durante el siguiente envase (igual que cuando se retrasa un periodo).
Información adicional para grupos especiales de pacientes:
Población pediátrica: La seguridad y eficacia de KELZY® se ha establecido en mujeres en edad reproductiva. Se espera que la seguridad y la eficacia sean las mismas en adolescentes pospúberes menores de 18 años y en usuarias de 18 años o más. No está indicado el uso de este producto antes de la menarquia.
Pacientes de edad avanzada: No aplica. KELZY®no está indicado después de la menopausia.
Pacientes con insuficiencia hepática: KELZY® está contraindicado en mujeres con enfermedades hepáticas graves (ver Contraindicaciones).
Pacientes con insuficiencia renal: KELZY® no se ha estudiado específicamente en pacientes con alteración de la función renal. Los datos disponibles no sugieren un cambio en el tratamiento en esta población de pacientes.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
La toxicidad oral aguda del etinilestradiol y el dienogest es muy baja. Si, por ejemplo, un niño toma varias tabletas de KELZY® al mismo tiempo, es poco probable que se produzcan síntomas tóxicos como consecuencia de ello. Los síntomas que pueden aparecer en tal caso son náuseas y vómitos y hemorragias inesperadas. Incluso, pueden producirse hemorragias vaginales en niñas antes de la menarquia, si toman accidentalmente el medicamento. Normalmente no se requiere un tratamiento específico. En caso necesario, debe administrarse un tratamiento de apoyo.
PRESENTACIÓN:
Caja con 24 tabletas blancas (activo) y 4 tabletas verdes (placebo) e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese la caja bien cerrada a no más de 25 ºC.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Léase instructivo anexo. Su venta requiere receta médica. No se deje al alcance de los niños. No se deberá usar en menores de 18 años. No se use en el embarazo ni en la lactancia.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx. y farmacovigilanciamx@exeltis.com.
Titular:
Laboratorios León Farma S.A.
Polígono Industrial Navatejera,
C/La Vallina s/n,
Villaquilambre-León, 24193, León, España.
Representante Legal:
EXELTIS PHARMA MÉXICO, S.A. de C.V.
Avenida Revolución, No 1267,
Piso 19, Col. Los Alpes, C.P. 01040,
Álvaro Obregón, Ciudad de México, México
Reg. Núm. 105M2025 SSA IV