
LYNPARZA®
OLAPARIB
Cápsulas
1 Caja, 4 Frasco(s), 112 Cápsulas, 50 mg
FORMA FARMACÉUTICA Y FORMULACIÓN
Cada CÁPSULA dura contiene:
Olaparib 50 mg
Excipiente, cbp Una cápsula
INDICACIONES TERAPÉUTICAS
LYNPARZA está indicado como monoterapia para el tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial seroso de grado elevado, cáncer de trompas de Falopio, o cáncer peritoneal primario, recurrentes con sensibilidad al platino, que contengan mutación en BRCA (germinal y/o somática), que respondan (respuesta completa o parcial) a la quimioterapia basada en platino.
FARMACOCINÉTICA Y FARMACODINAMIA
Farmacocinética
La farmacocinética de LYNPARZA en la dosis de una cápsula de 400 mg dos veces al día, se caracterizan por una depuración plasmática aparente de ~ 8.6 L/h, un volumen aparente de distribución de ~ 167 L y una vida media terminal de 11.9 horas.
Absorción
Después de la administración oral de LYNPARZA a través de la formulación de cápsula, la absorción es rápida, con concentraciones máximas en plasma alcanzadas típicamente entre 1 a 3 horas después de la dosificación. En dosificaciones múltiples no hay acumulación marcada, con exposiciones del estado estacionario alcanzadas en ~ 3-4 días.
La coadministración con alimentos disminuyó la tasa (tmáx retrasado por 2 horas) y marginalmente aumentó el grado de absorción de LYNPARZA (el ABC aumentó aproximadamente un 20%). Por lo tanto, se recomienda que las pacientes tomen LYNPARZA al menos una hora después de la comida, y se abstengan de comer preferentemente hasta 2 horas después (véase sección de Dosis y vía de administración).
Distribución
La unión a proteína in vitro de LYNPARZA a concentraciones plasmáticas alcanzadas después de la dosificación a 400 mg dos veces al día es de ~ 82%. LYNPARZA se une moderadamente a ASH (Albúmina Sérica Humana) de forma no saturable (55% aproximadamente) y débilmente (35% aproximadamente) a AAG (Ácido Alfa-1 Glicoproteina).
Biotransformación
In vitro, se demostró que CYP3A4 es la principal enzima responsable del metabolismo de LYNPARZA. (véase la sección de Interacciones medicamentosas y de otro género).
Después de la administración oral de 14C-olaparib a pacientes del sexo femenino, LYNPARZA sin cambios representó la mayor parte de la radioactividad circulante en el plasma (70%) y fue el principal componente encontrado en la orina y las heces (15% y 6% de la dosis, respectivamente). El metabolismo de LYNPARZA es extenso. La mayoría del metabolismo se atribuyó a las reacciones de oxidación con un número de los componentes producidos sometidos a una subsecuente conjugación a glucurónido o sulfato. Se detectaron hasta 20, 37 y 20 metabolitos en el plasma, orina y heces, respectivamente, en su mayoría representando < 1% del material dosificado.
Los dos principales componentes circulantes fueron una fracción de anillo abierto de hidroxiciclopropil, y dos metabolitos mono-oxigenados (cada uno de ~ 10%), con uno de los metabolitos mono-oxigenados siendo también el metabolito principal en el excremento (6% y 5% de la radiactividad urinaria y fecal respectivamente).
In vitro, LYNPARZA produjo poca/ninguna inhibición de CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 o 2E1 y no se espera que sea un inhibidor dependiente de tiempo clínicamente significativo de cualquiera de las enzimas P-450.
Los datos in vitro también muestran que olaparib no es un sustrato para OATP1B1, OATP1B3, OCT1, BCRP o MRP2 y no es un inhibidor de OATP1B3, OAT1 o MRP2.
Eliminación
Tras una dosis única de 14C-olaparib, ~ 86% de la radioactividad dosificada se recuperó dentro de un periodo de recolección de 7 días, ~ 44% a través de la orina y ~ 42% a través de las heces. La mayoría del material se excreta en forma de metabolitos.
Poblaciones especiales
Insuficiencia renal
En pacientes con insuficiencia renal leve (depuración de creatinina de 51 a 80 ml / min), el ABC aumentó en un 24% y la Cmax en un 15% en comparación con las pacientes con función renal normal. No se requiere ajuste de dosis de LYNPARZA en pacientes con insuficiencia renal leve.
En pacientes con insuficiencia renal moderada (depuración de creatinina de 31 a 50 ml / min), el ABC incrementó un 44% y la Cmáx un 26% comparado con las pacientes con función renal normal. Se recomienda un ajuste de dosis de LYNPARZA en pacientes con insuficiencia renal moderada (ver sección Dosis y Vía de administración).
No hay datos en pacientes con insuficiencia grave (depuración de creatinina < 30 ml / min).
Insuficiencia hepática
En pacientes con insuficiencia hepática leve (Clase A según Child-Pugh), el ABC aumentó en un 15% y la Cmáx en un 13% en comparación con las pacientes con función hepática normal. No se requiere ajuste de dosis de LYNPARZA en pacientes con insuficiencia hepática leve (ver sección Dosis y vía de administración). No hay datos en pacientes con insuficiencia hepática moderada o grave.
Personas mayores
Existen datos limitados en pacientes de 75 años y más. Un análisis de la población de los datos disponibles no encontró relación entre las concentraciones plasmáticas de LYNPARZA y la edad del paciente.
Peso
No existen datos en pacientes obesas (IMC > 30 kg/m2) o bajos de peso (IMC < 18 kg/m2). Un análisis de población de los datos disponibles no encontró pruebas de que el peso del paciente afecta las concentraciones plasmáticas de LYNPARZA.
Raza
No hay datos suficientes para evaluar el efecto potencial de la raza en la farmacocinética de LYNPARZA ya que la experiencia clínica es predominantemente caucásicas (94% de las pacientes incluidas en el análisis de la población eran caucásicas). En los escasos datos disponibles, no hubo pruebas de una diferencia étnica marcada en la FC de LYNPARZA entre las pacientes japonesas y caucásicas.
Población pediátrica
No se realizaron estudios para investigar la farmacocinética de LYNPARZA en pacientes pediátricas.
Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros agentes antineoplásicos, código ATC: L01XX46
Mecanismo de acción y efectos farmacodinámicos
LYNPARZA es un potente inhibidor de las enzimas polimerasas poli (ADP-ribosa) humanas (PARP-1, PARP-2, y PARP-3), y se demostró que inhibe in vitro el crecimiento de líneas celulares tumorales seleccionadas y de crecimiento tumoral in vivo ya sea como un tratamiento independiente o en combinación con quimioterapias establecidas.
Las PARP son necesarias para la reparación eficiente de rupturas de cadena sencilla de ADN y un aspecto importante de la reparación inducida por PARP requiere que después de la modificación de la cromatina, PARP se automodifique y disocie del ADN para facilitar el acceso de las enzimas de reparación por escisión de base (BER por sus siglas en inglés). Cuando LYNPARZA está unido al sitio activo de la PARP asociada a ADN evita la disociación de PARP y lo atrapa en el ADN, bloqueando así la reparación. En células en replicación, esto lleva a rupturas de la cadena doble de ADN (DSB por sus siglas en inglés) cuando las horquillas de replicación se encuentran con el aducto PARP-ADN. En las células normales, la reparación de recombinación homóloga (R por sus siglas en inglés), que requiere genes BRCA1 y 2 funcionales, es eficaz en la reparación de estas rupturas de la cadena doble de ADN. En ausencia de BRCA1 o 2 funcional, las DSB de ADN no pueden ser reparadas a través de HRR. En lugar de ello, se activan las vías alternativas y propensas a errores, tales como la vía de unión de extremos no homólogos (NHEJ por sus siglas en inglés), que conducen a un aumento de la inestabilidad genómica. Después de serie de ciclos de replicación, la inestabilidad genómica puede alcanzar niveles insoportables y resultar en la muerte de células cancerosas, ya que las células cancerosas tienen una alta carga de ADN dañado con respecto a las células normales.
En modelos in vivo deficientes de BRCA, LYNPARZA administrada después de tratamiento de platino dio como resultado un retraso en la progresión del tumor y un aumento en la supervivencia general en comparación con el tratamiento de platino solo.
Detección de la mutación BRCA
Los pacientes son elegibles para el tratamiento de LYNPARZA si tienen una mutación de BRCA deletérea confirmada o sospechada (es decir, una mutación que interrumpe la función normal del gen), ya sea en la línea germinal o el tumor (detectada usando una prueba validada adecuadamente).
Eficacia clínica
Se estudió, la seguridad y eficacia de LYNPARZA como un tratamiento de mantenimiento en el tratamiento de cáncer de ovario seroso de alto grado recidivante sensible al platino (RSP), incluyendo pacientes con cáncer de trompa de Falopio o peritoneal primario, después del tratamiento con dos o más esquemas que contienen platino, en un estudio de Fase II, aleatorizado, doble ciego, controlado con placebo (estudio 19). El estudio comparó la eficacia del tratamiento de mantenimiento LYNPARZA tomado hasta la progresión sin tratamiento de mantenimiento en 265 (136 LYNPARZA y 129 placebo) pacientes con cáncer de ovario seroso RSP que tuvieron respuesta (RC [respuesta completa] o RP [respuesta parcial]) confirmadas según RECIST y/o según los criterios de CA-125 definidos por el Intergrupo de Cáncer Ginecológico (GCIG por sus siglas en inglés) (al menos una reducción del 50% en niveles CA-125, desde la última muestra de pretratamiento, confirmada 28 días después) tras la terminación de dos o más quimioterapias previas con platino. El criterio de valoración primario fue SLP (supervivencia libre de progresión) con base en la valoración del investigador mediante RECIST 1.0. Los criterios de valoración secundarios de eficacia incluyeron SG (supervivencia general), TCE (tasa de control de la enfermedad) definida como RC/RP + EE (enfermedad estable) confirmada, CVRS (calidad de vida relacionada con la salud), y los síntomas relacionados con la enfermedad. También se realizaron análisis exploratorios del tiempo hasta el primer tratamiento posterior o la muerte (TPTP) y el tiempo hasta el segundo tratamiento posterior o la muerte (TSTP- una aproximación de SLP2).
Sólo se reclutaron pacientes RSP con enfermedad parcialmente sensible al platino (intervalo libre de platino de 6 a 12 meses) y pacientes con enfermedad sensible al platino (intervalo libre de platino > 12 meses) que tuvieron respuesta tras la terminación de la última quimioterapia basada en platino. Las pacientes no podían haber recibido tratamiento previo de LYNPARZA u otro inhibidor de PARP. Las pacientes podrían haber recibido previamente bevacizumab, excepto en el esquema inmediatamente antes de la aleatorización. No se permitió el retratamiento con LYNPARZA después de la progresión en LYNPARZA.
Las pacientes fueron aleatorizadas en el estudio por una mediana de 40 días después de completar su última quimioterapia de platino. Ellos recibieron un promedio de 3 esquemas previos de quimioterapia (rango 2-11) y 2.6 quimioterapias previas con platino (rango 2-8).
Las pacientes en el grupo de LYNPARZA continuaron recibiendo tratamiento por más tiempo que aquellos en el grupo de placebo. Un total de 54 (39.7%) pacientes recibieron tratamiento durante > 12 meses en el grupo de LYNPARZA en comparación con 14 (10.9%) pacientes del grupo de placebo.
El estudio cumplió su objetivo primario de SLP mejorada estadísticamente significativa para la monoterapia de mantenimiento de LYNPARZA en comparación con el placebo en la población general (CR 0.35, IC del 95% 0.25 a 0.49; p < 0.00001), además, el análisis de subgrupos preplanificado por estado de mutación de BRCA, identificó a pacientes con cáncer de ovario con BRCA mutado (n = 136, 51.3%) como el subgrupo que derivó el mayor beneficio clínico de la monoterapia de mantenimiento con LYNPARZA.
En las pacientes con BRCA mutado (n = 136) hubo una mejoría estadísticamente significativa en SLP, TPTP y TSTP. La mediana de mejoría de SLP fue de 6.9 meses sobre el placebo para pacientes tratadas con LYNPARZA (CR 0.18; IC del 95%: 0.10-0.31; p < 0.00001; mediana de 11.2 meses frente a 4.3 meses). La evaluación del investigador de SLP fue consistente con una revisión radiológica central independiente ciega de SLP. El tiempo desde la aleatorización hasta el inicio del primer tratamiento posterior o la muerte (TPTP) fue 9.4 meses más para pacientes tratadas con LYNPARZA (CR 0.33; IC del 95%: 0.22-0.50; p < 0.00001; mediana de 15.6 meses frente a 6.2 meses). El tiempo desde la aleatorización hasta el inicio del segundo tratamiento posterior o la muerte (TSTP) fue 8.6 meses más para pacientes tratadas con LYNPARZA (CR 0.44, IC del 95% 0.29 -0.67; p = 0.00013; mediana de 23.8 meses frente a 15.2 meses). No hubo diferencia estadísticamente significativa en la SG (CR 0.73, IC del 95% 0:45-1.17; p = 0.19; mediana de 34.9 meses frente a 31.9 meses). Dentro de la población de BRCA mutado la tasa de control de la enfermedad a las 24 semanas fue del 57 y 24% para las pacientes en los grupos de LYNPARZA y placebo, respectivamente.
No se observaron diferencias estadísticamente significativas entre LYNPARZA y placebo en pacientes que reportaron síntomas o CVRS como se midió por las tasas de mejora y empeoramiento en el índice de síntomas de ovarios FACT/NCCN (FOSI por sus siglas en inglés), índice de resultado de prueba (TOI por sus siglas en inglés) y puntación total del análisis funcional de la terapia de cáncer de ovario (FACT-O total por sus siglas en inglés).
Las principales conclusiones de eficacia del estudio 19 para pacientes con mutaciones BRCA se presentan en la Tabla 1, y en las figuras 1 y 2.
Tabla 1: Resumen de los resultados principales de eficacia para pacientes con cáncer de ovario RSP con BRCA mutado en Estudio 19
|
SLP |
N (eventos/pacientes) (%) |
Mediana SLP (meses) |
CRa |
IC del 95% |
Valor p |
|
LYNPARZA 400 mg db |
26/74 (35%) |
11.2 |
0.18 |
0.10-0.31 |
< 0.00001 |
|
Placebo |
46/62 (74%) |
4.3 |
|||
|
TSTP-una aproximación de SLP2 |
N |
Mediana TSTP (meses) |
CRa |
IC del 95% |
Valor p |
|
LYNPARZA 400 mg db |
42/74 (57%) |
23.8 |
0.44 |
0.29-0.67 |
0.00013 |
|
Placebo |
49/62 (79%) |
15.2 |
|||
|
SG interina (52% de madurez) |
N |
Mediana SG (meses) |
CRa |
IC del 95% |
Valor p |
|
LYNPARZA 400 mg db |
37/74 (50%) |
34.9 |
0.73 |
0.45-1.17 |
0.19 |
|
Placebob |
34/62 (55%) |
31.9 |
a CR = coeficiente de riesgo. Un valor < 1 favorece LYNPARZA. El análisis se realizó utilizando un modelo de riesgos proporcionales de Cox con factores de tratamiento, el tiempo hasta la progresión de la enfermedad en el penúltimo tratamiento de platino previo, la respuesta objetivo previa al último tratamiento con platino y ascendencia judía.
b Aproximadamente una cuarta parte de las pacientes tratadas con placebo en el subgrupo con BRCA mutado (14/62; 22.6%) recibieron un inhibidor de PARP posterior.
N Número de eventos/número de pacientes aleatorizadas; SG supervivencia general; SLP supervivencia libre de progresión; IC Intervalo de confianza; TSTP tiempo desde la aleatorización hasta el inicio del segundo tratamiento posterior o la muerte.
Figura 1 Estudio 19: gráfica Kaplan-Meier de SLP en pacientes con BRCA mutado (53% de valoración de investigador de la madurez)
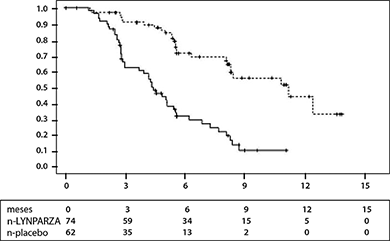
--- LYNPARZA 400 mg db dos veces al día, __ placebo, eje x = tiempo desde la aleatorización en meses, eje y = SLP (supervivencia libre de progresión), n-LYNPARZA = número de pacientes en riesgo-LYNPARZA, n - placebo = número de pacientes en riesgo-placebo.
Figura 2 Estudio 19: gráfica Kaplan-Meier de SG en pacientes con BRCA mutado (52% de madurez)
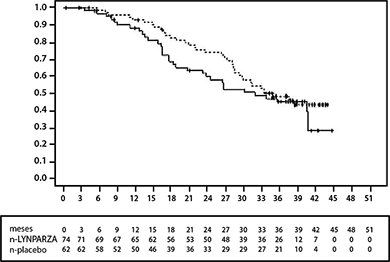
--- LYNPARZA 400 mg db dos veces al día, __ placebo, eje x = tiempo desde la aleatorización en meses, eje y = SG (supervivencia general), n-LYNPARZA = número de pacientes en riesgo-LYNPARZA, n - placebo = número de pacientes en riesgo-placebo.
En el Estudio 19, 18 pacientes fueron identificadas con un tumor somático con BRCA mutado (una mutación en el tumor, pero de tipo salvaje en la línea germinal). Los datos limitados para estas pacientes con tumores somáticos con BRCA mutado (sBRCA) muestran que el número de pacientes en LYNPARZA reportaron eventos de progresión o eventos de muerte en comparación con el placebo (Tabla 2).
Tabla 2 Resumen de la supervivencia libre de progresión y la supervivencia general: población de sBRCA mutado en el Estudio 19
|
N Eventos/pacientes (%) |
|
|
SLP |
|
|
LYNPARZA 400 mg db |
3/8 (38%) |
|
Placebo |
6/10 (60%) |
|
SG |
|
|
LYNPARZA 400 mg db |
4/8 (50%) |
|
Placebo |
6/10 (60%) |
Población pediátrica: La Agencia Europea de Medicamentos eximió de la obligación de presentar los resultados de los estudios con LYNPARZA en los diferentes grupos de población pediátrica, en carcinoma de ovario (excluyendo rabdomiosarcoma y tumores de células germinales) (véase sección de Dosis y vía de administración).
CONTRAINDICACIONES
Hipersensibilidad al fármaco o a los componentes de la fórmula, durante el embarazo y la lactancia y durante 1 mes después de haber recibido la última dosis de LYNPARZA (véase sección de Restricciones de uso durante el embarazo y la lactancia).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
Mujeres en edad fértil/anticoncepción en las mujeres Las mujeres en edad fértil no deben quedar embarazadas mientras toman LYNPARZA y no deben estar embarazadas al comienzo del tratamiento. Se debe realizar una prueba de embarazo en todas las mujeres premenopáusicas antes del tratamiento. Las mujeres en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento y durante 1 mes después de recibir la última dosis de LYNPARZA. Como no se puede excluir que LYNPARZA puede reducir la exposición a sustratos del CYP3A a través de la inducción de la enzima, la eficacia de los anticonceptivos hormonales se puede reducir si se administran de forma concomitante con LYNPARZA. Por lo tanto, se debe considerarse un método anticonceptivo no hormonal adicional y pruebas de embarazo regulares durante el tratamiento (véase sección de Interacciones medicamentosas y de otro género).
Embarazo
Los estudios en animales mostraron toxicidad reproductiva, incluyendo efectos teratogénicos graves y efectos en la supervivencia embriofetal en ratas a exposiciones sistémicas maternas inferiores a las de los humanos en dosis terapéuticas (véase sección Farmacocinética y farmacodinamia). No hay datos sobre el uso de LYNPARZA en mujeres embarazadas, sin embargo, con base en el modo de acción de LYNPARZA, LYNPARZA no debe utilizarse durante el embarazo y en mujeres en edad fértil que no utilicen métodos anticonceptivos confiables durante el tratamiento y durante 1 mes después de recibir la última dosis de LYNPARZA. (Véase el párrafo anterior: "mujeres en edad fértil/anticoncepción en las mujeres" para obtener más información sobre métodos anticonceptivos y pruebas de embarazo).
Lactancia
No hay estudios en animales sobre la excreción de LYNPARZA en la leche materna. Se desconoce si LYNPARZA o sus metabolitos se excretan en la leche humana. LYNPARZA está contraindicado durante la lactancia y durante 1 mes después de recibir la última dosis, dada la propiedad farmacológica del producto (véase sección de Contraindicaciones).
Fertilidad
No existen datos clínicos sobre la fertilidad. En estudios con animales, no se observó ningún efecto sobre la concepción, pero hay efectos adversos sobre la supervivencia embriofetal (véase sección de Contraindicaciones).
REACCIONES SECUNDARIAS Y ADVERSAS
Resumen del perfil de seguridad
La monoterapia con LYNPARZA se asoció con reacciones adversas generalmente de gravedad leve o moderada (CTCAE 1 o 2) y generalmente no requieren la interrupción del tratamiento. Las reacciones adversas observadas con mayor frecuencia entre los estudios clínicos en pacientes que recibieron monoterapia con LYNPARZA (≥ 10%) fueron náuseas, vómitos, diarrea, dispepsia, fatiga, cefalea, alteración del gusto, disminución del apetito, mareos, anemia, neutropenia, linfopenia, elevación del volumen corpuscular medio, y aumento de la creatinina.
Lista tabulada de reacciones adversas
Las siguientes reacciones adversas fueron identificadas en los estudios clínicos con pacientes que recibieron monoterapia con LYNPARZA. Su frecuencia se presenta utilizando la clasificación de frecuencia CIOMS III y luego enlistada por Clasificación de órganos y sistemas de MedDRA (SOC, por sus siglas en inglés) y al nivel de término preferido. Las frecuencias de aparición de reacciones adversas se definen como: muy comunes (≥ 1/10); comunes (≥ 1/100 a < 1/10); no comunes (≥ 1/1,000 a < 1/100); poco frecuentes (≥ 1/10,000 a < 1/1000); muy poco frecuentes (< 1/10,000). Esta sección incluye sólo los datos derivados de estudios terminados donde se sabe la exposición del paciente.
Tabla 3 Lista tabulada de reacciones adversas
|
Reacciones adversas |
||
|
Clasificación de órganos y sistema de MedDRA |
Frecuencia de todos los grados CTCAE |
Frecuencia de grado CTCAE 3 y mayor |
|
Trastornos del sistema inmune |
Común Salpullido |
|
|
Poco común Hipersensibilidad, dermatitis |
||
|
Trastornos de metabolismo y nutrición |
Muy común Disminución de apetito |
No común Disminución de apetito |
|
Trastornos del sistema nervioso |
Muy común Cefalea, mareo, alteración del gusto |
No común Cefálea, mareo |
|
Trastorno gastrointestinal |
Muy común Náuseas, vómitos, diarrea, dispepsia |
Común Náuseas, vómitos, diarrea |
|
Común Dolor abdominal superior, estomatitis |
No común Dolor abdominal superior, estomatitis |
|
|
Trastornos generales y alteraciones en el sitio de administración |
Muy común Fatiga (incluyendo astenia) |
Común Fatiga (incluyendo astenia) |
|
Investigaciones |
Muy común Anemia (disminución de la hemoglobina),a,b neutropenia (disminución en el recuento absoluto de neutrófilos),a,b linfopenia (disminución de linfocitos) a,b Aumento de la creatinina en sangre,a,d elevación del volumen corpuscular medio a,c |
Muy común Anemia (disminución de la hemoglobina),a,b linfopenia (disminución de linfocitos) a,b |
|
Común Trombocitopenia (disminución de las plaquetas) a,b |
Común Neutropenia (disminución en el recuento absoluto de neutrófilos) a,b Trombocitopenia (disminución de las plaquetas) a,b |
|
|
No común Aumento de creatinina en sangre a,d |
||
a. El término Exantema incluye los términos preferidos (PT, por sus siglas en inglés) exantema, exantema eritematoso, exantema generalizado, exantema maculoso, exantema maculopapuloso, exantema papuloso, exantema pruriginoso, exantema exfoliativo y exantema generalizado. El término Hipersensibilidad incluye los PT hipersensibilidad e hipersensibilidad a medicamentos. El término Dermatitis incluye los PT dermatitis, dermatitis alérgica y dermatitis exfoliativa.
b. Representa la incidencia de los hallazgos de laboratorio, no de eventos adversos reportados.
c. Los descensos fueron CTCAE grado 2 o superior para la hemoglobina, neutrófilos absolutos, plaquetas y linfocitos.
d. La elevación en el volumen corpuscular medio desde el valor basal hasta por encima del LSN (límite superior al normal). Los niveles parecían volver a la normalidad después de la interrupción del tratamiento y no parece haber consecuencias clínicas.
e. Los datos de un estudio doble ciego controlado con placebo mostró una mediana de aumento (cambio percentual respecto al valor basal) hasta el 23% restante consistente en el tiempo y el regreso a la línea de base después de la interrupción del tratamiento, sin secuelas clínicas evidentes. El 90% de las pacientes tenían CTCAE grado 0 al valor basal, y el 10% tenían CTCAE grado 1 al valor basal.
Descripción de reacciones adversas seleccionadas
Las toxicidades gastrointestinales son frecuentes con la terapia de LYNPARZA y son generalmente de grado bajo (CTCAE de grado 1 o 2) e intermitentes y puede ser destinada mediante interrupción de la dosis, reducción de la dosis y/o fármacos concomitantes (por ejemplo, tratamiento antiemético). No se requiere profilaxis antiemética.
La anemia y otras toxicidades hematológicas son generalmente de bajo grado (CTCAE grado 1 o 2); sin embargo, hay informes de CTCAE grado 3 y eventos mayores. Se recomiendan las pruebas en el valor basal, seguidas de un control mensual de los recuentos sanguíneos completos para los primeros 12 meses de tratamiento y periódicamente después de este tiempo para supervisar los cambios clínicamente significativos en cualquier parámetro durante el tratamiento que pueda requerir la interrupción de la dosis o la reducción y/o tratamiento adicional.
Población pediátrica
No se realizaron estudios en pacientes pediátricas.
Otras poblaciones especiales
Están disponibles datos limitados sobre la seguridad en personas mayores (edad ≥ 75 años) y pacientes no caucásicas.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
Genotoxicidad
LYNPARZA no mostró potencial mutagénico, pero fue blastogénico en células de mamíferos in vitro. Cuando se dosificó por vía oral a ratas, LYNPARZA indujo micronúcleos en la médula ósea. Esta clastogenicidad es coherente con la farmacología conocida de LYNPARZA e indica potencial de genotoxicidad en el hombre.
Toxicidad por dosis repetida
En estudios de toxicidad de dosis repetidas de hasta 6 meses de duración en ratas y perros, las dosis orales diarias de LYNPARZA fueron bien toleradas. El principal órgano blanco para toxicidad en ambas especies fue la médula ósea, con los cambios asociados en los parámetros hematológicos periféricos. Estos hallazgos se observaron con exposiciones por debajo de los observados clínicamente y fueron en gran parte reversibles dentro de las 4 semanas de suspender la administración.
Estudios con células de la médula ósea humana también demostraron que la exposición directa a LYNPARZA puede producir toxicidad en células de la médula ósea en ensayos ex vivo.
Toxicología reproductiva
En un estudio de fertilidad femenina donde las ratas se dosificaron hasta la implantación, aunque esto prolongado se observó en algunos animales, la tasa de rendimiento de apareamiento y embarazo no fue afectada. Sin embargo, hubo una ligera reducción en la supervivencia embrionaria.
Los estudios de desarrollo embriofetal en ratas, y en niveles de dosis que no inducen toxicidad materna significativa, LYNPARZA causó disminución de la supervivencia embriofetal, redujo el peso fetal y anomalías fetales de desarrollo, incluyendo malformaciones oculares (por ejemplo, anoftalmia, microftalmia), malformación vertebral/costillas, y anomalías viscerales y esqueléticas.
Carcinogenicidad
No se realizaron estudios de carcinogenicidad con LYNPARZA.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Interacciones farmacodinámicas
Los estudios clínicos de LYNPARZA en combinación con otros fármacos anticancerígenos, incluyendo agentes que dañan el ADN, indican una potenciación y prolongación de la toxicidad mielosupresora. La dosis recomendada de la monoterapia con LYNPARZA no es adecuada para la combinación con otros medicamentos anticancerígenos.
La combinación de LYNPARZA con vacunas o agentes inmunosupresores no fue estudiada. Por lo tanto, se debe tener precaución si estos fármacos son co-administrados con LYNPARZA y las pacientes deben ser estrechamente monitoreadas.
Interacciones farmacocinéticas
Efectos de otros fármacos sobre LYNPARZA
CYP3A4/5 son las isoenzimas predominantemente responsables de la depuración metabólica de LYNPARZA.
Un estudio clínico para evaluar el impacto de rifampicina, un inductor conocido del CYP3A, ha demostrado que la co-administración con LYNPARZA disminuye la Cmáx media de LYNPARZA en un 71% (cociente del tratamiento: 0.29; IC del 90%: 0.24 - 0.33) y el ABC media en un 87% (cociente del tratamiento: 0.13; IC del 90%: 0.11 - 0.16).
Por lo tanto, se recomienda evitar la administración de inductores potentes conocidos de esta isoenzima (por ejemplo, fenitoína, rifampicina, rifapentina, carbamazepina, nevirapina, fenobarbital y hierba de San Juan) con LYNPARZA, ya que es posible que la eficacia de LYNPARZA pueda reducirse de forma sustancial. La magnitud del efecto de inductores de moderados a potentes (por ejemplo, efavirenz, rifabutina) sobre la exposición a LYNPARZA aún no se ha establecido, por lo tanto, la co-administración de LYNPARZA con estos fármacos tampoco se recomienda (véase sección de Precauciones Generales).
Un estudio clínico para evaluar el impacto de itraconazol, un inhibidor conocido del CYP3A, demostró que la co- administración con LYNPARZA incrementa la Cmáx media de LYNPARZA del orden de 1.42 veces (IC del 90%: 1.33 - 1.52) y el ABC media del orden de 2.70 veces (IC del 90%: 2.44 - 2.97). Por lo tanto, se recomienda evitar la administración de inhibidores potentes (por ejemplo, itraconazol, telitromicina, claritromicina, inhibidores de proteasa reforzados con ritonavir o cobicistat, boceprevir, telaprevir) o moderados de esta isoenzima (eritromicina, diltiazem, fluconazol, verapamilo) con LYNPARZA (véase sección de Precauciones Generales). Si se debe co- administrar los inhibidores potentes o moderados del CYP3A, la dosis de LYNPARZA se debe reducir. Se recomienda reducir la dosis de LYNPARZA a 150 mg tomados dos veces al día (equivalente a una dosis total diaria de 300 mg) con un inhibidor potente del CYP3A o a 200 mg tomados dos veces al día (equivalente a una dosis total diaria de 400 mg) con un inhibidor moderado del CYP3A (véase sección de Dosis y Vía de administración y Precauciones Generales). Tampoco se recomienda el consumo de jugo de toronja durante el tratamiento con LYNPARZA.
LYNPARZA in vitro es un sustrato para el transportador de eflujo P-gp y, por lo tanto, los inhibidores de la P-gp podrían incrementar la exposición a LYNPARZA (véase sección Precauciones Generales).
Efecto de LYNPARZA sobre otros fármacos
LYNPARZA inhibe el CYP3A4 in vitro y se espera que sea un inhibidor leve del CYP3A in vivo. Por lo tanto, se debe tener precaución cuando los sustratos sensibles del CYP3A4 o sustratos con un margen terapéutico estrecho (por ejemplo, simvastatina, cisaprida, ciclosporina, alcaloides del cornezuelo de centeno, fentanilo, pimozida, sirolimus, tacrolimus y quetiapina) se combinan con LYNPARZA. Se recomienda un monitoreo clínico apropiado para pacientes que reciben sustratos del CYP3A con un margen terapéutico estrecho de forma concomitante con LYNPARZA.
Se ha observado in vitro inducción del CYP1A2, 2B6 y 3A4, siendo más probable que la inducción del CYP2B6 alcance un grado clínicamente relevante. El potencial de LYNPARZA para inducir CYP2C9, CYP2C19 y P-gp no se puede excluir. Por lo tanto, LYNPARZA en co-administración podría reducir la exposición a sustratos de esta enzima metabólica y transportar la proteína. La eficacia de los anticonceptivos hormonales se podría reducir si se co- administran con LYNPARZA (véase sección Precauciones Generales y Restricciones de uso durante el embarazo y la lactancia).
In vitro, LYNPARZA es un inhibidor del trasportador de eflujo P-gp (IC 50= 76 μM), por lo tanto, no se puede excluir que LYNPARZA puede causar interacciones farmacológicas clínicamente relevantes con sustratos de P-gp (por ejemplo, simvastatina, pravastatina, dabigratán, digoxina y colchicina). Se recomienda el monitoreo clínico apropiado para pacientes que reciban este tipo de medicación concomitantemente.
Se ha observado in vitro que LYNPARZA es un inhibidor de OATP1B1, OCT1, OCT2, OAT3, MATE1 y MATE2K. No se puede descartar que LYNPARZA podría incrementar la exposición a sustratos de OATP1B1 (por ejemplo, bosentán, glibenclamida, repaglinida, estatinas y valsartán), OCT1 (por ejemplo metformina), OCT2 (por ejemplo, creatinina sérica), OAT3 (por ejemplo, furosemida y metotrexato), MATE1 (por ejemplo, metformina) y MATE2K (por ejemplo, metformina). En particular, se debe tener precaución si LYNPARZA se administra en combinación con alguna estatina.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
Toxicidad hematológica
La toxicidad hematológica se reportó en pacientes tratadas con LYNPARZA, incluyendo diagnósticos clínicos y/o resultados de laboratorio de anemia generalmente leve o moderada (CTCAE de grado 1 o 2), neutropenia, trombocitopenia y linfopenia. Las pacientes no deben iniciar el tratamiento con LYNPARZA hasta que se hayan recuperado de la toxicidad hematológica causada por el tratamiento previo contra el cáncer (hemoglobina, plaquetas y niveles de neutrófilos deben estar dentro del rango normal o CTCAE grado 1). Se recomiendan las pruebas en el valor basal, seguidas de un control mensual de los recuentos sanguíneos completos para los primeros 12 meses de tratamiento y periódicamente después de este tiempo para supervisar los cambios clínicamente significativos en cualquier parámetro durante el tratamiento.
Si un paciente desarrolla una toxicidad hematológica grave o dependencia de transfusión de sangre, el tratamiento con LYNPARZA debe interrumpirse y la prueba hematológica adecuada debe iniciarse. Si los parámetros de la sangre permanecen clínicamente anormales después de 4 semanas de interrupción de la dosis de LYNPARZA, se recomienda el análisis de la médula ósea y/o análisis citogenético de sangre.
PRECAUCIONES GENERALES
Advertencias especiales y precauciones de uso
Síndrome mielodisplásico/leucemia mieloide aguda
Se reportaron síndrome mielodisplásico/leucemia mieloide aguda (SMD/LMA) en un pequeño número de pacientes que recibieron LYNPARZA solo o en combinación con otros fármacos contra el cáncer; la mayoría de los casos fueron mortales. La duración del tratamiento con LYNPARZA en pacientes que desarrollaron SMD/LMA varió de < 6 meses a > 2 años. Los casos eran típicos del tratamiento de SMD/LMA relacionada a la terapia de cáncer. Todas las pacientes tenían factores contribuyentes para el desarrollo de SMD/LMA; la mayoría de los casos eran portadores de mutaciones gBRCA y algunas pacientes tenían antecedentes de cáncer o de displasia de la médula ósea. Todos habían recibido esquemas previos de quimioterapia con platino y muchos de ellos también habían recibido otros agentes que dañan el ADN y radioterapia. Si se confirman SMD y/o LMA durante el tratamiento con LYNPARZA, se recomienda que el paciente sea tratado adecuadamente. Si se recomienda terapia adicional contra el cáncer, LYNPARZA debe interrumpirse y no administrarse en combinación con otras terapias contra el cáncer.
Neumonitis
Se reportó neumonitis en un pequeño número de pacientes recibiendo LYNPARZA, y algunos reportes fueron mortales. Los reportes de la neumonitis no tenían un patrón clínico consistente y fueron confundidos por una serie de factores predisponentes (cáncer y/o metástasis en los pulmones, enfermedad pulmonar subyacente, antecedentes de tabaquismo, y/o quimioterapia previa y radioterapia). Si las pacientes presentan síntomas respiratorios nuevos o que empeoran, como disnea, tos y fiebre, o si ocurre una anomalía radiológica, el tratamiento con LYNPARZA debe ser interrumpido y debe iniciarse una pronta investigación. Si se confirma la neumonitis, el tratamiento con LYNPARZA debe interrumpirse y el paciente debe ser tratado adecuadamente.
Toxicidad embriofetal
Basándose en su mecanismo de acción (inhibición de PARP), LYNPARZA podría causar daño fetal cuando se administra a una mujer embarazada. Los estudios pre clínicos realizados en ratas demostraron que LYNPARZA causa efectos adversos sobre la supervivencia embriofetal e induce malformaciones fetales a exposiciones por debajo de las esperadas a la dosis recomendada en humanos de 400 mg dos veces al día.
Embarazo/anticoncepción
LYNPARZA no debe utilizarse durante el embarazo y en mujeres en edad fértil que no utilicen métodos anticonceptivos confiables durante el tratamiento y durante 1 mes después de recibir la última dosis de LYNPARZA (véase sección de Restricciones de uso durante el embarazo y la lactancia).
Interacciones
La co-administración de LYNPARZA con inhibidores potentes o moderados del CYP3A no se recomienda (véase sección de Interacciones medicamentosas y de otro género). Si es necesario administrar de forma concomitante un inhibidor potente o moderado del CYP3A, la dosis de LYNPARZA se debe reducir (véase sección de Interacciones medicamentosas y de otro género y Dosis y Vía de administración).
La co-administración de LYNPARZA con inductores potentes o moderados del CYP3A no se recomienda (véase sección de Interacciones medicamentosas y de otro género). En caso de que la paciente que ya recibe LYNPARZA requiera tratamiento con un inductor potente o moderado del CYP3A, el médico debe estar consciente de que la eficacia de LYNPARZA puede reducirse sustancialmente (véase sección de Interacciones medicamentosas y de otro género).
En el caso de que un paciente que ya está recibiendo LYNPARZA requiera tratamiento con un inhibidor de la P gp, se recomienda un cuidadoso monitoreo de eventos adversos relacionados a LYNPARZA y gestión de estos eventos a través de la estrategia de reducción de la dosis (véase sección de Dosis y Vía de administración).
Efectos sobre la capacidad para conducir y utilizar máquinas
Durante el tratamiento con LYNPARZA, se reportó astenia, fatiga y mareos y aquellas pacientes que experimentan estos síntomas deben tener precaución al conducir o utilizar máquinas.
DOSIS Y VÍA DE ADMINISTRACIÓN
El tratamiento con LYNPARZA debe ser iniciado y supervisado por un médico con experiencia en el uso de los medicamentos contra el cáncer.
Las pacientes deben tener la confirmación de una mutación de un gen de susceptibilidad al cáncer de mama (BRCA) (ya sea de línea germinal o tumoral) antes de iniciar el tratamiento con LYNPARZA. El estado de la mutación BRCA debe ser determinado por un laboratorio con experiencia utilizando un método validado (véase sección de Farmacocinética y farmacodinamia).
Existen datos limitados en pacientes con tumores somáticos con BRCA mutado (véase sección de Farmacocinética y farmacodinamia).
La asesoría genética para pacientes con BRCA mutado se debe realizar de acuerdo con las normativas locales. Posología
La dosis recomendada de LYNPARZA es 400 mg (ocho cápsulas) dos veces al día, equivalente a una dosis diaria total de 800 mg.
Las pacientes deben iniciar el tratamiento con LYNPARZA a más tardar 8 semanas después de la terminación de su última administración del esquema que contiene platino.
Se recomienda que el tratamiento se continúe hasta la progresión de la enfermedad subyacente. No hay datos sobre el retratamiento con LYNPARZA después de recaídas posteriores (véase sección de Farmacocinética y farmacodinamia).
Dosis faltante
Si un paciente olvida una dosis de LYNPARZA, debe tomar su próxima dosis normal a la hora programada.
Ajustes de dosis para reacciones adversas
El tratamiento puede ser interrumpido para gestionar las reacciones adversas como náuseas, vómitos, diarrea y anemia y se puede considerar la reducción de la dosis (véase sección de Reacciones secundarias y adversas).
La reducción de la dosis recomendada es de 200 mg dos veces al día (equivalente a una dosis diaria total de 400 mg). Si se requiere una reducción de la dosis final mayor, entonces se podría considerar la reducción a 100 mg dos veces al día (equivalente a una dosis diaria total de 200 mg).
Ajustes de dosis para la administración concomitante con inhibidores del CYP3A
El uso concomitante con inhibidores del CYP3A potentes y moderados no se recomienda y se deben considerar agentes alternativos. Si un inhibidor potente o moderado del CYP3A debe ser usado, se recomienda reducir la dosis de olaparib a 150 mg tomados dos veces al día (equivalente a una dosis diaria de 300 mg) con un inhibidor potente del CYP3A o a 200 mg tomados dos veces al día (equivalente a una dosis diaria de 400 mg) con un inhibidor moderado del CYP3A (véase sección de Precauciones Generales e Interacciones medicamentos y de otro género).
Ancianos
No se requiere ajuste de dosis inicial para pacientes mayores. Hay datos clínicos limitados en pacientes de 75 o más años de edad.
Insuficiencia renal
La dosis recomendada de LYNPARZA en pacientes con insuficiencia renal moderada (depuración de creatinina de 31 a 50 ml / min) es 300 mg dos veces al día (equivalente a una dosis diaria total de 600 mg) (véase sección de Farmacocinética y Farmacodinamia).
LYNPARZA puede ser administrado a pacientes con insuficiencia renal leve (depuración de creatinina 51 a 80 ml/min) sin ajuste de dosis.
No se recomienda el uso de LYNPARZA en pacientes con insuficiencia renal grave o con enfermedad renal en estadio terminal (depuración de creatinina ≤ 30 ml/min) ya que no hay datos en estas pacientes.
LYNPARZA sólo puede utilizarse en pacientes con insuficiencia renal grave si el beneficio supera el riesgo potencial, y el paciente debe ser cuidadosamente monitoreado para la función renal y los eventos adversos.
Insuficiencia hepática
Se puede administrar LYNPARZA en pacientes con insuficiencia hepática leve (Clase A según Child-Pugh) sin ajuste de dosis (véase Sección Farmacocinética y Farmacodinamia). No se recomienda el uso de LYNPARZA en pacientes con insuficiencia hepática moderada o grave ya que la seguridad y la eficacia no han sido estudiadas en estas pacientes.
Pacientes no caucásicas
Existen datos clínicos disponibles limitados en pacientes no caucásicas. Sin embargo, no se requiere ajuste de dosis en función de la etnicidad (véase sección de Farmacocinética y farmacodinamia).
Pacientes con estado funcional de 2 a 4
Hay muy pocos datos clínicos disponibles en pacientes con estado funcional de 2 a 4.
Población pediátrica
No se estableció la seguridad y eficacia de LYNPARZA en niños y adolescentes. Menores de 18 años.
No se dispone de datos.
Método de administración
LYNPARZA es para uso oral.
Debido al efecto de los alimentos sobre la absorción de LYNPARZA, las pacientes deben tomar LYNPARZA al menos una hora después de la comida, y deben abstenerse de comer preferentemente hasta 2 horas después.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
No hay un tratamiento específico en el caso de sobredosis con LYNPARZA, y no están establecidos los síntomas de sobredosis. En el caso de una sobredosis, los médicos deben seguir las medidas de apoyo generales y deben tratar sintomáticamente.
NOMBRE Y DIRECCIÓN DEL LABORATORIO

ASTRAZENECA, S.A. de C.V.
Súper Av. Lomas Verdes No. 67,
Fracc. Lomas Verdes, C.P. 53120
Naucalpan de Juárez, México.
PRESENTACIONES
Cajas con 4 frascos con 112 cápsulas de 50 mg de Olaparib.
RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese entre 2°C - 8°C. No se congele.
LEYENDAS DE PROTECCIÓN
Su venta requiere receta médica. No use en el embarazo y la lactancia. No se deje al alcance de los niños. Este medicamento deberá ser prescrito únicamente por médicos especialistas en Oncología y con experiencia en quimioterapia antineoplásica. Literatura exclusiva para médicos.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
patientsafety.mexico@astrazeneca.com y al 01800 06 27872 (ASTRA)