
MERCILON
DESOGESTREL, ETINILESTRADIOL
Tabletas
1 Caja, 21 Tabletas,
1 Caja, 63 Tabletas,
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Tabletas.
Cada TABLETA contiene:
Desogestrel 0.150 mg
Etinilestradiol 0.020 mg
Excipiente cbp 1 tableta
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 001M93 SSA IV
Versión: S-CCDS-OG8276A-MCL21-TB-112021
RCN: 100000641-MX
IV. INDICACIONES TERAPÉUTICAS
Anticonceptivo.
V. FARMACOCINÉTICA Y FARMACODINAMIA
Propiedades farmacodinámicas
El efecto anticonceptivo de los anticonceptivos orales combinados (AOCs) se basa en la interacción de diversos factores, de los cuales, el más importante es la inhibición de la ovulación y los cambios en la secreción cervical. Adicional al efecto anticonceptivo, los AOCs tienen numerosas propiedades positivas que, junto con las propiedades negativas (ver Precauciones generales, Reacciones Secundarias y Adversas), pueden ser de utilidad al decidir el método de control natal. El ciclo es más regular, la menstruación suele ser menos dolorosa y el sangrado más ligero. Esto último puede producir una disminución de la ocurrencia de deficiencia de hierro. Además de esto, con los AOCs a dosis altas (50 microgramos de etinilestradiol) hay evidencia de un riesgo reducido de tumores fibroquísticos en mama, quistes ováricos, enfermedad pélvica inflamatoria, embarazo ectópico, cáncer de endometrio y cáncer de ovario. Falta confirmar si esto también aplica con el uso de dosis bajas de AOCs.
Propiedades farmacocinéticas
Desogestrel
Absorción
Después de la administración oral de desogestrel, éste se absorbe completamente y se convierte con rapidez a etonogestrel. Las concentraciones séricas máximas se alcanzan en aproximadamente 1.5 horas. La biodisponibilidad es de 62-81%.
Distribución
Etonogestrel se une a la albúmina sérica y a la globulina fijadora de esteroides sexuales (SHBG). De la concentración sérica total del fármaco, sólo del 2 al 4% está presente como esteroide libre y unido específicamente a SHBG, del 40 al 70%. El incremento inducido por etinilestradiol en SHBG influye en la distribución de las proteínas séricas, causando un aumento de la fracción unida a SHBG y una disminución de la fracción unida a albúmina. El volumen aparente de distribución del desogestrel es de 1.5 L/kg.
Metabolismo
El etonogestrel se metaboliza por completo mediante las vías conocidas del metabolismo de esteroides. La velocidad de depuración metabólica es de aproximadamente 2 mL/min/kg. No se encontró alguna interacción con el etinilestradiol coadministrado.
Eliminación
Los niveles séricos de etonogestrel disminuyen en dos fases. La fase terminal se caracteriza por una vida media de aproximadamente 30 horas. El desogestrel y sus metabolitos se excretan en una relación urinaria/biliar de aproximadamente 6:4.
Condiciones en estado estable
La farmacocinética del etonogestrel es influenciada por los niveles de SHBG, los cuales incrementan tres veces por el etinilestradiol. Después de la administración diaria, los niveles séricos del fármaco aumentan de dos a tres veces, alcanzando las condiciones de estado estable durante la segunda mitad del ciclo de tratamiento.
Etinilestradiol
Absorción
El etinilestradiol se absorbe rápidamente y por completo después de la administración por vía oral. Las concentraciones séricas máximas se alcanzan dentro de las siguientes 1-2 horas. La biodisponibilidad absoluta, que es resultado de la conjugación presistémica y el metabolismo de primer paso, es de aproximadamente 60%.
Distribución
El etinilestradiol se une en un gran porcentaje a la albúmina sérica (aproximadamente 98.5%) aunque de manera inespecífica, e induce un aumento de las concentraciones séricas de SHBG. Se determinó un volumen aparente de distribución cercano a 5 L/kg.
Metabolismo
El etinilestradiol es sujeto a conjugación presistémica en la mucosa del intestino delgado y en el hígado. Se metaboliza principalmente mediante hidroxilación aromática, formándose una amplia variedad de metabolitos hidroxilados y metilados, los cuales están presentes como metabolitos libres y como conjugados con glucurónidos y sulfatos. La tasa de depuración metabólica es cercana a 5 mL/min/kg.
Eliminación
Los niveles séricos de etinilestradiol disminuyen en dos fases; la fase de eliminación terminal se caracteriza por una vida media de aproximadamente 24 horas. La porción del fármaco sin cambios no se excreta; los metabolitos del etinilestradiol son excretados en una relación urinaria/biliar de 4:6. La vida media de excreción de los metabolitos es de alrededor de 1 día.
Condiciones en estado estable
Se alcanzan después de 3 a 4 días cuando los niveles séricos del fármaco están por arriba del 30 a 40%, en comparación con una sola dosis.
VI. CONTRAINDICACIONES
Los anticonceptivos hormonales combinados (AHCs) no deben utilizarse en presencia de cualquiera de las condiciones listadas más adelante. Si cualquiera de estas aparece cuando por primera vez se utilizan AHCs, debe suspenderse de inmediato la toma del medicamento:
• Presencia o antecedentes de trombosis venosa (trombosis venosa profunda, embolismo pulmonar).
• Presencia o antecedentes de trombosis arterial (infarto al miocardio, accidente cerebro-vascular) o condiciones prodrómicas (p. ej., ataque isquémico transitorio, angina de pecho).
• Predisposición conocida para trombosis arterial o venosa tales como resistencia de proteína C activada (APC), deficiencia de anti-trombina III, deficiencia de proteína C, deficiencia de proteína S, hiperhomocisteinemia y anticuerpos anti-fosfolípidos.
• Antecedentes de migraña con síntomas neurológicos focales (ver Precauciones generales).
• Diabetes mellitus con compromiso vascular.
• La presencia de un factor grave o múltiples factores de riesgo para trombosis venosa o arterial también puede constituir una contraindicación (ver Precauciones generales).
• Cirugía mayor con inmovilización prolongada (ver Precauciones generales).
• Pancreatitis o antecedentes de ella, asociada a hipertrigliceridemia severa.
• Presencia o antecedentes de enfermedades hepáticas graves en tanto los valores de funcionamiento hepático no hayan regresado a la normalidad.
• Presencia o antecedente de tumores hepáticos (benignos o malignos).
• Conocimiento o sospecha de condiciones malignas dependientes de esteroides sexuales (p. ej. de los órganos genitales o mamas).
• Hemorragia vaginal no diagnosticada.
• Conocimiento o sospecha de embarazo.
• Hipersensibilidad a las sustancias activas o a cualquiera de los excipientes de MERCILON.
• MERCILON está contraindicado para usarse con el régimen de combinación para Hepatitis C ombitasvir/paritaprevir/ritonavir, con o sin dasabuvir (ver Precauciones Generales).
VII. PRECAUCIONES GENERALES
Si aparece cualquiera de las condiciones/factores de riesgo mencionados a continuación, los beneficios del uso de AHC deberán ser evaluados contra los posibles riesgos para cada mujer en particular y discutidos con la paciente antes de que ella decida utilizarlos. En caso de agravamiento, exacerbación o aparición de cualquiera de estas condiciones o factores de riesgo, la paciente deberá contactar a su médico. El médico deberá decidir si el uso del AHC debe ser suspendido.
A lo largo de esta sección se utiliza el término de anticonceptivo hormonal combinado (AHC) cuando existe información para anticonceptivos orales y no orales. El término anticonceptivo oral combinado (AOC) se utiliza cuando existe información solamente para anticonceptivos orales.
1. Trastornos circulatorios
• Estudios epidemiológicos han mostrado una relación entre el uso de AHCs y un mayor riesgo de patologías trombóticas y tromboembólicas arteriales y venosas, como son el infarto al miocardio, accidente cerebrovascular, trombosis venosa profunda y embolia pulmonar. Estos acontecimientos se producen en muy raras ocasiones.
• El uso de AHCs se asocia con un incremento del riesgo de tromboembolismo venoso (TEV) que se manifiesta en forma de trombosis venosa profunda y/ o embolia pulmonar. El riesgo es mayor durante el primer año que la mujer utiliza el AHC. El riesgo también incrementa después de iniciar por vez primera un AHC, o al reiniciar el mismo AHC o uno diferente, después de un descanso en el uso de 4 semanas o más.
• Algunos estudios epidemiológicos han sugerido que las mujeres que utilizan AOC’s de bajas dosis con progestágenos de tercera generación, incluido desogestrel, tienen un incremento del riesgo de TEV en comparación con las usuarias de AOCs de dosis baja con el progestágeno levonorgestrel. Estos estudios indican un incremento de aproximadamente el doble en el riesgo, el cual puede corresponder a 1-2 casos adicionales de TEV por cada 10,000 mujeres por año de uso. Sin embargo, la información de otros estudios no ha mostrado este incremento del riesgo.
• En general, la incidencia de TVE en usuarias de AHCs de dosis bajas de estrógenos (<0.05 mg de etinilestradiol) varía de alrededor de 3 a 12 casos por 10,000 mujeres por año en comparación con 1 a 5 casos por 10,000 mujeres por año en no usuarias de AHC. La incidencia de TEV que aparece durante el uso de AHC es menor que la incidencia asociada al embarazo (es decir, 5 a 20 casos por 10,000 mujeres por año). La TVE es fatal en el 1-2% de los casos.
• La figura abajo muestra el riesgo de desarrollar una TVE en mujeres que no están embarazadas y no utilizan AHCs, para mujeres que usan AHCs, para mujeres embarazadas y para mujeres en el periodo post-parto. Para poner en perspectiva al riesgo de desarrollar TVE: si se realiza un seguimiento de 10,000 mujeres que no están embarazadas y no usan AHC durante un año, entre 1 y 5 de estas mujeres desarrollarán TVE.
• Probabilidad de desarrollar un TVE.
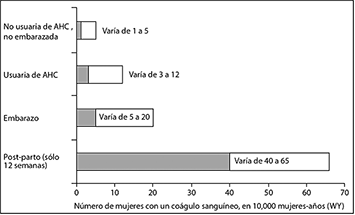
* AHC= anticoncepción hormonal combinada.
** Información de embarazo basada en la duración real del embarazo en los estudios de referencia. Basado en un modelo en que se asume que la duración del embarazo es de 9 meses, la tasa es de 7 a 27 por 10,000 mujeres/año.
• En casos extremadamente raros se ha informado la aparición de trombosis en otros vasos sanguíneos, p.ej., venas o arterias hepáticas, mesentéricas, renales, cerebrales o retinianas en usuarias de AHC.
• Los síntomas de eventos trombóticos/tromboembólicos venosos o arteriales o de un accidente cerebrovascular pueden ser los siguientes: dolor unilateral y/o, edema de miembros inferiores, dolor severo y repentino en el pecho, con irradiación o no al brazo izquierdo; disnea repentina; aparición repentina de tos; cualquier cefalea no habitual, grave y prolongada; pérdida repentina parcial o total de la visión; diplopia; dificultad para hablar o afasia; vértigo; desvanecimiento con o sin crisis focal; debilidad o insensibilidad muy marcada que afecta de repente a un lado o una parte del cuerpo; trastornos motores, abdomen “agudo”.
• El riesgo de tromboembolismo venoso aumenta con:
- La edad;
- Antecedentes familiares positivos (es decir, tromboembolismo venoso en algún hermano o padre a una edad relativamente corta). Si se sospecha que hay una predisposición hereditaria, la mujer debe ser referida a un especialista para que reciba consejo antes de decidir sobre el uso de cualquier anticonceptivo hormonal;
- Obesidad (índice de masa corporal de más de 30 kg/m2);
- Inmovilización prolongada, cirugía mayor, cualquier cirugía en miembros inferiores o traumatismo de importancia. En estas situaciones es recomendable suspender el uso de AOC (en el caso de cirugía programada, al menos con cuatro semanas de antelación) y no reanudarlo hasta dos semanas después de haber recuperado totalmente la movilidad. Ver Contraindicaciones;
- Y posiblemente también con tromboflebitis superficial y venas varicosas. No hay consenso sobre el posible papel de estas condiciones en la tromboembolia venosa.
• El riesgo de complicaciones tromboembólicas arteriales incrementa con:
- La edad;
- Tabaquismo (cuánto más fume y mayor la edad de la paciente, mayor el riesgo, especialmente en mujeres mayores de 35 años de edad);
- Dislipoproteinemia;
- Obesidad (índice de masa corporal superior a 30 kg/m2);
- Hipertensión;
- Migraña;
- Enfermedad valvular cardiaca;
- Fibrilación auricular;
- Antecedentes familiares (es decir, tromboembolia arterial en hermanos o padres a edad relativamente temprana). Si se sospecha una predisposición hereditaria, la paciente debe remitirse a un especialista antes de decidir el uso de cualquier anticonceptivo hormonal;
• Debe tenerse en consideración el aumento del riesgo de tromboembolia en el puerperio (ver Restricciones de Uso Durante el Embarazo y la Lactancia).
• Otras situaciones médicas que se han relacionado con problemas circulatorios adversos son diabetes mellitus, lupus eritematoso sistémico, síndrome hemolítico-urémico, enfermedad intestinal inflamatoria crónica (enfermedad de Crohn o colitis ulcerativa) y anemia de células falciformes.
• Un aumento en la frecuencia o en la gravedad de la migraña durante el uso de AOC (que puede ser un síntoma premonitorio de un evento cerebro vascular) puede ser una razón para la inmediata interrupción del tratamiento con AOC.
• Entre los factores bioquímicos que pueden ser indicativos de una predisposición hereditaria o adquirida a la trombosis venosa o arterial, se incluyen la resistencia a la proteína C activada, hiperhomocisteinemia, deficiencia de antitrombina-III, deficiencia de proteína C, deficiencia de proteína S, anticuerpos antifosfolípidos (anticuerpos anticardiolipina, anticoagulante lúpico).
• Al considerar la relación riesgo/beneficio, el médico debe tener en cuenta que el tratamiento correcto de una condición médica puede reducir el riesgo relacionado de trombosis.
2. Tumores
• El factor de riesgo más importante para el cáncer cervicouterino es la infección persistente por el virus del papiloma humano (VPH). Algunos estudios epidemiológicos han indicado que el uso a largo plazo de AOCs contribuye aumentando el riesgo, siendo objeto de controversia hasta qué punto estos hechos son atribuibles a efectos de confusión p.ej., un incremento en la detección cervical y a diferencias en el comportamiento sexual incluyendo el uso de anticonceptivos de barrera o una asociación causal.
• En un meta-análisis de 54 estudios epidemiológicos, se observó que existe un ligero aumento del riesgo relativo (RR= 1.24) de padecer cáncer de mama entre mujeres que están usando actualmente AOCs. Este aumento desparece gradualmente durante el transcurso de los 10 años posteriores a haber dejado de usar el AOC. Debido a que el cáncer de mama es raro en mujeres menores de 40 años, es pequeño el aumento en el número de cáncer de mama diagnosticados entre usuarias actuales y recientes de AOC"s en relación con el riesgo global de padecer cáncer de mama. Los cánceres de mama diagnosticados entre las usuarias de AOC tienden a ser menos avanzados clínicamente que los cánceres diagnosticados entre las mujeres que no los han usado nunca.
• En otro estudio epidemiológico de 1.8 millones de mujeres danesas seguidas durante un promedio de 10.9 años, el RR reportado de cáncer de mama entre usuarias de AOC incrementó con una mayor duración de uso, en comparación con mujeres que nunca usaron AOC´s (RR global = 1.19; el RR varió de 1.17 para 1 a menos de 5 años de uso, a 1.46 después de más de 10 años de uso). La diferencia reportada en el riesgo absoluto (número de casos de cáncer de mama entre mujeres que nunca usaron AOC´s en comparación con usuarias actuales y recientes de AOC) fue pequeña: 13 por 100,000 mujeres-años.
• Los estudios epidemiológicos no brindan evidencia de causalidad. El patrón observado de incremento en el riesgo puede deberse a un diagnóstico más temprano de cáncer de mama en usuarias de AOC, a los efectos biológicos de los AOC´s o a una combinación de ambos.
• En casos raros se han observado entre las usuarias de AOC´s, tumores hepáticos benignos, y raramente, malignos. En casos aislados, estos tumores han originado hemorragias intra-abdominales que ponen en riesgo la vida. En el caso de que se presentase dolor epigástrico intenso, aumento del tamaño del hígado o signos de hemorragia intra-abdominal en usuarias de AOC"s, debe considerarse la posibilidad de un tumor hepático en el diagnóstico diferencial.
3. Hepatitis C
• Durante estudios clínicos con algunos regímenes de medicamentos combinados contra el HCV, se observaron elevaciones de ALT en mujeres que usaban medicamentos que contenían etinilestradiol (ver Interacciones Medicamentosas y de Otro Género) Por ejemplo, en el régimen de combinación para HCV ombitasvir/paritaprevir/ritonavir, con o sin dasabuvir, las elevaciones en ALT mayores a 5 veces el límite superior normal (ULN) fueron significativamente más frecuentes en mujeres que utilizaban medicamentos que contenían etinilestradiol, como AHCs. MERCILON debe ser descontinuado antes de iniciar el tratamiento con el régimen de combinación de ombitasvir/paritaprevir/ritonavir, con o sin dasabuvir (ver Contraindicaciones e Interacciones Medicamentosas y de otro Género). MERCILON puede ser reiniciado después de terminar el tratamiento con el régimen de combinación.
4. Otras situaciones
• Las mujeres con hipertrigliceridemia o con antecedentes familiares de la misma, pueden tener un mayor riesgo de padecer pancreatitis si usan AOCs.
• Los estrógenos exógenos pueden inducir o exacerbar los síntomas del angioedema hereditario y adquirido.
• Aunque se han observado pequeños incrementos de la presión sanguínea en muchas mujeres que toman AOC"s, los incrementos clínicamente relevantes son raros. No se ha establecido una relación entre el uso de AOC y la hipertensión clínica. No obstante, si se desarrolla hipertensión persistente clínicamente significativa durante el uso de un AOC, lo prudente es que el médico suspenda el mismo y trate la hipertensión. Si se considera oportuno, se puede reanudar el uso del AOC, si se logran obtener valores normotensos con tratamiento antihipertensivo.
• Se ha observado la aparición o empeoramiento de las siguientes situaciones tanto en caso de embarazo como en caso de uso de AOC, pero la evidencia de una relación no es concluyente: ictericia, prurito o ambos relacionados con colestasis; formación de cálculos biliares; porfiria, lupus eritematoso sistémico, síndrome urémico hemolítico, corea de Sydenham; herpes gestacional; pérdida auditiva relacionada a otosclerosis.
• En caso de alteraciones agudas o crónicas de la función hepática, puede ser necesaria la interrupción del uso del AOC hasta que los índices vuelvan a ser normales. En caso de recurrencia de una ictericia colestásica que se haya presentado por vez primera en el embarazo o durante el uso anterior de esteroides sexuales, es necesario interrumpir el AOC.
• Aunque los AOC pueden tener un efecto sobre la resistencia periférica a la insulina y a la tolerancia a la glucosa, no existe evidencia alguna de que sea necesario modificar la pauta terapéutica en las mujeres con diabetes que utilizan AOC a bajas dosis (contenido de etinilestradiol <0.05 mg). No obstante, las mujeres con diabetes deben someterse a una observación más estrecha mientras estén tomando AOC.
• La enfermedad de Crohn y la colitis ulcerativa se han asociado al uso de AOCs.
• Puede presentarse cloasma en algunas ocasiones, sobre todo en mujeres con antecedentes de cloasma gravídico. Las mujeres que tengan tendencia a padecer cloasma deberán evitar la exposición al sol o a los rayos ultravioleta mientras están tomando AOCs.
• MERCILON contiene <80 mg de lactosa por tableta. A mujeres con problemas raros hereditarios de intolerancia a la galactosa, deficiencia de lactasa de Lapp o mala absorción de glucosa-galactosa que están en dieta libre de lactosa deben tomar esta cantidad en consideración.
Cuando se asesora sobre la elección del método anticonceptivo, toda la información anterior debe tomarse en cuenta.
Reconocimiento / consulta médica
Antes de iniciar o reanudar el tratamiento de MERCILON debe hacerse una historia clínica completa (incluyendo antecedentes personales) y descartarse embarazo. Debe evaluarse la presión sanguínea y si está indicado clínicamente, debe realizarse un reconocimiento físico, guiado por las contraindicaciones (ver Contraindicaciones) y las precauciones (ver Precauciones Generales). La paciente debe leer cuidadosamente el instructivo para la usuaria y apegarse a las recomendaciones dadas. La frecuencia y naturaleza de los controles periódicos debe estar basada en las guías de práctica establecidas y adaptarse a la mujer de manera individual.
Es indispensable advertir a las mujeres que los anticonceptivos orales no ofrecen protección frente a la infección por VIH (SIDA) ni frente a otras enfermedades de transmisión sexual.
Reducción de la eficacia
La eficacia de MERCILON puede reducirse en caso de p. ej., olvido de las tabletas (ver Dosis y Vía de administración), trastornos gastrointestinales (ver Dosis y Vía de administración) o medicamentos concomitantes que disminuyen la concentración plasmática de etonogestrel, el metabolito activo de desogestrel (ver Interacciones medicamentosas y de otro Género).
Control de reducción del ciclo
Con todos los AOCs pueden presentarse hemorragias irregulares (manchado o sangrado intermenstrual), especialmente durante los primeros meses de uso. Por lo tanto, la evaluación de cualquier hemorragia irregular solo tiene sentido después de un plazo de adaptación de aproximadamente tres ciclos.
Si persisten las irregularidades en el sangrado o aparecen después de haber tenido ciclos regulares, entonces hay que tener en cuenta posibles causas no hormonales e indicar las medidas de diagnóstico apropiadas para excluir procesos malignos o embarazo. Éstas pueden incluir el legrado.
En algunas mujeres puede no presentarse la hemorragia por deprivación durante el intervalo sin toma de tabletas. Si se ha tomado el AOC según las instrucciones descritas en la sección de Dosis y Vía de Administración, es poco probable que la mujer esté embarazada. Sin embargo, si el AOC no ha sido tomado de acuerdo a estas indicaciones, antes de la primera falta de hemorragia por deprivación o si faltan dos de ellas, hay que descartar el embarazo antes de proseguir con el uso de AOC.
Efectos sobre la capacidad para conducir vehículos y operar maquinaria
No se han observado efectos sobre la capacidad para conducir o usar máquinas.
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
MERCILON no está indicado durante el embarazo. Si ocurre un embarazo durante el tratamiento con MERCILON, deberá suspenderse la toma. Sin embargo, la mayoría de estudios epidemiológicos no han revelado ni un aumento del riesgo de defectos de nacimiento en niños de mujeres que tomaron AOCs antes del embarazo, ni un efecto teratogénico cuando se utilizaron AOCs accidentalmente durante el primer trimestre del embarazo.
Es posible que los AOCs influyan en la lactancia, ya que pueden reducir la cantidad de la leche materna y su composición. En consecuencia, por lo general no se recomienda el uso de AOC hasta que la madre ha dejado de lactar por completo. Es posible que pequeñas cantidades de esteroides anticonceptivos, sus metabolitos, o ambos, se excreten por la leche, pero no hay evidencia de que esto afecte de manera adversa la salud del lactante.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
Las Reacciones adversas posiblemente relacionados que se han reportado en estudios clínicos u observacionales con usuarias de MERCILON o de AOCs, están listados en la tabla de abajo1.
|
Clasificación por órganos y sistemas |
Común (≥ 1/100) |
No común (≥1/1,000 y <1/100) |
Raro (< 1/1,000) |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
||
|
Trastornos metabólicos y nutricionales |
Retención de líquidos |
||
|
Trastornos psiquiátricos |
Estado de ánimo depresivo, estado de ánimo alterado |
Disminución de la libido |
Aumento de la libido |
|
Trastornos del sistema nervioso |
Cefalea |
Migraña |
|
|
Trastornos oculares |
Intolerancia a los lentes de contacto |
||
|
Trastornos vasculares |
Tromboembolismo venoso2 Tromboembolismo arterial2 |
||
|
Trastornos gastrointestinales |
Náusea, dolor abdominal |
Vómito, diarrea |
|
|
Trastornos de la piel y del tejido subcutáneo |
Erupciones, urticaria |
Eritema nodoso, eritema multiforme |
|
|
Trastornos del aparato reproductor y las glándulas mamarias |
Sensibilidad y dolor en las mamas |
Agrandamiento de mamas |
Secreción vaginal, secreción mamaria |
|
Estudios complementarios |
Aumento de peso |
|
Pérdida de peso |
1 Se lista el término más idóneo de MedDRA para describir una cierta reacción adversa. Los síntomas o las condiciones relacionadas no se listan, pero también deben tomarse en cuenta.
2 Incidencia en estudios observacionales de cohortes de ≥10,000 a <1/1,000 mujeres-años.
Se ha reportado un número de efectos no deseados en las mujeres que utilizan anticonceptivos orales combinados, los cuales se describen con más detalle en Precauciones Generales. Esto incluye: trastornos tromboembólicos venosos, trastornos tromboembólicos arteriales; hipertensión; tumores dependientes de hormonas (p. ej., tumores en hígado; cáncer de mama) exacerbaciones de angioedema hereditario y adquirido; cloasma.
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Nota: Debe consultarse la información para prescribir de los medicamentos concomitantes para identificar las interacciones potenciales.
Las interacciones entre anticonceptivos orales y otros medicamentos pueden provocar hemorragias intermenstruales y/o fracaso de la anticoncepción oral. Las siguientes interacciones han sido reportadas en la literatura:
Metabolismo hepático: Pueden ocurrir interacciones con medicamentos o productos herbolarios que inducen a las enzimas microsomales, específicamente a las enzimas del citocromo P450 (CYP), que pueden resultar en un incremento en la depuración, reduciendo las concentraciones plasmáticas de hormonas sexuales y puede disminuir la efectividad de los anticonceptivos orales combinados, incluyendo MERCILON. Estos productos incluyen fenitoína, fenobarbital, primidona, bosentan, carbamazepina, rifampicina y posiblemente también oxcarbazepina, topiramato, felbamato, griseofulvina, algunos inhibidores de la proteasa del VIH (p.ej., ritonavir) e inhibidores no nucleósidos de transcriptasa reversa (p.ej., efavirenz) y productos que contienen el remedio herbolario Hierba de San Juan.
Puede ocurrir inducción enzimática después de algunos días de tratamiento. Generalmente se observa inducción enzimática máxima en unas pocas semanas. Después de suspender el tratamiento farmacológico, la inducción enzimática puede durar alrededor de 28 días.
Cuando se administran de manera conjunta con anticonceptivos hormonales, muchas combinaciones de inhibidores de proteasa del VIH (p.ej., nelfinavir) e inhibidores no nucleósidos de transcriptasa reversa (p.ej., nevirapina), y/o las combinaciones con medicamentos para el virus de la Hepatitis C (VHC) (p.ej., boceprevir, telaprevir) pueden incrementar o disminuir las concentraciones plasmáticas de progestágenos, incluyendo etonogestrel, el metabolito activo de desogestrel, o de estrógenos. El efecto neto de estos cambios puede ser clínicamente relevante en algunos casos.
Las mujeres que reciben cualquiera de los medicamentos o productos herbolarios inductores de enzimas hepáticas deben ser advertidas de que la eficacia de MERCILON puede estar reducida. Debe usarse un método anticonceptivo de barrera además de MERCILON durante la administración del medicamento inductor de enzimas hepáticas y durante 28 días después de la suspensión del medicamento inductor de enzimas hepáticas. Si la administración concomitante va más allá del final de las tabletas del paquete actual del AOC, el siguiente paquete de AOC debe iniciarse inmediatamente, sin el intervalo usual libre de tabletas.
Para mujeres con tratamiento a largo plazo con medicamentos inductores de enzimas, deberá considerarse un método anticonceptivo alternativo, que no se vea afectado por medicamentos inductores de enzimas.
La administración concomitante de inhibidores potentes (p. ej., ketoconazol, itraconazol, claritromicina) o moderados (p. ej., fluconazol, diltiazem, eritromicina) de CYP 3A4 puede incrementar las concentraciones séricas de estrógenos o progestágenos, incluyendo etonogestrel, el metabolito activo de desogestrel.
Los anticonceptivos orales pueden interferir con el metabolismo de otros fármacos. Como consecuencia, sus concentraciones en plasma y tejidos pueden incrementar (p. ej., ciclosporina) o disminuir (p. ej., lamotrigina).
Durante estudios clínicos con el régimen de combinación de medicamentos para HCV ombitasvir/paritaprevir/ritonavir, con o sin dasabuvir, las elevaciones en ALT mayores a 5 veces el límite superior normal (ULN) fueron significativamente más frecuentes en mujeres que utilizaban medicamentos que contenían etinilestradiol, como AHCs. MERCILON debe suspenderse antes del inicio del tratamiento con el régimen de combinación ombitasvir/paritaprevir/ritonavir, con o sin dasabuvir (ver Contraindicaciones y de Precauciones Generales). MERCILON puede ser reiniciado aproximadamente 2 semanas después de terminar el tratamiento con el régimen de combinación de medicamentos.
El uso concomitante con otros medicamentos antivirales contra el HCV, como los que contienen glecaprevir/pibrentasvir, puede aumentar el riesgo de elevaciones de ALT (ver Precauciones Generales).
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
El uso de esteroides anticonceptivos puede influir en los resultados de ciertas pruebas de laboratorio, que incluyen parámetros bioquímicos de las funciones hepática, tiroidea, suprarrenal y renal, niveles plasmáticos de proteínas (transportadoras), p. ej., globulina transportadora de corticoesteroides y fracciones lipídicas/lipoproteicas, parámetros del metabolismo de carbohidratos y parámetros de coagulación y de fibrinólisis. Las alteraciones suelen mantenerse dentro de los límites normales de laboratorio.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
Vía de administración: Oral.
Las tabletas deben tomarse, todos los días a la misma hora con algo de líquido. Hay que tomar una tableta diaria durante 21 días consecutivos. Cada nuevo envase se comienza tras un intervalo de 7 días sin toma de tabletas; durante el cual suele aparecer una hemorragia por deprivación. Ésta suele empezar el día 2-3 después de la última tableta y puede no haber terminado antes de comenzar el nuevo envase.
Cómo empezar a tomar MERCILON
Cuando no se han utilizado anticonceptivos hormonales anteriormente (en el mes anterior).
La toma de las tabletas tiene que iniciar el primer día del ciclo natural de la mujer (es decir, el primer día de su menstruación). Puede comenzarse en los días 2-5, pero en el primer ciclo se recomienda usar además un método de barrera durante los siete primeros días de la toma de las tabletas.
Cambio a partir de un anticonceptivo hormonal combinado (AHC) [anticonceptivo oral combinado (AOC), anillo vaginal o parche transdérmico]
La usuaria debe comenzar con MERCILON de preferencia al siguiente día de tomar la última tableta activa (la última tableta que contiene la sustancia activa) de su AOC anterior, pero a más tardar al día siguiente de la pausa sin toma de tabletas o después de la última tableta inactiva de su AOC anterior. Si se ha utilizado un anillo vaginal o un parche transdérmico, la mujer debe empezar con MERCILON de preferencia el día que sean retirados, pero máximo cuando debiera haber sido la siguiente aplicación.
Si la mujer ha estado utilizando su método previo de forma consistente y correcta y se está razonablemente seguros de que no está embarazada, ella puede también cambiar de su anticonceptivo hormonal combinado previo en cualquier día del ciclo.
El intervalo libre de hormonas de su método previo nunca deberá extenderse más allá de su duración recomendada.
Cambio a partir de un método de progestágeno solo (minitableta, inyección, implante) o de dispositivo intrauterino (DIU) de liberación de progesterona
La usuaria puede cambiar cualquier día de la minitableta (de un implante, o del DIU) el día de su retiro; de un inyectable, el día previsto para la siguiente inyección), pero en todos estos casos se le debe aconsejar que use además un método de barrera durante los 7 primeros días de la toma de las tabletas.
Después de un aborto en el primer trimestre
La mujer puede empezar inmediatamente. En este caso, no necesita tomar medidas anticonceptivas adicionales.
Después de un parto o de un aborto en el segundo trimestre
Para mujeres durante la lactancia, ver Restricciones de uso durante el Embarazo y la Lactancia.
Es indispensable aconsejar a las mujeres a que inicien el día 21 a 28 después del parto o del aborto en el segundo trimestre. En caso de comenzar más tarde, debe sugerirse que utilicen adicionalmente un método de barrera durante los siete primeros días de la toma de las tabletas. No obstante, si ya se han tenido relaciones sexuales, debe comprobarse la ausencia de embarazo antes de iniciar el uso del AOC o la mujer tiene que esperar a que se presente su primera menstruación.
Debe considerarse el incremento en el riesgo de TEV en el periodo post-parto al reiniciar MERCILON (ver Precauciones Generales).
Manejo de tabletas olvidadas
Si han transcurrido menos de 12 horas desde la hora habitual de la toma de la tableta, la protección anticonceptiva no se reduce. La mujer debe tomar la tableta en cuanto se dé cuenta del olvido y debe seguir tomando las restantes a la hora habitual.
Si se retrasa más de 12 horas en la toma de cualquier tableta, es factible que se reduzca la protección anticonceptiva. El comportamiento en este caso puede regirse por las dos reglas básicas siguientes:
1.- Nunca hay que suspender la toma de tabletas durante más de 7 días.
2.- Hacen falta 7 días de toma ininterrumpida de tabletas para conseguir una adecuada supresión del eje hipotálamo-hipófisis-ovario.
En consecuencia, puede darse el siguiente consejo en la práctica diaria:
• Semana 1
La usuaria debe tomar la última tableta olvidada en cuanto se dé cuenta del olvido, incluso aunque esto signifique tomar dos tabletas a la vez. Luego continuará tomando las tabletas a su hora habitual. Además, debe usarse un método de barrera, como el condón, durante los 7 días siguientes. Si han tenido lugar relaciones sexuales en los 7 días anteriores, hay que considerar la posibilidad de embarazo. Cuantas más tabletas se hayan olvidado y más cerca estén del intervalo normal sin toma de tabletas, mayor es el riesgo de embarazo.
• Semana 2
La usuaria debe tomar la última tableta olvidada en cuanto se dé cuenta del olvido, incluso aunque esto signifique tomar dos tabletas a la vez. Luego continuará tomando las tabletas a su hora habitual. Siempre que la mujer haya tomado las tabletas correctamente en los 7 días anteriores a la primera tableta olvidada, no es necesario tomar precauciones anticonceptivas adicionales. Sin embargo, si no ha sido así, o si se olvidó más de una tableta, debe aconsejarse a la mujer que tome precauciones adicionales durante 7 días.
• Semana 3
Es inminente el riesgo de que la confiabilidad disminuya por la proximidad del intervalo sin toma de tabletas. No obstante, todavía puede evitarse la disminución de la protección anticonceptiva ajustando la pauta de toma de las tabletas. Siguiendo cualquiera de las dos opciones siguientes no hará falta, por tanto, tomar precauciones anticonceptivas adicionales, siempre que en los 7 días anteriores a la primera tableta olvidada la mujer haya tomado correctamente todas las tabletas. Si no ha sido así, debe aconsejarse a la mujer que siga la primera de estas dos opciones y que tome también precauciones adicionales durante los 7 días siguientes.
1.- La usuaria debe tomar la última tableta olvidada en cuanto se dé cuenta del olvido, incluso aunque esto signifique tomar dos tabletas a la vez. Luego continuará tomando las tabletas a su hora habitual. Hay que comenzar el nuevo envase en cuanto se termine el actual, es decir, no debe haber interrupción alguna entre los envases. Es improbable que la usuaria tenga una hemorragia por deprivación hasta terminar el segundo envase, pero podría presentar manchado o hemorragia intermenstrual durante los días de toma de tabletas.
2.- También puede aconsejarse a la mujer que suspenda la toma de tabletas del envase actual. Tendría entonces un intervalo sin toma de tabletas hasta por 7 días, incluyendo los días en los que olvidó la toma, y seguiría a continuación con el nuevo envase.
Si la mujer olvidó tabletas y no ha tenido a continuación ninguna hemorragia por deprivación en el primer intervalo normal sin toma de tabletas, se debe considerar la posibilidad de un embarazo.
Consejo en caso de trastornos gastrointestinales
En el caso de tener trastornos gastrointestinales severos, la absorción puede no ser completa y se deberán tomar medidas anticonceptivas adicionales.
Si se produce vómito en las 3 - 4 horas después de la toma de la tableta, son válidos los consejos para el caso de tabletas olvidadas de la sección anterior. Si la mujer no quiere cambiar su pauta normal de toma, tiene que sacar la tableta o tabletas adicionales necesarias de otro envase.
Cómo cambiar un periodo o aplazar la menstruación
Para retrasar la menstruación, la mujer debe continuar con otro envase del producto sin periodo de descanso. El aplazamiento puede prolongarse todo el tiempo que se desee hasta terminar el segundo envase. Durante el aplazamiento pueden presentarse hemorragias intermenstruales o manchado. La ingestión regular del producto se reanuda entonces después del intervalo normal de 7 días sin toma de tabletas.
Para cambiar el comienzo de la menstruación a otro día de la semana distinto al que está acostumbrada la mujer con su pauta actual, se le puede aconsejar que acorte el próximo intervalo sin toma tantos días como se desee. Cuanto más corto sea el intervalo, mayor será el riesgo de que no tenga una hemorragia por deprivación y se presente hemorragia intermenstrual y manchados durante el segundo envase (igual que al retrasar la menstruación).
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
No ha habido reportes de efectos nocivos graves por sobredosificación. Los síntomas que pueden aparecer en este caso son: náusea, vómito y, en niñas, hemorragias vaginales leves. No existe antídoto alguno y el tratamiento debe ser sintomático.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
La información preclínica no revela un riesgo especial para los humanos cuando se usan los AOCs como se recomiendan. Esto está basado en estudios convencionales de toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad sobre la fertilidad. Sin embargo, debe tenerse en cuenta que los esteroides sexuales pueden estimular el crecimiento de los tejidos y de los tumores dependientes de hormonas.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
Schering-Plough, S.A. de C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan,
C.P. 16090, Xochimilco,
Ciudad de México, México.
XV. PRESENTACIÓN
Caja de cartón con sobre con 21 tabletas (con y sin calendario) en envase de burbuja.
Caja de cartón con tres sobres con 21 tabletas (con y sin calendario) 63 tabletas en envase de burbuja.
Todas las presentaciones con instructivo anexo.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese a no más de 30 °C.
Consérvese la caja bien cerrada.
Protéjase de la luz.
XVII. LEYENDAS DE PROTECCIÓN
Literatura exclusiva para el Profesional de la Salud.
Léase instructivo anexo.
No se deje al alcance de los niños.
Su venta requiere receta médica.
No se use durante el embarazo.
En caso de lactancia, consulte a su médico.
Reporte las sospechas de reacción adversa a los correos: farmacovigilancia@cofepris.gob.mx y
dpoc.méxico@organon.com