
MIRENA / JAYDESS
LEVONORGESTREL
Dispositivo intrauterino
1 Caja, 1 Dispositivo intrauterino,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Polvo
El dispositivo con POLVO MIRENA contiene:
|
Levonorgestrel |
52.00 mg |
|
Dispositivo intrauterino 1 pieza. |
|
El dispositivo con POLVO JAYDESS contiene:
|
Levonorgestrel |
13.5 mg |
|
Dispositivo intrauterino 1 pieza. |
|
MIRENA 52 mg es un endoceptivo (Sistema intrauterino de liberación hormonal). El sistema intrauterino liberador de levonorgestrel (SIU-LNG) consiste de un núcleo de fármaco, cubierto con una membrana opaca, blanca o casi blanca, el cual está montado sobre el brazo vertical de un cuerpo en T. El cuerpo en T tiene un asa en el extremo del brazo vertical y dos brazos horizontales en el otro extremo. Los hilos de extracción se encuentran atados al asa. El brazo vertical del endoceptivo se carga en el tubo de inserción a la altura de la punta del insertor. El endoceptivo y el insertor se encuentran esencialmente libres de impurezas visibles.
JAYDESS 13.5 mg es un endoceptivo (Sistema intrauterino de liberación hormonal) que consiste de un núcleo de fármaco de color blancuzco o amarillo pálido, cubierto con una membrana semi-opaca, blanca o casi blanca, el cual está montado sobre el brazo vertical de un cuerpo en T. Además, la porción vertical contiene un anillo de plata que se ubica cerca de los brazos horizontales. El cuerpo en T tiene un asa en un extremo de la porción vertical y dos brazos horizontales en el otro extremo. Tiene hilos de extracción de color café fijados al asa. El brazo vertical del endoceptivo se carga en el tubo de inserción a la altura de la punta del insertor. El endoceptivo y el insertor se encuentran esencialmente libres de impurezas visibles.
INDICACIONES TERAPÉUTICAS:
MIRENA 52 mg: Anticoncepción intrauterina de acción prolongada; manejo del sangrado menstrual abundante; prevención de hiperplasia de endometrio durante la terapia de reemplazo estrogénica.
JAYDESS 13.5 mg: Anticoncepción en mujeres multíparas y nulíparas.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Código ATC: G02BA03.
Grupo fármaco-terapéutico: sistema intrauterino de plástico con progestágeno.
MIRENA 52 mg:
El Levonorgestrel es un progestágeno con actividad antiestrogénica ampliamente utilizado en ginecología: para anticoncepción como el componente progestágeno en los anticonceptivos orales y en la terapia de sustitución hormonal o para la anticoncepción en las píldoras con solo progestágeno e implantes subdérmicos. El Levonorgestrel también puede administrarse en la cavidad uterina con un sistema intrauterino de liberación. Esto permite una dosis diaria muy baja, ya que la hormona es liberada directamente en el órgano blanco.
MIRENA tiene efectos progestagénicos principalmente locales en la cavidad uterina. La alta concentración de levonorgestrel en el endometrio disminuye los receptores estrogénicos y progestagénicos endometriales, insensibilizando el endometrio al estradiol circulante ocasionando un potente efecto antiproliferativo. Durante el uso de MIRENA se observan cambios morfológicos en el endometrio y una débil reacción local a cuerpo extraño. El aumento de viscosidad del moco cervical impide el paso de los espermatozoides a través del canal cervical. La liberación hormonal local en útero y las trompas inhibe la motilidad y función de los espermatozoides, evitando la fertilización. En algunas mujeres se presenta inhibición de la ovulación.
La eficacia anticonceptiva de MIRENA ha sido estudiada en 5 importantes estudios clínicos con 3,330 mujeres usuarias de MIRENA. El índice de falla (índice Pearl) fue de aproximadamente 0.2% en un año y aproximadamente 0.7% en 5 años. El índice de falla incluye también embarazos debido a expulsión del dispositivo o perforaciones no detectadas. Se observó una eficacia anticonceptiva similar en un estudio de farmacovigilancia con más de 17 000 mujeres usuarias de MIRENA. Debido a que el uso de MIRENA no requiere un cumplimiento de toma diaria para las usuarias, la tasa de embarazos durante el "uso típico" es similar a aquéllas observadas en estudios clínicos controlados ("uso perfecto").
El uso de MIRENA no altera la fertilidad futura. Aproximadamente 80% de las mujeres que deseaban quedar embarazadas concibieron dentro de los 12 meses siguientes a la extracción del endoceptivo.
El patrón menstrual es el resultado de la acción directa del levonorgestrel sobre el endometrio y no refleja el ciclo ovárico. No hay diferencias claras entre las mujeres con diferentes patrones menstruales con respecto al desarrollo folicular, ovulación o producción de estradiol y progesterona. En el proceso de inactivación de la proliferación del endometrio puede producirse un aumento inicial del manchado durante los primeros meses de uso. Después de eso, la fuerte supresión del endometrio ocasiona la reducción de la duración y el volumen del sangrado menstrual durante el uso de MIRENA. El sangrado escaso se convierte frecuentemente en oligomenorrea o amenorrea. La función ovárica es normal y los niveles de estradiol se mantienen, incluso en el caso de usuarias de MIRENA con amenorrea.
MIRENA puede usarse satisfactoriamente en el tratamiento del sangrado menstrual abundante. En estas mujeres la pérdida de sangre menstrual disminuyó 62-94% al final de tres meses y 71-95% al final de seis meses de uso. Es posible que en el caso de hemorragia producida por miomas submucosos la respuesta clínica no sea tan favorable. La disminución del sangrado aumenta la concentración de hemoglobina en la sangre. MIRENA también alivia la dismenorrea.
MIRENA previene con igual eficacia la hiperplasia de endometrio durante tratamiento continuo con estrógeno oral o transdérmico. Durante el tratamiento con estrógeno solo, se observó una tasa de hiperplasia de 20%. En estudios clínicos con 634 usuarias perimenopáusicas y postmenopáusicas de MIRENA, no se reportaron casos de hiperplasia de endometrio durante un periodo de observación que varió de uno a 5 años.
JAYDESS 13.5:
JAYDESS 13.5 mg tiene efectos progestagénicos principalmente locales en la cavidad uterina. La alta concentración de levonorgestrel en el endometrio disminuye los receptores endometriales de estrógeno y progesterona. El endometrio se vuelve relativamente insensible al estradiol circulante y se observa un fuerte efecto antiproliferativo. Se observaron cambios morfológicos del endometrio y una débil reacción local al cuerpo extraño durante su uso. El espesamiento del moco cervical impide el paso de los espermatozoides a través del canal cervical. El entorno local del útero y de las trompas de Falopio inhibe la movilidad y la función de los espermatozoides, lo que impide la fertilización. En estudios clínicos con JAYDESS 13.5 mg, se observó ovulación en la mayoría del subconjunto de pacientes estudiadas. Se observó ovulación en 34 de 35 mujeres durante el primer año, en 26 de 27 mujeres durante el segundo año y en 26 de 26 mujeres durante el tercer año.
La eficacia anticonceptiva de JAYDESS 13.5 mg se evaluó en un estudio clínico con 1,432 mujeres de 18 a 35 años de edad, de las cuales 38.8% (556) eran nulíparas y 83.6% de ellas (465) eran nuligrávidas.
Durante el primer año, el Índice de Pearl fue de 0.41 y el Índice de Pearl después de 3 años fue de 0.33. La tasa de falla fue de aproximadamente 0.4% a 1 año, y la tasa de falla acumulada fue de aproximadamente 0.9% a los 3 años. La tasa de falla también incluye embarazos debido a expulsiones y perforaciones no detectadas. Dado que el uso de JAYDESS 13.5 mg no requiere el cumplimiento de una ingesta diaria por parte de las usuarias, las tasas de embarazo durante el "uso típico" son similares a las observadas en los estudios clínicos controlados ("uso perfecto"). El uso de JAYDESS 13.5 mg no altera el curso de la fertilidad en el futuro. En otro estudio con 3 dosis diferentes de SIU-LNG, incluido JAYDESS 13.5 mg, 25 de 29 mujeres (86.2%) que deseaban quedar embarazadas concibieron en los 12 meses siguientes a la extracción del sistema.
Con JAYDESS 13.5 mg, la alteración de los patrones menstruales es el resultado de la acción directa del levonorgestrel en el endometrio y no refleja la función ovárica. No hay una diferencia clara en el desarrollo folicular, la ovulación o la producción de estradiol y progesterona en mujeres con distintos patrones de sangrado. En el proceso de inhibición de la proliferación endometrial, podría haber un aumento inicial del manchado durante los primeros meses de uso. A partir de ese momento, la supresión del endometrio ocasiona la reducción de la duración y el volumen del sangrado menstrual durante el uso de JAYDESS 13.5 mg. El sangrado escaso con frecuencia se transforma en oligomenorrea o amenorrea. La función ovárica permanece normal y las concentraciones de estradiol se mantienen, aun cuando las mujeres presenten amenorrea.
Propiedades farmacocinéticas: El principio activo de MIRENA es Levonorgestrel. El levonorgestrel es liberado localmente en la cavidad uterina.
MIRENA 52 mg:
La tasa de liberación inicial in vivo de levonorgestrel es de aproximadamente 20 mcg/24 h la cual disminuye a 10 mcg/24 h después de 5 años.
JAYDESS 13.5 mg:
Las tasas de liberación in vivo calculadas para diferentes puntos temporales se proporcionan en la siguiente tabla:
Tasas calculadas de liberación in vivo.
|
Tiempo |
Tasa calculada de liberación in vivo [µg/24 horas] |
|
24 días después de la colocación |
14 |
|
60 días después de la colocación |
10 |
|
3 años después de la colocación |
5 |
|
Promedio durante 3 años |
6 |
Absorción:
MIRENA 52 mg:
Después de la inserción, el levonorgestrel es inmediatamente liberado en la cavidad uterina, en base a las determinaciones de su concentración en suero. La alta exposición local al fármaco en la cavidad uterina ocasiona un gran gradiente de concentración desde el endometrio al miometrio (gradiente endometrio a miometrio > 100 veces) y bajas concentraciones de levonorgestrel en suero (gradiente endometrio a suero > 1 000 veces).
JAYDESS 13.5 mg:
Después de la colocación, el levonorgestrel se libera inmediatamente del SIU en la cavidad uterina, de acuerdo a las mediciones de la concentración del LNG en suero. La concentración máxima de levonorgestrel en suero se alcanza durante las primeras dos semanas después de la colocación de JAYDESS 13.5 mg. Siete días después de la colocación, se determinó una concentración media de levonorgestrel de 162 pg/ml. A partir de ese momento, las concentraciones en suero de levonorgestrel disminuyen con el tiempo hasta alcanzar concentraciones medias de 59 pg/ml después de 3 años. Con el uso de un SIU-LNG, la alta exposición local al fármaco en la cavidad uterina ocasiona un fuerte gradiente de concentración desde el endometrio hasta el miometrio (gradiente del endometrio al miometrio > 100 veces), y bajas concentraciones de levonorgestrel en suero (gradiente de endometrio a suero > 1 000 veces).
Distribución:
MIRENA 52 mg:
El Levonorgestrel se une de forma no específica a la albúmina del suero y de forma específica a la globulina fijadora de hormonas sexuales (SHBG, por sus siglas en inglés). Alrededor del 1-2% del levonorgestrel circulante se encuentra como esteroide libre y un 42-62% unido de forma específica a la SHBG. Durante el uso de MIRENA la concentración de SHBG disminuye. Por consiguiente, la fracción unida a SHBG disminuye durante el tratamiento y se incrementa la fracción libre. El volumen medio aparente de distribución es de 106 L.
Después de una hora de la inserción de MIRENA, el levonorgestrel es detectable en suero. La concentración máxima se alcanza dentro de las 2 semanas posteriores a la inserción. De acuerdo al decremento de la tasa de liberación, la concentración media en suero de levonorgestrel disminuye de 206 pg/mL (percentiles 25 a 75: 151 pg/mL a 264 pg/mL) a los 6 meses, a 194 pg/mL (146 pg/mL a 266 pg/mL) a los 12 meses y a 131 pg/mL (113 pg/mL a 161 pg/mL) a los 60 meses en mujeres en edad reproductiva con peso superior a 55 kg.
Se ha demostrado que el peso corporal y la concentración de SHBG afectan la concentración sistémica de levonorgestrel, es decir, el bajo peso corporal y/o altos niveles de SHBG incrementan la concentración de levonorgestrel. En mujeres en edad reproductiva con bajo peso corporal (37 a 55 kg) la concentración media en suero de Levonorgestrel es aproximadamente 1.5 veces mayor.
En mujeres postmenopáusicas usando MIRENA junto con tratamiento estrogénico no oral, la concentración media en suero de levonorgestrel disminuye de 257 pg/mL (percentiles 25 a 75: 186 pg/mL a 326 pg/mL) a los 12 meses a 149 pg/mL (122 pg/mL a 180 pg/mL) a los 60 meses. Cuando se usa MIRENA junto con tratamiento estrogénico oral, la concentración media en suero de levonorgestrel se incrementa a los 12 meses aproximadamente a 478 pg/mL (percentiles 25 a 75: 341 pg/mL a 655 pg/mL) debido a la inducción de SHBG por el tratamiento estrogénico oral.
JAYDESS 13.5 mg:
El levonorgestrel se une en forma no específica a la albúmina del suero y en forma específica a la globulina fijadora de hormonas sexuales (SHBG, por sus siglas en inglés). Menos del 2% del levonorgestrel circulante está presente como esteroide libre. El levonorgestrel se une con alta afinidad a la SHBG. En consecuencia, los cambios de la concentración en suero de SHBG producen un aumento (con concentraciones más altas de SHBG) o una disminución (con concentraciones más bajas de SHBG) de la concentración total de levonorgestrel en suero. La concentración de SHBG disminuye en promedio 15% durante el primer mes después de la colocación de JAYDESS 13.5 mg y permanece estable durante el periodo de 3 años de uso. La media del volumen de distribución aparente de levonorgestrel es de aproximadamente 106 L.
Biotransformación:
MIRENA 52 mg:
Levonorgestrel es extensamente metabolizado. Los metabolitos más importantes en el plasma son las formas conjugada y no conjugada de 3α, 5ß-tetrahidrolevonorgestrel. Basado en estudios in vivo e in vitro, la enzima CYP3A4 es la principal involucrada en el metabolismo de levonorgestrel, las enzimas CYP2E1, CYP2C19 y CYP2C9 pueden también estar involucradas, pero en menor grado.
JAYDESS 13.5 mg:
El levonorgestrel se metaboliza considerablemente. Los principales metabolitos en plasma son las formas no conjugada y conjugada de 3α, 5ß-tetrahidrolevonorgestrel. Según estudios in vitro e in vivo, CYP3A4 es la enzima principal involucrada en el metabolismo del levonorgestrel.
Eliminación:
MIRENA 52 mg, JAYDESS 13.5 mg:
La depuración total de levonorgestrel del plasma es de aproximadamente 1.0 mL/min/kg. Sólo cantidades mínimas de levonorgestrel se eliminan en forma inalterada. Los metabolitos son excretados en las heces y la orina con un cociente de excreción de aproximadamente 1. La vida media de excreción la cual es representada principalmente por los metabolitos es de aproximadamente 1 día.
Linealidad/no linealidad Farmacocinética:
MIRENA 52 mg:
La farmacocinética del levonorgestrel depende de la concentración de SHBG, que a su vez está influenciada por los estrógenos y andrógenos. Durante el primer mes de uso de JAYDESS 13.5 mg y MIRENA 52 mg, se observó una disminución media de SHBG de alrededor del 30%, lo que ocasiona una disminución del levonorgestrel en suero, indicando una farmacocinética no lineal del levonorgestrel con respecto al tiempo. En función de la acción principalmente local de JAYDESS 13.5 mg y MIRENA 52 mg, no se espera un efecto sobre la eficacia de JAYDESS 13.5 mg y MIRENA 52 mg.
JAYDESS 13.5 mg:
La farmacocinética del levonorgestrel depende de la concentración de SHBG, que a su vez está influenciada por los estrógenos y andrógenos. Una disminución de la concentración de SHBG ocasiona una disminución de la concentración total del levonorgestrel en suero, indicando una farmacocinética no lineal del levonorgestrel con respecto al tiempo. En función de la acción principalmente local de JAYDESS 13.5 mg, no se espera un efecto sobre la eficacia de JAYDESS 13.5 mg.
CONTRAINDICACIONES:
MIRENA 52 mg:
Embarazo o sospecha del mismo; enfermedad pélvica inflamatoria actual o recurrente; infección del aparato genital inferior; endometritis postparto; aborto séptico en los últimos tres meses; cervicitis; displasia cervical; neoplasia uterina o cervical; tumores progestágeno dependientes; hemorragia uterina anormal no diagnosticada; anomalía uterina congénita o adquirida incluyendo miomas si deforman la cavidad del útero; estados asociados a un aumento de la susceptibilidad a las infecciones; enfermedad hepática aguda o tumor hepático; hipersensibilidad a los constituyentes del preparado.
JAYDESS 13.5 mg:
Embarazo; enfermedad pélvica inflamatoria aguda o recurrente; o afecciones asociadas con un aumento del riesgo de infecciones pélvicas; cervicitis o vaginitis aguda; endometritis posparto o infección debida a un aborto durante los últimos tres meses; neoplasia cervical; neoplasia maligna uterina o cervical; tumores dependientes de progestágenos; sangrado vaginal anormal de etiología desconocida; anomalía uterina congénita o adquirida; incluidos fibromas que podrían interferir con la colocación y/o retención del sistema intrauterino (por ejemplo; si distorsionan la cavidad uterina); enfermedad hepática aguda o tumor hepático; hipersensibilidad al ingrediente activo o alguno de los excipientes.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
• Embarazo: El uso de MIRENA 52 mg y JAYDESS 13.5 mg está contraindicado durante el embarazo o sospecha del mismo (Ver sección Contraindicaciones). En caso de embarazo durante el uso de MIRENA 52 mg y JAYDESS 13.5 mg, se recomienda extraer el endoceptivo, puesto que cualquier anticonceptivo intrauterino que se deje in situ puede aumentar el riesgo de aborto y parto prematuro. La extracción de MIRENA 52 mg y JAYDESS 13.5 mg o la introducción de sondas en el útero también pueden provocar un aborto espontáneo. Si la mujer deseara continuar el embarazo y el sistema no puede extraerse, se le debe informar a la mujer sobre los riesgos y posibles consecuencias para el producto de un parto prematuro. El curso de estos embarazos debe ser estrechamente controlado. Se debe excluir un embarazo ectópico. Se debe instruir a la paciente para que comunique todos los síntomas que sugieran complicaciones en el embarazo, como por ejemplo, cólicos abdominales con fiebre.
Debido a la administración intrauterina y a la exposición local al levonorgestrel, se debe tener en cuenta la posibilidad de efectos de virilización en el feto de sexo femenino. La experiencia clínica de los resultados de embarazos con MIRENA 52 mg y JAYDESS 13.5 mg es limitada debido a la alta eficacia anticonceptiva, pero se le debe informar a la mujer que actualmente no hay evidencias de malformaciones congénitas causadas por el uso de MIRENA 52 mg y JAYDESS 13.5 mg, en caso de parto de término con MIRENA 52 mg y JAYDESS 13.5 mg in situ.
• Lactancia:
MIRENA 52 mg:
Aproximadamente 0.1% de la dosis de levonorgestrel se ha detectado en la leche materna, pero no es probable que exista un riesgo para el niño con la dosis liberada por MIRENA cuando se encuentra insertado en la cavidad uterina.
Parece que no hay efectos adversos sobre el crecimiento o desarrollo del lactante cuando se usa MIRENA después de seis semanas posparto. Los métodos con sólo progestágeno no parecen afectar la cantidad ni la calidad de la leche materna.
JAYDESS 13.5 mg:
En general, no parece haber un efecto perjudicial en el crecimiento ni en el desarrollo de los lactantes durante el uso de cualquier método con solo progestágenos después de seis semanas del parto. Un SIU-LNG (Levonorgestrel) no afecta la cantidad ni la calidad de la leche maternal. Pequeñas cantidades de progestina (aproximadamente 0.1% de la dosis de levonorgestrel) pasan a la leche materna en mujeres lactantes.
• Fertilidad: El uso de un SIU-LNG no altera el curso de la fertilidad en el futuro. Después de la extracción de MIRENA, la mujer recupera su fertilidad normal (consulte la sección "Propiedades farmacodinámicas").
Efectos sobre la capacidad de conducir y usar maquinaria: Ninguno conocido.
REACCIONES SECUNDARIAS Y ADVERSAS:
MIRENA 52 mg:
Resumen del perfil de seguridad: La mayoría de las mujeres experimenta cambios en el patrón de sangrado menstrual después de la inserción de MIRENA. Durante los primeros 90 días, el 22% de las mujeres experimentó sangrado prolongado y el 67% sangrado irregular después de la inserción posmenstruación de MIRENA, disminuyendo al 3% y 19% al final del primer año de uso, respectivamente. Concomitantemente, ninguna mujer experimentó y se presentó sangrado poco frecuente en el 11% durante los primeros 90 días, aumentando al 16% y 57% al final del primer año de empleo, respectivamente.
Cuando MIRENA se usa en combinación con tratamiento continuo de sustitución de estrógenos, se desarrolla gradualmente un patrón de ausencia de hemorragia en la mayoría de las mujeres durante el primer año.
Lista tabulada de reacciones adversas: Las frecuencias de las reacciones adversas al medicamento (RAM), reportadas con MIRENA, se resumen en la tabla siguiente. Las frecuencias se definen como muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1,000 a < 1 /1 00), raras (≥ 1/10,000 a < 1 /1,000) y no conocidas. En la siguiente tabla se presentan las reacciones adversas según la clasificación por órganos y sistemas de MedDRA (COS MedDRA). Las frecuencias son incidencias brutas de los eventos observados en estudios clínicos en las indicaciones anticoncepción y menorragia idiopática/sangrado menstrual abundante, incluyendo 5091 mujeres y 12,101 mujeres-año.
Las reacciones adversas en estudios clínicos en la indicación para la protección contra hiperplasia endometrial durante el tratamiento de sustitución de estrógenos (incluyendo 514 mujeres y 1218.9 mujeres-año) se observaron a una frecuencia similar, salvo que se especifique en pies de página.
|
Clase de órgano o sistema |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raros |
No conocida |
|
Trastornos del sistema inmunológico |
Hipersensibilidad, incluyendo erupción, urticaria y angioedema |
||||
|
Trastornos psiquiátricos |
Humor deprimido/depresión |
||||
|
Trastornos del Sistema nervioso |
Cefalea |
Migraña |
|||
|
Trastornos gastrointestinales |
Dolor pélvico/abdominal |
Náuseas |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Acné Hirsutismo |
Alopecia |
|||
|
Trastornos musculoesqueléticos, óseos y del tejido conjuntivo |
Dolor de espalda** |
||||
|
Trastornos del aparato reproductor y de la mama |
Cambios en el sangrado, incluyendo aumento y disminución del sangrado menstrual, manchado, oligomenorrea y amenorrea Vulvovaginitis* Secreción genital* |
Infección del aparato genital superior Quiste ovárico Dismenorrea Mastalgia** Expulsión del sistema anticonceptivo intrauterino (completa y parcial) |
Perforación uterina*** |
||
|
Exploraciones complementarias |
Aumento de la presión arterial |
El término MedDRA más adecuado se utiliza para describir una determinada reacción y sus sinónimos y trastornos relacionados.
* Estudios de protección endometrial: "frecuentes".
** Estudios de protección endometrial: "muy frecuentes".
*** Esta frecuencia se basa en los estudios clínicos que excluyeron a las mujeres en periodo de lactancia. En un gran estudio de cohortes, prospectivo, comparativo, no intervencional, en usuarias de DIU, la frecuencia de perforación en mujeres que estaban amamantando o que tuvieron una colocación hasta 36 semanas después del parto fue "poco frecuente" (ver Precauciones Generales).
JAYDESS 13.5 mg:
Resumen del perfil de seguridad: La mayoría de las mujeres experimenta cambios en el patrón de sangrado menstrual después de la colocación de JAYDESS 13.5 mg. Con el tiempo, la frecuencia de amenorrea y sangrado infrecuente aumenta, y la frecuencia de sangrado prolongado y frecuente disminuye. En estudios clínicos con JAYDESS 13.5 mg, se observaron los siguientes patrones de sangrado:
• Durante el primer periodo de referencia de 90 días, menos del 1% de las mujeres experimentaron amenorrea, 8% experimentaron sangrado infrecuente, 31% experimentaron sangrado frecuente, 39% experimentaron sangrado irregular* y 55% experimentaron sangrado prolongado*.
• Durante el segundo periodo de referencia de 90 días, 3% de las mujeres experimentaron amenorrea, 19% experimentaron sangrado infrecuente, 12% experimentaron sangrado frecuente, 25% experimentaron sangrado irregular* y 14% experimentaron sangrado prolongado*.
• Al final del tercer año, 12% de las mujeres experimentaron amenorrea, 22% experimentaron sangrado infrecuente, 4% experimentaron sangrado frecuente, 15% experimentaron sangrado irregular* y 2% experimentaron sangrado prolongado*.
* Las mujeres con sangrado prolongado también podrían estar incluidas en una de las otras categorías (excepto amenorrea).
Lista tabulada de reacciones adversas: La frecuencia de las reacciones adversas al medicamento (RAM) informadas con JAYDESS 13.5 mg se resume en la siguiente tabla. Dentro de cada agrupamiento de frecuencia, los efectos no deseables se presentan en orden de severidad descendente. La siguiente tabla informa las reacciones adversas según la Clase de órganos del sistema MedDRA (COS de MedDRA). Las frecuencias son las incidencias sin procesar de los eventos observados en estudios clínicos sobre la indicación de anticoncepción, que incluyeron 1672 mujeres y 3820.65 mujeres-año tratadas con JAYDESS 13.5 mg.
Las frecuencias se definen como:
Muy frecuente (≥ 1/10).
Frecuente (≥ 1/100 a < 1/10).
Poco frecuente (≥ 1/1,000 a < 1/100).
Infrecuente (≥ 1/10,000 a < 1/1,000).
Muy poco frecuente (< 1/10,000).
Reacciones adversas al medicamento, estudios clínicos de fase II y III, N = 1672 mujeres (3820.65 mujeres-año).
|
Clase de órganos del sistema (MedDRA) |
Muy frecuente |
Frecuente |
Poco frecuente |
Infrecuente |
Muy poco frecuente |
|
Trastornos psiquiátricos |
Estado de ánimo deprimido/depresión |
||||
|
Trastornos del sistema nervioso |
Dolor de cabeza |
Migraña |
|||
|
Trastornos gastrointestinales |
Dolor abdominal/pélvico |
Náusea |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Acné/Seborrea |
Alopecia |
Hirsutismo |
||
|
Trastornos del aparato reproductor y de las mamas |
Cambios en el sangrado menstrual, incluido el aumento o la disminución del sangrado menstrual, manchado, oligomenorrea y amenorrea Quiste ovárico* Vulvovaginitis |
Infección del tracto genital superior Dismenorrea Dolor/molestia en las mamas Expulsión del dispositivo (completa y parcial) Secreción genital |
Perforación del útero** |
< Se utiliza el término preferido del MedDRA para describir una cierta reacción y sus sinónimos y afecciones relacionadas. La representación de los términos de las RAF se basa en la versión <14.0> del MedDRA. >
* Los quistes ováricos se debían informar como EA si eran quistes anormales, no funcionales y/o tenían un diámetro > 3 cm en el examen con ultrasonido.
** Esta frecuencia se basa en los estudios clínicos que excluyeron a las mujeres en lactancia. En un gran estudio de cohortes, prospectivo, comparativo, no intervencional, en usuarias de otro SIU-LNG y usuarias de DIU de cobre, la frecuencia de perforación en mujeres que estaban amamantando o que tuvieron una colocación hasta 36 semanas después del parto fue "poco frecuente" (consulte la sección "Advertencias y precauciones especiales de empleo").
Descripción de reacciones adversas seleccionadas:
MIRENA 52 mg:
Embarazo, puerperio y condiciones perinatales: Cuando una mujer queda embarazada con MIRENA in situ, el riesgo relativo de embarazo ectópico aumenta.
Trastornos del aparato reproductor: Los hilos para la extracción puede sentirlos la pareja durante la relación sexual.
Trastornos mamarios: Se desconoce el riesgo de cáncer de mama cuando MIRENA se utiliza en la indicación para la protección contra hiperplasia endometrial durante el tratamiento de sustitución de estrógenos. Se han comunicado casos de cáncer de mama (frecuencia desconocida, ver la sección "Precauciones generales").
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos:
Las siguientes RAM se han reportado en relación con la inserción o el procedimiento de extracción de MIRENA: Dolor durante el procedimiento, sangrado durante el procedimiento, reacción vasovagal relacionada con la inserción con mareos o síncope. El procedimiento puede precipitar una crisis en una paciente epiléptica.
Se han reportado casos de sepsis (incluida la sepsis por estreptococos de grupo A) después de la colocación de un DIU (ver "Precauciones generales").
JAYDESS 13.5 mg:
Trastornos del Sistema inmunológico: Con el uso de otros SIUs de Levonorgestrel, se han informado casos de hipersensibilidad, incluidas erupción, urticaria y angioedema.
Embarazo, puerperio y afecciones perinatales: Si una mujer queda embarazada mientras está usando JAYDESS 13.5 mg, el riesgo relativo de embarazo ectópico aumenta.
Trastornos del aparato reproductor: Los hilos para la extracción puede sentirlos la pareja durante la relación sexual.
Se han informado las siguientes RAM con relación al procedimiento de colocación o de extracción de JAYDESS 13.5 mg: Dolor debido al procedimiento; sangrado debido al procedimiento; reacción vasovagal, mareos o síncope relacionados con la colocación. El procedimiento puede precipitar convulsiones en las pacientes epilépticas.
Infecciones e Infestaciones: Se han reportado, en relación a otros DIU, casos de sepsis (incluida la sepsis por estreptococos de grupo A) después de la colocación (ver "Precauciones generales").
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
MIRENA 52 mg:
Las evaluaciones sobre seguridad preclínica no revelaron riesgos especiales para los seres humanos, con base en estudios sobre seguridad farmacológica, toxicidad, genotoxicidad y potencial carcinogénico del levonorgestrel. En el conejo no se observó embriotoxicidad tras la administración intrauterina de levonorgestrel. La evaluación de la seguridad de los componentes elastoméricos del depósito de hormona, de los materiales polieitilénicos del producto y de la combinación de elastómero y levonorgestrel, teniendo como base los estudios sobre la toxicología genética en sistemas de ensayo in vitro e in vivo y análisis de biocompatibilidad en ratón, cobaya, conejos y sistemas de ensayo in Vitro no han revelado bioincompatibilidad.
JAYDESS 13.5 mg:
La evaluación preclínica de seguridad no reveló ningún riesgo especial para los seres humanos con base en estudios de farmacología, farmacocinética y toxicidad de seguridad, incluidos la genotoxicidad y el potencial carcinogénico del levonorgestrel. El levonorgestrel es un progestágeno bien establecido. El perfil de seguridad después de la administración sistémica está bien documentado. Estudios en monos con administración intrauterina de levonorgestrel durante 9 a 12 meses confirmaron la actividad farmacológica local con una buena tolerancia local y sin signos de toxicidad sistémica. No se observó embriotoxicidad en conejos después de la administración intrauterina de levonorgestrel. La evaluación de seguridad de los componentes de elastómero del depósito de la hormona, los materiales de polietileno del producto, y la combinación de elastómero y levonorgestrel, basada tanto en la evaluación de toxicología genética en sistemas de prueba estándares in vitro e in vivo así como en las pruebas de biocompatibilidad en ratones, ratas, cobayos y conejos, y en sistemas de prueba in vitro no reveló incompatibilidad biológica.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
MIRENA 52 mg:
El metabolismo de los progestágenos puede verse aumentado por el uso concomitante de sustancias que se sabe inducen enzimas metabolizantes de fármacos, específicamente las enzimas del sistema citocromo P450, tales como los anticonvulsivantes (p. ej., fenobarbital, fenitoína, carbamazepina) y anti-infecciosos (p. ej., rifampicina, rifabutina, nevirapina, efavirenz). Se desconoce la influencia de estos fármacos sobre la eficacia anticonceptiva de MIRENA, pero no se cree que pueda tener mayor importancia puesto que los mecanismos de acción anticonceptiva son principalmente locales.
JAYDESS 13.5 mg:
Se pueden producir interacciones con fármacos que inducen enzimas microsomales hepáticas, específicamente las enzimas del citocromo P450 y, por lo tanto, se podría aumentar el metabolismo del levonorgestrel, lo que ocasiona un aumento de la depuración de las hormonas sexuales (p. ej., fenitoína, barbitúricos, primidona, carbamazepina, rifampicina, rifabutina, nevirapina, efavirenz, bosentán y posiblemente también oxcarbazepina, topiramato, felbamato, griseofulvina y productos que contienen el remedio hierba de San Juan).
Por otro lado, las sustancias que han demostrado inhibir las enzimas metabolizadoras de fármacos (p. ej., itraconazol, ketoconazol) pueden aumentar las concentraciones séricas de levonorgestrel.
Se desconoce la influencia de esos fármacos sobre la eficacia de JAYDESS 13.5 mg, pero no se cree que tengan una importancia significativa debido al mecanismo de acción local.
Otras formas de interacción:
Imágenes por resonancia magnética (IRM): Las pruebas no clínicas han demostrado que se puede examinar con seguridad a una paciente después de la colocación de JAYDESS 13.5 mg (RM condicional) bajo las siguientes condiciones: campo magnético estático de 3 Tesla o menos, campo magnético de gradiente espacial máximo de 720 Gauss/cm o menos. Bajo estas condiciones, con 15 minutos de examen, el aumento máximo de la temperatura producido en el sitio de JAYDESS 13.5 mg fue de 1.8ºC. Puede aparecer una pequeña cantidad de artefactos en la imagen si la zona de interés está en la misma región o relativamente cerca de la posición del SIU JAYDESS 13.5 mg.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No existe evidencia.
PRECAUCIONES GENERALES: En caso de que cualquiera de las siguientes condiciones exista o se presente por primera vez, MIRENA 52 mg, JAYDESS 13.5 mg puede ser usado con precaución después de la consulta con el especialista o debe considerarse la extracción del endoceptivo:
• Migraña, migraña focal con pérdida asimétrica de la visión u otros síntomas indicadores de isquemia cerebral transitoria.
• Cefalea excepcionalmente intensa.
• Ictericia.
• Aumento marcado de la presión arterial.
• Enfermedad arterial grave como por ej. accidente cerebrovascular o infarto de miocardio.
MIRENA 52 mg:
Puede usarse con precaución en mujeres con enfermedad cardiaca congénita o valvulopatía con riesgo de endocarditis infecciosa. A estas pacientes se les debe administrar profilácticamente un antibiótico al insertar o extraer el endoceptivo.
Dosis bajas de levonorgestrel pueden afectar la tolerancia a la glucosa y en las usuarias de MIRENA diabéticas se debe monitorear la concentración de glucosa en la sangre.
Las hemorragias irregulares pueden enmascarar algunos síntomas y signos de pólipos endometriales ó cáncer de endometrio, y en estos casos se deben considerar medidas diagnósticas.
MIRENA no es el método de primera elección para mujeres jóvenes nulíparas, ni tampoco para mujeres postmenopáusicas con atrofia uterina avanzada.
Los datos disponibles demuestran que MIRENA no aumenta el riesgo de cáncer de mama en mujeres premenopáusicas menores de 50 años. Debido a la exposición limitada en estudios con MIRENA en la indicación para la protección contra la hiperplasia endometrial durante el tratamiento de sustitución de estrógenos, los datos disponibles no son suficientes para confirmar o refutar un riesgo de cáncer de mama cuando MIRENA se utiliza en esta indicación.
JAYDESS 13.5 mg:
Puede usarse con precaución en mujeres que tengan enfermedad cardiaca congénita o valvulopatía con riesgo de endocarditis infecciosa. El levonorgestrel en dosis bajas puede afectar la tolerancia a la glucosa, por lo que la concentración de glucosa en sangre se debe supervisar en las mujeres diabéticas que utilicen JAYDESS 13.5 mg. Sin embargo, generalmente no es necesario alterar el régimen terapéutico en pacientes que utilizan SIU-LNG.
• Consulta y examen médico: Antes de realizar la inserción, se debe informar a la paciente sobre la eficacia y riesgos de MIRENA. Se debe realizar un examen físico, incluyendo examen pélvico, de las mamas y citología cervical. Se debe realizar un frotis cervical según sea necesario, de acuerdo con la evaluación del profesional de la salud. Debe descartarse la existencia de embarazo e infecciones de transmisión sexual; las infecciones genitales deben ser previa y adecuadamente tratadas antes de la colocación. Además debe determinarse la posición del útero y el tamaño de la cavidad uterina. Es importante que el endoceptivo MIRENA quede colocado en el fondo uterino para así poder asegurar una exposición uniforme del endometrio al progestágeno, reducir el riesgo de expulsión y maximizar la eficacia. Por consiguiente, se deben observar estrictamente las instrucciones de colocación. Las instrucciones de colocación se deben seguir cuidadosamente. Se debe hacer énfasis en la capacitación sobre la técnica de colocación correcta. La inserción y la extracción pueden ir acompañadas de cierto dolor y hemorragia. El procedimiento puede producir desmayo como reacción vasovagal o una crisis en una paciente epiléptica.
La paciente debe ser reexaminada 4 a 12 semanas después de la inserción y posteriormente una vez al año a partir de ese momento o más a menudo si su condición clínica lo requiere.
MIRENA no es adecuado para ser usado como anticonceptivo postcoital ("anticonceptivo de emergencia").
Puesto que las hemorragias irregulares/manchado son comunes durante los primeros meses de tratamiento, antes de insertar MIRENA 52 mg debe excluirse la posibilidad de patología endometrial. Si la mujer continúa usando el endoceptivo MIRENA 52 mg, insertado previamente como método anticonceptivo, debe excluirse una patología endometrial en caso de que ocurran trastornos menstruales tras el inicio de la terapia de reemplazo estrogénica. Se deben tomar las medidas diagnósticas apropiadas en caso de que durante un tratamiento prolongado se presenten hemorragias irregulares.
El sangrado irregular y el manchado menstrual son frecuentes durante los primeros meses de tratamiento con todos los SIU-LNG, incluido JAYDESS 13.5 mg. Si el sangrado se vuelve más abundante y/o más irregular con el tiempo, se deben tomar las medidas de diagnóstico adecuadas, ya que el sangrado irregular puede ser un síntoma de enfermedad endometrial: pólipos, hiperplasia o cáncer.
• Oligomenorrea/amenorrea:
MIRENA 52 mg:
En mujeres en edad fértil se desarrolla gradualmente oligomenorrea y amenorrea en el 57% y 16% de las mujeres, respectivamente. Se debe considerar la posibilidad de un embarazo si no se presenta menstruación dentro de las 6 semanas siguientes al inicio de la menstruación anterior.
Cuando MIRENA se usa en combinación con terapia continua de sustitución estrogénica, en la mayoría de las mujeres se desarrolla gradualmente un patrón de ausencia de hemorragia durante el primer año.
JAYDESS 13.5 mg:
Gradualmente se desarrolla sangrado infrecuente y/o amenorrea en alrededor de 22.3% y 11.6% de las pacientes, respectivamente. Se debe considerar la posibilidad de un embarazo si la menstruación no ocurre en las seis semanas siguientes al inicio de la menstruación anterior. No es necesario repetir una prueba de embarazo en pacientes que permanecen en amenorrea a menos que esté indicado debido a otros signos de embarazo.
Infección pélvica: Al igual que otros procedimientos ginecológicos o quirúrgicos, se puede producir infección severa o sepsis (incluida la sepsis por estreptococos del grupo A) después de la colocación de un DIU, aunque es extremadamente raro que esto suceda.
MIRENA 52 mg:
Uno de los factores conocidos de riesgo de enfermedad pélvica inflamatoria es la promiscuidad sexual (múltiples parejas sexuales). La infección pélvica puede tener serias consecuencias y puede afectar la fertilidad y aumentar el riesgo de embarazo ectópico.
MIRENA debe ser extraído si la usuaria padece de endometritis o infecciones pélvicas recurrentes, o si una infección aguda es severa o no responde al tratamiento en el curso de algunos días.
JAYDESS 13.5 mg:
Aunque JAYDESS 13.5 mg y el dispositivo de colocación en sí están estériles, se podrían convertir en vehículos de transporte microbiano en el tracto genital superior debido a la contaminación bacteriana durante la colocación.
Se debe evaluar a las pacientes exhaustivamente para detectar factores de riesgo asociados con la infección pélvica (p. ej., múltiples parejas sexuales, infecciones de transmisión sexual, antecedentes previos de EPI) . Las infecciones pélvicas, como la enfermedad pélvica inflamatoria (EPI), pueden tener consecuencias graves, pueden disminuir la fertilidad y aumentar el riesgo de un embarazo ectópico.
Si una mujer experimenta endometritis o enfermedad pélvica inflamatoria recurrentes, o si una infección aguda es grave o no responde al tratamiento, se debe extraer JAYDESS 13.5 mg.
Los exámenes bacteriológicos están indicados y se recomienda la supervisión, incluso con síntomas discretos que sugieran la presencia de infección.
• Expulsión:
MIRENA 52 mg:
Los síntomas de expulsión completa o parcial de un DIU pueden incluir hemorragia o dolor. Sin embargo, es posible que el endoceptivo sea expulsado de la cavidad uterina sin que la mujer lo advierta, ocasionando la pérdida de la protección anticonceptiva. La expulsión parcial puede disminuir la eficacia de MIRENA. Dado que MIRENA disminuye el flujo menstrual, un aumento de éste puede ser un indicativo de una expulsión.
En caso de desplazamiento, MIRENA debe extraerse a la brevedad posible; al mismo tiempo puede insertarse un endoceptivo nuevo.
La paciente debe ser instruida sobre la forma como revisar los hilos del endoceptivo MIRENA.
JAYDESS 13.5 mg:
En estudios clínicos con JAYDESS 13.5, la incidencia de expulsión fue baja y dentro del mismo rango que el informado para otros DIU y SIU. Los síntomas de expulsión parcial o completa de JAYDESS 13.5 mg pueden incluir sangrado o dolor. Sin embargo, se puede producir una expulsión parcial o completa sin que la mujer lo note, lo que ocasiona una disminución o la pérdida de la protección anticonceptiva. Dado que JAYDESS 13.5 mg normalmente disminuye el sangrado menstrual con el tiempo, un aumento del sangrado menstrual podría indicar una expulsión.
Un dispositivo JAYDESS 13.5 mg parcialmente expulsado se debe extraer. Se puede colocar un sistema nuevo en ese momento, siempre y cuando se haya descartado un embarazo.
Se debe recomendar a la mujer que revise los hilos de JAYDESS 13.5 mg y que se comunique con su profesional de la salud si no los puede sentir.
• Perforación:
MIRENA 52 mg, JAYDESS 13.5 mg:
La perforación o penetración del cuerpo uterino o del cérvix por un anticonceptivo intrauterino puede ocurrir más frecuentemente durante la inserción y pueden disminuir la eficacia de MIRENA. En estos casos, el sistema intrauterino debe extraerse.
En un gran estudio de cohortes, prospectivo, comparativo, no intervencional, en usuarias de DIU (N = 61,448 mujeres), la incidencia de perforación fue 1.3 (IC del 95%: 1.1-1.6) por cada 1 000 colocaciones en el estudio de cohortes completo; 1.4 (IC del 95%: 1.1-1.8) por cada 1 000 colocaciones en la cohorte de MIRENA y 1.1 (IC del 95%: 0.7-1.6) por cada 1 000 colocaciones en la cohorte de DIU de cobre.
En el estudio se demostró que tanto la lactancia en el momento de la colocación como la colocación hasta 36 semanas después del parto estaban asociadas a un riesgo mayor de perforación (ver la Tabla 1). Estos factores de riesgo eran independientes del tipo de DIU colocado.
Tabla 1. incidencia de perforación por cada 1 000 colocaciones para el estudio de cohortes completo, estratificado por lactancia y tiempo desde el parto a la colocación (mujeres que parieron)
|
Lactancia al momento de la colocación |
Sin lactancia al momento de la colocación |
|
|
Colocación ≤ 36 semanas después del parto |
5.6 (IC del 95% 3.9-7.9; n = 6047 colocaciones) |
1.7 (IC del 95% 0.8-3.1; n = 5927 colocaciones) |
|
Colocación > 36 semanas después del parto |
1.6 (IC del 95% 0.0-9.1; n = 608 colocaciones) |
0.7 (IC del 95% 0.5-1.1; n = 41910 colocaciones) |
El riesgo de perforación puede aumentar en mujeres con el útero retrovertido fijo.
• Embarazo ectópico:
MIRENA 52 mg:
La mujer con historia previa de embarazo ectópico, cirugía tubárica ó infección pélvica tiene un riesgo mayor de embarazo ectópico. Se debe considerar la posibilidad de un embarazo ectópico en el caso de dolor abdominal inferior, especialmente en combinación con ausencia de menstruación, o si una mujer en amenorrea comienza a sangrar. En los estudios clínicos, la tasa de embarazo ectópico con MIRENA fue aproximadamente 0,1% al año. En un gran estudio de cohortes, prospectivo, comparativo, no intervencional, con un periodo de observación de 1 año, la tasa de embarazo ectópico con MIRENA fue 0.02%. El riesgo absoluto de embarazo ectópico en las usuarias de MIRENA es bajo. Sin embargo, cuando una mujer se queda embarazada con MIRENA in situ, aumenta la probabilidad relativa de embarazo ectópico.
JAYDESS 13.5 mg:
Las mujeres con antecedentes de embarazo ectópico, cirugía de trompas o infección pélvica tienen un mayor riesgo de embarazo ectópico. Se debe considerar la posibilidad de un embarazo ectópico en caso de dolor en la parte baja del abdomen, especialmente con relación a periodos faltantes o si una mujer amenorreica comienza a sangrar. Se debe evaluar a las mujeres que queden embarazadas mientras estén usando JAYDESS 13.5 mg, para detectar un embarazo ectópico. El riesgo absoluto de embarazo ectópico en usuarias de JAYDESS 13.5 mg es bajo. Sin embargo, cuando una mujer queda embarazada con JAYDESS 13.5 mg colocado, la probabilidad de que ese embarazo sea ectópico es elevada.
La incidencia general de embarazo ectópico con JAYDESS 13.5 mg es de aproximadamente 0.11 por cada 100 mujeres-año. Esta tasa es más baja que en mujeres que no usan ningún método anticonceptivo (0.3 a 0.5 por cada 100 mujeres-año).
• Pérdida de los hilos de extracción: Si en las visitas de seguimiento no se pueden detectar en el cérvix los hilos de extracción, debe excluirse un embarazo. Es posible que los hilos se hayan desplazado al canal cervical o a la cavidad uterina y que reaparezcan durante la siguiente menstruación. Si se ha confirmado la ausencia de embarazo, los hilos pueden localizarse, por lo general, sondeando suavemente con un instrumento adecuado. Si no se pueden encontrar, debería considerarse la posibilidad de una expulsión o una perforación.
MIRENA 52 mg:
El endoceptivo MIRENA puede localizarse mediante ultrasonido para demostrar su correcta posición. En caso de que no se disponga de ultrasonido o éste no sea satisfactorio, MIRENA puede localizarse mediante una radiografía.
JAYDESS 13.5 mg:
Se puede utilizar un examen con ultrasonido para evaluar la posición del sistema. Si no se dispone de ultrasonido o este es infructuoso, se pueden utilizar rayos X para localizar JAYDESS 13.5 mg.
Quistes ováricos:
MIRENA 52 mg:
Puesto que el efecto anticonceptivo de MIRENA es principalmente local, generalmente se presentan ciclos ovulatorios con ruptura folicular en mujeres en edad fértil. Algunas veces la atresia folicular está retrasada y la foliculogénesis puede continuar. Se han notificado quistes ováricos como reacciones adversas al medicamento en aproximadamente el 7% de las usuarias de MIRENA. Por lo general, estos folículos son asintomáticos, aun cuando algunos pueden ir acompañados de dolor pélvico o dispareunia.
En la mayoría de los casos los quistes ováricos desaparecen espontáneamente durante 2 a 3 meses de observación. Si éste no fuese el caso, se recomienda continuar con la monitorización por ultrasonido y considerar otras medidas diagnósticas ó terapéuticas. Muy rara vez se requiere intervención quirúrgica.
• Hilos no visibles: Si los hilos de extracción no son visibles en el cérvix en exploraciones de seguimiento, se debe excluir un embarazo. Es posible que los hilos hayan ingresado al útero o al canal del cuello uterino y pueden volver a aparecer durante el siguiente periodo menstrual. Si se ha excluido un embarazo, los hilos pueden ubicarse, generalmente, explorando suavemente el canal del cuello uterino con un instrumento adecuado. Si no se pueden encontrar los hilos, se debe considerar la posibilidad de expulsión o perforación. Se puede utilizar una evaluación con ultrasonido para determinar la posición del SIU-LNG.
• Quistes ováricos /folículos ováricos agrandados:
JAYDESS 13.5 mg:
Dado que el efecto anticonceptivo de JAYDESS 13.5 mg se debe principalmente a sus efectos locales dentro del útero, por lo general no hay ningún cambio en la función ovulatoria, lo que incluye el desarrollo folicular habitual, la liberación de ovocitos y la atresia folicular en mujeres en edad fértil. A veces la atresia del folículo se retrasa y la foliculogénesis puede continuar. No es posible distinguir clínicamente esos folículos agrandados de los quistes ováricos, y se han informado como reacciones adversas al fármaco en aproximadamente 13.2% de las mujeres que usan JAYDESS 13.5 mg, incluidos los quistes ováricos, los quistes ováricos hemorrágicos y los quistes ováricos rotos. La mayoría de esos folículos agrandados son asintomáticos, aunque algunos pueden ir acompañados de dolor pélvico o dispareunia.
En la mayoría de los casos, los folículos agrandados se resuelven espontáneamente durante dos a tres meses de observación. Si un folículo agrandado no se resuelve espontáneamente, podría ser adecuada la supervisión continua con ultrasonido y otras medidas de diagnóstico/terapéuticas. Raramente, podría ser necesaria una intervención quirúrgica.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dispositivo intrauterino:
MIRENA 52 mg:
MIRENA 52 mg se inserta en la cavidad uterina y tiene una duración efectiva de 5 años.
La tasa de disolución in vivo de levonorgestrel es de aproximadamente 20 µg/24 horas inicialmente y se reduce a aproximadamente 10 µg/24 horas después de 5 años. La tasa de disolución promedio de levonorgestrel es de aproximadamente 14 µg/24 horas durante los primeros cinco años.
En mujeres bajo terapia de reemplazo hormonal, MIRENA 52 mg puede usarse en combinación con preparados estrogénicos orales o transdérmicos sin progestágeno.
MIRENA 52 mg cuando es insertado de acuerdo a las instrucciones de inserción, tiene un índice de falla de aproximadamente 0.2% a un año y un índice de falla acumulado de aproximadamente 0.7% en 5 años.
Inserción y extracción/sustitución: En mujeres en edad fértil, MIRENA 52 mg debe insertarse en la cavidad uterina en cualquiera de los siete días siguientes al inicio de la menstruación. MIRENA puede reemplazarse por un endoceptivo nuevo en cualquier momento del ciclo. También puede insertarse inmediatamente después de un aborto del primer trimestre.
Las inserciones postparto deberán posponerse hasta que el útero haya involucionado completamente, sin embargo, no antes de las 6 semanas posteriores al parto. Si la involución se retrasa notablemente, considerar esperar hasta 12 semanas post-parto. En caso de una difícil inserción, y/o dolor excepcional o sangrado durante o después de la inserción, debe realizarse inmediatamente un examen físico y un ultrasonido para excluir perforación.
Cuando se usa para proteger el endometrio durante la terapia de reemplazo estrogénica, MIRENA 52 mg puede insertarse en cualquier momento en una mujer con amenorrea, o durante los últimos días de la menstruación o hemorragia por deprivación.
Se recomienda que MIRENA 52 mg sea insertado por el médico tratante o el especialista con experiencia en inserciones de MIRENA y tenga entrenamiento suficiente para ello.
MIRENA 52 mg se extrae tirando suavemente de los hilos con unas pinzas. Si no pueden verse los hilos y el endoceptivo está en la cavidad uterina, se puede extraer utilizando una pinza angosta, lo que puede requerir de la dilatación del canal cervical u otra intervención quirúrgica.
El endoceptivo debe extraerse después de 5 años de uso. Si la usuaria desea continuar usando el mismo método, se le puede insertar inmediatamente un nuevo endoceptivo.
En las mujeres en edad fértil que no deseen quedar embarazadas, MIRENA 52 mg debe extraerse durante la menstruación, siempre y cuando exista un ciclo menstrual. Si el endoceptivo se extrae en la mitad del ciclo y la mujer ha tenido relaciones sexuales durante la semana anterior, corre riesgo de embarazo a menos que se inserte un nuevo endoceptivo inmediatamente después de la extracción.
Después del reemplazo de MIRENA 52 mg, es necesario revisar que el sistema extraído se encuentre intacto. Durante extracciones difíciles, se han reportado casos individuales relacionados con el desplazamiento del cilindro hormonal sobre los brazos horizontales, lo cual ocasiona que éstos se oculten dentro del cilindro. Esta situación no requiere de intervenciones adicionales una vez que se ha determinado que el SIU se encuentra completo. Las protuberancias de los brazos horizontales normalmente evitan que el cilindro se desprenda totalmente del cuerpo en forma de T.
Instrucciones para su manejo y su uso: MIRENA 52 mg se suministra en un envase estéril que sólo debe abrirse inmediatamente antes de la inserción. El producto expuesto debe manejarse bajo condiciones asépticas. Si está rota la junta del envase estéril, el producto debe desecharse.
JAYDESS 13.5 mg:
JAYDESS 13.5 mg se coloca en la cavidad uterina y es eficaz hasta por tres años.
La tasa de liberación in vivo es de aproximadamente 14 µg/24 horas después de 24 días y se reduce a aproximadamente 10 µg/24 horas después de 60 días. Luego, declina progresivamente hasta alcanzar los 5 µg/24 horas después de tres años. La tasa promedio de liberación de levonorgestrel in vivo es de aproximadamente 6 µg/24 horas durante el periodo de tres años.
Cuando se ha colocado siguiendo las instrucciones de colocación, JAYDESS 13.5 mg tiene una tasa de falla de aproximadamente 0.4% a 1 año y una tasa de falla acumulada de aproximadamente 0.9% a los 3 años. La tasa de falla también incluye embarazos debido a expulsiones y perforaciones uterinas no detectadas.
Colocación y retiro/reemplazo: Se recomienda que JAYDESS 13.5 mg sólo sea colocado por médicos/profesionales de la salud que tengan experiencia en la colocación del SIU y/o que hayan recibido capacitación sobre el procedimiento de colocación de JAYDESS 13.5 mg.
JAYDESS 13.5 mg se debe colocar dentro de la cavidad uterina en los siete días siguientes al inicio de la menstruación. JAYDESS 13.5 mg se puede reemplazar con un nuevo sistema en cualquier momento del ciclo. JAYDESS 13.5 mg también se puede colocar inmediatamente después de un aborto del primer trimestre.
La colocación posparto se debe posponer hasta la involución completa del útero, no antes de que hayan pasado seis semanas desde el parto. Si la involución se retrasa sustancialmente, considere esperar hasta 12 semanas después del parto.
En caso de una colocación difícil y/o dolor o sangrado excepcional durante la colocación o después de ella, se deben tomar inmediatamente las medidas necesarias para descartar una perforación, como un examen físico y un ultrasonido.
JAYDESS 13.5 mg se distingue de otros SIU-Lenovorgestrel por la visibilidad de su anillo de plata en el ultrasonido. El cuerpo en forma de T de JAYDESS 13.5 mg contiene sulfato de bario, que lo hace visible en el examen con rayos X.
JAYDESS 13.5 mg se extrae jalando los hilos suavemente con una pinza. Si los hilos no están a la vista y el sistema se detecta en la cavidad uterina durante el examen con ultrasonido, se puede extraer con una pinza delgada. Esto podría requerir la dilatación del canal cervical o una intervención quirúrgica.
El sistema se debe extraer a más tardar al finalizar el tercer año. Si la mujer desea seguir usando el mismo método, se puede colocar un nuevo sistema intrauterino inmediatamente después de haber extraído el sistema original.
Si no se desea un embarazo, la extracción se debe realizar en los siete días siguientes al inicio de la menstruación, siempre y cuando la mujer siga teniendo periodos menstruales regularmente. Si el sistema se extrae en otro momento del ciclo y la mujer mantuvo relaciones sexuales durante la semana previa, tiene riesgo de embarazarse a menos que se coloque un nuevo sistema inmediatamente después de la extracción.
Después de la extracción de JAYDESS 13.5 mg, el sistema se debe examinar para verificar que esté intacto.
Instrucciones de uso y manejo: JAYDESS 13.5 mg se suministra en un empaque estéril que no se debe abrir hasta que sea necesario para su colocación. El producto expuesto se debe manejar utilizando técnicas asépticas. Si el sello del empaque estéril está roto o parece alterado, el producto no se debe usar.
JAYDESS 13.5 mg, sistema intrauterino liberador de levonorgestrel de dosis baja:
Debe ser colocado por un profesional de la salud utilizando una técnica aséptica: JAYDESS 13.5 mg se suministra dentro de un dispositivo de colocación en un empaque estéril, el cual no se debe abrir hasta que sea necesario para la colocación. No re-esterilizar. Como se suministra, JAYDESS 13.5 mg es para un solo uso. No utilizar si el empaque interno está dañado o abierto. No colocar después del mes y año de vencimiento que se muestra en la etiqueta.
Para conocer el momento de colocación, consulte la información de prescripción de JAYDESS 13.5 mg.
Preparación para la colocación:
• Examine a la paciente para establecer el tamaño y la posición del útero, así como para detectar cualquier signo de infección genital aguda u otras contraindicaciones para la colocación de JAYDESS 13.5 mg, como la presencia de un embarazo.
• Coloque un espéculo, visualice el cuello del útero, y luego limpie meticulosamente el cuello del útero y la vagina con una solución antiséptica adecuada.
• Recurra a un asistente si es necesario.
• Sujete el labio anterior del cuello del útero con un tenáculo u otra pinza para alinear el útero. Si el útero está en retroversión, podría ser más adecuado sujetar el labio posterior del cuello del útero. Se puede aplicar tracción suave a la pinza a fin de enderezar el canal cervical y alinearlo con la cavidad uterina. La pinza debe permanecer en su posición, y se debe mantener una ligera contracción del cuello del útero durante todo el procedimiento de colocación.
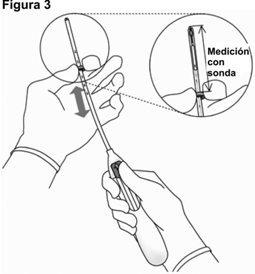
• Coloque una sonda uterina (histerómetro) a través del canal cervical hasta el fondo del útero, para medir su profundidad y confirmar la dirección de la cavidad uterina, y para descartar cualquier evidencia de anomalías intrauterinas (p. ej., tabique, fibromas submucosos) o un anticonceptivo intrauterino colocado previamente y que no se haya extraído. Si hay alguna dificultad, considere la dilatación del canal cervical. Si se requiere la dilatación cervical, considere el uso de analgésicos y/o bloqueo paracervical.
Colocación:
1. Primero, abra el empaque estéril completamente (Figura 1). Luego, use una técnica aséptica y guantes estériles.
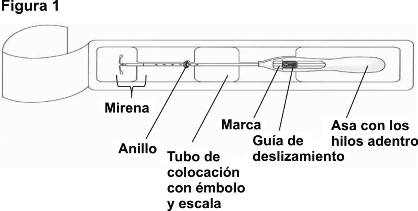
2. Empuje la guía de deslizamiento hacia adelante en la dirección de la flecha hasta la posición más alejada, para cargar JAYDESS 13.5 mg en el tubo de colocación (Figura 2).
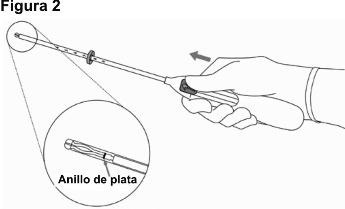
¡IMPORTANTE! No jale la guía de deslizamiento hacia abajo, ya que eso podría liberar el dispositivo prematuramente. Una vez liberado, no se puede volver a cargar.
3. Manteniendo la guía de deslizamiento en la posición más alejada, ajuste el borde superior del anillo para que se corresponda con la medición de la profundidad del útero (Figura 3).
4. Mientras sostiene la guía de deslizamiento en la posición más alejada, deslice el dispositivo de colocación a través del cuello del útero hasta que el anillo esté a aproximadamente 1.5 a 2.0 cm del cuello del útero (Figura 4).
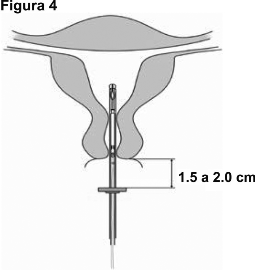
¡IMPORTANTE! No forzar el dispositivo de colocación. Dilate el canal cervical, si es necesario.
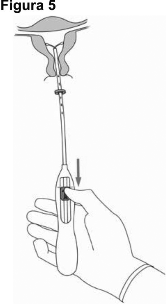
5. Mientras sostiene el dispositivo de colocación establemente, jale la guía de deslizamiento hasta la marca, para abrir los brazos horizontales de JAYDESS 13.5 mg (Figura 5). Espere de 5 a 10 segundos hasta que los brazos horizontales se abran por completo.
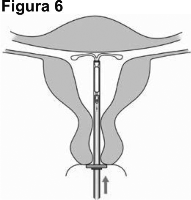
6. Deslice el dispositivo de colocación suavemente hacia el fondo del útero hasta que el anillo toque el cuello del útero. JAYDESS 13.5 mg está ahora en su posición correcta, en el fondo del útero (Figura 6).
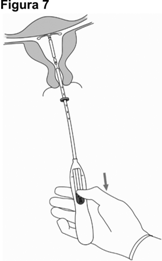
7. Mientras sostiene el dispositivo de colocación en su lugar, libere JAYDESS 13.5 mg, jalando la guía de deslizamiento por completo hacia abajo (Figura 7). Mientras sostiene la guía de deslizamiento completamente hacia abajo, retire suavemente el dispositivo de colocación, jalándolo hacia afuera. Corte los hilos de forma que queden 2 a 3 cm visibles fuera del cuello del útero.
¡IMPORTANTE! Si sospecha que el sistema intrauterino no está en la posición correcta, verifique su colocación (p. ej., con ultrasonido). Retire el sistema si no está colocado correctamente dentro de la cavidad uterina. Un sistema extraído no se puede volver a colocar.
Extracción/reemplazo:
Para la extracción/reemplazo, consulte la información de prescripción de JAYDESS 13.5 mg.
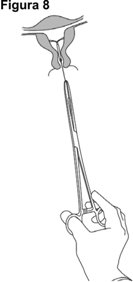
JAYDESS 13.5 mg se extrae jalando los hilos suavemente con una pinza (Figura 8).
Puede colocar un nuevo dispositivo JAYDESS 13.5 mg inmediatamente después de la extracción.
Información adicional sobre poblaciones especiales:
Niñas y adolescentes:
MIRENA 52 mg:
Se ha establecido la seguridad y eficacia de MIRENA 52 mg en mujeres en edad fértil. No existe indicación relevante para el uso de MIRENA 52 mg antes de la menarquia.
JAYDESS 13.5 mg:
Pacientes pediátricas: Se observó que el perfil de seguridad de JAYDESS 13.5 mg en un estudio de 304 adolescentes pospúberes fue consistente con el observado en la población adulta.
El perfil de seguridad de JAYDESS 13.5 mg observado en un estudio de 304 adolescentes pospúberes fue consistente con el observado en la población adulta. Se espera que la eficacia y la seguridad sean iguales en las adolescentes pospúberes menores de 18 años que en las mujeres de 18 años o más. No hay una indicación para el uso de JAYDESS 13.5 mg antes de la menarquia.
Pacientes geriátricas: MIRENA 52 mg no ha sido estudiado en mujeres mayores de 65 años.
JAYDESS 13.5 mg no ha sido estudiado en mujeres mayores de 65 años. No hay una indicación para el uso de JAYDESS 13.5 mg en mujeres posmenopáusicas.
Pacientes con insuficiencia hepática: MIRENA 52 mg, está contraindicado en mujeres con enfermedad hepática aguda o tumor hepático (ver Contraindicaciones).
JAYDESS 13.5 mg no se ha estudiado en mujeres con insuficiencia hepática. JAYDESS 13.5 mg está contraindicado en mujeres con enfermedad hepática aguda o tumor hepático (ver Contraindicaciones).
Pacientes con insuficiencia renal: MIRENA 52 mg y JAYDESS 13.5 mg no se ha estudiado en mujeres con insuficiencia renal.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No aplica.
PRESENTACIÓN: Caja con un dispositivo intrauterino.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Protéjase de la luz solar y de la humedad.
Consérvese o manténgase a no más de 30°C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. Literatura exclusiva para médicos. No se use durante el embarazo.
Reporte las sospechas de reacciones adversas al correo:
farmacovigilancia@cofepris.gob.mx
Hecho en Finlandia por:
Bayer Oy
Pansiontie 47, 20210 Turku,
Finlandia
Distribuido por:
BAYER DE MÉXICO, S.A. de C.V.
Carr. México-Toluca Km 52.5
C.P. 52000, Lerma, México
Reg. Núm. 259M99, SSA IV
173300416T0039
Fecha de autorización: 19.Jun.2017