
MYSPESS
MISOPROSTOL
Óvulos
1 Caja , 1 Óvulos , 200 µg
1 Caja , 2 Óvulos , 200 µg
1 Caja , 5 Óvulos , 200 µg
FORMA FARMACÉUTICA Y FORMULACIÓN:
MIV: Sistema de liberación prolongada inserto vaginal = óvulo de misoprostol.
Cada ÓVULO contiene:
|
Misoprostol |
200 mcg |
|
Excipiente, c.b.p. 1 óvulo. |
|
INDICACIONES TERAPÉUTICAS: El MIV (óvulo de misoprostol) está indicado para la inducción del trabajo de parto en mujeres con o cerca del embarazo a término.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacología clínica:
Farmacodinamia: La PGE1 es un compuesto natural cuyo análogo sintético es el misoprostol. El misoprostol tiene efectos sobre el tracto gastrointestinal, incluyendo la inhibición de la secreción ácida gástrica y la protección de la mucosa contra una variedad de estímulos nocivos. Las prostaglandinas en general tienen dos funciones: contracción del músculo liso y regulación de la actividad hormonal.
El tejido cervical se compone de músculo liso, tejido conjuntivo y colágena; su actividad, por lo tanto, es influenciada por las prostaglandinas. Las divisiones funcionales del trabajo de parto son: preparatoria, dilatatoria y pélvica. En la división preparatoria el cérvix experimenta una muy pequeña dilatación, aunque los cambios más notables ocurren en la colágena y el tejido conjuntivo. La prostaglandina comienza el proceso para la preparación cervical o "maduración". Las prostaglandinas son agentes eficaces para la maduración cervical y la inducción del trabajo de parto en el embarazo a término.
Farmacocinética: El inserto vaginal de misoprostol MIV (óvulo de misoprostol), con la presencia de humedad, permite la liberación del misoprostol in vivo a una tasa aproximada de 8 mcg por hora, hasta por 24 horas.
El misoprostol se metaboliza rápidamente a su ácido libre, el ácido de misoprostol, que es un metabolito activo. Solamente el ácido libre es detectable en plasma. Se metaboliza posteriormente en los metabolitos ácidos inactivos dinor y tetranor antes de su excreción.
En un estudio con 12 voluntarias sanas, no embarazadas, se observó una Cmáx. promedio de 73.4 pg/ml, con un Tmáx. promedio de 9.2 horas. En un estudio con mujeres embarazadas a término se observó una Cmáx. de 35.4 pg/ml con un Tmáx. promedio de 6.1 horas. La vida media terminal (después de retirar el inserto) fue menor de una hora en las voluntarias no embarazadas y en las mujeres con embarazo a término.
Eficacia: En cuatro estudios clínicos llevados a cabo en 1,413 mujeres en México, Inglaterra, Estados Unidos y Canadá, el MIV 200 mg ha mostrado la habilidad de inducir el trabajo de parto y reducir el tiempo para el parto vaginal. En uno de estos estudios, Miso-Obs-204, el MIV 200 mg fue probado en 131 mujeres con un Índice de Bishop modificado de 4 o menos al ingreso. En esta población, el promedio de inducción para el parto vaginal fue de 19.7 horas. Un total de 80.25 de las mujeres alcanzaron una madurez cervical exitosa a las 12 horas, y 76.0% de las mujeres tuvieron un parto vaginal dentro de las 24 horas posteriores a la aplicación inicial del MIV.
En 48.9% (64/131) de los sujetos expuestos a MIV 200 mg se utilizó oxitocina previa al parto.
CONTRAINDICACIONES: El MIV (óvulo de misoprostol) no debe ser utilizado o dejado en su lugar:
1. Antes de la semana 36 de la gestación.
2. Cuando el trabajo de parto ha comenzado.
3. Cuando se están administrando oxitócicos u otros agentes inductivos del trabajo de parto.
4. Cuando ha habido cirugía uterina mayor, por ejemplo, cesárea.
5. Cuando hay desproporción cefalopélvica.
6. Cuando existe una presentación fetal anómala.
7. Cuando existe sospecha o evidencia de sufrimiento fetal.
8. Cuando existen antecedentes de una cirugía mayor previa o ruptura del cérvix.
9. Cuando existe placenta previa o sangrado vaginal inexplicable después de 24 semanas de gestación en el embarazo actual.
10. Cuando existe hipersensibilidad al misoprostol o a cualquiera de los excipientes.
11. Paridad > 3.
Advertencias: El MIV (óvulo de misoprostol) debe ser administrado sólo por personal obstétrico apropiadamente entrenado y en una unidad obstétrica adecuada.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Trabajo de parto: El MIV está indicado para la inducción del trabajo de parto en mujeres con o cerca del embarazo a término.
Madres lactantes: El misoprostol se ha detectado en la leche materna después de la administración vaginal. Las concentraciones del ácido de misoprostol en la leche materna son muy bajas, los niveles cayeron rápidamente después de la dosificación, de modo que la cantidad total del misoprostol excretado en el calostro o la leche fue clínicamente insignificante (Vogel, Abdel - Aleem).
REACCIONES SECUNDARIAS Y ADVERSAS: Las siguientes han sido reportadas como reacciones adversas al fármaco en mujeres que han recibido el MIV 200 mg en los estudios clínicos efectuados.
Tabla 1: Reacciones adversas con ocurrencia > 1% en los sujetos con MIV 200 mg
|
Reacción adversa al medicamento (término del MedDRA) |
Inserto vaginal de misoprostol (MIV) Número de sujetos (% de población) |
|
200 mcg |
|
|
Número de sujetos |
172 |
|
Materno-fetales |
|
|
Trabajo de parto anormal que afecta al feto |
11 (6%) |
|
Desórdenes en el ritmo cardiaco fetal |
30 (17%) |
|
Meconio en el líquido amniótico |
5 (3%) |
|
Contracciones uterinas anormales |
52 (30%) |
|
Hipertonía uterina |
5 (3%) |
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogénesis, mutagénesis y alteraciones de la fertilidad: No se han realizado estudios a largo plazo de la carcinogenicidad y de la fertilidad con el MIV (óvulo de misoprostol). Los estudios de la carcinogenicidad realizados en ratas y ratones con misoprostol por vía oral fueron negativos.
El misoprostol no es mutagénico en una gama de ensayos in vitro; ningún dato in vivo parece estar disponible en la literatura. En estudios de fertilidad en ratas existe evidencia de posibles efectos adversos del misoprostol en la implantación, pero esta observación y la potencial teratogenicidad del fármaco no es un problema de seguridad para el MIV, pues se contraindica para su uso antes de la semana 36 de gestación (véase Contraindicaciones).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones del fármaco: No se recomienda el uso concomitante de fármacos oxitócicos o de otros agentes que induzcan el trabajo de parto debido al elevado potencial de efectos uterotónicos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han reportado exámenes de laboratorio anormales con el uso de misoprostol.
PRECAUCIONES GENERALES: El óvulo de misoprostol (MIV) no se ha estudiado en mujeres con gestación múltiple y, por lo tanto, se debe utilizar con precaución en estas mujeres.
El MIV no se ha estudiado en mujeres cuyas membranas se hayan roto por más de 48 horas antes de la inserción del MIV y, por lo tanto, se debe utilizar con precaución en estas mujeres.
Debido a que las prostaglandinas refuerzan el efecto uterotónico de los fármacos oxitócicos, el MIV debe ser retirado antes de que se inicie la administración de la oxitocina. Se recomienda un intervalo de dosificación de por lo menos 30 minutos para el uso secuencial de la oxitocina después del retiro del inserto.
El MIV se debe retirar bajo las siguientes circunstancias: al inicio del trabajo de parto; si las contracciones uterinas son prolongadas o excesivas; si existe evidencia de compromiso fetal.
Se debe monitorear cuidadosamente la actividad uterina y la condición fetal mientras el MIV esté colocado.
Uso pediátrico: La seguridad y la eficacia del MIV se ha establecido en mujeres embarazadas mayores de 18 años de edad. El MIV no se ha estudiado sistemáticamente en mujeres menores de 18 años de edad.
Uso geriátrico: El MIV está indicado para su uso en mujeres en edad reproductiva y quienes están embarazadas y, por lo tanto, no está indicado para la población geriátrica.
DOSIS Y VÍA DE ADMINISTRACIÓN: El MIV (óvulo de misoprostol) contiene 200 mcg de misoprostol, diseñado para ser liberado a razón de 8 mcg/hora aproximadamente. Un solo MIV debe insertarse por hasta 24 horas. El MIV se debe retirar bajo las siguientes circunstancias: ante el inicio del trabajo de parto; si las contracciones uterinas son prolongadas o excesivas; si hay evidencia de compromiso fetal; si han transcurrido 24 horas desde la inserción.
Para retirar el MIV del empaque primario, primero rasgue la envoltura a lo largo de la parte superior del sobre (a). Utilizar la cinta de retiro para sacar suavemente el inserto del sobre (b). Sostener el inserto entre los dedos índice y medio (c).
a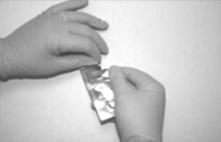 b
b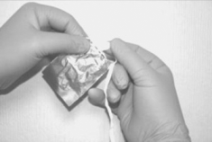 c
c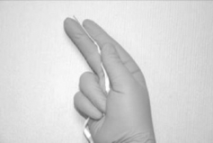
Colocar el extremo del inserto en el fondo de saco vaginal (fórnix) posterior (d) (e). Utilizar solamente lubricantes solubles en agua para ayudar a la inserción. Después de la inserción, se puede cortar la cinta de retiro con tijeras de modo que el extremo de la cinta esté apenas dentro del introito.
d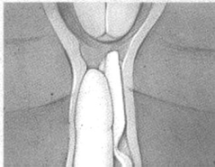 e
e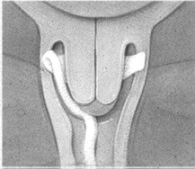 f
f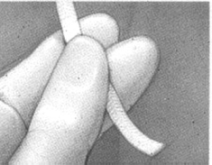
La paciente debe recostarse de 20 a 30 minutos después de la inserción, pero posteriormente puede deambular. El MIV es retirado por la tracción suave del sistema de recuperación (cinta de retiro) (f). Después de su retiro, asegúrese de que el producto entero (inserto y sistema de recuperación) se haya removido de la vagina.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La sobredosificación es improbable con una formulación de liberación controlada. El MIV (óvulo de misoprostol) se debe retirar inmediatamente ante el inicio del trabajo de parto; dejar colocado el MIV después de que inicie el trabajo de parto podría dar como resultado una excesiva cantidad de prostaglandina exógena, dando por resultado una hiperestimulación uterina. Si esto ocurre, el MIV debe ser retirado y la paciente debe ser manejada de acuerdo con al protocolo local.
Abuso de fármacos y dependencia: No se ha observado ningún abuso o dependencia del fármaco con el uso del MIV (óvulo de misoprostol).
PRESENTACIÓN: El MIV (óvulo de misoprostol) está empacado de forma individual, sellado con un sobre laminado de aluminio/polietileno, en un paquete individual.
Caja con 1 óvulo de 200 mcg e instructivo anexo.
Caja con 2 óvulos de 200 mcg e instructivo anexo.
Caja con 5 óvulos de 200 mcg e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Almacenar en congelación entre -10 y -20ºC en el envase original. El MIV es estable por un periodo de tres años cuando está almacenado bajo estas condiciones.
Después de su uso, el producto entero debe ser desechado, como residuo clínico.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. Para uso exclusivo del hospital. Léase instructivo anexo. No se deje al alcance de los niños. Para uso exclusivo del médico especialista. No ingerir. No utilizar si el empaque ha sido violado. Literatura exclusiva para médicos.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx
safety.mailbox.mexico@ferring.com
Hecho en Reino Unido por:
Ferring Controlled Therapeutics Limited
1 Redwood Place, Peel Park Campus,
East Kilbride Strathclyde, G74 5PB, Reino Unido
Acondicionado y distribuido por:
FERRING, S.A. de C.V.
Av. Nemesio Diez Riega Mz. 2, Lote 15, No. 15
Col. Parque Industrial Cerrillo II
C.P. 52000, Lerma, Edo. de México
Reg. Núm. 033M2010, SSA IV
133300415A0237