
NUCALA
MEPOLIZUMAB
Solución inyectable
1 Caja, 1 Frasco(s) ámpula con liofilizado, 100 mg
1 Caja, 3 Frasco(s) ámpula con liofilizado, 100 mg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
FORMA FARMACÉUTICA Y FORMULACIÓN:
Solución:
Polvo liofilizado:
Fórmula:
El frasco ámpula con polvo liofilizado contiene:
Mepolizumab 144 mg
Excipiente cbp
Diluyente recomendado: Agua estéril para uso inyectable en un volumen de 1.2 mL. Los 144 mg de mepolizumab reconstituidos con 1.2 mL de agua inyectable dan un volumen final de la solución de 1.44 mL, con una concentración final de 100 mg/mL, para permitir un volumen extraíble de 1 mL después de la reconstitución.
Después de la reconstitución, cada mL de solución contiene 100 mg de mepolizumab
Fórmula líquida:
Fórmula:
La pluma precargada (auto-inyector) contiene:
Mepolizumab 100 mg
Vehículo cbp 1 mL
Fórmula:
La jeringa prellenada (jeringa de seguridad) contiene:
Mepolizumab 100 mg o 40 mg
Vehículo cbp 1 mL, 0.4 mL
Anticuerpo monoclonal humanizado IgG1 de origen ADN recombinante expresado en células de ovario de Hámster Chino (CHO)
INDICACIONES TERAPÉUTICAS:
Asma eosinofílica grave refractaria:
NUCALA® está indicado como un tratamiento complementario de mantenimiento en pacientes adultos y pacientes pediátricos mayores de 6 años de edad, con asma eosinofílica grave refractaria. (Véase sección de estudios clínicos, en la sección de Farmacocinética).
Limitaciones de uso: NUCALA® no está indicado para el alivio del broncoespasmo agudo o estado asmático.
Rinosinusitis crónica con pólipos nasales (RSCcPN):
NUCALA® está indicado como tratamiento de mantenimiento complementario en pacientes adultos mayores de 18 años con rinosinusitis crónica con pólipos nasales (RSCcPN) inadecuadamente controlada.
Granulomatosis eosinofílica con poliangitis (EGPA):
NUCALA® está indicado como tratamiento en pacientes adultos mayores de 18 años con granulomatosis eosinofílica con poliangitis (EGPA).
Síndrome hipereosinofílico (HES): NUCALA® está indicado para el tratamiento del síndrome hipereosinofílico (HES) en pacientes adultos y adolescentes mayores de 12 años de edad.
FARMACOCINÉTICA Y FARMACODINAMIA:
Código ATC: R030X09.
Mecanismo de acción: NUCALA® es un antagonista de IL-5 (IgG1 kappa). La IL-5 es la principal citosina responsable del crecimiento y diferenciación, reclutamiento, activación y supervivencia de los eosinófilos. NUCALA® se une a IL-5 con una constante de disociación de 100 pM, inhibiendo la bioactividad de IL-5 al bloquear su unión a la cadena alfa del complejo receptor de IL-5 expresada en la superficie celular de los eosinófilos. La inflamación es un componente importante en la patogénesis del asma, RSCcPN, EGPA y HES. En la inflamación están involucrados múltiples tipos celulares (por ejemplo, mastocitos, eosinófilos, neutrófilos, macrófagos, linfocitos) y mediadores (por ejemplo, histamina, eicosanoides, leucotrienos, citosinas). NUCALA® inhibe la señalización de IL-5, lo que reduce la producción y la supervivencia de eosinófilos; sin embargo, el mecanismo de acción de mepolizumab no se ha establecido definitivamente en asma, RSCcPN, EGPA y HES.
Farmacodinamia:
La respuesta farmacodinámica (reducción de eosinófilos en sangre) después de dosis repetidas de mepolizumab administrado por vía subcutánea o intravenosa se evaluó en sujetos adultos con asma y niveles de eosinófilos en sangre > 200 células/μL. Los sujetos recibieron 1 de 4 tratamientos de mepolizumab (administrados cada 28 días para un total de 3 dosis): 12.5 mg SC, 125 mg SC, 250 mg SC o 75 mg IV. Sesenta y seis (66) de los 70 sujetos aleatorizados completaron el estudio. En comparación con los niveles basales, los eosinófilos en sangre disminuyeron de manera dependiente de la dosis. Se observó una reducción en los niveles sanguíneos de eosinófilos en todos los grupos de tratamiento en el día 3 (48 horas después de dosificarse). En el día 84 (4 semanas después de la última dosis), la reducción promedio observada, a partir del valor basal de eosinófilos en sangre fue del 64%, 78%, 84% y 90% en los grupos de tratamiento de 12.5 mg SC, 75 mg IV, 125 mg SC y 250 mg SC, respectivamente. Las dosis subcutáneas predichas por el modelo que proporcionaron el 50% y el 90% de la reducción máxima de eosinófilos en sangre el día 84 se estimaron en 11 y 99 mg, respectivamente. Estos resultados, junto con los datos de eficacia clínica del estudio de exacerbaciones de rango de dosis en sujetos adultos y adolescentes con asma grave (Estudio 1) apoyaron la evaluación de mepolizumab 75 mg IV y 100 mg SC en los estudios confirmatorios de asma grave (consulte Estudios clínicos). Tras la administración subcutánea de mepolizumab 100 mg cada 4 semanas durante 32 semanas en sujetos adultos y adolescentes con asma grave (Estudio 2), los eosinófilos en sangre se redujeron a un recuento promedio de 40 células/μL, que corresponde a una reducción promedio del 84% en comparación con placebo.
La respuesta farmacodinámica (reducción de eosinófilos en sangre) también se evaluó en niños de 6 a 11 años de edad con asma grave. Tras la administración subcutánea de NUCALA® 40 mg cada 4 semanas durante 52 semanas, los eosinófilos en sangre se redujeron a un recuento promedio de 48 células/μL. Esto corresponde a una reducción promedio del valor basal del 85%.
La magnitud de reducción en adultos, adolescentes y niños se observó dentro de las 4 semanas de tratamiento y se mantuvo durante los periodos de tratamiento.
Para adultos con RSCcPN, después de una dosis de NUCALA® 100 mg administrada por vía subcutánea cada 4 semanas durante 52 semanas, los eosinófilos en sangre se redujeron hasta un recuento promedio de 60 células/μL. Hubo una reducción promedio del 83% en comparación con placebo. Esta magnitud de reducción se observó dentro de las 4 semanas de tratamiento y se mantuvo durante todo el periodo de tratamiento (véase Estudios clínicos).
Para adultos con EGPA, después de la administración subcutánea de NUCALA® 300 mg cada 4 semanas durante 52 semanas, los eosinófilos en sangre se redujeron a un recuento promedio de 38 células/μL. Hubo una reducción promedio del 83% en comparación con placebo, y esta magnitud de reducción se observó dentro de las 4 semanas de tratamiento (véase Estudios clínicos).
Para adultos y adolescentes con HES, después de la administración subcutánea de NUCALA® 300 mg cada 4 semanas durante 32 semanas, los eosinófilos en sangre se redujeron a un recuento promedio de 70 células/μL. Hubo una reducción promedio del 92% en comparación con placebo (véase Estudios clínicos).
Farmacocinética:
Después de la dosificación subcutánea en sujetos adultos con asma, mepolizumab presentó una farmacocinética aproximadamente proporcional a la dosis a lo largo de un rango de dosis de 12.5 mg a 250 mg. Las propiedades farmacocinéticas de mepolizumab observadas en sujetos con RSCcPN (adultos), EGPA (adultos) o HES (adultos y adolescentes) fueron similares a las propiedades farmacocinéticas observadas en sujetos con asma grave (adultos y adolescentes).
La administración subcutánea de 300 mg de NUCALA® tuvo aproximadamente tres veces la exposición sistémica de 100 mg de mepolizumab.
Absorción: Después de la administración subcutánea de 100 mg en la parte superior del brazo de sujetos adultos y adolescentes con asma, la biodisponibilidad de mepolizumab se estimó en aproximadamente el 80%.
Después de repetir la administración subcutánea una vez cada 4 semanas, hubo una acumulación de aproximadamente 2 veces en estado estacionario.
Distribución: El volumen de distribución de la población central de mepolizumab en sujetos adultos con asma se estima en 3.6 L para un individuo de 70 kg.
Eliminación: Tras la administración subcutánea de mepolizumab en sujetos adultos con asma, la media de semi vida terminal (t½) varió de 16 a 22 días. El aclaramiento aparente sistémico poblacional de mepolizumab en sujetos adultos y adolescentes con asma se estima es de 0.28 L/día para un individuo de 70 kg.
Metabolismo: Mepolizumab es un anticuerpo monoclonal humanizado IgG1 degradado por enzimas proteolíticas ampliamente distribuidas en el cuerpo y no se restringen al tejido hepático.
Poblaciones específicas:
Grupos raciales y sujetos masculinos y femeninos: Los análisis farmacocinéticos poblacionales indicaron que no hubo un efecto significativo de raza y género en el aclaramiento de mepolizumab.
Edad: Los análisis farmacocinéticos poblacionales indicaron que no hubo un efecto significativo de edad sobre el aclaramiento de mepolizumab.
Pacientes pediátricos: La farmacocinética del mepolizumab después de la administración subcutánea en sujetos de 6 a 11 años de edad con asma grave se investigó en la fase inicial de tratamiento de 12 semanas de un estudio clínico abierto. Las exposiciones (ABC) después de la administración subcutánea de 40 mg (para niños que pesan < 40 kg) o 100 mg (para niños que pesan ≥ 40 kg) fueron 1.32 y 1.97 veces mayores, respectivamente, en comparación con las observadas en adultos y adolescentes que recibieron 100 mg. Basados en estos resultados, la simulación de una dosis subcutánea de 40 mg cada 4 semanas en niños de 6 a 11 años de edad, independientemente del peso corporal, dio lugar a exposiciones similares previas a las observadas en adultos y adolescentes.
Pacientes con insuficiencia renal: No se han realizado estudios clínicos para investigar el efecto de la insuficiencia renal sobre la farmacocinética de mepolizumab. Con base en los análisis farmacocinéticos de la población, el aclaramiento de mepolizumab fue comparable entre sujetos con valores de aclaramiento de creatinina entre 50 y 80 mL/min y pacientes con función renal normal. Se cuenta con datos limitados disponibles en sujetos con valores de aclaramiento de creatinina < 50 mL/min; sin embargo, mepolizumab no se elimina por vía renal.
Sujetos con insuficiencia hepática: No se han realizado estudios clínicos para investigar el efecto de la insuficiencia hepática sobre la farmacocinética de mepolizumab. Dado que mepolizumab es degradado por enzimas proteolíticas ampliamente distribuidas, no restringidas al tejido hepático, los cambios en la función hepática tienen pocas probabilidades de tener algún efecto sobre la eliminación de mepolizumab.
Estudios de interacción farmacológica: No se han realizado estudios formales de interacción farmacológica con mepolizumab. En los análisis farmacocinéticos poblacionales de los estudios de fase 3, no hubo evidencia de un efecto de fármacos de molécula pequeñas coadministrados comúnmente en la exposición a mepolizumab.
Uso en poblaciones específicas:
Uso pediátrico:
Asma grave: La seguridad y eficacia de NUCALA® para el asma grave, y con un fenotipo eosinofílico, se han establecido en sujetos pediátricos a partir de los 6 años de edad.
El uso de NUCALA® en adolescentes de 12 a 17 años de edad está respaldado por evidencia de estudios adecuados y bien controlados en adultos y adolescentes. Un total de 28 adolescentes de edad de 12 a 17 años de edad con asma grave fueron enrolados en los estudios de asma fase 3. De éstos, 25 fueron enrolados en el estudio de exacerbación de 32 semanas (Estudio 2, NCT01691521) y tenían una edad media de 14.8 años. Los sujetos tenían un historial de 2 o más exacerbaciones en el año anterior a pesar del uso regular de corticosteroides inhalados de dosis media o alta más controladores adicionales con o sin corticosteroides orales y tenían eosinófilos en sangre ≥ a 150 células/μL en la selección o ≥ 300 células/μL en los 12 meses previos al enrolamiento. (Véase Estudios clínicos - Farmacocinética). Los sujetos tuvieron una reducción en la tasa de exacerbaciones que tendió a favor de NUCALA®. De los 19 adolescentes que recibieron NUCALA®, 9 recibieron 100 mg y el aclaramiento medio aparente en estos sujetos fue del 35% menos que los adultos. El perfil de seguridad observado en adolescentes fue generalmente similar al de la población general en los estudios fase 3.
El uso de NUCALA® en sujetos pediátricos de 6 a 11 años de edad con asma grave y con un fenotipo eosinofílico está respaldado por evidencia de estudios adecuados y bien controlados en adultos y adolescentes con datos farmacocinéticos, farmacodinámicos y de seguridad adicionales en niños de 6 a 11 años de edad. Se realizó un único estudio clínico abierto (NCT02377427) en 36 niños de 6 a 11 años de edad (edad media: 8.6 años, 31% mujeres) con asma grave. Los criterios de enrolamiento fueron los mismos que para los adolescentes en el estudio de exacerbación de 32 semanas (Estudio 2). Según datos farmacocinéticos de este estudio se determinó que una dosis subcutánea de 40 mg cada 4 semanas tiene una exposición similar en adultos y adolescentes a los que se les administró una dosis de 100 mg por vía subcutánea.
La eficacia de NUCALA® en sujetos pediátricos de 6 a 11 años de edad se extrapola de la eficacia en sujetos pediátricos y adolescentes con el apoyo de análisis farmacocinéticos que muestran niveles similares de exposición al fármaco para 40 mg administrados por vía subcutánea cada 4 semanas en niños de 6 a 11 años de edad en comparación con adultos y adolescentes. El perfil de seguridad y la respuesta farmacodinámica observados en este estudio para niños de 6 a 11 años de edad fueron similares a los observados en adultos y adolescentes (ver Reacciones adversas, Farmacocinética y farmacodinamia).
No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 6 años de edad con asma grave.
Rinosinusitis crónica con pólipos nasales: No se ha establecido la seguridad y eficacia en sujetos menores de 18 años de edad con RSCcPN.
Granulomatosis eosinofílica con poliangitis: No se ha establecido la seguridad y eficacia en sujetos menores de 18 años de edad con EGPA.
Síndrome hipereosinofílico: La seguridad y eficacia de NUCALA® para el HES se ha establecido en sujetos adolescentes de 12 años o más. La seguridad y eficacia en sujetos pediátricos menores de 12 años de edad con HES no ha sido establecida.
El uso de NUCALA® para esta indicación está respaldado por evidencia de un estudio adecuado y bien controlado (NCT02836496) en adultos y adolescentes y un estudio de extensión abierto (NCT03306043). Un adolescente recibió NUCALA® durante el estudio controlado y este paciente y otros 3 adolescentes recibieron NUCALA® durante el estudio de extensión abierto (ver Estudios clínicos). El adolescente tratado con NUCALA® en el estudio de 32 semanas no tuvo un brote de HES ni un evento adverso informado. Todos los adolescentes recibieron 300 mg de NUCALA® durante 20 semanas en la extensión abierta.
Uso geriátrico: Los estudios clínicos de NUCALA® no incluyeron un número suficiente de sujetos de 65 años de edad o más que recibieran NUCALA® (n = 79) para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica reportada no ha identificado diferencias en las respuestas entre los sujetos ancianos y los más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardiaca y de enfermedad concomitante u otra terapia farmacológica. Con base en los datos disponibles, ningún ajuste de la dosis de NUCALA® en sujetos geriátricos es necesario, pero no se puede descartar una mayor sensibilidad en algunas personas mayores.
Estudios clínicos:
Asma grave: El programa de desarrollo de asma para NUCALA® en pacientes de 12 años de edad o más incluyó 3 estudios doble ciego; aleatorizados controlados con placebo: 1 estudio de variación de dosis y exacerbación (Estudio 1, NCT01000506) y 2 estudios confirmatorios (Estudio 2, NCT01691521 y Estudio 3, NCT01691508). Mepolizumab se administró cada 4 semanas en los 3 estudios como complemento al tratamiento base. Todos los pacientes continuaron su tratamiento base para el asma durante la duración de los estudios.
Estudio de variación de dosis y exacerbación: El estudio 1 fue un estudio de 52 semanas de variación de dosis y reducción de exacerbaciones en sujetos con asma grave con antecedentes de 2 o más exacerbaciones en el año anterior a pesar del uso regular de dosis altas de corticosteroides inhalados (ICS) más controlador(es) adicional(es) con o sin corticosteroides orales (OCS). Los pacientes inscritos en este estudio debían tener al menos 1 de los siguientes 4 criterios preespecificados en los 12 meses anteriores: recuento de eosinófilos en sangre ≥ 300 células/μL, recuento de eosinófilos en esputo ≥ 3%, concentración de óxido nítrico exhalado ≥ 50 ppb, o deterioro del control del asma después de una reducción de ≤ 25% en el mantenimiento regular de ICS/OCS. Se evaluaron tres dosis IV de mepolizumab (75, 250 y 750 mg) administradas una vez cada 4 semanas en comparación con el placebo. Los resultados de este estudio y el estudio farmacodinámico respaldaron la evaluación de mepolizumab 75 mg IV y 100 mg subcutáneo en los estudios posteriores. NUCALA® no está indicado para uso intravenoso y sólo debe administrarse por vía subcutánea.
Estudios confirmatorios: Se estudiaron un total de 711 pacientes con asma grave en los 2 estudios confirmatorios (Estudios 2 y 3). En estos 2 estudios, se requirió que los pacientes seleccionados tuvieran eosinófilos en sangre de ≥ 150 células/μL (dentro de las 6 semanas de la dosificación) o eosinófilos en sangre de ≥ 300 células/μL dentro de los 12 meses de reclutamiento. El criterio de detección de eosinófilos en sangre de ≥ 150 células/μL se derivó de análisis exploratorios de datos del Estudio 1. El Estudio 2 fue un estudio controlado con placebo y activo de 32 semanas en sujetos con asma grave con antecedentes de 2 o más exacerbaciones en el año anterior a pesar del uso regular de dosis altas de ICS más controlador(es) adicional(es) con o sin OCS. Los pacientes recibieron mepolizumab 75 mg IV (n = 191), NUCALA® 100 mg (n = 194) o placebo (n = 191) una vez cada 4 semanas durante 32 semanas.
El estudio 3 fue un estudio de reducción de OCS de 24 semanas en pacientes con asma grave que requerían OCS diarios además del uso regular de dosis altas de ICS más controlador(es) adicional(es) para mantener el control del asma. No se requirió que los pacientes del estudio 3 tuvieran antecedentes de exacerbaciones en el año anterior. Los sujetos recibieron NUCALA® 100 mg (n = 69) o placebo (n = 66) una vez cada 4 semanas durante 24 semanas. El uso medio inicial de OCS fue similar en los 2 grupos de tratamiento: 13.2 mg en el grupo de placebo y 12.4 mg en el grupo que recibió NUCALA® 100 mg.
Las características demográficas y de referencia de estos 3 estudios se proporcionan en la Tabla 1.
Tabla 1. Datos demográficos y características iniciales de los estudios de asma grave
|
Estudio 1 (N = 616) |
Estudio 2 (N = 576) |
Estudio 3 (N = 135) |
|
|
Edad media, años |
49 |
50 |
50 |
|
Mujeres, n (%) |
387 (63) |
328 (57) |
74 (55) |
|
Raza blanca, n (%) |
554 (90) |
450 (78) |
128 (95) |
|
Duración del asma, años, promedio |
19 |
20 |
19 |
|
Nunca fumó, n (%) |
483 (78) |
417 (72) |
82 (61) |
|
FEV1 basal, L |
1.88 |
1.82 |
1.95 |
|
% Basal previsto del FEV1 |
60 |
61 |
59 |
|
% Reversibilidad basal |
25 |
27 |
26 |
|
Línea de base post-SABA FEV1/FVC |
0.67 |
0.66 |
0.66 |
|
Recuento promedio de eosinófilos al inicio del estudio, células/μL |
250 |
290 |
240 |
|
Número medio de exacerbaciones en el año anterior |
3.6 |
3.6 |
3.1 |
FEV1 = volumen espiratorio forzado en 1 segundo, SABA = agonista beta 2 de acción corta, FVC = capacidad vital forzada.
Exacerbaciones: La eficacia se evaluó en los Estudios 1 y 2 utilizando un criterio de valoración de la frecuencia de las exacerbaciones definidas como empeoramiento del asma que requiere el uso de corticosteroides orales/sistémicos y/o hospitalización y/o visitas al servicio de urgencias. Para los pacientes con OCS de mantenimiento, una exacerbación que requería OCS se definió como el uso de corticosteroides orales/sistémicos al menos el doble de la dosis existente durante al menos 3 días. En comparación con el placebo, los sujetos que recibieron NUCALA® 100 mg o mepolizumab 75 mg IV experimentaron significativamente menos exacerbaciones. Además, en comparación con el placebo, hubo menos exacerbaciones que requirieron hospitalización y/o visita a la sala de emergencias, y exacerbaciones que requirieron sólo hospitalización con NUCALA® 100 mg (Tabla 2).
Tabla 2. Tasa de exacerbaciones en los estudios de asma grave 1 y 2 (población con intención de tratar)
|
Estudio |
Tratamiento |
Exacerbaciones por año |
||
|
Tasa |
Diferencia |
Relación de tasas (IC 95%) |
||
|
Todas las exacerbaciones |
||||
|
Estudio 1 |
Placebo (n = 155) |
2.40 |
||
|
Mepolizumab 75 mg IV (n = 153) |
1.24 |
1.16 |
0.52 (0.39, 0.69) |
|
|
Estudio 2 |
Placebo (n = 191) |
1.74 |
||
|
Mepolizumab 75 mg IV (n = 191) |
0.93 |
0.81 |
0.53 (0.40, 0.72) |
|
|
NUCALA® 100 mg SC (n = 194) |
0.83 |
0.91 |
0.47 (0.35, 0.64) |
|
|
Exacerbaciones que requirieron hospitalización/visita a la sala de emergencias |
||||
|
Estudio 1 |
Placebo (n = 155) |
0.43 |
||
|
Mepolizumab 75 mg IV (n = 153) |
0.17 |
0.26 |
0.40 (0.19, 0.81) |
|
|
Estudio 2 |
Placebo (n = 191) |
0.20 |
||
|
Mepolizumab 75 mg IV (n = 191) |
0.14 |
0.06 |
0.68 (0.33, 1.41) |
|
|
NUCALA® 100 mg SC (n = 194) |
0.08 |
0.12 |
0.39 (0.18, 0.83) |
|
|
Exacerbaciones que requirieron hospitalización |
||||
|
Estudio 1 |
Placebo (n = 155) |
0.18 |
||
|
Mepolizumab 75 mg IV (n = 153) |
0.11 |
0.07 |
0.61 (0.28, 1.33) |
|
|
Estudio 2 |
Placebo (n = 191) |
0.10 |
||
|
Mepolizumab 75 mg IV (n = 191) |
0.06 |
0.04 |
0.61 (0.23, 1.66) |
|
|
NUCALA® 100 mg SC (n = 194) |
0.03 |
0.07 |
0.31 (0.11, 0.91) |
|
IV = intravenoso, SC = subcutáneo, IC = Intervalo de confianza.
El tiempo hasta la primera exacerbación fue mayor para los grupos que recibieron NUCALA® 100 mg y mepolizumab 75 mg IV en comparación con placebo en el estudio 2 (Figura 1).
Figura 1. Curva de incidencia acumulada de Kaplan-Meier para el tiempo hasta la primera exacerbación (Estudio 2 de asma grave)
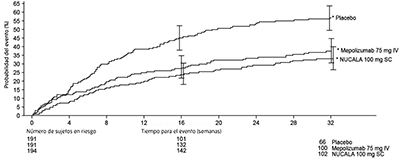
* Barras de error indicando 95% de intervalos de confianza.
IV = intravenosa, SC = subcutánea.
Se exploraron los datos del estudio 1 para determinar los criterios que podrían identificar a los pacientes que probablemente se beneficiarían del tratamiento con NUCALA®. El análisis exploratorio sugirió que el recuento basal de eosinófilos en sangre de ≥ 150 células/μL era un predictor potencial del beneficio del tratamiento. El análisis exploratorio de los datos del Estudio 2 también sugirió que el recuento basal de eosinófilos en sangre (obtenido dentro de las 6 semanas posteriores al inicio de la administración) de ≥ 150 células/μL fue un predictor potencial de eficacia y mostró una tendencia de mayor beneficio de exacerbación con el aumento del recuento de eosinófilos en sangre. En el estudio 2, los pacientes enrolados únicamente sobre la base del recuento histórico de eosinófilos en sangre de ≥ 300 células/μL en los 12 meses anteriores, pero que tenían un recuento basal de eosinófilos en sangre < 150 células/μL, prácticamente no tuvieron ningún beneficio de exacerbación después del tratamiento con NUCALA® 100 mg en comparación con placebo.
El Cuestionario de Control del Asma-5 (ACQ-5) se evaluó en los estudios 1 y 2, y el Cuestionario de Respiración de St. George (SGRQ) se evaluó en el estudio 2. En el estudio 1, la tasa de respuesta ACQ-5 (definida como una disminución en la puntuación de 0.5 o más como límite) para el grupo de mepolizumab IV de 75 mg fue del 47% comparada con el 50% para placebo con una relación de probabilidad (OR) de 1.1 (IC 95%: 0.7, 1.7). En el estudio 2, la tasa de respuesta a la ACQ-5 para el grupo de tratamiento para NUCALA® 100 mg fue del 57% en comparación con el 45% para placebo con un OR de 1.8 (IC del 95%: 1.2, 2.8). En el estudio 2, la tasa de respuesta del SGRQ (definida como una disminución de la puntuación de 4 o más como límite) para el grupo de tratamiento con NUCALA® 100 mg fue del 71% en comparación con el 55% para placebo con un OR de 2.1 (IC del 95%: 1.3, 3.2).
Reducción de corticosteroides orales: El estudio 3 evaluó el efecto de NUCALA® 100 mg sobre la reducción del uso de corticosteroides orales de mantenimiento. La eficacia se evaluó utilizando un criterio de valoración del porcentaje de reducción de la dosis de OCS durante las semanas 20 a 24, en comparación con la dosis inicial, manteniendo el control del asma.
Los sujetos se clasificaron de acuerdo con su cambio en el uso de OCS durante el estudio con las siguientes categorías: disminución del 90% al 100%, disminución del 75% al < 90%, disminución del 50% al < 75%, disminución del > 0% al < 50% y ninguna mejoría (es decir, ningún cambio o cualquier aumento o falta de control del asma o retiro del tratamiento). En comparación con placebo, los sujetos que recibieron NUCALA® 100 mg lograron mayores reducciones en la dosis diaria de OCS de mantenimiento, manteniendo el control del asma. Dieciséis (23%) sujetos en el grupo que recibió NUCALA® 100 mg frente a 7 (11%) en el grupo placebo tuvieron una reducción del 90% al 100% en su dosis de OCS. Veinticinco (36%) sujetos en el grupo que recibió NUCALA® 100 mg frente a 37 (56%) en el grupo placebo se clasificaron como sin mejoría para la dosis de OCS. Además, el 54% de los sujetos que recibieron NUCALA® 100 mg lograron al menos una reducción del 50% en la dosis diaria de prednisona en comparación con el 33% de los sujetos que recibieron placebo (IC del 95% para la diferencia: 4%, 37%). También se realizó un análisis exploratorio en el subgrupo de 29 sujetos en el Estudio 3 que tenían un recuento promedio de eosinófilos en sangre basal y de detección < 150 células/μL. Cinco (29%) sujetos en el grupo que recibió NUCALA® 100 mg frente a 0 (0%) en el grupo placebo tuvieron una reducción del 90% al 100% en su dosis. Cuatro sujetos (24%) en el grupo que recibió NUCALA® 100 mg frente a 8 (67%) en el grupo placebo se clasificaron como sin mejoría para la dosis de OCS. También se evaluaron el ACQ y el SGRQ en el Estudio 3 y mostraron resultados similares a los del Estudio 2.
Función pulmonar: El cambio desde el inicio en el volumen espiratorio forzado medio en 1 segundo (FEV1) se midió en los 3 estudios y se presenta en la Tabla 3. En comparación con placebo, NUCALA® 100 mg no proporcionó mejorías consistentes en el cambio medio desde el inicio en el FEV1.
Tabla 3. Cambio desde la línea de base en el FEV1 (mL) en estudios de asma grave
|
Estudio |
Diferencia contra placebo en el cambio medio desde el FEV1 basal (mL) (IC del 95%) |
||
|
Semana 12 |
Semana 24 |
Semana 32/52 |
|
|
1ª |
10 (-87, 108) |
5 (-98, 108) |
61 (-39, 161)b |
|
2c |
52 (-30, 134) |
76 (-6, 159) |
98 (11, 184)d |
|
3c |
56 (-91, 203) |
114 (-42, 271) |
N/A |
FEV1 = volumen espiratorio forzado en 1 segundo, IC = intervalo de confianza.
a Dosis = 75 mg por vía intravenosa.
b Volumen espiratorio forzado en 1 segundo (FEV1) en la semana 52.
c Dosis = 100 mg por vía subcutánea.
d FEV1 en la semana 32.
El efecto de mepolizumab sobre la función pulmonar también se estudió en un estudio controlado con placebo de 12 semanas que incluyó a sujetos con asma con una dosis moderada de ICS con evidencia de síntomas y deterioro de la función pulmonar. El enrolamiento no dependió de un historial de exacerbaciones o un recuento de eosinófilos preespecificado. El cambio desde el inicio en el FEV1 en la semana 12 fue numéricamente menor en los grupos de tratamiento con mepolizumab que en el grupo placebo.
Rinosinusitis crónica con pólipos nasales: Un total de 407 sujetos adultos con RSCcPN fueron evaluados en un estudio aleatorizado, doble ciego, controlado con placebo, multicéntrico, de 52 semanas (NCT03085797). Los sujetos recibieron NUCALA® 100 mg o placebo administrado por vía subcutánea una vez cada 4 semanas mientras continuaban con la administración de una terapia nasal de corticosteroides. Los sujetos debieron recibir previamente corticosteroides nasales durante ≥8 semanas antes de la selección. Los sujetos debieron tener RSCcPN recurrente y sintomático, y al menos 1 cirugía para la extirpación de pólipos nasales en los 10 años anteriores. Se requirió que los sujetos tuvieran síntomas de obstrucción nasal con una puntuación de la escala analógica visual (EVA) de > 5 de una puntuación máxima de 10. También se requirió que los sujetos tuvieran una puntuación endoscópica bilateral de pólipos nasales (NPS) de ≥ 5 de 8 con NPS ≥ 2 en cada cavidad nasal. Los sujetos informaron las puntuaciones de obstrucción nasal (VAS) diariamente colocando una sola marca en una línea continua etiquetada de 0 (ninguno) a 100 (tan malo como se pueda imaginar). La distancia a lo largo de la línea se convirtió en una escala de 0 a 10 puntos para la puntuación. Para NPS, los pólipos a cada lado de la nariz se calificaron en una escala categórica (0 = sin pólipos, 1 = pólipos pequeños en el meato medio que no llegan por debajo del borde inferior de la concha media, 2 = pólipos que llegan por debajo del borde inferior del cornete nasal medio, 3 = pólipos grandes que alcanzan el borde inferior del cornete nasal inferior o pólipos medial nasales a la concha media, 4 = pólipos grandes que causan una congestión/obstrucción casi completa del meato inferior) para una puntuación total de 0 a 8. No se realizaron tomografías computarizadas de senos paranasales al inicio del estudio ni durante el tratamiento para evaluar la opacificación de los senos paranasales.
Los criterios de valoración coprimarios fueron el cambio desde el inicio hasta la semana 52 en NPS endoscópica total (escala de 0 a 8) según la calificación de evaluadores ciegos independientes y el cambio desde el inicio en la puntuación VAS de obstrucción nasal (escala de 0 a 10) durante las semanas 49 a 52. El criterio clave de valoración secundario fue el tiempo hasta la primera cirugía nasal (polipectomía nasal) hasta la semana 52 en este estudio. Otros criterios de valoración secundarios fueron el cambio desde el inicio en la puntuación VAS de pérdida del olfato durante las semanas 49 a 52, y la proporción de sujetos que requirieron esteroides sistémicos para los pólipos nasales hasta la semana 52. Los sujetos recopilaron todos los puntajes VAS diariamente y los informaron en una escala de 0 a 10 (0 = ninguno, 10 = tan malo como puedas imaginar).
Los datos demográficos y las características iniciales de los sujetos de este estudio se proporcionan en la Tabla 4.
Tabla 4. Demografía y características basales en RSCcPN
|
N = 407 |
|
|---|---|
|
Edad media, años |
49 |
|
Mujeres, n (%) |
143 (35) |
|
Raza blanca, n (%) |
379 (93) |
|
Duración media de RSCcPN en años (SD) |
11.4 (8.4) |
|
Sujetos con ≥ 1 cirugía en los últimos 10 años (%) |
407 (100) |
|
Sujetos con ≥ 3 cirugías en los últimos 10 años (%) |
124 (30) |
|
Uso de OCS (≥ 1 en curso) en los últimos 12 meses, n (%) |
197 (48) |
|
NPS endoscópica bilateral mediaª, (SD), rango 0-8 |
5.5 (1.29) |
|
Puntuación VAS de obstrucción nasal media (SD), rango 0-10 |
9.0 (0.83) |
|
Promedio de células eosinofílicas/μL en sangre (IC 95%) |
390 (360, 420) |
|
Asma, n (%) |
289 (71) |
|
AERD, n (%) |
108 (27) |
RSCcPN = rinosinusitis crónica con pólipos nasales, DE = desviación estándar, OCS = corticosteroide oral, NPS = puntuación de pólipos nasales, VAS = escala analógica visual, AERD = enfermedad respiratoria exacerbada por aspirina.
a Según la clasificación de evaluadores independientes ciegos.
Puntuación endoscópica de pólipos nasales y Puntuaciones de obstrucción nasal de la escala analógica visual:
Los sujetos que recibieron NUCALA® 100 mg tuvieron una mejoría (disminución) estadísticamente significativa en la NPS bilateral en la semana 52 y la puntuación VAS de la obstrucción nasal de las semanas 49 a 52 al final del periodo de tratamiento de 52 semanas (Tabla 5).
Tabla 5. Análisis de puntos finales en RSCcPN
|
Puntuacionesª (intervalo) |
Placebo (N=201) |
NUCALA® 100 mg SC (N=206) |
Diferencias de medias vs placebo (95% IC) |
||
|
Media basal (SD) |
Cambio mediob (SE) |
Media basal (SD) |
Cambio mediob (SE) |
||
|
NPS (0-8) |
5.6 (1.41) |
0.06 (0.14) |
5.4 (1.17) |
-0.87 (0.14) |
-0.93 (-1.31, -0.55) |
|
Obstrucción nasal (0-10) |
9.02 (0.83) |
-2.54 (0.25) |
8.92 (0.83) |
-4.40 (0.25) |
-1.86 (-2.53, -1.19) |
RSCcPN = rinosinusitis crónica con pólipos nasales, SD = desviación estándar, SE = error estándar, IC = intervalo de confianza, NPS = puntuación de pólipos nasales en la semana 52.
a Sujetos con cirugía nasal a los que se les asignó la peor puntuación posible para el periodo posterior a la cirugía nasal. Los datos faltantes imputados se basaron en los datos disponibles fuera del tratamiento para todos los grupos de tratamiento.
Las imputaciones se realizaron paso a paso por visita y se condicionaron a datos de visitas anteriores con las mismas covariables utilizadas en el modelo de análisis.
b Las medias de mínimos cuadrados del análisis utilizando medidas repetidas de modelos mixtos con covariables de grupo de tratamiento, región geográfica, puntuación inicial y log(e) recuento inicial de eosinófilos en sangre, visita, términos de interacción para visita por referencia y visita por tratamiento.
Polipectomía nasal: El punto final secundario clave fue el tiempo hasta la primera cirugía nasal (polipectomía nasal) hasta la Semana 52. La proporción de sujetos que se sometieron a cirugía se redujo significativamente en un 57% (cociente de riesgos: 0.43, IC del 95%: 0.25, 0.76) en el grupo tratado con NUCALA® 100 mg en comparación con el grupo de placebo (Figura 2). Para la semana 52, 18 (9%) sujetos que recibieron NUCALA® 100 mg se sometieron a cirugía en comparación con 46 (23 %) sujetos en el grupo de placebo.
Figura 2. Diagrama de Kaplan-Meier del tiempo hasta la primera cirugía nasal en RSCcPN
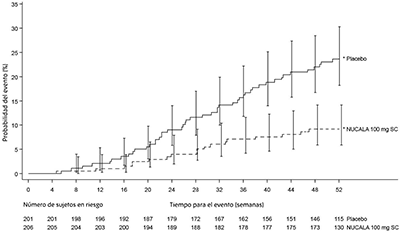
* Las barras de error indican intervalos de confianza del 95%.
RSCcPN = rinosinusitis crónica con pólipos nasales, SC = subcutánea.
Puntuaciones adicionales de síntomas de RSCcPN:
Para los sujetos que recibieron NUCALA® 100 mg, se observó una mejoría estadísticamente significativa en la pérdida del olfato en comparación con placebo y también se observaron mejoras en las puntuaciones individuales de los síntomas de EVA en comparación con los sujetos en el grupo placebo en las 4 semanas previas al final del periodo de tratamiento de 52 semanas (Tabla 6).
Tabla 6. Puntuaciones adicionales de síntomas de la escala analógica visual evaluadas en las semanas 49-52
|
Puntuación VAS (rango) |
Placebo (N=201) |
NUCALA® 100 mg N= 206 |
Diferencia de medias vs placebo (IC del 95%) |
||
|
Media de referencia (SD) |
Cambio mediob (SE) |
Media de referencia (SD) |
Cambio mediob (SE) |
||
|
Pérdida del olfato (0-10) |
9.68 (0.60) |
-1.46 (0.24) |
9.63 (0.83) |
-2.92 (0.24) |
-1.46 (-2.11, -0.81) |
|
Secreción nasalc (0-10) |
8.78 (1.25) |
-2.49 (0.26) |
8.78 (1.07) |
-4.38 (0.25) |
-1.89 (-2.58, -1.20) |
|
Mucosidad en la gargantac (0-10) |
8.58 (1.63) |
-2.37 (0.26) |
8.51 (1.61) |
-4.07 (0.26) |
-1.70 (-2.41, -0.99) |
|
Dolor facialc (0-10) |
7.77 (2.72) |
-2.04 (0.28) |
7.76 (2.51) |
-3.73 (0.27) |
-1.69 (-2.43, -0.95) |
VAS = Escala analógica visual; SD = desviación estándar; SE = error estándar; IC =intervalo de confianza.
a Sujetos con cirugía nasal que se les asignó la peor puntuación posible para el periodo después de la cirugía nasal. Los datos faltantes imputados se basaron en los datos disponibles fuera del tratamiento en todos los grupos de tratamiento. Las imputaciones se hicieron paso a paso y condicionadas a los datos de visitas anteriores con las mismas covariables utilizadas en el modelo de análisis.
b Medias por mínimos cuadrados de un análisis que utiliza medidas repetidas de modelos mixtos con covariables de grupos de tratamiento, región geográfica, puntuación inicial y log(e) visita inicial de eosinófilos en sangre, términos de interacción para la visita por línea base y visita por tratamiento.
c Este criterio de valoración no se especificó previamente en el plan de análisis para ajustar la multiplicidad.
Reducción de corticosteroides: El tratamiento con NUCALA® 100 mg redujo significativamente la necesidad de esteroides sistémicos para pólipos nasales en comparación con el placebo hasta la Semana 52 (tasa de probabilidad: 0.58, IC del 95%: 0.36, 0.92). En los sujetos que recibieron NUCALA® 100 mg, 52 (25%) requirieron ≥ 1 curso de esteroides sistémicos en comparación con 74 (37%) en el grupo de placebo durante el periodo de tratamiento de 52 semanas.
Resultados en sujetos con asma comórbida: En 289 (71%) sujetos con asma comórbida, los análisis preespecificados mostraron mejorías en los criterios de valoración coprimarios consistentes con las observadas en la población general en los sujetos que recibieron NUCALA® 100 mg en comparación con el placebo. Además, con base a un análisis post-hoc en estos sujetos, hubo una mayor respuesta desde el inicio en la Semana 52 en el control del asma según lo medido por el Cuestionario de Control del Asma (ACQ-5) para NUCALA® 100 mg en comparación con el placebo (57 % de los sujetos de NUCALA® alcanzaron la reducción del umbral de respuesta de ≥ 0.5, en comparación con el 35% en el grupo de placebo, con una razón de probabilidad de 2.42 [IC del 95%: 1.43; 4.11]).
Granulomatosis eosinofílica con poliangitis: Se evaluó un total de 136 sujetos adultos con EGPA en un estudio aleatorizado, controlado con placebo, multicéntrico y de 52 semanas (NCT02020889). Los sujetos recibieron 300 mg de NUCALA® o placebo administrado por vía subcutánea una vez cada 4 semanas mientras continuaban con su terapia estable de OCS. A partir de la Semana 4, los OCS se redujeron gradualmente durante el periodo de tratamiento a discreción del investigador. En este estudio, se evaluó la eficacia utilizando criterios de valoración coincidentes de la duración total acumulada de remisión durante el periodo de tratamiento de 52 semanas, definido como la Puntuación de actividad de vasculitis de Birmingham (BVAS) = 0 (sin vasculitis activa) más prednisolona o una dosis de prednisona menor o igual a 4 mg/día, y la proporción de sujetos en remisión tanto en la Semana 36 como en la Semana 48 de tratamiento. El BVAS es una herramienta clínica completa para evaluar la vasculitis clínicamente activa que probablemente requiera tratamiento, después de la exclusión de otras causas. La demografía y las características basales de los sujetos en este estudio se proporcionan en la Tabla 7.
Table 7. Demografía y características basales en EGPA
|
N = 136 |
|
|
Edad media, años |
48.5 |
|
Mujeres, n (%) |
80 (59) |
|
Raza blanca, n (%) |
125 (92) |
|
Duración de EGPA, años, media (SD) |
5.5 (4.63) |
|
Antecedentes de recaída confirmada de > 1 en los últimos 2 años, n (%) |
100 (74) |
|
Enfermedad resistente al tratamiento, n (%) |
74 (54) |
|
Recurrencia de los síntomas de EGPA, n (%) |
68 (50) |
|
Tratamiento de inducción fallido, n (%) |
6 (4) |
|
Dosis diaria basal de corticosteroides oralesa, mg, mediana (rango) |
12 (7.5-50) |
|
Recibiendo terapia inmunosupresora,b n (%) |
72 (53) |
EGPA = granulomatosis eosinofílica con poliangitis, SD = desviación estándar.
a Prednisona o equivalente de prednisolona.
b por ejemplo, azatioprina, metotrexato, ácido micofenólico.
Remisión: Los sujetos que recibieron 300 mg de NUCALA® lograron un tiempo de remisión acumulado significativamente mayor en comparación con el placebo. Una proporción significativamente mayor de sujetos que recibieron 300 mg de NUCALA® lograron la remisión tanto en la Semana 36 como en la Semana 48 en comparación con el placebo (Tabla 8). Los resultados de los componentes de la remisión también se muestran en la Tabla 8. Además, significativamente más sujetos que recibieron 300 mg de NUCALA® lograron la remisión dentro de las primeras 24 semanas y permanecieron en remisión durante el resto del periodo de tratamiento de prueba de 52 semanas en comparación con el placebo (19% para 300 mg de NUCALA® versus 1% para placebo; OR 19.7; IC del 95%: 2.3, 167.9).
Tabla 8. Remisión y componentes de la remisión en EGPA
|
Remisión (OCS ≤ 4 mg/día + BVAS = 0) |
OCS ≤ 4 mg/día |
BVAS = 0 |
||||
|
Placebo n = 68 |
NUCALA® 300 mg n = 68 |
Placebo n = 68 |
NUCALA® 300 mg n = 68 |
Placebo n = 68 |
NUCALA® 300 mg n = 68 |
|
|
Duración acumulada durante 52 semanas, n (%) |
||||||
|
0 |
55 (81) |
32 (47) |
46 (68) |
27 (40) |
6 (9) |
3 (4) |
|
> 0 a < 12 semanas |
8 (12) |
8 (12) |
12 (18) |
5 (7) |
15 (22) |
13 (19) |
|
12 a < 24 semanas |
3 (4) |
9 (13) |
6 (9) |
12 (18) |
11 (16) |
5 (7) |
|
24 a <36 semanas |
0 |
10 (15) |
2 (3) |
10 (15) |
17 (25) |
2 (3) |
|
≥ 36 semanas |
2 (3) |
9 (13) |
2 (3) |
14 (21) |
19 (28) |
45 (66) |
|
Relación de probabilidad NUCALA®/placebo)a (IC 95% |
5.9 (2.7, 13.0) |
5.1 (2.5, 10.4) |
3.7 (1.8, 7.6) |
|||
|
Proporción de sujetos en las semanas 36 y 48 |
||||||
|
Sujetos, n (%) |
2 (3) |
22 (32) |
7 (10) |
28 (41) |
23 (34) |
34 (50) |
|
Relación de probabilidad NUCALA®/placebo)ª (IC 95%) |
16.7 (3.6, 77.6) |
6.6 (2.6, 17.1) |
1.9 (0.9, 4.2) |
|||
EGPA = granulomatosis eosinofílica con poliangitis, OCS = corticosteroide oral, BVAS = puntuación de actividad de la vasculitis de Birmingham, IC = intervalo de confianza.
a Relación de probabilidad >1 favorece a NUCALA®.
Además, se demostró un beneficio estadísticamente significativo para estos criterios de valoración utilizando la remisión definida como BVAS = 0 más prednisolona/prednisona ≤ 7.5 mg/día.
Recaída: El tiempo hasta la primera recaída (definida como empeoramiento relacionado con vasculitis, asma o síntomas sinonasales que requieren un aumento de la dosis de corticosteroides o terapia inmunosupresora u hospitalización) fue significativamente mayor para los sujetos que recibieron 300 mg de NUCALA® en comparación con el placebo con un cociente de riesgos de 0.32 (IC 95%: 0.21, 0.5).
(Figura 3). Además, los sujetos que recibieron 300 mg de NUCALA® tuvieron una reducción en la tasa de recaídas en comparación con los sujetos que recibieron placebo (cociente de tasas 0.50; IC del 95%: 0.36, 0.70 para 300 mg de NUCALA® en comparación con el placebo). La incidencia y el número de tipos de recaídas (vasculitis, asma, sinonasal) fueron numéricamente inferiores con NUCALA® en comparación con el placebo.
Figura 3. Gráfico de Kaplan-Meier del tiempo hasta la primera recaída en EGPA
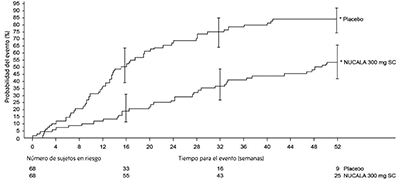
* Las barras de error indican intervalos de confianza de 95%.
EGPA = granulomatosis eosinofílica con poliangitis, SC = subcutánea.
Reducción de corticosteroides: Los sujetos que recibieron 300 mg de NUCALA® tuvieron una reducción significativamente mayor en la dosis diaria promedio de OCS en comparación con los sujetos que recibieron placebo durante las semanas 48 a 52 (Tabla 9).
Tabla 9. Dosis media diaria de corticosteroides orales durante las semanas 48 a 52 en EGPA
|
Número (%) de sujetos |
||
|
Placebo n = 68 |
NUCALA® 300 mg n = 68 |
|
|
0 |
2 (3) |
12 (18) |
|
> 0 a ≤ 4,0 mg |
3 (4 |
18 (26) |
|
> 4,0 a ≤ 7,5 mg |
18 (26) |
10 (15) |
|
> 7,5 mg |
45 (66) |
28 (41) |
|
Comparación: NUCALA®/placeboª Relación de probabilidadb IC del 95% |
0.20 0.09, 0.41 |
|
EGPA = granulomatosis eosinofílica con poliangitis, IC = intervalo de confianza.
a Se analizó mediante un modelo de probabilidades proporcionales con covariables del grupo de tratamiento, la dosis diaria inicial de corticosteroides orales, la puntuación basal de actividad de la vasculitis de Birmingham y la región.
b Relación de probabilidad < 1 favorece a NUCALA®.
Cuestionario de control del asma-6 (ACQ-6): El ACQ-6, es un cuestionario de 6 preguntas que es completado por el paciente, fue desarrollado para medir la adecuación del control del asma y el cambio en el control del asma. La tasa de respuesta al ACQ-6 durante el tratamiento durante las semanas 48 a 52 (definida como una disminución en la puntuación de 0.5 o más en comparación con el valor inicial) fue del 22% para 300 mg de NUCALA® y del 16% para el placebo (OR 1.56; IC del 95%: 0.63, 3.88 para 300 mg de NUCALA® en comparación con placebo).
Síndrome hipereosinofílico: Se evaluó un total de 108 sujetos adultos y adolescentes de 12 años de edad o más con HES durante al menos 6 meses en un estudio aleatorizado, doble ciego, controlado con placebo, multicéntrico de 32 semanas (NCT02836496). Los sujetos con HES secundario no hematológico (p. ej., hipersensibilidad al fármaco, infección por helmintos parasitarios, infección por VIH, neoplasias malignas no hematológicas) o HES con quinasa positiva para FIP1L1-PDGFRα fueron excluidos del estudio. Los sujetos recibieron 300 mg de NUCALA® o placebo por vía subcutánea una vez cada 4 semanas mientras continuaban con su terapia HES estable. Los sujetos que ingresaron al estudio habían experimentado al menos 2 brotes de HES en los últimos 12 meses y un recuento de eosinófilos en sangre de 1000 células/μL o más durante la selección. Los brotes históricos de HES para los criterios de ingreso al estudio se definieron como el empeoramiento de los síntomas clínicos o los recuentos de eosinófilos en sangre relacionados con HES que requirieron un escalamiento en la terapia. Los sujetos deben haber estado en terapia HES estable durante las 4 semanas anteriores a la aleatorización. La terapia HES podría incluir corticosteroides orales (OCS) crónicos o episódicos, terapia inmunosupresora o citotóxica.
La eficacia de NUCALA® en HES se estableció en función de la proporción de sujetos que experimentaron un brote de HES durante el periodo de tratamiento de 32 semanas. Un brote de HES se definió como el empeoramiento de los signos y síntomas clínicos de HES o el aumento de eosinófilos (en al menos 2 ocasiones), lo que resultó en la necesidad de aumentar los OCS o aumentar/agregar terapia HES citotóxica o inmunosupresora.
La demografía y las características basales de los sujetos en este estudio se proporcionan en la Tabla 10.
Tabla 10. Demografía y características basales en HES
|
N = 108 |
|
|
Edad media, años (SD) |
46.0 (15.78) |
|
Mujeres, n (%) |
57 (53) |
|
Raza blanca, n (%) |
100 (93) |
|
Duración media del HES, años |
5.55 |
HES = Síndrome hipereosinofílico, SD = desviación estándar.
Brotes: El estudio comparó la proporción de sujetos que experimentaron un brote de HES o se retiraron del estudio en los grupos de tratamiento con NUCALA® y placebo (Tabla 11). Durante el periodo de tratamiento de 32 semanas, la incidencia de brote de HES durante el periodo de tratamiento fue del 56% para el grupo de placebo y del 28% para el grupo tratado con NUCALA® (50% de reducción).
Tabla 11. Descripción general de brotes por HES
|
Número (%) de sujetos |
||
|
Placebo n = 54 |
NUCALA® 300 mg n = 54 |
|
|
Sujetos con brote de HES ≥ 1 o que se retiraron del estudio |
30 (56) |
15 (28) |
|
Sujetos con brote de HES de ≥ 1 |
28 (52) |
14 (26) |
|
Sujetos sin brote de HES que se retiraron del estudio |
2 (4) |
1 (2) |
|
Comparación: NUCALA®/placeboª |
||
|
Valor de P CMH |
||
|
Comparación: NUCALA®/placeboa Valor de P CMH Relación de probabilidadb IC del 95% |
0.002 0.28 (0.12, 0.64) |
|
HES = síndrome hipereosinofílico, CMH = Cochran-Mantel-Haenszel, IC = intervalo de confianza.
a El análisis comparó el número de sujetos que experimentaron un brote de HES ≥ 1 y/o se retiraron del estudio prematuramente.
b Relación de probabilidad < 1 favorece a NUCALA®.
Tiempo hasta el primer brote: Se observó una diferencia entre los grupos de NUCALA® y placebo en el tiempo hasta el primer brote de HES (Figura 4). El riesgo de un primer brote de HES durante el periodo de tratamiento fue un 66% más bajo para los sujetos tratados con NUCALA® en comparación con el placebo (índice de riesgo: 0.34; IC del 95%: 0.18; 0.67; P = 0.002).
Figura 4: Curva de Kaplan-Meier para el tiempo hasta el primer brote de HES
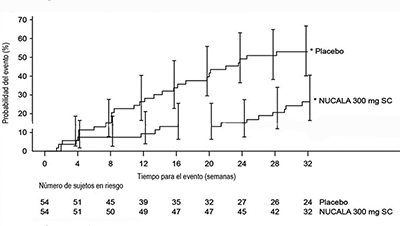
* Las barras de error indican Intervalos de confianza de 95%.
HES = síndrome hipereosinofílico, SC = subcutáneo.
Proporción de sujetos que experimentaron brotes durante la semana 20 hasta la semana 32: Desde la semana 20 hasta la semana 32, significativamente menos sujetos experimentaron un brote de HES o se retiraron del estudio cuando recibieron tratamiento con 300 mg de NUCALA® en comparación con placebo (17% vs 35%, respectivamente, P = 0.020; OR: 0.33; IC del 95%: 0.13, 0.85).
Tasa de brotes: Los sujetos que recibieron NUCALA® experimentaron significativamente menos brotes de HES durante el periodo de tratamiento de 32 semanas en comparación con el grupo de placebo (Tabla 12). El tratamiento con NUCALA® dio como resultado una reducción estadísticamente significativa del 66% en la tasa anual de brotes de HES en comparación con el placebo.
Tabla 12. Frecuencia de los brotes
|
Número (%) de sujetos |
||
|
Placebo n = 54 |
NUCALA® 300 mg n = 54 |
|
|
0 |
26 (48) |
40 (74) |
|
1 |
15 (28) |
11 (20) |
|
2 |
7 (13) |
3 (6) |
|
3 |
5 (9) |
0 |
|
4 |
1 (2) |
0 |
|
≥ 5 |
0 |
0 |
|
Comparación: NUCALA®/placeboª |
||
|
Valor de P de Wilcoxon (sin ajustar/ajustado)ª |
1.46 |
0.002/0.02 |
|
Tasa/año |
0.50 |
|
|
Relación de tasasb |
0.34 |
|
|
IC del 95% |
(0.19, 0.63) |
|
IC = intervalo de confianza.
a Valores de P ajustados, basados en la jerarquía especificada previamente.
b Una relación de tasas < 1 favorece a NUCALA®.
Breve inventario de fatiga: La sección 3 del Breve Inventario de Fatiga (BFI, por sus siglas en inglés) pide a los sujetos que registren su peor nivel de gravedad de agotamiento/cansancio durante las últimas 24 horas (escala: 0 = sin fatiga a 10 = tan malo como pueda imaginar). Al inicio del estudio, la mediana de las puntuaciones del punto 3 del BFI fue similar entre los grupos de tratamiento (4.46 para NUCALA® 300 mg y 4.69 para placebo). En la semana 32, las puntuaciones del punto 3 del BFI mejoraron con NUCALA® en comparación con el placebo (P = 0.036). La mediana del cambio desde la puntuación inicial para el punto 3 de BFI en la semana 32 fue de -0.66 en el grupo tratado con NUCALA® y de 0.32 en el grupo de placebo.
CONTRAINDICACIONES:
NUCALA® está contraindicado en sujetos con antecedentes de hipersensibilidad a mepolizumab o a cualquiera de los excipientes de la fórmula. Menores de 6 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
Consideraciones clínicas:
Riesgo materno y/o embriofetal asociado a la enfermedad: En mujeres con asma mal o moderadamente controlada, la evidencia demuestra que existe un mayor riesgo de preeclampsia en la madre y prematuridad, bajo peso al nacer y pequeño para la edad gestacional en el recién nacido. El nivel de control del asma debe ser monitoreado de cerca en mujeres embarazadas y el tratamiento debe ajustarse según sea necesario para mantener un control óptimo.
Lactancia:
Resumen de riesgos: No hay información con respecto a la presencia de mepolizumab en la leche materna, los efectos en el lactante amamantado o los efectos sobre la producción de leche. Sin embargo, mepolizumab es un anticuerpo monoclonal humanizado (IgG1 kappa), y la inmunoglobulina G (IgG) está presente en la leche materna en pequeñas cantidades. Mepolizumab estuvo presente en la leche de monos cynomolgus después del parto tras su dosificación durante el embarazo. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de NUCALA® de la madre y cualquier posible efecto adverso en el lactante causado por mepolizumab o por la afección materna subyacente.
REACCIONES SECUNDARIAS Y ADVERSAS:
Las siguientes reacciones adversas se describen con mayor detalle en otras secciones:
• Reacciones de hipersensibilidad (véase Precauciones generales).
• Infecciones oportunistas: herpes zóster (véase Precauciones generales).
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, la cantidad de reacciones adversas observadas en estudios clínicos de un medicamento no pueden compararse directamente con las de estudios clínicos de otro medicamento y pueden no reflejar las observadas en la práctica.
Experiencia en estudios clínicos en asma grave:
Sujetos adultos y adolescentes de 12 años de edad o más: Se evaluó un total de 1,327 sujetos con asma grave en 3 estudios aleatorizados, controlados con placebo, multicéntricos de 24 a 52 semanas de duración (Estudio 1, NCT01000506; Estudio 2, NCT01691521; y Estudio 3, NCT01691508). De éstos, 1,192 tenían antecedentes de 2 o más exacerbaciones en el año anterior al enrolamiento a pesar del uso regular de dosis altas de corticosteroides inhalados más controlador(es) adicional(es) (Estudios 1 y 2), y 135 sujetos requirieron corticosteroides orales diarios (OCS) además del uso regular de dosis altas de corticosteroides inhalados más controlador(es) adicional(es) para mantener el control del asma (Estudio 3). Todos los sujetos tenían marcadores de inflamación eosinofílica de las vías respiratorias (véase Estudios clínicos). De los sujetos enrolados, el 59% eran mujeres, el 85% eran de raza blanca, las edades oscilaron entre los 12 a 82 años.
Mepolizumab se administró por vía subcutánea o intravenosa una vez cada 4 semanas; 263 sujetos recibieron NUCALA® (mepolizumab 100 mg subcutáneo) durante al menos 24 semanas. Los eventos adversos graves que ocurrieron en más de 1 paciente y en un mayor porcentaje de sujetos que recibieron 100 mg de NUCALA®(n = 263) que placebo (n = 257) incluyeron 1 evento, herpes zóster (2 sujetos vs. 0 sujetos, respectivamente). Aproximadamente el 2% de los sujetos que recibieron NUCALA® 100 mg se retiraron de los estudios clínicos debido a eventos adversos en comparación con el 3% de los sujetos que recibieron placebo.
La incidencia de reacciones adversas en las primeras 24 semanas de tratamiento en 2 estudios confirmatorios de eficacia y seguridad (estudios 2 y 3) con NUCALA® 100 mg se muestra en la Tabla 13.
Tabla 13. Reacciones adversas con NUCALA® con una incidencia ≥ 3% y más comunes que placebo en sujetos con asma grave (Estudios 2 y 3)
|
Reacción adversa |
NUCALA® (Mepolizumab 100 mg subcutáneo) (n = 263) % |
Placebo (n = 257) % |
|
Cefalea |
19 |
18 |
|
Reacción en el sitio de inyección |
8 |
3 |
|
Dolor de espalda |
5 |
4 |
|
Fatiga |
5 |
4 |
|
Influenza |
3 |
2 |
|
Infección del tracto urinario |
3 |
2 |
|
Dolor abdominal superior |
3 |
2 |
|
Prurito |
3 |
2 |
|
Eccema |
3 |
<1 |
|
Espasmos musculares |
3 |
< 1 |
Estudio de 52 semanas: Las reacciones adversas del estudio 1 con 52 semanas de tratamiento con mepolizumab 75 mg por vía intravenosa (IV) (n = 153) o placebo (n = 155) y con una incidencia del ≥ 3% más frecuente que con placebo y no mostradas en la Tabla 13 fueron: dolor abdominal, rinitis alérgica, astenia, bronquitis, cistitis, mareos, disnea, infección del oído, gastroenteritis, infección del tracto respiratorio inferior, dolor musculoesquelético, congestión nasal, nasofaringitis, náuseas, faringitis, pirexia, sarpullido, dolor de dientes, infección viral, infección viral del tracto respiratorio y vómitos. Además, se produjeron 3 casos de herpes zóster en sujetos que recibieron mepolizumab 75 mg IV en comparación con 2 sujetos en el grupo placebo.
Reacciones sistémicas, incluidas las reacciones de hipersensibilidad: En los estudios 1, 2 y 3 descritos anteriormente, el porcentaje de sujetos que experimentaron reacciones sistémicas (alérgicas y no alérgicas) fue del 3% en el grupo que recibió NUCALA® 100 mg y del 5% en el grupo placebo. Se notificaron reacciones alérgicas/ de hipersensibilidad sistémicas en el 1% de los sujetos del grupo que recibió NUCALA® 100 mg y en el 2% de los sujetos del grupo placebo. Las manifestaciones notificadas con mayor frecuencia de reacciones alérgicas/de hipersensibilidad sistémicas en el grupo que recibió NUCALA® 100 mg incluyeron erupción cutánea, prurito, cefalea y mialgia. Se notificaron reacciones sistémicas no alérgicas en 2% de los sujetos en el grupo que recibió NUCALA® 100 mg y en 3% de los sujetos en el grupo placebo. Las manifestaciones de reacciones sistémicas no alérgicas reportadas con mayor frecuencia en el grupo que recibió NUCALA® 100 mg incluyeron erupción cutánea, rubor y mialgia. La mayoría de las reacciones sistémicas en sujetos que recibieron NUCALA® 100 mg (5/7) se experimentaron el día de la administración.
Reacciones en el sitio de inyección: Las reacciones en el sitio de inyección (p. ej., dolor, eritema, hinchazón, picazón, sensación de ardor) ocurrieron a una tasa del 8% en sujetos que recibieron NUCALA® 100 mg en comparación con el 3% en sujetos que recibieron placebo.
Seguridad a largo plazo: Novecientos noventa y ocho sujetos recibieron NUCALA® 100 mg en estudios de extensión abiertos en curso, durante los cuales se informaron casos adicionales de herpes zóster. El perfil general de eventos adversos ha sido similar a los estudios de asma grave descritos anteriormente.
Sujetos pediátricos de 6 a 11 años de edad: Los datos de seguridad de NUCALA® se basan en 1 estudio clínico de extensión abierto en el que participaron 36 sujetos con asma grave de 6 a 11 años de edad. Los sujetos recibieron 40 mg (para aquellos que pesan < 40 kg) o 100 mg (para aquellos que pesan ≥ 40 kg) de NUCALA® administrado por vía subcutánea una vez cada 4 semanas. Los sujetos recibieron NUCALA® durante 12 semanas (fase corta inicial). Después de una interrupción del tratamiento de 8 semanas, 30 sujetos recibieron NUCALA® durante otras 52 semanas (fase larga). El perfil de reacciones adversas para sujetos de 6 a 11 años de edad fue similar al observado en sujetos de 12 años o más.
Experiencia en estudios clínicos en rinosinusitis crónica con pólipos nasales: Un total de 407 sujetos con RSCcPN fueron evaluados en 1 estudio aleatorizado, controlado con placebo, multicéntrico, de tratamiento de 52 semanas. Los sujetos recibieron NUCALA® 100 mg o placebo por vía subcutánea una vez cada 4 semanas. Los sujetos tenían RSCcPN recurrente con antecedentes de cirugía previa y estaban tomando corticosteroides nasales durante al menos 8 semanas antes de la detección (ver Estudios clínicos). De los sujetos enrolados, el 35% eran mujeres, el 93% eran de raza blanca y las edades que oscilaron entre los 18 a 82 años. Aproximadamente el 2% de los sujetos que recibieron NUCALA® 100 mg se retiraron del tratamiento del estudio debido a eventos adversos en comparación con el 2% de los sujetos que recibieron placebo.
La Tabla 14 resume las reacciones adversas que ocurrieron en ≥ 3% de los sujetos tratados con NUCALA® y con mayor frecuencia que en los sujetos tratados con placebo en el estudio RSCcPN.
Tabla 14. Reacciones adversas con NUCALA® con una incidencia ≥ 3% y más comunes que placebo en sujetos con RSCcPN
|
Reacción adversa |
NUCALA® (Mepolizumab 100 mg subcutáneo) (n = 206) % |
Placebo (n = 201) % |
|
Dolor orofaríngeo |
8 |
5 |
|
Artralgia |
6 |
2 |
|
Dolor abdominal superior |
3 |
2 |
|
Diarrea |
3 |
2 |
|
Pirexia |
3 |
2 |
|
Sequedad nasal |
3 |
< 1 |
|
Sarpullido |
3 |
< 1 |
RSCcPN = rinosinusitis crónica con pólipos nasales.
Reacciones sistémicas, incluyendo reacciones de hipersensibilidad: En el estudio de 52 semanas, el porcentaje de sujetos que experimentaron reacciones sistémicas (alérgicas [hipersensibilidad tipo I] y otras) fue < 1% en el grupo que recibió NUCALA® 100 mg y < 1% en el grupo placebo. Las reacciones alérgicas sistémicas (hipersensibilidad tipo I) fueron notificadas por < 1% de los sujetos en el grupo que recibió NUCALA® 100 mg y ningún paciente en el grupo placebo. Las manifestaciones de reacciones alérgicas sistémicas (hipersensibilidad tipo I) incluyeron urticaria, eritema y erupción cutánea y 1 de las 3 reacciones ocurrieron el día de la administración. No se notificaron otras reacciones sistémicas en ningún paciente en el grupo que recibió NUCALA® 100 mg y en < 1% de los sujetos en el grupo placebo.
Reacciones en el sitio de inyección: Las reacciones en el sitio de la inyección (p. ej., eritema, prurito) ocurrieron a una tasa del 2% en sujetos que recibieron NUCALA® 100 mg en comparación con < 1% en sujetos que recibieron placebo.
Experiencia en estudios clínicos en granulomatosis eosinofílica con poliangitis: Un total de 136 sujetos con EGPA fueron evaluados en 1 estudio aleatorizado, controlado con placebo, multicéntrico, de tratamiento de 52 semanas. Los sujetos recibieron 300 mg de NUCALA® o placebo por vía subcutánea una vez cada 4 semanas. Los sujetos enrolados tuvieron un diagnóstico de EGPA durante al menos 6 meses antes de la inscripción con antecedentes de enfermedad recidivante o refractaria y estaban en un régimen de dosificación estable de prednisolona oral o prednisona mayor o igual a 7.5 mg/día (pero no superior a 50 mg/día) durante al menos 4 semanas antes del enrolamiento (véase Estudios clínicos). De los sujetos enrolados, el 59% eran mujeres, el 92% eran de raza blanca y las edades estuvieron en un rango de 20 a 71 años. No se identificaron reacciones adversas adicionales a las informadas en los estudios de asma grave.
Reacciones sistémicas, incluidas las reacciones de hipersensibilidad: En el estudio de 52 semanas, el porcentaje de sujetos que experimentaron reacciones sistémicas (alérgicas y no alérgicas) fue del 6% en el grupo que recibió 300 mg de NUCALA® y del 1% en el grupo que recibió placebo. Se notificaron reacciones alérgicas/de hipersensibilidad sistémicas por el 4% de los sujetos en el grupo que recibió 300 mg de NUCALA® y el 1% de los sujetos en el grupo placebo. Las manifestaciones de reacciones alérgicas/de hipersensibilidad sistémicas notificadas en el grupo que recibió 300 mg deNUCALA® incluyeron erupción cutánea, prurito, rubor, fatiga, hipertensión, sensación de calor en tronco y cuello, extremidades frías, disnea y estridor. Se notificaron reacciones sistémicas no alérgicas en 1 (1%) paciente en el grupo que recibió 300 mg de NUCALA® y ningún paciente en el grupo placebo. La manifestación notificada de reacciones sistémicas no alérgicas notificadas en el grupo que recibió 300 mg de NUCALA® fue angioedema. La mitad de las reacciones sistémicas en sujetos que recibieron 300 mg de NUCALA®(2/4) se experimentaron el día de la dosificación.
Reacciones en el sitio de inyección: Las reacciones en el sitio de inyección (p. ej., dolor, eritema, hinchazón) ocurrieron a una tasa del 15% en sujetos que recibieron 300 mg de NUCALA® en comparación con 13% en sujetos que recibieron placebo.
Experiencia de estudios clínicos en síndrome hipereosinofílico: Un total de 108 sujetos adultos y adolescentes de 12 años de edad o más con HES fueron evaluados en un estudio de tratamiento aleatorizado, controlado con placebo, multicéntrico y de 32 semanas. Los sujetos con HES secundario no hematológico o HES positivo para quinasa FIP1L1-PDGFRα se excluyeron del estudio. Los sujetos recibieron 300 mg de NUCALA® o placebo por vía subcutánea una vez cada 4 semanas. Los sujetos debieron estar en un régimen de dosificación estable previa de terapia para HES durante las 4 semanas anteriores a la aleatorización (ver Estudios clínicos). De los sujetos inscritos, el 53% eran mujeres, el 93% eran de raza blanca y las edades oscilaron de los 12 a 82 años. No se identificaron reacciones adversas adicionales a las informadas en los estudios de asma grave.
Reacciones sistémicas, incluyendo reacciones de hipersensibilidad: En el estudio, no se informaron reacciones alérgicas sistémicas (hipersensibilidad tipo I). Se notificaron otras reacciones sistémicas en 1 paciente (2%) del grupo que recibió 300 mg de NUCALA® y ningún paciente en el grupo placebo. La manifestación notificada de otra reacción sistémica fue una reacción cutánea multifocal experimentada el día de la administración.
Reacciones en el lugar de inyección: Las reacciones en el lugar de la inyección (p. ej., ardor, picor) ocurrieron a una tasa del 7% en sujetos que recibieron 300 mg de NUCALA® en comparación con el 4% en sujetos que recibieron placebo.
Inmunogenicidad: En sujetos adultos y adolescentes con asma grave que reciben NUCALA® 100 mg, 15/260 (6%) se presentaron anticuerpos anti-mepolizumab detectables. Se detectaron anticuerpos neutralizantes en solo 1 paciente con asma recibiendo NUCALA® 100 mg. Los anticuerpos anti-mepolizumab aumentaron ligeramente (aproximadamente un 20%) el aclaramiento de mepolizumab. No hubo evidencia de una correlación entre los títulos de anticuerpos anti-mepolizumab y el cambio en el nivel de eosinófilos. Se desconoce la relevancia clínica de la presencia de anticuerpos anti-mepolizumab. En el estudio clínico de niños de 6 a 11 años de edad con asma grave que recibieron NUCALA® 40 o 100 mg, 2/35 (6%) tuvieron anticuerpos anti-mepolizumab detectables durante la fase inicial del estudio. Ningún niño presentó anticuerpos anti-mepolizumab detectables durante la fase larga del estudio.
En sujetos con RSCcPN que recibieron 100 mg de NUCALA®, 6/196 (3%) presentaron anticuerpos anti-mepolizumab detectables. No se detectaron anticuerpos neutralizantes en ningún paciente con RSCcPN.
En pacientes con EGPA que recibieron 300 mg de NUCALA®, 1/68 (< 2%) presentaron anticuerpos anti-mepolizumab detectables. No se detectaron anticuerpos neutralizantes en ningún paciente con EGPA.
En pacientes adultos y adolescentes con HES que recibieron 300 mg de NUCALA®, 1/53 (2%) tuvieron anticuerpos anti-mepolizumab detectables. No se detectaron anticuerpos neutralizantes en ningún paciente con HES.
La frecuencia reportada de anticuerpos anti-mepolizumab puede subestimar a la frecuencia real debido a la menor sensibilidad del estudio en presencia de una alta concentración de fármaco. Los datos reflejan el porcentaje de los sujetos cuyos resultados de las pruebas fueron positivos para anticuerpos contra mepolizumab en estudios específicos. La incidencia observada de positividad de anticuerpos en un estudio depende en gran medida de varios factores, incluidos sensibilidad y especificidad del estudio, metodología del estudio, manejo de la muestra, momento de la recolección de la muestra, medicamentos concomitantes y enfermedad subyacente.
Datos post-comercialización: Además de las reacciones adversas notificadas en los estudios clínicos, se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de NUCALA®. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al medicamento. Estos eventos han sido elegidos para su inclusión debido a su gravedad, frecuencia de notificación o conexión causal con NUCALA® o una combinación de estos factores.
Trastornos del sistema inmunitario: Reacciones de hipersensibilidad, incluyendo anafilaxia.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de mepolizumab. La literatura publicada utilizando modelos animales sugiere que la IL-5 y los eosinófilos son parte de una reacción inflamatoria temprana en el sitio de la tumorigénesis y pueden promover el rechazo tumoral. Sin embargo, otros informes indican que la infiltración de eosinófilos en los tumores puede promover el crecimiento tumoral. Por lo tanto, se desconoce el riesgo de malignidad en humanos de un anticuerpo contra IL-5 como mepolizumab.
La fertilidad masculina y femenina no se vio afectada con base en la ausencia de hallazgos histopatológicos adversos en los órganos reproductivos de monos cynomolgus que recibieron mepolizumab durante 6 meses en dosis IV de hasta 100 mg/kg una vez cada 4 semanas (aproximadamente 20 veces la MRHD de 300 mg en una base de ABC). El apareamiento y el rendimiento reproductivo no se vieron afectados en ratones CD-1 machos y hembras que recibieron un anticuerpo análogo, que inhibe la actividad de la IL-5 murina, a una dosis IV de 50 mg/kg una vez por semana.
Resumen de riesgos: Los datos sobre la exposición durante el embarazo son insuficientes para informar sobre el riesgo asociado al fármaco. Los anticuerpos monoclonales, como el mepolizumab, se transportan a través de la placenta de manera lineal a medida que avanza el embarazo; por lo tanto, los efectos potenciales en un feto tienen probabilidad de ser mayores durante el segundo y tercer trimestre del embarazo. En un estudio de desarrollo prenatal y postnatal realizado en monos cynomolgus, no hubo evidencia de daño fetal con la administración IV de mepolizumab durante todo el embarazo a dosis que produjeron exposiciones de hasta aproximadamente 9 veces la exposición a la dosis humana máxima recomendada (MRHD) de 300 mg por vía subcutánea. En población general en los Estados Unidos, el riesgo estimado de defectos congénitos graves y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos:
Datos en animales: En un estudio de desarrollo prenatal y postnatal, monos cynomolgus preñados recibieron mepolizumab desde los días 20 a 140 días de gestación a dosis que produjeron exposiciones hasta aproximadamente 9 veces mayores que las logradas con la MRHD (sobre una base de AUC con dosis intravenosas maternas de hasta 100 mg/kg una vez cada 4 semanas). El mepolizumab no provocó efectos adversos sobre el crecimiento fetal o neonatal (incluida la función inmunitaria) hasta 9 meses después del nacimiento. No se realizaron exámenes para detectar malformaciones internas o esqueléticas. El mepolizumab cruzó la placenta en monos cynomolgus. Las concentraciones de mepolizumab fueron aproximadamente 2.4 veces más altas en los lactantes que en las madres hasta el día 178 después del parto. Los niveles de mepolizumab en la leche fueron ≤ 0.5% de la concentración sérica materna.
En un estudio de fertilidad, embrionario temprano y desarrollo embriofetal, ratones CD-1 preñados recibieron un anticuerpo análogo, que inhibe la actividad de la interleucina-5 murina (IL-5), a una dosis IV de 50 mg/kg una vez por semana durante toda la gestación. El anticuerpo análogo no fue teratogénico en ratones. Se ha informado que el desarrollo embriofetal de ratones deficientes en IL-5 generalmente no se ve afectado en relación con los ratones de tipo salvaje.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
No se han realizado estudios formales de interacciones farmacológicas con NUCALA®.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
No hay datos.
PRECAUCIONES GENERALES:
Reacciones de hipersensibilidad: Se han producido reacciones de hipersensibilidad (p. ej., anafilaxia, angioedema, broncoespasmo, hipotensión, urticaria, erupción cutánea) después de la administración de NUCALA®. Estas reacciones generalmente ocurren a las pocas horas de la administración, pero en algunos casos pueden tener un inicio retardado (es decir, días). En caso de una reacción de hipersensibilidad, NUCALA® debe suspenderse.
Síntomas de asma aguda o de enfermedad deteriorante:
NUCALA® no debe ser usado para tratar síntomas agudos de asma o exacerbaciones agudas. No usar NUCALA® para tratar broncoespasmo agudo o estado asmático. Los sujetos deben buscar atención médica si su asma continúa sin controlarse o empeora después de iniciar el tratamiento con NUCALA®.
Infecciones oportunistas: Herpes zóster: El herpes zóster ha ocurrido en sujetos que recibieron NUCALA® 100 mg en estudios clínicos controlados (véase Reacciones adversas). Considere la vacunación si es médicamente apropiado.
Reducción en la dosis de corticoesteroides:
No interrumpa los corticosteroides sistémicos o inhalados (ICS) abruptamente al iniciar el tratamiento con NUCALA®. Las reducciones en la dosis de corticosteroides, si se requieren, deben ser graduales y realizarse bajo la supervisión de un médico. La reducción en la dosis de corticosteroides puede estar asociada con síntomas sistémicos de abstinencia y/o desenmascarar condiciones previamente suprimidas por la terapia sistémica con corticosteroides.
Infecciones parasitarias (helmintos): Los eosinófilos pueden participar en la respuesta inmunológica a algunas infecciones por helmintos. Los sujetos con infecciones parasitarias preexistentes se excluyeron de participar en estudios clínicos. Se desconoce si NUCALA® influenciará en la respuesta del paciente contra las infecciones parasitarias. Los sujetos con infecciones preexistentes por helmintos deben tratarse antes del tratamiento con NUCALA®. Si los sujetos se infectan mientras reciben tratamiento con NUCALA® y no responden al tratamiento contra helmintos, interrumpir el tratamiento con NUCALA® hasta que se resuelva la infección.
Efectos sobre la capacidad para conducir y usar maquinaria pesada:
No se han realizado estudios para investigar el efecto de mepolizumab sobre el desempeño en la capacidad para conducir o para operar maquinaria pesada. No se anticiparía un efecto deletéreo sobre estas actividades a partir del perfil farmacológico de reacciones adversas de NUCALA®.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Subcutánea.
Asma grave:
Adultos y adolescentes mayores de 12 años de edad:
La dosis recomendada de NUCALA® en adultos y adolescentes mayores de 12 años de edad es de 100 mg administrados una vez cada 4 semanas mediante inyección subcutánea en la parte superior del brazo, el muslo o el abdomen (Véase Uso y manejo en Dosis y vía de administración).
Pacientes pediátricos de 6 a 11 años de edad: La dosis recomendada de NUCALA® para inyección en pacientes pediátricos de 6 a 11 años de edad es de 40 mg administrados una vez cada 4 semanas mediante inyección subcutánea en la parte superior del brazo, el muslo o el abdomen (Véase Uso y manejo en Dosis y vía de administración).
Rinosinusitis crónica con pólipos nasales: La dosis recomendada de NUCALA® es de 100 mg administrados una vez cada 4 semanas mediante inyección subcutánea en la parte superior del brazo, el muslo o el abdomen (Véase Uso y manejo en Dosis y vía de administración).
Granulomatosis eosinofílica con poliangitis: La dosis recomendada de NUCALA® es de 300 mg administrados una vez cada 4 semanas por inyección subcutánea como 3 inyecciones separadas de 100 mg en la parte superior del brazo, el muslo o el abdomen. Administre inyecciones individuales de 100 mg a una distancia mínima de 5 cm (aproximadamente 2 pulgadas) (Véase Uso y manejo en Dosis y vía de administración).
Síndrome hipereosinofílico: La dosis recomendada de NUCALA® es de 300 mg administrados una vez cada 4 semanas por inyección subcutánea como 3 inyecciones separadas de 100 mg en la parte superior del brazo, el muslo o el abdomen. Administre inyecciones individuales de 100 mg a una distancia mínima de 5 cm (aproximadamente 2 pulgadas) (Véase Uso y manejo en Dosis y vía de administración).
Uso y manejo:
Fórmula liofilizada:
Preparación y administración de NUCALA® (frasco ámpula) NUCALA® para inyección debe ser reconstituido y administrado por un profesional de la salud. En línea con la práctica clínica se recomienda el monitoreo de los pacientes tras la administración de agentes biológicos (Véase precauciones generales).
Instrucciones de reconstitución:
1. Reconstituir NUCALA® en el frasco ámpula con 1.2 mL de agua estéril para uso inyectable, utilizando preferentemente una jeringa de 2 o 3 mL y una aguja calibre 21. La solución reconstituida contendrá una concentración de 100 mg/mL de mepolizumab. No mezclar con otros medicamentos.
2. Dirigir el flujo del agua estéril para uso inyectable en sentido vertical hacia el centro del polvo liofilizado, que puede tener una apariencia apelmazada. Agite suavemente el frasco ámpula durante 10 segundos con movimientos circulares a intervalos de 15 segundos hasta que el polvo se haya disuelto.
Nota: No agitar la solución reconstituida durante el procedimiento ya que esto puede llevar a producir espuma o la precipitación del producto. La reconstitución se completa en un lapso de 5 minutos después de haber agregado el agua estéril para uso inyectable, pero puede tomar tiempo adicional.
Luego de la reconstitución con 1.2 mL de agua estéril para uso inyectable, el volumen final de la solución es 1.44 mL que incluye la contribución de volumen del polvo liofilizado, proporcionando una concentración objetivo de 100 mg/mL (144 mg/1.44 mL = 100 mg/mL).
Los 144 mg de mepolizumab reconstituidos con 1.2 mL de agua inyectable proporcionan una concentración de mepolizumab garantizada de 100 mg/mL y un volumen extraíble de 1.0 mL por cada frasco ámpula.
3. Si se utiliza un dispositivo de reconstitución mecánica (agitador orbital) para reconstituir NUCALA® para inyección, agitar a 450 rpm por no más de 10 minutos. Alternativamente, agitar a 1,000 rpm por no más de 5 minutos es aceptable.
4. Inspeccionar visualmente la claridad de la solución reconstituida y partículas antes de su uso. La solución debe ser clara a opalescente, e incolora a amarillo pálido o café pálido, sin partículas visibles. La formación de pequeñas burbujas de aire es esperada y aceptable. Si hay partículas presentes en la solución o si ésta parece estar turbia o lechosa, la solución no debe administrarse.
5. Si la solución reconstituida no se usa inmediatamente, debe:
• Almacenar a menos de 30°C.
• No congelar, y
• Desechar si no se usa dentro de las siguientes 8 horas después de la reconstitución.
Administración de dosis de 100 mg:
1. Para administración subcutánea, usar preferiblemente una jeringa de polipropileno de 1 mL equipada con una aguja desechable de calibre de 21 a 27 x 0.5 pulgadas (13 mm).
2. Justo antes de la administración, tomar 1 mL de NUCALA® reconstituido del frasco ámpula. No agitar la solución reconstituida durante el procedimiento ya que esto puede producir espuma o precipitación del producto.
3. Administrar la inyección de 1 mL (equivalente a 100 mg de mepolizumab) por vía subcutánea en la parte superior del brazo, muslo o abdomen.
Administración de dosis de 40 mg:
1. Para administración subcutánea, usar preferiblemente una jeringa de polipropileno de 1 mL equipada con una aguja desechable de calibre de 21 a 27 x 0.5 pulgadas (13 mm).
2. Justo antes de la administración, tomar 0.4 mL de NUCALA® reconstituido del frasco ámpula. No agitar la solución reconstituida durante el procedimiento ya que esto puede producir espuma o precipitación del producto.
3. Administrar la inyección de 0.4 mL (equivalente a 40 mg de mepolizumab) por vía subcutánea en la parte superior del brazo, muslo o abdomen.
Cada frasco ámpula de NUCALA® debe usarse para un solo paciente, y el resto del contenido debe desecharse.
Fórmula líquida:
Preparación y administración de la inyección de NUCALA® autoinyector precargado y jeringa de seguridad: La inyección de NUCALA® está diseñada para su uso bajo la guía de un profesional de la salud.
El autoinyector precargado de 100 mg/mL y la jeringa de seguridad de 100 mg/mL son sólo para uso en adultos y adolescentes mayores de 12 años. Un paciente puede autoinyectarse, o el cuidador capacitado del paciente puede administrar la inyección de NUCALA® 100 mg/mL por vía subcutánea después de que el profesional de la salud determine que es apropiado.
La jeringa de seguridad de 40 mg/0.4 mL es sólo para uso en niños de 6 a 11 años de edad y debe ser administrada por un profesional de la salud o cuidador capacitado. El cuidador capacitado puede administrar la inyección de NUCALA® 40 mg/0.4 mL por vía subcutánea después de que el profesional de la salud determine que es apropiado.
Es necesario proporcionar un entrenamiento apropiado en la técnica de inyección subcutánea y en la preparación y administración de NUCALA® previo a su uso.
Administración:
1. Sacar el autoinyector o la jeringa de seguridad del refrigerador y dejarlo reposar a temperatura ambiente durante 30 minutos antes de la inyección. No calentar la inyección de NUCALA® de ninguna otra manera.
2. Antes de la administración, inspeccionar visualmente la ventana del autoinyector o la jeringa de seguridad para detectar partículas o decoloración. La inyección de NUCALA® debe ser de clara a opalescente, de incolora a amarillo pálido a marrón pálido. No use la inyección de NUCALA® si el producto presenta decoloración, turbidez o si hay partículas presentes en la solución. No utilice el autoinyector de NUCALA® ni la jeringa de seguridad si ésta cae sobre una superficie dura.
3. Administrar la inyección subcutánea en el muslo o el abdomen, evitando los 5 cm (aproximadamente 2 pulgadas) alrededor del ombligo. La administración en la parte superior del brazo también se puede usar si un cuidador administra la inyección subcutánea.
4. Para su uso en EGPA y HES, asegúrese de que los sitios de inyección para cada inyección subcutánea estén separados por al menos 5 cm (aproximadamente 2 pulgadas).
5. Nunca aplique inyecciones en áreas donde la piel esté sensible, amoratada, roja o dura.
6. Si se olvida una dosis, administre la dosis lo antes posible. A partir de entonces, el paciente puede reanudar la dosificación el día habitual de administración. Si ya es momento de aplicar la siguiente dosis, entonces administrar según lo planeado.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
No existe un tratamiento específico para una sobredosis de mepolizumab. Si se produce una sobredosis, el paciente debe recibir tratamiento de apoyo con el monitoreo adecuado según sea necesario.
PRESENTACIONES:
Caja de cartón con 1 o 3 frasco(s) ámpula con 100 mg de polvo liofilizado.
Caja de cartón con 1 o 3 pluma(s) pre-cargada(s) (autoinyector) o con 1 o 3 jeringa(s) pre-llenadas(s) (jeringa de seguridad) con 100 mg/mL.
Caja de cartón con 1 o 3 jeringa(s) pre-llenada(s) (jeringa de seguridad) con 40 mg/0.4 mL.
Todas las presentaciones con instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Precauciones especiales de almacenamiento:
Frasco ámpula con liofilizado sin abrir:
No congelar. Proteger de la luz. Almacenar en el empaque original hasta su uso.
Solución reconstituida:
Después de la reconstitución con agua estéril para uso inyectable, el producto permanece estable hasta por 8 horas cuando se almacena a menos de 30 °C.
No congelar.
Durante la administración, no se requiere la protección de la luz.
Pluma precargada (autoinyector) o jeringa prellenada (jeringa de seguridad): Almacenar en refrigeración (2-8 ºC) en su empaque original hasta su uso para proteger de la luz.
No congelar.
Si es necesario, el producto se puede conservar fuera del refrigerador hasta por 7 días a temperatura ambiente (hasta 30°C), en su empaque original sin abrir, protegido de la luz. Desechar el producto si se dejó fuera del refrigerador por más de 7 días.
Una vez que se abra el empaque, el medicamento debe administrarse dentro de las siguientes 8 horas. Desechar el producto si no se administra dentro de 8 horas.
Deséchese inmediatamente después de su uso.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. La prescripción y administración de NUCALA® debe ser por médicos con experiencia en el diagnóstico y tratamiento del asma eosinofílica grave refractaria, rinosinusitis crónica con pólipos nasales (RSCcPN), granulomatosis eosinofílica con poliangitis (EGPA) o síndrome hipereosinofílico (HES). Su venta requiere receta médica. No se deje al alcance de los niños. Este medicamento no está destinado para uso en niños menores de 6 años de edad, para el tratamiento de asma eosinofílica grave refractaria. Este medicamento está destinado para su uso en mayores de 12 años de edad, para el tratamiento del síndrome hipereosinofílico. Este medicamento está destinado para su uso en adultos, para el tratamiento de la rinosinusitis crónica con pólipos nasales o granulomatosis Eosinofílica con poliangitis. NUCALA® no debe mezclarse con otros medicamentos. En caso de embarazo y lactancia, consulte a su médico. No se administre si la solución no es transparente, o si contiene partículas en suspensión o sedimentos. No se administre si el cierre ha sido violado.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx y
farmacovigilancia.mx@gsk.com
Titular del Registro:
Glaxo Wellcome, S.A.
Avda. Extremadura, 3, Pol. Ind. Allendeduero,
Aranda de Duero, 09400 Burgos, España.
Representante Legal:
GLAXOSMITHKLINE MÉXICO, S.A. de C.V.
Autopista México-Querétaro Km. 41.5 Edif. TR9,
Interior 5-C, Ex. Hacienda San Miguel,
C.P. 54715, Cuautitlán Izcalli, México, México.
Reg. Núm. 243M2017 SSA IV
® Marca Registrada