
NUVARING
ETINILESTRADIOL, ETONOGESTREL
Anillo vaginal
1 Caja, 1 Dispositivo vaginal con polvo, 11.7/2.7 mg/mg
III. FORMA FARMACÉUTICA Y FORMULACIÓN
El dispositivo vaginal contiene:
Etonogestrel 1.7 mg
Etinilestradiol 2.7 mg
Excipiente cbp
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 422M2003 SSA IV
Versión: S-CCDS-MK8342A-RNG-112021
RCN: 100000642-MX
IV. INDICACIONES TERAPÉUTICAS
Anticonceptivo.
V. FARMACOCINÉTICA Y FARMACODINAMIA
Propiedades Farmacodinámicas:
Grupo farmacoterapéutico Anillo vaginal con progestágeno y estrógeno, código ATC: G02BB01.
Mecanismo de acción:
NUVARING contiene etonogestrel y etinilestradiol. El etonogestrel es un progestágeno derivado de la 19-nortestosterona y se une con gran afinidad a los receptores de la progesterona en los órganos blanco. El etinilestradiol es un estrógeno ampliamente utilizado en los productos anticonceptivos. El efecto anticonceptivo de NUVARING se basa en varios mecanismos, de los cuales el más importante es la inhibición de la ovulación.
EFICACIA
Se realizaron estudios clínicos a nivel mundial en mujeres entre 18 y 40 años de edad. En estos estudios, el índice de Pearl global para NUVARING asciende a 0.96 (IC 95%: 0.64-1.39) y 0.64 (IC 95%: 0.35-1.07) para los análisis ITT y PP, respectivamente.
Estos valores fueron similares a los índices de Pearl obtenidos en los estudios comparativos para el anticonceptivo oral combinado (AOC) con levonorgestrel/etinilestradiol (LNG/EE) 0.150/0.030 mg y el AOC con drospirenona/etinilestradiol (DRSP/EE) 3/0.030 mg.
Los anticonceptivos combinados administrados oralmente tienen, además de la protección contra el embarazo, varias propiedades positivas que, junto con las propiedades negativas (ver REACCIONES SECUNDARIAS Y ADVERSAS), pueden resultar útiles para decidir el método anticonceptivo. El ciclo es más regular y con frecuencia la menstruación es menos dolorosa y el sangrado es más leve. Esto último puede reducir la aparición de deficiencia de hierro.
Además, existe evidencia de reducción del riesgo de cáncer de endometrio y cáncer de ovario. Asimismo, se ha demostrado que los AOCs de mayor concentración (0.05 mg de EE) reducen la incidencia de quistes de ovario, enfermedad inflamatoria pélvica, enfermedad benigna de la mama y embarazo ectópico. Se requiere confirmación acerca de si estos beneficios también aplican a los anticonceptivos hormonales de menor concentración.
PATRÓN DE SANGRADO
Se compararon las características del sangrado con NUVARING con un AOC que contiene 0.150/0.030 mg LNG/EE en más de 1,000 mujeres durante un año. Los resultados de este estudio demuestran que la incidencia de manchado o sangrado intermenstrual fue significativamente más baja en las usuarias de NUVARING que en las usuarias de AOC.
Además, la incidencia de sangrado limitado exclusivamente al periodo sin uso de hormonas fue significativamente mayor en las usuarias de NUVARING.
EFECTOS SOBRE LA DENSIDAD MINERAL ÓSEA
Se evaluaron los efectos de NUVARING (n = 76) sobre la densidad mineral ósea (DMO) en comparación con un dispositivo intrauterino (DIU) no hormonal (n = 31) en mujeres durante un periodo de dos años. No se observaron efectos adversos sobre la masa ósea.
POBLACIÓN PEDIÁTRICA
No se han estudiado la seguridad y la eficacia de NUVARING en adolescentes de menos de 18 años.
Propiedades Farmacocinéticas
Etonogestrel
ABSORCIÓN
El etonogestrel que libera NUVARING se absorbe rápidamente por la mucosa vaginal. Aproximadamente 1 semana después de la inserción, se alcanzan concentraciones séricas máximas de etonogestrel de alrededor de 1,700 pg/mL. Las concentraciones séricas presentan pequeñas fluctuaciones y disminuyen lentamente hasta aproximadamente 1,600 pg/mL después de 1 semana, 1,500 pg/mL después de 2 semanas y 1,400 pg/mL después de 3 semanas de uso. La biodisponibilidad absoluta es de alrededor del 100%, la cual es más elevada que tras la administración por vía oral. En una pequeña cantidad de mujeres que utilizaban NUVARING o un anticonceptivo oral que contenía 0.150 mg de desogestrel y 0.020 mg de etinilestradiol, se midieron los niveles cervicales e intrauterinos de etonogestrel. Los niveles observados fueron comparables.
DISTRIBUCIÓN
El etonogestrel se une a la albúmina sérica y a la globulina fijadora de hormonas sexuales (SHBG).
El volumen de distribución aparente de etonogestrel es de 2.3 L/kg.
METABOLISMO
El etonogestrel se metaboliza por las vías conocidas del metabolismo de esteroides. La depuración aparente del suero es de alrededor de 3.5 L/h. No se observó interacción directa con la administración simultánea de etinilestradiol.
ELIMINACIÓN
Los niveles séricos de etonogestrel disminuyen en dos fases. La fase de eliminación terminal se caracteriza por una vida media de aproximadamente 29 horas. El etonogestrel y sus metabolitos se excretan en una relación orina/bilis de alrededor de 1.7:1. La vida media de excreción de metabolitos es de alrededor de 6 días.
Etinilestradiol
ABSORCIÓN
El etinilestradiol que libera NUVARING se absorbe rápidamente por la mucosa vaginal. Concentraciones séricas máximas de alrededor de 35 pg/mL se alcanzan 3 días después de la inserción y disminuyen a 19 pg/mL después de 1 semana, 18 pg/mL después de 2 semanas y 18 pg/mL después de 3 semanas de uso. La biodisponibilidad absoluta es aproximadamente del 56%, la cual es comparable a la administración oral de etinilestradiol. Se midieron los niveles cervicales e intrauterinos de etinilestradiol en una pequeña cantidad de mujeres que utilizaban NUVARING o un anticonceptivo oral que contenía 0.150 mg de desogestrel y 0.020 mg de etinilestradiol. Los niveles observados fueron comparables.
Se midieron los niveles de etinilestradiol en un estudio aleatorizado comparativo con NUVARING (liberación vaginal diaria de 0.015 mg de EE), un parche transdérmico (norelgestromina/EE, liberación diaria de 0.020 mg de EE) y un AOC (levonorgestrel/EE, liberación diaria de 0.030 mg de EE) durante un ciclo en mujeres sanas. La exposición sistémica mensual a etinilestradiol (AUC0-∞) de NUVARING fue significativamente menor desde el punto de vista estadístico que la observada con el parche y con el AOC, con valores de 10.9; 37.4 y 22.5 ng• h/mL, respectivamente.
DISTRIBUCIÓN
El etinilestradiol se une en gran medida, pero inespecíficamente, a la albúmina sérica. Se determinó un volumen de distribución aparente de alrededor de 15 L/kg.
METABOLISMO
El etinilestradiol se metaboliza principalmente por hidroxilación aromática, pero se forma una gran variedad de metabolitos hidroxilados y metilados. Estos están presentes como metabolitos libres y como conjugados glucurónido y sulfato. La depuración aparente es de alrededor de 35 L/h.
ELIMINACIÓN
Los niveles séricos del etinilestradiol disminuyen en 2 fases. La fase de eliminación terminal se caracteriza por una gran variación individual en la vida media, lo cual da como resultado una mediana de vida media de aproximadamente 34 horas. No se excreta etinilestradiol sin cambios; los metabolitos del etinilestradiol se excretan en una relación orina: bilis de 1.3:1. La vida media de la excreción de metabolitos es de alrededor de 1.5 días.
POBLACIONES ESPECIALES
Población pediátrica
No se ha estudiado la farmacocinética de NUVARING en adolescentes postmenárquicas sanas de menos de 18 años de edad.
Efecto de la insuficiencia renal
No se realizaron estudios para evaluar el efecto de la enfermedad renal sobre la farmacocinética de NUVARING.
Efecto de la insuficiencia hepática
No se realizaron estudios para evaluar el efecto de la enfermedad hepática sobre la farmacocinética de NUVARING. Sin embargo, las hormonas esteroideas podrían ser muy mal metabolizadas en mujeres con alteración de la función hepática.
Grupos étnicos
No se realizaron estudios para evaluar la farmacocinética de NUVARING en grupos étnicos.
VI. CONTRAINDICACIONES
NUVARING no deberá ser utilizado en presencia de cualquiera de las condiciones que se listan a continuación.
En el caso de que aparezca por primera vez cualquiera de estas condiciones durante el uso de NUVARING, se deberá extraer de inmediato.
• Presencia o antecedentes de trombosis venosa, con o sin embolia pulmonar.
• Presencia o antecedentes de trombosis arterial (por ej., accidente cerebrovascular, infarto de miocardio o pródromos de una trombosis [por ej., angina de pecho o ataque isquémico transitorio]).
• Predisposición conocida para trombosis venosa o arterial, con o sin compromiso hereditario como, por ejemplo, resistencia a la proteína C. Activada (PCA), deficiencia de antitrombina III, deficiencia de proteína C, deficiencia de proteína S, hiperhomocisteinemia y anticuerpos antifosfolípidos (anticuerpos anticardiolipina, anticoagulante lúpico).
• Cirugía mayor con inmovilización prolongada (véase la Sección de PRECAUCIONES GENERALES).
• Antecedentes de migraña con síntomas neurológicos focales.
• Diabetes mellitus con compromiso vascular.
• La presencia de un factor de riesgo grave o de múltiples factores de riesgo para trombosis venosa o arterial también puede constituir una contraindicación.
• Pancreatitis o antecedentes de la misma si está asociada con hipertrigliceridemia grave.
• Presencia o antecedentes de enfermedad hepática grave en la medida en que los valores de la función hepática no se hayan normalizado.
• Presencia o antecedentes de tumores hepáticos (benignos o malignos).
• Conocimiento o sospecha de condiciones malignas de los órganos genitales o las mamas si son influenciadas por los esteroides sexuales.
• Sangrado vaginal no diagnosticado.
• Conocimiento o sospecha de embarazo.
• Hipersensibilidad a la sustancia activa o a cualquiera de los excipientes componentes de NUVARING.
NUVARING está contraindicado para utilizarse con el régimen de combinación contra el virus de Hepatitis C (HCV) ombitasvir/paritaprevir/ritonavir, con o sin dasabuvir (ver sección de PRECAUCIONES GENERALES).
VII. PRECAUCIONES GENERALES
Si se presentan cualquiera de las condiciones/factores de riesgo mencionados a continuación, se deberán considerar los beneficios del uso de NUVARING frente a los posibles riesgos para cada mujer en particular y discutirlos con la mujer antes de que decida comenzar a utilizarlo.
En el caso de que se agrave, exacerbe o aparezca por primera vez cualquiera de estas condiciones o factores de riesgo, la mujer deberá consultar al médico. El médico deberá, entonces, decidir si se debe discontinuar el uso de NUVARING.
Trastornos circulatorios
• El uso de anticonceptivos hormonales combinados (AHC) ha sido asociado con la aparición de trombosis venosa (trombosis venosa profunda y embolia pulmonar) y trombosis arterial y complicaciones asociadas, algunas veces con consecuencias fatales.
• El uso de AHCs conlleva un riesgo mayor de tromboembolismo venoso (TEV) en comparación con el no uso. El exceso de riesgo de TEV es mayor durante el primer año en que una mujer utiliza AHC. Los datos de un estudio de seguridad con una cohorte prospectiva grande de varios anticonceptivos orales combinados (AOC) sugieren que este incremento en el riesgo, en comparación con las usuarias de no-AOC, es más alto durante los primeros seis meses de uso de AOC y se presenta después de comenzar a utilizar por primera vez AOC o al recomenzar su uso (después de un intervalo libre de píldora de 4 semanas o más), el mismo o un AOC diferente. Este riesgo incrementado es menor al riesgo de TEV asociado con embarazo, que se estima en 5 a 20 casos por 10 000 mujeres-años. El TEV es fatal en el 1-2% de los casos.
• La siguiente figura presenta el riesgo de desarrollar una TEV en mujeres que no están embarazadas y que no utilizan AHC, para mujeres que utilizan AHC, para mujeres embarazadas y para mujeres en el periodo postparto. Para poner en perspectiva el riesgo de desarrollar una TEV: si 10,000 mujeres que no están embarazadas y que no utilizan AHCs son seguidas durante un año, entre 1 y 5 de estas mujeres desarrollarán una TEV.
Probabilidad de desarrollar una TEV
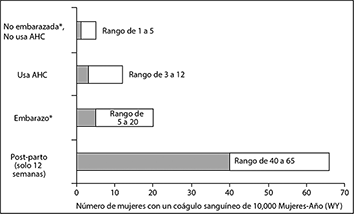
* AHC= anticonceptivo hormonal combinado.
** Datos de embarazo basados en la duración real del embarazo en los estudios de referencia. Con base en una hipótesis modelo de que la duración del embarazo es de nueve meses, la tasa es de 7 a 27 por 10,000 WY.
• En los estudios requeridos o patrocinados por las agencias regulatorias, las usuarias de NUVARING tuvieron un riesgo de presentar una TEV similar al de las usuarias de AOC (véase en la siguiente tabla las proporciones de riesgo ajustadas). Un estudio observacional, prospectivo, grande, el Transatlantic Active Surveillance on Cardiovascular Safety of NUVARING (TASC), investigó el riesgo de padecer TEV en nuevas usuarias, pacientes con cambio de esquema y pacientes que reinician el uso de NUVARING y AOCs en una población representativa de usuarias clínicas de rutina. Las mujeres fueron seguidas durante un periodo de 24 a 48 meses. Los resultados mostraron un riesgo similar de TEV entre los usuarios de NUVARING (incidencia de TEV de 8.3 por 10,000 WY) y las mujeres que utilizan AOCs (incidencia de TEV de 9.2 por 10,000 WY). Para mujeres que utilizan AOC, excluyendo al desogestrel (DSG), gestodeno (GSD) y drospirenona (DRSP), la incidencia de TEV fue de 8.5 por 10,000 WY.
• Un estudio retrospectivo de cohortes que utilizó datos de 4 planes de salud de EE.UU. ("estudio patrocinado por la FDA") mostró una incidencia de TEV para nuevas usuarias de NUVARING de 11.4 eventos por 10,000 WY y para nuevas usuarias de un AOC que contiene levonorgestrel (LNG) de 9.2 eventos por 10,000 WY.
Estimaciones (proporciones de riesgo) del riesgo de tromboembolismo venoso en usuarias de NUVARING en comparación con las usuarias de anticonceptivos orales combinados (AOCs).
|
Estudio epidemiológico (autor, año de publicación) Población estudiada |
Producto(s) comparador(es) |
Proporciones de riesgo (HR) (95% CI) |
|
TASC (Dinger, 2012). Usuarias de primera vez, incluyendo a las nuevas usuarias, a las usuarias que cambian de esquema y a los que reinician su uso |
Todos los AOC disponibles durante el curso del estudio* AOC disponibles, excluyendo DSG-, GSD-, AO que contienen DRSP |
HR1": 0.8 (0.5-1.5) HR1: 0.9 (0.4-2.0) |
|
"Estudio patrocinado por la FDA" (Sidney, 2011) Primer uso de un anticonceptivo hormonal combinado (AHC) durante el periodo del estudio |
AOC disponibles durante el curso del estudio§ LNG/0.03 mg etinilestradiol |
HR¶: 1:1.09 (0.55-2.16) HR¶: 1:0.96 (0.47-1.95) |
* Incluye dosis bajas de AOC que contienen las siguientes progestinas: acetato de clormadinona, acetato de ciproterona, desogestrel, dienogest, drospirenona, diacetato de etinodiol, gestodeno, levonorgestrel, noretindrona, norgestimato o norgestrel.
1 Ajustado por edad, IMC, duración de uso, antecedentes de TEV.
§ Incluye dosis bajas de AOC que contienen las siguientes progestinas: norgestimato, noretindrona o levonorgestrel.
¶ Ajustado por edad, sitio, año de entrada al estudio.
• Se han reportado casos extremadamente raros de trombosis en otros vasos sanguíneos, p.ej. hepáticos, mesentéricos, renales, venas y arterias retinianas o cerebrales o, en usuarias de AHC.
• Los síntomas de trombosis venosa o arterial pueden incluir: dolor y/o edema unilateral en miembros inferiores; dolor torácico severo repentino, con o sin irradiación al brazo izquierdo; disnea respiratoria repentina; tos de comienzo súbito; cualquier cefalea inusual, grave, prolongada; pérdida repentina de la visión en forma parcial o total; diplopía; lenguaje cercenado o afasia, vértigo, síncope con o sin epilepsia focal, debilidad o entumecimiento muy marcado que afecta repentinamente un lado o una parte del cuerpo, trastornos motores, abdomen agudo.
• El riesgo de tromboembolismo venoso aumenta con:
– el avance de la edad;
– antecedentes familiares positivos (es decir, un hermano o progenitor que alguna vez haya tenido tromboembolismo venoso a una edad relativamente joven). Si se sospecha predisposición hereditaria, la mujer deberá ser derivada a un especialista para asesoramiento antes de que ella tome una decisión sobre el uso de cualquier anticonceptivo hormonal;
– inmovilización prolongada, cirugía mayor, cualquier cirugía de miembros inferiores, o trauma mayor. En estos casos, se recomienda interrumpir el uso (en el caso de cirugía electiva por lo menos con cuatro semanas de anticipación) y no reanudarlo hasta dos semanas después de recuperar la movilidad por completo (ver sección de CONTRAINDICACIONES).
– obesidad (índice de masa corporal superior a 30 kg/m2)
– y posiblemente también con tromboflebitis superficial y venas varicosas. No existe consenso acerca del posible papel de estas condiciones en la etiología de la trombosis venosa.
• El riesgo de complicaciones tromboembólicas arteriales aumenta con:
– el avance de la edad;
– el tabaquismo (el riesgo es mayor cuanto mayor sea el consumo de tabaco y la edad, especialmente en mujeres mayores de 35 años);
– dislipoproteinemia;
– obesidad (índice de masa corporal superior a 30 kg/m2);
– hipertensión;
– migraña;
– cardiopatía valvular;
– fibrilación auricular;
– antecedentes familiares positivos (es decir, un hermano o progenitor que alguna vez haya tenido trombosis arterial a una edad relativamente joven). Si se sospecha predisposición hereditaria, la mujer deberá ser derivada a un especialista para asesoramiento antes de que ella tome una decisión sobre el uso de cualquier anticonceptivo hormonal.
• Los factores bioquímicos que pueden ser indicadores de predisposición hereditaria o adquirida para trombosis venosa o arterial incluyen resistencia a la Proteína C Activada (PCA), hiperhomocisteinemia, deficiencia de antitrombina III, deficiencia de proteína C, deficiencia de proteína S, anticuerpos antifosfolípidos, anticuerpos anticardiolipina, anticoagulante lúpico.
• Otras condiciones médicas que se han asociado con eventos adversos circulatorios incluyen diabetes mellitus, lupus eritematoso sistémico, síndrome urémico hemolítico, y enfermedad inflamatoria crónica intestinal (por ej., enfermedad de Crohn o colitis ulcerativa) y anemia de células falciformes.
• Debe considerarse el aumento en el riesgo de riesgo de tromboembolismo en el puerperio (Ver sección de EMBARAZO Y LACTANCIA).
• Un aumento de la frecuencia o la severidad de la migraña durante el uso de anticonceptivos hormonales (que puede ser prodrómico de un evento cerebrovascular) puede ser una razón para interrumpir de inmediato el uso de anticonceptivos hormonales.
• Se les debe recomendar a las mujeres que utilizan anticonceptivos hormonales combinados (AHC) que se pongan en contacto con su médico en caso de tener posibles síntomas de trombosis. En caso de sospecha o trombosis confirmada, debe descontinuarse el uso de AHC. Debe iniciarse el uso de un método anticonceptivo adecuado debido a la teratogenicidad de la terapia anticoagulante (cumarinas).
Tumores
• El factor de riesgo más importante para cáncer cérvico-uterino es la infección persistente por el virus del papiloma humano (HPV). Los estudios epidemiológicos han indicado que el uso de AOCs a largo plazo contribuye a este aumento del riesgo pero todavía existe incertidumbre acerca del grado en el cual este hallazgo es atribuible a efectos de confusión, como un aumento en la exploración cervical y diferencias en la conducta sexual, incluido el uso de anticonceptivos de barrera, o una asociación causal. Se desconoce la relación entre este efecto y NuvaRing.
• Un meta-análisis de 54 estudios epidemiológicos informó que existe un ligero aumento del riesgo relativo (RR = 1.24) de que se diagnostique cáncer de mama en mujeres que actualmente emplean AOCs. Este aumento del riesgo desaparece gradualmente durante el curso de los 10 años posteriores al cese del uso de AOCs. Debido a que el cáncer de mama es raro en mujeres de menos de 40 años, el aumento en el número de diagnósticos de cáncer de mama en usuarias actuales y recientes de AOCs es bajo en relación con el riesgo global de cáncer de mama. Los casos de cáncer de mama diagnosticados en usuarias de AOCs tienden a ser clínicamente menos avanzados que los diagnosticados en mujeres que nunca los utilizaron.
• En otro estudio epidemiológico de 1.8 millones de mujeres danesas seguidas durante un promedio de 10.9 años, el RR reportado de cáncer de mama entre usuarias de AOC incrementó con una mayor duración de uso, en comparación con mujeres que nunca usaron AOCs (RR global = 1.19; el RR varió de 1.17 para 1 a menos de 5 años de uso, a 1.46 después de más de 10 años de uso). La diferencia reportada en el riesgo absoluto (número de casos de cáncer de mama entre mujeres que nunca usaron AOC´s en comparación con usuarias actuales y recientes de AOC) fue pequeña: 13 por 100,000 mujeres-años.
• Los estudios epidemiológicos no brindan evidencia de causalidad. El patrón observado de incremento en el riesgo puede deberse a un diagnóstico más temprano de cáncer de mama en usuarias de AOC, a los efectos biológicos de los AOCs o a una combinación de ambos.
• En raros casos, se han observado tumores hepáticos benignos y, aún más raramente, malignos, en usuarias de AOCs. En casos aislados, estos tumores han causado hemorragias intra-abdominales con riesgo para la vida. Por lo tanto, en el diagnóstico diferencial de usuarias de NuvaRing que presentaran dolor severo en abdomen alto, hepatomegalia o signos de hemorragia intra-abdominal, se deberá considerar la existencia de un tumor hepático.
Reacciones de hipersensibilidad
• Se han reportado reacciones de hipersensibilidad de angioedema y anafilaxia durante el uso NUVARING. Si se sospecha de angioedema y/o anafilaxia, debe descontinuarse el uso de NUVARING y administrarse el tratamiento apropiado.
Hepatitis C
• Durante estudios clínicos con algunos regímenes de medicamentos combinados contra el VHC, se observaron elevaciones de ALT en mujeres que usaban medicamentos que contenían etinilestradiol. Por ejemplo; el régimen de combinación contra HCV ombitasvir/paritaprevir/ ritonavir, con y sin dasabuvir, las elevaciones en ALT mayores a 5 veces el límite superior normal (ULN) fueron significativamente más frecuentes en mujeres que utilizaban medicamentos que contenían etinilestradiol, como los AHCs. Debe descontinuarse el uso de NUVARING antes de comenzar el tratamiento con el régimen de combinación de ombitasvir/paritaprevir/ritonavir, con o sin dasabuvir (ver secciones de CONTRAINDICACIONES e INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO). Puede reiniciarse el uso de NUVARING aproximadamente 2 semanas después de haber terminado el tratamiento con el régimen de combinación.
Otras condiciones
• Las mujeres con hipertrigliceridemia o antecedentes familiares de la misma, pueden tener mayor riesgo de pancreatitis durante el uso de anticonceptivos hormonales.
• Los estrógenos exógenos pueden inducir o exacerbar los síntomas del angioedema hereditario y adquirido.
• Si bien en muchas mujeres que usan anticonceptivos hormonales se han observado pequeños aumentos de la presión arterial, rara vez estos son clínicamente relevantes. No se ha establecido una relación definitiva entre el uso de anticonceptivos hormonales y la hipertensión clínica. Sin embargo, si durante el uso de NuvaRing se presenta hipertensión clínicamente significativa de manera sostenida, es prudente que el médico suspenda el uso del anillo y trate la hipertensión. Cuando se considere apropiado, se puede reanudar el uso de NuvaRing si se logran valores normales de la presión arterial con el tratamiento antihipertensivo.
• Se ha informado la manifestación o agravamiento de las siguientes condiciones tanto durante el embarazo como durante el uso de anticonceptivos hormonales, aunque no se ha demostrado en forma concluyente una asociación con su uso: ictericia y/o prurito relacionado con colestasis; formación de cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome urémico hemolítico; corea de Sydenham; herpes gestacional; pérdida de la audición por otosclerosis.
• Las alteraciones agudas o crónicas de la función hepática pueden requerir la interrupción del uso de NUVARING hasta que los marcadores de la función hepática se normalicen. La recurrencia de ictericia colestásica y/o prurito relacionado con colestasis, que aparecieron por primera vez durante el embarazo o con el uso previo de esteroides sexuales, requiere la descontinuación del anillo.
• Si bien los estrógenos y los progestágenos pueden tener un efecto sobre la resistencia periférica a la insulina y la tolerancia a la glucosa, no se ha demostrado la necesidad de alterar el régimen terapéutico en pacientes con diabetes que utilizan anticoncepción hormonal. Sin embargo, las mujeres con diabetes que usan NUVARING deberán ser monitoreadas con cuidado, especialmente durante los primeros meses de uso.
• Con el uso de anticonceptivos hormonales se han reportado enfermedad de Crohn y colitis ulcerativa.
• Ocasionalmente, puede presentarse melasma, en especial en mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia al cloasma deberán evitar la exposición al sol o a los rayos ultravioleta durante el uso de NUVARING.
• Si una mujer padece cualquiera de las siguientes condiciones no podrá insertarse NUVARING en forma correcta o podrá, de hecho, perder el anillo: prolapso del cuello uterino, cistocele y/o rectocele, estreñimiento severo o crónico.
Muy rara vez se informó la inserción accidental de NUVARING en la uretra y que posiblemente llegue a la vejiga. Por lo tanto, en el caso de síntomas de cistitis el diagnóstico diferencial deberá considerar una ubicación incorrecta.
• Durante el uso de NUVARING, las mujeres ocasionalmente pueden experimentar vaginitis. No existen indicios de que la eficacia de NuvaRing se vea afectada por el tratamiento de la vaginitis, ni que el uso de NUVARING afecte el tratamiento de la vaginitis (Ver sección de INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
• Muy rara vez se ha informado adherencia del anillo al tejido vaginal, que requiera la extracción por parte del médico. En algunos casos cuando hubo un crecimiento de tejido vaginal por encima del anillo, se logró removerlo cortando el anillo sin hacer incisión en el tejido vaginal que lo recubría.
Examen médico/consulta médica
Antes de iniciar o reinstituir el uso de NUVARING se deberá elaborar una historia clínica completa (incluidos los antecedentes médicos familiares) y se deberá excluir la posibilidad de embarazo. La presión arterial y el examen físico deberán estar orientados por las contraindicaciones y las precauciones. Se deberá recomendar a la mujer que lea cuidadosamente el instructivo y que siga las recomendaciones proporcionadas.
La frecuencia y la naturaleza de otros controles periódicos deberán basarse en las pautas de práctica clínica establecidas y adaptadas a cada mujer.
Se deberá informar a las mujeres que NUVARING no protege contra las infecciones por HIV (SIDA) y otras enfermedades de transmisión sexual.
Disminución de la eficacia
La eficacia de NUVARING puede disminuir en el caso de incumplimiento o cuando se utilizan medicamentos concomitantes que disminuyen la concentración plasmática de etonogestrel.
Control de la reducción de los ciclos
Durante el uso de NUVARING puede producirse sangrado irregular (manchado o sangrado intercurrente). Si se producen irregularidades del sangrado después de ciclos previamente regulares durante el uso de NUVARING de acuerdo con el régimen recomendado, entonces se deberán considerar causas no hormonales, y se indica aplicar medidas diagnósticas adecuadas para excluir una malignidad o embarazo. Estas pueden incluir legrado.
Durante el periodo sin anillo, puede no presentarse sangrado por supresión en algunas mujeres. Si NUVARING ha sido utilizado de acuerdo con las instrucciones descritas es improbable que la mujer quede embarazada. Sin embargo, si NUVARING no ha sido utilizado siguiendo estas instrucciones antes de la primera falta de sangrado por supresión o si se han producido dos faltas, se debe excluir la posibilidad de embarazo antes de continuar con el uso de NUVARING.
Exposición masculina a etinilestradiol y etonogestrel
No se han estudiado el grado y el posible papel farmacológico de la exposición de las parejas sexuales masculinas al etinilestradiol y al etonogestrel a través de la absorción peneana.
Rotura del anillo
Raramente se ha informado rotura de NUVARING durante el uso (ver INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO). Debido a que el núcleo de NUVARING es sólido, su contenido se mantendrá intacto y la liberación de hormonas no se verá significativamente afectada. Se ha reportado lesión vaginal asociada con la rotura del anillo. En el caso de rotura del anillo, es probable que el mismo sea expulsado (ver DOSIS Y VÍA DE ADMINISTRACION - Qué hacer si el anillo estuvo temporalmente fuera de la vagina). En el caso de rotura de NUVARING, la mujer deberá desechar el anillo y reemplazarlo con uno nuevo.
Expulsión
Se ha informado expulsión de NUVARING, por ejemplo, si el anillo no fue insertado correctamente, al retirar un tampón, durante las relaciones sexuales, o en el caso de estreñimiento severo o crónico. Por lo tanto, es un buen hábito que la mujer verifique regularmente la presencia de NUVARING (por ejemplo, antes y después de tener relaciones sexuales). En el caso de expulsión accidental de NUVARING, la mujer deberá seguir las instrucciones proporcionadas en DOSIS Y VÍA DE ADMINISTRACIÓN, ‘Qué hacer si el anillo estuvo temporalmente fuera de la vagina’.
Efectos sobre la capacidad para conducir vehículos y operar maquinaria
Sobre la base del perfil farmacodinámico, se espera que NUVARING no influya en la capacidad para conducir vehículos y operar maquinaria.
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
Embarazo
NUVARING no está indicado durante el embarazo. En el caso de que se produzca un embarazo con NUVARING in situ, se deberá extraer el anillo. Estudios epidemiológicos extensos no revelaron un aumento del riesgo de defectos congénitos en los hijos de mujeres que usaban AOCs antes del embarazo, ni de efecto teratogénico cuando los AOCs fueron utilizados en forma inadvertida durante los primeros meses del embarazo. Si bien esto probablemente aplica a todos los AOCs, no resulta claro si también es el caso de NUVARING.
Un estudio clínico en una pequeña cantidad de mujeres demostró que, a pesar de que se administra por vía intravaginal, las concentraciones intrauterinas de los esteroides anticonceptivos de NUVARING son similares a los niveles observados en las usuarias de AOCs.
No se ha informado experiencia clínica sobre los resultados de embarazos expuestos a NUVARING.
Lactancia
Los estrógenos pueden influir en la lactancia debido a que pueden reducir la cantidad de leche materna y modificar su composición. Por consiguiente, en general no se deberá recomendar el uso de NUVARING hasta finalizar el periodo de lactancia materna. Pueden excretarse en la leche materna pequeñas cantidades de los esteroides anticonceptivos y/o sus metabolitos; sin embargo, no se ha demostrado que ello afecte de manera adversa la salud del lactante.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
Los efectos no deseados más serios asociados con el uso de anticonceptivos hormonales se listan en PRECAUCIONES GENERALES.
En la tabla siguiente se listan las reacciones adversas al fármaco que han sido informados en usuarias de NuvaRing.
Para describir un determinado evento adverso se lista el término más apropiado del MedDRA (versión 11.0).
Todas las reacciones adversas están listadas por clase de sistema orgánico y frecuencia: comunes (≥1/100 a <1/10), poco comunes (≥1/1,000 a <1/100), raras (≥1/10,000 a <1/1,000) y desconocida (no puede ser estimada de la información disponible).
|
Clasificación por sistema/órgano |
Comunes |
Poco comunes |
Raro 1/10000 |
Desconocido1 |
|
Infecciones e infestaciones |
Infección vaginal |
Cervicitis, cistitis, infección de las vías urinarias |
||
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad, incluyendo angioedema y anafilaxia. |
|||
|
Trastornos metabólicos y nutricionales |
Aumento del apetito |
|||
|
Trastornos psiquiátricos |
Depresión, libido disminuida |
Alteración del estado de ánimo |
||
|
Trastornos del sistema nervioso |
Cefalea, migraña |
Mareos, Hipoestesia |
||
|
Trastornos oculares |
Alteración de la visión |
|||
|
Trastornos vasculares |
Bochornos |
Tromboembolia venosa3, tromboembolia arterial3 |
||
|
Trastornos gastrointestinales |
Dolor abdominal, náusea |
Distensión abdominal, diarrea, vómito, estreñimiento |
||
|
Trastornos de la piel y del tejido subcutáneo |
Acné |
Alopecia, eczema, prurito, erupción |
Exacerbaciones de angioedema hereditario y adquirido Urticaria. |
|
|
Trastornos Musculoesqueléticos y del tejido conjuntivo |
Dolor de espalda, calambres, dolor en extremidades |
|||
|
Trastornos renales y urinarios |
Disuria, urgencia para orinar, polaquiuria |
|||
|
Trastornos del aparato reproductor y las mamas |
Hiperestesia mamaria, prurito en los genitales femeninos, dismenorrea, dolor pélvico, secreción vaginal |
Amenorrea, molestia en las mamas, agrandamiento de las mamas, nódulo en las mamas, pólipo cervical, sangrado durante el coito, dispareunia, ectropión del cuello uterino, enfermedad fibroquística de la mama, menorragia, metrorragia, molestia pélvica, síndrome premenstrual, espasmo uterino, sensación de ardor vaginal, olor vaginal, dolor vaginal, molestia vulvovaginal, resequedad vulvovaginal |
Trastornos del pene2 Galactorrea. |
|
|
Trastornos generales y condiciones en el sitio de administración |
Fatiga, irritabilidad, malestar, edema, sensación de cuerpo extraño |
|||
|
Estudios complementarios |
Incremento del peso |
Aumento de la presión arterial |
||
|
Lesión, intoxicación y complicaciones por el procedimiento |
molestia causada por el dispositivo médico, expulsión del dispositivo anticonceptivo vaginal |
Complicación del dispositivo anticonceptivo, rotura del dispositivo |
Lesión vaginal asociada con la rotura del anillo |
1) Listado de eventos adversos basados en el reporte espontáneo. No es posible determinar la frecuencia exacta.
2) “Trastornos del pene” incluyen reportes de “reacciones locales en el pene”.
3) Incidencia en estudios observacionales de cohortes de >1/10,000 a <1/1,000 mujeres-años.
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Nota: Se deberá consultar la información para prescribir de los medicamentos concomitantes para identificar posibles interacciones.
Las interacciones entre anticonceptivos hormonales y otros productos medicinales pueden dar lugar a hemorragia intercurrente y/o falla anticonceptiva. Se han comunicado las siguientes interacciones en la literatura.
Metabolismo hepático: pueden producirse interacciones con productos medicinales o herbolarios que inducen enzimas microsomales, específicamente enzimas del citocromo P450 (CYP), lo cual puede dar como resultado un aumento de la depuración, reduciendo las concentraciones plasmáticas de las hormonas sexuales y puede disminuir la efectividad de los anticonceptivos hormonales combinados, incluyendo NUVARING. Estos productos incluyen fenitoína, fenobarbital, primidona, bosentan, carbamazepina, rifampicina, y posiblemente también oxcarbazepina, topiramato, felbamato, griseofulvina, algunos inhibidores de proteasa del HIV (p.ej. ritonavir) e inhibidores no nucleósidos de transcriptasa reversa (p.ej., efavirenz) y productos que contienen el remedio herbolario hierba de San Juan.
La inducción enzimática puede ocurrir después de algunos días de tratamiento. La inducción enzimática máxima se observa generalmente en el lapso de algunas semanas. Después de que se descontinúa el tratamiento, la inducción enzimática puede durar alrededor de 28 días.
Cuando se administran de forma concomitante con anticonceptivos hormonales, muchas combinaciones de inhibidores de proteasa del HIV (p.ej., nelfinavir) e inhibidores no nucleósidos de transcriptasa reversa (p.ej., nevirapina) y/o combinaciones con medicamentos contra el virus de Hepatitis C (HCV) (p.ej., boceprevir, telaprevir), pueden incrementar o disminuir las concentraciones plasmáticas de progestinas, incluyendo etonogestrel, o de estrógeno. El efecto neto de estos cambios puede ser clínicamente importante en algunos casos.
Las mujeres que reciben alguno de los medicamentos o productos herbolarios inductores de enzimas hepáticas mencionados arriba, deberán ser advertidas de que la eficacia de NUVARING puede verse reducida. Se deberá utilizar temporalmente un método anticonceptivo de barrera además de NUVARING durante la administración concomitante del medicamento inductor de enzimas hepáticas y durante 28 días después de la descontinuación del medicamento inductor de enzimas hepáticas. Nota: NUVARING no debe ser utilizado con un diafragma, capuchón cervical o un condón femenino.
Si la administración concomitante del fármaco se extiende más allá de las 3 semanas de un ciclo con anillo, se debe insertar el siguiente anillo de inmediato sin dejar el periodo habitual sin uso del anillo.
Para las mujeres con tratamiento a largo plazo con medicamentos inductores enzimáticos, deberá considerarse un método anticonceptivo alternativo, que no se vea afectado por el medicamento inductor enzimático.
En un estudio de interacción farmacocinética, la administración oral de amoxicilina (875 mg, dos veces al día) o doxiciclina (200 mg el día 1, seguidos por 100 mg diarios) durante 10 días con el uso de NUVARING, no afectó significativamente la farmacocinética del etonogestrel y el etinilestradiol (EE). No se han evaluado los efectos de otros antibióticos sobre las concentraciones de etonogestrel o etinilestradiol.
La administración concomitante de inhibidores potentes (p.ej., ketoconazol, itraconazol, claritromicina) o moderados (p.ej., fluconazol, diltiazem, eritromicina) de CYP3A4 puede incrementar las concentraciones séricas de estrógenos o progestinas, incluyendo etonogestrel.
Ha habido reportes de rotura del anillo durante el uso concomitante de preparados intravaginales, incluyendo antimicóticos, antibióticos y productos lubricantes (ver Precauciones Generales “Rotura del anillo”). Sobre la base de la información farmacocinética, es improbable que la administración vaginal de antimicóticos y espermicidas afecte la eficacia anticonceptiva y la seguridad de NUVARING.
Los anticonceptivos hormonales pueden interferir con el metabolismo de otros fármacos. Por consiguiente, las concentraciones plasmáticas y tisulares pueden ya sea aumentar (por ej., ciclosporina) o disminuir (por ej., lamotrigina).
Durante los ensayos clínicos con el régimen de combinación de medicamentos contra el VHC ombitasvir/paritaprevir/ritonavir con y sin dasabuvir, las elevaciones de ALT superiores a 5 veces el límite superior normal (LSN) fueron significativamente más frecuentes en mujeres que usaban medicamentos que contenían etinilestradiol, como los AHC. NUVARING debe suspenderse antes de comenzar la terapia con el régimen de combinación de medicamentos ombitasvir/paritaprevir/ritonavir con o sin dasabuvir (consulte las secciones CONTRAINDICACIONES y PRECAUCIONES GENERALES). NUVARING se puede reiniciar aproximadamente 2 semanas después de completar el tratamiento con el régimen de combinación de medicamentos.
El uso concomitante con otros medicamentos antivirales contra el VHC, como los que contienen glecaprevir/pibrentasvir, puede aumentar el riesgo de elevaciones de ALT.
Interacción con tampones
La información de farmacocinética demuestra que el uso de tampones no afecta la absorción sistémica de las hormonas liberadas por NUVARING. En raras ocasiones NUVARING podría ser expulsado al retirar un tampón (ver DOSIS Y VÍA DE ADMINISTRACIÓN - “Qué hacer si el anillo estuvo temporalmente fuera de la vagina”).
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
El uso de esteroides anticonceptivos puede incidir en los resultados de determinadas pruebas de laboratorio, incluyendo los parámetros bioquímicos de las funciones hepática, tiroidea, suprarrenal y renal, los niveles plasmáticos de proteínas transportadoras (por ej. globulina fijadora de corticosteroides y globulina fijadora de hormonas sexuales), fracciones lipídicas/lipoproteicas, parámetros del metabolismo de carbohidratos y parámetros de la coagulación y fibrinólisis. En general, los cambios permanecen dentro del rango de valores de laboratorio normales.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
Vía de administración: Vaginal.
¿Cómo usar NUVARING?
NUVARING puede ser insertado en la vagina por la misma mujer. El médico deberá aconsejar a la mujer sobre cómo insertar y extraer NUVARING. La mujer deberá elegir la posición que le sea más cómoda para su inserción, por ejemplo, de pie con una pierna ligeramente elevada, en cuclillas o recostada. Deberá comprimir el anillo NUVARING e insertarlo en la vagina hasta que lo sienta cómodo. Una alternativa opcional es utilizar el Aplicador de NUVARING para insertar el anillo. La posición exacta de NUVARING en la vagina no es decisiva para el efecto anticonceptivo del anillo (ver Figuras 1-4).
Una vez que NUVARING haya sido insertado (ver “Cómo iniciar el uso de NUVARING”), se deja en la vagina en forma continua durante 3 semanas. Aconseje a la mujer que verifique regularmente la presencia de NUVARING en su vagina (por ejemplo, antes y después de tener relaciones sexuales). Si NUVARING es expulsado accidentalmente la mujer deberá seguir las instrucciones proporcionadas en el punto ‘Qué hacer si el anillo estuvo temporalmente fuera de la vagina’ (para más información, ver también el Punto ‘Expulsión’).
NUVARING debe ser extraído después de 3 semanas de uso, el mismo día de la semana en el que el anillo fue insertado. Después de un periodo de una semana sin usar el anillo, se inserta otro anillo (por ejemplo, si NUVARING se inserta un miércoles alrededor de las 22 horas, el anillo deberá ser extraído también un miércoles, 3 semanas después, aproximadamente a las 22 horas. El miércoles siguiente se deberá insertar un nuevo anillo).NUVARING puede ser extraído enganchando el anillo con el dedo índice o sujetando el anillo entre los dedos índices y medio y tirando del mismo (Figura 5). El anillo usado deberá ser colocado en el sobre (mantener fuera del alcance de los niños y mascotas) y ser desechado como se describe más adelante en Precauciones especiales para el desecho y otra manipulación, en esta sección. El sangrado por supresión usualmente comienza dos a tres días después de la extracción de NUVARING y puede no haber finalizado completamente antes de insertar el siguiente anillo.
Uso con otros productos vaginales
NUVARING puede interferir con la correcta colocación y posición de ciertos métodos anticonceptivos femeninos de barrera tales como el diafragma, el capuchón cervical o el condón femenino. Estos métodos no deben usarse como métodos de refuerzo junto con NUVARING.
|
|
|
|
Figura 1. retirar NUVARING del sobre. |
Figura 2. comprimir el anillo. |
|
|
|
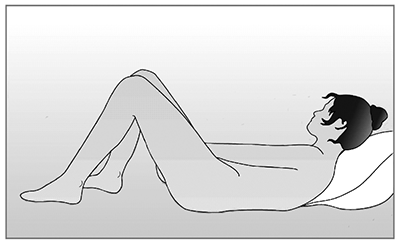
Figura 3.
Elegir una posición cómoda para insertar el anillo.
|
|
|
|
Figura 4A. |
Figura 4B. |
|
|
|
|
Figura 4C. |
|
Insertar el anillo en la vagina con una mano (Figura 4A). Si es necesario, se pueden separar los labios con la otra mano. Empujar el anillo hacia el interior de la vagina hasta que lo sienta cómodo (Figura 4B). Dejar el anillo insertado durante 3 semanas (Figura 4C).
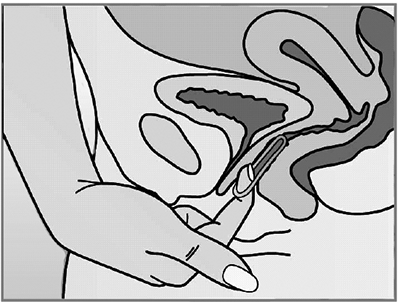
Figura 5. NUVARING puede ser extraído enganchando con el dedo índice o sujetando el anillo entre los dedos Índice y medio y tirando del mismo.
Cómo iniciar el uso de NUVARING
Sin uso de anticonceptivo hormonal en el ciclo precedente
NUVARING debe ser insertado el primer día del ciclo natural de la mujer (es decir, el primer día de la menstruación). Se puede comenzar los días 2-5, pero durante el primer ciclo se recomienda el uso adicional de un método de barrera durante los primeros 7 días de uso de NUVARING.
Cambio de un anticonceptivo hormonal combinado
La mujer deberá insertar NUVARING como máximo al día siguiente del intervalo usual sin comprimidos, sin parche o con placebo del anticonceptivo hormonal combinado anterior.
Si la mujer utilizó su método anterior de manera sistemática y correcta y está razonablemente segura de que no está embarazada, también puede cambiar de su anticonceptivo hormonal combinado anterior cualquier día del ciclo.
El intervalo sin uso de hormonas del método anterior nunca deberá prolongarse más allá del tiempo recomendado.
Cambio de un método con progestágeno solo (minipíldora, implante o inyección) o de un sistema intrauterino con liberación de progestágeno (SIU)
La mujer puede cambiar cualquier día si toma la minipíldora (de un implante o SIU deberá cambiar el día de su extracción y de un inyectable, cuando se debería aplicar la siguiente inyección) pero en todos estos casos, deberá utilizar un método de barrera adicional durante los primeros 7 días de uso de NUVARING.
Después de un aborto en el primer trimestre
La mujer puede empezar inmediatamente. En este caso, no es necesario tomar medidas anticonceptivas adicionales. Si se considera que un cambio inmediato no es aconsejable, la mujer deberá seguir las recomendaciones proporcionadas en el punto "sin uso de anticonceptivo hormonal en el ciclo precedente". Mientras tanto, se le deberá recomendar el uso de un método anticonceptivo alternativo.
Posterior al parto o de un aborto en el segundo trimestre
En el caso de mujeres que amamantan, ver el punto RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA. Se deberá recomendar a las mujeres que comiencen durante la cuarta semana posterior al parto o a un aborto en el segundo trimestre. Si se empieza más tarde, se deberá recomendar a la mujer que use un método de barrera adicional durante los primeros 7 días del uso de NUVARING. Sin embargo, si ya ha tenido relaciones sexuales, deberá excluirse la posibilidad de embarazo o la mujer deberá esperar hasta su primer periodo menstrual, antes de comenzar a usar NUVARING.
Deberá considerarse el incremento en el riesgo de TEV durante el periodo post-parto, al reiniciar el uso de NUVARING (ver sección PRECAUCIONES GENERALES).
Desviaciones del régimen recomendado
La eficacia anticonceptiva y el control del ciclo pueden verse comprometidos si la mujer se desvía del régimen recomendado. Para evitar la pérdida de la eficacia anticonceptiva en el caso de desviación, se puede recomendar lo siguiente:
• Qué hacer en el caso de un intervalo prolongado sin uso del anillo
La mujer deberá insertarse un nuevo anillo apenas lo recuerde. Además, durante los 7 días siguientes deberá utilizar un método de barrera, como por ejemplo un condón masculino. Si ha mantenido relaciones sexuales durante el intervalo sin uso del anillo, se deberá considerar la posibilidad de un embarazo. Cuanto mayor sea el intervalo sin uso del anillo, mayor es el riesgo de embarazo.
• Qué hacer si el anillo estuvo temporalmente fuera de la vagina
NUVARING deberá permanecer en la vagina en forma continua durante un periodo de 3 semanas. Si el anillo es expulsado accidentalmente, se puede enjuagar con agua fría o tibia (no caliente) y reinsertar de inmediato.
Si NUVARING estuvo fuera de la vagina durante menos de 3 horas, no disminuye la eficacia anticonceptiva. La mujer deberá volver a insertar el anillo cuanto antes, pero antes de las 3 horas.
Si NUVARING ha estado fuera de la vagina o se sospecha que estuvo fuera de la vagina durante más de 3 horas en la primera o la segunda semana de uso, la eficacia anticonceptiva puede disminuir. La mujer deberá volver a insertar el anillo apenas lo recuerde. Se deberá utilizar un método de barrera, como por ejemplo un condón, masculino, hasta que NUVARING haya permanecido en la vagina en forma continua durante 7 días. Cuanto mayor sea el tiempo que NUVARING haya estado fuera de la vagina y cuanto más cerca esté del intervalo sin uso del anillo, mayor es el riesgo de embarazo.
Si NUVARING ha estado fuera de la vagina, o se sospecha que estuvo fuera de la vagina por más de 3 horas durante la tercera semana del periodo de uso de tres semanas, la eficacia anticonceptiva puede disminuir. La mujer deberá desechar ese anillo y elegir una de las siguientes dos opciones:
1. insertar un nuevo anillo inmediatamente
Nota: la inserción de un nuevo anillo dará inicio al siguiente periodo de uso de 3 semanas. La mujer puede no experimentar sangrado por supresión del ciclo anterior. Sin embargo, puede ocurrir manchado o sangrado intercurrente.
2. Tener sangrado por supresión e insertar un nuevo anillo en un lapso no superior a 7 días después (7x24 horas) de la extracción o la expulsión del anillo anterior.
Nota: sólo se deberá elegir esta opción si el anillo fue utilizado en forma continua durante los 7 días precedentes.
Si NUVARING estuvo fuera de la vagina por una cantidad de tiempo desconocida, debe considerarse la posibilidad de que haya un embarazo. Deberá realizarse una prueba de embarazo antes de insertar un nuevo anillo.
• Qué hacer en caso de prolongación del periodo de uso del anillo
Siempre y cuando NUVARING haya sido utilizado durante 4 semanas como máximo, la eficacia anticonceptiva continúa siendo adecuada. La mujer puede mantener su intervalo de una semana sin uso del anillo y posteriormente insertar uno nuevo. Si NUVARING ha estado colocado durante más de 4 semanas, la eficacia anticonceptiva puede disminuir y se deberá excluir la posibilidad de embarazo antes de insertar un nuevo NUVARING.
Si la mujer no ha cumplido con el régimen recomendado y posteriormente no se presenta hemorragia por supresión en el siguiente intervalo sin uso del anillo, se deberá excluir la posibilidad de embarazo antes de insertar un nuevo NUVARING.
Cómo cambiar periodos o retrasar un periodo
Para retrasar un periodo, la mujer puede insertar un nuevo anillo sin dejar un intervalo de descanso. Nuevamente, el siguiente anillo puede ser utilizado hasta 3 semanas. La mujer puede experimentar sangrado o manchado. A continuación, se reanuda el uso habitual de NUVARING después del intervalo usual sin uso del anillo.
Para cambiar su periodo a otro día de la semana diferente al que la mujer está habituada con su esquema actual, se le puede recomendar que acorte el siguiente intervalo sin anillo cuantos días desee. Cuanto más corto sea el intervalo sin anillo, mayor será el riesgo de no tener sangrado por supresión y experimentar sangrado intercurrente y manchado durante el uso del siguiente anillo.
Precauciones especiales para el desecho y otro tipo de manipulación.
El dispensador debe indicar la fecha de uso en el empaque. NUVARING debe ser insertado no más de 4 meses después de la fecha de uso o de la fecha de caducidad, lo que suceda primero.
Después de su extracción, NUVARINGdeberá ser colocado nuevamente en el sobre resellable y eliminado en el cesto de basura común para evitar el contacto accidental. NUVARING no deberá ser arrojado al inodoro.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
No se han informado efectos nocivos graves luego de una sobredosis de anticonceptivos hormonales.
Los síntomas que pueden presentarse en este caso son: náusea, vómito y, en jovencitas, hemorragia vaginal leve. No existen antídotos y el tratamiento deberá ser sintomático.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
La información pre-clínica con etonogestrel y etinilestradiol no reveló un riesgo especial para los seres humanos de acuerdo con los estudios convencionales de seguridad farmacológica, toxicidad de dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad reproductiva, además de los ya conocidos para el hombre. Sin embargo, se deberá tener en mente que los esteroides sexuales pueden promover el crecimiento de ciertos tejidos y tumores hormono-dependientes.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
Schering-Plough, S.A. de C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan,
C.P. 16090, Xochimilco,
Ciudad de México, México.
XV. PRESENTACIÓN
NUVARING está disponible en las siguientes presentaciones:
• Caja de cartón con 1 anillo vaginal (11.7 mg / 2.7 mg) en sobre e instructivo anexo.
• Caja de cartón con 1 anillo vaginal (11.7 mg / 2.7 mg) en sobre y 1 aplicador para anillo vaginal e instructivo anexo.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Antes de la dispensación de NUVARING:
Consérvese en refrigeración entre 2°C y 8°C en el envase original por no más de 40 meses. No se congele.
Al momento de la dispensación:
No se debe utilizar NUVARING si han transcurrido más de 4 meses desde su dispensación.
Después de la dispensación:
Consérvese a no más de 30°C por 4 meses.
No se debe utilizar NUVARING después de la fecha de caducidad mostrada en la caja y en el sobre.
No se debe utilizar NUVARING si se observa un cambio en el color del anillo o cualquier signo visible de deterioro.
XVII. LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para Profesionales de la Salud.
Su venta requiere receta médica.
No se deje al alcance de los niños.
No se use en el embarazo ni lactancia.
Léase instructivo anexo.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
dpoc.mexico@organon.com