
OPTOCEF
CEFALEXINA MONOHIDRATADA
Cápsulas
1 Caja , 1 Envase(s) de burbuja , 15 Cápsulas , 500 Miligramos
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada CÁPSULA contiene:
|
Monohidrato de cefalexina |
500 mg |
|
Excipiente, c.b.p. 1 cápsula. |
|
La cefalexina es un antibiótico análogo semisintético de la cefalosporina C perteneciente a la familia de los ß-lactámicos y del grupo de las cefalosporinas llamadas de primera generación. Es un activo antibiótico bactericida contra un amplio rango de bacterias grampositivas y gramnegativas. Su fórmula molecular es C16H17N3O4S. H2O.
INDICACIONES TERAPÉUTICAS: Las pruebas de susceptibilidad in vitro indican que cefalexina es altamente activa contra los estreptococos ß-hemolíticos del grupo A y contra S. aureus, ambas cepas resistentes a la penicilina.
La cefalexina es efectiva en el manejo de infecciones, ya sea como agente primario, como sustituto de penicilinas u otros agentes antimicrobianos, o en aquellos pacientes en los que se decida la terapia secuencial y el espectro antimicrobiano sea similar al del medicamento intravenoso. La decisión final será del médico tratante.
OPTOCEF® está indicado en las siguientes patologías:
Aparato respiratorio: Bronquitis aguda y crónica, bronquiectasias con infecciones agregadas causadas por gérmenes susceptibles. Otitis media, mastoiditis, sinusitis, amigdalitis, faringitis.
Vías urinarias: Pielonefritis aguda y crónica, cistitis, prostatitis, gonorrea (si no es posible el tratamiento con penicilinas) y como profiláctico en infecciones recurrentes de las vías urinarias.
Infecciones ginecológicas y obstétricas.
Infecciones óseas, de piel y tejidos blandos.
Asimismo, OPTOCEF® es útil en infecciones odontológicas y en la profilaxis de pacientes cardiópatas sujetos a procedimientos dentales o a prostatectomía.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética:
Absorción: La cefalexina no se absorbe en el estómago, y no es destruida por los ácidos gástricos; pero se absorbe total y rápidamente en el tercio proximal del intestino delgado.
Las concentraciones séricas máximas posteriores a la ingesta oral de cefalexina a dosis únicas en sujetos en ayuno, se presentan una hora después y persisten durante 4 a 6 horas.
Las concentraciones alcanzadas 1 hora después de la ingesta oral única en sujetos en ayuno es de 14.5 µg/ml, mientras que en pacientes con ingesta alimentaria es de ~10.3 µg/ml, indicando que la absorción se retrasa, pero se logran concentraciones séricas equivalentes en el tiempo con ABC también equivalentes.
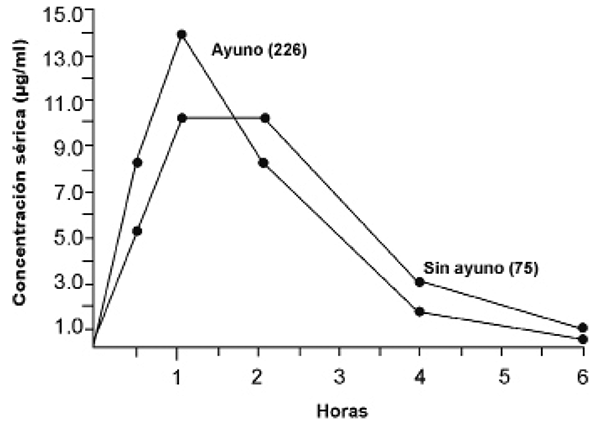
Sin embargo, la cantidad total que se absorbe del medicamento, no se considera modificada por la ingesta de alimentos, sino únicamente se retrasa. Cuando se administra oralmente en ayuno, la concentración sérica máxima se alcanza en una hora. Cuando se administra con los alimentos o leche, la absorción se demora y la concentración sérica máxima se alcanza a las 2 horas. Con concentraciones séricas máximas promedios de cefalexina de 7, 14 y 28 µg/ml para las dosis de 250, 500 mg y 1 g respectivamente. En contraste, en sujetos en ayuno estas mismas dosis dieron como resultado concentraciones séricas máximas promedio de 9, 18 y 32 µg/ml respectivamente.
La absorción no es afectada por enfermedad celíaca, gastrectomía parcial, aclorhidria o diverticulosis.
Una comparación de concentraciones séricas en niños demostró que las cápsulas ingeridas a la par con el alimento demoraron el inicio de la absorción con una concentración sérica máxima menor y una duración más prologada de los niveles séricos, que en niños en ayuno a quienes se les administró cefalexina como suspensión oral; sin embargo, los niveles séricos de cefalexina obtenidos no generaron diferencias significativas como para garantizar la alteración en la recomendación de dosis.
Los estudios han demostrado que cefalexina se absorbe bien después de la administración oral en mujeres embarazadas. La cefalexina atraviesa la placenta y se encuentra en el líquido amniótico y en la circulación fetal en concentraciones que serían efectivas contra aquellas bacterias frecuentemente implicadas en la corioamnioitis asociada con la ruptura prematura de membranas.
Se ha relacionado la administración simultánea de alcohol y cefalexina con la disminución de la absorción del antibiótico. El nifedipino aumentó aproximadamente 2 veces el nivel de cefalexina en plasma portal y aumentó la excreción urinaria. La perfusión de altas concentraciones de dipéptidos en el lúmen del yeyuno redujo competitivamente la absorción de cefalexina.
Distribución: La cefalexina no alcanza concentraciones intracelulares; sin embargo, se difunde a los líquidos corporales y a casi todos los órganos dando concentraciones útiles en bilis, líquido sinovial y humor acuoso, líquido pericárdico, pleural y peritoneal; esputo y orina; se distribuye a hueso, miocardio, piel y tejidos blandos, y vesícula biliar.
La cefalexina se encuentra en la leche materna a concentraciones máximas de 0.5 a 5 µg/ml de leche. Estas concentraciones son terapéuticas contra los patógenos asociados con mastitis en las madres lactando. Sin embargo, la concentración de cefalexina en la leche materna no es suficiente para tratar infecciones en el lactante.
El volumen de distribución del compartimiento central (Vc) de cefalexina es de aproximadamente 11 L. Se distribuye ampliamente en plasma y en líquido extracelular en menor cantidad. El volumen del compartimiento tisular es de aproximadamente 8 L. Esto da un volumen total de distribución de aproximadamente 19 L.
Metabolismo: La cefalexina no es metabolizada en el organismo y tiene baja afinidad por las proteínas plasmáticas (6 a 15%).
Excreción: El rango de valores de la vida media de la cefalexina, después de la administración oral fue de 0.7-1.2 horas, con un valor promedio de 0.9 ± 0.2 horas, que no es diferente del obtenido con la administración intravenosa.
El antibiótico se elimina por vía renal, sin alteraciones, alcanzando concentraciones urinarias de 500 a 1,000 µg/ml de orina después de la administración oral a dosis de 250 a 500 mg de cefalexina; las dosis más altas producen proporcionalmente concentraciones en orina más altas.
Aproximadamente 60-90% de la dosis administrada aparece sin cambio en la orina durante las primeras dos horas y de 80-100% se recupera en un lapso de 6-8 horas después de la dosis.
El fármaco puede eliminarse por hemodiálisis o por diálisis peritoneal.
Con falla renal, como todos los ß-lactámicos deben hacerse los ajustes de dosis necesarios, puesto que un aumento progresivo y acumulación puede originar reacciones adversas serias. El método más confiable para corroborar el estado del riñón es la depuración de creatinina. Con base a resultados de ésta se deberán hacer los ajustes necesarios de dosificación e intervalos.
Farmacodinamia: La cefalexina ha demostrado ser activa in vitro contra cepas de diferentes microorganismos.
Aerobios grampositivos:
|
Organismo |
CIM* (µg/ml) promedio |
||
|
Rango |
50% |
90% |
|
|
Staphylococcus aureus |
0.8-12.5 |
3.1 |
12.5 |
|
Staphylococcus epidermidis |
0.1 > 100 |
1.6 |
12.5 |
|
Streptococcus pyogenes |
0.2-0.8 |
0.2 |
0.8 |
|
Streptococcus agalactiae |
1.6-6.3 |
1.6 |
3.1 |
|
Streptococcus bovis |
1.6 > 100 |
1.6 |
100 |
|
Streptococcus pneumoniae |
0.8-6.3 |
0.8 |
3.1 |
|
Estreptococos del grupo viridans |
0.1 > 100 |
1.6 |
25 |
|
Listeria monocytogenes |
3.1 > 100 |
||
|
Corynebacterium JK |
> 100 |
||
Aerobios gramnegativos:
|
Organismo |
CIM* (µg/ml) promedio |
||
|
Rango |
50% |
90% |
|
|
Acinetobacter antitratus |
> 100 |
> 100 |
> 100 |
|
Acinetobacter lwoffii |
> 100 |
> 100 |
> 100 |
|
Aeromonas hydrophila |
> 100 |
||
|
Bordetella bronchiseptica |
> 100 |
||
|
Moraxella catarrhalis |
3.1-6.3 |
3.1 |
6.3 |
|
Campylobacter jejuni |
> 25 |
> 25 |
> 25 |
|
Citrobacter diversus |
3.1 > 100 |
3.1 |
50 |
|
Citrobacter freundii |
> 100 |
> 100 |
> 100 |
|
Enterobacter aerogenes |
> 100 |
> 100 |
> 100 |
|
Enterobacter agglomerans |
6.3 > 100 |
||
|
Enterobacter cloacae |
> 100 |
> 100 |
> 100 |
|
Enterobacter hafniae |
> 100 |
||
|
Escherichia coli |
6.3 > 100 |
6.3 |
50 |
|
Haemophilus influenzae |
0.8-25 |
6.3 |
12.5 |
|
Kleibsiella oxytoca |
3.1-100 |
3.1 |
100 |
|
Kleibsiella pneumoniae |
3.1 > 100 |
3.1 |
12.5 |
|
Morganella morganii |
100 > 100 |
> 100 |
> 100 |
|
Neisseria gonorrhoeae |
0.8-12.5 |
6.3 |
12.5 |
|
Proteus mirabilis |
12.5 > 100 |
12.5 |
50 |
|
Proteus vulgaris |
12.5 > 100 |
100 |
> 100 |
|
Providencia rettgeri |
100 > 100 |
> 100 |
> 100 |
|
Providencia stuartii |
2.5 > 100 |
100 |
> 100 |
|
Burkholderia cepacia |
> 100 |
> 100 |
> 100 |
|
Stenotrophomonas maltophilia |
> 100 |
||
|
Salmonella sp. |
6.3-25 |
6.3 |
25 |
|
Serratia liquefaciens |
> 100 |
||
|
Serratia marcescens |
> 100 |
> 100 |
> 100 |
|
Shigella sp. |
3.1-12.5 |
6.3 |
12.5 |
|
Yersinia enterocolitica |
3.1 > 100 |
12.5 |
> 100 |
Anaerobios:
|
Organismo |
CIM* (µg/ml) promedio |
|
Peptococcus asaccharolyticus Z-1003 |
0.78 |
|
P. prevotii ATCC 9321 |
1.56 |
|
P. magnus ATCC 14955 |
3.13 |
|
P. magnus ATCC 14956 |
0.78 |
|
Propionibacterium acnes ATCC 11828 |
3.13 |
|
Peptostreptococcus productus ATCC 27340 |
12.5 |
|
Eubacterium lentum H-1 |
1.56 |
|
E. limosum ATCC 8486 |
6.25 |
|
Clostridum perfringes SAKAI |
12.5 |
|
C. tetani FP390 |
1.56 |
|
C. difficile FP743 |
50 |
|
Veillonella alcalescens H-3 |
0.39 |
|
V. párvula ATCC 10790 |
0.39 |
|
Fusobacterium necrophorum W-12 |
1.56 |
|
F. nucleatum B-1 |
0.78 |
|
F. varium ATCC 5801 |
100 |
|
F. mortiferum H-14 |
> 100 |
|
F. russii ATCC 25533 |
1.56 |
|
Bacteroides fragilis ATCC 25285 |
> 100 |
|
B. fragilis FP404 |
3.13 |
|
B. distasonis KV 0450 |
50 |
|
B. vulgatus W-6 |
25 |
|
B. thetaiotaomicron núm. 11 |
100 |
|
B. melaninogenicus ss |
0.05 |
|
B. asaccharolytics Rm-1 |
0.78 |
|
B. praeacutus ATCC 25539 |
0.78 |
* CIM = Concentración inhibitoria mínima.
CONTRAINDICACIONES: OPTOCEF® por ser miembro del grupo de ß-lactámicos, puede presentar reacciones de hipersensibilidad cruzada con penicilinas (3-5%).
Debe evitarse si hay alguna reacción de hipersensibilidad o alergia conocida o sospechada con cefalosporinas, y queda a criterio del médico y bajo su responsabilidad la prescripción de OPTOCEF® si existen antecedentes conocidos o sospechados de reacción alérgica a penicilinas.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: En el caso específico de la cefalexina, una vez absorbida por vía oral, cruza rápidamente la placenta. Los niveles en sangre del cordón después de la ingesta materna son de alrededor de un tercio de la concentración sanguínea materna, alcanza concentraciones en líquido amniótico, suero y orina fetal.
Los estudios farmacocinéticos muestran un comportamiento similar a las penicilinas durante el embarazo donde a una misma dosis, las concentraciones sanguíneas y la vida media son menores y el volumen de distribución es mayor en relación con la mujer no embarazada.
No se ha encontrado asociación entre el uso de cefalexina y anormalidades congénitas.
Aunque los estudios clínicos y de laboratorio no han mostrado evidencia de teratogenicidad, debe tenerse precaución al prescribir este medicamento a una paciente embarazada.
La cefalexina parece ser segura para su administración durante el periodo de lactancia, ya que en la leche materna sólo se excretan concentraciones máximas de 0.5 a 5 µg/ml, 4 horas después de una dosis oral de 500 mg a 1 g.
Sin embargo, existe la posibilidad de que el fármaco pueda interferir con la flora normal intestinal del neonato, producir efectos directos, o interferir en la interpretación de los cultivos. No se han reportado efectos adversos en lactantes que toman leche de madres a las que se les administra el medicamento. Se debe tener precaución cuando se administre la cefalexina a una mujer en periodo de lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS: La diarrea es el efecto secundario más frecuente; sin embargo, sólo en 0.5% fue lo suficientemente grave para requerir la suspensión del tratamiento.
Los eventos adversos de mayor frecuencia son:
Diarrea 2.5%.
Náuseas con o sin vómito 1.4%.
Erupción 0.8%.
Vómito 0.5%.
Como reacciones no deseables leves, reportadas en < 0.05% de los pacientes, se encuentran las siguientes:
Piel:
Prurito genital 0.23%.
Prurito anal 0.17%.
Moniliasis genital 0.29%.
Intertrigo 0.11%.
Moniliasis:
Moniliasis intestinal 0.23%.
Vaginitis 0.17%.
Vulvovaginitis 0.17%.
Gastrointestinales:
Pancreatitis 0.05%.
Anorexia 0.11%.
Dispepsia 0.29%.
Flatulencia 0.05%.
Erupción 0.05%.
Dolor abdominal 0.29%.
Sistema nervioso central:
Vértigo 0.23%.
Fatiga 0.11%.
Cefalea 0.23%.
Diplopía 0.05%.
Marcha atáxica 0.05%.
Varios:
Fiebre 0.05%.
Alopecia 0.05%.
Agudización de vena varicosa 0.05%.
Como con otros antibióticos, la colitis pseudomembranosa ha sido reportada anecdóticamente por el uso de cefalexina; sin embargo, no existen reportes de frecuencia.
La enfermedad renal preexistente no es agravada por la administración de cefalexina.
Existen reportes de casos aislados de ámpulas diseminadas, lesiones cutáneas encostradas y ulceración de la mucosa, así como síndrome de Stevens-Johnson.
Sistema hemático y linfático: Se ha reportado eosinofilia, neutropenia, trombocitopenia y anemia hemolítica.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No hay datos publicados que demuestren presencia de teratogénesis, mutagénesis o carcinogénesis relacionada con el uso de cefalexina tanto en animales de experimentación como en humanos.
Con relación a los efectos de la cefalexina sobre la reproducción en animales, los estudios efectuados hasta el momento se reportan como negativos.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Se demostró el efecto del quinapril (un inhibidor de la ECA), sobre la cinética de la cefalexina. El análisis no compartamental de los datos reveló que no hay interacción significativa alguna cuando la cefalexina se administró por vía parenteral, mientras que cuando ambos compuestos se administraron por vía oral sí se encontró interacción.
El análisis indica que cuando se administran ambos medicamentos por la vía oral, quinapril reduce la depuración de cefalexina. La interacción de quinapril en la eliminación y la absorción de la cefalexina, no predetermina ninguna disminución en la eficacia del antibiótico ni incremento en la toxicidad, debido a que no depende de la concentración. Además, el efecto sobre la absorción se podría evitar administrando ambos fármacos en horarios separados (6 horas).
La interacción medicamentosa entre metformina y cefalexina genera que cefalexina inhiba la secreción tubular renal de metformina resultando en concentraciones séricas más elevadas de metformina, pudiendo causar hipoglucemia como consecuencia.
El tratamiento concomitante de cefalexina y colestiramina reduce la absorción de cefalexina.
Tal como ocurre con otros antibióticos betalactámicos, el probenecid inhibe la excreción renal de cefalexina.
En un estudio con 12 sujetos sanos tratados con dosis únicas de 500 mg de cefalexina y metformina, la Cmáx. y AUC plasmática de metformina aumentaron en un promedio de 34 y 24%, respectivamente; y el aclaramiento renal de la metformina disminuyó un promedio de 14%. No se reportaron efectos adversos en los 12 sujetos sanos de este estudio. No se dispone de información sobre la interacción de la cefalexina y la metformina después de la administración de dosis múltiples. La importancia clínica de este estudio no está clara, especialmente porque no se han reportado casos de acidosis láctica en relación con el tratamiento concomitante de metformina y cefalexina.
Se ha descrito hipocaliemia en pacientes que toman fármacos citotóxicos para la leucemia cuando se administró gentamicina y cefalexina.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Con el uso de cefalexina, se ha reportado eosinofilia, neutropenia y excepcionalmente trombocitopenia, los cuales revierten al descontinuar el tratamiento. Se ha reportado ligero aumento temporal de ASAT/ALAT y fosfatasas. Pueden producir además falsos-positivos en la determinación de glucosuria mediante pruebas de reducción de sulfato de cobre. También existe interferencia con los métodos de picrato alcalino para determinación de creatinina. Pueden aparecer falsos-positivos en pruebas de glucosa en orina con solución de Benedict o Fehling, o tabletas de Clinitest®, no así en las enzimáticas. Existen reportes de pruebas de Coombs positivas tanto en mujeres embarazadas como en recién nacidos cuando las madres se han encontrado expuestas a tratamientos con cefalosporinas.
PRECAUCIONES GENERALES: En forma previa al establecimiento del esquema de tratamiento es conveniente la determinación de antecedentes de hipersensibilidad a los fármacos cefalosporínicos, penicilinas, o cualquier otro medicamento ß-lactámico.
Este medicamento debe ser administrado con precaución a los pacientes alérgicos a la penicilina. Las reacciones graves de hipersensibilidad pueden requerir de manejo de emergencia.
Existe cierta evidencia clínica y de laboratorio de alergia cruzada parcial entre las penicilinas y las cefalosporinas. Algunos pacientes han experimentado reacciones graves (incluso anafilaxia) a ambos medicamentos.
Existe posibilidad para desarrollar colitis pseudomembranosa con el uso de antibióticos como macrólidos, penicilinas semisintéticas y cefalosporinas, entre otros; de ahí la importancia de considerar antecedentes de diarrea al emplear antibióticos.
En casi todos los casos de colitis pseudomembranosa la descontinuación del medicamento ha sido suficiente para detener la diarrea; en casos considerados de moderados a graves se requerirán medidas adicionales.
La prolongación del uso de cefalexina puede generar sobreinfecciones por organismos no susceptibles como Candida, lo que requiere la suspensión del tratamiento.
También existe antecedente de probable diagnóstico de celulitis en pacientes que residen en áreas geográficas en donde la enfermedad de Lyme (Borrelia burgdorferi) es endémica.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
Dosis: Las dosis promedio para el tratamiento de infecciones en el adulto varían de 250-500 mg/cada 6-8 horas.
La mayoría de los estudios reportaron resultados satisfactorios con un régimen de 1 g/día administrado en cuatro dosis divididas. Sin embargo, se ha encontrado que la administración de dos veces al día de 500 mg o 1 g dio como resultado tasas de curación clínica similares.
Se puede aumentar la dosis para tratar infecciones más graves o infecciones causadas por organismos que son menos susceptibles, hasta una dosis diaria máxima de 4 g en dos o cuatro dosis divididas.
Administración en pacientes con insuficiencia renal: Se recomienda reducir la dosis de acuerdo a las cifras de depuración de creatinina.
• Depuración de creatinina de 20 a 10 ml/min: Dosis máxima 1,500 mg/día (500 mg cada 8 o cada 12 horas).
• Depuración de creatinina < de 10 ml/min: Dosis máxima 1,000 mg/día (250-500 cada 12 horas).
Adultos en hemodiálisis deben recibir una dosis adicional de 250 mg posteriores a la diálisis (máximo 1 g/día). Los niños con insuficiencia renal deben recibir 8 mg/kg/día.
Pacientes con diálisis peritoneal continua ambulatoria (DPCA): 250 mg cada 8 horas.
En infecciones recurrentes de vías urinarias, se recomienda una dosis única de 125 mg por las noches, por varios meses a manera de profilaxis.
Pediátricos: En los pacientes pediátricos < 12 años las dosis para el tratamiento de infecciones leves y moderadas es de 25 a 60 mg/kg de peso corporal por día por vía oral divididas en 4 dosis.
En la infección sistémica grave se han empleado dosis más altas, hasta 100 mg/kg/día.
Dosis máxima diaria: 4 g.
|
Grupo de edad |
Dosis |
Intervalo de dosis |
|
Adultos y adolescentes |
250 mg-1 g |
6-12 h |
|
Niños > 40 kg peso |
250 mg-1 g |
6-12 h |
|
Niños > 1 año de edad (Peso corporal < 40 kg) |
6.25-25 mg/kg |
6 h |
|
12.5-50 mg/kg |
12 h |
|
|
Lactantes y niños > 1 mes de edad < 1 año |
6.25-12.5 mg/kg |
6 h |
La duración del tratamiento varía de 4 a 14 días con una media de 10 días; es recomendable continuar la ingesta de medicamento por dos días más allá de la desaparición total de los síntomas.
En el caso de infecciones crónicas o recurrentes de las vías urinarias, es recomendable el tratamiento con 500 mg cuatro veces al día durante dos semanas. Sin embargo, el criterio del médico impera para la prescripción.
Gonorrea: Dosis única de 3 g más 1 g de probenecid en hombres.
Dosis única de 2 g más 0.5 g de probenecid en mujeres.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La sobredosis oral se manifiesta a través de síntomas como diarrea, vómito, náuseas, dolor epigástrico o hematuria.
En caso de sobredosis grave, se recomienda cuidados generales de sostén, incluyendo la monitorización cuidadosa tanto clínica como de laboratorio de las funciones hematológica, renal y hepática y del estado de la coagulación hasta que el paciente se encuentre estable. No se recomienda el empleo de lavado gastrointestinal o inducción del vómito; es preferible el manejo con administración de carbón activado. La diálisis peritoneal o hemodiálisis es de utilidad en la reducción de los niveles plasmáticos.
A menos que se haya ingerido una cantidad equivalente a 5 a 10 veces la dosis diaria total habitual, no debería ser necesaria la descontaminación intestinal.
Ha habido reportes de hematuria sin deterioro de la función renal en niños que habían ingerido accidentalmente más de 3.5 g de cefalexina en un solo día. El tratamiento fue de sostén (líquidos) y no se han reportado secuelas.
PRESENTACIÓN:
Caja de cartón con 15 cápsulas de 500 mg en envase de burbuja.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C y en un lugar seco.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No se deje al alcance de los niños. Su venta requiere receta médica. OPTOCEF® no debe administrarse después de su fecha de caducidad. La administración de este medicamento durante el embarazo queda bajo la responsabilidad del médico.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Hecho en El Salvador por:
Corporación Bonima S. A de C.V.
Carretera Panamericana Km. 11
Ilopango, San Salvador, El Salvador
Distribuido por:
BAYER DE MÉXICO, S.A. de C.V.
Miguel de Cervantes Saavedra No. 259
C.P. 11520, Deleg. Miguel Hidalgo, D.F., México
OPTOCEF® Cápsulas Reg. Núm. 011M2005 SSA IV
No. de autorización: NE. 133300415A0359
® Marca registrada