
PROLIA
DENOSUMAB
Solución
1 Caja, 1 Jeringa(s) prellenada(s), 60 mg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
La jeringa prellenada contiene:
Denosumab 60 mg
Vehículo cs 1.0 mL
Anticuerpo monoclonal humano IgG2 de origen ADN recombinante expresado en células de ovario de hámster chino (CHO)
INDICACIONES TERAPÉUTICAS:
Osteoporosis posmenopáusica: PROLIA® está indicado en el tratamiento de la osteoporosis en mujeres posmenopáusicas. En las mujeres posmenopáusicas con osteoporosis, PROLIA® incrementa la densidad mineral ósea (DMO) y reduce la incidencia de fracturas de cadera, vertebrales y no vertebrales.
Osteoporosis masculina: PROLIA® está indicado para el tratamiento de osteoporosis en hombres.
Pérdida ósea en pacientes que se someten a ablación hormonal por cáncer: PROLIA® está indicado para el tratamiento de la pérdida ósea en pacientes que se someten a ablación hormonal por cáncer de próstata o cáncer de mama. En los pacientes con cáncer de próstata, PROLIA® reduce la incidencia de fracturas vertebrales.
Osteoporosis inducida por glucocorticoides: PROLIA® está indicado para el tratamiento de la osteoporosis asociada a la terapia sistémica con glucocorticoides a largo plazo en pacientes adultos con alto riesgo de fracturas.
El alto riesgo de fractura se define como: un historial de fractura osteoporótica, múltiples factores de riesgo para fractura, o pacientes con falla o que son intolerantes a otros tratamientos disponibles para la osteoporosis.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas: Después de la administración subcutánea, PROLIA® mostró una farmacocinética no lineal con una dosis sobre un amplio intervalo de dosis e incrementos proporcionales para la dosis expuesta de 60 mg (o 1 mg/kg) y superiores.
Absorción: Después de una dosis SC de 60 mg, la biodisponibilidad fue de 61% y las concentraciones máximas de denosumab en el suero (Cmáx) de 6 mcg/mL (intervalo: de 1 a 17 mcg/mL) ocurrieron en 10 días (intervalo de 2 a 28 días). Después de que los niveles séricos de Cmáx declinaran con una vida media de 26 días (intervalo de 6 a 52 días) durante un periodo de 3 meses (intervalo: de 1.5 a 4.5 meses). Cincuenta y tres por ciento de los pacientes no presentaron cantidades medibles detectables de denosumab a los 6 meses posteriores a la administración.
Distribución: No se observó una acumulación o cambio en el tiempo, en la farmacocinética de PROLIA® con dosis múltiples SC de 60 mg una vez cada seis meses.
Metabolismo: Denosumab está compuesto únicamente de aminoácidos y carbohidratos como la inmunoglobulina nativa. Con base en los datos no clínicos, el metabolismo de denosumab está previsto para seguir las rutas de eliminación de la inmunoglobulina, teniendo como resultado la degradación en péptidos pequeños y aminoácidos individuales.
Eliminación: Denosumab está compuesto únicamente de aminoácidos y carbohidratos como la inmunoglobulina nativa y no es probable que se elimine a través de los mecanismos metabólicos hepáticos (por ejemplo, enzimas del citocromo p450 [CYP]). Con base en los datos no clínicos, su eliminación está prevista que siga las rutas de eliminación de la inmunoglobulina, teniendo como resultado la degradación en péptidos pequeños y aminoácidos individuales.
En un estudio de 17 mujeres posmenopáusicas con osteoporosis, se administró midazolam (2 mg oral) dos semanas después de una sola dosis de denosumab (60 mg SC), que corresponde al tiempo de los efectos farmacodinámicos máximos de denosumab.
Denosumab no afectó la farmacocinética de midazolam, que se metaboliza por el citocromo P450 3A4 (CYP3A4). Esto indica que denosumab no debe alterar la PK de los fármacos metabolizados por el CYP3A4.
La farmacocinética y la farmacodinamia de denosumab fueron similares en pacientes con osteoporosis inducida por glucocorticoides .
Poblaciones especiales:
Población geriátrica: La farmacocinética de denosumab no se vio afectada por la edad de 28 a 87 años.
Población pediátrica: PROLIA® no se indica para su administración en pacientes pediátricos.
En un estudio fase III en pacientes pediátricos con osteogénesis imperfecta (OI) (N = 153), se observaron concentraciones séricas máximas de denosumab en el día 10 en todos los grupos etarios. Para las administraciones de la dosis una vez cada 3 meses y una vez cada 6 meses, se observó que las concentraciones mínimas medias de denosumab eran mayores en los niños de 11 a 17 años de edad, mientras que los niños de 2 a 6 años de edad presentaron las concentraciones mínimas medias de denosumab más bajas (consulte Dosis y vía de administración).
Raza: La farmacocinética del denosumab no fue afectada por la raza en mujeres posmenopáusicas o en pacientes con cáncer de mama sometidos a ablación hormonal.
Insuficiencia hepática: No se han llevado a cabo estudios clínicos para evaluar el efecto de la insuficiencia hepática en la farmacocinética del denosumab.
Insuficiencia renal: En un estudio de 55 pacientes con varios grados de función renal, incluyendo pacientes en diálisis, el grado de insuficiencia renal no tuvo un efecto en la farmacocinética y farmacodinámica del denosumab; por ello, no es necesario el ajuste de la dosis para la insuficiencia renal.
Propiedades farmacodinámicas:
Mecanismo de acción: Denosumab es un anticuerpo monoclonal humano (IgG2) que se dirige y se une con una alta afinidad y especificidad al RANKL (Ligando del Receptor Activador del Factor Nuclear K B) previniendo que el RANKL active su único receptor, RANK, sobre la superficie de osteoclastos y sus precursores, independientemente de la superficie ósea. La prevención de la interacción RANKL/RANK inhibe la formación, funciones y sobrevivencia de los osteoclastos disminuyendo así la resorción ósea e incrementa la masa y resistencia óseas tanto en el hueso cortical y trabecular.
Efectos farmacodinámicos: En estudios clínicos, el tratamiento con 60 mg de PROLIA® tuvo como resultado la reducción rápida en suero del marcador de resorción ósea tipo 1 C-telopéptidos (CTX) en las 6 horas posteriores a la administración SC (en aproximadamente 70%) con reducciones de aproximadamente 85% las cuales ocurrieron en 3 días. Las reducciones de CTX se mantuvieron durante el intervalo de dosis de 6 meses. Al final de cada intervalo de dosis, las reducciones de CTX se atenuaron parcialmente a partir de la reducción máxima ≥ 87% hasta aproximadamente ≥ 45% (en un intervalo de 45% a 80%), reflejando así la reversibilidad de los efectos de PROLIA® en la remodelación ósea una vez que disminuyen los niveles séricos. Estos efectos se sostuvieron con el tratamiento continuo. En concordancia con la relación fisiológica de la formación y resorción ósea en la remodelación del esqueleto, las reducciones en los marcadores de formación ósea (por ejemplo se observaron la fosfatasa alcalina específica del hueso (BSAP, por sus siglas en inglés] y el propéptido N-terminal en suero de colágeno tipo 1 [P1NP]) después de un mes de la primera dosis de PROLIA®.
Los marcadores de recambio óseo (marcadores de resorción y formación ósea) alcanzaron generalmente niveles de pretratamiento previo en un máximo de 9 meses después de la última dosis subcutánea de 60 mg. Al reiniciar, el grado de inhibición de CTX por PROLIA® fue similar al observado en pacientes al iniciar el tratamiento con denosumab.
En un estudio clínico de mujeres posmenopáusicas con masa ósea baja (n = 504), las cuales recibieron un tratamiento previo con alendronato durante una duración promedio de 3 años, aquellas que cambiaron a PROLIA® experimentaron reducciones adicionales en CTX en suero, en comparación con las mujeres que permanecieron con alendronato. En este estudio los cambios en el calcio sérico fueron similares entre los dos grupos.
Datos clínicos.
Tratamiento de la osteoporosis posmenopáusica: Se demostraron la eficacia y seguridad de PROLIA® en el tratamiento de la osteoporosis posmenopáusica en el Estudio 1 (FREEDOM), un estudio de 3 años, aleatorizado, doble ciego, controlado con placebo, multinacional que demostró que el denosumab fue efectivo en comparación con el placebo al reducir las nuevas fracturas vertebrales, no vertebrales y de cadera en mujeres posmenopáusicas con osteoporosis.
Las 7,808 mujeres con edades de 60 a 91 años se enrolaron, de las cuales el 23.6% tenía fracturas vertebrales prevalentes. Las mujeres fueron aleatorizadas para recibir inyecciones SC ya sea de placebo (n = 3,906) o PROLIA® 60 mg (n = 3,902) una vez cada 6 meses. Las mujeres recibieron complementos diarios de al menos 1,000 mg de calcio y 400 UI de vitamina D.
La variable primaria de eficacia fue la incidencia de nuevas fracturas vertebrales. Las variables secundarias de eficacia incluyeron la incidencia de fracturas no vertebrales y fractura de cadera, evaluadas después de 3 años.
Denosumab redujo considerablemente el riesgo de nuevas fracturas vertebrales, no vertebrales y de cadera en comparación con el placebo. Los 3 criterios de valoración de eficacia de fracturas obtuvieron el nivel de significancia estadística con base en el esquema de pruebas secuenciales preespecificadas.
Efecto en las fracturas vertebrales: Denosumab redujo considerablemente el riesgo de nuevas fracturas vertebrales (criterio de valoración primario) en un 68% (tasa de riesgo: 0.32; p < 0.0001) durante 3 años. Las tasas de fractura después de 3 años para las nuevas fracturas vertebrales fueron de 7.2% en el grupo de placebo y 2.3% en el grupo de PROLIA® (reducción de riesgo absoluto no ajustado de 4.8%). Las reducciones también se observaron desde el primer año (61% de reducción de riesgo relativo; 1.4% de reducción de riesgo absoluto no ajustado) y el segundo año de tratamiento (71% de reducción de riesgo relativo; 3 .5% de reducción de riesgo absoluto no ajustado) (todas las p < 0.0001).
Denosumab también redujo el riesgo de otras categorías de fracturas preespecificadas, incluyendo fracturas vertebrales nuevas y en deterioro (67% de reducción de riesgo relativo, 4.8% de reducción de riesgo absoluto no ajustado), nuevas fracturas vertebrales múltiples ( 61% de reducción de riesgo relativo, 1.0% de reducción de riesgo absoluto no ajustado), fracturas vertebrales clínicas (69% de reducción de riesgo relativo, 1.8% de reducción de riesgo absoluto no ajustada) durante 3 años.
Las reducciones en el riesgo de nuevas fracturas vertebrales mediante denosumab durante 3 años fueron consistentes y considerables independientemente del riesgo de fractura basal a 10 años evaluado por el algoritmo FRAX (Herramienta para la Evaluación del riesgo de fractura de la OMS) independientemente de si las mujeres tuvieron fracturas vertebrales prevalentes o con historial de fracturas no vertebrales, sin importar la edad, DMO, nivel de recambio óseo y uso previo de un medicamento para la osteoporosis en línea basal.
En mujeres posmenopáusicas con osteoporosis en edades mayores de 75 años, el denosumab redujo la incidencia de nuevas fracturas vertebrales (64%) y no vertebrales (16%).
Efecto en las fracturas de cadera: Denosumab redujo considerablemente el riesgo de fracturas de cadera (criterio de valoración secundario) en 40% (tasa de riesgo: 0.60; p = 0.0362) durante 3 años. Las tasas de fractura de cadera a tres años fueron de 1.2% en el grupo de placebo y 0.7% en el grupo de denosumab (reducción de riesgo absoluto no ajustado de 0.5%). Las reducciones en la incidencia de fracturas de cadera durante 3 años fueron consistentes y considerablemente independientes a la probabilidad en la línea basal a 10 años de una fractura de cadera (medición del riesgo de fractura como se evaluó mediante FRAX). En mujeres con alto riesgo de fractura con base en la edad en la línea basal, la DMO y los antecedentes de fracturas (las fracturas vertebrales prevalentes ), se observó un 1.1% de reducción del riesgo absoluto y un 48% de reducción del riesgo relativo con PROLIA®. Se observaron reducciones en mujeres con mayor riesgo de fractura, incluido un análisis post-hoc en mujeres mayores de 75 años de edad, entre las que la incidencia de fractura de cadera es más alta (reducción del riesgo relativo de 62%).
Efecto en todas las fracturas clínicas:
Denosumab redujo considerablemente el riesgo de fracturas no vertebrales ( criterio de evaluación secundario) en un 20% (tasa de riesgo: 0.80; p = 0.0106) durante 3 años. Las tasas de fracturas no vertebrales fueron de 8.0% en el grupo de placebo y de 6.5% en el grupo de denosumab (reducción de riesgo absoluto no ajustado de 1.5%).
Denosumab también redujo el riesgo de fracturas clínicas (30% de reducción de riesgo relativo, 2.9% de reducción de riesgo absoluto no ajustado), fracturas no vertebrales graves (20% de reducción de riesgo relativo, 1.2% de reducción de riesgo absoluto no ajustado) y las fracturas osteoporóticas graves (35% de reducción de riesgo relativo, 2. 7% de reducción de riesgo absoluto no ajustado) durante 3 años.
En mujeres con un valor-T de DMO de cuello femoral de línea basal ≤ 2.5, el denosumab redujo la incidencia de fracturas no vertebrales (35% de reducción de riesgo relativo, 4.1 % de reducción de riesgo absoluto no ajustado, p < 0.001) durante 3 años. Las reducciones en las fracturas no vertebrales se observaron independientemente de la probabilidad de línea basal a 10 años de una fractura osteoporótica grave como se evaluó mediante FRAX.
Efecto en la Densidad Mineral Ósea (DMO): El tratamiento con PROLIA® incrementó considerablemente la DMO en todos los sitios clínicos analizados, comparado con placebo después de 1, 2 y 3 años. El denosumab PROLIA® incrementó la DMO en 9.2% en la columna lumbar, 6.0% en 9.2%, la DMO en la cadera total, 4.8% en 6.0%, la DMO en el cuello femoral, 7.9% en 4.8%, la DMO en el trocánter de la cadera, 3.5% en 7.9%, la DMO en el 1/3 distal del radio en 3.5% y 4.1%la DMO en el cuerpo total en 4.1% durante 3 años. Los incrementos en la DMO en la columna lumbar, cadera total y trocánter de cadera se observaron tan rápido como 1 mes posterior a la dosis inicial. El denosumab al mes.
PROLIA® incrementó la DMO de la columna lumbar a partir de la línea basal en 96% de las mujeres posmenopáusicas después de 3 años. Se observaron efectos consistentes en la DMO de la columna lumbar independientemente de la edad, raza, peso/índice de masa corporal (IMC), DMO y nivel de remodelado óseo en la línea basal.
Estudio de extensión abierto en el tratamiento de la osteoporosis posmenopáusica: Un total de 4,550 mujeres que no perdieron más de una dosis de PROLIA® en el Estudio 1 (N = 7,808) y completaron la visita de estudio al mes 36 se inscribieron al estudio de extensión de un solo brazo, multinacional, multicéntrico, abierto de 7 años para evaluar la seguridad y eficacia a largo plazo de PROLIA®. Todas las mujeres en el estudio de extensión debían recibir PROLIA® cada 6 meses en una sola dosis SC de 60 mg, así como calcio diario (al menos 1 g) y vitamina D (al menos 400 UI).
Con base en los datos hasta 7 años de la extensión, en el grupo a largo plazo, el tratamiento con PROLIA® mantuvo una baja incidencia de nuevas fracturas vertebrales y no vertebrales (7.0% de las mujeres tuvo al menos una nueva fractura vertebral, 9.3% de las mujeres tuvo al menos una fractura no vertebral).
Tabla 1. El efecto de PROLIA® sobre la incidencia anual de nuevas fracturas vertebrales y no vertebrales durante 7 años del estudio de extensión
|
Exposición a |
Grupo PROLIA® a largo plazoa |
Exposición a |
Grupo PROLIA® cruzadob |
||
|---|---|---|---|---|---|
|
Proporción de mujeres con nuevas fracturas vertebrales (%)c |
Proporción de mujeres con fracturas no vertebrales (%)d |
Proporción de mujeres con nuevas fracturas vertebrales (%)c |
Proporción de mujeres con fracturas no vertebrales (%)d |
||
|
Año 4 |
1.5e (N = 2,116) |
1.5 (N = 2,343) |
Año 1 |
0.9e (N = 1,991) |
2.5 (N = 2,207) |
|
Año 5 |
1.2 (N = 2,244) |
Año 2 |
2.0 (N = 2,105) |
||
|
Año 6 |
1.2 (N = 1,809) |
1.8 (N = 2,067) |
Año 3 |
1.5 (N = 1,695) |
2.6 (N = 1,965) |
|
Año 7 |
1.4e (N = 1,585) |
1.6 (N = 1,867) |
Año 4 |
1.9e (N = 1,508) |
1.2 (N = 1,756) |
|
Año 8 |
0.8 (N = 1,743) |
Año 5 |
1.8 (N = 1,646) |
||
|
Año 9 |
1.3e (N = 1,323) |
1.1 (N = 1,585) |
Año 6 |
1.6 (N = 1,267) |
1.5 (N = 1,515) |
|
Año 10 |
1.9 (N = 1,451) |
Año 7 |
1.7 (N = 1,394) |
||
a Grupo a largo plazo: mujeres que recibieron PROLIA® en el estudio 1 y continuaron en terapia en la extensión.
b Grupo cruzado: mujeres que recibieron placebo en el estudio 1 y fueron transicionadas a PROLIA® en la extensión.
c Basado en incidencia cruda.
d Basado en el estimado de Kaplan-Meier.
e Incidencia anualizada de sujetos de Año.
En el grupo a largo plazo, el tratamiento con PROLIA® continuó aumentando la DMO desde la basal de la extensión hasta los 7 años de la siguiente forma: en la columna lumbar (10.8%), cadera total (3.4%), cuello femoral (3.8%) y trocánter (5.1%). El incremento porcentual en la DMO desde la basal original del Estudio 1 (es decir, después de 10 Años de tratamiento) fue del 21.7% en la columna lumbar, 9.2% en la cadera total, 9.0% en el cuello femoral y 13.0% en el trocánter.
En el grupo cruzado, el inicio de PROLIA® se asoció con incrementos en la DMO desde la basal de la extensión hasta los 7 años en la columna lumbar (16.5%), cadera total (7.4%), cuello femoral (7.1%) y trocánter (10.3%).
Datos clínicos comparativos vs. alendronato en el tratamiento de mujeres posmenopáusicas con peso o masa ósea bajos: En dos estudios aleatorizados, doble ciego, controlados de 1 año, PROLIA® demostró ganancias significativamente, mayores en la DMO en todos los sitios clínicos y una respuesta terapéutica más rápida como lo demuestran las reducciones en los marcadores de recambio óseo (CTX sérico), en comparación con alendronato. Todas las mujeres recibieron suplementos de calcio y vitamina D.
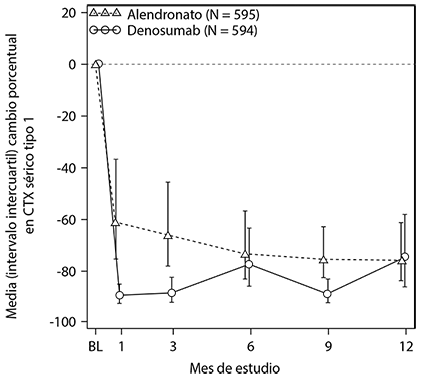
En un estudio, la eficacia de PROLIA® se comparó con alendronato en un estudio aleatorizado, doble ciego, controlado con activo en 1,189 mujeres posmenopáusicas con baja masa ósea que no habían recibido tratamiento previo. Aquellas mujeres que recibieron PROLIA® tuvieron ganancias significativamente mayores en la DMO en comparación con alendronato en la columna lumbar (5.3% denosumab vs.4.2% de alendronato), cadera total (3.5% vs 2.6%), cuello femoral (2.4% vs. 1.8%), trocánter de cadera (4.5% vs. 3.4%) y 1/3 distal del radio (1.1% vs. 0.6%) (Figura 1). Además, PROLIA® también redujo los marcadores de recambio óseo (89% vs. 61% de reducción de CTX sérico en el mes 1) más que alendronato (Figura 2).
Figura 1. Cambio porcentual en la DMO desde la basal hasta 1 año en mujeres sin tratamiento previo con osteoporosis (PROLIA® vs. alendronato)
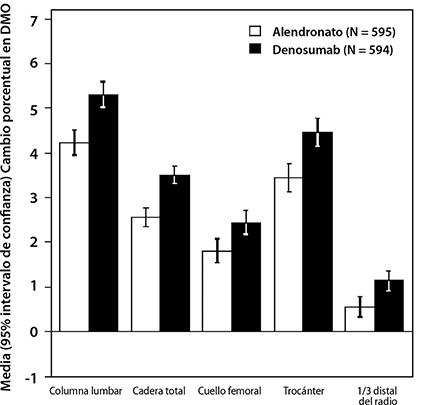
Figura 2. Cambio porcentual en CTX sérico desde la basal hasta 1-año en mujeres sin tratamiento previo con osteoporosis (PROLIA® vs. alendronato)
En el segundo estudio, se comparó la eficacia de PROLIA® con alendronato en un estudio aleatorizado, doble ciego, controlado con activo en 504 mujeres posmenopáusicas con baja masa ósea que estaban siendo tratadas con alendronato por una mediana de duración de 3 años. Aquellas mujeres que hicieron la transición para recibir PROLIA® tuvieron ganancias significativamente mayores en la DMO en la columna lumbar (3.03% PROLIA® vs. 1.85% alendronato), cadera total (1.90% vs. 1.05%), cuello femoral (1.40% vs. 0.41%), trocánter de cadera (2.95% vs. 1.90%) y 1/3 de radio distal (0.87% vs. 0.15%), en comparación con aquellas que continuaron recibiendo terapia con alendronato (Figura 3).
Además, se observaron reducciones adicionales en los marcadores de recambio óseo (reducción del 63% en CTX sérico en el mes 1) en las mujeres que hicieron la transición al tratamiento con PROLIA® (Figura 4). Las mujeres que continuaron el tratamiento con alendronato no tuvieron reducciones adicionales en los marcadores de recambio óseo.
Figura 3. Cambio porcentual en la DMO desde la basal hasta 1-año en mujeres con osteoporosis recibiendo terapia con alendronato (PROLIA® vs. alendronato)
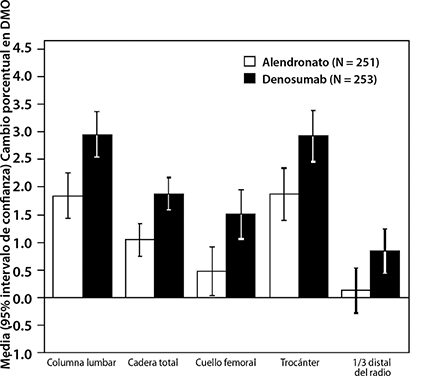
Figura 4. Cambio porcentual en CTX sérico desde la basal hasta 1-año en mujeres con osteoporosis recibiendo terapia con alendronato (PROLIA® vs. alendronato)

Histología: Cincuenta y tres muestras de biopsia ósea de cresta transiliaca se obtuvieron en el mes 24 y/o el mes 36 de 47 mujeres posmenopáusicas con osteoporosis tratadas con PROLIA®. También se obtuvieron quince muestras de biopsia de hueso después de 12 meses de tratamiento con PROLIA® de 15 mujeres posmenopáusicas con baja masa ósea que habían hecho la transición del tratamiento anterior con alendronato. Las evaluaciones histológicas en ambos estudios mostraron hueso de arquitectura y calidad normales, así como la disminución esperada en el recambio óseo en relación con el placebo. No hubo evidencia de defectos de mineralización, hueso tejido o fibrosis de la médula ósea. Cincuenta y nueve mujeres participaron en el subestudio de biopsia de hueso al mes 24 (N = 41) y/o mes 84 (N = 22) de la extensión del Estudio 1, lo que representa hasta 5 y 10 años de tratamiento con PROLIA®, respectivamente. Los resultados de la biopsia de hueso mostraron hueso de arquitectura y calidad normales sin evidencia de defectos de mineralización, hueso reticular o fibrosis de la médula ósea, así como la disminución esperada en el recambio óseo. En estudios preclínicos de calidad ósea en monos tratados con terapia a largo plazo con PROLIA®, las disminuciones similares en el recambio óseo se asociaron con una mejora en la resistencia ósea y la histología ósea normal. Estos datos preclínicos, junto con la histología ósea normal en mujeres posmenopáusicas, respaldan la conclusión de que después del tratamiento con PROLIA®, el hueso es de calidad normal. Los hallazgos de histomorfometría en el estudio de extensión en mujeres posmenopáusicas con osteoporosis mostraron que los efectos antirresortivos de PROLIA®, medidos por la frecuencia de activación y las tasas de formación ósea, se mantuvieron a lo largo del tiempo.
Tratamiento de la osteoporosis en hombres:
La eficacia y seguridad de PROLIA® en el tratamiento de hombres con osteoporosis se demostró en un estudio de 1 año de 242 hombres con masa ósea baja, que tenían un valor-T basal de DMO entre -2.0 y -3.5 en la columna lumbar y en el cuello femoral. Los hombres con un valor-T de DMO entre -1.0 y -3.5 en la columna lumbar y en el cuello femoral, y con antecedentes de fractura previa por fragilidad también fueron inscritos. Los hombres con otras enfermedades (tales como artritis reumatoide, osteogénesis imperfecta y enfermedad de Paget) o en terapias que podían afectar los huesos fueron excluidos de este estudio.
El tratamiento con PROLIA® incrementó significativamente la DMO respecto al valor basal en la columna lumbar y de todos los sitios esqueléticos medidos (fémur proximal, radio distal) en 1 año. PROLIA® aumentó la DMO de la columna lumbar en un 4.8%, la DMO en la cadera total en un 2.0%, la DMO en el trocánter de la cadera en un 2.3%, la DMO del cuello femoral en un 2.2%, la DMO de 1/3 del radio distal en un 0.9%, en relación con el placebo.
Los incrementos en la DMO de la columna lumbar, cadera total y trocánter de la cadera se observaron a los 6 meses.
Se observaron efectos consistentes sobre la DMO en la columna lumbar, independientemente de la edad, la raza, el índice de masa/peso corporal (IMC), DMO, y el nivel de recambio óseo en la línea basal.
Histología e histomorfometría de hueso: Las evaluaciones de histología cualitativa mostraron una arquitectura y calidad normales sin evidencia de defectos de mineralización, tejido óseo o fibrosis de médula en pacientes tratados con PROLIA®.
Tratamiento de la pérdida ósea en hombres sometidos a terapia de privación androgénica para:
Cáncer de próstata: Se demostró la eficacia y seguridad del PROLIA® en el tratamiento de la pérdida ósea en hombres con cáncer de próstata no metastásico que recibían privación de andrógenos en el Estudio 3, un estudio multinacional aleatorizado, doble ciego, controlado con placebo y de 3 años de duración. Los hombres menores a 70 años de edad también presentaron ya sea un valor-T de DMO en la columna lumbar, cadera total o de cuello femoral menor a < -1.0 o un historial de alguna fractura osteoporótica.
Los 1,468 hombres inscritos tenían entre 48 y 97 años de edad. Los hombres fueron aleatorizados para recibir inyecciones SC ya sea de placebo (N = 734) o PROLIA® 60 mg (N = 734) una vez cada 6 meses. Los hombres recibieron complementos diarios de, al menos, 1,000 mg de calcio y 400 UI de vitamina D.
PROLIA® incrementó la DMO de la columna lumbar en 7.9%, DMO de cadera total en 5.7%, DMO de cuello femoral en 4.9%, DMO de trocanter de cadera en 6.9%, DMO de 1/3 distal de radio en 6.9%, y DMO del cuerpo total en 4.7% durante 3 años, en comparación con placebo (p < 0.0001). Se observaron incrementos considerables en la DMO de la columna lumbar, cadera total, cuello femoral y el trocánter de la cadera tan rápido como 1 mes después de la dosis inicial. Se observaron efectos consistentes en la DMO de la columna lumbar independientemente de la edad, raza, región geográfica, peso/IMC, la DMO y nivel de recambio óseo en la línea basal; duración de la terapia de deprivación andrógenica y presencia de fracturas vertebrales.
Denosumab redujo considerablemente el riesgo de nuevas fracturas vertebrales en 62% (tasa de riesgo: 0.38; p < 0.0063) durante 3 años. También se observaron reducciones durante un año (85% reducción de riesgo relativo; 1.6% reducción de riesgo absoluto), y después de 2 años (69% de reducción de riesgo relativo; 2.2% reducción de riesgo absoluto) (todos p < 0.01). El denosumab también redujo la incidencia de los sujetos para más de una fractura osteoporótica en cualquier sitio en 72% comparado con placebo durante 3 años (placebo 2.5% vs. denosumab 0.7%, p = 0.0063).
Tratamiento de la pérdida ósea en mujeres que se sometieron a una terapia de inhibidor de aromatasa para cáncer de mama:
Se evaluaron la eficacia y seguridad de PROLIA® en el tratamiento de la pérdida ósea en mujeres con cáncer de mama no metastásico que recibían terapia adyuvante de inhibidor de aromatasa en el Estudio 4, un estudio de 2 años, aleatorizado, doble ciego y controlado por placebo. Las mujeres presentaron valores T de DMO en la línea basal entre -1.0 a -2.5 en la columna lumbar, cadera total o cuello femoral.
Las 252 mujeres inscritas tenían edades que oscilaban entre 35 y 84 años. Las mujeres se aleatorizaron para recibir inyecciones SC ya sea de placebo (N = 125) o PROLIA® de 60 mg (N = 127) una vez cada 6 meses. Todas las mujeres recibieron, al menos, un complemento diario de 1,000 mg de calcio y 400 UI de vitamina D. La variable de eficacia primaria fue el cambio porcentual en la DMO de la columna lumbar.
El tratamiento con PROLIA® incrementó considerablemente la DMO en todos los sitios clínicos analizados a los 2 años. PROLIA® aumentó la DMO en la columna lumbar 7.6%, la DMO en la cadera total en 4.7%, la DMO en el cuello femoral en 3.6%, la DMO en el trocánter de la cadera en 5.9%, la DMO en el 1/3 distal del radio en 6.1% y la DMO en el cuerpo total en 4.2% durante 2 años. Se observaron incrementos considerables en la DMO de la columna lumbar tan rápido como al mes de la dosis inicial. Se observaron efectos consistentes en la DMO independientemente de la edad, duración de la terapia con inhibidor de aromatasa, peso/IMC, quimioterapia previa, uso previo de moduladores selectivos del receptor de estrógeno (SERM por sus siglas en inglés), y tiempo desde la menopausia.
Tratamiento de la osteoporosis inducida por glucocorticoides:
La eficacia y la seguridad de PROLIA® en el tratamiento de la osteoporosis inducida por glucocorticoides se demostraron en un estudio de 1 año aleatorizado, multicéntrico, doble ciego, doble simulación, de grupos paralelos, con control activo de 795 pacientes (70% mujeres y 30% hombres) de 20 a 94 años (edad media de 63.1 años) tratados con ≥ 7 .5 mg de prednisona oral diaria (o equivalente).
Se estudiaron dos subpoblaciones: glucocorticoides continuos (≥ 7.5 mg diarios de prednisona o su equivalente durante ≥ 3 meses antes de la inclusión en el estudio y la planificación para continuar el tratamiento durante un mínimo de 6 meses, n = 505) e iniciación de glucocorticoides (≥ 7.5 mg diarios de prednisona o su equivalente por < 3 meses antes de la inscripción en el estudio y la planificación para continuar el tratamiento durante un mínimo de 6 meses, n = 290). Dentro de cada subpoblación, la aleatorización se estratificó por género y los pacientes fueron aleatorizados (1 : 1) para recibir PROLIA® 60 mg por vía subcutánea una vez cada 6 meses (n = 398) o risedronato oral 5 mg una vez al día (control activo) (n = 397). Todos los pacientes debían recibir al menos 1,000 mg de calcio y 800 UI de vitamina D por día.
Los pacientes inscritos < 50 años de edad debían tener antecedentes de fractura osteoporótica. Los pacientes inscritos ≥ 50 años de edad que estaban en la subpoblación con glucocorticoides continuos debían tener un valor-T de DMO inicial de ≤ -2.0 en la columna lumbar, la cadera total o el cuello femoral; o un valor-T de DMO ≤ -1.0 en la columna lumbar, la cadera total o el cuello femoral y un historial de fractura osteoporótica.
Efecto en la densidad mineral osea (DMO):
En la subpoblación glucocorticoides continuos, PROLIA® demostró un aumento significativamente mayor en la DMO de la columna lumbar en comparación con risedronato a 1 año (PROLIA® 4.4%, risedronato 2.3%) con una diferencia de tratamiento de 2.2% (p < 0.001). En la subpoblación de iniciación de glucocorticoides, PROLIA® demostró un aumento significativamente mayor en la DMO de la columna lumbar en comparación con risedronato a 1 año (PROLIA® 3.8%, risedronato 0.8%) con una diferencia de tratamiento de 2.9% (p < 0.001).
Se observaron efectos consistentes en la DMO de la columna lumbar independientemente del sexo, raza, región geográfica, estado de la menopausia, la edad basal, valor-T de la DMO de la columna lumbar y la dosis de glucocorticoides dentro de cada subpoblación.
Además, también se observaron diferencias significativas entre los grupos de tratamiento en el aumento porcentual medio de la DMO desde el inicio al año en el trocánter cadera, cuello femoral y cadera total (ambas subpoblaciones) y 1/3 distal del radio (subpoblación de glucocorticoides continuos solamente) (consulte Tabla 2).
Tabla 2. Cambio porcentual en la DMO desde el inicio hasta el 1.° año en mujeres y hombres con osteoporosis inducida por glucocorticoides (PROLIA® vs. risedronato)
|
Subpoblación |
Localización |
Media en el grupo de PROLIA® (95% IC) |
Media en el grupo de risedronato (95% IC) |
Media de diferencia de grupos de tratamiento (95% CI) |
Valor-p |
|
Glucocorticoides continuos |
Columna lumbar |
4.4 (3.8, 5.0) (N = 209) |
2.3 (1.7, 2.9) (N = 211) |
2.2 (1.4, 3.0) |
< 0.001* |
|
Cadera total |
2.1 (1.7, 2.5) (N = 217) |
0.6 (0.2, 1.0) (N = 215) |
1.5 (1.0, 2.1) |
< 0.001* |
|
|
Cuello femoral |
1.6 (1.0, 2.1) (N = 217) |
0.6 (0.1, 1.1) (N = 215) |
1.0 (0.3, 1.7) |
0.004 |
|
|
Trocánter (cadera) |
2.9 (2.2, 3.6) (N = 217) |
1.1 (0.4, 1.8) (N = 215) |
1.8 (0.8, 2.7) |
< 0.001 |
|
|
1/3 distal del radio |
0.2 (-0.2, 0.6) (N = 217) |
-0.6 (-1.1, -0.2) (N = 215) |
0.8 (0.2, 1.4) |
0.008 |
|
|
Iniciación de glucocorticoides |
Columna lumbar |
3.8 (3.1, 4.5) (N = 119) |
0.8 (0.2, 1.5) (N = 126) |
2.9 (2.0, 3.9) |
< 0.001* |
|
Cadera total |
1.7 (1.2, 2.2) (N = 119) |
0.2 (-0.2, 0.7) (N = 128) |
1.5 (0.8, 2.1) |
< 0.001* |
|
|
Cuello femoral |
0.9 (0.2, 1.7) (N = 119) |
-0.2 (-1.0, 0.5) (N = 128) |
1.1 (0.2, 2.1) |
0.020 |
|
|
Trocánter (cadera) |
3.0 (2.2, 3.8) (N = 119) |
0.9 (0.1, 1.7) (N = 128) |
2.1 (1.0, 3.2) |
< 0.001 |
|
|
1/3 distal del radio |
-0.1 (-0.6, 0.5) (N = 120) |
-0.5 (-1.0, 0.1) (N = 126) |
0.4 (-0.4, 1.2) |
0.35 |
* Valor-p ajustado para multiplicidad dentro de cada subpoblación.
Histología de hueso: Se obtuvieron muestras de biopsia de hueso de 17 pacientes (6 en el grupo de tratamiento de PROLIA® y 11 en el grupo de tratamiento con risedronato). Las evaluaciones de histología cualitativa mostraron una arquitectura y calidad normales sin evidencia de defectos de mineralización, tejido óseo o fibrosis de médula en pacientes tratados con PROLIA®.
CONTRAINDICACIONES: Hipersensibilidad a denosumab o a los componentes de PROLIA®.
Embarazo.
Lactancia.
Menores de 18 años.
Hipocalcemia.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LACTANCIA:
Embarazo: No existen datos adecuados acerca de mujeres embarazadas. PROLIA® no debe administrarse en mujeres embarazadas.
En las exposiciones de ABC hasta 100 veces mayores a la exposición humana (60 mg cada 6 meses), el denosumab no mostró evidencia de discapacidad en la fertilidad en monos cynomolgus.
En un estudio en monos cynomolgus que recibieron una dosis de denosumab durante el periodo equivalente al primer trimestre, con exposiciones de ABC hasta 99 veces mayores que la dosis humana (60 mg cada 6 meses), no hubo evidencia de daño materno o fetal. En este estudio, no se examinaron los ganglios linfáticos del feto.
En otro estudio en monos cynomolgus que recibieron una dosis de denosumab durante el embarazo, exposiciones de ABC 119 veces mayores que la dosis humana (60 mg cada 6 meses), hubo un incremento de mortinatos y de la mortalidad postnatal; el crecimiento anormal del hueso dio como resultado la reducción de la resistencia ósea, reducción de la hematopoyesis, y mala alineación de los dientes; ausencia de ganglios linfáticos periféricos, y disminución del crecimiento del recién nacido. No hubo evidencia de daño maternal antes del parto; los efectos adversos maternos fueron poco frecuentes durante el parto. El desarrollo de la glándula mamaria materna fue normal.
Los estudios en ratones knockout sugieren que la ausencia de RANKL podría interferir con la maduración de la glándula mamaria materna lo que conduce a una insuficiencia en la lactancia posparto.
Lactancia: No se conoce si denosumab es excretado en la leche materna. Ya que el denosumab tiene el potencial de provocar reacciones adversas en infantes durante la lactancia, se debe tomar la decisión, ya sea de descontinuar la lactancia o descontinuar el medicamento. PROLIA® no debe emplearse en la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS:
Datos de estudios clínicos: Las reacciones adversas se enlistan a continuación por sistema de clasificación de órganos de MedDRA y por su frecuencia. Las categorías de frecuencia con base en las tasas de eventos de un año son:
Muy común: ≥ 1 en 10.
Común: ≥ 1 en 100 y < 1 en 10.
Poco común: ≥ 1 en 1,000 y < 1 en 100.
Rara: ≥ 1 en 10,000 y < 1 en 1,000.
Muy rara: < 1 en 10,000.
No conocida: no puede estimarse a partir de los datos disponibles.
Dentro de cada grupo de frecuencia y clase de órganos del sistema, las reacciones adversas se presentan en orden decreciente de gravedad.
|
Clasificación por Órgano y Sistema |
Término preferido de reacción adversa |
Frecuencia |
Origen/intensidad/gravedad |
|---|---|---|---|
|
Infecciones e infestaciones |
Infección cutáneaa que conduce a hospitalización |
Poco común |
Los pacientes que reciben PROLIA® pueden desarrollar infecciones cutáneas (predominantemente celulitis) que conducen a la hospitalización. Las infecciones cutáneas que llevaron a la hospitalización se reportaron en 0.1% (3 de 4,041) de las mujeres posmenopáusicas con osteoporosis que recibieron placebo versus el 0.4% (16 de 4,050) de las mujeres que recibieron PROLIA®. Estos casos fueron predominantemente celulitis. Las infecciones cutáneas reportadas como reacciones adversas graves fueron similares en los grupos de placebo (0.6%, 5 de 845) y PROLIA® (0.6%, 5 de 860) en los estudios de cáncer de mama y próstata. |
|
Trastornos metabólicos y de nutrición |
Hipocalcemia |
Rara |
PROLIA® está contraindicado en pacientes con hipocalemia. La hipocalcemia debe ser corregida antes de iniciar el tratamiento con denosumab. En pacientes predispuestos a la hipocalcemia, se recomienda monitoriar clínicamente los niveles de calcio durante el tratamiento, especialmente en las primeras semanas de iniciado el tratamiento. La ingesta adecuada de calcio y vitamina D es importante en todos los pacientes. En dos estudios clínicos fase III controlados con placebo en mujeres posmenopáusicas con osteoporosis, aproximadamente 0.05% (2 de 4,050) de los pacientes presentaron una disminución de los niveles séricos de calcio (menos de 1.88 mmol/L) después de la administración de PROLIA®. No se reportaron descensos de los niveles séricos de calcio (menos de 1.88 mmol/L) en ninguno de los dos estudios clínicos fase III controlados con placebo en pacientes que recibieron terapia de ablación hormonal o en el estudio fase III controlado con placebo en hombres con osteoporosis. Los síntomas de la hipocalcemia en los estudios clínicos de denosumab incluyeron parestesias o rigidez muscular, contracciones, espasmos y calambres musculares. En estudios clínicos, los pacientes con insuficiencia renal severa (filtración de creatinina < 30 mL/min) o que recibían diálisis tenían mayor riesgo de desarrollar hipocalcemia en ausencia de suplementos de calcio. La ingesta adecuada de calcio y vitamina D es importante en pacientes con insuficiencia renal severa o que reciben diálisis. |
|
Trastornos en la piel y en el tejido subcutáneo |
Eczemab |
Común |
|
|
Trastornos musculoesqueléticos y de tejido conectivo |
Dolor en las extremidades |
Muy común |
|
|
Osteonecrosis mandibular |
Rara |
OM ha sido reportada rara vez e incluye 16 pacientes, en estudios clínicos en osteoporosis y en pacientes con cáncer de mama o próstata que recibieron ablación hormonal, incluyendo un total de 23,148 pacientes (consulte Precauciones generales). 13 de estos casos de OM ocurrieron en mujeres posmenopáusicas con osteoporosis durante la extensión del estudio clínico fase III continuando el tratamiento con PROLIA® hasta 10 años (0.3%; < 0.1 eventos por 100 sujetos-años). El riesgo de OM parece aumentar con la duración de la exposición a PROLIA®. El inicio del tratamiento/nuevo tratamiento debe ser retrasado en pacientes con lesiones de tejido blando abiertas no cicatrizadas en la cavidad bucal. Se recomienda realizar un examen dental con odontología preventiva y una evaluación individual beneficio-riesgo antes del tratamiento con PROLIA® en pacientes con factores de riesgo concomitante. Los siguientes factores de riesgo deben ser considerados al evaluar el riesgo de un paciente de desarrollar OM: - Potencia del medicamento que inhibe la reabsorción ósea (mayor riesgo para compuestos altamente potentes), vía de administración (mayor riesgo para administración parenteral) y dosis acumulativa de la terapia de resorción ósea. - Cáncer, condiciones comórbidas (por ejemplo, anemia, coagulopatías, infección), tratamientos concomitantes para tabaquismo: corticosteroides, quimioterapia, inhibidores de la angiogénesis, radioterapia en la cabeza y cuello. - Higiene bucal deficiente, enfermedad periodontal, prótesis dentales mal ajustadas, antecedentes de enfermedad dental, procedimientos dentales invasivos, por ejemplo, extracciones dentales. |
|
|
Fractura femoral atípica |
Rara |
Se han reportado fracturas femorales atípicas en pacientes que recibieron PROLIA (consulte Reacciones secundarias y adversas). Las fracturas femorales atípicas pueden ocurrir con un pequeño o ningún trauma en las regiones subtrocantérica y diafisaria del fémur. Los hallazgos radiográficos específicos caracterizan estos eventos. También se han reportado fracturas femorales atípicas en pacientes con ciertas enfermedades comórbidas (por ejemplo, deficiencia de vitamina D, artritis reumatoide, hipofosfatasia) y con el uso de ciertos agentes farmacéuticos (por ejemplo, bifosfonatos, glucocorticoides, inhibidores de la bomba de protones). Estos eventos también han ocurrido sin terapia antirresortiva. Fracturas similares reportadas en asociación con bifosfonatos son a menudo bilaterales; por lo tanto, el fémur contralateral debe ser examinado en los pacientes tratados con PROLIA quienes hayan sufrido una fractura del eje femoral. La descontinuación del tratamiento con PROLIA en pacientes con sospecha de fractura atípica del fémur debe considerarse pendiente de evaluación del paciente basándose en una evaluación beneficio-riesgo individual. |
|
|
Múltiples fracturas vertebrales después de la descontinuación del tratamiento con PROLIAc |
Poco común |
a Predominantemente celulitis.
b Incluye dermatitis, dermatitis alérgica, dermatitis atópica y dermatitis de contacto.
c Particularmente en aquellos con historial de fracturas vertebrales.
Inmunogenicidad: Denosumab es un anticuerpo monoclonal humano; como con todas las proteínas terapéuticas, existe un potencial teórico de inmunogenicidad. Más de 13,000 pacientes fueron evaluados en relación con los anticuerpos vinculantes mediante el uso de un inmunoensayo de electroquimioluminiscencia sensible.
Menos del 1% (55 de 8,113) de los pacientes tratados con denosumab por hasta 5 años tuvieron un resultado positivo (incluyendo anticuerpos previamente existentes, transitorios y en desarrollo). Los pacientes con resultado positivo para anticuerpos vinculantes se evaluaron adicionalmente para anticuerpos neutralizantes mediante un ensayo biológico in vitro, basado en células quimioluminiscentes y ninguno de ellos resultó positivo. Ninguna evidencia de alteración en el perfil farmacocinético, perfil de toxicidad o respuesta clínica se asoció con el desarrollo de anticuerpos vinculantes.
Experiencia poscomercialización
|
Clasificación por órgano y sistema |
Término preferido de reacción adversa |
Frecuencia |
Origen/intensidad/gravedad |
|---|---|---|---|
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidada |
Rara |
Durante la poscomercialización, se han reportado eventos raros de hipersensibilidad relacionada con el fármaco, incluyendo erupción cutánea, urticaria, edema facial, eritema y reacciones anafilácticas en pacientes que recibieron PROLIA®. |
|
Trastornos del metabolismo y nutrición |
Hipocalcemia sintomática severab |
Rara |
Durante la poscomercialización, se han notificado casos raros de hipocalcemia sintomática severa predominantemente en pacientes con riesgo aumentado de hipocalcemia que reciben PROLIA®, que en la mayoría de los casos ocurren en las primeras semanas de iniciar el tratamiento. Ejemplos de las manifestaciones clínicas de la hipocalcemia sintomática severa han incluido prolongación del intervalo QT, tetania, convulsiones y alteración del estado mental. |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor musculoesqueléticoc |
Muy común |
Dolor musculoesquelético, incluyendo casos severos, ha sido reportado en pacientes que reciben PROLIA® en el entorno poscomercialización. |
|
Trastornos de la piel y de tejidos blandos |
Alopecia |
Común |
|
|
Erupción liquenoide inducida por fármaco |
Poco común |
Durante la poscomercialización, se han observado erupciones liquenoides inducidas por el fármaco (p. ej., reacciones de liquen plano). |
|
|
Vasculitis por hipersensibilidad |
Muy rara |
||
|
Síndrome de reacción a fármaco con eosinofilia y síntomas sistémicos (DRESS) |
No conocida |
a Incluyendo erupción cutánea, urticaria, edema facial, eritema y reacciones anafilácticas.
b Se han notificado casos que resultan en hospitalizaciones, eventos potencialmente mortales y casos mortales, especialmente en pacientes con insuficiencia renal grave, que reciben diálisis o tratamiento con otros medicamentos que disminuyen las concentraciones de calcio.
c Incluyendo casos severos.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogenicidad: No se ha evaluado el potencial carcinogénico de denosumab en estudios a largo plazo con animales.
Mutagenicidad: El potencial genotóxico del denosumab no ha sido evaluado.
Trastorno de la fertilidad:
Denosumab no tiene efecto alguno en la fertilidad de las hembras o en los órganos reproductores de los machos en monos en las exposiciones que fueron de 100 a 150 veces superiores a la exposición en humanos de 60 mg administrados SC una vez cada 6 meses.
Embarazo: Con exposiciones hasta 100 veces superiores a la exposición humana (60 mg cada 6 meses), el denosumab no mostró evidencia alguna de daño en el feto en los estudios de toxicidad del desarrollo.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: PROLIA® (60 mg SC) no afectó la farmacocinética de midazolam, que se metaboliza por el citocromo P450 3A4 (CYP3A4), lo que indica que no debería afectar a la farmacocinética de los fármacos metabolizados por esta enzima (consulte Farmacocinética y farmacodinamia).
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No conocidas.
PRECAUCIONES GENERALES:
Hipocalcemia: La hipocalcemia debe corregirse antes de iniciar el tratamiento con denosumab. En pacientes con predisposición a la hipocalcemia (como los pacientes con insuficiencia renal [aclaramiento de creatinina < 30 mL/min] que reciben diálisis o tratamiento con otros medicamentos que disminuyen las concentraciones de calcio), se recomienda la monitorización clínica de los niveles de calcio durante el tratamiento, especialmente en las primeras semanas de haber iniciado la terapia.
La ingesta adecuada de calcio y vitamina D es importante en todos los pacientes.
En el contexto posterior a la comercialización, se han notificado casos de hipocalcemia sintomática grave (dando como resultado hospitalizaciones, eventos potencialmente mortales y casos mortales), especialmente en pacientes con insuficiencia renal grave, que reciben diálisis o tratamiento con otros medicamentos que disminuyen las concentraciones de calcio. Aunque la mayoría de los casos se dieron en las primeras semanas tras iniciar el tratamiento, algunos también ocurrieron más tarde.
Infecciones de la Piel: Los pacientes que reciben PROLIA® pueden desarrollar infecciones en la piel (predominantemente celulitis) que pueden llevarlos a la hospitalización. Estos eventos fueron reportados con mayor frecuencia en los grupos de PROLIA® (0.4%) vs.el placebo (0.1%)
La incidencia general de infecciones en la piel fue similar entre los grupos de placebo y denosumab. Se debe asesorar a los pacientes para buscar atención médica inmediata en caso de desarrollar signos o síntomas de celulitis.
Osteonecrosis de la mandíbula (OM):
Los casos de (OM) fueron reportados predominantemente en pacientes con cáncer avanzado los cuales recibían 120 mg cada 4 semanas. La OM se reportó raramente en pacientes con osteoporosis que recibían 60 mg cada 6 meses.
La mala higiene bucal y los procedimientos dentales invasivos (por ejemplo, la extracción dental) fueron factores de riesgo de (OM) en pacientes que recibían PROLIA® en estudios clínicos. El riesgo de OM puede aumentar con la duración de la exposición a PROLIA®.
Es importante evaluar a los pacientes para factores de riesgo de OM antes de comenzar el tratamiento. Si se identifican factores de riesgo, se recomienda un examen dental con una apropiada odontología preventiva, antes de iniciar el tratamiento con PROLIA®. Las buenas prácticas de higiene bucal deben mantenerse durante el tratamiento con PROLIA®.
Deben evitarse procedimientos dentales invasivos durante el tratamiento con PROLIA®. Para pacientes en los que los procedimientos dentales invasivos no se pueden evitar, el juicio clínico del médico tratante debe guiar el plan de manejo de cada paciente en función de la evaluación beneficio/riesgo individual.
En los pacientes en quienes se sospecha o que desarrollan OM, mientras que están usando PROLIA® deben recibir atención de un odontólogo o un cirujano maxilofacial. En los pacientes que desarrollan OM durante el tratamiento con PROLIA®, se debe considerar la interrupción temporal del tratamiento con base en la evaluación individual del riesgo/beneficio hasta que la condición se resuelva.
Se han reportado fracturas femorales atípicas en pacientes que reciben PROLIA®. Las fracturas femorales atípicas pueden ocurrir con poco o ningún trauma en las regiones subtrocantéreas y diafisaria del fémur y pueden ser bilaterales. Hallazgos radiológicos específicos caracterizan estos eventos. Las fracturas femorales atípicas también han sido reportadas en pacientes con ciertas condiciones de comorbilidad (por ejemplo, la deficiencia de vitamina D, artritis reumatoide, hipofosfatasia) y con el uso de ciertos agentes farmacéuticos (por ejemplo, bifosfonatos, glucocorticoides, inhibidores de la bomba de protones). Estos eventos también se han producido sin tratamiento antirresortivo. Durante el tratamiento con PROLIA®, los pacientes deben ser notificados para que reporten dolor nuevo o inusual de muslo, cadera o en la ingle. Los pacientes que presentan estos síntomas deben ser evaluados para una fractura de fémur incompleta, y el fémur contralateral también debe ser examinado. La interrupción del tratamiento debe considerarse para cada caso, evaluando el beneficio/riesgo de manera individual.
Pueden ocurrir fracturas vertebrales múltiples (FVM) después de la descontinuación del tratamiento con PROLIA®, particularmente en pacientes con antecedentes de fractura vertebral.
Aconseje a los pacientes que no interrumpan el tratamiento con PROLIA® sin el consejo de su médico. Evalúe el beneficio/riesgo individual antes de descontinuar el tratamiento con PROLIA®.
Si se descontinúa el tratamiento con PROLIA®, considere la transición a una terapia antirresortiva alternativa.
PROLIA® no se indica para su administración en pacientes pediátricos. En estudios clínicos, se ha reportado hipercalcemia en pacientes pediátricos con osteogénesis imperfecta tratados con denosumab. Algunos casos requirieron la hospitalización (consulte Dosis y Vía de Administración).
Efectos sobre la capacidad para conducir y utilizar maquinaria: No se han llevado a cabo estudios sobre el efecto en la capacidad para conducir o utilizar maquinaria pesada en pacientes que reciben denosumab.
Medicamentos con el mismo ingrediente activo: PROLIA® contiene el mismo principio activo que se encuentra en XGEVA (denosumab). Los pacientes que son tratados con PROLIA®, no deben recibir XGEVA.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Subcutánea.
Administración: La administración debe llevarse a cabo por un individuo que esté capacitado en forma adecuada en técnicas de inyección.
Dosis: La dosis recomendada de PROLIA® para osteoporosis posmenopáusica y pérdida ósea en pacientes que se someten a ablación hormonal por cáncer es una inyección subcutánea de 60 mg administrada una vez cada seis meses.
Los pacientes deberán recibir complementos de calcio y vitamina D mientras se someten al tratamiento.
Poblaciones especiales:
Población pediátrica:
PROLIA® no se indica para su administración en pacientes pediátricos. En estudios clínicos, se ha reportado hipercalcemia de manera muy frecuente en pacientes pediátricos con osteogénesis imperfecta tratados con denosumab. Algunos casos requirieron de hospitalización y se complicaron con una lesión renal aguda (consulte Precauciones generales).
En un estudio de fase III prospectivo, multicéntrico, abierto y con un solo grupo, se evaluó la eficacia, la seguridad y la farmacocinética en niños con osteogénesis imperfecta (OI) de entre 2 y 17 años de edad, de los cuales el 52.3% eran hombres y el 88.2% de raza blanca. Un total de 153 sujetos recibieron inicialmente denosumab 1 mg/kg por vía subcutánea (SC), hasta un máximo de 60 mg cada 6 meses (Q6M) por 36 meses. Los datos clínicos preliminares respaldaron el ajuste de la administración de la dosis de Q6M a cada 3 meses (Q3M). Sesenta sujetos pasaron a la administración de la dosis Q3M.
En el mes 12 de la administración de la dosis Q3M, el cambio medio (error estándar, EE) de los mínimos cuadrados (LS, por sus siglas en inglés) desde el valor inicial del puntaje Z de DMO en la columna lumbar fue de 1.009 (0.119), lo que demuestra un aumento estadísticamente significativo en comparación con los controles históricos.
En este estudio de fase III, los eventos adversos más frecuentes informados durante la administración de la dosis Q6M fueron artralgia (45.8%), dolor en las extremidades (37.9%), dolor de espalda (32.7%) e hipercalciuria (32.0%). Uno de los eventos adversos más frecuentes informados durante la administración de la dosis Q3M fue la artralgia (25.0%). Se informaron casos de hipercalcemia durante la administración de la dosis Q6M (19%) y Q3M (36.7%). En la administración de la dosis Q6M, no se informaron eventos adversos graves de hipercalcemia; sin embargo, sí se informaron eventos adversos graves de hipercalcemia (13.3%) durante la administración de la dosis Q3M.
En un estudio de extensión abierto y prospectivo (N = 75), con el propósito de evaluar la seguridad y la eficacia a largo plazo del tratamiento actual o anterior con denosumab en niños/adultos jóvenes con OI, no se observaron eventos adversos graves de hipercalcemia durante la administración de la dosis de denosumab Q6M ni en grupos alternativos. Sin embargo, se observaron eventos adversos graves de hipercalcemia (18.5%) durante la administración de la dosis de denosumab Q3M.
Los estudios finalizaron de forma anticipada debido a la aparición de eventos potencialmente mortales y a hospitalizaciones producto de la hipercalcemia.
Los primates adolescentes que recibieron una dosis de denosumab entre 27 y 150 veces (dosis 10 y 50 mg/kg) la exposición clínica basada en el ABC tuvieron placas de crecimiento anormales. En monos cynomolgus recién nacidos expuestos en el útero a denosumab 50 mg/kg, hubo un incremento en la mortalidad posnatal; el crecimiento anormal de los huesos que dio como resultado una reducción de la resistencia ósea, reducción de la hematopoyesis, y mala alineación dental; ausencia de ganglios linfáticos periféricos, y disminución del crecimiento del recién nacido. Después de un periodo de recuperación desde el nacimiento hasta los 6 meses de edad, los efectos sobre el hueso volvieron a la normalidad; no hubo efectos adversos sobre la erupción de los dientes; y se observó mineralización de mínima a moderada en múltiples tejidos en un animal de recuperación. En estudios con ratas recién nacidas, la inhibición de RANK/ligando de RANK (RANKL) con un constructo de osteoprotegerina ligado a Fc (OPG-Fc) se ha relacionado con la inhibición del crecimiento óseo y la falta de erupción dental. Por lo tanto, el tratamiento con denosumab puede impedir el crecimiento óseo en niños con placas de crecimiento abiertas y puede inhibir la erupción de la dentición. Se observaron cambios fenotípicos similares en un estudio corroborativo en ratas de 2 semanas de edad, a las que se les administró OPG-Fc. Estos cambios fueron parcialmente reversibles en este modelo al descontinuar la administración de inhibidores de RANKL.
Población geriátrica: Con base en los datos se seguridad y eficacia disponibles en ancianos, no se requiere un ajuste en la dosis (consulte Farmacocinética y farmacodinamia; Propiedades farmacocinéticas: poblaciones de pacientes especiales).
Insuficiencia renal: Con base en los datos de seguridad y eficacia disponibles en ancianos, no se requiere un ajuste en la dosis en pacientes con insuficiencia renal (consulte Farmacocinética y Farmacodinamia; Propiedades farmacocinéticas: poblaciones de pacientes especiales).
Los pacientes con insuficiencia renal severa (tasa de filtración de creatinina menor a < 30 mL/min) o que reciben diálisis se encuentran en un riesgo mayor de desarrollar hipocalcemia. El consumo adecuado de calcio y vitamina D es importante en los pacientes con insuficiencia renal severa o que reciben diálisis.
Insuficiencia hepática: No se han estudiado la seguridad y eficacia de PROLIA® en pacientes con insuficiencia hepática.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
No hay experiencia de sobredosis de ensayos clínicos en humanos. Denosumab se administró en estudios clínicos utilizando dosis de hasta 180 mg cada 4 semanas (dosis acumulativas de hasta 1,080 mg durante 6 meses), y no se observó ningún efecto adverso adicional.
PRESENTACIÓN: Caja con una jeringa prellenada con 60 mg/1 mL, con o sin guarda manual para aguja, en envase de burbuja e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese en refrigeración entre (2 a 8°C).
No congelar.
Mantener la jeringa prellenada dentro de la caja para protegerla de la luz directa.
No agitar.
Si se saca del refrigerador, PROLIA® debe guardarse a una temperatura ambiente controlada (hasta 25 °C) en su caja original, y debe usarse dentro de un periodo de 30 días.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Manténgase fuera del alcance de los niños. Su venta requiere receta médica. No se use PROLIA® durante el embarazo ni la lactancia. No se administre a niños menores de 18 años. La jeringa prellenada no está fabricada con látex de caucho natural.
Reporte cualquier sospecha de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
farmacovigilanciamx@amgen.com
Titular del Registro:
Amgen Inc.
One Amgen Center Drive,
Thousand Oaks, CA 91320, EUA.
Representante Legal:
AMGEN MÉXICO, S.A. de C.V.
Av. Vasco de Quiroga No. 3000,
Piso 4, Col. Santa Fe,
C.P. 01210, Álvaro Obregón,
Ciudad de México, México
Reg. Núm. 067M2011, SSA IV
®Marca registrada