
PROPINORM
CLORHIDRATO DE PROPIVERINA
Cápsulas de liberación prolongada
1 Caja, 7 Cápsulas de liberación prolongada,
1 Caja, 14 Cápsulas de liberación prolongada,
1 Caja, 28 Cápsulas de liberación prolongada,
1 Caja, 56 Cápsulas de liberación prolongada,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada CÁPSULA contiene:
Clorhidrato de propiverina 30 mg
Equivalente a 27.28 mg de propiverina
Excipiente cbp 1 cápsula
Este producto contiene lactosa monohidratada
INDICACIONES TERAPÉUTICAS:
PROPINORM® cápsula está indicado para el tratamiento sintomático de la incontinencia urinaria y/o incremento de la frecuencia y urgencia en pacientes con síndrome de vejiga hiperactiva.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Urología medicamentos para frecuencia e incontinencia urinaria.
Código ATC: G04BD06.
Mecanismo de acción:
Inhibición del flujo de calcio y modulación del calcio intracelular en las células de músculo liso de la vejiga urinaria provocando espasmolisis musculotrópica. Inhibición de la conexión eferente del nervio pélvico debido a su actividad anticolinérgica.
Efectos farmacodinámicos:
En modelos animales, el clorhidrato de propiverina produce un descenso dosis dependiente de la presión intravesical, así como un incremento en la capacidad de la vejiga.
Su actividad se basa en la suma de las propiedades farmacológicas de propiverina y sus tres metabolitos activos a nivel urinario, tal y como se evidencia en franjas aisladas del músculo detrusor en humanos y animales.
Propiedades farmacocinéticas:
Características generales del principio activo:
La propiverina se absorbe casi por completo en el tracto gastrointestinal. Sufre un importante efecto metabólico de primer paso. El efecto sobre las células del músculo liso de la vejiga urinaria se deben al compuesto original y también a tres metabolitos activos, que son rápidamente excretados en la orina.
Absorción:
Tras la administración de PROPINORM® 30 mg por vía oral, la propiverina se absorbe en el tracto gastrointestinal llegando a concentraciones máximas en plasma a las 9.9 horas. La biodisponiblidad absoluta media de PROPINORM® 30 mg es 60.8 ± 17.3% (media aritmética ± DS para AUC0-∞ (p.o.)/AUC0-∞ [IV]).
La ingesta de alimentos no influye en la farmacocinética de propiverina. La biodisponibilidad de propiverina tras la ingesta fue del 99% en comparación con la administración en ayunas. La administración de la cápsula de liberación modificada conduce a una concentración máxima media Cmáx-concentraciones de propiverina de unos 70 ng/mL, y se alcanzan a las 9.5 horas tras su administración. Los valores de Cmáx para el metabolito principal de propiverina, propiverina-N-óxido resultaron ligeramente elevados por la comida (f = 1.26), mientras la absorción permaneció inalterada. Propiverina-N-óxido evidenció para todos los parámetros farmacocinéticos un 90% de los intervalos de confianza en rangos aceptables.
No se requiere ajuste de dosis en relación con la ingesta de alimentos.
Distribución:
Después de la administración de PROPINORM® cápsulas 30 mg, el estado de equilibrio se alcanza a las cuatro o cinco días a un nivel de concentración superior que al cabo de administrar una dosis única (Cpromedio = 71 ng/mL).
El volumen de distribución se determinó en 21 voluntarios sanos tras administración intravenosa de clorhidrato de propiverina en un rango de 125 a 473 L (media 279 L) resultando en que una elevada cantidad de propiverina libre se distribuye hacia los compartimentos periféricos. Propiverina se une a proteínas plasmáticas en un 90-95% y aproximadamente un 60% en el caso de su metabolito principal.
Características farmacocinéticas (media geométrica ± DS) de propiverina en 10 voluntarios sanos tras una dosis única de PROPINORM® 30 mg y PROPINORM® 45 mg en cápsulas de liberación prolongada:
|
Dosis [mg] |
30 |
45 |
|---|---|---|
|
AUC0-∞ [ng×h/mL] |
1,378 (903, 2104) |
1,909 (1002, 3639) |
|
Cmax [ng/mL] |
60.6 (41.5, 88.6) |
80.0 (41.8, 152.1) |
|
t1/2 [h] |
14.2 (10.8, 18.6) |
16.3 (13.9, 19.2) |
|
tmax [h] |
9.9 ± 2.4 |
9.9 ± 2.4 |
Concentraciones plasmáticas de propiverina en 10 voluntarios sanos tras una dosis única de PROPINORM® 30 mg y PROPINORM® 45 mg en cápsulas de liberación prolongada:

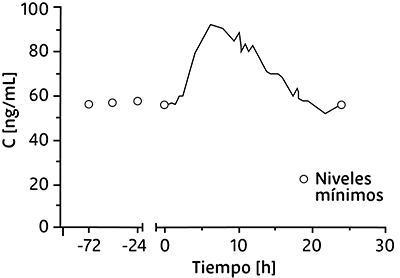
Características del estado de equilibrio para propiverina tras administración de dosis repetida en 24 voluntarios sanos de PROPINORM® 45 mg en cápsulas de liberación prolongada, una vez al día durante 7 días:
|
Media geométrica |
Rango ± DS |
|
|---|---|---|
|
AUC0-24h |
1,711 |
1,079, 2,713 |
|
PTF [%] |
109.4 |
81.2, 147.5 |
|
Cav [ng/mL] |
71 |
45.0, 113.0 |
|
Cmáx [ng/mL] |
105 |
71, 155 |
|
Cmin [ng/mL] |
29 |
20, 42 |
|
t1/2 [h] |
20.4 |
12.8, 32.3 |
|
tmáx [h] |
7.3 |
± 2.5 |
PTF (Peak-trough fluctuation): fluctuación niveles pico-más bajos
Concentraciones plasmáticas de propiverina al día 7 y a diversos niveles tras administración de dosis repetida de PROPINORM® 45 mg cápsulas de liberación prolongada una vez al día durante 7 días:
Biotransformación:
Propiverina es extensamente metabolizada por enzimas intestinales y hepáticas. La principal ruta metabólica produce la oxidación de la piperidil-N mediada por CYP 3A4 y flavin-monooxigenasas (FMO) 1 y 3, y conduce a la formación de un N-óxido mucho menos activo y que excede notablemente la concentración al componente original. En orina se han identificado 4 metabolitos; tres de ellos son farmacológicamente activos y contribuyen a la eficacia terapéutica.
In vitro se detecta una ligera inhibición de CYP 3A4 y CYP 2D6, que se produce a concentraciones que superan de 10 a 100 veces la concentración plasmática terapéutica.
Eliminación:
Tras la administración de una dosis oral de 30 mg de clorhidrato de 14C-propiverina en voluntarios sanos, se recuperó un 60% de radiactividad en orina y un 21% en heces a lo largo de 12 días. En orina se excreta menos del 1% de una dosis oral en forma inalterada. El aclaramiento medio total tras una dosis única de 30 mg es 371 mL/min (191-870 mL/min).
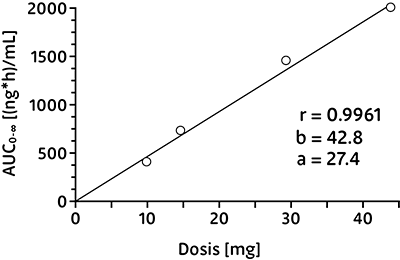
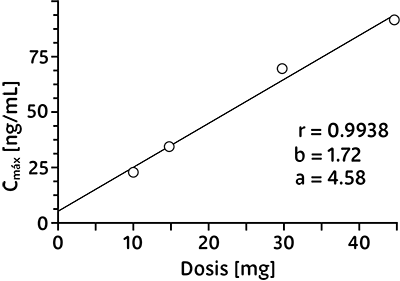
Linealidad/no linealidad:
Los parámetros farmacocinéticos de propiverina tras una administración oral de 10-45 mg de hidrocloruro de propiverina están en relación lineal con la dosis.
Correlación entre la dosis de propiverina oral de liberación prolongada y AUC0-∞ resultante:
Correlación entre la dosis oral de propiverina de liberación prolongada y Cmáx resultante:
Poblaciones especiales:
Insuficiencia renal:
La insuficiencia renal severa no altera de forma significativa la disponibilidad de propiverina y su metabolito principal, propiverina-N-óxido, tal y como se concluye de un estudio a dosis única en 12 pacientes con aclaramiento de creatinina <30 mL/min. No se recomienda ajuste de dosis.Insuficiencia hepática:
Se ha observado un estado de equilibrio similar a nivel farmacocinético en 12 pacientes con insuficiencia hepática leve a moderada debida a esteatosis hepática, cuando se comparan contra 12 sujetos sanos. No se dispone de datos sobre pacientes con insuficiencia hepática severa.
Edad:
La comparación de concentraciones plasmáticas mínimas en estado de equilibrio no muestra diferencias entre los pacientes de edad más avanzada (60-85 años, media 68) y sujetos jóvenes sanos. La proporción de fármaco respecto al metabolito permanece inalterada en los pacientes de edad avanzada, indicando que la edad no es un factor limitante en la conversión metabólica de propiverina hacia su principal metabolito, propiverina-N-óxido, así como tampoco es un factor limitante en la excreción total. Se ha demostrado bioequivalencia entre PROPINORM® 15 mg tabletas recubiertas 3 veces al día y PROPINORM® 45 mg cápsulas de liberación prolongada una vez al día en un ensayo que cumple Buenas Prácticas Clínicas, lo mismo se puede concluir para PROPINORM® 30 mg.
Pacientes con glaucoma:
El tratamiento con PROPINORM® 30 mg no provoca incremento de la presión intraocular en pacientes con glaucoma de ángulo abierto ni en pacientes tratados (controlados) con glaucoma de ángulo cerrado. Esto se ha demostrado en dos estudios controlados con clorhidrato de propiverina 15 mg tabletas recubiertas 3 veces al día contra placebo, durante 7 días.
Datos de seguridad de estudios preclínicos:
En estudios a largo plazo en dos especies mamíferas, el efecto principal relacionado con el tratamiento fue alteración en el hígado (incluida elevación de las enzimas hepáticas). Este efecto se caracterizó por hipertrofia hepática y degeneración grasa. La degeneración grasa resultó reversible tras interrumpir el tratamiento.
CONTRAINDICACIONES:
PROPINORM® está contraindicado en pacientes con hipersensibilidad al fármaco o a cualquiera de los excipientes (este producto contiene lactosa monohidratada), así como en pacientes que padezcan las siguientes alteraciones:
- Obstrucción intestinal.
- Grado significativo de obstrucción de la vejiga donde se puede prever retención urinaria.
- Miastenia grave.
- Atonía intestinal.
- Colitis ulcerativa severa.
- Megacolon tóxico.
- Glaucoma de ángulo cerrado no controlado.
- Insuficiencia hepática de grado moderado o severo.
- Taquiarritmias.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
No se dispone de datos sobre el efecto de propiverina en el embarazo.
Los estudios en animales han evidenciado toxicidad reproductiva. Se recomienda no administrar PROPINORM® 30 mg durante el embarazo.
Lactancia:
Se desconoce si propiverina o sus metabolitos se excretan en la leche humana. Los datos farmacodinámicos/toxicológicos disponibles en animales han evidenciado excreción de propiverina o sus metabolitos en la leche materna. No se puede descartar un riesgo en recién nacidos o lactantes.
Se debe decidir si discontinuar la lactancia o discontinuar/abstenerse de administrar PROPINORM® 30 mg tomando en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS:
Las reacciones adversas se clasifican para cada sistema de órganos afectados en función de su frecuencia, de la siguiente manera:
Muy frecuentes (pueden afectar a ≥1/10 personas).
Frecuentes (pueden afectar desde ≥1/100 a <1/10 personas).
Poco frecuentes (pueden afectar desde ≥1/1,000 a <1/100 pacientes).
Raras (pueden afectar desde ≥1/10,000 a <1/1,000 pacientes).
Muy raras (pueden afectar hasta a 1 de cada 10,000 pacientes).
No conocidas (no pueden estimarse a partir de los datos disponibles).
Todas las reacciones adversas son transitorias y cesan tras una reducción de la dosis o al interrumpir el tratamiento, en un máximo de 1-4 días.
Trastornos del sistema inmunológico:
Rara: hipersensibilidad.
Trastornos psiquiátricos:
Muy raras: agitación, confusión.
No conocida: alucinaciones.
Trastornos del sistema nervioso:
Frecuentes: cefalea.
Poco frecuentes: temblor, mareo, disgeusia.
No conocida: alteración en el habla.
Trastornos oculares:
Frecuentes: trastornos de la acomodación, alteración
visual.
Trastornos cardiacos:
Rara: taquicardia.
Muy raras: palpitaciones.
Trastornos vasculares:
Poco frecuentes: descenso de la presión arterial con somnolencia, enrojecimiento.
Trastornos gastrointestinales:
Muy frecuente: sequedad de boca.
Frecuentes: estreñimiento, dolor abdominal, dispepsia.
Poco frecuentes: náuseas/vómitos.
Trastornos de la piel y del tejido subcutáneo:
Poco frecuentes: prurito.
Rara: erupción.
Trastornos renales y urinarios:
Poco frecuentes: retención urinaria, síntomas en vejiga y uretra.
Trastornos generales y alteraciones en el lugar de administración:
Frecuente: fatiga.
Las enzimas hepáticas deben ser monitoreadas durante el tratamiento a largo plazo, ya que en raras ocasiones pueden producirse alteraciones reversibles en las enzimas hepáticas.
PRECAUCIÓN EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Fertilidad:
No se dispone de datos sobre el efecto de la propiverina en la fertilidad en humanos.
Los estudios en animales no indican efectos nocivos directos o indirectos respecto a la fertilidad.
No se observaron efectos sobre la fertilidad en machos y hembras, ni en el comportamiento durante la reproducción, en los estudios toxicológicos llevados a cabo en ratas.
En estudios en animales, cuando el fármaco se administró por vía oral a dosis elevadas en hembras preñadas, se produjo un retraso esquelético en las camadas. En mamíferos bajo lactancia, propiverina se excretó a través de la leche materna.
No se ha reportado efectos de mutagenicidad.
El estudio de carcinogenicidad llevado a cabo en ratones, evidenció una incidencia elevada de adenoma hepatocelular y carcinoma en dosis altas administradas a machos.
En el estudio de carcinogenicidad llevado a cabo en ratas, tras dosis elevadas se observó adenoma hepatocelular, adenoma renal y papiloma de vejiga urinaria en los machos, mientras las hembras mostraron tras dosis elevadas pólipos en el estroma endometrial. Tanto los tumores en ratón como los de rata se consideraron específicos de la especie y por lo tanto sin relevancia clínica.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Se puede incrementar el efecto de PROPINORM® con la adminsitración concomitante de antidepresivos tricíclicos (p. ej., imipramina), tranquilizantes (p. ej. benzodiacepinas), anticolinérgicos (si se administran vía sistémica), amantadina, neurolépticos (p. ej., fenotiazinas) y agonistas de los beta-adrenoreceptores (beta-simpaticomiméticos).
Puede disminuir el efecto debido a tratamiento concomitante con fármacos colinérgicos.
Se puede presentar disminución de la presión sanguínea en pacientes tratados con isoniazida. Es posible que disminuya el efecto de procinéticos, como la metoclopramida.
Pueden observarse interacciones con otros fármacos que se metabolizan a través del citocromo P4503A4 (CYP 3A4). No obstante, no se espera un incremento significativo en las concentraciones de estos fármacos, ya que el efecto de propiverina es reducido cuando se compara con otros inhibidores enzimáticos clásicos (p. ej., ketoconazol o jugo de toronja). Propiverina puede ser considerada como un inhibidor débil del CYP 3A4. No se han llevado a cabo estudios farmacocinéticos en pacientes sometidos a tratamiento concomitante con inhibidores potentes del CYP 3A4 tales como antifúngicos azólicos (p. ej., ketoconazol, itraconazol) o antibióticos macrólidos (p. ej., eritromicina, claritromicina).
Pacientes en tratamiento concomitante con fármacos inhibidores potentes del CYP 3A4 en combinación con metimazol.
En pacientes en tratamiento con fármacos inhibidores potentes de la flavina monooxigenasa (FMO), tales como metimazol, en combinación con inhibidores potentes del CYP 3A4/5, el tratamiento con propiverina debería iniciarse con dosis de 15 mg/día. La dosis puede ser incrementada posteriormente. Sin embargo, se debe tener precaución y los médicos deben monitorear cuidadosamente a estos pacientes en virtud de potenciales efectos secundarios (véase las secciones Precauciones Generales y Farmacocinética y Farmacodinamia).
TRASTORNOS EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
En raras ocasiones pueden producirse alteraciones reversibles en las enzimas hepáticas.
PRECAUCIONES GENERALES:
PROPINORM® debe ser utilizado con precaución en pacientes que padecen:
• Neuropatía autonómica.
• Insuficiencia renal (ver sección Farmacocinética y Farmacodinamia).
• Insuficiencia hepática (ver sección Farmacocinética y Farmacodinamia).
Tras la administración de propiverina, pueden agravarse los síntomas de las siguientes patologías:
- Insuficiencia cardiaca congestiva severa (NYHA IV).
- Hipertrofia prostática.
- Hernia hiatal con reflujo esofágico.
- Arritmia cardiaca.
- Taquicardia.
La propiverina como otros anticolinérgicos, puede inducir midriasis. Por lo tanto, puede incrementarse el riesgo de inducir glaucoma agudo de ángulo cerrado en individuos con predisposición a ángulo estrecho de la cámara anterior. Se ha reportado inducción de glaucoma agudo de ángulo cerrado con fármacos de esta clase, incluida la propiverina.
Antes del tratamiento, debería ser descartada la presencia de poliaquiuria y nicturia debidas a enfermedad renal o falla cardiaca congestiva, así como patologías orgánicas de la vejiga (p. ej., infecciones del tracto urinario, lesiones malignas).
PROPINORM® contiene lactosa monohidratada y no debe ser tomado por pacientes con problemas hereditarios raros como intolerancia a la galactosa, deficiencia de lactosa de Lapp o mala absorción de glucosa-galactosa.
Efectos en la capacidad de conducir y usar maquinaria:
No se han realizado estudios sobre el efecto para conducir o utilizar máquinas.
Propiverina puede producir somnolencia y visión borrosa. Esto puede limitar la capacidad del paciente para actividades que requieren estar en alerta, como conducir vehículos automotores o maquinaria, o producir un riesgo en el trabajo mientras está en tratamiento con este fármaco.
Los fármacos tranquilizantes pueden potenciar la somnolencia producida por propiverina.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
PROPINORM® cápsulas no debe aplastarse o masticarse.
Posología:
La dosis diaria recomendada es la siguiente:
Adultos: Como dosis habitual se recomienda una cápsula (30 mg hidrocloruro de propiverina) una vez al día.
Uso en personas de edad avanzada: En general no se requiere ajuste de dosis en personas de edad avanzada.
Población pediátrica: Debido a la escasez de datos, este medicamento no está recomendado para su uso en niños.
Se debe tener precaución y los médicos deben monitorear atentamente al paciente en cuanto a los efectos adversos en las siguientes condiciones (ver secciones Precauciones Generales, Interacciones Medicamentosas y de Otro Género y Propiedades Farmacocinéticas):
Uso en insuficiencia renal:
En pacientes con insuficiencia renal leve o moderada, no se requiere ajuste de dosis.
Uso en insuficiencia hepática:
En pacientes con insuficiencia hepática leve, no se requiere ajuste de dosis; sin embargo, debe administrarse el tratamiento con precaución. No se han llevado a cabo estudios para investigar el uso de propiverina en pacientes con insuficiencia hepática moderada a severa, por lo que no se recomienda su uso en este tipo de pacientes.
Pacientes que están recibiendo un tratamiento concomitante con medicamentos que son inhibidores potenciales del CYP 3A4 combinado con metimazol:
En pacientes recibiendo medicamentos que son inhibidores potentes de la flavina monooxigenasa (FMO), tales como metimazol, en combinación con inhibidores potentes del CYP 3A4/5, el tratamiento con propiverina debería iniciar con dosis de 15 mg/día. La dosis puede ser incrementada posteriormente. Sin embargo, se debe tener precaución y los médicos deben monitorear cuidadosamente a estos pacientes en virtud de potenciales efectos secundarios.
Método de administración:
Se toma una cápsula de PROPINORM® a la misma hora cada día con o sin alimentos. La cápsula se debe tragar con un vaso de agua y no se debe aplastar o masticar.
No se observa un efecto importante de la comida en la farmacocinética de PROPINORM® 30 mg con base en ello no hay recomendaciones particulares para la ingesta de PROPINORM® 30 mg en relación con la dieta.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Síntomas:
Una sobredosis con el antagonista del receptor muscarínico propiverina puede potencialmente desencadenar efectos anticolinérgicos severos.
Pueden producirse alteraciones en el sistema nervioso central y periférico tales como:
• Sequedad de boca severa.
• Bradicardia, que puede inducir taquicardia al cabo de un tiempo.
• Midriasis y alteraciones de la acomodación.
• Retención urinaria.
• Inhibición de la motilidad intestinal.
• Inquietud, confusión, alucinaciones, confabulación.
• Mareos, náuseas, alteraciones del habla, debilidad muscular.
Tratamiento:
• En caso de sobredosis por propiverina, el paciente debe ser tratado con carbón activado en suspensión con abundante cantidad de agua.
• El lavado gástrico sólo debe realizarse con intubación protectora con un tubo lubricado (sequedad de la mucosa) y aplicado solamente si es en la hora siguiente a la ingestión de propiverina. No debe inducirse el vómito.
• La diuresis forzada o la hemodiálisis no resulta eficaz para favorecer la eliminación renal.
• En caso de efectos severos centrales de tipo anticolinérgico tales como alucinaciones o excitación masiva, se debe admnistrar un tratamiento antídoto con fisostigmina.
Convulsión o excitación masiva: Tratamiento con benzodiacepinas.
Insuficiencia respiratoria: Tratamiento con respiración asistida.
Retención urinaria: Aplicar cateterización.
Midriasis: Tratamiento con pilocarpina en gotas oftálmicas y/o mantener al paciente en oscuridad.
PRESENTACIONES:
Caja con 7, 14, 28 o 56 cápsulas e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a no más de 25 °C y en lugar seco.
Consérvese en su envase original.
Protéjase de la luz.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. Literatura exclusiva de médicos. No aplastar o masticar. No se deje al alcance de los niños. No se use en embarazo y lactancia. Prohibida la venta fraccionada del producto.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx
y safety.mailbox.mexico@ferring.com
o al tel. 8006241414.
Hecho en Alemania por:
Losan Pharma GmbH
Otto-Hahn-Straβe 13, 15, 79395 Neuenburg, Alemania.
Acondicionado en Alemania por:
Losan Pharma GmbH
Otto-Hahn-Straβe 13, 15, 79395 Neuenburg, Alemania.
Acondicionado en Alemania por:
APOGEPHA Arzneimittel GmbH
Dohnaer Straβe 205, 01257 Dresden, Alemania.
Para:
APOGEPHA Arzneimittel GmbH
Kyffhäuserstraße 27, 01309 Dresden, Alemania.
Distribuido en México por:
Ferring, S.A. de C.V.
Av. Nemesio Diez Riega, Mz 2, Lote 15, No. 15,
Parque Industrial Cerrillo II, C.P. 5200,
Lerma, México, México.
Reg. No. 208M2021 SSA IV