REDEVANT
PITAVASTATINA
Tabletas
1 Caja,7 Tabletas,2 mg
1 Caja,14 Tabletas,2 mg
1 Caja,28 Tabletas,2 mg
1 Caja,7 Tabletas,4 mg
1 Caja,14 Tabletas,4 mg
1 Caja,28 Tabletas,4 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Pitavastatina cálcica equivalente a 2 o 4 mg de pitavastatina
Excipiente, c.b.p. 1 tableta.
Pitavastatina es un nuevo inhibidor de la enzima hidroximetilglutaril coenzima A reductasa (HMG-CoA). Es un agente hipolipemiante sintético para administración oral.
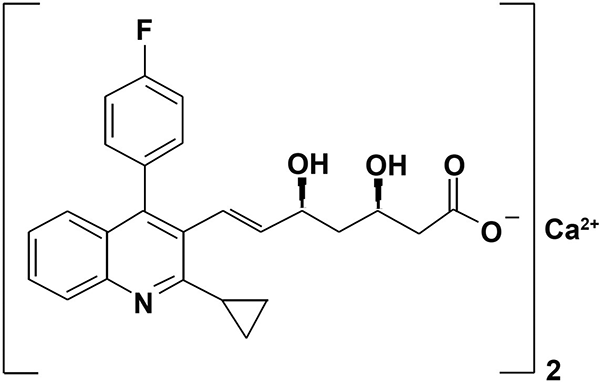
Su nombre químico es (+)-monocalcio bis {(3R, 5S, 6E)-7-[2-ciclopropil-4-(4-fluorofenil)-3-quinolinil] 3,5-dihidroxi-6-heptenoato}, su fórmula empírica es C50H46N2O8F2Ca, con un peso molecular de 880.98 y su fórmula estructural es:
Pitavastatina está disponible en tabletas que contienen 2 y 4 mg de pitavastatina y los siguientes ingredientes inactivos: monohidrato de lactosa, hidroxipropilcelulosa de substitución baja, hipromelosa, metasilicato de aluminio y magnesio, estearato de magnesio y una capa entérica que contiene los siguientes ingredientes inactivos: hipromelosa, dióxido de titanio, trietil citrato y silicio anhidro coloidal.
INDICACIONES TERAPÉUTICAS: Pitavastatina está indicada para pacientes con hipercolesterolemia primaria y dislipidemia mixta (incluyendo Fredrickson IIa, IIb y IV) e hipercolesterolemia heterocigota familiar como adyuvante a la dieta, cuando la respuesta a la dieta y a otros tratamientos no farmacológicos es inadecuada.
Pitavastatina está indicada para pacientes con hipercolesterolemia familiar homocigota como adyuvante a la dieta y a otros agentes hipolipemiantes (por ejemplo, aféresis de LDL).
Pitavastatina reduce colesterol total (TC), lipoproteína de colesterol de baja densidad (LDL-C), apolipoproteína B (Apo B) y triglicéridos (TG) cuando están elevados, e incrementa la lipoproteína de colesterol de alta densidad (HDL-C).
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacodinamia:
Mecanismo de acción: La pitavastatina inhibe competitivamente a la enzima hidroximetilglutaril coenzima A reductasa (HMG-CoA), la enzima que limita la tasa de la biosíntesis de colesterol inhibiendo de esa manera, la síntesis de colesterol en el hígado. Como resultado, la expresión de los receptores de LDL en el hígado se incrementa, promoviendo la captura del LDL circulante en la sangre, disminuyendo el colesterol total y las concentraciones de lipoproteína de colesterol de baja densidad (LDL-C). Además, la inhibición sostenida de la síntesis de colesterol en el hígado reduce la secreción a la sangre de la lipoproteína de colesterol de muy baja densidad (VLDL), reduciendo los niveles plasmáticos de triglicéridos (TG).
Pitavastatina reduce el colesterol total (TC), la lipoproteína de colesterol de baja densidad (LDL-C), la apolipoproteína B (Apo B) y los triglicéridos (TG) elevados e incrementa la lipoproteína de colesterol de alta densidad (HDL-C).
Efecto sobre la conducción cardiaca: Pitavastatina no se asoció con prolongación clínicamente significativa del intervalo QTc o de la frecuencia cardiaca.
Farmacocinética:
Absorción: Las concentraciones plasmáticas máximas de pitavastatina se alcanzan en aproximadamente una hora después de la administración oral. Tanto la Cmax. como el AUC0-inf se incrementaron de manera proporcional a la dosis después de dosis únicas de pitavastatina de 1 a 24 mg una vez al día. La biodisponibilidad absoluta de pitavastatina es del 51%. La administración de pitavastatina con una comida alta en grasas (50% de contenido de grasa) disminuye la Cmax. de pitavastatina en 43% pero no reduce de manera significativa el AUC de pitavastatina. La Cmax. y el AUC de pitavastatina no difieren después de la administración matutina o vespertina. En voluntarios sanos que recibieron 4 mg de pitavastatina, el porcentaje de cambio a partir de la basal en LDL-C después de la dosis vespertina fue ligeramente mayor que después de la dosis matutina. La pitavastatina se absorbe en el intestino delgado y muy poco en el colon.
Distribución: Pitavastatina se une a las proteínas plasmáticas del humano en más del 99%, principalmente a la albúmina y a la glucoproteína alfa 1-ácida, y el volumen de distribución promedio es de aproximadamente 148 L.
Metabolismo: Pitavastatina es metabolizada marginalmente por el CYP2C9 y en menor grado por el CYP2C8. El principal metabolito en plasma humano es la lactona, la cual se forma por vía de un conjugado de glucurónido de pitavastatina tipo éster por la glucuronosiltransferasa de uridina5'-difosfato (UDP) (UGT1A3 y UGT2B7).
Eliminación: La vía principal de excreción son las heces, ya que la excreción urinaria es mínima. La vida media de eliminación plasmática es de aproximadamente 12 horas y el promedio geométrico de depuración es de 43.4 L/h.
Poblaciones especiales:
Raza: En comparaciones farmacocinéticas entre voluntarios caucásicos y japoneses, no hubo diferencias significativas en la concentración máxima (Cmax.) ni en el área bajo la curva (AUC).
En estudios de farmacocinética, la Cmax. y el AUC de pitavastatina fueron 21 y 5% más bajas, respectivamente, en voluntarios sanos negros o afroamericanos en comparación con voluntarios sanos caucásicos.
Género: En un estudio de farmacocinética que comparó voluntarios sanos hombres y mujeres, el AUC de pitavastatina se incrementó 1.5 veces en mujeres. Esto no tuvo ningún efecto sobre la seguridad o eficacia de la pitavastatina en mujeres en los estudios clínicos controlados.
Pacientes ancianos: En un estudio de farmacocinética que comparó voluntarios sanos jóvenes y ancianos (³ 65 años), la Cmax. y el AUC de pitavastatina fueron 10 y 30% más elevados, respectivamente, en el anciano. Esto no tuvo ningún efecto sobre la seguridad o eficacia de la pitavastatina en ancianos en los estudios clínicos controlados.
De los 2,800 pacientes asignados de manera aleatoria a pitavastatina a dosis de 1 a 4 mg en los estudios clínicos controlados, 1,209 (43%) fueron mayores de 65 años. No se observaron diferencias en eficacia o seguridad entre los pacientes ancianos y los pacientes más jóvenes. Sin embargo, una mayor sensibilidad en algunos pacientes de edad avanzada no puede descartarse.
Insuficiencia renal: En pacientes con insuficiencia renal moderada (tasa de filtración glomerular de 30 a < 60 ml/?min/1.73 m2) y en pacientes con enfermedad renal terminal que estaban siendo sometidos a hemodiálisis, el AUC0-inf de pitavastatina fue 79 y 86% más elevada, respectivamente, que aquella observada en voluntarios sanos, mientras que la Cmax. de pitavastatina fue 60 y 40% mayor, respectivamente, que la de voluntarios sanos.
Insuficiencia hepática: En pacientes con insuficiencia hepática leve (Child-Pugh A) el AUC de pitavastatina fue 1.6 veces mayor que en sujetos sanos. En pacientes con insuficiencia hepática moderada (Child-Pugh B) el AUC de pitavastatina fue 3.9 veces más alta que en sujetos sanos.
Estudios clínicos: Hiperlipidemia primaria y dislipidemia mixta.
Estudio de rango de dosis: Un estudio multicéntrico, aleatorio, doble ciego, controlado con placebo, de rango de dosis, fue realizado para evaluar la eficacia de pitavastatina comparada con placebo en 251 pacientes con hiperlipidemia primaria (tabla 1). Pitavastatina, administrada a una dosis única diaria por 12 semanas redujo significativamente los niveles plasmáticos de LDL-C, TC, TG y Apo-B comparada con placebo y se asoció con incrementos variables de HDL-C en todo el rango de dosis.
Tabla 1. Dosis-respuesta en pacientes con hipercolesterolemia primaria (cambio promedio (%) ajustado a partir de la basal en la semana 12)
|
Tratamiento |
N |
LDL-C |
Apo-B |
TC |
TG |
HDL-C |
|
Placebo |
53 |
-3 |
-2 |
-2 |
1 |
0 |
|
Pitavastatina 1 mg |
52 |
-32 |
-25 |
-23 |
-15 |
8 |
|
Pitavastatina 2 mg |
49 |
-36 |
-30 |
-26 |
-19 |
7 |
|
Pitavastatina 4 mg |
51# |
-43 |
-35 |
-31 |
-18 |
5 |
# El número de sujetos para Apo-B fue de 49.
Estudio con control activo (atorvastatina): Pitavastatina fue comparada con el inhibidor de la HMG-CoA reductasa atorvastatina en un estudio de no inferioridad, fase 3, con control activo, aleatorio, multicéntrico, doble ciego, en 817 pacientes con hiperlipidemia primaria o dislipidemia mixta. Los pacientes ingresaron a un periodo de lavado/dieta de 6 a 8 semanas y posteriormente fueron asignados de forma aleatoria a 12 semanas de tratamiento con pitavastatina o atorvastatina.
Los resultados sobre lípidos se muestran en la tabla 2. Con base en el porcentaje de cambio de la basal al punto final en LDL-C, pitavastatina no fue inferior a atorvastatina en las dos comparaciones pareadas: pitavastatina 2 mg vs. atorvastatina 10 mg y pitavastatina 4 mg vs. atorvastatina 20 mg. Las diferencias promedio entre tratamientos fueron de 0% y 1%, respectivamente.
Tabla 2. Respuesta por dosis de pitavastatina y atorvastatina en pacientes con hiperlipidemia primaria o dislipidemia mixta (cambio promedio (%) a partir de la basal en la semana 12)
|
Tratamiento |
N |
LDL-C |
Apo-B |
TC |
TG |
HDLC |
no-HDL-C |
|
Pitavastatina 2 mg/día |
315 |
38 |
30 |
28 |
14 |
4 |
-35 |
|
Pitavastatina 4 mg/día |
298 |
45 |
35 |
32 |
19 |
5 |
-41 |
|
Atorvastatina 10 mg/día |
102 |
38 |
29 |
28 |
18 |
3 |
-35 |
|
Atorvastatina 20 mg/día |
102 |
44 |
36 |
33 |
22 |
2 |
-41 |
Estudio con control activo con simvastatina: Pitavastatina se comparó con el inhibidor de la HMG-CoA reductasa simvastatina en un estudio de no inferioridad, fase 3, con control activo, aleatorio, multicéntrico, doble ciego, en 843 pacientes con hiperlipidemia primaria o dislipidemia mixta. Los pacientes ingresaron a un periodo de lavado/dieta de 6 a 8 semanas y posteriormente fueron asignados de forma aleatoria a 12 semanas de tratamiento con pitavastatina o simvastatina.
Los resultados sobre lípidos se muestran en la tabla 3. En lo que respecta al porcentaje de cambio de la basal al punto final en LDL-C, pitavastatina no fue inferior a simvastatina en las dos comparaciones pareadas: pitavastatina 2 mg vs. simvastatina 20 mg y pitavastatina 4 mg vs. simvastatina 40 mg. Las diferencias promedio entre tratamientos fueron de 4% y 1%, respectivamente.
Tabla 3. Respuesta por dosis de pitavastatina y simvastatina en pacientes con hiperlipidemia primaria o dislipidemia mixta (cambio promedio (%) a partir de la basal en la semana 12)
|
Tratamiento |
N |
LDLC |
ApoB |
TC |
TG |
HDLC |
no-HDL-C |
|
Pitavastatina 2 mg/día |
307 |
39 |
30 |
28 |
16 |
6 |
-36 |
|
Pitavastatina 4 mg/día |
319 |
44 |
35 |
32 |
17 |
6 |
-41 |
|
Simvastatina 20 mg/día |
107 |
35 |
27 |
25 |
16 |
6 |
-32 |
|
Simvastatina 40 mg/día |
110 |
43 |
34 |
31 |
16 |
7 |
-39 |
Estudio con control activo con pravastatina en el anciano: Pitavastatina se comparó con el inhibidor de la HMG-CoA reductasa pravastatina en un estudio de no inferioridad, fase 3, con control activo, aleatorio, multicéntrico, doble ciego, de grupos paralelos, en 942 pacientes ancianos (> 65 años) con hiperlipidemia primaria o dislipidemia mixta. Los pacientes ingresaron a un periodo de lavado/dieta de 6 a 8 semanas y posteriormente fueron asignados de forma aleatoria a 12 semanas de tratamiento con dosis diarias una vez al día de pitavastatina o pravastatina.
Los resultados sobre lípidos se muestran en la tabla 4. Pitavastatina redujo el LDL-C de manera significativa comparado con pravastatina como se demostró con las siguientes comparaciones pareadas de dosis: pitavastatina 1 mg vs. pravastatina 10 mg, pitavastatina 2 mg vs. pravastatina 20 mg y pitavastatina 4 mg vs. pravastatina 40 mg. Las diferencias promedio entre tratamientos fueron de 9%, 10% y 10%, respectivamente.
Tabla 4. Respuesta por dosis de pitavastatina y pravastatina en pacientes con hiperlipidemia primaria o dislipidemia mixta (cambio promedio (%) a partir de la basal en la semana 12)
|
Tratamiento |
N |
LDLC |
ApoB |
TC |
TG |
HDLC |
no-HDL-C |
|
Pitavastatina 1 mg/día |
207 |
31 |
25 |
22 |
13 |
1 |
-29 |
|
Pitavastatina 2 mg/día |
224 |
39 |
31 |
27 |
15 |
2 |
-36 |
|
Pitavastatina 4 mg/día |
210 |
44 |
37 |
31 |
22 |
4 |
-41 |
|
Pravastatina 10 mg/día |
103 |
22 |
17 |
15 |
5 |
0 |
-20 |
|
Pravastatina 20 mg/día |
96 |
29 |
22 |
21 |
11 |
1 |
-27 |
|
Pravastatina 40 mg/día |
102 |
34 |
28 |
24 |
15 |
1 |
-32 |
Estudio con control activo con simvastatina en pacientes con ³ 2 factores de riesgo de enfermedad cardiaca coronaria: Pitavastatina se comparó con el inhibidor de la HMG-CoA reductasa simvastatina en un estudio de no inferioridad, fase 3, con control activo, aleatorio, multicéntrico, doble ciego, en 351 pacientes con hiperlipidemia primaria o dislipidemia mixta con > 2 factores de riesgo de enfermedad coronaria. Después de un periodo de lavado/dieta de 6 a 8 semanas los pacientes fueron asignados de forma aleatoria a 12 semanas de tratamiento con pitavastatina o simvastatina.
Los resultados sobre lípidos se muestran en la tabla 5. En lo que respecta al porcentaje de cambio de la basal al punto final en LDL-C, pitavastatina 4 mg no fue inferior a simvastatina 40 mg. La diferencia promedio entre tratamientos fue de 0%.
Tabla 5. Respuesta por dosis de pitavastatina y simvastatina en pacientes con hiperlipidemia primaria o dislipidemia mixta con ³ 2 factores de riesgo de enfermedad coronaria (cambio promedio (%) a partir de la basal en la semana 12)
|
Tratamiento |
N |
LDLC |
ApoB |
TC |
TG |
HDLC |
no-HDL-C |
|
Pitavastatina 4 mg diarios |
233 |
-44 |
-34 |
-31 |
-20 |
7 |
-40 |
|
Simvastatina 40 mg diarios |
118 |
-44 |
-34 |
-31 |
-15 |
5 |
-39 |
Estudio con control activo con atorvastatina en pacientes con diabetes mellitus tipo 2: Pitavastatina fue comparada con el inhibidor de la HMG-CoA reductasa atorvastatina en un estudio de no inferioridad, fase 3, con control activo, aleatorio, multicéntrico, doble ciego, de grupos paralelos, en 410 pacientes con diabetes mellitus tipo 2 y dislipidemia combinada. Los pacientes ingresaron a un periodo de lavado/dieta de 6 a 8 semanas y posteriormente fueron asignados de forma aleatoria a 12 semanas de una dosis una vez al día de pitavastatina o atorvastatina.
Los resultados sobre lípidos se muestran en la tabla 6. La diferencia promedio entre tratamientos en el porcentaje de cambio en LDL-C de la basal al punto final fue de 2%. Los dos grupos de tratamiento no fueron diferentes de manera estadísticamente significativa.
Tabla 6. Respuesta por dosis de pitavastatina y atorvastatina en pacientes con dislipidemia combinada y diabetes mellitus tipo 2 (cambio promedio (%) a partir de la basal en la semana 12).
|
Tratamiento |
N |
LDLC |
ApoB |
TC |
TG |
HDLC |
no-HDL-C |
|
Pitavastatina 4 mg diarios |
274 |
-41 |
-32 |
-28 |
-20 |
7 |
-36 |
|
Atorvastatina 20 mg diarios |
136 |
-43 |
-34 |
-32 |
-27 |
8 |
-40 |
Meta-análisis vs. rosuvastatina: No existen estudios comparativos directos de pitavastatina y rosuvastatina. Por lo tanto, para comparar pitavastatina con rosuvastatina, se realizó un meta-análisis de bases de datos. Cuando no existe evidencia directa entre dos comparadores o ésta es muy poca, los meta-análisis de bases de datos permiten una síntesis de los datos relevantes de los estudios clínicos disponibles de los tratamientos para apoyar una comparación indirecta entre ellos. Se evaluó la no-inferioridad de pitavastatina comparada con rosuvastatina, con respecto al efecto sobre LDL-C, utilizando un margen de no-inferioridad del 6%.
La diferencia promedio en la reducción de LDL entre pitavastatina a dosis de 4 mg y rosuvastatina a dosis de 10 mg fue de -3.38%. Con base en los resultados de este meta-análisis, se puede concluir que 4 mg de pitavastatina no son inferiores a rosuvastatina para reducir los niveles de LDL-C con base en un margen de no-inferioridad de 6%.
CONTRAINDICACIONES: Pacientes con antecedentes de hipersensibilidad a pitavastatina o a alguno de los componentes de las tabletas de pitavastatina. Reacciones de hipersensibilidad que incluyen erupción cutánea, prurito y urticaria se han reportado con REDEVANT®.
Pacientes con enfermedad hepática activa que puede incluir elevaciones persistentes de los niveles de las transaminasas hepáticas.
Embarazo, lactancia y mujeres que planean embarazarse.
Pacientes que reciben ciclosporina.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: La pitavastatina no debe administrase a mujeres embarazadas o a mujeres que planean embarazarse. La seguridad de pitavastatina en mujeres embarazadas no se ha establecido. En un estudio de pitavastatina en ratas, la administración en los periodos perinatal y lactancia (1 mg/kg y mayores) produjo la muerte de las crías antes del nacimiento en cierto estadio perinatal. En un estudio de administración durante el periodo de organogénesis en conejos, se observó muerte de las crías (dosis de pitavastatina de 0.3 mg/kg y mayores). Se han observado anormalidades del esqueleto en fetos cuando se han administrado dosis altas de un inhibidor de la HMG-CoA reductasa a ratas. En humanos, se ha reportado el desarrollo de alteraciones congénitas del feto cuando se ha administrado un inhibidor de la HMG-CoA reductasa hasta por 3 meses durante el embarazo.
Lactancia: La pitavastatina no debe administrarse a mujeres en periodo de lactancia. Los estudios en animales han mostrado que pitavastatina puede excretarse en la leche materna.
REACCIONES SECUNDARIAS Y ADVERSAS: Los siguientes eventos adversos se discuten con mayor detalle en otras secciones de este documento:
• Rabdomiólisis con mioglobinuria e insuficiencia renal aguda y miopatía (incluyendo miositis) (ver Precauciones generales).
• Alteración de las enzimas hepáticas (ver Precauciones generales).
De los 4,798 pacientes reclutados en 10 estudios clínicos controlados y en 4 estudios subsecuentes de extensión abiertos, a 3,291 pacientes se les administró pitavastatina 1 a 4 mg diarios. La exposición continua promedio de pitavastatina (1 a 4 mg) fue de 36.7 semanas (media 51.1 semanas). La edad promedio de los pacientes fue de 60.9 años (rango; 18 a 89 años) y la distribución por género fue de 48% hombres y 52% mujeres.
Experiencia en los estudios clínicos: Debido a que los estudios clínicos de pitavastatina fueron realizados en varias poblaciones de estudio, y con diseños diferentes, la frecuencia de eventos adversos en los estudios clínicos no se puede comparar directamente con la de los estudios clínicos de otros inhibidores de la HMG-CoA reductasa y puede no reflejar la frecuencia de eventos adversos observada en la práctica clínica.
Los eventos adversos reportados en ³ 2% de los pacientes en estudios clínicos controlados y con mayor o igual frecuencia que placebo se muestran en la tabla 7. Dichos estudios tuvieron una duración de hasta 12 semanas.
Tabla 7. Eventos adversos* reportados en ³ 2.0% de los pacientes tratados con pitavastatina y > placebo en estudios controlados a corto plazo
|
Eventos adversos* |
Placebo |
Pitavastatina 1 mg N = 309 |
Pitavastatina 2 mg |
Pitavastatina 4 mg |
|
Dolor de espalda |
2.9% |
3.9% |
1.8% |
1.4% |
|
Constipación |
1.9% |
3.6% |
1.5% |
2.2% |
|
Diarrea |
1.9% |
2.6% |
1.5% |
1.9% |
|
Mialgia |
1.4% |
1.9% |
2.8% |
3.1% |
|
Dolor en extremidad |
1.9% |
2.3% |
0.6% |
0.9% |
* Término preferido de evento adverso de acuerdo al MedDRA.
Otros eventos adversos reportados en los estudios clínicos fueron artralgia, cefalea, influenza y nasofaringitis.
En los estudios clínicos controlados y en sus extensiones abiertas, 3.9% (1 mg), 3.3% (2 mg) y 3.7% (4 mg) de los pacientes tratados con pitavastatina fueron discontinuados debido a eventos adversos. Los eventos adversos más frecuentes que llevaron a la discontinuación del tratamiento fueron: incremento de creatina fosfocinasa (0.6% con 4 mg) y mialgia (0.5% con 4 mg).
También se han reportado con pitavastatina reacciones de hipersensibilidad incluyendo erupción cutánea, prurito y urticaria.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Datos preclínicos de seguridad: Los datos de los estudios no-clínicos no revelaron ningún riesgo especial para humanos con base en los resultados de los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad y potencial carcinogénico. Pitavastatina no tuvo efecto sobre la fertilidad ni sobre el desempeño reproductivo y no hubo evidencia de potencial teratogénico. Sin embargo, se observó toxicidad materna con dosis altas: un estudio en ratas indicó mortalidad materna a término, o cerca de término, acompañada de muertes fetales y neonatales a dosis de 1 mg/kg/día. En un estudio de administración durante el periodo de organogénesis en conejos, se observó muerte de las crías a dosis de 0.3 mg/kg/día.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Ciclosporina: Ciclosporina incrementa de manera significativa la exposición a pitavastatina. La pitavastatina está contraindicada en pacientes tratados con ciclosporina.
Eritromicina: Eritromicina incrementa de manera significativa la exposición a pitavastatina. En pacientes que toman eritromicina no se debe de exceder la dosis de pitavastatina de 1 mg una vez al día.
Rifampicina: Rifampicina incrementa de manera significativa la exposición a pitavastatina. En pacientes que toman rifampicina no se debe de exceder la dosis de pitavastatina de 2 mg una vez al día.
Gemfibrozilo y otros fibratos: La coadministración de pitavastatina con gemfibrozilo y fenofibrato produjo un ligero incremento en las concentraciones plasmáticas de pitavastatina. La coadministración con bezafibrato no tuvo impacto sobre las concentraciones plasmáticas de pitavastatina. Sin embargo, ya que se conoce que el riesgo de miopatía durante el tratamiento con inhibidores de la HMG-CoA reductasa se incrementa con la administración concomitante de fibratos, la pitavastatina debe administrase con precaución cuando se utiliza de manera concomitante con gemfibrozilo u otros fibratos.
Lopinavir/ritonavir: Con base en los datos de otros inhibidores de la HMG-CoA reductasa que tienen un perfil farmacocinético similar, al de pitavastatina, la coadministración de la combinación de inhibidores de la proteasa, lopinavir/ritonavir, con pitavastatina puede incrementar de manera significativa la exposición a pitavastatina. Por lo tanto, pitavastatina no debe utilizarse con esta combinación de inhibidores de proteasa.
Niacina: El riesgo de efectos sobre el músculo esquelético puede incrementarse cuando pitavastatina se utiliza en combinación con dosis de niacina que modifican los lípidos; se debe considerar una reducción en la dosis de pitavastatina en esta situación.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Las siguientes alteraciones de laboratorio se han reportado: incrementos de creatina fosfocinasa, transaminasas, fosfatasa alcalina, bilirrubina y glucosa.
PRECAUCIONES GENERALES:
Musculoesquelético: Se han reportado casos de miopatía y de rabdomiólisis con insuficiencia renal aguda secundaria a mioglobinuria con los inhibidores de la HMG-CoA reductasa, incluyendo pitavastatina. Dichos eventos adversos pueden presentarse a cualquier nivel de dosis, pero se incrementan de manera dependiente de la dosis.
La pitavastatina debe prescribirse con precaución en pacientes con los siguientes factores predisponentes a rabdomiólisis:
• Insuficiencia renal.
• Hipotiroidismo.
• Antecedentes familiares o personales de trastornos musculares hereditarios.
• Antecedentes de toxicidad muscular previa con un fibrato u otra estatina.
• Antecedentes de enfermedad hepática o de abuso de alcohol.
• Pacientes ancianos.
En dichas circunstancias, se recomienda la vigilancia clínica y se debe de considerar el riesgo del tratamiento en relación con los posibles beneficios.
La pitavastatina debe administrase con precaución en pacientes con insuficiencia renal y en pacientes ancianos.
El riesgo de miopatía y de rabdomiólisis puede incrementarse con la administración concomitante con fibratos o de niacina a dosis que modifican los lípidos por lo que la coadministración con ambos medicamentos debe hacerse con precaución.
El tratamiento con pitavastatina debe ser discontinuado si se presentan elevaciones importantes de creatina cinasa (CK) o si se diagnostica o se sospecha miopatía o rabdomiólisis.
El tratamiento con pitavastatina debe ser suspendido temporalmente en cualquier paciente con una condición aguda grave, sugestiva de una posible miopatía que predisponga al desarrollo de insuficiencia renal secundaria a rabdomiólisis; dichas condiciones pueden incluir; sepsis, hipotensión, deshidratación, cirugía mayor, trauma, trastornos metabólicos, endocrinos o electrolíticos severos, así como convulsiones no controladas.
A todos los pacientes se les debe recomendar reportar de inmediato cualquier dolor, malestar o debilidad muscular, inexplicable, particularmente si se acompaña de fiebre y astenia. Elevación de la CK, dolor, malestar o debilidad muscular pueden ser un signo temprano de miopatía o rabdomiólisis. Se debe hacer una vigilancia estrecha y si es necesario suspender la administración de pitavastatina.
Hígado: Al igual que otros inhibidores de la HMG-CoA reductasa, la pitavastatina debe ser utilizada con precaución en pacientes que consumen cantidades importantes de alcohol.
La enfermedad hepática activa, la cual puede incluir elevaciones persistentes inexplicables de las transaminasas, es una contraindicación para el uso de la pitavastatina (ver Contraindicaciones).
Se recomienda que se realicen determinaciones de enzimas enzimáticas antes del tratamiento y posteriormente con periodicidad.
Los pacientes que desarrollen incrementos en las enzimas hepáticas deben ser vigilados hasta que las alteraciones se resuelvan. Si persiste una elevación en los niveles de ALT o AST > 3 veces el límite superior normal, se recomienda la reducción de la dosis o la suspensión del tratamiento.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis habitual en el adulto: El rango de dosis de pitavastatina en el adulto es de 1 a 4 mg una vez al día, por vía oral, en cualquier momento del día, con o sin alimentos.
La dosis recomendada de inicio es de 2 mg y la dosis máxima es de 4 mg.
Las dosis de inicio y de mantenimiento deben individualizarse de acuerdo con las características del paciente, con el objetivo del tratamiento y con la respuesta al mismo.
Después del inicio o del ajuste de dosis de REDEVANT®, los niveles de lípidos deben ser analizados después de 4 semanas y la dosis ajustada en forma apropiada.
Pacientes con insuficiencia renal: En pacientes con insuficiencia renal moderada (tasa de filtración glomerular de 30 a < 60 ml/min/1.73 m2) y en pacientes con enfermedad renal terminal que están sometidos a hemodiálisis, se debe utilizar una dosis de inicio de pitavastatina de 1 mg diario con una dosis máxima de 2 mg una vez al día. Pitavastatina no debe ser utilizada en pacientes con insuficiencia renal severa (tasa de filtración glomerular < 30 ml/min/1.73 m2) que no estén en hemodiálisis.
Pacientes con insuficiencia hepática: La dosis de pitavastatina debe individualizarse en pacientes con insuficiencia hepática.
Niños: No se ha establecido la seguridad de pitavastatina en niños.
Ancianos: En el anciano aplican las dosis del adulto.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No hay un tratamiento específico en caso de sobredosis. El paciente debe ser tratado sintomáticamente y las medidas de soporte deben ser iniciadas conforme se requieran. La función hepática y los niveles de CK deben ser vigilados. La hemodiálisis es poco probable que sea de beneficio.
PRESENTACIONES:
Caja con 7, 14 y 28 tabletas de 2 mg.
Caja con 7, 14 y 28 tabletas de 4 mg.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. Consérvese en su envase original. No se deje al alcance de los niños. Literatura exclusiva para médicos.
Hecho en EUA por:
Patheon Pharmaceuticals Inc.
2110 East Galbraith Road Cincinnati, Ohio 45237 EUA.
Para:
Kowa Company Ltd., Pharmaceutical Division
3-4-14 Nihonbashi-Honcho, Chuo-ku, Tokio, 103-8433, Japón.
Distribuido por:
ELI LILLY Y COMPAÑÍA DE MÉXICO, S. A. de C. V.
Calzada de Tlalpan No. 2024, Col. Campestre Churubusco, Deleg. Coyoacán, C.P. 04200 México, D.F.
Reg. Núm. 173M2011, SSA IV
Bajo licencia de Kowa Company Ltd.
103300404C0046
® Marca registrada