
REPATHA
EVOLOCUMAB
Solución inyectable
1 Jeringa(s) prellenada(s), 140 mg/ml
1 Pluma precargada, 140 mg/ml
2 Pluma precargada, 140 mg/ml
3 Pluma precargada, 140 mg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
La jeringa prellenada contiene:
Evolocumab 140 mg
Vehículo cbp 1 mL
La pluma precargada contiene:
Evolocumab 140 mg
Vehículo cbp 1 mL
REPATHA® es un anticuerpo monoclonal humano lgG2 de origen ADN recombinante expresado en células de ovario de hámster chino ( CHO).
INDICACIONES TERAPÉUTICAS:
Prevención de eventos cardiovasculares: REPATHA® está indicado en combinación con otras terapias en adultos con enfermedad cardiovascular establecida, para reducir el riesgo de infarto de miocardio, enfermedad vascular cerebral isquémica y revascularización coronaria.
Hipercolesterolemia y dislipidemia mixta: REPATHA® está indicado en adultos con hipercolesterolemia primaria (heterocigoto familiar y no familiar) o dislipidemia mixta y en pacientes pediátricos a partir de 10 años con hipercolesterolemia familiar heterocigótica, como complemento a la dieta.
• En combinación con una estatina o estatina con otras terapias de reducción de lípidos en pacientes que no consiguen alcanzar los niveles objetivo de colesterol de baja densidad (LDL-C por sus siglas en inglés) con la dosis máxima tolerada de estatina, o bien,
• Solo o en combinación con otras terapias de reducción de lípidos en pacientes que son intolerantes a las estatinas, o en los que las estatinas están contraindicadas.
Hipercolesterolemia familiar homocigota: REPATHA® está indicado en adultos y pacientes pediátricos desde los 10 años de edad con hipercolesterolemia familiar homocigota (HFho, por sus siglas en inglés) en combinación con otras terapias de reducción de lípidos.
FARMACOCINÉTICA Y FARMACODINAMIA:
Grupo fármaco-terapéutico: Agentes modificadores de los lípidos, otros agentes modificadores de los lípidos.
Código ATC: C10AX13.
Farmacocinética:
Absorción y distribución: Después de una dosis única subcutánea de 140 mg o 420 mg de evolocumab administrada a adultos sanos, la mediana de concentraciones séricas pico fue alcanzada en 3 a 4 días. La administración de una única dosis subcutánea de 140 mg provocó una Cmáx media (DE) de 13.0 (10.4) μg/mL y una ABCfinal media (DE) de 96.5 (78.7) día• μg/mL. Tres dosis subcutáneas de 140 mg fueron bioequivalentes a una dosis subcutánea única de 420 mg. A partir de modelos farmacocinéticos, se determinó que la biodisponibilidad absoluta tras la administración SC fue del 72%.
Después de una dosis intravenosa única de 420 mg de evolocumab, el volumen de distribución promedio (DE) en estado de equilibrio fue estimado en 3.3 (0.5) L, lo que sugiere que evolocumab tiene una limitada distribución tisular.
Biotransformación: Evolocumab está compuesto únicamente de aminoácidos y carbohidratos como las inmunoglobulinas naturales y es improbable que se elimine a través de mecanismos metabólicos hepáticos. Se prevé que su metabolismo y eliminación sigan las vías de aclaramiento de las inmunoglobulinas, que se degradan en pequeños péptidos y aminoácidos simples.
Eliminación: Se calculó que evolocumab tiene una vida media efectiva de entre 11 a 17 días.
En pacientes con hipercolesterolemia familiar heterocigota (HFHe) que recibían dosis altas de estatinas, la exposición sistémica a evolocumab fue ligeramente inferior que en sujetos que recibían dosis de estatinas entre bajas y moderadas (la relación de ABCfinal 0.74 [IC 90% 0.29; 1.9]). El aumento de aproximadamente el 20% en el aclaramiento se debe en parte a que las estatinas aumentaron la concentración de proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), lo que no afectó negativamente al efecto farmacodinámico de evolocumab en los lípidos. Los análisis farmacocinéticos de la población determinaron que no existían diferencias apreciables en las concentraciones séricas de evolocumab en los pacientes con hipercolesterolemia (hipercolesterolemia no familiar o hipercolesterolemia familiar) que tomaban estatinas de forma concomitante.
Linealidad/no linealidad: Después de una dosis intravenosa única de 420 mg, la media (DE) de depuración sistémica se estimó en 12 (2) mL/h. En estudios clínicos con dosificación subcutánea repetida durante 12 semanas, se observaron incrementos en la exposición proporcionales a la dosis con regímenes de dosificación de 140 mg y mayores. Se observó una acumulación aproximada de dos a tres veces en concentraciones séricas mínimas (Cmín [DE] 7.21 [6.6]) después de dosis de 140 mg cada 2 semanas o después de dosis de 420 mg administradas mensualmente (Cmín [DE] 11.2 [10.8]), y concentraciones séricas mínimas cercanas al estado de equilibrio a las 12 semanas de dosificación.
No se observaron cambios dependientes del tiempo en las concentraciones séricas durante un periodo de 124 semanas.
Poblaciones especiales:
Insuficiencia renal: Como no se sabe que los anticuerpos monoclonales se eliminen a través de vías renales, no se espera que la función renal afecte la farmacocinética de evolocumab.
En un ensayo clínico de 18 pacientes con función renal normal (tasa estimada de filtración glomerular [TFGe] ≥ 90 mL/min/1.73 m2, n = 6), insuficiencia renal grave (TFGe < 30 mL/min/1.73 m2, n = 6), o enfermedad renal en etapa terminal (ESRD) que recibían hemodiálisis (n = 6), la exposición a evolocumab después de una sola dosis subcutánea de 140 mg disminuyó en pacientes con insuficiencia renal grave o ESRD que recibían hemodiálisis. Las reducciones en los niveles de PCSK9 en pacientes con insuficiencia renal grave o ESRD que recibían hemodiálisis fueron similares a aquellos con función renal normal (Ver Dosis y vía de administración, Poblaciones específicas).
Insuficiencia hepática: No se requiere ajuste de la dosis en pacientes con insuficiencia hepática leve (Child-Pugh clase A). La dosis única subcutánea de 140 mg de evolocumab fue estudiada en 8 pacientes con insuficiencia hepática leve, 8 pacientes con insuficiencia hepática moderada, y 8 sujetos sanos. Se encontró que la exposición a evolocumab es aproximadamente 40% a 50% inferior comparada con sujetos sanos. Sin embargo, se encontró que los niveles basales de PCSK9 y el grado y duración de la neutralización de la PCSK9 son similares entre pacientes con insuficiencia hepática leve a moderada y voluntarios sanos. Esto resultó en valores similares tanto para la reducción absoluta de LDL-C como para el intervalo de tiempo necesario para dicha reducción. Evolocumab no se ha estudiado en pacientes con insuficiencia hepática severa (Child-Pugh clase C) (ver Precauciones generales).
Peso corporal: El peso corporal fue una covariable significativa en el análisis farmacocinético de la población afectando a las concentraciones mínimas de evolocumab, sin embargo, no hubo impacto en la reducción del LDL-C. Tras la administración subcutánea repetida de 140 mg cada 2 semanas, las concentraciones mínimas en la semana 12 fueron de un 147% mayores y un 70% menores en pacientes de 69 kg y 93 kg, respectivamente, que la de un paciente estándar de 81 kg. Se observó una menor influencia del peso corporal con dosis mensuales subcutáneas repetidas de 420 mg de evolocumab.
Otras poblaciones especiales: Los análisis farmacocinéticos de la población sugieren que no es necesario ajustar la dosis en función de la edad, la raza o el sexo. La farmacocinética de evolocumab fue influenciada por el peso corporal, pero este hallazgo no tuvo ningún efecto notable en la reducción del LDL-C. Por lo tanto, no es necesario ajustar la dosis en función del peso corporal.
La farmacocinética de REPATHA® se evaluó en 103 pacientes pediátricos de entre ≥ 10 y < 18 años con hipercolesterolemia familiar heterocigótica (HAUSER-RCT). Luego de la administración subcutánea de 420 mg de REPATHA® una vez al mes, las concentraciones séricas mínimas medias (DE) fueron de 20.3 (14.6) μg/mL y 17.6 (28.6) μg/mL en la semana 12 y la semana 80, respectivamente.
Farmacodinamia:
Mecanismo de acción: Evolocumab se enlaza selectivamente a PCSK9 y previene la unión de la PCSK9 circulante con el receptor de lipoproteína de baja densidad (LDLR) localizado sobre la superficie celular del hígado, y de esta forma previene la degradación del LDLR mediada por PCSK9. El incremento en los niveles de LDLR del hígado resulta en reducciones asociadas de colesterol LDL (LDL-C) sérico.
Efectos farmacodinámicos: En estudios clínicos, evolocumab redujo la PCSK9 libre, el LDL-C, el colesterol total (TC), la apolipoproteína B (ApoB), el colesterol no HDL (C-no-HDL), los índices TC/HDL-C y ApoB/ApoA1, el colesterol de muy baja densidad (VLDL-C), los triglicéridos (TG), y la Lp(a), e incrementó el colesterol de alta densidad (HDL-C) y la apolipoproteína A1 (ApoA1) en pacientes con hipercolesterolemia primaria, dislipidemia mixta y enfermedad cardiovascular establecida.
Una administración subcutánea única de 140 mg o 420 mg de evolocumab resultó en supresión máxima de la PCSK9 circulante no-ligada por 4 horas seguida de una reducción en el LDL-C alcanzando una media del nadir de la respuesta de 14 y 21 días, respectivamente. Los cambios en la PCSK9 no-ligada y las lipoproteínas séricas fueron reversibles a la discontinuación de evolocumab. No se observó incremento en la PCSK9 no-ligada o el LDL-C arriba del valor basal durante el periodo de lavado de evolocumab lo que sugiere que los mecanismos compensatorios para incrementar la producción de PCSK9 y LDL-C no ocurren durante el tratamiento.
Los regímenes subcutáneos de 140 mg cada 2 semanas y 420 mg una vez por mes fueron equivalentes en la reducción promedio de LDL-C (media de 10 y 12 semanas), con un resultado de -72% a -57% con respecto a los valores basales en comparación con placebo. El tratamiento con evolocumab resultó en reducciones similares de LDL-C cuando se usó solo o en combinación con otras terapias de reducción de lípidos. El efecto de reducción del LDL-C es sostenido; la duración más prolongada medida fue de 112 semanas.
Eficacia clínica:
Prevención de eventos cardiovasculares: El estudio FOURIER fue un estudio doble ciego, aleatorizado, controlado con placebo, controlado por evento en 27,564 (13,784 REPATHA®, 13,780 placebo) pacientes adultos con enfermedad cardiovascular establecida y con LDL-C ≥ 70 mg/dL y/o HDL-C ≥ 100 mg/dL a pesar del tratamiento con estatinas de intensidad alta o moderada. Los pacientes fueron asignados aleatoriamente 1: 1 para recibir inyecciones subcutáneas de REPATHA® (140 mg cada 2 semanas o 420 mg una vez al mes) o placebo; el 86% usó el régimen de cada 2 semanas a lo largo del estudio. La mediana de seguimiento fue de 26 meses. En general, el 99.2% de los pacientes fueron seguidos hasta el final del estudio o la muerte.
La edad media (DE) al inicio del estudio fue de 63 (9) años, con 45% con al menos 65 años de edad; 25% eran mujeres. La población de prueba fue 85% blanca, 2% negra y 10% asiática; 8% identificado como etnia hispana. En cuanto a los diagnósticos previos de enfermedades cardiovasculares, el 81% tenía infarto de miocardio previo, el 19% tenía ictus no hemorrágico previo y el 13% tenía enfermedad arterial periférica sintomática. Los factores de riesgo iniciales adicionales seleccionados incluyeron hipertensión (80%), diabetes mellitus (1% tipo 1, 36% tipo 2), tabaquismo diario actual (28%), insuficiencia cardiaca congestiva clase I o II de la Asociación Cardiaca de Nueva York (23%) y TFGe < 60 mL/min por 1.73 m2 (6%). La mayoría de los pacientes tomaban una terapia con estatinas alta (69%) o de intensidad moderada (30%) al inicio del estudio, y el 5% también tomaba ezetimiba. La mayoría de los pacientes tomaban al menos otro medicamento cardiovascular, incluidos los antiagregantes plaquetarios (93%), los bloqueadores beta (76%), los inhibidores de la enzima convertidora de angiotensina (ECA) (56%) o los bloqueadores de los receptores de angiotensina (23%). En la terapia de reducción de lípidos basal estable, la mediana [Q1, Q3] de LDL-C al inicio del estudio fue 92 [80, 109] mg/dL; la media (DE) fue de 98 (28) mg/dL.
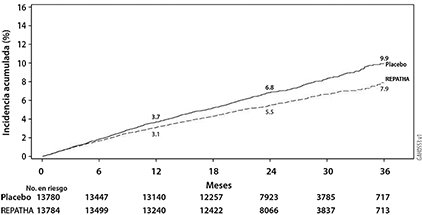
REPATHA® redujo significativamente el riesgo para la variable primaria compuesta (tiempo hasta la primera aparición de muerte cardiovascular, infarto de miocardio, enfermedad vascular cerebral isquémica, hospitalización por angina inestable o revascularización coronaria; p < 0.0001) y la variable secundaria clave compuesta (tiempo hasta la primera aparición de muerte por enfermedad cardiovascular, infarto de miocardio o enfermedad vascular cerebral isquémica; p < 0.0001). Al realizar el análisis individual de la variable primaria compuesta (tiempo hasta la primera aparición de muerte cardiovascular, infarto de miocardio, enfermedad vascular cerebral isquémica, hospitalización por angina inestable o revascularización coronaria) sólo se demostró beneficio en la reducción del riesgo de infarto de miocardio, enfermedad cerebral vascular isquémica y revascularización coronaria. Las estimaciones de Kaplan-Meier de la incidencia acumulada de las variables compuestas primaria y secundaria clave compuesta a lo largo del tiempo se muestran en la Figura 1 y la Figura 2 a continuación.
Los resultados de las variables primaria y secundaria se muestran en la Tabla 1 a continuación.
Tabla 1. Efecto de evolocumab sobre eventos cardiovasculares en pacientes con enfermedad cardiovascular establecida en FOURIER
|
Placebo |
REPATHA® |
REPATHA® vs. placebo |
|||
|
N = 13,780 n (%) |
Tasa de incidencia (por 100 pacientes-años) |
N = 13,784 n (%) |
Tasa de incidencia (por 100 pacientes-años) |
Índice de riesgo (95% CI) |
|
|
Variable primaria compuesta |
|||||
|
Tiempo hasta la primera aparición de muerte cardiovascular, infarto de miocardio, enfermedad vascular cerebral isquémica, revascularización coronaria, hospitalización por angina inestable |
1,563 (11.3) |
5.2 |
1,344 (9.8) |
4.5 |
0.85 (0.79, 0.92) |
|
Variable secundaria clave compuesta |
|||||
|
Tiempo hasta la primera aparición de muerte cardiovascular, infarto de miocardio, enfermedad vascular cerebral isquémica |
1,013 (7.4) |
3.4 |
816 (5.9) |
2.7 |
0.80 (0.73, 0.88) |
|
Otras variables secundarias |
|||||
|
Tiempo hasta la muerte cardiovascular |
240 (1.7) |
0.8 |
251 (1.8) |
0.8 |
1.05 (0.88, 1.25) |
|
Tiempo hasta la muerte por cualquier causaa |
426 (3.1) |
1.4 |
444 (3.2) |
1.5 |
1.04 (0.91, 1.19) |
|
Tiempo hasta el primer infarto de miocardio fatal o no fatal |
639 (4.6) |
2.1 |
468 (3.4) |
1.6 |
0.73 (0.65, 0.82) |
|
Tiempo hasta la primer enfermedad vascular cerebral isquémica fatal o no fatal |
262 (1.9) |
0.9 |
207 (1.5) |
0.7 |
0.79 (0.66, 0.95) |
|
Tiempo hasta la primer revascularización coronaria |
965 (7.0) |
3.2 |
759 (5.5) |
2.5 |
0.78 (0.71, 0.86) |
|
Tiempo hasta la primer hospitalización por angina inestableb |
239 (1.7) |
0.8 |
236 (1.7) |
0.8 |
0.99 (0.82, 1.18) |
a Tiempo hasta la muerte por cualquier causa no es un componente de la variable primaria compuesta o de la variable secundaria clave compuesta.
b No es una variable pre especificada; se realizó un análisis ad hoc para garantizar que se proporcionan resultados para cada componente individual de la variable primaria.
Figura 1. Incidencia acumulada estimada de la variable primaria compuesta durante 3 años en FOURIER
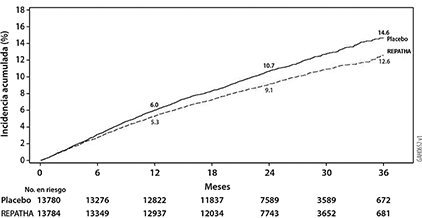
Figura 2. Incidencia acumulada estimada de la variable secundaria clave compuesta durante 3 años en FOURIER
La diferencia entre REPATHA® y placebo en el cambio porcentual medio en LDL-C desde la basal hasta la semana 12 fue de -63% (IC 95%: -63%, -62%) y desde la basal hasta la semana 72 fue -57% (IC 95%: -58%, -56%). En la semana 48, la mediana [Q1, Q3] de LDL-C fue 26 [15, 46] mg/dL en el grupo de REPATHA®, con un 47% de pacientes que tenían LDL-C < 25 mg/dL.
Teniendo en cuenta todas las evaluaciones, entre los pacientes tratados con REPATHA®, 10401 (76%) tenían al menos un valor de LDL-C < 25 mg/dL. Aunque no fue una comparación aleatorizada, el perfil de seguridad fue similar entre pacientes tratados con REPATHA® con LDL-C después de la basal < 25 mg/dL en comparación con pacientes tratados con REPATHA® con LDL-C después de la basal (LDL-C ≥ 40 mg/dL).
En EBBINGHAUS, un subestudio de 1974 pacientes inscritos en el estudio FOURIER, REPATHA® no mostró inferioridad comparado con placebo en dominios seleccionados de funciones cognitivas evaluados con el uso de pruebas de función neuropsicológica durante un seguimiento medio de 19 meses.
Eficacia clínica en hipercolesterolemia primaria y la dislipidemia mixta: Con evolocumab, la reducción de LDL-C de entre el 55% y el 75% aproximadamente se logró incluso en la semana 1 y se mantuvo durante el tratamiento a largo plazo. La respuesta máxima por lo general se obtuvo en el plazo de 1 o 2 semanas tras iniciar el tratamiento con 140 mg cada dos semanas y 420 mg una vez al mes. Evolocumab fue eficaz respecto a placebo y ezetimib en todos los subgrupos, sin diferencias notables entre ellos; los subgrupos estaban determinados por la edad, raza, sexo, región, índice de masa corporal, riesgo según el Programa Nacional de Educación en Colesterol, tabaquismo actual, factores de riesgo de cardiopatía coronaria (CC) basales, antecedentes familiares de CC prematura, tolerancia a la glucosa (es decir, diabetes mellitus de tipo 2, síndrome metabólico o ninguno), hipertensión, dosis e intensidad de estatinas, PCSK9 libre basal, LDL-C basal y TG basal.
En el 80% a 85% de todos los pacientes tratados con cualquiera de estas dosis, evolocumab demostró una reducción de LDL-C ≥ 50% en la media de las semanas 10 y 12. Hasta un 99% de los pacientes tratados con cualquiera de las dosis de evolocumab lograron un LDL-C < 100 mg/dL y hasta un 95% lograron un LDL-C < 70 mg/dL en la media de las semanas 10 y 12.
REPATHA® redujo el LDL-C, C-no-HDL, ApoB, TC, Lp(a), VLDL-C, TG, TC/HDL-C y ApoB/ApoA1 y aumentó el HDL-C en pacientes con dislipidemia mixta.
REPATHA® fue superior a ezetimiba en la reducción de LDL-C, TC, ApoB, C-no-HDL, Lp(a), TC/HDL-C y ApoB/ApoA1.
Combinación con una estatina y con una estatina y otros tratamientos hipolipemiantes: LAPLACE-2 fue un estudio internacional, multicéntrico, doble ciego, aleatorizado y de 12 semanas de duración en el que participaron 1,896 pacientes con hipercolesterolemia primaria o dislipidemia mixta que fueron aleatorizados para recibir evolocumab en combinación con estatinas (rosuvastatina, simvastatina o atorvastatina). Evolocumab se comparó con placebo en los grupos de rosuvastatina y simvastatina, y con placebo y ezetimiba en el grupo de atorvastatina.
REPATHA® redujo significativamente el LDL-C desde el nivel basal hasta la media de las semanas 10 y 12 en comparación con placebo en los grupos de rosuvastatina y simvastatina y en comparación con placebo y ezetimiba en el grupo de atorvastatina (p < 0.001). REPATHA® redujo significativamente el TC, ApoB, C-no-HDL, TC/HDL-C, ApoB/ApoA1, VLDL-C, TG y Lp(a), y aumentó el HDL-C desde el nivel basal hasta la media de las semanas 10 y 12 en comparación con placebo en los grupos de rosuvastatina y simvastatina (p < 0.05); asimismo, redujo significativamente el TC, ApoB, C-no-HDL, TC/HDL-C, ApoB/ApoA1 y Lp(a) en comparación con placebo y ezetimiba en el grupo de atorvastatina (p < 0.001) (ver tablas 2 y 3).
RUTHERFORD-2 fue un estudio internacional, multicéntrico, doble ciego, aleatorizado, controlado con placebo y de 12 semanas de duración en el que participaron 329 pacientes con hipercolesterolemia familiar heterocigótica en tratamiento con fármacos hipolipemiantes. REPATHA® redujo significativamente el LDL-C desde el nivel basal hasta la media de las semanas 10 y 12 en comparación con placebo (p < 0.001). REPATHA® redujo significativamente el TC, ApoB, C-no-HDL, TC/HDL-C, ApoB/ApoA1, VLDL-C, TG y Lp(a), y aumentó el HDL-C y ApoA1 desde el nivel basal hasta la media de las semanas 10 y 12 en comparación con placebo (p < 0.05) (ver tabla 2).
Tabla 2. Efectos del tratamiento con evolocumab en comparación con placebo en pacientes con hipercolesterolemia primaria y dislipidemia mixta - cambio porcentual medio desde el nivel basal hasta la media de las semanas 10 y 12 (%, IC 95%)
|
Estudio |
Régimen de dosis |
LDL-C (%) |
C-no-HDL (%) |
ApoB (%) |
TC (%) |
Lp(a) (%) |
VLDL-C (%) |
HDL-C (%) |
TG (%) |
ApoA1 (%) |
Relación TC/HDL-C% |
Relación ApoB/ApoA1% |
|
LAPLACE-2 (HMD) (grupos de rosuvastatina, simvastatina y atorvastatina combinadas) |
140 mg Q2W (N = 555) |
-72b (-75; -69) |
-60b (-63; -58) |
-56b (-58; -53) |
-41b (-43; -39) |
-30b (-35; -25) |
-18b (-23; -14) |
6b (4; 8) |
-17b (-22; -13) |
3b (1; 5) |
-45b (-47; -42) |
-56b (-59; -53) |
|
420 mg QM (N = 562) |
-69b (-73; -65) |
-60b (-63; -57) |
-56b (-58; -53) |
-40b (-42; -37) |
-27b (-31; -24) |
-22b (-28; -17) |
8b (6; 10) |
-23b (-28; -17) |
5b (3; 7) |
-46b (-48; -43) |
-58b (-60; -55) |
|
|
RUTHERFORD-2 (HFHe) |
140 mg Q2W (N = 110) |
-61b (-67; -55) |
-56b (-61; -51) |
-49b (-54; -44) |
-42b (-46; -38) |
-31b (-38; -24) |
-22b (-29; -16) |
8b (4; 12) |
-22b (-29; -15) |
7a (3; 12) |
-47b (-51; -42) |
-53 (-58; -48) |
|
420 mg QM (N = 110) |
-66b (-72; -61) |
-60b (-65; -55) |
-55b (-60; -50) |
-44b (-48; -40) |
-31b (-38; -24) |
-16b (-23; -8) |
9b (5; 14) |
-17b (-24; -9) |
5a (1; 9) |
-49b (-54; -44) |
-56b (-61; -50) |
Leyenda: Q2W = una vez cada dos semanas, QM = una vez al mes, HDM = hipercolesterolemia primaria y dislipidemia mixta, HFHe = hipercolesterolemia familiar heterocigótica; a valor de p < 0.05 en comparación con placebo; b valor de p < 0.001 en comparación con placebo.
Pacientes intolerantes a las estatinas: GAUSS-2 fue un estudio internacional, multicéntrico, doble ciego, aleatorizado, controlado con ezetimiba y de 12 semanas de duración en el que participaron 307 pacientes intolerantes a las estatinas o incapaces de tolerar una dosis eficaz de una estatina. REPATHA® redujo significativamente el LDL-C en comparación con ezetimiba (p < 0.001). REPATHA® redujo significativamente el TC, ApoB, C-no-HDL, TC/HDL-C, ApoB/ApoA1 y Lp(a) desde el nivel basal hasta la media de las semanas 10 y 12 en comparación con ezetimiba (p < 0.001) (ver tabla 3).
Tratamiento en ausencia de estatinas: MENDEL-2 fue un estudio internacional, multicéntrico, doble ciego, aleatorizado, controlado con placebo y ezetimiba y de 12 semanas de duración sobre la administración de REPATHA® en el que participaron 614 pacientes con hipercolesterolemia primaria y dislipidemia mixta. REPATHA® redujo significativamente el LDL-C desde el nivel basal hasta la media de las semanas 10 y 12 en comparación con placebo y ezetimiba (p < 0.001). REPATHA® redujo significativamente el TC, ApoB, C-no-HDL, TC/HDL-C, ApoB/ApoA1 y Lp(a) desde el nivel basal hasta la media de las semanas 10 y 12 en comparación con placebo y ezetimiba (p < 0.001) (ver tabla 3).
Tabla 3. Efectos del tratamiento con evolocumab en comparación con ezetimiba en pacientes con hipercolesterolemia primaria y dislipidemia mixta - cambio porcentual medio desde el nivel basal hasta la media de las semanas 10 y 12 (%, IC 95%)
|
Estudio |
Régimen de dosis |
LDL-C (%) |
C-no-HDL (%) |
Apo B (%) |
TC (%) |
Lp(a) (%) |
VLDL-C (%) |
HDL-C (%) |
TG (%) |
ApoA1 (%) |
Relación TC/HDL-C% |
Relación ApoB/ApoA1% |
|
LAPLACE-2 (HMD) (grupo de atorvastatina combinada) |
140 mg Q2W (N = 219) |
-43c (-50; -37) |
-34c (-39; -30) |
-34c (-38; -30) |
-23c (-26; -19) |
-30c (-35; -25) |
-1 (-7; 5) |
7c (4; 10) |
-2 (-9; 5) |
7c (4; 9) |
-27c (-30; -23) |
-38c (-42; -34) |
|
420 mg QM (N = 220) |
-46c (-51; -40) |
-39c (-43; -34) |
-40c (-44; -36) |
-25c (-29; -22) |
-33c (-41; -26) |
-7 (-20; 6) |
8c (5; 12) |
-8 (-21; -5) |
7c (2; 11) |
-30c (-34; -26) |
-42c (-47; -38) |
|
|
GAUSS-2 (intolerantes a estatinas) |
140 mg Q2W (N = 103) |
-38b (-44; -33) |
-32b (-36; -27) |
-32b (-37; -27) |
-24b (-28; -20) |
-24b (-31; -17) |
-2 (-10; 7) |
5 (1; 10) |
-3 (-11; 6) |
5a (2; 9) |
-27b (-32; -23) |
-35b (-40; -30) |
|
420 mg QM (N = 102) |
-39b (-44; -35) |
-35b (-39; -31) |
-35b (-40; -30) |
-26b (-30; -23) |
-25b (-34; -17) |
-4 (-13; 6) |
6 (1; 10) |
-6 (-17; 4) |
3 (-1; 7) |
-30b (-35; -25) |
-36b (-42; -31) |
|
|
MENDEL-2 (tratamiento en ausencia de estatinas) |
140 mg Q2W (N = 153) |
-40b (-44; -37) |
-36b (-39; -32) |
-34b (-37; -30) |
-25b (-28; -22) |
-22b (-29; -16) |
-7 (-14; 1) |
6a (3; 9) |
-9 (-16; -1) |
3 (0; 6) |
-29b (-32; -26) |
-35b (-39; -31) |
|
420 mg QM (N = 153) |
-41b (-44; -37) |
-35b (-38; -33) |
-35b (-38; -31) |
-25b (-28; -23) |
-20b (-27; -13) |
-10 (-19; -1) |
4 (1; 7) |
-9 (-18; 0) |
4a (1; 7) |
-28b (-31; -24) |
-37b (-41; -32) |
Leyenda: Q2W = una vez cada dos semanas, QM = una vez al mes, HDM = hipercolesterolemia primaria y dislipidemia mixta; a valor de p < 0.05 en comparación con ezetimiba; b valor de p < 0.001 en comparación con ezetimiba; c valor nominal de p < 0.001 en comparación con ezetimiba.
Eficacia a largo plazo en la hipercolesterolemia primaria y la dislipidemia mixta: DESCARTES fue un estudio internacional, multicéntrico, doble ciego, aleatorizado, controlado con placebo y de 52 semanas de duración en el que participaron 901 pacientes con hiperlipidemia controlados únicamente con dieta o bien que seguían un tratamiento con atorvastatina o una combinación de atorvastatina y ezetimiba. REPATHA®, en dosis de 420 mg una vez al mes, redujo significativamente el LDL-C respecto al valor basal a las 52 semanas en comparación con placebo (p < 0.001). Los efectos del tratamiento continuaron durante 1 año, como lo demuestra la reducción del LDL-C desde la semana 12 a la 52. La reducción del LDL-C respecto al valor basal en la semana 52 en comparación con placebo no variaba en función del tratamiento hipolipemiante optimizado según los niveles de LDL-C y el riesgo cardiovascular que tenía el paciente.
REPATHA® redujo significativamente el TC, ApoB, C-no-HDL, TC/HDL-C, ApoB/ApoA1, VLDL-C, TG y Lp(a), y aumentó el HDL-C y ApoA1 en la semana 52 en comparación con placebo (p < 0.001) (tabla 4).
Tabla 4. Efectos del tratamiento con evolocumab en comparación con placebo en pacientes con hipercolesterolemia primaria y
dislipidemia mixta - cambio porcentual medio desde el nivel basal hasta la semana 52 (%, IC 95%)
|
Estudio |
Régimen de dosis |
LDL-C (%) |
C-no-HDL (%) |
ApoB (%) |
TC (%) |
Lp(a) (%) |
VLDL-C (%) |
HDL-C (%) |
TG (%) |
ApoA1 (%) |
Relación TC/HDL-C% |
Relación ApoB/ApoA1% |
|
DESCARTES |
420 mg QM (N = 599) |
-59b (-64; -55) |
-50b (-54; -46) |
-44b (-48; -41) |
-33b (-36; -31) |
-22b (-26; -19) |
-29b (-40; -18) |
5b (3; 8) |
-12b (-17; -6) |
3a (1; 5) |
-37b (-40; -34) |
-46b (-50; -43) |
Leyenda: QM = una vez al mes; a valor nominal de p < 0.001 en comparación con placebo; b valor de p < 0.001 en comparación con placebo.
OSLER y OSLER-2 fueron dos estudios de extensión, abiertos, controlados y aleatorizados para valorar la seguridad y eficacia a largo plazo de REPATHA® en pacientes que finalizaron el tratamiento en un estudio original. En cada estudio de extensión, los pacientes se aleatorizaron 2:1 para recibir REPATHA® más el tratamiento estándar (grupo de evolocumab) o únicamente el tratamiento estándar (grupo control) durante el primer año del estudio. Al final del primer año (semana 52 en OSLER y 48 en OSLER-2), los pacientes entraron al periodo de sólo REPATHA® en el que todos los pacientes recibieron REPATHA® en etiqueta abierta durante 4 años más (OSLER) o 2 año más (OSLER-2).
En OSLER se incluyeron un total de 1,324 pacientes. REPATHA®, en dosis de 420 mg una vez al mes, redujo significativamente el LDL-C respecto al valor basal en la semana 12 y en la semana 52 en comparación con el grupo control (p nominal < 0.001). Los efectos del tratamiento continuaron durante 272 semanas, como lo demuestra la reducción del LDL-C desde la semana 12 del estudio original hasta la semana 260 del estudio de extensión abierto. En OSLER-2 se incluyeron un total de 3,681 pacientes. REPATHA® redujo significativamente el LDL-C respecto al valor basal en la semana 12 y semana 48 en comparación con el grupo de control (p nominal < 0.001). Los efectos del tratamiento fueron continuados, como lo demuestra la reducción del LDL-C desde la semana 12 hasta la 104 del estudio de extensión abierto. REPATHA® redujo significativamente el TC, ApoB, C-no-HDL, TC/HDL-C, ApoB/ApoA1, VLDL-C, TG y Lp(a), y aumentó el HDL-C y ApoA1 desde el nivel basal hasta la semana 52 en OSLER y la semana 48 en OSLER-2 en comparación con el grupo de control (p nominal < 0.001). El LDL-C y otros parámetros lipídicos volvieron al nivel basal en el plazo de 12 semanas tras la interrupción del tratamiento con REPATHA® al comienzo de los estudios OSLER u OSLER-2, sin evidencia de efecto rebote.
TAUSSIG fue un estudio de extensión, de 5 años de duración, abierto y multicéntrico actualmente en curso para valorar la seguridad y eficacia a largo plazo de REPATHA®, como complemento de otros tratamientos hipolipemiantes, en pacientes con hipercolesterolemia familiar (HF) grave, incluida la hipercolesterolemia familiar homocigótica. En total, en el estudio TAUSSIG se incluyeron 194 pacientes con hipercolesterolemia familiar grave (no-HFho) y 106 con hipercolesterolemia familiar homocigótica. Todos los pacientes del estudio se trataron inicialmente con REPATHA® en dosis de 420 mg una vez al mes, excepto los que recibían aféresis de lípidos en el momento de la inclusión, que empezaron con 420 mg de REPATHA® cada dos semanas. La frecuencia de la dosis en los pacientes que no recibían aféresis podía ajustarse hasta 420 mg cada dos semanas en función de la respuesta del LDL-C y los niveles de PCSK9. El uso a largo plazo de REPATHA® tuvo un efecto continuado, como lo demuestra la reducción del LDL-C en pacientes con hipercolesterolemia familiar grave (no-HFho) (ver tabla 5).
Los cambios en los demás parámetros lipídicos (TC, ApoB, C-no-HDL, TC/HDL-C y ApoB/ApoA1) también demostraron el efecto continuado de la administración a largo plazo de REPATHA® en pacientes con hipercolesterolemia familiar grave (no-HFhgo).
Tabla 5. Efecto de evolocumab en el LDL-C en pacientes con hipercolesterolemia familiar grave (no-HFho) - media del cambio porcentual desde el nivel basal hasta la semana 216 de la OLE (y asociada al 95% IC)
|
Población de pacientes (N) |
OLE Semana 12 (n = 191) |
OLE Semana 24 (n = 191) |
OLE Semana 36 (n = 187) |
OLE Semana 48 (n = 187) |
OLE Semana 96 (n = 180) |
OLE Semana 144 (n = 180) |
OLE Semana 192 (n = 147) |
OLE Semana 216 (n = 96) |
|
HF grave (no-HFho) (N = 194) |
-54.9 (-57.4, -52.4) |
-54.1 (-57.0, -51.3) |
-54.7 (-57.4, -52.0) |
-56.9 (-59.7, -54.1) |
-53.3 (-56.9, -49.7) |
-53.5 (-56.7, -50.2) |
-48.3 (-52.9, -43.7) |
-47.2 (-52.8, -41.5) |
Leyenda: OLE = extensión abierta, N (n) = Número de pacientes evaluables (N) y pacientes con valores de LDL-C observados en una visita programada concreta (n) del conjunto de análisis final de la hipercolesterolemia familiar grave (no-HFho).
Aún no se ha establecido la relevancia clínica, incluida la seguridad a largo plazo, de los niveles muy reducidos y continuados de LDL-C (es decir, < 25 mg/dL). Los datos disponibles demuestran que no existen diferencias clínicamente significativas entre los perfiles de seguridad de los pacientes con niveles de LDL-C < 0.25 mg/dL y de los pacientes con niveles de LDL-C más altos (ver Reacciones secundarias y adversas).
Tratamiento de la hipercolesterolemia familiar heterociqótica en pacientes pediátricos:
HAUSER-RCT fue un ensayo aleatorizado, multicéntrico, controlado con placebo, con doble ciego y con grupos paralelos de 24 semanas de duración realizado con 158 pacientes pediátricos de entre 10 y < 18 años con hipercolesterolemia familiar heterocigótica. Los pacientes debían seguir una dieta baja en grasas y estar recibiendo un tratamiento hipolipemiante de base optimizado (dosis óptimas de estatinas, sin requerir aumento de la dosis). Los pacientes inscritos se aleatorizaron en una proporción de 2:1 para recibir por vía subcutánea 420 mg de REPATHA® una vez al mes durante 24 semanas, o bien para recibir placebo.
La variable de eficacia primaria en este ensayo fue el cambio porcentual desde el periodo inicial hasta la semana 24 en el LDL-C. La diferencia entre REPATHA® y placebo en el cambio porcentual medio del LDL-C desde el periodo inicial hasta la semana 24 fue 38% (IC 95%: 45%, 31%; p < 0.0001). La reducción del error estándar (EE) de la media de mínimos cuadrados (p < 0.0001) del LDL-C en la semana 24 con respecto al periodo inicial fue del 44% (2%) en el grupo de REPATHA® y del 6% (3%) en el grupo de placebo. La media de los valores absolutos de LDL-C en la semana 24 fue de 104 mg/dL en el grupo de REPATHA® y de 172 mg/dL en el grupo de placebo. Se observaron reducciones del LDL-C mediante la primera evaluación tras el periodo inicial en el punto temporal de la semana 12 y se mantuvieron durante todo el ensayo.
La variable secundaria de este ensayo fue el cambio porcentual medio desde el periodo inicial hasta las semanas 22 y 24 en el LDL-C, donde la semana 22 refleja el valor máximo y la semana 24 el valor mínimo del intervalo de dosificación una vez al mes por vía subcutánea, y proporciona información sobre el efecto promediado por el tiempo del tratamiento con REPATHA® en todo el intervalo de dosificación. La diferencia del tratamiento de la media de los mínimos cuadrados entre REPATHA® y placebo en el cambio porcentual medio en el LDL-C desde el periodo inicial hasta la media de la semana 22 y la semana 24 fue de un 42% (IC 95%: 48%, 36%; p < 0.0001). Para ver resultados adicionales, consulte la tabla 6.
Tabla 6. Efectos del tratamiento con REPATHA® en comparación con placebo en pacientes pediátricos con hipercolesterolemia familiar heterocigótica - cambio porcentual medio desde el periodo inicial hasta la semana 24 (%, IC 95%)
|
Estudio |
Régimen de dosis |
LDL-C (%) |
C-no-HDL (%) |
ApoB (%) |
Relación TC/HDL-C (%) |
Relación ApoB/ApoA1 (%) |
|
HAUSER-RCT (pacientes pediátricos con HFHe) |
420 mg QM (N = 104) |
-38.3 (-45.5; -31.1) |
-35.0 (-41.8; -28.3) |
-32.5 (-38.8; -26.1) |
-30.3 (-36.4; -24.2) |
-36.4 (-43.0; -29.8) |
QM = una vez al mes (vía subcutánea); IC = intervalo de confianza; LDL-C = colesterol de lipoproteínas de baja densidad; HDL-C = colesterol de lipoproteínas de alta densidad; ApoB = apolipoproteína B; ApoA1 = apolipoproteína A1, TC = colesterol total.
Todos son valores p ajustados < 0.0001.
N = cantidad de pacientes aleatorizados y que recibieron dosis en el conjunto de análisis completo.
HAUSER-OLE fue un estudio abierto, de un solo grupo y multicéntrico de 80 semanas de duración de REPATHA® realizado en 150 pacientes pediátricos de 10 a 17 años con HFHe que procedían del estudio HAUSER-RCT e incluyó a 13 pacientes pediátricos con HFho de novo. Los pacientes debían seguir una dieta baja en grasas y recibir un tratamiento hipolipemiante de base. Todos los pacientes con HFHe del estudio recibieron 420 mg de REPATHA® por vía subcutánea una vez al mes (mediana de la duración de la exposición: 18.4 meses). Los cambios porcentuales medios (EE) en el LDL-C calculados con respecto al periodo inicial fueron los siguientes: -44.4% (1.7%) en la semana 12, - 41.0% (2.1%) en la semana 48 y-35.2% (2.5%) en la semana 80.
Los cambios porcentuales medios (EE) desde el periodo inicial hasta la semana 80 en otras variables lipídicas fueron los siguientes: -32.1% (2.3%) para C-no-HDL, -25.1% (2.3%) para ApoB, - 28.5% (2.0%) para la relación TC/HDL-C, -30.3% (2.2%) para la relación ApoB/ApoA1 y - 24.9% (1.9%) para TC.
Tratamiento de la hipercolesterolemia familiar homocigótica: TESLA fue un estudio internacional, multicéntrico, doble ciego, aleatorizado, controlado con placebo y de 12 semanas de duración en el que participaron 49 pacientes con hipercolesterolemia familiar homocigótica con edades comprendidas entre los 12 y los 65 años. REPATHA®, en dosis de 420 mg una vez al mes, como complemento de otros tratamientos hipolipemiantes (p. ej., estatinas o secuestradores de ácidos biliares), redujo significativamente el LDL-C y ApoB en la semana 12 en comparación con placebo (p < 0.001) (tabla 7). Los cambios observados en los demás parámetros lipídicos (TC, C-no-HDL, TC/HDL-C y ApoB/ApoA1) también demostraron el efecto de la administración de REPATHA® en pacientes con hipercolesterolemia familiar homocigótica.
Tabla 7. Efectos del tratamiento con evolocumab en comparación con placebo en pacientes con hipercolesterolemia familiar homocigótica - cambio porcentual medio desde el nivel basal hasta la semana 12 (%, IC 95%)
|
Estudio |
Régimen de dosis |
LDL-C (%) |
C-no-HDL (%) |
ApoB (%) |
TC (%) |
Lp(a) (%) |
VLDL-C (%) |
HDL-C (%) |
TG (%) |
Relación TC/HDL-C % |
Relación ApoB/ApoA1 % |
|
TESLA (HFho) |
420 mg QM (N = 33) |
-32b (-45; -19) |
-30a (-42; -18) |
-23b (-35; -11) |
-27a (-38; -16) |
-12 (-25; 2) |
-44 (-128; 40) |
-0.1 (-9; 9) |
0.3 (-15; 16) |
-26a (-38; -14) |
-28a (-39; -17) |
Leyenda: HFho = hipercolesterolemia familiar homocigótica, QM = una vez al mes; a valor nominal de p < 0.001 en comparación con placebo; b valor de p < 0.001 en comparación con placebo.
Eficacia a largo plazo en la hipercolesterolemia familiar homocigótica: En el estudio TAUSSIG, el uso a largo plazo de REPATHA® tuvo un efecto continuado, como lo demuestra la reducción del LDL-C de entre el 20% y el 30% aproximadamente en pacientes con hipercolesterolemia familiar homocigótica no sometidos a aféresis y de entre el 10% y el 30% aproximadamente en pacientes con hipercolesterolemia familiar homocigótica sometidos a aféresis (ver tabla 8). Los cambios en los demás parámetros lipídicos (TC, ApoB, C-no-HDL, TC/HDL-C y ApoB/ApoA1) también demostraron el efecto continuado de la administración a largo plazo de REPATHA® en pacientes con hipercolesterolemia familiar homocigótica. Las reducciones del LDL-C y los cambios en los demás parámetros lipídicos en 14 pacientes adolescentes (≥ 12 a < 18 años) con hipercolesterolemia familiar homocigótica son comparables a los de la población global de pacientes con hipercolesterolemia familiar homocigótica.
Tabla 8. Efecto de evolocumab en el LDL-C en pacientes con hipercolesterolemia familiar homocigótica - cambio porcentual medio desde el nivel basal hasta la semana 216 de la OLE (y asociada al 95% IC)
|
Población de pacientes (N) |
OLE Semana 12 |
OLE Semana 24 |
OLE Semana 36 |
OLE Semana 48 |
OLE Semana 96 |
OLE Semana 144 |
OLE Semana 192 |
OLE Semana 216 |
|
HFho (N = 106) |
-21.2 (-26.0, -16.3) (n = 104) |
-21.4 (-27.8, -15.0) (n = 99) |
-27.0 (-32.1, -21.9) (n = 94) |
-24.8 (-31.4, -18.3) (n = 93) |
-25.0 (-31.2, -18.8) (n = 82) |
-27.7 (-34.9, -20.5) (n = 79) |
-27.4 (-36.9, -17.8) (n = 74) |
-24.0 (-34.0, -14.0) (n = 68) |
|
Sin aféresis (N = 72) |
-22.7 (-28.1, -17.2) (n = 70) |
-25.8 (-33.1, -18.5) (n = 69) |
-30.5 (-36.4, -24.7) (n = 65) |
-27.6 (-35.8, -19.4) (n = 64) |
-23.5 (-31.0, -16.0) (n = 62) |
-27.1 (-35.9, -18.3) (n = 60) |
-30.1 (-37.9, -22.2) (n = 55) |
-23.4 (-32.5, -14.2) (n = 50) |
|
Con aféresis (N = 34) |
-18.1 (-28.1, -8.1) (n = 34) |
-11.2 (-24.0, 1.7) (n = 30) |
-19.1 (-28.9, -9.3) (n = 29) |
-18.7 (-29.5, -7.9) (n = 29) |
-29.7 (-40.6, -18.8) (n = 20) |
-29.6 (-42.1, -17.1) (n = 19) |
-19.6 (-51.2, 12.1) (n = 19) |
-25.9 (-56.4, 4.6) (n = 18) |
Leyenda: OLE = extensión abierta, N (n) = Número de pacientes evaluables (N) y pacientes con valores de LDL observados en una visita programada concreta (n) del conjunto de análisis final de la HFho.
HAUSER-OLE fue un ensayo abierto, de un solo grupo y multicéntrico de 80 semanas de duración realizado con 12 sujetos con HFho para evaluar la seguridad, la tolerabilidad y la eficacia de REPATHA® en la reducción del LDL-C en pacientes pediátricos de entre ≥ 10 y < 18 años con hipercolesterolemia familiar homocigótica. Los pacientes debían seguir una dieta baja en grasas y recibir un tratamiento hipolipemiante de base. Todos los pacientes del estudio recibieron 420 mg de REPATHA® por vía subcutánea una vez al mes. La mediana (Q1, Q2) de LDL-C al inicio fue de 398 (343; 475) mg/dL. La mediana (Q1, Q3) del cambio porcentual en el LDL-C desde el periodo inicial hasta la semana 80 fue de -14% (-41; 4). Se observaron reducciones del LDL-C en la primera evaluación en la semana 12 y se mantuvieron durante todo el ensayo; la mediana (Q1, Q3) de las reducciones oscilaba entre un 12% (-3; 32) y un 15% (-4; 39). Para ver resultados adicionales, consulte la tabla 9.
Tabla 9. Efectos del tratamiento con evolocumab en comparación con placebo en pacientes con hipercolesterolemia familiar homocigótica - mediana (Q1, Q3) del cambio porcentual desde el periodo inicial hasta la semana 80
|
Estudio |
Régimen de dosis |
LDL-C (%) |
C-no-HDL (%) |
ApoB (%) |
Relación TC/HDL-C (%) |
Relación ApoB/ApoA1 % |
|
HAUSER-OLE (pacientes pediátricos con HFHo) |
420 mg QM (N = 12) |
-14.3 (-40.6; 3.5) |
-13 (-40.7; 2.7) |
-19.1 (-33.3; 11.6) |
-3.7 (-41.6; 7.6) |
-3 (-35.7; 9.3) |
QM = una vez al mes (vía subcutánea); LDL-C = colesterol de lipoproteínas de baja densidad; HDL-C = colesterol de lipoproteínas de alta densidad; ApoB = apolipoproteína B; ApoA1 = apolipoproteína A1, TC = colesterol total.
N = cantidad de pacientes aleatorizados y que recibieron dosis en el conjunto de análisis intermedio.
Regresión de la aterosclerosis: GLAGOV fue un estudio de fase 3, doble ciego, aleatorizado, controlado con placebo para evaluar los efectos del tratamiento con REPATHA® en la enfermedad aterosclerótica coronaria medida por ultrasonido intravascular (IVUS).
Era necesario que los pacientes incluidos en el estudio recibieran terapia hipolipemiante basal estable y que tuvieran un LDL-C ≥ 80 mg /dL o LDL-C ≥ 60 a < 80 mg/dL con un factor de riesgo mayor o tres factores de riesgo cardiovasculares menores. Estos pacientes tenían enfermedad arterial coronaria y requirieron angiografía coronaria.
Un total de 970 pacientes fueron aleatorizados 1:1 en dos grupos de tratamiento para recibir REPATHA® 420 mg una vez al mes o placebo una vez al mes en inyecciones subcutáneas durante 76 semanas. La ecografía intravascular se realizó al inicio del estudio y en la semana 78. Un total de 27.8% de los pacientes eran mujeres, y 93.8% eran de etnia blanca. La edad media (DE) fue de 59.8 (9.2) años. La media (SD) de LDL-C al inicio fue de 92.6 (27.3) mg/dL.
REPATHA® redujo el porcentaje de volumen de ateroma (PAV, por sus siglas en inglés) y el volumen total de ateroma (TAV, por sus siglas en inglés) desde el inicio hasta la semana 78 en comparación con placebo. La regresión de aterosclerosis, definida como cualquier reducción en PAV o TAV en la semana 78, se observó en más pacientes tratados con REPATHA® que los pacientes tratados con placebo.
Los resultados del estudio se muestran en la tabla 10, a continuación:
Tabla 10. Efectos del tratamiento de evolocumab en comparación con placebo en pacientes con hiperlipidemia - cambio en el volumen de ateroma porcentual y el volumen total de ateroma desde el inicio hasta la semana 78
|
Variable |
Tipo de resumen |
Placebo QM (N = 423) |
REPATHA® 420 mg QM (N = 423) |
Diferencia de tratamiento (REPATHA® – placebo) |
|
Cambios en PAV (%)a |
Media ajustada (95% IC) |
0.05 (-0.32, 0.42) |
-0.95 (-1.33, -0.58) |
-1.01c (-1.38, -0.64) |
|
Cambios en TAV (mm3)b |
Media ajustada (95% IC) |
-0.91 (-3.29, 1.47) |
-5.80 (-8.19, -3.41) |
-4.89c (-7.25, -2.53) |
|
Regresión en PAVb |
n (%) (95% IC) |
200 (47.3) (42.6, 52.0) |
272 (64.3) (59.6, 68.7) |
17.0c (10.3, 23.5) |
|
Regresión en TAVb |
n (%) (95% IC) |
207 (48.9) (44.2, 53.7) |
260 (61.5) (56.7, 66.0) |
12.5d (5.8, 19.1) |
QM = una vez al mes.
a Variable primaria.
b Variable secundaria.
c Valor-p < 0.0001.
d Valor-p = 0.0002.
La diferencia de tratamiento en la reducción del LDL-C entre REPATHA® y placebo fue del 68.7% (IC del 95%: 64.7%, 72.7%) desde el inicio hasta la semana 78. Estas reducciones se mantuvieron hasta el final del estudio. Las concentraciones medias correspondientes de LDL-C (DE) en la semana 78 fueron 29.2 (27.6) mg/dL en el grupo de REPATHA®.
Con base en un análisis ad-hoc, las concentraciones más bajas de LDL-C logradas durante el estudio se asociaron con una mayor regresión de la aterosclerosis, medida por la reducción en PAV.
Efecto sobre la morfología de la aterosclerosis coronaria: Los efectos de la dosis de 420 mg de REPATHA® una vez al mes sobre la aterosclerosis coronaria, según lo evaluado mediante una tomografía óptica de coherencia (OCT, por sus siglas en inglés), se analizaron en un estudio de 52 semanas, doble ciego, aleatorizado y controlado con placebo en el que se incluyó a pacientes adultos y que inició en el plazo de 7 días desde que se presentó el síndrome coronario agudo sin elevación del segmento ST (NSTEACS, por sus siglas en inglés), que se trató con la dosis máxima tolerada de estatinas. En el caso de la variable primaria de cambio absoluto en el FCT (grosor de la capa fibrosa) mínimo en un segmento correspondiente de arteria con respecto al periodo inicial, la media (IC 95%) de los mínimos cuadrados (LS) aumentó 42.7 μm (32.4, 53.1) con respecto al periodo inicial en el grupo de REPATHA® y 21.5 μm (10.9, 32.1) en el grupo de placebo, lo que corresponde a 21.2 μm (4.7, 37.7) adicionales en comparación con placebo (p = 0.015; 38% de diferencia [p = 0.041]). Los hallazgos secundarios informados muestran diferencias en el tratamiento que incluyen un cambio en la media del FCT mínimo (aumento de 32.5 μm (12.7, 52.4); p = 0.016) y un cambio absoluto en el arco lipídico máximo (-26º (-49.6, -2.4); p = 0.041).
Efectos en el LDL-C durante la fase aguda del síndrome coronario agudo (SCA): EVOPACS fue un estudio en un solo país, multicéntrico, doble ciego, aleatorizado, controlado con placebo, de 8 semanas de duración, en el que participaron 308 pacientes con SCA en los que se inició tratamiento con evolocumab en el hospital, entre las 24 y las 72 horas desde el inicio del SCA.
Si los pacientes no estaban recibiendo tratamiento con estatinas o estaban recibiendo un tratamiento con estatinas diferente de atorvastatina 40 mg antes de la selección, éste se interrumpía y se iniciaba un tratamiento con atorvastatina 40 mg una vez al día. La aleatorización se estratificó según el centro de estudio y según la presencia de tratamiento estable con estatinas en un plazo ≥ 4 semanas previas a la inscripción. La mayoría de los pacientes (241 [78%]) no estaba recibiendo un tratamiento estable con estatinas en las ≥ 4 semanas previas a la selección y la mayoría (235 [76%]) no estaba recibiendo estatinas en el periodo inicial. En la semana 4, 281 (97%) pacientes estaban recibiendo un tratamiento con estatinas de alta intensidad. Evolocumab, en dosis de 420 mg una vez al mes, redujo significativamente el LDL-C desde el periodo inicial hasta la semana 8 en comparación con placebo (p < 0.001). La reducción media (DE) en el LDL-C calculado desde el periodo inicial hasta la semana 8 fue del 77.1% (15.8%) en el grupo de evolocumab y de un 35.4% (26.6%) en el grupo de placebo, con una diferencia media de mínimos cuadrados (LS) (IC 95%) del 40.7% (36.2%, 45.2%). Los valores iniciales de LDL-C fueron de 3.61 mmol/L (139.5 mg/dL) en el grupo de evolocumab y de 3.42 mmol/L (132.2 mg/dL) en el grupo de placebo. Las reducciones de LDL-C en este estudio fueron coherentes con estudios previos en los que se adicionó evolocumab a un tratamiento hipolipemiante estable, como lo demostraron los niveles de LDL-C durante el tratamiento en la semana 8 de este estudio (lo que refleja el efecto estable del tratamiento con estatinas de alta intensidad en ambos grupos de tratamiento), de 0.79 mmol/L (30.5 mg/dL) y 2.06 mmol/L (79.7 mg/dL) en los grupos de evolocumab más atorvastatina y de placebo más atorvastatina, respectivamente.
Los efectos de evolocumab en esta población de pacientes fueron coherentes con los observados en estudios previos en el programa de desarrollo clínico de evolocumab y no se detectaron nuevos problemas de seguridad.
CONTRAINDICACIONES: Hipersensibilidad al principio activo o a los componentes de la fórmula.
Hipersensibilidad al látex.
No se use en el embarazo, lactancia ni en niños menores de 10 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No hay datos o éstos son limitados relacionados con el uso de REPATHA® en mujeres embarazadas.
Los estudios en animales no sugieren efectos directos ni indirectos en términos de toxicidad para la reproducción (ver Precauciones en relación con efectos de carcinogénesis, mutagénesis y sobre la fertilidad).
REPATHA® no debe utilizarse durante el embarazo.
Lactancia: Se desconoce si evolocumab se excreta en la leche materna.
No se puede excluir el riesgo en recién nacidos/niños alimentados mediante lactancia materna.
Se debe decidir si es necesario interrumpir la lactancia materna o interrumpir/no iniciar el tratamiento con REPATHA® tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad: Las reacciones adversas del medicamento notificadas con mayor frecuencia durante los estudios pivotales a las dosis recomendadas, fueron nasofaringitis (7.4%), infección respiratoria del tracto superior (4.6%), dolor de espalda (4.4%), artralgia (3.9%), gripe (3.2%) y reacciones en el sitio de inyección (2.2%). El perfil de seguridad de la población con hipercolesterolemia familiar homocigótica fue consistente con lo demostrado en la población con hipercolesterolemia primaria y dislipidemia mixta.
Lista tabulada de reacciones adversas: Las reacciones adversas notificadas en los estudios clínicos pivotales controlados en pacientes con hipercolesterolemia primaria y dislipidemia mixta, enfermedad cardiovascular establecida e hipercolesterolemia familiar homocigótica y reportes espontáneos se muestran por frecuencia, y por clasificación por órganos y sistemas en la tabla 11. Las reacciones adversas se enlistan por clase de órganos y sistemas y por frecuencia. Las categorías de frecuencia se definen como: muy frecuente (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1,000 a < 1/100), raras (≥ 1/10,000 a < 1/1,000) y muy raras (< 1/10,000).
Tabla 11. Reacciones adversas
|
Sistema de clasificación por órganos y sistemas (SOC) MedDRA |
Reacciones adversas |
Categoría de frecuencia |
|
Infecciones e infestaciones |
Gripe |
Frecuentes |
|
Nasofaringitis |
Frecuentes |
|
|
Infección respiratoria del tracto superior |
Frecuentes |
|
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Frecuentes |
|
Erupción cutánea |
Frecuentes |
|
|
Urticaria |
Poco frecuentes |
|
|
Trastornos del sistema nervioso |
Dolor de cabeza |
Frecuentes |
|
Trastornos gastrointestinales |
Náuseas |
Frecuentes |
|
Trastornos de la piel y del tejido subcutáneo |
Angioedema |
Raro |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor de espalda |
Frecuentes |
|
Artralgia |
Frecuentes |
|
|
Mialgia |
Frecuentes |
|
|
Trastornos generales y alteraciones en el lugar de la administración |
Reacciones en la zona de inyección1 |
Frecuentes |
|
Enfermedad similar a la influenza |
Poco frecuentes |
1 Ver Descripción de reacciones adversas seleccionadas.
Descripción de reacciones adversas seleccionadas:
Reacciones en la zona de inyección: Las reacciones más frecuentes en el lugar de la inyección fueron hematoma, eritema, hemorragia, dolor en el lugar de la inyección e inflamación.
Población pediátrica: Se ha establecido la seguridad y la eficacia de REPATHA® en pacientes pediátricos con hipercolesterolemia familiar heterocigótica y homocigótica. Para evaluar los efectos de REPATHA®, se realizó un estudio clínico en 158 pacientes pediátricos de entre ≥ 10 y < 18 años con hipercolesterolemia familiar heterocigótica. No se identificaron nuevos problemas de seguridad y los datos de seguridad en esta población pediátrica fueron coherentes con el perfil de seguridad conocido del producto en adultos con hipercolesterolemia familiar heterocigótica. Veintiséis pacientes pediátricos que presentaban hipercolesterolemia familiar homocigótica recibieron un tratamiento con REPATHA® en los estudios clínicos realizados en pacientes de entre ≥ 10 y < 18 años. No se observó ninguna diferencia en la seguridad entre los pacientes pediátricos y adultos con hipercolesterolemia familiar homocigótica.
Población de edad avanzada: De los 18,546 pacientes tratados con evolocumab en los estudios clínicos doble ciego; 7,656 (41.3%) tenían ≥ 65 años y 1,500 (8.1%) ≥ 75 años. En general, no se observaron diferencias en la seguridad ni la eficacia entre estos pacientes y los pacientes más jóvenes.
Inmunogenicidad: En estudios clínicos, el 0.3% de los pacientes (48 de 17,992 pacientes) tratados con al menos una dosis de evolocumab dieron positivo para el desarrollo de anticuerpos de unión. Los pacientes cuyos sueros dieron positivo para anticuerpos de unión se evaluaron adicionalmente para anticuerpos neutralizantes y ninguno de los pacientes dio positivo para anticuerpos neutralizantes.
No hubo pruebas de que la presencia de anticuerpos antiadherentes afectara el perfil farmacocinético, la respuesta clínica o la seguridad de REPATHA®, pero se desconocen las consecuencias a largo plazo del tratamiento con REPATHA® en presencia de anticuerpos que se unen a fármacos.
No se detectó desarrollo de anticuerpos de antievolocumab en ensayos clínicos con pacientes pediátricos tratados con REPATHA®.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Fertilidad: No hay datos disponibles sobre el efecto de evolocumab en la fertilidad humana. Los estudios en animales no mostraron efecto alguno sobre las variables de fertilidad en el área bajo la curva de concentración-tiempo (ABC) de niveles de exposición mucho más altos que en pacientes que reciben evolocumab en dosis de 420 mg una vez al mes.
Evolocumab no fue carcinogénico en hámsteres con exposiciones muy superiores a las de los pacientes que recibían evolocumab a dosis de 420 mg una vez al mes. No se ha evaluado el potencial mutagénico de evolocumab.
En hámsteres y monos macacos con exposiciones muy superiores a las de los pacientes que recibían evolocumab a dosis de 420 mg una vez al mes, no se observaron efectos sobre la fertilidad de los machos ni de las hembras.
En monos macacos con exposiciones muy superiores a las de los pacientes que recibían evolocumab en dosis de 420 mg una vez al mes, no se observaron efectos sobre el desarrollo embriofetal ni posnatal (hasta los 6 meses de edad).
A excepción de una respuesta dependiente de anticuerpos de las células T en monos macacos inmunizados con hemocianina de lapa californiana (KLH, por sus siglas en inglés) después de 3 meses de tratamiento con evolocumab, no se observaron efectos adversos en hámsteres (hasta los 3 meses) ni en monos macacos (hasta los 6 meses) con exposiciones muy superiores a las de los pacientes que recibían evolocumab en dosis de 420 mg una vez al mes. En estos estudios, el efecto farmacológico pretendido sobre la disminución del LDL-C y colesterol total en suero fue observado y fue reversible tras la interrupción del tratamiento.
No se observaron efectos adversos en combinación con rosuvastatina durante 3 meses en monos macacos con exposiciones muy superiores a las de los pacientes que recibían 420 mg de evolocumab una vez al mes. Las reducciones del LDL-C y colesterol total en suero fueron más pronunciadas que las observadas anteriormente con evolocumab solo, y reversibles tras la interrupción del tratamiento.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se han realizado estudios de interacción medicamentosa.
La interacción farmacocinética entre las estatinas y evolocumab fue evaluada en los ensayos clínicos. Se observó un incremento aproximado de 20% en la depuración de evolocumab en pacientes coadministrados con estatinas. Este aumento en la depuración es en parte mediado por el efecto de las estatinas que incrementan la concentración de PCSK9, hecho que no impactó adversamente el efecto de farmacodinamia de evolocumab sobre los lípidos. No se requiere ajuste a la dosis de la estatina cuando se usa en combinación con evolocumab.
No se han realizado estudios de interacciones farmacocinéticas ni farmacodinámicas entre evolocumab y fármacos hipolipemiantes distintos de las estatinas y la ezetimiba.
En ausencia de estudios de compatibilidad, este medicamento no debe ser mezclado con otros productos medicinales.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Ninguna conocida.
PRECAUCIONES GENERALES:
Efectos sobre la capacidad para conducir y usar maquinaria: La influencia de REPATHA® sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. Trazabilidad: Con objeto de mejorar la trazabilidad de los medicamentos biotecnológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
Insuficiencia hepática: En pacientes con insuficiencia hepática moderada se observó una reducción en la exposición total a evolocumab que puede dar lugar a una disminución del efecto sobre la reducción de los niveles de LDL-C. Por lo tanto, en estos pacientes se debe garantizar un estrecho seguimiento.
Los pacientes con insuficiencia hepática grave (Child-Pugh clase C) no han sido estudiados (ver Precauciones en relación con efectos de carcinogénesis, mutagénesis y sobre la fertilidad). Evolocumab se debe usar con precaución en pacientes con insuficiencia hepática grave.
Caucho natural: La cubierta de la aguja de la jeringa de vidrio prellenada y de la pluma precargada está fabricada con caucho natural (un derivado del látex), que puede causar reacciones alérgicas graves.
Contenido de sodio: Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, es decir, esencialmente “sin sodio”.
DOSIS Y VÍA DE ADMINISTRACIÓN: Antes de iniciar el tratamiento con evolocumab, se deben excluir las causas secundarias de la hipercolesterolemia o dislipidemia mixta (p. ej., el síndrome nefrótico y el hipotiroidismo).
Posología:
Enfermedad cardiovascular establecida en adultos:
La dosis recomendada de evolocumab es 140 mg cada 2 semanas o 420 una vez al mes; ambas dosis son clínicamente equivalentes.
Hipercolesterolemia primaria y dislipidemia mixta (incluida la hipercolesterolemia familiar heterocigótica):
Pacientes y adultos pediátricos (a partir de 10 años).
La dosis recomendada de evolocumab es 140 mg cada 2 semanas o 420 mg una vez al mes; ambas dosis son clínicamente equivalentes.
Hipercolesterolemia familiar homocigótica en pacientes adultos y pediátricos de 10 años de edad y mayores: La dosis inicial recomendada es 420 mg una vez al mes. Después de 12 semanas de tratamiento, la frecuencia de la dosificación se puede ajustar al alza a 420 mg cada dos semanas si no se obtiene una respuesta clínicamente significativa. Los pacientes en aféresis pueden iniciar el tratamiento con 420 mg cada 2 semanas para que coincida con su programa de aféresis.
Poblaciones especiales:
Pacientes de edad avanzada (≥ 65 años de edad):
No se necesita ajuste de la dosis en pacientes de edad avanzada.
Pacientes con insuficiencia renal: No se necesita ajuste de la dosis en pacientes con insuficiencia renal (vea Farmacocinética y farmacodinamia, poblaciones especiales).
Pacientes con insuficiencia hepática: No se necesita ajuste de la dosis en pacientes con insuficiencia hepática leve (ver Farmacocinética y farmacodinamia, Farmacocinética) para pacientes con insuficiencia hepática moderada y severa.
Población pediátrica: No se ha establecido la seguridad ni la eficacia de REPATHA® en pacientes pediátricos menores de 10 años con hipercolesterolemia familiar heterocigótica (HFHe) o hipercolesterolemia familiar homocigótica (HFho), ni en pacientes pediátricos con otros tipos de hiperlipidemia.
Instrucciones de uso importantes:
Vía de administración: Subcutánea.
Evolocumab se debe administrar mediante inyección subcutánea en el abdomen, el muslo o la parte superior del brazo. Se deben alternar las zonas de inyección y descartar aquellas donde la piel presente dolor a la palpación, equimosis, eritema o induración.
Evolocumab no se debe administrar por vía intravenosa ni intramuscular, ni coadministrarse con otros medicamentos inyectables en el mismo sitio de administración.
La dosis de 420 mg una vez al mes o cada dos semanas se debe administrar utilizando tres jeringas prellenadas o tres plumas precargadas administradas consecutivamente dentro de un intervalo de 30 minutos.
REPATHA® está pensado para que el paciente se lo autoadministre después de recibir una capacitación adecuada. La administración de evolocumab también puede realizarla una persona que haya sido capacitada para administrar el medicamento.
Cada jeringa prellenada o pluma precargada es de un solo uso.
Precauciones especiales de eliminación y otras manipulaciones:
La solución debe examinarse antes de su administración. No se debe inyectar la solución si contiene partículas, o si está turbia o presenta algún cambio de color. Para evitar las molestias en la zona de inyección, se debe dejar que el medicamento alcance la temperatura ambiente (hasta 25 ºC) antes de la inyección. Se debe inyectar todo el contenido de la jeringa prellenada o pluma precargada. La pluma precargada está diseñada para entregar el contenido completo como una dosis fija o única.
Cualquier producto medicinal no utilizado o material de desecho debe ser eliminado en cumplimiento con los requisitos locales.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No se observaron efectos adversos en estudios en animales con exposiciones hasta 300 veces superiores a las de los pacientes tratados con dosis de evolocumab de 420 mg una vez al mes.
No hay tratamiento específico para sobredosis de evolocumab. En caso de sobredosis, se debe iniciar el tratamiento según los signos y síntomas clínicos del paciente y se deberán instituir medidas de cuidado de soporte acorde a lo requerido.
PRESENTACIONES: Las cubiertas de la aguja de la jeringa prellenada y la pluma precargada están hechas de caucho natural (un derivado del látex), (ver Precauciones generales).
REPATHA® se presenta como:
• Caja de cartón con una jeringa prellenada con 140 mg/mL.
• Caja de cartón con 1, 2 o 3 pluma (s) precargada(s) Sure Click con 140 mg/mL.
Todas las presentaciones con instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Mantener en refrigeración (2 °C a 8 °C). No se congele.
Conservar la jeringa prellenada o la pluma precargada en la caja original con la intención de protegerlo de la luz.
Si se saca del refrigerador, REPATHA® debe ser almacenado a temperatura ambiente (hasta 25 °C) en la caja de cartón original y deberá ser usado en un lapso de 30 días. Una vez transcurrido este periodo el producto deberá desecharse.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Mantener fuera del alcance de los niños. Su venta requiere receta médica. No se use durante el embarazo, la lactancia, ni en menores de 10 años. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. Si no se administra todo el producto, deséchese el sobrante.
Reportar reacciones adversas por correo electrónico a: farmacovigilancia@cofepris.gob.mx y
farmacovigilanciamx@amgen.com
Titular del Registro:
Amgen Inc.
One Amgen Center Drive,
Thousand Oaks, California (CA) 91320, EUA.
Representante Legal:
AMGEN MÉXICO, S.A. de C.V.
Av. Vasco de Quiroga No. 3000,
Piso 4, Col. Santa Fe,
C.P. 01210, Álvaro Obregón,
Ciudad de México, México
Reg. Núm. 223M2016 SSA IV