
RYZODEG
INSULINA DEGLUDEC
Solución inyectable
1 Caja, 1 Pluma precargada, 3 ml, 100 U/ml
1 Caja, 5 Pluma precargada, 3 ml, 100 U/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada ml contiene:
Insulina degludec*/Insulina 100 U (2.56 mg insulina
asparta* 70/30 (70% insulina degludec y 1.05 mg
degludec y 30% insulina insulina asparta)
asparta)
Vehículo, cbp 1 ml
FlexTouch® Una pluma precargada contiene 300 unidades de insulina degludec/insulina asparta en 3 ml de solución.
*Análogos de Insulinas de origen ADN recombinante expresado en Saccharomyces cerevisiae*.
INDICACIONES TERAPÉUTICAS: Tratamiento de diabetes mellitus tipo 1 y 2 en adultos.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
Absorción: Después de la inyección subcutánea, se forman multihexámeros solubles y estables de insulina degludec, los cuales forman un depósito de insulina en el tejido subcutáneo, que a la vez no interfieren con la liberación rápida de monómeros de insulina asparta hacia la circulación. Los monómeros de insulina degludec se separan gradualmente de los multihexámeros resultando en una lenta y continua liberación de insulina degludec en la circulación. La concentración sérica en estado de equilibrio del componente basal (insulina degludec) se alcanza después de 2-3 días de la administración diaria de RYZODEG®.
RYZODEG® mantiene las características de absorción rápida de la insulina asparta consolidada. El perfil farmacocinético de la insulina asparta aparece 14 minutos después de la inyección, con una concentración máxima tras 72 minutos.
Distribución: La afinidad de insulina degludec con la albúmina sérica corresponde a una unión a proteínas plasmáticas > 99%. La insulina asparta tiene una baja unión a proteínas plasmáticas (< 10%), similar a aquélla observada con la insulina humana regular.
Bio-transformación: La degradación de insulina degludec e insulina asparta es similar a aquélla observada con la insulina humana; todos los metabolitos formados son inactivos.
Eliminación: La vida media después de la administración subcutánea de RYZODEG® está determinada por la tasa de absorción del tejido subcutáneo. La vida media del componente basal (insulina degludec) en estado de equilibrio es de 25 horas, independientemente de la dosis.
Linealidad: La exposición total con RYZODEG® se incrementa proporcionalmente con el aumento de la dosis del componente basal (insulina degludec) y del componente para el momento de los alimentos (insulina asparta) en la diabetes mellitus tipo 1 y tipo 2.
Género: No existen diferencias de género en las propiedades farmacocinéticas de RYZODEG®.
Pacientes de edad avanzada, raza, insuficiencia renal y hepática: No se observan diferencias clínicamente relevantes en la farmacocinética de RYZODEG® entre los pacientes de edad avanzada y los pacientes adultos, entre razas o entre sujetos sanos y pacientes con insuficiencia renal o hepática.
Población Pediátrica: Las propiedades farmacocinéticas de RYZODEG® en la diabetes mellitus tipo 1 fueron investigadas en niños (6-11 años de edad) y adolescentes (12-18 años de edad), y fueron comparadas con los adultos después de una administración de dosis.
La exposición total y la concentración máxima de insulina asparta son mayores en los niños en comparación con los adultos, y son similares para los adolescentes y adultos.
Las propiedades farmacocinéticas de la insulina degludec en niños y adolescentes fueron comparables a aquéllas observadas en adultos con diabetes mellitus tipo 1. Sin embargo, la exposición total de insulina degludec después de la administración de una dosis única es mayor en niños y adolescentes que en adultos con diabetes mellitus tipo 1.
Propiedades farmacodinámicas:
Código ATC: A10AD06.
Clase farmacológica: Medicamentos utilizados para la diabetes. Insulinas y análogos inyectables de acción intermedia o prolongada combinados con los de acción rápida.
RYZODEG® es una insulina soluble compuesta por insulina degludec (insulina basal de acción ultraprolongada) e insulina asparta (insulina prandial de acción rápida) administrada en una inyección.
Mecanismo de acción: Insulina degludec e insulina asparta se unen específicamente al receptor de insulina humana y producen los mismos efectos farmacológicos que ésta.
El efecto hipoglucemiante de la insulina se debe a que facilita la absorción de la glucosa al unirse a los receptores de insulina en las células musculares y adiposas, y a que inhibe al mismo tiempo la producción hepática de glucosa.
Efectos farmacodinámicos: El efecto farmacodinámico de RYZODEG® está claramente diferenciado para cada uno de los dos componentes (ver figura 1) y el perfil resultante de la acción refleja a los componentes individuales, insulina asparta de acción rápida e insulina degludec de acción ultraprolongada.
El componente basal de RYZODEG® (insulina degludec) forma multihexámeros solubles cuando se inyecta por vía subcutánea, dando lugar a la formación de un depósito desde donde se absorbe a la circulación insulina degludec de forma continua y lenta, produciendo un efecto hipoglucemiante, ultraprolongado, plano y estable. Este efecto se mantiene en la coformulación con insulina asparta y no interfiere con los monómeros de insulina asparta de acción rápida.
RYZODEG® tiene un inicio de acción rápida que ocurre tan pronto como se administra la inyección que cubre la comida, mientras que el componente basal tiene un perfil de acción plano y estable que proporciona una cobertura continua de las necesidades de insulina basal. La duración de la acción de una sola dosis de RYZODEG® es superior a 24 horas.
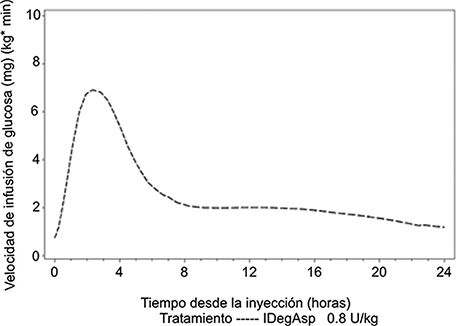
Figura 1. Farmacodinamia, Dosis única-perfil medio de la velocidad de infusión de la glucosa-pacientes con diabetes Tipo 1-0.8 U/Kg RYZODEG®-Estudio 3539.
Los efectos hipoglucemiantes totales y máximos de RYZODEG® incrementan linealmente con dosis ascendentes. El estado de equilibrio ocurre después de 2-3 días de la administración de dosis.
No se observa ninguna diferencia en el efecto farmacodinámico de RYZODEG® entre los pacientes de edad avanzada y los más jóvenes.
Datos de eficacia y seguridad clínica: Se realizaron cinco estudios clínicos multinacionales, aleatorizados, controlados, abiertos, y de tratamiento a metas con una duración de 26 a 52 semanas en los cuales se expuso a un total de 1360 pacientes con diabetes mellitus (362 pacientes con diabetes mellitus tipo 1 y 998 pacientes con diabetes mellitus tipo 2). RYZODEG® administrado una vez al día (o.d.) más antidiabéticos orales (ADO) fue comparado contra insulina glargina (IGlar) (o.d.) más ADO en dos estudios clínicos de diabetes mellitus tipo 2 (Tabla 2). Se comparó administración de RYZODEG® dos veces al día (b.i.d.) más ADO con la administración de insulina asparta bifásica 30 (BIAspB 30) dos veces al día (b.i.d.) más ADO en dos estudios de diabetes mellitus tipo 2 (Tabla 3). También se comparó RYZODEG® 0D más insulina asparta (IAsp) con insulina detemir una vez al día (o.d.) o insulina detemir (IDet) dos veces al día más IAsp en la diabetes mellitus tipo 1 (Tabla 4).
Se confirmó la no inferioridad del cambio en la HbA1c del valor basal hasta el término del tratamiento en todos los estudios con respecto a todos los comparadores, cuando se trató a los pacientes hasta alcanzar el objetivo.
En dos estudios en los que se combinó insulina y tratamiento con ADO en pacientes sin tratamiento previo con insulina (inicio de la insulina) y con uso de insulina (intensificación de la insulina) con diabetes mellitus tipo 2, RYZODEG® una vez al día mostró un control glucémico similar (HbA1c) en comparación con IGlar (administrado como se indica en la etiqueta) Tabla 2.
Debido a que RYZODEG® contiene una insulina de acción rápida en el momento de los alimentos (insulina asparta), ésta mejora el control glucémico prandial en la dosis de la comida en relación con la administración de sólo insulina basal; véanse los resultados de estudio en la Tabla 2. Se observó una tasa inferior de hipoglucemia (definida como episodios entre la media noche y las 6 a.m. confirmados mediante una glucosa plasmática < 3.1 mmol/L o que el paciente requiera ayuda de terceros) con RYZODEG® en relación con IGlar (Tabla 2).
La administración de RYZODEG® b.i.d. (dos veces al día) demostró un control glucémico similar (HbA1c) en comparación con BIAsp 30 b.i.d. (dos veces al día) en pacientes con diabetes mellitus tipo 2. También demostró una disminución superior de los niveles de glucosa plasmática de ayuno en comparación con los pacientes tratados con BIAsp 30. RYZODEG® causa una menor tasa de hipoglucemia nocturna y general (Tabla 3).
En pacientes con diabetes mellitus tipo 1, el tratamiento con RYZODEG® una vez al día más IAsp en las comidas restantes demuestra un control glucémico similar (HbA1c y glucosa plasmática en ayuno) con una menor tasa de hipoglucemia nocturna en comparación con un régimen basal/bolo con IDet mas IAsp en todas las comidas (Tabla 4).
No se observa desarrollo clínicamente relevante de anticuerpos anti-insulina después del tratamiento a largo plazo con RYZODEG®.
Además de los 5 estudios confirmatorios terapéuticos realizados en el programa de desarrollo clínico global, también se investigó RYZODEG® en un estudio clínico de tratamiento a metas aleatorizado, controlado y abierto de 26 semanas en pacientes japoneses sin tratamiento previo con insulina con diabetes mellitus tipo 2 tratados con monoterapia o en combinación con ADO.
En este estudio, RYZODEG® administrado una vez al día con la comida principal del día proporcionó un mejor control glucémico a largo plazo (HbA1c) y una glucosa plasmática similar en ayuno en comparación con IGlar (Tabla 5). Una mayor proporción de pacientes alcanzó una HbA1c < 7% con y sin hipoglucemia durante el tratamiento con RYZODEG® en comparación con IGlar, y el incremento en la glucosa plasmática prandial en la cena fue menor con RYZODEG®. Estos resultados se lograron con una menor tasa de hipoglucemia general y nocturna con RYZODEG® en comparación con IGlar, y con dosis de insulina comparables al término del estudio.
En un meta-análisis a posteriori de dos estudios de tratamiento a metas no cegados de 26 semanas en pacientes con diabetes tipo 2, RYZODEG® dos veces al día (b.i.d.) demostró que fue superior en términos de un menor número de episodios de hipoglucemia general (Figura 2) y nocturna (Figura 3) confirmados comparados con la BIAsp 30. Los resultados demuestran que el menor nivel de glucosa plasmática en ayuno con RYZODEG® se logra con un menor riesgo de hipoglucemia tanto en el periodo de estudio global como en el periodo de mantenimiento a partir de la semana 16 (tabla 1).
Tabla 1. Resultados del meta-análisis de los episodios hipoglucémicos confirmados con la administración de RYZODEG® dos veces al día en el periodo completo del estudio y en el periodo de mantenimiento a partir de la semana 16
|
Análisis |
Rango Estimado [95% CI] Periodo total del estudio |
Rango Estimado [95% CI] Periodo de mantenimiento (a partir de la semana 16) |
|
Hipoglucemias generales confirmadas RYZODEG® (b.i.d.)/BIAsp 30 (b.i.d.) |
0.81 [0.67; 0.98] |
0.69 [0.55; 0.87] |
|
Hipoglucemias nocturnas confirmadas RYZODEG® (b.i.d.)/BIAsp30 (b.i.d.) |
0.43 [0.31; 0.59] |
0.38 [0.25; 0.58] |
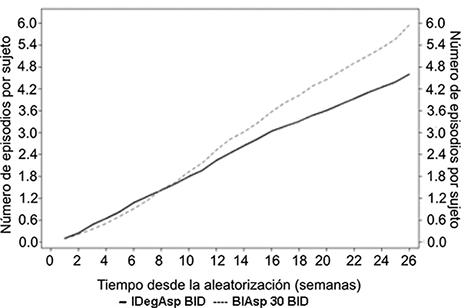
Figura 2. Episodios de hipoglucemia confirmada con RYZODEG® (dos veces al día) vs. BIAsp 30 (dos veces al día), función acumulativa media en dos ensayos de 26 semanas, abiertos, de tratamiento hasta alcanzar el objetivo, en pacientes con diabetes mellitus tipo 2.
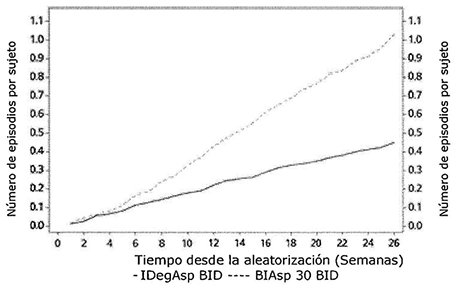
Figura 3. Episodios de hipoglucemia nocturna confirmada con RYZODEG® (dos veces al día) vs. BIAsp 30 (dos veces al día), función acumulativa media en dos ensayos de 26 semanas, abiertos, de tratamiento hasta alcanzar el objetivo, en pacientes con diabetes mellitus tipo 2.
Evaluación cardiovascular: DEVOTE es un ensayo clínico distribuido al azar, doble ciego determinado por eventos, con una mediana de duración de 2 años, que comparó la seguridad cardiovascular de insulina degludec vs. insulina glargina (100 unidades/ml) en 7,637 pacientes con diabetes mellitus tipo 2 con alto riesgo de desarrollar eventos cardiovasculares.
El análisis primario fue el tiempo desde la distribución al azar hasta el primer incidente de un evento cardiovascular adverso mayor (ECAM, MACE siglas en inglés) de 3 componentes definido como muerte cardiovascular, infarto del miocardio no mortal o evento cerebrovascular no mortal. El ensayo fue designado como un ensayo de no inferioridad para excluir un margen de riesgo preespecificado de 1.3 para la razón de riesgos de ECAM que compara insulina degludec con insulina glargina. Se confirmó la seguridad cardiovascular de insulina degludec en comparación con insulina glargina (figura 4).

N: Número de sujetos con un primer evento confirmado por EAC durante el ensayo.
%: Porcentaje de sujetos con un primer evento confirmado por EAC, relativo al número de sujetos distribuidos al azar.
EAC: Comité de Adjudicación de Eventos.
CV: Cociente de riesgos.
MI: Infarto del miocardio Intervalo de confianza del 95%.
Figura 4. Gráfico de efectos del análisis del compuesto ECAM de 3 puntos y objetivos finales cardiovasculares individuales en DEVOTE.
Tabla 2. Resultados de dos estudios de 26 semanas en la diabetes mellitus tipo 2
con RYZODEG® administrado una vez al día
|
RYZODEG® (o.d.)1 Sin tratamiento previo con insulina |
IGIar (o.d.)1 Sin tratamiento previo con insulina |
RYZODEG® (o.d.)2 Usuarios de insulina |
IGIar (o.d.)2 Usuarios de insulina |
|
|
N |
266 |
263 |
230 |
233 |
|
HbA1c media (%) |
||||
|
Término del estudio |
7.2 |
7.2 |
7.3 |
7.4 |
|
Cambio medio |
-1.65 |
-1.72 |
-0.98 |
-1.00 |
|
Diferencia: 0.03 [-0.14; 0.20] |
Diferencia: -0.03 [-0.20; 0.14] |
|||
|
Glucosa plasmática en ayuno (GPA) [mmol/l] |
||||
|
Término del estudio |
6.8 |
6.3 |
6.3 |
6.0 |
|
Cambio medio |
-3.32 |
-4.02 |
-1.68 |
-1.88 |
|
Diferencia: 0.51 [0.09; 0.93] |
Diferencia: 0.33 [-0.11; 0.77] |
|||
|
Incremento de glucosa prandial en sangre 90 minutos después de la dosificación con la comida (Plasma) [mmol/l] |
||||
|
Término del estudio |
1.9 |
3.4 |
1.2 |
2.6 |
|
Cambio medio |
-1.5 |
-0.3 |
-1.5 |
-0.6 |
|
Tasa de hipoglucemia (por pacientes-año de exposición) |
||||
|
Severo |
0.01 |
0.01 |
0.00 |
0.04 |
|
Confirmado3 |
4.23 |
1.85 |
4.31 |
3.20 |
|
Proporción: 2.17 [1.59; 2.94] |
Proporción: 1.43 [1.07; 1.92] |
|||
|
Nocturno confirmado3 |
0.19 |
0.46 |
0.82 |
1.01 |
|
Proporción: 0.29 [0.13; 0.65] |
Proporción: 0.80 [0.49; 1.30] |
|||
1 Régimen una vez al día + Metformina.
2 Régimen una vez al día + Metformina ± pioglitazona ± inhibidores de DPP-4.
3 La hipoglucemia confirmada fue definida como episodios confirmados por glucosa plasmática < 3.1 mmol/l o la necesidad del paciente de ayuda de terceros. La hipoglucemia confirmada nocturna se define como los episodios entre medianoche y las 6 a.m.
Tabla 3. Resultados de dos estudios de 26 semanas en la diabetes mellitus tipo 2 con
RYZODEG® administrado dos vez al día
|
RYZODEG® (b.i.d.)1 Usuarios de insulina |
BIAsp 30 (b.i.d.)1 Usuarios de insulina |
RYZODEG® (b.i.d.)2 Usuarios de insulina |
BIAsp 30 (b.i.d.)2 Usuarios de insulina |
|
|
N |
224 |
222 |
280 |
142 |
|
HbA1c media (%) |
||||
|
Término del estudio |
7.1 |
7.1 |
7.1 |
7.0 |
|
-1.28 |
-1.30 |
-1.38 |
-1.42 |
|
|
Diferencia: -0.03 [-0.18; 0.13] |
Diferencia: 0.05 [-0.10; 0.20] |
|||
|
GPA [mmol/l] |
||||
|
Término del estudio |
5.8 |
6.8 |
5.4 |
6.5 |
|
Cambio medio |
-3.09 |
-1.76 |
-2.55 |
-1.47 |
|
Diferencia: -1.14 [-1.53; -0.76] |
Diferencia: -1.06 [-1.43; -0.70] |
|||
|
Tasa de hipoglucemia (por pacientes-año de exposición) |
||||
|
Severo |
0.09 |
0.25 |
0.05 |
0.03 |
|
Confirmado3 |
9.72 |
13.96 |
9.56 |
9.52 |
|
Proporción: 0.68 [0.52; 0.89] |
Proporción: 1.00 [0.76; 1.32] |
|||
|
Nocturno confirmado3 |
0.74 |
2.53 |
1.11 |
1.55 |
|
Proporción: 0.27 [0.18; 0.41] |
Proporción: 0.67 [0.43; 1.06] |
|||
1 Régimen dos veces al día ± metformina ± pioglitazona ± inhibidor de DPP 4 .
2 Régimen dos veces al día ± metformina.
3 La hipoglucemia confirmada fue definida como episodios confirmados por glucosa plasmática < 3.1 mmol/l o la necesidad del paciente de ayuda de terceros. La hipoglucemia confirmada nocturna se define como los episodios entre medianoche y las 6 a.m. entre medianoche y las 6 a.m.
Tabla 4. Resultados de un estudios de 26 semanas en la diabetes mellitus tipo 1 con RYZODEG® administrado una vez al día
|
RYZODEG® (o.d.)1 |
IDet (o.d./b.i.d)2 |
|
|
N |
366 |
182 |
|
HbA1c media (%) |
||
|
Término del estudio |
7.6 |
7.6 |
|
Cambio medio |
-0.73 |
-0.68 |
|
Diferencia: -0.05 [-0.18; 0.8] |
||
|
GPA [mmol/l] |
||
|
Término del estudio |
8.7 |
8.6 |
|
Cambio medio |
-1.61 |
-2.41 |
|
Diferencia: 0.23 [-0.46; 0.91] |
||
|
Tasa de hipoglucemia (por pacientes-año de exposición) |
||
|
Severo |
0.33 |
0.42 |
|
Confirmado3 |
39.2 |
44.3 |
|
Proporción: 0.91 [0.76; 1.09] |
||
|
Nocturno confirmado3 |
3.71 |
5.72 |
|
Proporción: 0.63 [0.49; 0.81] |
||
1 Régimen una vez al día + insulina asparta para cubrir los requerimientos de insulina en las comidas.
2 Régimen una vez o dos veces al día + insulina asparta para cubrir los requerimientos de insulina en las comidas.
3 La hipoglucemia confirmada fue definida como episodios confirmados por glucosa plasmática < 3.l mmol/l o la necesidad del paciente de ayuda de terceros. La hipoglucemia confirmada nocturna se define como los episodios entre medianoche y las 6 a.m.
Tabla 5. Resultados de un estudio de 26 semanas
en la diabetes mellitus tipo 2
con RYZODEG® administrado una vez al día
|
RYZODEG® (o.d.)1 |
IGlar (o.d.)2 |
|
|
N |
147 |
149 |
|
HbA1c media (%) |
||
|
Término del estudio |
7.0 |
7.3 |
|
Cambio medio |
-1.35 |
-1.22 |
|
Diferencia: -0.28 [-0.46; 0.10] |
||
|
GPA (mmol/l) |
||
|
Término del estudio |
5.7 |
5.6 |
|
Cambio medio |
-3.25 |
-3.52 |
|
Diferencia: 0.15 [-0.29; 0.60] |
||
|
Tasa de hipoglucemia (por pacientes-año de exposición) |
||
|
Severo |
0.00 |
0.00 |
|
Confirmado3 |
1.9 |
2.7 |
|
Proporción: 0.73 [0.50; 1.08] |
||
|
Nocturno confirmado3 |
0.4 |
0.5 |
|
Proporción: 0.75 [0.34; 1.64] |
||
1 Régimen una vez al día, ya sea como monoterapia o en combinación con no más de 2 ADO (excluyendo SU, inhibidores de DPP-4 y glinidas).
2 Régimen una vez al día, ya sea como monoterapia o en combinación con no más de 2 ADO (excluyendo SU, inhibidores de DPP-4 y glinidas).
3 La hipoglucemia confirmada fue definida como episodios confirmados por glucosa plasmática < 3.1 mmol/l o la necesidad del paciente de ayuda de terceros. Hipoglucemia nocturna confirmada.
CONTRAINDICACIONES: Hipersensibilidad a la sustancia activa o a alguno de los excipientes. (Glicerol, Metacresol, Fenol, Cloruro de sodio, Acetato de Zinc, Ácido Clorhídrico, Hidróxido de Sodio, Agua para fabricación de Inyectables).
Embarazo, lactancia y menores de 18 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No se use en el embarazo ni la lactancia.
Mujeres en edad fértil, anticoncepción en hombres y mujeres.
Embarazo: No hay experiencia clínica con el uso de RYZODEG® en mujeres embarazadas.
Los estudios de reproducción animal no han revelado diferencias entre la insulina degludec y la insulina humana con respecto a embriotoxicidad y teratogenicidad.
En general, se recomienda el control intensificado de la glucosa sanguínea y un monitoreo estrecho de las mujeres embarazadas con diabetes a lo largo de la gestación y cuando se está planeando un embarazo. Los requisitos de insulina usualmente disminuyen en el primer trimestre y aumentan posteriormente durante el segundo y tercer trimestre. Después del parto, los requisitos de insulina usualmente vuelven rápidamente a los valores previos al embarazo.
Lactancia: No hay experiencia clínica con RYZODEG® durante la lactancia. En ratas, se detectó insulina degludec en la leche secretada, la concentración en la leche fue menor que en el plasma.
Se desconoce si la insulina degludec/insulina asparta se excreta en la leche materna. No se prevén efectos metabólicos en los recién nacidos/lactantes.
Fertilidad: Estudios de reproducción en animales con insulina degludec no han revelado efectos adversos en la fertilidad.
REACCIONES SECUNDARIAS Y ADVERSAS: Las reacciones adversas al medicamento (RAM) incluidas en esta sección se consideran esperadas con el medicamento.
Resumen del perfil de seguridad: La reacción adversa reportada con mayor frecuencia durante el tratamiento fue la hipoglucemia (ver sección Descripción de reacciones adversas seleccionadas).
Reacciones adversas para estudios clínicos:
Lista tabulada de reacciones adversas: Las reacciones adversas que se enlistan a continuación se basan en datos de los estudios clínicos y se clasifican de acuerdo a las Clases de órganos por sistema de MedDRA.
|
Clase de órganos por sistema |
Término preferido |
Frecuencia |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
0.04% |
|
Urticaria |
0.04% |
|
|
Trastornos del metabolismo y nutrición |
Hipoglucemia |
95% en sujetos con diabetes tipo 1 44.2%-57.7% en sujetos con diabetes tipo 2 tratados con RYZODEG® o.d.* 61.2%-73.5% en sujetos con diabetes tipo 2 tratados con RYZODEG® b.i.d.** |
|
Trastornos cutáneos y del tejido subcutáneo |
Lipodistrofia |
0.0% |
|
Trastornos generales y alteraciones en el sitio de administración |
Reacciones en el sitio de inyección |
1.1% |
|
Edema periférico |
0.4% |
* o.d.: Una vez al día.
** b.i.d.: Dos veces al día.
Descripción de las reacciones adversas seleccionadas:
Trastornos del sistema inmunológico: Las insulinas pueden producir reacciones alérgicas. Las reacciones alérgicas inmediatas a la propia insulina o a los excipientes pueden poner en peligro la vida de los pacientes.
Se han notificado casos raros de hipersensibilidad (manifestada por hinchazón de la lengua y los labios, diarrea, náuseas, cansancio y prurit o) y urticaria derivados del uso de RYZODEG®.
Hipoglucemia: Puede producirse hipoglucemia si la dosis de insulina es demasiado alta en relación con el requerimiento de insulina. Una hipoglucemia severa puede causar pérdida de la conciencia y/o convulsiones y puede llevar a discapacidad temporal o permanente de la función cerebral o incluso la muerte. Los síntomas de hipoglucemia generalmente ocurren de manera repentina. Éstos pueden incluir: sudor frío, piel fría y pálida, fatiga, nerviosismo o temblor, ansiedad, cansancio inusual o debilidad, confusión, dificultad para la concentración, somnolencia, hambre excesiva, cambios en la visión, cefalea, náuseas y palpitaciones.
Lipodistrofia: Puede ocurrir lipodistrofia (incluyendo la lipohipertrofia y lipoatrofia) en el sitio de inyección. La rotación continua del sitio de inyección dentro de una misma área de inyección puede ayudar a reducir el riesgo de desarrollar estas reacciones.
Reacciones en el sitio de inyección: Se produjeron reacciones en el sitio de la inyección (incluyendo hematoma en el sitio de inyección, dolor, hemorragia, eritema, nódulos, inflamación, decoloración, prurito, calor y masa en el sitio de la inyección) en pacientes tratados con RYZODEG®. Estas reacciones son en general leves y transitorias, y normalmente desaparecen durante el tratamiento continuo.
Población pediátrica: RYZODEG® se ha administrado en niños y adolescentes de hasta 18 años de edad con el fin de investigar las propiedades farmacocinéticas (consulte la sección Propiedades Farmacocinéticas). No se ha investigado la eficacia y seguridad en niños y adolescentes.
Otras poblaciones especiales: Con base en los resultados de estudios clínicos, la frecuencia, tipo y la severidad de las reacciones adversas observadas en pacientes de edad avanzada y en pacientes con insuficiencia renal o hepática no indican diferencias en comparación con la amplia experiencia en la pobalación general.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos no clínicos no muestran ningún riesgo de seguridad para los humanos según estudios sobre farmacología de seguridad, toxicidad de dosis repetida, potencial carcinogénico y toxicidad a la reproducción.
La proporción de mitógenos en relación con la potencia metabólica de la insulina degludec es comparable a aquélla de la insulina humana.
No se han realizado estudios de carcinogenicidad estándar de 2 años en animales para evaluar el potencial carcinogénico de RYZODEG®.
En un estudio de 52 semanas que incluyó a la insulina humana (insulina NPH) como comparador, se administraron por vía subcutánea a ratas Sprague-Dawlye insulina degludec, el componente basal de RYZODEG® a una dosis de 3.3, 6.7 y 10 U/kg/día, lo cual resultó en 5 veces la exposición en seres humanos de 1.08 U/kg/día de RYZODEG®. La insulina humana fue dosificada en 6.7 U/kg/día. No se registraron aumentos relacionados con el tratamiento en las incidencias de hiperplasia, tumores benignos o malignos en las glándulas mamarias de las ratas dosificadas con insulina degludec y no se identificó ningún cambio relacionado con el tratamiento en la proliferación de células en las glándulas mamarias femeninas mediante la incorporación de BrdU (bromodesoxiuridina). Además, no se observaron cambios relacionados con el tratamiento en la incidencia de lesiones hiperplásicas o neoplásicas en animales dosificados con insulina degludec, en comparación con el vehículo o con la insulina humana.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Ciertos medicamentos son conocidos por interactuar con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina: Medicamentos antidiabéticos orales, agonistas del receptor de GLP-1, inhibidores de monoaminoxidasa (IMAO), beta-bloqueadores, inhibidores de la enzima convertidora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormonas de crecimiento y danazol.
Los beta-bloqueadores pueden enmascarar los síntomas de hipoglucemia.
Octreotida/Lanreotida pueden tanto aumentar o disminuir los requerimientos de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucemiante de la insulina.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han observado.
PRECAUCIONES GENERALES:
Hipoglucemia: La omisión de alguna comida o el ejercicio físico extenuante no planeado pueden causar hipoglucemia.
Puede ocurrir hipoglucemia si la dosis de insulina es demasiado alta en relación con los requisitos de insulina (consulte las secciones Reacciones secundarias y adversas y Manifestaciones y manejo de la sobredosificación o ingesta accidental).
Los pacientes cuyo control glucémico mejora notablemente (por ejemplo, mediante la intensificación del tratamiento de insulina, pueden experimentar un cambio en los síntomas habituales de advertencia de hipoglucemia, y se les debe informar adecuadamente. Los síntomas habituales de advertencia de hipoglucemia pueden desaparecer en pacientes que padecen diabetes desde hace mucho tiempo.
Las enfermedades concomitantes, en especial las infecciones y padecimientos que se acompañan de fiebre, usualmente aumentan los requisitos de insulina en el paciente. Las enfermedades concomitantes renales o hepáticas o las enfermedades que afectan las glándulas suprarrenales, glándula pituitaria o glándula tiroides pueden requerir cambios en la dosis de insulina.
Como con otros productos de insulina basal o productos de insulina con un componente basal, el efecto prolongado de RYZODEG® puede retrasar la recuperación de la hipoglucemia.
Hiperglucemia: Se recomienda la administración de insulina de acción rápida en situaciones de hiperglucemia grave.
Una dosificación inadecuada y/o la descontinuación del tratamiento en pacientes que requieren insulina pueden causar hiperglucemia y potencialmente cetoacidosis diabética. Además las enfermedades concomitantes, en especial las infecciones, pueden causar hiperglucemia y, por lo tanto, causar un requerimiento mayor de insulina.
Usualmente, los primeros síntomas de hiperglucemia se desarrollan de forma gradual, durante un periodo de horas o días y pueden ser: sed, aumento de la frecuencia de micción, náusea, vómito, somnolencia, piel seca enrojecida, sequedad de boca, pérdida del apetito, así como aliento cetónico. En diabetes mellitus tipo 1, los eventos hiperglucémicos que no se traten pueden dar lugar a cetoacidosis diabética, que es potencialmente letal.
Transferencia de otros medicamentos de insulina: El cambio de insulina en el paciente a otro tipo, marca o fabricante de insulina debe realizarse bajo supervisión médica y esto puede resultar en la necesidad de un cambio en la dosificación.
Combinación de tiazolidinedionas e insulina: Se han reportado casos de insuficiencia cardiaca cuando se utilizaron tiazolidinedionas en combinación con insulina, en especial en pacientes con factores de riesgo para el desarrollo de insuficiencia cardiaca. Esto debe tenerse en cuenta si se considera el tratamiento con la combinación de tiazolidinedionas y RYZODEG®. Si se utiliza la combinación, se debe observar a los pacientes con el fin de detectar signos o síntomas de insuficiencia cardiaca, aumento de peso y edema. Se debe interrumpir el uso de tiazolidinedionas si se produce un deterioro de los síntomas cardiacos.
Trastornos oculares: La intensificación del tratamiento con insulina con una mejora abrupta del control glucémico puede asociarse a un empeoramiento temporal de la retinopatía diabética.
Evitar confusiones accidentales: Se debe instruir a los pacientes para que siempre verifiquen la etiqueta de la insulina antes de cada inyección para evitar confusiones de RYZODEG® y otros productos insulínicos.
Los pacientes deben verificar visualmente las unidades marcadas del contador de dosis de la pluma. Por lo tanto, se requiere que los pacientes que se inyectan por sí mismos lean el contador de dosis de la pluma. Se debe instruir a los pacientes con pérdida de visión o con visión pobre que siempre deben pedir ayuda/asistencia de otra persona que tenga buena visión y esté entrenada en el uso de la insulina.
Anticuerpos anti-insulina: La administración de insulina puede provocar anticuerpos anti-insulina. En casos raros, la presencia de dichos anticuerpos anti-insulina puede requerir un ajuste de la dosis de insulina con el fin de corregir la tendencia a la hiper o hipoglucemia.
Efectos en las capacidades para manejar y utilizar maquinaria: La capacidad del paciente para concentrarse y reaccionar puede verse afectada como resultado de la hipoglucemia. Esto puede constituir un riesgo en situaciones en que esta habilidad es de especial importancia (por ejemplo, como al conducir un automóvil u operar maquinaria).
Deberá indicarse a los pacientes que extremen precauciones con el fin de evitar hipoglucemia mientras conducen. Esto es de particular importancia en aquellos pacientes que presentan una conciencia reducida o ausente de los signos de alerta de hipoglucemia o que experimentan episodios frecuentes de hipoglucemia. Deberá considerarse la conveniencia de conducir en estas circunstancias.
Incompatibilidades: Sustancias que se agregan a RYZODEG® pueden causar degradación de la insulina degludec y/o de la insulina asparta.
RYZODEG® no debe añadirse a sustancias para infusión.
Este producto no debe de ser mezclado con otros productos.
DOSIS Y VÍA DE ADMINISTRACIÓN: RYZODEG® es un producto de insulina soluble compuesto por insulina degludec basal de acción ultraprolongada e insulina asparta prandial de acción rápida.
RYZODEG® se puede administrar una o dos veces al día con la (s) comida (s) principal (es). Cuando sea necesario, el paciente puede cambiar la hora de administración siempre y cuando RYZODEG® se dosifique con la comida principal cuando se toma una vez al día.
La potencia de los análogos de insulina, incluyendo RYZODEG®, se expresa en unidades (U). Una (1) unidad (U) de RYZODEG® corresponde a una unidad internacional (UI) de insulina humana, 1 unidad de insulina glargina, 1 unidad de insulina detemir o 1 unidad de insulina asparta bifásica.
En pacientes con diabetes mellitus tipo 2 se puede administrar RYZODEG® solo o en combinación con medicamentos antidiabéticos orales y en combinación con insulina en bolo (véase la sección Propiedades Farmacodinámicas. Eficacia clínica y seguridad).
En diabetes mellitus tipo 1, RYZODEG® se combina con insulina de acción corta/rápida en las comidas restantes.
RYZODEG® debe ser dosificado según las necesidades individuales del paciente. Se recomienda que los ajustes de la dosis se basen principalmente en las mediciones de glucosa plasmática en ayuno.
Como con todos los productos de insulina, podría requerirse un ajuste de dosis si los pacientes aumentan la actividad física, cambian su dieta habitual o durante una enfermedad concomitante.
Flexibilidad de la hora de dosificación: RYZODEG® permite la flexibilidad de la hora de la administración de la insulina, siempre que se dosifique con la (s) comida (s) principal (es).
Si se omite una dosis de RYZODEG®, el paciente puede administrarse la dosis olvidada con la siguiente comida principal del día y después reanudar el horario habitual de dosificación, los pacientes no deben administrar una dosis extra para compensar una dosis omitida.
Inicio:
Para pacientes con diabetes mellitus tipo 2: La dosis inicial diaria total recomendada es de 10 unidades con la (s) comida (s), seguida de ajustes individuales de la dosis.
Pacientes con diabetes mellitus tipo 1: La dosis inicial recomendada de RYZODEG® es de 60 al 70% de los requerimientos totales diarios de insulina. |
RYZODEG® debe ser usado una vez al día en el momento de los alimentos en combinación con insulina de acción corta/rápida en las comidas restantes, seguida por ajustes individuales de la dosificación.
Cambio de otros productos de insulina: Se recomienda el monitoreo estrecho de la glucosa durante el cambio y durante las semanas posteriores. Podría ser necesario ajustar las dosis y la hora de los medicamentos de insulina de acción rápida o de acción corta u otro tratamiento antidiabético concomitantes.
Pacientes con diabetes mellitus tipo 2: En pacientes que cambian de un tratamiento de insulina basal o premezcla una vez al día, es posible convertir unidad por unidad con RYZODEG® una vez al día en la misma dosis de insulina total de la dosis diaria total previa de insulina del paciente.
En pacientes que cambian de insulina basal o premezcla de más de una vez al día, es posible convertir unidad por unidad a RYZODEG® dos veces al día en la misma dosis de insulina total de la dosis diaria total previa de insulina diaria del paciente.
Los pacientes que cambian de tratamiento de insulina basal/bolo a RYZODEG® requerirán convertir su dosis con base en los requerimientos individuales. En general se inicia a los pacientes en el mismo número de unidades basales.
Pacientes con diabetes mellitus tipo 1: La dosis inicial recomendada de RYZODEG® es del 60 al 70% de los requerimientos diarios totales de insulina en combinación con insulina de acción corta/rápida en las comidas restantes, seguida por ajustes de la dosificación individual.
Poblaciones especiales:
Personas de edad avanzada (> 65 años de edad): RYZODEG® puede utilizarse en pacientes de edad avanzada. Se debe intensificar el monitoreo de glucosa y ajustarse la dosis de insulina en forma individual (consulte Propiedades fármacocinéticas).
Insuficiencia renal y hepática: RYZODEG® puede utilizarse en pacientes con insuficiencia renal y hepática.
Se debe intensificar el monitoreo de la glucosa y ajustar la dosis de insulina de forma individual (véase la sección Propiedades farmacocinéticas).
Población pediátrica: Aún no se ha establecido la seguridad y eficacia de RYZODEG® en niños y adolescentes, menores de 18 años de edad.
Los datos están disponibles en Propiedades farmacocinéticas, sin embargo, no se consideran suficientes para hacer recomendaciones de posología.
Vía de administración: RYZODEG® está diseñado sólo para administración subcutánea.
RYZODEG® no debe administrarse por vía intravenosa porque podría causar hipoglucemia severa. RYZODEG® no debe administrarse por vía intramuscular porque podría cambiar la absorción. RYZODEG® no debe utilizarse con bombas de infusión de insulina.
RYZODEG® se administra por vía subcutánea con una inyección en la pared abdominal, la parte superior del brazo o el muslo. Los sitios de inyección siempre deben rotarse para reducir el riesgo de lipodistrofia.
RYZODEG® FlexTouch® es una pluma precargada diseñada para utilizarse con agujas de inyección NovoFine®. La pluma precargada suministra de 1 a 80 unidades en pasos-de 1 unidad.
No diluya ni mezcle RYZODEG® con ninguna otra insulina o solución. Las proporciones de insulina degludec o insulina asparta en RYZODEG® son fijas y no permiten ajustes de dosis basal vs ajuste de dosis prandial.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Las reacciones adversas detalladas en esta sección se consideran esperadas con el medicamento.
No puede definirse una sobredosis específica. Sin embargo, la hipoglucemia puede desarrollarse luego de etapas secuenciales si se dosifica con más insulina de la requerida.
• Los episodios leves de hipoglucemia pueden tratarse con la administración oral de glucosa u otros productos que contienen azúcar. Por lo tanto, se recomienda que el paciente siempre lleve consigo productos con contenido de glucosa.
• Los episodios hipoglucémicos severos donde el paciente es incapaz de tratarse por sí mismo pueden ser manejados con glucagón (0.5 a 1 mg) por vía intramuscular o subcutánea aplicado por una persona capacitada o con glucosa por vía intravenosa aplicada por un profesional de la salud. La glucosa debe administrarse por vía intravenosa si el paciente no responde al glucagón en 10 o 15 minutos. Una vez que el paciente recupere el conocimiento, se recomienda la administración oral de carbohidratos con el fin de evitar una recaída
PRESENTACIONES:
RYZODEG® pluma precargada FlexTouch® 100 U/ml, solución inyectable en pluma precargada multidosis.
Caja con 1 o 5 pluma (s) precargada (s) FlexTouch® con 3 ml.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Caducidad: 30 meses.
RYZODEG® pluma precargada (FlexTouch®): Después de la primera utilización, el producto puede conservarse durante un máximo de 4 semanas. Una vez transcurrido este periodo, el producto deberá desecharse. No conservar por encima de 30°C. Puede almacenarse en un refrigerador (2°C-8°C).
Antes del primer uso: Consérvese en el refrigerador (2°C-8°C). Manténgase alejado del compartimento congelador. No congelar.
Pluma precargada FlexTouch®: Mantener el tapón puesto para proteger el producto de la luz.
Después del primer uso o de llevarlo consigo como repuesto:
RYZODEG® pluma precargada FlexTouch®: No conservar por encima de 30°C. Puede almacenarse en un refrigerador (2°C-8°C). Mantener el tapón puesto para proteger el producto de la luz.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No administre si la solución no es clara o si contiene partículas en suspensión o si el cierre está roto. Si RYZODEG® se ha congelado no debe utilizarlo. RYZODEG® pluma precargada FlexTouch®: La pluma precargada está diseñada para utilizarse con agujas de inyección NovoFine® de hasta 8 mm de longitud (Reg. Núm. 625C94, SSA). La pluma precargada FlexTouch® 100 U/ml suministra de 1 a 8O U en incrementos de 1 unidad. Se deben seguir las instrucciones detalladas que acompañan al medicamento RYZODEG® pluma precargada Flex Touch®. Sólo una persona debe usar la pluma precargada (Flex Touch®). La pluma precargada no debe ser rellenada. RYZODEG® no debe utilizarse si la solución no tiene un aspecto claro e incoloro. No debe utilizarse RYZODEG® si ha sido congelado. Se debe indicar al paciente que deseche la aguja después de cada inyección. Cualquier material de desecho debe eliminarse de acuerdo a los requisitos locales. Para consultar las instrucciones detalladas, veáse el instructivo. Se debe advertir a los pacientes que no deben compartir las plumas precargadas o agujas para administración de insulina con otros pacientes debido a que esto representa un riesgo de transmisión de patógenos sanguíneos. Los pacientes deben recibir una capacitación adecuada sobre cómo usar la pluma precargada Flex Touch® de Ryzodeg®, indicar a los pacientes que cuando se inyecten Ryzodeg®, deben presionar y mantener presionado el botón dosificador hasta que el contador de dosis muestre un O y luego dejar la aguja en la piel y contar lentamente hasta 6. Si retira antes la aguja, verá un flujo de solución que sale de la pluma de la aguja. Si esto ocurre, no se administró la dosis completa, y usted debe aumentar la frecuencia de comprobación de los niveles de azúcar en sangre. Su venta requiere receta médica. Manténgase fuera de la vista y el alcance de los niños. No se use en embarazo, lactancia ni en menores de 18 años. No se administre si la solución no es transparente, si contiene partículas en suspensión, sedimentos o si el cierre ha sido violado. Consérvese en refrigeración (2ºC a 8ºC). No congelar. Después del primer uso de la pluma precargada, se conserva hasta 4 semanas a temperatura ambiente a no más de 30ºC o en refrigeración de 2°C-8°C. Una vez transcurrido este periodo, el producto deberá desecharse. Mantener el tapón en la pluma con el fin de proteger el producto de la luz.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Hecho en Dinamarca por:
Novo Nordisk A/S
Novo Allé,
Bagsvaerd, 2880, Dinamarca
Representante legal:
NOVO NORDISK MÉXICO, S.A. de C.V.
Homero Núm. 1500, piso 3, Col. Polanco
C.P. 11560, Miguel Hidalgo
Ciudad de México, México
Reg. Núm. 289M2012, SSA IV
®Marca registrada