SPIRIVA RESPIMAT
BROMURO DE TIOTROPIO
Solución
1 Caja, 1 Cartucho con dispositivo, 4 mL, 0.226 mg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada ml contiene:
Bromuro de Tiotropio monohidratado equivalente a 0.226 mg de Tiotropio
INDICACIONES TERAPÉUTICAS:
EPOC: SPIRIVA® en su Dispositivo Dosificador RESPIMAT® está indicado para la terapia de mantenimiento de los pacientes con Enfermedad Pulmonar Obstructiva Crónica (EPOC) (incluyendo la bronquitis crónica y el enfisema), la terapia de mantenimiento de la disnea asociada, la mejoría de la calidad de vida comprometida por la EPOC y para la reducción de las exacerbaciones.
ASMA: SPIRIVA® en su Dispositivo Dosificador RESPIMAT® está indicado como tratamiento broncodilatador adicional de mantenimiento en pacientes de 6 años de edad en adelante con asma quienes permanecen sintomáticos a pesar del tratamiento con al menos corticoesteroides para la mejoría de los síntomas y la reducción de las exacerbaciones.
FARMACOCINÉTICA Y FARMACODINAMIA:
Código ATC: R03B B04.
Grupo farmacoterapéutico: Anticolinérgico.
El bromuro de tiotropio es un agente antimuscarínico específico, de acción prolongada, que en la medicina clínica generalmente recibe el nombre de anticolinérgico. Tiene una afinidad similar por los subtipos M1 a M5 de los receptores muscarínicos. En las vías aéreas, la inhibición de los receptores M3 en el músculo liso ocasiona relajación. Se demostró la naturaleza competitiva y reversible del antagonismo en receptores humanos y de origen animal y en preparaciones de órganos aislados. En estudios no-clínicos in vitro e in vivo los efectos broncoprotectores fueron dependientes de la dosis y duraron más de 24 horas. La larga duración del efecto probablemente se debe a su muy lenta disociación de los receptores M3, que indica una vida media de disociación significativamente más prolongada que la observada con ipratropio. En calidad de anticolinérgico N-cuaternario, tiotropio es tópicamente (bronco-) selectivo cuando se le administra por inhalación, y demuestra un rango terapéutico aceptable antes de ocasionar efectos anticolinérgicos sistémicos. La disociación de los receptores M2 ocurre más rápidamente que la de los M3, lo cual en estudios funcionales in vitro provocó una selectividad (controlada cinéticamente) por los subtipos de receptores M3 más que por los M2. La gran potencia y la lenta disociación de los receptores encontraron su correlato clínico en la broncodilatación significativa y prolongada en los pacientes con EPOC y en los pacientes con asma. La broncodilatación después de la inhalación de tiotropio es primordialmente un efecto local (en las vías aéreas) y no sistémico.
EPOC: El programa de estudios clínicos de fase III incluyó dos estudios de 1 año, dos de 12 semanas, y dos de 4 semanas, todos ellos doble-ciego, aleatorizados, con un total de 2,901 pacientes con EPOC (1,038 pacientes recibieron la dosis de tiotropio de 5 μg). El programa de 1 año constó de dos estudios controlados con placebo. Los dos estudios a 12 semanas estuvieron controlados tanto con un compuesto activo (ipratropio) como con un placebo. Los seis estudios incluyeron mediciones de la función pulmonar. Además, los dos estudios de 1 año incluyeron medidas de disnea, calidad de vida relacionada con la salud y el efecto sobre las exacerbaciones.
Estudios con control de placebo:
Función pulmonar: SPIRIVA® en su Dispositivo Dosificador RESPIMAT®, administrado una vez al día, proporcionó una mejoría significativa de la función pulmonar (volumen espiratorio forzado en un segundo y capacidad vital forzada) dentro de los 30 minutos después de la primera dosis, en comparación con el placebo. La mejoría de la función pulmonar se mantuvo durante 24 horas en estado estable.
El estado farmacodinámico estable se alcanzó durante la primera semana. SPIRIVA® en su Dispositivo Dosificador RESPIMAT® mejoró significativamente el flujo espiratorio pico (PEFR, por sus siglas en inglés) de la mañana y la noche, medido a partir de los registros diarios del paciente. El uso de SPIRIVA® en su dispositivo dosificador RESPIMAT® se tradujo en una reducción del uso del broncodilatador de rescate en comparación con el placebo.
Los efectos broncodilatadores de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® se mantuvieron a lo largo del periodo de administración de 48 semanas sin evidencia de tolerancia.
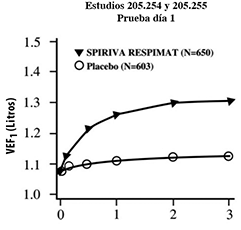
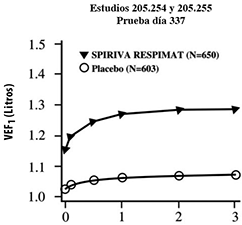
Figura 1: Volumen espiratorio forzado en el primer segundo (VEF1 o FEV1 por sus siglas en inglés) medio (litros) en cada punto del tiempo (antes y después de la administración del fármaco del estudio) los días 1 y 337, respectivamente (datos combinados de dos estudios de grupos paralelos de 1 año)*
Tiempo desde la administración del medicamento (hrs.)
Tiempo desde la administración del medicamento (hrs.)
* Medias ajustadas por centro, estado de tabaquismo y efecto basal. Un total de 545 y 434 pacientes de los grupos de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® y placebo, respectivamente, concluyeron la prueba el día 337. Los datos de los pacientes restantes fueron imputados usando la extrapolación de la última observación o de la observación menos favorable.
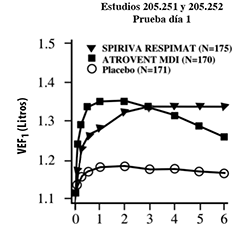
Figura 2: Volumen espiratorio forzado en el primer segundo (VEF1 ó FEV1 por sus siglas en inglés) medio (litros) en cada punto del tiempo (antes y después de la administración del fármaco del estudio) los días 1 y 85, respectivamente (datos combinados de dos estudios de grupos paralelos de 12 semanas)
Tiempo desde la administración del medicamento (hrs.)
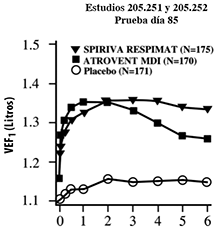
Tiempo desde la administración del medicamento (hrs)
* En el día 85, un total de 155, 142 y 152 pacientes de los grupos de SPIRIVA® en su Dispositivo Dosificador RESPIMAT®, ATROVENT MDI y placebo, respectivamente concluyeron el día 85 de la prueba. Los datos de los pacientes restantes fueron imputados usando la extrapolación de la última observación o de la observación menos favorable.
Figura 3: Volumen espiratorio forzado en el primer segundo (VEF1 ó FEV1 por sus siglas en inglés) medio (litros) en cada punto del tiempo (antes y después de la administración del fármaco del estudio) el día 29 (datos combinados de dos estudios cruzados, de 4 semanas, 205.249 y 205.250)*
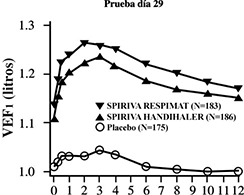
Tiempo desde la administración del medicamento (hrs)
* Medias ajustadas por centro, el paciente (dentro del centro), el periodo y el efecto basal. Los datos de los pacientes que suspendieron el tratamiento antes del día de la prueba se imputaron mediante la extrapolación de la última observación o de la observación menos favorable. Los pacientes que finalizaron los estudios recibieron los 3 tratamientos.
Un análisis combinado de dos estudios clínicos aleatorizados, cruzados, controlados con placebo, demostró que la respuesta de broncodilatación con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® (5 μg) fue numéricamente más elevada comparada con el polvo para inhalación de SPIRIVA HandiHaler (18 μg) después de un periodo de tratamiento de 4 semanas.
Disnea, calidad de vida relacionada con la salud y exacerbaciones de la EPOC en estudios a largo plazo de 1 año de duración:
a) SPIRIVA® en su Dispositivo Dosificador RESPIMAT® mejoró significativamente la disnea (evaluada usando el índice de Disnea Transicional). Se mantuvo la mejoría a lo largo de todo el periodo de tratamiento.
b) La evaluación de la Calidad de Vida del paciente (medida con el Cuestionario Respiratorio de St. George) mostró que SPIRIVA® en su Dispositivo Dosificador RESPIMAT® tuvo efectos positivos sobre los impactos psicosociales de la EPOC, las actividades afectadas por la EPOC y la angustia debida a los síntomas de la EPOC.
La mejoría del puntaje total medio entre SPIRIVA® en su Dispositivo Dosificador RESPIMAT® versus placebo al final de los dos estudios de 1 año fue estadísticamente significativa y se mantuvo a lo largo de todo el periodo de tratamiento.
c) Exacerbaciones de la EPOC: En tres estudios aleatorizados, doble ciegos, controlados con placebo, de un año de duración, el tratamiento con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® redujo significativamente el riesgo de una exacerbación de la EPOC en comparación con el placebo. Las exacerbaciones de la EPOC se definieron como "un complejo conformado por al menos dos eventos/síntomas respiratorios con una duración de tres días o más, que requiere de un cambio en el tratamiento (prescripción de antibióticos y/o corticoesteroides sistémicos y/o un cambio significativo de la medicación respiratoria prescrita)". El tratamiento con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® redujo el riesgo de hospitalización como consecuencia de exacerbaciones de la EPOC (dicha reducción fue significativa en el estudio de exacerbaciones a gran escala, que tenía la potencia adecuada).
El análisis de datos combinados de dos estudios de Fase III y el análisis aparte de un estudio de exacerbación adicional se presentan en la Tabla 1. Estuvieron permitidos como tratamientos concomitantes todos los medicamentos respiratorios, excepto los anticolinérgicos y los agonistas beta de acción prolongada, es decir, agonistas beta de acción rápida, corticoesteroides inhalables y xantinas. Los agonistas beta de acción prolongada también estuvieron permitidos en el estudio de exacerbación.
Tabla 1. Análisis estadístico de las exacerbaciones de la EPOC y de las exacerbaciones de la EPOC con hospitalización en pacientes con EPOC moderada a muy severa.
|
Estudio (NSPIRIVA® Nplacebo) |
Objetivos del estudio |
SPIRIVA® en su dispositivo dosificador Respimat® |
Placebo |
% de reducción del riesgo (IC del 95%)a |
Valor p |
|
Estudios de Fase III de un año de duración, análisis combinadod (670, 653) |
Días hasta la primera exacerbación de la EPOC |
160a |
86a |
29 (16 a 40)b |
< 0.0001b |
|
Media de la tasa de incidencia de exacerbaciones por año-paciente |
0.78c |
1.00c |
22 (8 a 33)c |
0.002c |
|
|
Tiempo hasta la primera exacerbación de la EPOC con hospitalización |
NAe |
NAe |
25 (-16 a 51)b |
0.20b |
|
|
Media de la tasa de incidencia de exacerbaciones con hospitalización por año-paciente |
0.09c |
0.11c |
20 (- 4 a 38)c |
0.096c |
|
|
Estudio de Fase IIIb de exacerbaciones, de 1 año de duración (1939, 1953) |
Días hasta la primera exacerbación de la EPOC |
169a |
119a |
31 (23 a 37)b |
< 0.0001b |
|
Media de la tasa de incidencia de exacerbaciones por año-paciente |
0.69c |
0.87c |
21 (13 a 28)c |
< 0.0001c |
|
|
Tiempo hasta la primera exacerbación de la EPOC con hospitalización |
NAe |
NAe |
27 (10 a 41)b |
0.003b |
|
|
Media de la tasa de incidencia de exacerbaciones con hospitalización por año-paciente |
0.12c |
0,15c |
19 (7 a 30)c |
0.004c |
a) Tiempo hasta el primer evento: días en tratamiento para cuando el 25% de los pacientes tenían al menos una exacerbación de la EPOC/exacerbación de la EPOC con hospitalización. En el estudio A, el 25% de los pacientes que recibieron placebo tuvieron una exacerbación para el día 112, en tanto que en el grupo de pacientes tratados con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® el 25% tuvo una exacerbación para el día 173 (p = 0,09); en el estudio B, el 25% de los pacientes que recibieron placebo tuvieron una exacerbación para el día 74, en tanto que en el grupo de pacientes tratados con SPIRIVA® en su Dispositivo Dosificador Respimat® el 25% tuvo una exacerbación para el día 149 (p < 0,0001).
b) Las razones de riesgos se estimaron a partir de un modelo de riesgos proporcionales de Cox. El porcentaje de reducción del riesgo es 100 (1- razón de riesgos).
c) Regresión de Poisson. La reducción del riesgo es 100 (1-razón de riesgos).
d) La agrupación de los datos se especificó al momento del diseño de los estudios. Se observó una mejoría significativa de los objetivos del estudio para las exacerbaciones en los análisis individuales de los dos estudios de un año de duración.
e) Menos del 25% de los pacientes tuvo una exacerbación de la EPOC que condujo a una hospitalización.
Estudio a largo plazo con control activo de tiotropio: Se llevó a cabo un estudio aleatorizado, doble ciego, con control activo, a largo plazo, a gran escala, con un periodo de tratamiento de hasta 3 años para comparar la eficacia y la seguridad de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® y SPIRIVA® HANDIHALER® (5.711 pacientes recibieron SPIRIVA® en su Dispositivo Dosificador RESPIMAT® 2,5 microgramos (dosis medicinal de 5 microgramos); 5.694 pacientes recibieron SPIRIVA® HANDIHALER®. Los objetivos del estudio primarios fueron el tiempo hasta la primera exacerbación de la EPOC, el tiempo hasta la mortalidad por cualquier causa y, en un subestudio (906 pacientes), el VEF1 remanente (previo a la dosis).
El tiempo hasta la primera exacerbación de la EPOC fue similar durante el estudio con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® y SPIRIVA® HANDIHALER® (razón de riesgos (SPIRIVA® en su Dispositivo Dosificador RESPIMAT®/SPIRIVA® HANDIHALER®) de 0,98 con un IC del 95% de 0,93 a 1,03).
La mediana del número de días hasta la primera exacerbación de la EPOC fue 756 días para SPIRIVA® en su Dispositivo Dosificador RESPIMAT® y 719 días para SPIRIVA® HANDIHALER®.
El efecto broncodilatador de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® se sostuvo a lo largo de 120 semanas, y fue similar al de SPIRIVA® HANDIHALER®. La media de la diferencia en términos de VEF1 remanente para SPIRIVA® en su Dispositivo Dosificador RESPIMAT® frente a SPIRIVA® HANDIHALER® fue -0,010 L (IC del 95% -0,038 a 0,018 ml).
La mortalidad por todas las causas fue similar durante el estudio con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® y SPIRIVA® HANDIHALER® (razón de riesgos SPIRIVA® en su Dispositivo Dosificador RESPIMAT®/SPIRIVA® HANDIHALER®) de 0,96 con un IC del 95% de 0,84 a 1,09).
Asma:
Pacientes adultos: El programa clínico de Fase III para el asma persistente comprendió estudios aleatorizados, doble ciego, controlado con placebo, dos de ellos de 1 año de duración, otros dos de 6 meses de duración y uno de 12 semanas de duración llevados a cabo en un total 3,476 pacientes con asma (1,128 de los cuales recibieron SPIRIVA® en su Dispositivo Dosificador RESPIMAT®) tratados con un régimen de base de por lo menos corticosteroides inhalados (ICS, inhaled corticosteroids), o bien ICS/agonistas-beta de acción prolongada (long-acting beta-agonist, LABA). Los dos estudios de 6 meses de duración también incluyeron un control activo (salmeterol). Todos estos 5 estudios incluyeron mediciones de la función pulmonar, evaluaciones de los síntomas, incluidas las exacerbaciones, y evaluaciones de la calidad de vida relacionada con la salud.
En los dos estudios en asma de 1 año de duración (PrimoTinA) realizados en pacientes que presentaban sintomatología estando bajo tratamiento de mantenimiento con por lo menos ICS en dosis altas más un LABA, SPIRIVA® en su Dispositivo Dosificador RESPIMAT® evidenció mejorías significativas en la función pulmonar respecto del placebo cuando se usó como terapia complementaria del tratamiento de base.
• En la semana 24, los valores medios de la mejoría en los valores pico y remanente de VEF1 fueron 0.110 litros (IC del 95%: 0.063 a 0.158 litros, p < 0.0001) y 0.093 litros (IC del 95%: 0.050 a 0.137 litros, p < 0.0001), respectivamente.
• La mejoría de la función pulmonar en comparación con el placebo se mantuvo durante 24 horas (Figura 4).
Figura 4: Perfiles de VEF1 a lo largo de 24 horas en un subconjunto de pacientes de los estudios en asma en PrimoTinA en la semana 24.
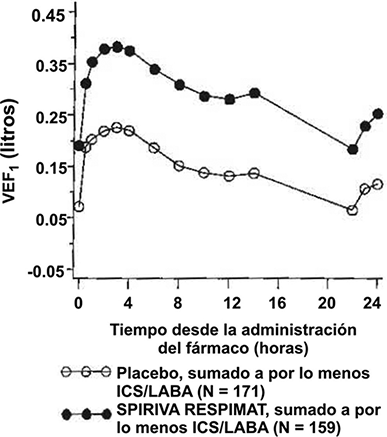
• En la semana 24, SPIRIVA® en su Dispositivo Dosificador RESPIMAT® logró una mejoría significativa en las mediciones matutinas y vespertinas del flujo espiratorio pico (FEM; valor medio de mejoría matutina 23 L/min; IC del 95%: 16 a 29 L/min, p < 0.0001; valor medio de mejoría vespertina 26 L/min; IC del 95%: 20 a 33 L/min, p < 0.0001).
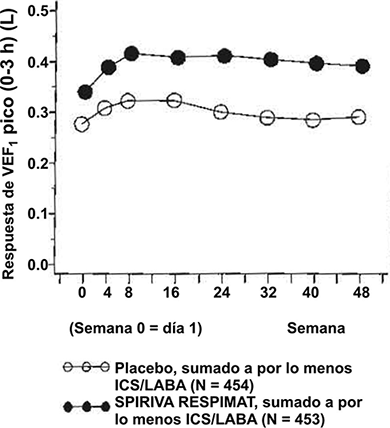
• Los efectos broncodilatadores de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® se mantuvieron a lo largo de todo el periodo de 1 año de administración sin evidencia de desarrollo de taquifilaxia o tolerancia.
(Figura 5).
Figura 5. Respuesta de VEF1 pico a lo largo de 48 semanas en los estudios en asma realizados en PrimoTinA
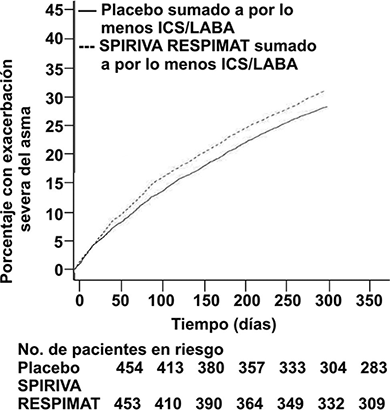
• SPIRIVA® en su Dispositivo Dosificador RESPIMAT® redujo significativamente el riesgo de exacerbaciones severas del asma (ver Tabla 2 y Figura 6).
Tabla 2. Exacerbaciones en pacientes que presentan sintomatología estando en tratamiento con ICS más LABA (estudios de asma en PrimoTinA)
|
Estudio |
Objetivo del estudio |
SPIRIVA® en su dispositivo dosificador RESPIMAT® tratamiento suplementario a por lo menos ICS/LABA (N = 453) |
Placebo tratamiento suplementario a por lo menos ICS/LABA (N = 454) |
% de reducción del riesgo (IC del 95%)a |
Valor p |
|
Estudios de Fase III de un año de duración, análisis combinado |
Días hasta la 1era exacerbación severa del asma |
282b |
226b |
21 (0.38) |
0.0343 |
|
Número medio de exacerbaciones severas del asma/año-paciente |
0.530 |
0.663 |
20 (0.36) |
0.0458 |
|
|
Días hasta el 1er empeoramiento del asma |
315b |
181b |
31 (18.42) |
< 0.0001 |
|
|
Número medio de empeoramientos del asma/año-paciente |
2.145 |
2.835 |
24 (9.37) |
0.0031 |
a La razón de riesgo, el intervalo de confianza y el valor p se obtuvieron a partir de un modelo de riesgos proporcionales de Cox únicamente con tratamiento como efecto. La reducción del riesgo porcentual es 100 (1-razón de riesgo).
b Tiempo hasta el primer evento: días en tratamiento para cuando el 25% de los pacientes tenían al menos una exacerbación severa del asma o un empeoramiento del asma.
Figura 6. Exacerbaciones severas del asma a lo largo del tiempo en los estudios en asma en PrimoTinA
• Las tasas de respondedores según el Cuestionario de Control del Asma (Asthma Control Questionnaire, ACQ), definidas como el porcentaje de pacientes con una mejoría de por lo menos 0.5 puntos, fueron significativamente más altas con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® (53.9% frente a 46.9%; p = 0.0427).
• Los puntajes medios del Cuestionario de Calidad de Vida en el Asma. (Asthma Quality of Life Questionnaire, AQLQ[S]) para SPIRIVA® en su Dispositivo Dosificador RESPIMAT® mejoraron significativamente respecto del placebo en la semana 24.
En los dos estudios en asma de 6 meses de duración (MezzoTinA) realizados en pacientes que presentaban sintomatología estando bajo tratamiento de mantenimiento con ICS en dosis intermedias, SPIRIVA® en su Dispositivo Dosificador RESPIMAT® evidenció mejorías significativas en la función pulmonar respecto del placebo cuando se usó como terapia complementaria del tratamiento de base.
• En la semana 24, los valores medios de la mejoría en los valores pico y remanente de VEF1 fueron 0.185 litros (IC del 95%: 0.146 a 0.223 litros, p < 0.0001) y 0.146 litros (0.105 a 0.188 litros, p < 0.0001), respectivamente. Los valores pico y remanente de VEF1 para el salmeterol fueron 0.196 litros (IC del 95%: 0.158 a 0.234 litros) y 0.114 litros (IC del 95%: 0.073 a 0.155 litros), respectivamente.
• SPIRIVA® en su Dispositivo Dosificador RESPIMAT® mejoró significativamente los valores matutinos y vespertinos de FEM (matutino: 24 L/min, IC del 95%: 18 a 31 L/min, p < 0.0001; vespertino: 23 L/min, IC del 95%: 17 a 30 L/min, p < 0.0001). Los valores matutinos y vespertinos de FEM para el salmeterol en comparación con el placebo fueron 25 L/min (IC 95%: 19 a 31 L/min) y 21 L/min (IC del 95%: 15 a 27 L/min), respectivamente.
• Los pacientes tratados con SPIRIVA® en su Dispositivo Dosificador RESPIMAT® tuvieron una tasa de respondedor de ACQ significativamente más alta en la semana 24 en comparación con los pacientes que recibieron placebo (Tabla 3).
Tabla 3. Respondedores ACQ en los pacientes que presentan sintomatología estando bajo tratamiento con ICS (estudios de asma MezzoTinA)
|
Estudio |
Tratamiento |
Respondedor de ACQ (%) |
Valor p* |
|
Estudios de Fase III de 24 semanas de duración, análisis combinado |
Placebo, tratamiento complementario a ICS (N = 518) |
57.7 |
|
|
SPIRIVA® en su dispositivo dosificador RESPIMAT®, tratamiento complementario de ICS (N = 513) |
64.3 |
0.0348 |
|
|
Salmeterol, tratamiento complementario de ICS (N = 535) |
66.5 |
0.0039 |
* Calculado como 2* valor p de una cola en la dirección correspondiente a la comprobación de la hipótesis nula.
En el estudio en asma de 12 semanas de duración (GraziaTinA) realizado en pacientes que presentaban sintomatología estando bajo tratamiento de mantenimiento con ICS en dosis bajas, SPIRIVA® en su Dispositivo Dosificador RESPIMAT® evidenció mejorías significativas en la función pulmonar respecto del placebo cuando se usó como terapia complementaria del tratamiento de base. A las 12 semanas, los valores medios de la mejoría en los valores pico y remanente de VEF1 fueron 0.128 litros (IC del 95%: valores medio 0.057 a 0.199 litros, p < 0.0005) y 0.122 litros (IC 95%: 0.049 a 0.194 litros, p < 0.0010), respectivamente.
El bromuro de tiotropio es un compuesto de amonio cuaternario no-quiral y es moderadamente hidrosoluble. El bromuro de tiotropio está disponible en forma de solución inhalable administrado con el Dispositivo Dosificador RESPIMAT®. Aproximadamente el 40% de la dosis inhalada se deposita en los pulmones, el órgano blanco y la cantidad restante se deposita en el tubo digestivo. Algunos de los datos farmacocinéticos descritos más abajo se obtuvieron con dosis más altas que las recomendadas para el tratamiento.
Absorción: Después de la inhalación por voluntarios jóvenes sanos, los datos sobre la excreción urinaria sugieren que aproximadamente el 33% de la dosis inhalada llega a la circulación sistémica. Las soluciones orales de tiotropio tienen una biodisponibilidad absoluta del 2-3%. No se espera que los alimentos afecten la absorción del tiotropio por la misma razón. Las concentraciones plasmáticas máximas de bromuro de tiotropio se observaron 5 a 7 minutos después de la inhalación. En estado estable, se alcanzaron concentraciones plasmáticas pico de tiotropio de 10.5 pg/ml en los pacientes con EPOC, las cuales se redujeron rápidamente con una cinética multicompartimental. Las concentraciones plasmáticas remanentes en el estado estable fueron 1.60 pg/ml.
Se logró una concentración plasmática pico en estado estable de tiotropio de 5.15 pg/ml 5 minutos después de la administración de la misma dosis a pacientes con asma.
Distribución: El fármaco presenta un grado de unión a las proteínas plasmáticas del 72% y muestra un volumen de distribución de 32 L/Kg. Se desconocen las concentraciones locales en los pulmones, pero la vía de administración sugiere que las concentraciones en los pulmones son sustancialmente más elevadas. Estudios en ratas han demostrado que el tiotropio no atraviesa la barrera hemato-encefálica en forma relevante.
Biotransformación: La magnitud de la biotransformación es pequeña. Esto se pone en evidencia en la excreción urinaria del 74% de la sustancia sin ninguna alteración después de administrar una dosis endovenosa a voluntarios sanos jóvenes. El bromuro de tiotropio, un éster, se adhiere no enzimáticamente al alcohol N-metilescopina y al ácido ditienilglicólico, ninguno de los cuales se fija a los receptores muscarínicos.
Experimentos in vitro con microsomas hepáticos humanos y hepatocitos humanos sugieren que una parte del fármaco (< 20% de la dosis después de la administración endovenosa) es metabolizada por la oxidación dependiente del citocromo P450 y la conjugación subsiguiente del glutatión a una variedad de metabolitos de la fase II. Esta vía enzimática puede ser inhibida por los inhibidores de CYP450 2D6 (y 3A4) quinidina, ketoconazol y gestodeno. Por ende, CYP450 2D6 y 3A4 participan en la vía metabólica que es responsable de la eliminación de una menor parte de la dosis. Incluso a concentraciones supra-terapéuticas, el bromuro de tiotropio no inhibe el citocromo P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 o 3A en microsomas hepáticos humanos.
Eliminación: La vida media efectiva del tiotropio se ubica en el rango de 27 a 45 horas después de la inhalación en pacientes con EPOC. La vida media efectiva fue de 34 horas en los pacientes con asma. La depuración total fue de 880 ml/min. Después de una dosis endovenosa en voluntarios sanos jóvenes. El bromuro de tiotropio administrado por vía endovenosa se excreta principalmente en la orina sin alteraciones (74%). Después de la inhalación de la solución en pacientes con EPOC, la excreción urinaria es de 18.6% (0.93 μg) de la dosis, el resto es fármaco no absorbido en el intestino que se elimina por la vía fecal. En los pacientes con asma, el 11.9% (0.595 μg) de la dosis se excreta inalterado en la orina a lo largo de las 24 horas posteriores a la dosis en estado estable.
La depuración del tiotropio por la vía renal excede la depuración de creatinina, lo que indica secreción urinaria. Después de la inhalación diaria crónica una sola vez al día, se alcanzó el estado farmacocinéticamente estable para el día 7 sin que hubiera acumulación a partir de ese momento.
Linealidad/no-linealidad: El tiotropio demuestra una farmacocinética lineal en el intervalo terapéutico independiente de la formulación.
Pacientes pediátricos:
El programa clínico de fase III para el asma persistente en los pacientes pediátricos (entre 1 y 17 años) incluyó:
• Adolescentes (entre 12 y 17 años): Estudios aleatorizados, doble ciego, controlados con placebo, uno de ellos con 1 año de duración y uno con 12 semanas de duración, en un total de 789 pacientes con asma (264 pacientes recibieron SPIRIVA® con su Dispositivo Dosificador RESPIMAT®).
• Niños (entre 6 y 11 años): Estudios aleatorizados, doble ciego, controlados con placebo, uno de ellos con 1 año de duración y uno con 12 semanas de duración, en un total de 801 pacientes con asma (265 pacientes recibieron SPIRIVA® con su Dispositivo Dosificador RESPIMAT®).
• Niños (entre 1 y 5 años): Un estudio aleatorizado, doble ciego, controlado con placebo, con 12 semanas de duración, en un total de 101 pacientes con asma (31 pacientes recibieron SPIRIVA® con su Dispositivo Dosificador RESPIMAT®).
En todos estos estudios, los pacientes recibían un tratamiento de base con, al menos, ICS.
Adolescentes (entre 12 y 17 años): En el estudio sobre asma, de 1 año de duración (RubaTinA) en pacientes que fueron sintomáticos durante el tratamiento de mantenimiento con, al menos, una dosis media de ICS, SPIRIVA® con su Dispositivo Dosificador RESPIMAT® demostró mejorías significativas en la función pulmonar, controlado con placebo, cuando se administró como tratamiento complementario al de base.
• En la semana 24, los valores medios de las mejorías en la VEF1 pico y valle fueron 0,174 litros (IC del 95%: 0,076 a 0,272 litros, p = 0,0005) y 0,117 litros (IC del 95%: 0,010 a 0,223 litros, p = 0,0320), respectivamente.
• En la semana 24, SPIRIVA® con su Dispositivo Dosificador RESPIMAT® mejoró significativamente el FEM matutino y vespertino (matutino 15,8 L/min; IC del 95%: 2,3, 29,3 L/min, p = 0,0214; vespertino 16,7 L/min; IC del 95%: 3,4, 30,0 L/min, p = 0,0137).
• Los efectos del broncodilatador de SPIRIVA® con su Dispositivo Dosificador RESPIMAT® se mantuvieron durante un periodo de administración de 1 año, sin evidencia de taquifilaxia (Figura 7).
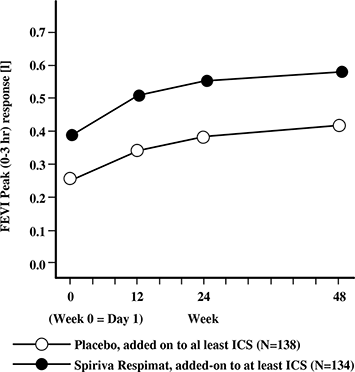
Figura 7. Respuesta de VEF1 pico durante 48 semanas en el estudio sobre asma. Referencias de la Figura 7: FEV1 Peak = VEF1 pico; Week = Semana; Day = Día; Placebo; Placebo, added-on to at least ICS = Placebo, sumado a por lo menos ICS; Spiriva Respimat, added-on to at least ICS = Spiriva Respimat, sumado a por lo menos ICS.
En el estudio sobre asma de 12 semanas de duración en pacientes que fueron sintomáticos en el tratamiento de mantenimiento con, al menos, una dosis media de ICS, combinado con una o más medicaciones de control, SPIRIVA® con su Dispositivo Dosificador RESPIMAT® demostró mejorías en la función pulmonar controlado con placebo, cuando se usó como tratamiento complementario al de base; no obstante, no fueron estadísticamente significativas las diferencias en la VEF1 pico y valle.
• En la semana 12, los valores medios de las mejorías en la VEF1 pico y valle fueron 0,090 litros (IC del 95%: -0,019 a 0,198 litros, p = 0,1039) y 0,054 litros (IC del 95%: -0,061 a 0.168 litros, p = 0,3605), respectivamente.
• En la semana 12, SPIRIVA® con su Dispositivo Dosificador RESPIMAT® mejoró significativamente el FEM matutino y vespertino (matutino 17,4 L/min; IC del 95%: 5,1 a 29,6 L/min; vespertino 17,6 L/min; IC del 95%: 5,9 a 29,6 L/min).
Niños (entre 6 y 11 años de edad): En el estudio sobre asma, de 1 año de duración en pacientes que fueron sintomáticos en el tratamiento de mantenimiento con, al menos, una dosis media de ICS, SPIRIVA® con su Dispositivo Dosificador RESPIMAT® demostró mejorías significativas en la función pulmonar y en el control de asma control controlado con placebo cuando se usó como tratamiento complementario al de base.
• En la semana 24, los valores medios de las mejorías en la VEF1 pico y valle fueron 0,164 litros (IC del 95%: 0,103 a 0,225 litros, p < 0,0001) y 0,118 litros (IC del 95%: 0,048 a 0,188 litros, p = 0,0010), respectivamente.
• Los efectos del broncodilatador de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® se mantuvieron durante un periodo de administración de 1 año, sin evidencia de taquifilaxia (Figura 8).
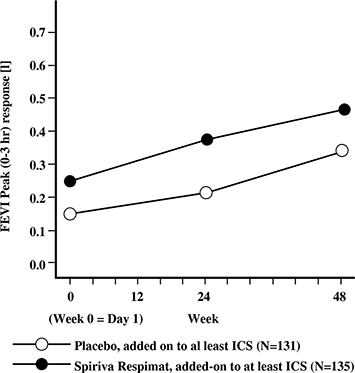
Figura 8. Respuesta de VEF1 pico durante 48 semanas en el estudio sobre asma.
Referencias de la Figura 8: FEV1 Peak = VEF1 pico; Week = Semana; Day = Día; Placebo; Placebo, added-on to at least ICS = Placebo, sumado a por lo menos ICS; Spiriva Respimat, added-on to at least ICS = Spiriva Respimat, sumado a por lo menos ICS.
En el estudio sobre asma, de 12 semanas de duración (VivaTinA) en pacientes que fueron sintomáticos en el tratamiento de mantenimiento con, al menos, una dosis media de ICS, combinado con una o más medicaciones de control, SPIRIVA® con su Dispositivo Dosificador RESPIMAT® demostró mejorías significativas en la función pulmonar controlado con placebo, cuando se usó como tratamiento complementario al de base.
• En la semana 12, los valores medios de las mejorías en la VEF1 pico y valle fueron 0,139 litros (IC del 95%: 0,075 a 0,203 litros, p < 0,0001) y 0,087 litros (IC del 95%: 0,019 a 0,154 litros, p = 0,0117), respectivamente.
Niños (entre 1 y 5 años): Se realizó un estudio clínico aleatorizado, doble ciego, comparativo con placebo, de fase II/III, sobre asma (NinoTinA), en el que participaron 101 niños con asma (31 recibieron SPIRIVA® con su Dispositivo Dosificador RESPIMAT®), que recibían tratamiento con, al menos, ICS.
Se usó una cámara con una mascarilla Aerochamber® Plus Flow-Vu® para administrar el medicamento de prueba en 98 pacientes.
El objetivo primario del estudio fue seguridad; las evaluaciones de eficacia fueron exploratorias.
La cantidad de eventos adversos de pacientes con asma fue inferior en los pacientes que recibieron SPIRIVA® con su Dispositivo Dosificador RESPIMAT® controlado con placebo. Las evaluaciones exploratorias de eficacia no revelaron diferencias entre SPIRIVA® con su Dispositivo Dosificador RESPIMAT® y placebo. La eficacia en los pacientes entre 1 y 5 años de edad se extrapoló, sobre la base de la eficacia demostrada en pacientes de 6 años de edad y mayores.
Pacientes de edad avanzada: Como se espera con todos los fármacos de excreción predominantemente renal, el incremento de la edad se asoció con una disminución de la depuración renal del tiotropio (de 347 ml/min en los pacientes con EPOC < 65 años a 275 ml/min en los pacientes con EPOC ≥ 65 años). Esto no resulta en un incremento correspondiente del AUC0-6,ss o Cmax,ss. Se determinó que la exposición al tiotropio no varía en función de la edad en los pacientes con asma.
Pacientes pediátricos: No se demostró que la exposición pico y total a tiotropio sea diferente entre los pacientes pediátricos (entre 6 y 17 años) y los adultos con asma. En los pacientes con asma entre 1 y 5 años de edad, la exposición total según la medición por la excreción urinaria fue del 52 al 60%, inferior a la observada en pacientes con asma, de 6 años de edad y mayores; los datos de la exposición total, cuando se ajustó según el área de la superficie corporal, fueron comparables en todos los grupos etarios. Se administró SPIRIVA® con su Dispositivo Dosificador RESPIMAT® con una cámara con mascarilla en pacientes entre 1 y 5 años de edad.
Pacientes con insuficiencia renal: Tras la administración de tiotropio en un régimen de una dosis diaria mediante inhalación hasta alcanzar el estado estable en pacientes con EPOC, en presencia de un deterioro leve de la función renal (CLCR 50-80 ml/min) se observaron valores ligeramente más altos de AUC0-6,ss (entre 1.8% y 30% más altos) y valores de Cmax,ss similares en comparación con los pacientes con función renal normal (CIcr > 80 ml/min. En los pacientes con EPOC con insuficiencia renal de moderada a severa (depuración de creatinina < 50 ml/min.), la administración endovenosa de bromuro de tiotropio se tradujo en una duplicación de la exposición total (82% más altos y valores de Cmax un 52% más altos) en comparación con los pacientes con EPOC con función renal normal, la cual fue confirmada por las concentraciones plasmáticas posteriores a la inhalación del polvo seco.
En los pacientes con asma con insuficiencia renal leve (CLCR 50-80 ml/min), el tiotropio inhalado no provocó incrementos relevantes en la exposición en comparación con los pacientes con función renal normal.
Pacientes con insuficiencia hepática: No se espera que la insuficiencia hepática tenga alguna influencia relevante sobre la farmacocinética del tiotropio. El tiotropio se elimina predominantemente por la vía renal (74% en voluntarios sanos jóvenes) y por la unión simple no enzimática de los ésteres a los productos farmacológicamente inactivos.
CONTRAINDICACIONES: SPIRIVA® en su Dispositivo Dosificador RESPIMAT® está contraindicado en los pacientes con antecedentes de hipersensibilidad a la atropina o sus derivados, por ejemplo, al ipratropio u oxitropio o a cualquiera de los componentes de este producto.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: Existe una cantidad limitada de datos sobre el uso de tiotropio en las mujeres embarazadas. Los estudios en animales no indican efectos nocivos directos ni indirectos en lo que se refiere a la toxicidad para la reproducción en las dosis clínicamente relevantes (véase la sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
Como medida de precaución, es preferible evitar el uso de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® durante el embarazo.
No se cuenta con datos clínicos de mujeres expuestas a tiotropio durante la lactancia. Con base en estudios de roedores durante la lactancia, se sabe que se excreta una pequeña cantidad de tiotropio a la leche materna. En consecuencia, SPIRIVA® en su Dispositivo Dosificador RESPIMAT® no debe usarse en mujeres embarazadas o que estén lactando, a menos que el beneficio esperado sea mayor que cualquier posible riesgo para el niño por nacer o para el lactante.
REACCIONES SECUNDARIAS Y ADVERSAS: Muchos de los efectos no deseados mencionados pueden atribuirse a las propiedades anticolinérgicas de SPIRIVA® en su Dispositivo Dosificador RESPIMAT®.
Las reacciones adversas de los medicamentos se identificaron a partir de datos obtenidos en estudios clínicos y reportes espontáneos durante el uso post-aprobación del medicamento. La base de datos de los estudios clínicos para EPOC incluye 3,282 pacientes de SPIRIVA® EN SU DISPOSITIVO DOSIFICADOR RESPIMAT® a partir de 7 ensayos clínicos controlados con placebo con periodos de tratamiento que van entre cuatro semanas a un año, que representan 2,440 personas año de exposición.
La base de datos de estudios clínicos para asma incluye 1,930 pacientes tratados con tiotropio de 12 estudios controlados con placebo con periodos de tratamiento de entre doce semanas y un año, lo que representa 1,128 años-persona de exposición al tiotropio.
La frecuencia está definida usando la siguiente convención:
Muy común (≥ 1/10); Común (≥ 1/100 a < 1/10); No común (≥ 1/1,000 a < 1/100); Raro (≥ 1/10,000 a < 1/1,000); muy raro (< 1/10,000), no conocido (no puede ser estimado con los datos disponibles).
|
Clasificación Sistemas y Órganos/MedDRA Términos preferidos |
Frecuencia EPOC |
Frecuencia Asma |
|
Trastornos del metabolismo y nutricionales |
||
|
Deshidratación |
No Conocido |
No Conocido |
|
Trastornos del sistema nervioso |
||
|
Mareo |
No común |
No común |
|
Dolor de cabeza |
No común |
No común |
|
Insomnio |
No conocido |
No común |
|
Trastornos oculares |
||
|
Glaucoma |
Raro |
No conocido |
|
Incremento en la presión intraocular |
Raro |
No conocido |
|
Visión borrosa |
Raro |
No conocido |
|
Trastornos cardiacos |
||
|
Fibrilación auricular |
No común |
No conocido |
|
Palpitaciones |
No común |
No común |
|
Taquicardia supraventricular |
No común |
No conocido |
|
Taquicardia |
No común |
No conocido |
|
Trastornos respiratorios, torácicos y del mediastino |
||
|
Tos |
No común |
No común |
|
Epistaxis |
No común |
No conocido |
|
Faringitis |
No común |
No común |
|
Disfonía |
No común |
No común |
|
Broncoespasmo |
Raro |
No común |
|
Laringitis |
Raro |
No conocido |
|
Sinusitis |
No conocido |
No conocido |
|
Trastornos gastrointestinales |
||
|
Boca seca |
Común |
Común |
|
Constipación |
No común |
Raro |
|
Candidiasis orofaríngea |
No común |
No común |
|
Disfagia |
No común |
No conocido |
|
Enfermedad por reflujo gastroesofágico |
Raro |
No conocido |
|
Caries |
Raro |
No conocido |
|
Gingivitis |
Raro |
Raro |
|
Glositis |
Raro |
No conocido |
|
Estomatitis |
Raro |
Raro |
|
Obstrucción intestinal, incluyendo íleo paralítico |
No conocido |
No conocido |
|
Náusea |
No conocido |
No conocido |
|
Trastornos de la piel y el tejido subcutáneo, trastornos del sistema inmune |
||
|
Rash |
No común |
Raro |
|
Prurito |
No común |
Raro |
|
Edema angioneurótico |
Raro |
Raro |
|
Urticaria |
Raro |
Raro |
|
Infección en la piel/úlceras de la piel |
Raro |
No conocido |
|
Piel seca |
Raro |
No conocido |
|
Hipersensibilidad (incluyendo reacciones inmediatas) |
No conocido |
Raro |
|
Reacción anafiláctica |
No conocido |
No conocido |
|
Trastornos del tejido conectivo y musculoesquelético |
||
|
Inflamación de las articulaciones |
No conocido |
No conocido |
|
Trastornos renales y urinarios |
||
|
Retención urinaria (generalmente en hombres con factores predisponentes) |
No común |
No conocido |
|
Disuria |
No común |
No conocido |
|
Infección del tracto urinario |
Raro |
No conocido |
Población pediátrica: La frecuencia, el tipo y la gravedad de las reacciones adversas en los pacientes pediátricos son similares en comparación con los adultos.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: En ratones, ratas y perros, la toxicidad aguda del producto administrado por inhalación o por vía oral fue baja; por ende, es improbable que una sobredosis aguda del fármaco en los seres humanos produzca efectos tóxicos. Los estudios de seguridad farmacológica de dosis únicas mostraron los efectos previsibles de un fármaco anticolinérgico, incluyendo midriasis, elevación de la frecuencia cardiaca y prolongación del tiempo de tránsito gastrointestinal.
Los efectos secundarios en los estudios de dosis repetidas en ratas, ratones y perros estuvieron relacionados con las propiedades anticolinérgicas del bromuro de tiotropio,e incluyeron midriasis, elevación de la frecuencia cardiaca, estreñimiento, menor aumento de peso corporal y disminución de la secreción de las glándulas salivales y lagrimales. Se observaron otros cambios de importancia: irritación de las vías respiratorias altas en las ratas, evidencia de rinitis y cambios en el epitelio de la cavidad nasal y la laringe, y prostatitis acompañada de depósitos proteináceos y litiasis en la vejiga en las ratas macho, aumento del peso pulmonar en las ratas y disminución del peso cardiaco en perros.
En los estudios sobre reproducción en conejos y ratas sólo fue posible demostrar efectos dañinos relacionados con el embarazo, el desarrollo embrionario/fetal, el parto o el desarrollo post-natal a niveles de la dosis que fueron tóxicos para la madre. En un estudio general sobre reproducción y fertilidad en ratas no hubo indicios de efectos adversos sobre la fertilidad o el apareamiento de los padres o sus descendientes en ninguna de las dosis.
En ratas jóvenes expuestas a partir del día 7 postnatal hasta la madurez sexual, se observaron los mismos cambios farmacológicos directos e indirectos, en los estudios de toxicidad de dosis repetidas como así también rinitis. No se observó toxicidad sistémica y no se observaron efectos toxicológicos relevantes en los parámetros claves del desarrollo, desarrollo de órganos clave y en la tráquea.
En una serie de ensayos de mutagenicidad in vivo e in vitro, el bromuro de tiotropio no ocasionó mutaciones génicas en las procariotas y eucariotas, daño cromosómico en condiciones in vitro e in vivo o daño al ADN primario.
No se cuenta con datos clínicos de Tiotropio relacionados con la fertilidad. Un estudio pre-clínico realizado con Tiotropio no indicó ningún efecto adverso sobre la fertilidad (ver sección de precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Aun cuando no se han realizado estudios formales de interacciones medicamentosas, el bromuro de tiotropio se ha usado concomitantemente con otros fármacos comúnmente empleados para el tratamiento de la EPOC y el asma, incluidos los broncodilatadores simpaticomiméticos, las metilxantinas, los esteroides orales e inhalados, antihistamínicos, mucolíticos modificadores de leucotrienos, cromonas, y tratamiento anti-IgE, sin evidencia clínica de interacciones medicamentosas.
Se comprobó que los medicamentos que son comúnmente administrados en forma concomitante en los pacientes con EPOC (agonistas beta de acción prolongada, corticoesteroides inhalados y sus combinaciones) no alteran la exposición al tiotropio.
No se ha estudiado la co-administración crónica de bromuro de tiotropio con otros fármacos anticolinérgicos. En consecuencia, no se recomienda la co-administración crónica de otros fármacos anticolinérgicos con SPIRIVA® en su Dispositivo Dosificador RESPIMAT®.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se ha reportado ninguna alteración hasta la fecha.
PRECAUCIONES GENERALES: Dado que SPIRIVA® en su Dispositivo Dosificador RESPIMAT® es un broncodilatador de mantenimiento que se usa una sola vez al día, no debe emplearse para el tratamiento inicial de los episodios agudos de broncoespasmo, ni para el alivio de los síntomas agudos. En el caso de un ataque agudo, debe usarse un agonista-beta-2 de acción rápida.
SPIRIVA® en su Dispositivo Dosificador RESPIMAT® no debe usarse como tratamiento de primera elección para el asma. Debe indicarse a los pacientes asmáticos que deben continuar tomando su tratamiento antiinflamatorio, por ejemplo corticosteroides inhalados, sin ningún cambio de dosis luego de la introducción de SPIRIVA® en su Dispositivo Dosificador RESPIMAT®, incluso aunque sus síntomas mejoren.
Puede haber reacciones inmediatas de hipersensibilidad después de la administración de la solución inhalable de SPIRIVA® en su Dispositivo Dosificador RESPIMAT®.
Al igual que otros fármacos anticolinérgicos, SPIRIVA® en su Dispositivo Dosificador RESPIMAT® debe usarse con precaución en los pacientes con glaucoma de ángulo cerrado, hiperplasia prostática u obstrucción del cuello vesical.
Las medicinas inhaladas pueden ocasionar broncoespasmo inducido por inhalación.
Como ocurre con todos los fármacos de excreción predominantemente renal, SPIRIVA® en su Dispositivo Dosificador RESPIMAT® debe monitorearse cuidadosamente en los pacientes con insuficiencia renal de moderada a severa (depuración de creatinina ≤ 50 ml/min).
Hay que darle a los pacientes instrucciones sobre la administración correcta de SPIRIVA® en su Dispositivo Dosificador RESPIMAT®. Hay que tener cuidado para que la solución no entre a los ojos. El dolor o molestia ocular, la visión borrosa, los halos visuales o las imágenes de colores asociadas con los ojos rojos debidos a congestión conjuntival y edema corneal pueden ser signos de glaucoma agudo de ángulo cerrado. En caso de desarrollar cualquier combinación de estos síntomas, hay que consultar de inmediato a un especialista. Las gotas oftálmicas mióticas no se consideran como un tratamiento efectivo.
SPIRIVA® en su Dispositivo Dosificador RESPIMAT® no debe usarse más de una vez al día.
Los cartuchos de SPIRIVA® deben usarse sólo con el Dispositivo Dosificador RESPIMAT®.
No se han realizado estudios sobre los efectos en la capacidad para conducir y utilizar maquinaria. La aparición de mareo o visión borrosa puede afectar la capacidad para conducir y utilizar maquinaria.
DOSIS Y VÍA DE ADMINISTRACIÓN: La dosificación recomendada para SPIRIVA® en su Dispositivo Dosificador RESPIMAT® es la inhalación de dos disparos una vez al día, a la misma hora del día, utilizando el Dispositivo Dosificador RESPIMAT® (consulte las instrucciones de uso).
En el tratamiento del asma, los beneficios máximos en la función pulmonar pueden tomar hasta 4 a 8 semanas de dosificación.
Poblaciones especiales: Los pacientes de edad avanzada pueden usar SPIRIVA® en su Dispositivo Dosificador RESPIMAT® a la dosis recomendada.
Los pacientes con insuficiencia renal pueden usar SPIRIVA® en su Dispositivo Dosificador RESPIMAT® a la dosis recomendada. No obstante, como ocurre con todos los fármacos de excreción predominantemente renal, el uso de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® debe monitorearse cuidadosamente en los pacientes con insuficiencia renal de moderada a severa.
Los pacientes con insuficiencia hepática pueden usar SPIRIVA® en su Dispositivo Dosificador RESPIMAT® a la dosis recomendada.
Poblaciones especiales: Normalmente, la EPOC no se presenta en niños.
En asma, la posología recomendada de SPIRIVA® RESPIMAT® en pacientes entre 6 y 17 años de edad es la inhalación de la solución pulverizada que se obtiene a partir de dos aplicaciones (disparos) una vez al día mediante su Dispositivo Dosificador RESPIMAT®, a la misma hora todos los días.
La eficacia y la seguridad de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® en pacientes pediátricos menores de 1 año de edad con asma aún no ha sido determinada.
Instrucciones de uso:
Los niños deben utilizar SPIRIVA® en su Dispositivo Dosificador RESPIMAT® con la ayuda de un adulto.
Usted debe usar este Dispositivo Dosificador sólo UNA VEZ AL DÍA.
Cada vez que lo use inhale dos disparos.

Cómo cuidar su Dispositivo Dosificador RESPIMAT® de SPIRIVA®: Al menos una vez a la semana, debe limpiar la boquilla, incluyendo la parte metálica del interior de la boquilla, únicamente con un paño o pañuelo de papel húmedo.
Puede producirse un ligero cambio en el color de la boquilla, que no afecta el funcionamiento de su Dispositivo Dosificador RESPIMAT®.
Cuando debe adquirir un nuevo Dispositivo Dosificador RESPIMAT® de SPIRIVA®

El Dispositivo Dosificador RESPIMAT® de SPIRIVA® contiene 60 aplicaciones (30 dosis) si se usa como se ha indicado (2 aplicaciones una vez al día).
El indicador de la dosis muestra de manera aproximada cuánta medicación queda.
Cuando el indicador ingrese en la zona roja de la escala, usted deberá conseguir una nueva receta; quedará medicación para aproximadamente 7 días más (14 aplicaciones).
Una vez que el indicador de dosis llegue al final de la escala roja, su Dispositivo Dosificador RESPIMAT® de SPIRIVA® se trabará automáticamente y no liberará más dosis. A partir de ese momento, ya no se podrá girar más la base.
Una vez cumplidos tres meses después del primer uso, su Dispositivo Dosificador RESPIMAT® de SPIRIVA® deberá ser desechado aunque no haya sido utilizado más veces.
¿Cómo preparar el Dispositivo Dosificador para usarlo por primera vez?
|
1. Remueva la base transparente. • Mantenga la tapa cerrada. • Presione el seguro al mismo tiempo que jala firmemente de la base transparente con su otra mano. |
|
|
2. Inserte el cartucho • Introduzca en el Dispositivo Dosificador el extremo del cartucho de menor diámetro. • Coloque el Dispositivo Dosificador sobre una superficie dura y presione con firmeza hasta que quede correctamente ubicado. |
|
|
3. Coloque nuevamente la base transparente. • Coloque la base transparente de vuelta en su lugar hasta que escuche un click. |
|
|
4. Gire. • Mantenga la tapa cerrada. • Gire la base transparente en la dirección que le indican las flechas de la etiqueta hasta que escuche un click (media vuelta). |
|
|
5. Abra la tapa. • Abra la tapa por completo. |
|
|
6. Presione • Apunte el Dispositivo Dosificador hacia el suelo. • Presione el botón para liberar la dosis. • Cierre la tapa. • Repita los pasos 4 a 6 hasta que una nube sea visible. • Cuando se haya formado una nube, repita los pasos 4 a 6 tres veces más. |
|
Uso diario
|
GIRE • Mantenga la tapa cerrada. • GIRE la base transparente en la dirección de las flechas que marca la etiqueta hasta que escuche un click (media vuelta). |
|
|
ABRA • ABRA la tapa por completo. |
|
|
PRESIONE • Exhale en forma lenta todo el aire de los pulmones. • Coloque sus labios alrededor de la boquilla sin cubrir los orificios de ventilación. • Mientras inhala lenta y profundamente por la boca, PRESIONE el botón de liberación de dosis y continúe inhalando. • Mantenga la respiración por 10 segundos o durante todo el tiempo que pueda sin que llegue a resultarle incómodo. • Repita los pasos: Gire, Abra, Presione para recibir un total de dos aplicaciones. |
|
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Las dosis altas de SPIRIVA® en su Dispositivo Dosificador RESPIMAT® pueden provocar signos y síntomas de tipo anticolinérgico.
No se observaron eventos adversos relevantes más allá de sequedad en la boca, garganta y mucosa nasal, en una incidencia dependiente de la dosis [10-40 microgramos al día], después de 14 días de dosificación de hasta 40 mcg de solución de inhalación de tiotropio en voluntarios sanos, a excepción de la reducción pronunciada en la salivación a partir del día 7 en adelante. No se han observado efectos no deseados significativos en seis estudios a largo plazo en pacientes con EPOC con una dosis diaria de 10 mcg de solución para inhalación de tiotropio a lo largo de 4-48 semanas.
PRESENTACIÓN: Caja de cartón con cartucho con 4 ml y Dispositivo Dosificador (RESPIMAT®) e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 25°C.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. No se administre durante el embarazo y la lactancia.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx y
farmacovigilancia-mex@boehringer-ingelheim.com
Hecho en Alemania por:
Boehringer Ingelheim Pharma GmbH & Co. KG.
Binger Strasse 173, 55216 Ingelheim am Rhein, Alemania.
Distribuido por:
BOEHRINGER INGELHEIM PROMECO, S.A. de C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocán,
C.P. 16090, Xochimilco, Ciudad de México, México.
Reg. Núm. 034M2010, SSA IV
®Marca registrada