SPRIAFIL®
POSACONAZOL
Suspensión
1 Caja, 1 Frasco con cuchara dosificadora, 105 ml, 40 mg/ml
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Suspensión
Cada 100 mL contienen:
Posaconazol 4 g
Vehículo cbp 100 mL
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 369M2014 SSA IV
Número de Tracer: MK5592-MEX-2017-016446
IV. INDICACIONES TERAPÉUTICAS
Spriafil® Suspensión oral está indicado para la profilaxis de infecciones fúngicas invasivas, incluyendo tanto levaduras como mohos, en pacientes de 13 años de edad y mayores, que tienen alto riesgo de desarrollar estas infecciones, incluyendo aquellos con neutropenia o que han pasado por trasplante de células madre hematopoyéticas (HSCT, por sus siglas en inglés).
Spriafil® Suspensión oral está indicado en el tratamiento de las siguientes infecciones fúngicas en pacientes de 13 años de edad y mayores:
• Aspergilosis invasiva en pacientes con enfermedad refractaria a anfotericina B, itraconazol o voriconazol, o en pacientes que sean intolerantes a estos medicamentos. La refractariedad se define como la progresión de la infección o la ausencia de mejoría después de un mínimo de 7 días de dosis terapéuticas previas de terapia antimicótica efectiva.
• Candidiasis esofágica o candidemia en pacientes con una enfermedad refractaria a anfotericina B, fluconazol o itraconazol, o en pacientes que no toleran estos medicamentos. La refractariedad se define como la progresión de la infección o la ausencia de mejoría después de un periodo mínimo de tratamiento (fungemia persistente: 3 días; infecciones no fúngicas: 7 días; candidiasis esofágica: 14 días) de dosis terapéuticas anteriores de terapia antimicótica efectiva.
• Fusariosis, zigomicosis, criptococcosis, cromoblastomicosis y micetoma en pacientes con enfermedad refractaria a otra terapia antifúngica o pacientes que son intolerantes a otra medicación.
• Coccidioidomicosis
• Candidiasis orofaríngea, incluyendo a pacientes con enfermedad refractaria a itraconazol y fluconazol. La refractariedad se define como la progresión de la infección o la ausencia de mejoría después de un mínimo de 7 días de dosis terapéuticas previas de terapia antimicótica efectiva.
V. FARMACOCINÉTICA Y FARMACODINAMIA
PROPIEDADES FARMACODINÁMICAS
Mecanismo de Acción
Spriafil® Suspensión oral es un inhibidor potente de la enzima lanosterol 14α-demetilasa que cataliza un paso esencial en la biosíntesis del ergosterol.
Efectos Farmacodinámicos
Microbiología
Spriafil® Suspensión oral ha demostrado, in vitro y en infecciones clínicas, actividad contra los siguientes microorganismos: especies de Aspergillus (A. fumigatus, A. flavus, A. terreus, A. nidulans, A. niger, A. ustus, A. ochraceus), especies de Cándida (C. albicans, C. glabrata, C. krusei, C. parapsilosis), Cryptococcus neoformans, Coccidioides immitis, Fonsecaea pedrosoi, Histoplasma capsulatum, Pseudallescheria boydii y especies de Alternaria, Exophiala, Fusarium, Ramichloridium, Rhizomucor, Mucor y Rhizopus.
Spriafil® Suspensión oral exhibe también actividad in vitro contra las siguientes levaduras y mohos: Candida dubliniensis, C. famata, C. guilliermondii, C. lusitaniae, C. kefyr, C. rugosa, C. tropicalis, C. zeylanoides, C. inconspicua, C. lipolytica, C. norvegensis, C. pseudotropicalis, Cryptococcus laurentii, Kluyveromyces marxianus, Saccharomyces cerevisiae, Yarrowia lipolytica, especies de Pichia y Trichosporum, Aspergillus sydowii, Bjerkandera adusta, Blastomyces dermatitidis, Epidermophyton floccosum, Paracoccidioides brasiliensis, Scedosporium apiospermum, Sporothrix schenckii, Wangiella dermatitidis y especies de Absidia, Apophysomyces, Bipolaris, Curvularia, Microsporum, Paecilomyces, Penicillium y Trichophyton. Sin embargo, la seguridad y eficacia de Spriafil® Suspensión oral en el tratamiento de infecciones clínicas causadas por estos microorganismos no se han establecido en estudios clínicos.
Spriafil® Suspensión oral exhibe una actividad antifúngica de amplio espectro contra algunas levaduras o mohos que en general no son susceptibles o son resistentes a otros azoles:
• Especies de Cándida (incluyendo cepas de C. albicans resistentes a fluconazol, voriconazol e itraconazol)
• C. krusei y C. glabrata que son inherentemente menos susceptibles a fluconazol
• C. lusitaniae que es inherentemente menos susceptible a anfotericina B
• Aspergillus (incluyendo cepas resistentes a fluconazol, voriconazol, itraconazol y anfotericina B)
• Organismos previamente no considerados como susceptibles a los azoles como Zygomycetes (por ejemplo, especies de Absidia, Mucor, Rhizopus y Rhizomucor)
In vitro Spriafil® Suspensión oral exhibió actividad fungicida contra diferentes especies de:
• Aspergillus
• Hongos dimórficos (Blastomyces dermatitidis, Histoplasma capsulatum, Penicillium marneffei, Coccidioides immitis)
• Algunas especies de Cándida
En modelos de infección en animales Spriafil® Suspensión oral demostró actividad contra una amplia variedad de infecciones fúngicas causadas por mohos o levaduras. Sin embargo, no se encontró una correlación consistente entre la concentración mínima inhibitoria y la eficacia. Los especímenes para el cultivo fúngico y otros estudios relevantes de laboratorio (incluyendo histopatología) deben obtenerse antes del tratamiento para aislar e identificar el (los) organismo(s) causal(es). La terapia puede instituirse antes de que se conozcan los resultados de los cultivos y otros estudios de laboratorio. Sin embargo, una vez que estos resultados estén disponibles, la terapia antimicótica deberá ajustarse de manera correspondiente.
Resistencia al fármaco
Las cepas de C. albicans resistentes a posaconazol suspensión oral no pueden generarse en el laboratorio; los mutantes espontáneos de Aspergillus fumigatus de laboratorio que exhiben una reducción en la susceptibilidad a posaconazol suspensión oral se desarrollaron en una frecuencia de 1x10-8 a 1x10-9. Los aislados clínicos de Candida albicans y Aspergillus fumigatus que exhiben disminuciones significativas en la susceptibilidad a posaconazol suspensión oral son raros. En los casos raros en donde se notó una menor susceptibilidad, no se estableció una correlación clara entre la disminución de la susceptibilidad y la falla clínica. El éxito clínico se ha observado en pacientes infectados con organismos resistentes a otros azoles; consistente con estas observaciones Spriafil® Suspensión oral fue activo in vitro contra muchas cepas de Aspergillus y Candida que desarrollaron resistencia a otros azoles y/o anfotericina B. Los valores de corte para Spriafil® Suspensión oral no han sido establecidos para ningún hongo.
COMBINACIONES DE FÁRMACOS ANTIMICÓTICOS
Cuando se combinó posaconazol suspensión oral con anfotericina B o caspofungina in vitro e in vivo no hubo o solamente hubo un antagonismo muy pequeño y en algunas circunstancias hubo un efecto aditivo. Se desconoce la significancia clínica de estos resultados.
PROPIEDADES FARMACOCINÉTICAS
Los hallazgos farmacocinéticos generales a través del programa clínico en voluntarios sanos y pacientes fueron consistentes, en que Spriafil® Suspensión oral se absorbe lentamente y se elimina lentamente con un volumen de distribución extenso.
La exposición a posaconazol tras la administración de 400 mg de suspensión oral dos veces al día fue ~3 veces mayor en los voluntarios sanos que en los pacientes, sin datos adicionales de seguridad a concentraciones más altas.
Absorción
Spriafil® suspensión oral se absorbe con una mediana de tmax de 3 horas (pacientes) y 5 horas (voluntarios sanos). La farmacocinética de Spriafil® suspensión oral es lineal después de la administración de dosis únicas y múltiples de hasta 800 mg. No se observó ningún aumento adicional en la exposición cuando se administraron dosis mayores de 800 mg diarios de suspensión oral en pacientes y voluntarios sanos. No hay ningún efecto de modificación en el pH sobre la absorción de Spriafil® suspensión oral.
La división de la dosis diaria total de posaconazol suspensión oral (800 mg) en 400 mg dos veces al día da como resultado una exposición 184% mayor en relación con la administración de una vez al día en pacientes.
Efecto de los alimentos en la absorción oral en voluntarios sanos
El área bajo la curva (ABC) de Spriafil® suspensión oral es aproximadamente 2.6 veces mayor cuando se administra con una comida sin grasas o un suplemento alimenticio (14 g de grasa) y 4 veces mayor cuando se administra con una comida alta en grasas (~50 g de grasa) en relación con el estado de ayuno. Spriafil® suspensión oral debe administrarse junto con alimentos o con un suplemento alimenticio.
Distribución
Spriafil® suspensión oral tiene un gran volumen aparente de distribución (1,774 L) lo que sugiere una extensa penetración en los tejidos periféricos.
Spriafil® Suspensión oral se une altamente a las proteínas plasmáticas (>98.0%) predominantemente a albúmina sérica.
Metabolismo
Spriafil® Suspensión oral no cuenta con metabolitos principales circulantes y es poco probable que sus concentraciones sean alteradas por los inhibidores de las enzimas CYP450. De los metabolitos circulantes, la mayoría son conjugados glucurónidos de posaconazol con sólo cantidades menores de metabolitos oxidativos (mediados por CYP450). Los metabolitos excretados en la orina y las heces representan aproximadamente 17% de la dosis administrada marcada radiactivamente.
Excreción
Spriafil® Suspensión oral se excreta predominantemente en las heces (77% de la dosis marcada radiactivamente), eliminando el componente principal como fármaco original (66% de la dosis marcada radiactivamente). La depuración renal es una vía de eliminación menor, con 14% de la dosis marcada excretada en la orina (<0.2 % de la dosis radiomarcada es el fármaco original).
Spriafil® Suspensión oral se elimina lentamente con una vida media (t½) promedio de 35 horas (rango de 20 a 66 horas) y una depuración corporal total (Cl/F) de 32 L/hr. El estado estable se alcanza después de 7 a 10 días de administración de dosis múltiples.
Poblaciones Especiales
Pediátrica
Después de la administración de 800 mg/día de posaconazol suspensión oral en dosis divididas para el tratamiento de infecciones fúngicas invasivas, las concentraciones plasmáticas valle promedio en 12 pacientes entre 8-17 años de edad (776 ng/mL) fueron similares a la concentración de 194 pacientes entre 18 - 64 años de edad (817 ng/mL). No se dispone de datos farmacocinéticos en pacientes pediátricos menores de 8 años de edad. De la misma forma, en los estudios de profilaxis la concentración plasmática promedio en estado estable de posaconazol (Cav) fue comparable entre 10 adolescentes (13-17 años de edad) a la Cav en adultos (≥18 años de edad).
En un estudio de 136 pacientes pediátricos de 11 meses a 17 años de edad con neutropenia tratados con posaconazol suspensión oral a dosis de hasta 18 mg/kg/día divididas en 3 dosis al día, aproximadamente el 50% cumplieron con el objetivo previamente especificado (Cavg en el día 7 de aproximadamente 500 ng/mL-2500 ng/mL).
En general, las exposiciones tendieron a ser más altas en los pacientes mayores (7 a <18 años) que en los pacientes más jóvenes (2 a <7 años). Ver Tabla 1.
Tabla 1: Distribución de Cavg por Dosis y Grupo de Edad al Día 7 en el Estudio P03579
|
Dosis |
Grupo de edad |
N |
Cavg (ng/mL) |
||||
|
<200 |
200-<500 |
500-<2500 |
2500-<3650 |
>3650 |
|||
|
12 mg/kg/día divididos BID |
2 a <7 años |
16 |
19% (3/16) |
44% (7/16) |
31% (5/16) |
6% (1/16) |
0 |
|
7 a <18 años |
14 |
14% (2/14) |
21% (3/14) |
65% (9/14) |
0 |
0 |
|
|
18 mg/kg/día divididos BID |
2 a <7 años |
12 |
25% (3/12) |
25% (3/12) |
50% (6/12) |
0 |
0 |
|
7 a <18 años |
12 |
8% (1/12) |
25% (3/12) |
50% (6/12) |
8% (1/12) |
8% (1/12) |
|
|
18 mg/kg/día divididos TID |
2 a <7 años |
5 |
20% (1/5) |
20% (1/5) |
60% (3/5) |
0 |
0 |
|
7 a <18 años |
10 |
20% (2/10) |
0 |
80% (8/10) |
0 |
0 |
|
|
12 mg/kg/día divididos TID |
3 meses a <2 años |
1 |
0 |
100% (1/1) |
0 |
0 |
0 |
|
Números entre paréntesis = (Número de sujetos en la categoría/Número total de sujetos) Rango de Cavg blanco (500-<2500 ng/mL) requerido para ~90% de sujetos para cumplir el criterio de éxito del estudio |
|||||||
Género
La farmacocinética de Spriafil® Suspensión oral es comparable en hombres y mujeres. No es necesario el ajuste de la dosis de Spriafil® Suspensión oral por razones de género.
Geriátrica
Se observó un incremento en la Cmáx (26%) y el ABC (29%) en sujetos de la tercera edad (24 sujetos ≥ 65 años de edad) en relación a sujetos jóvenes (24 sujetos 18-45 años de edad). Sin embargo, en un análisis farmacocinético de la población (Estudio 1899), la edad no influenció la farmacocinética de posaconazol suspensión oral. Además en los estudios de eficacia clínica, el perfil de seguridad de SPRIAFIL® Suspensión oral entre sujetos jóvenes y de la tercera edad fue similar. Por lo tanto no es necesario ajustar la dosis según la edad.
Raza
Los resultados de un estudio de dosis múltiples en voluntarios sanos (n=56) indicaron que había un leve descenso (16%) en el ABC y la Cmáx de posaconazol suspensión oral en sujetos de raza afroamericana en relación a los sujetos caucásicos. No se requiere ajuste de dosis.
Peso
El modelo farmacocinético de posaconazol suspensión oral sugiere que los pacientes que pesan más de 120 kg pueden tener una menor exposición a posaconazol. Por lo tanto, se sugiere monitorear de cerca las infecciones fúngicas en pacientes que pesan más de 120 kg. Insuficiencia renal
Después de la administración de una sola dosis, no hubo algún efecto de la insuficiencia renal leve y moderada (n=18, Cl cr ≥20 mL/min/1.73 m2) sobre la farmacocinética de Spriafil® Suspensión oral, por lo tanto, no se requiere ningún ajuste de dosis. En sujetos con insuficiencia renal grave (n=6, Cl cr < 20 mL/min/1.73 m2), la exposición de Spriafil® Suspensión oral fue altamente variable (>96% de coeficiente de variación, CV) comparado con la exposición de otros grupos (<40% CV). Sin embargo, ya que Spriafil® Suspensión oral no se elimina de manera significativa a través de la orina, no se espera ningún efecto de la insuficiencia renal grave sobre la farmacocinética de Spriafil® Suspensión oral y no se recomienda ningún ajuste de dosis. Spriafil® Suspensión oral no es eliminado a través de hemodiálisis. Debido a la variabilidad en la exposición, los pacientes con insuficiencia renal grave deberán ser monitoreados estrechamente para infecciones fúngicas intercurrentes.
Insuficiencia hepática
En un estudio con un número pequeño de sujetos (n=12) con insuficiencia hepática (Child-Pugh clase A, B o C), los valores de Cmáx generalmente disminuyeron con la severidad de la disfunción hepática (545, 414 y 347 ng/mL) para los grupos leve, moderado y grave, respectivamente, aunque los valores de Cmáx (promedio de 508 ng/mL) para los sujetos normales fueron consistentes con estudios anteriores en voluntarios sanos. Además el incremento de la vida media se asoció con una disminución en la función hepática (26.6, 35.5 y 46.1 horas para los grupos de insuficiencia leve, moderada y grave respectivamente), comparada con 22.1 horas en sujetos con función hepática normal. Debido a la limitada información de farmacocinética en pacientes con insuficiencia hepática, no pueden hacerse recomendaciones de ajuste de dosis.
ESTUDIOS CLÍNICOS
Farmacocinética y Seguridad de Posaconazol Suspensión Oral en Pacientes
Aspergilosis Invasiva
Eficacia en pacientes con enfermedad refractaria o intolerancia al tratamiento previo: La eficacia y supervivencia de posaconazol oral para el tratamiento de la aspergilosis invasiva en pacientes con enfermedad resistente a anfotericina B (incluidas las formulaciones liposomales) o itraconazol, o en pacientes que eran intolerantes a estos medicamentos, se demostró en 107 pacientes que participaron en un estudio de terapia de rescate. A los pacientes se les administró posaconazol suspensión oral, 800 mg/día en dosis divididas. La mayoría de los pacientes estaban severamente inmunocomprometidos con condiciones subyacentes como neoplasias hematológicas, incluyendo trasplante de médula ósea, trasplante de órganos sólidos, tumores sólidos y/o SIDA. Un panel de expertos independientes revisaron los datos de todos los pacientes, incluyendo el diagnóstico de aspergilosis invasiva, la refractariedad e intolerancia a la terapia previa y los resultados clínicos de forma paralela y ciega, con un grupo de control externo de 86 pacientes tratados con terapia estándar en su mayoría al mismo tiempo y en los mismos sitios que los pacientes reclutados en el ensayo con posaconazol suspensión oral. El éxito fue definido como resolución (respuesta completa) o una mejoría clínicamente significativa (respuesta parcial) de todos los signos, síntomas y hallazgos radiográficos atribuibles a la infección micótica. La enfermedad estable, sin progresión y la falla fueron consideradas como falta de éxito. La mayoría de los casos de aspergilosis se consideraron como refractarios tanto en el grupo de posaconazol suspensión oral (88%) como en el grupo de control externo (79%).
Como se muestra en la Tabla 2, se observó una respuesta global exitosa al final del tratamiento en 42% de los pacientes tratados con Spriafil® en comparación con 26% del grupo externo (P=0.006).
Tabla 2: Eficacia global de posaconazol suspensión oral al final del tratamiento para aspergilosis invasiva en comparación con un grupo control externo
|
Posaconazol |
Grupo de control externo |
|||
|
Respuesta global |
45/107 (42%) |
22/86 (26%) |
||
|
Relación 4.06 (95% CI: 1.50, 11.04) P=0.006 |
||||
|
Sobrevivencia al día 365 |
(38%) |
(22%) |
||
|
Éxito por especie |
||||
|
Todos confirmados micológicamente Aspergillus spp.* |
34/76 |
(45%) |
19/74 |
(26%) |
|
A. fumigatus |
12/29 |
(41%) |
12/34 |
(35%) |
|
A. flavus |
10/19 |
(53%) |
3/16 |
(19%) |
|
A. terreus |
4/14 |
(29%) |
2/13 |
(15%) |
|
A. niger |
3/5 |
(60%) |
2/7 |
(29%) |
* incluye otras especies menos comunes o especies desconocidas
Se observó un beneficio de posaconazol en la supervivencia, en comparación con el tratamiento estándar como se muestra en la Figura 1 (p<0.001).
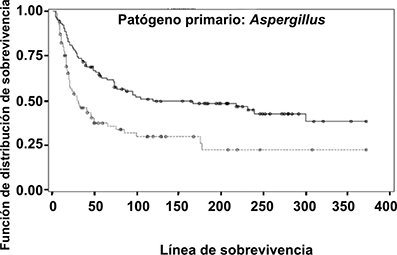
(Línea continua= curva de supervivencia de posaconazol, línea discontinua= otro tipo de terapia de rescate, curva de supervivencia). Todos los eventos de no-muerte se consideran censurados.
Figura 1. Análisis de Kaplan-Meier del tiempo de Supervivencia para sujetos con patógeno primario de Aspergillus.
Otros patógenos micóticos graves
Spriafil® Suspensión oral ha demostrado ser efectivo contra los siguientes patógenos cuando otros tratamientos han sido ineficaces o cuando el paciente había desarrollado intolerancia a la terapia previa:
Cándida: 11 de 23 pacientes respondieron a la terapia con Spriafil® Suspensión oral. Cinco de los pacientes con respuesta estaban infectados con VIH con enfermedad esofágica y 4 pacientes presentaban candidemia. Además, en especies no-albicans (C. krusei) resistentes a fluconazol se observó un resultado satisfactorio en 4 de 5 casos.
Zigomicosis: Se observó respuesta exitosa a la terapia con Spriafil® Suspensión oral en 7 de 13 pacientes con infecciones por zigomicetos. Los sitios de infección incluyeron senos paranasales, pulmones y piel. La mayoría de los pacientes presentaban neoplasia hematológica subyacente, la mitad de ellos requirieron un trasplante de médula ósea. La mitad de los pacientes fueron incluidos con intolerancia a la terapia anterior y la otra mitad como consecuencia de enfermedad refractaria al tratamiento previo. Se observó que tres pacientes tenían enfermedad diseminada, uno de los cuales tuvo buen resultado después de fallar la terapia con anfotericina B.
Fusarium spp.: 11 de 24 pacientes fueron tratados exitosamente con posaconazol suspensión oral, cuatro de los pacientes con respuesta tenían enfermedad diseminada y un paciente presentó una enfermedad localizada en el ojo, el resto de ellos tuvieron infección en diversos sitios. De los 24 pacientes, 7 presentaban neutropenia importante en la medición basal. Además, 3/5 pacientes con infección debida a F. solani que es típicamente resistente a la mayoría de los agentes antifúngicos, fueron tratados exitosamente.
Criptococcus: 15 de 31 pacientes fueron tratados exitosamente con Spriafil® Suspensión oral, la mayoría de ellos estaban infectados por VIH y presentaban meningitis criptocóccica refractaria.
Cromoblastomicosis/Micetoma: 9 de 11 pacientes fueron tratados exitosamente con Spriafil® Suspensión oral. Cinco de estos pacientes tuvieron cromoblastomicosis debida a Fonsecaea pedrosoi y cuatro presentaron micetoma, en su mayoría causada por especies de Madurella.
Coccidioidomicosis: La eficacia de Spriafil® Suspensión oral en el tratamiento primario de la coccidioidomicosis no meníngea fue demostrada en 15 pacientes clínicamente evaluables incluidos en un estudio abierto no comparativo para recibir 400 mg diarios de posaconazol suspensión oral durante 6 meses. La mayoría de los pacientes eran sanos por lo demás y tenían infecciones en sitios diversos. Una respuesta satisfactoria (definida como una mejoría de por lo menos 50% de la calificación Cocci definida por el grupo de ensayos clínicos BAMSG de Coccidioidomicosis) fue observada en 12 de 15 pacientes (80%) después de un tratamiento con Spriafil® Suspensión oral durante 4 meses. En otro estudio abierto, no comparativo, se analizaron la seguridad y eficacia de 400 mg de posaconazol suspensión oral dos veces al día en 16 pacientes con infección por coccidioidomicosis refractaria a tratamiento estándar. La mayoría de ellos habían sido tratados con anfotericina B (incluyendo formulaciones lipídicas) y/o itraconazol o fluconazol por meses a años antes del tratamiento con posaconazol suspensión oral. Al final del tratamiento con Spriafil® Suspensión oral se alcanzó una respuesta satisfactoria (resolución parcial o completa de los signos y síntomas presentes a nivel basal) según lo determinó un panel de expertos independiente en 11/16 (69%) de los pacientes. Un paciente con enfermedad del SNC que había fracasado con el tratamiento con fluconazol tuvo un resultado exitoso después de 12 meses de tratamiento con posaconazol suspensión oral.
Tratamiento de la candidiasis orofaríngea susceptible a azoles
Se completó un estudio controlado, aleatorizado, doble ciego en pacientes con VIH con candidiasis orofaríngea susceptible a azoles. La variable primaria de eficacia fue la tasa de éxito clínico (definido como curación o mejoría) después de 14 días de tratamiento. Los pacientes fueron tratados con suspensión oral de posaconazol o fluconazol (ambos se administraron de la siguiente manera: 100 mg dos veces al día durante 1 día seguido por 100 mg una vez al día por 13 días).
Las tasas de respuesta clínica y micológica para el estudio anterior se muestran en la Tabla 3.
Spriafil® y fluconazol demostraron tasas de éxito clínico equivalentes en el Día 14, así como 4 semanas después de finalizar el tratamiento. Sin embargo, Spriafil® Suspensión oral demostró una tasa significativamente mayor de respuesta micológica que fluconazol.
Tabla 3: Tasas de eficacia clínica y respuesta micológica en candidiasis orofaríngea
|
Punto final de evaluación |
Spriafil® Suspensión oral |
Fluconazol |
|
Tasa de éxito clínico en el Día 14 |
91.7% (155/169) |
92.5% (148/160) |
|
Tasa de éxito clínico 4 semanas después de haber concluido el tratamiento |
68.5% (98/143) |
61.8% (84/136) |
|
Tasa de respuesta micológica 4 semanas después del finalizar el tratamiento* |
40.6% (41/101) |
26.4% (24/91) |
* Estadísticamente significativo (P=0.0376)
La tasa de éxito clínico se definió como el número de casos evaluados que tuvieron una respuesta clínica (curación o mejoría) dividido entre el número total de casos elegibles para análisis.
La tasa de respuesta micológica se definió como éxito micológico (≤20 UFC/mL) dividido por el número total de casos elegibles para el análisis.
Tratamiento de candidiasis orofaríngea refractaria a azoles (COFr) (Estudios 330 y 298)
El parámetro de eficacia primaria en el Estudio 330 fue la tasa de éxito clínico (curación o mejoría) después de 4 semanas de tratamiento. Pacientes infectados por el VIH fueron tratados con posaconazol suspensión oral 400 mg dos veces al día con la opción de tratamiento durante un periodo de mantenimiento de 3 meses. Se alcanzó una tasa de 75% (132/176) de éxito clínico y una de tasa 36.5% (46/126) (≤20 UFC/mL) de respuesta micológica después de 4 semanas de tratamiento con posaconazol suspensión oral. Las tasas de éxito clínico variaron del 71-100% inclusive para todas las especies de Candida resistentes a azoles identificadas al inicio del tratamiento, incluyendo C. glabrata y C. krusei.
Del total de pacientes tratados en el estudio, 43 de ellos presentaron candidiasis esofágica (CE) refractaria a azoles, ya fuera aisladamente o en combinación con COF. Todos los pacientes con CE refractaria a azoles tenían confirmación endoscópica de CE al inicio del estudio. La tasa de éxito clínico después de 4 semanas fue de 74.4%.
En el Estudio 298, el punto final primario de eficacia fue la tasa de éxito clínica (curación o mejoría) después de 3 meses de tratamiento. Un total de 100 pacientes infectados por VIH con COF y/o CE recibieron posaconazol suspensión oral 400 mg dos veces al día hasta por 15 meses. Sesenta de estos pacientes ya habían sido tratados previamente en el Estudio 330. Después de tres meses de tratamiento, se observó una tasa de éxito clínico (curación o mejoría) del 85.6% (77/90); 80.6% (25/31) de los sujetos que no habían recibido tratamiento previo.
La exposición promedio a Spriafil® Suspensión oral con base en los días reales de dosificación fue de 102 días (rango: 1-544 días). Sesenta y siete por ciento (67%, 10/15) de los pacientes tratados con Spriafil® Suspensión oral por al menos 12 meses tuvieron éxito clínico continuo en la última evaluación.
De los pacientes tratados en el Estudio 298, 15 con CE refractaria a azoles habían sido tratados previamente en el Estudio 330. Sesenta y siete por ciento (67% 10/15) fueron considerados curados al final del tratamiento y el 33% (5/15) se consideró con mejoría. Para esos pacientes, la duración del tratamiento varió desde 81 hasta 651 días.
Profilaxis de infecciones fúngicas invasivas (IFIs) (Estudios 316 y 1899)
Se realizaron dos grandes estudios controlados, aleatorizados, utilizando posaconazol suspensión oral como profilaxis para la prevención de IFIs en pacientes de alto riesgo.
El Estudio aleatorizado y doble ciego 316 que comparaba posaconazol suspensión oral (200 mg tres veces al día) con fluconazol cápsulas (400 mg una vez al día) como profilaxis contra infecciones fúngicas invasivas en receptores de trasplantes alogénicos de células madre hematopoyéticas con enfermedad de huésped contra injerto. El punto final primario de eficacia fue la incidencia de IFI probable/confirmada a las 16 semanas después de la aleatorización determinado por un panel de expertos independientes externo y cegado. Un segundo punto final clave fue la incidencia de IFIs probables o confirmadas durante el periodo de tratamiento (de la primera a la última dosis del medicamento en estudio + 7 días). El promedio de duración de la terapia fue comparable entre los dos grupos de tratamiento (80 días para posaconazol y 77 días para fluconazol).
El Estudio 1899 fue un estudio aleatorizado, ciego para el evaluador que comparó posaconazol suspensión oral (200 mg tres veces al día) con la suspensión de fluconazol (400 mg una vez al día) o itraconazol solución oral (200 mg dos veces al día) como profilaxis contra IFIs en pacientes neutropénicos que estaban recibiendo quimioterapia citotóxica para leucemia mieloide aguda o síndromes mielodisplásicos. La variable principal de eficacia fue la incidencia de IFIs probadas/probables, determinado por un panel, ciego, de expertos independientes externos durante el periodo de tratamiento. Una variable clave secundaria de valoración fue la incidencia de IFIs probables/comprobadas 100 días después de la aleatorización. La duración promedio del tratamiento fue comparable entre los dos grupos de tratamiento (29 días, posaconazol, 25 días, fluconazol/itraconazol).
En ambos estudios de profilaxis, la aspergilosis fue la infección intercurrente que apareció con más frecuencia. Hubo significativamente menos infecciones intercurrentes por Aspergillus en pacientes que reciben profilaxis con posaconazol suspensión oral en comparación con los pacientes control tratados con fluconazol o itraconazol. Ver la tabla 4 para los resultados de ambos estudios.
Tabla 4: Resultados de los estudios clínicos en profilaxis de infecciones fúngicas invasivas
|
Estudio |
Posaconazol Suspensión oral |
Controla |
Valor de P |
|
Proporción (%) de pacientes con IFI"s probables o comprobadas |
|||
|
En periodo de tratamientob |
|||
|
1899d |
7/304 (2) |
25/298 (8) |
0.0009 |
|
316e |
7/291 (2) |
22/288 (8) |
0.0038 |
|
Periodo de tiempo fijoc |
|||
|
1899d |
14/304 (5) |
33/298 (11) |
0.0031 |
|
316d |
16/301 (5) |
27/299 (9) |
0.0740 |
|
Proporción (%) de pacientes con aspergilosis probable o comprobada |
|||
|
En periodo de tratamientob |
|||
|
1899d |
2/304 (1) |
20/298 (7) |
0.0001 |
|
316e |
3/291 (1) |
17/288 (6) |
0.0013 |
|
Periodo de tiempo fijoc |
|||
|
1899d |
4/304 (1) |
26/298 (9) |
< 0.0001 |
|
316d |
7/301 (2) |
21/299 (7) |
0.0059 |
FLU=fluconazol ITZ=itraconazol POS= posaconazol
a: FLU/ITZ (1899; FLU (316)
b: En el estudio 1899 el periodo comprende desde la aleatorización hasta la última dosis del medicamento más 7 días; en el estudio 316 fue el periodo desde la primera dosis hasta la última dosis del medicamento del estudio más 7 días
c: En el estudio 1899, éste fue el periodo de aleatorización a los 100 días después de la aleatorización; en el estudio 316 fue el periodo desde el día basal hasta los 111 días post-basal
d: Todos los aleatorizados
e: Todos los tratados
En el Estudio 1899, se observó una disminución significativa en la mortalidad por cualquier causa a favor de posaconazol suspensión oral [POS 49/304 (16%) vs. FLU/ITZ 67/298 (22%) p=0.048]. Con base en estimaciones Kaplan-Meier, la probabilidad de supervivencia hasta los 100 días después de la aleatorización, fue significativamente mayor para los receptores de posaconazol suspensión oral, lo que ha demostrado beneficio en la supervivencia cuando el análisis consideró todas las causas de muerte (p=0.0354) (Figura 2), así como muertes relacionadas con IFI (p=0.0209).
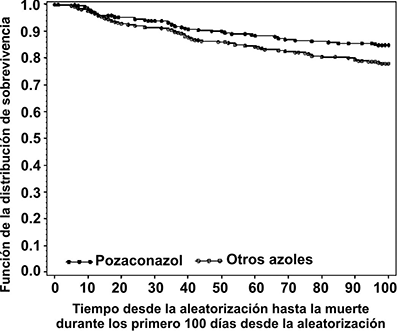
Figura 2: Todas las causas de muerte en el Estudio 1899 (POS vs FLU/ITZ; P = 0.0354)
En el Estudio 316, la mortalidad total fue similar (POS, 25%; FLU, 28%), sin embargo, la proporción de muertes relacionadas con IFI fue significativamente menor en el grupo de POS (4/301), en comparación con el grupo de FLU (12/299, p = 0.0413).
VI. CONTRAINDICACIONES
• Hipersensibilidad a Spriafil® Suspensión oral o alguno de los componentes del producto.
• A pesar de que no se estudió in vitro o in vivo, la co-administración de Spriafil® Suspensión oral con ciertos fármacos metabolizados a través del sistema de CYP3A4: terfenadina, astemizol, cisaprida, pimozida y quinidina está contraindicada, porque se puede producir un aumento de las concentraciones plasmáticas de estos fármacos, que puede originar prolongación del intervalo QT y raros casos de torsade de pointes.
• La administración concomitante de inhibidores de la HMG-CoA reductasa que son principalmente metabolizados a través del CYP3A4 está contraindicada ya que las mayores concentraciones plasmáticas de estos fármacos pueden causar rabdomiólisis.
• Aunque no se ha estudiado in vitro o in vivo, Spriafil® Suspensión oral puede aumentar las concentraciones plasmáticas de los alcaloides del ergot, lo que puede provocar ergotismo. Está contraindicada la administración concomitante de Spriafil® Suspensión oral y alcaloides del ergot.
VII. PRECAUCIONES GENERALES
Hipersensibilidad: No hay información relativa a la sensibilidad cruzada entre Spriafil® Suspensión oral y otros agentes antimicóticos azoles. Spriafil® Suspensión oral deberá prescribirse con precaución a pacientes con hipersensibilidad a otros azoles.
Toxicidad hepática: En los estudios clínicos, se reportaron reacciones hepáticas poco frecuentes (por ejemplo, elevaciones de leves a moderadas de ALT, AST, fosfatasa alcalina, bilirrubina total y/o hepatitis clínica). Las elevaciones en las pruebas de función hepática fueron, por lo general, reversibles al suspender el tratamiento y en algunos casos estas pruebas se normalizaron sin la interrupción del tratamiento y rara vez requirieron la descontinuación del medicamento. En raras ocasiones se reportaron reacciones hepáticas más graves (incluyendo casos que progresaron a resultados fatales) en pacientes con condiciones médicas graves subyacentes (por ejemplo neoplasias hematológicas) durante el tratamiento con Spriafil® Suspensión oral.
Prolongación del intervalo QT: Algunos azoles se han relacionado con una prolongación del intervalo QT. Los resultados de un análisis de electrocardiograma (ECG) correlacionado en el tiempo en voluntarios sanos, no mostraron ningún aumento en el intervalo QTc promedio. Sin embargo, no debe administrarse Spriafil® Suspensión oral con medicamentos que prolonguen el intervalo QTc y que sean metabolizados a través del sistema CYP3A4.
Alteraciones en los electrólitos: Especialmente las que involucran niveles de potasio, magnesio o calcio, deben ser monitoreadas y corregidas cuando sea necesario antes y durante el tratamiento con Spriafil® Suspensión oral.
Toxicidad por Vincristina: La administración concomitante de antifúngicos del tipo de los azoles, incluyendo posaconazol suspensión oral, con vincristina ha sido asociada con neurotoxicidad y otras reacciones adversas serias como convulsiones, neuropatía periférica, síndrome de secreción inadecuada de la hormona antidiurética e íleo paralítico. Utilice los antifúngicos del tipo de los azoles, incluyendo posaconazol suspensión oral, en pacientes que reciben alcaloides de la vinca, incluyendo vincristina, sólo cuando no existan otras opciones alternativas de tratamiento antifúngico. (Ver sección X Interacciones Medicamentosas y de Otro Género).
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
No existe información suficiente sobre el uso de Spriafil® Suspensión oral en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva. Se ha demostrado que posaconazol suspensión oral causa malformaciones esqueléticas en ratas cuando se exponen a dosis menores a las terapéuticas en humanos. En conejos, posaconazol suspensión oral fue embriotóxico a dosis mayores a las terapéuticas. Se desconoce el riesgo potencial en seres humanos. Spriafil® Suspensión oral no debe utilizarse durante el embarazo a menos que el beneficio para la madre justifique el riesgo potencial para el feto.
Spriafil® Suspensión oral se excreta en la leche de ratas en periodo de lactancia. No se ha investigado la excreción de Spriafil® Suspensión oral en leche materna humana. Spriafil® Suspensión oral no debe utilizarse durante la lactancia a menos que el beneficio para la madre supere claramente el riesgo para el lactante.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
La seguridad de posaconazol suspensión oral ha sido evaluada en 2,400 pacientes y voluntarios sanos incluidos en estudios clínicos y en la experiencia post-comercialización. Ciento setenta y dos pacientes recibieron terapia con Spriafil® Suspensión oral durante ≥6 meses; 58 de ellos recibieron terapia con Spriafil® Suspensión oral durante ≥12 meses.
Los eventos adversos graves relacionados con el tratamiento reportados en 428 pacientes tratados con posaconazol suspensión oral con infecciones fúngicas invasivas (1% de cada uno) incluyeron alteración de la concentración de otros medicamentos, elevación de las enzimas hepáticas, náusea, exantema y vómito. Los eventos adversos graves relacionados con el tratamiento reportados en 605 pacientes tratados con posaconazol suspensión oral para profilaxis (1% de cada uno) incluyeron bilirrubinemia, elevación de enzimas hepáticas, daño hepatocelular, náusea y vómito.
Los eventos adversos poco comunes o raros clínicamente significativos que se reportaron durante los estudios clínicos con posaconazol suspensión oral incluyeron insuficiencia suprarrenal, pancreatitis, reacciones alérgicas y/o de hipersensibilidad.
Se han reportado además casos aislados de ¨torsade de pointes¨ en pacientes bajo tratamiento con posaconazol suspensión oral.
Además, se han reportado casos raros de síndrome urémico hemolítico y púrpura trombótica trombocitopénica, principalmente en pacientes que han recibido de manera concomitante ciclosporina o tacrolimus para el manejo de rechazo de trasplantes o enfermedad de huésped contra injerto.
Reacciones Adversas relacionadas con el Tratamiento (RATs) reportadas en estudios de posaconazol suspensión oral
Las reacciones adversas más comunes relacionadas con el tratamiento, reportadas en toda la población de voluntarios sanos y pacientes en los estudios de posaconazol suspensión oral se muestran en la Tabla 5.
|
Tabla 5: Reacciones adversas relacionadas con el tratamiento (RART) observadas en sujetos tratados con posaconazol suspensión oral por sistema corporal. Incluye todos los RART con incidencia del 1% o mayor Común (>1/100, <1/10) |
|
|
Trastornos hematológicos y del sistema linfático |
|
|
Comunes: |
Neutropenia |
|
Trastornos del metabolismo y de la nutrición |
|
|
Común: |
Anorexia |
|
Trastornos del sistema nervioso |
|
|
Comunes: |
Mareo, cefalea, parestesias, somnolencia |
|
Trastornos gastrointestinales |
|
|
Comunes: |
Dolor abdominal, diarrea, dispepsia, flatulencias, boca seca, náusea, vómito |
|
Trastornos hepatobiliares |
|
|
Comunes: |
Pruebas de función hepática elevadas (incluyendo AST, ALT, fosfatasa alcalina, GGT, bilirrubina) |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Común: |
Rash |
|
Trastornos generales y alteraciones en el lugar de la administración |
|
|
Comunes: |
Astenia, fatiga, pirexia (fiebre) |
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Efectos de otros medicamentos sobre posaconazol suspensión oral:
Spriafil® Suspensión oral se metaboliza mediante glucuronidación con UDP (enzimas de fase 2) y es un sustrato para la salida de la glucoproteína-P (P-gp). Por lo tanto, los inhibidores o inductores de estas vías de depuración pueden afectar las concentraciones plasmáticas de Spriafil® Suspensión oral.
Rifabutina (dosis de 300 mg una vez al día) disminuyó la Cmax (concentración plasmática máxima) y el ABC de posaconazol suspensión oral en 43% y 49% respectivamente. El uso concomitante de posaconazol suspensión oral y rifabutina debe de evitarse a menos que el beneficio para el paciente sobrepase el riesgo.
Fenitoína (dosis de 200 mg una vez al día) disminuyó la Cmax y el ABC de posaconazol suspensión oral en 41% y 50% respectivamente. El uso concomitante de posaconazol suspensión oral y fenitoína debe evitarse a menos que el beneficio para el paciente sobrepase el riesgo.
Antagonistas de los receptores H2, Inhibidores de la bomba de protones y Antiácidos: Las concentraciones plasmáticas de posaconazol suspensión oral (Cmax y ABC) se redujeron en un 39% cuando posaconazol suspensión oral fue administrado con cimetidina (400 mg dos veces al día), debido a la reducción de la absorción posiblemente secundaria a una disminución de la producción de ácido gástrico. La co-administración de posaconazol suspensión oral con antagonistas de los receptores H2 deberá evitarse si es posible.
Del mismo modo, la administración de 400 mg de posaconazol suspensión oral con esomeprazol (40 mg diarios) disminuyó el promedio de Cmax y del ABC en 46% y 32%, respectivamente, en comparación con la dosis de 400 mg de posaconazol suspensión oral sola. La co-administración de posaconazol suspensión oral con inhibidores de la bomba de protones deberá evitarse si es posible.
Agentes de motilidad gastrointestinal:
La metoclopramida cuando se administra con posaconazol suspensión oral, disminuye las concentraciones plasmáticas de posaconazol. Si metoclopramida se administra concomitantemente con posaconazol suspensión oral, se recomienda monitoreo estrecho para infecciones fúngicas.
La loperamida no afecta las concentraciones plasmáticas de posaconazol suspensión oral. No se requiere ajuste de dosis de posaconazol suspensión oral cuando loperamida y posaconazol se usan de manera concomitante. Glipizida: (dosis única de 10 mg) no mostró un efecto clínicamente significativo sobre la Cmax y el ABC de posaconazol suspensión oral.
Efavirenz: (400 mg una vez al día) disminuyó la Cmax y el ABC de posaconazol suspensión oral en 45% y 50% respectivamente. El uso concomitante de posaconazol suspensión oral y efavirenz debe evitarse a menos que el beneficio para el paciente sobrepase el riesgo.
Fosamprenavir: La combinación de fosamprenavir con posaconazol suspensión oral puede conducir a la disminución de las concentraciones plasmáticas de posaconazol. Si la administración concomitante es necesaria, se recomienda una estrecha vigilancia de las infecciones fúngicas. La administración repetida de dosis de fosamprenavir (700 mg dos veces al día x 10 días) disminuyó la Cmax y ABC de posaconazol (200 mg una vez al día en el 1er día, 200 mg de suspensión oral dos veces al día en el 2° día, luego 400 mg de suspensión oral dos veces al día x 8 días) en un 21% y 23%, respectivamente.
Efectos de posaconazol suspensión oral sobre otros medicamentos:
Spriafil® Suspensión oral no se metaboliza de manera clínicamente significativa, a través del sistema del citocromo P450. Sin embargo, Spriafil® Suspensión oral es un inhibidor de CYP3A4 y, por consiguiente, los niveles plasmáticos de fármacos que se metabolizan a través de esta vía enzimática pueden aumentar cuando se administran con Spriafil® Suspensión oral.
Alcaloides del ergot: A pesar de que no se ha estudiado in vitro o in vivo, Spriafil® Suspensión oral puede aumentar la concentración plasmática de los alcaloides del ergot (ergotamina y dihidroergotamina) que pueden dar lugar a ergotismo. La administración simultánea de Spriafil® Suspensión oral y alcaloides del ergot está contraindicada.
Alcaloides de la vinca: Gran parte de los alcaloides de la vinca (como la vincristina y vinblastina) son sustratos del CYP3A4. La administración concomitante de antifúngicos del tipo de los azoles, incluyendo posaconazol suspensión oral, con la vincristina ha sido asociada con reacciones adversas serias (ver sección VII Precauciones Generales). Posaconazol suspensión oral puede aumentar las concentraciones plasmáticas de los alcaloides de la vinca lo cual puede llevar a una neurotoxicidad y a otras reacciones adversas serias. Por lo tanto, utilice los antifúngicos del tipo de los azoles, incluyendo posaconazol suspensión oral, en pacientes que reciben alcaloides de la vinca, incluyendo vincristina, sólo cuando no existan otras opciones alternativas de tratamiento antifúngico.
Ciclosporina: En pacientes con trasplante cardiaco con dosis estables de ciclosporina, 200 mg de Spriafil® Suspensión oral una vez al día aumentaron las concentraciones de ciclosporina, lo que requirió reducciones de la dosis. Cuando se inicia el tratamiento con posaconazol suspensión oral en pacientes que ya están recibiendo ciclosporina, debe reducirse la dosis de ciclosporina (por ejemplo, a aproximadamente tres cuartos de la dosis actual). En adelante, deberá realizarse un monitoreo de los niveles sanguíneos de ciclosporina durante la administración simultánea y al suspender el tratamiento con Spriafil® Suspensión oral se debe realizar ajuste de las dosis de ciclosporina según sea necesario.
Tacrolimus: Spriafil® Suspensión oral aumentó la Cmáx y el ABC de tacrolimus (dosis única de 0.05 mg/kg) en 121% y 358%, respectivamente. Cuando se inicie tratamiento con posaconazol suspensión oral en pacientes que ya están recibiendo tacrolimus debe reducirse la dosis de tacrolimus (por ejemplo, a aproximadamente un tercio de la dosis actual). Posteriormente, deberán controlarse cuidadosamente los niveles sanguíneos de tacrolimus durante la administración simultánea y al suspender Spriafil® Suspensión oral. La dosis de tacrolimus deberá ajustarse según sea necesario.
Sirolimus: La administración de dosis repetidas de posaconazol suspensión oral (400 mg dos veces al día durante 16 días) incrementaron la Cmax y el ABC de sirolimus (2 mg dosis única) en promedio 6.7 veces y 8.9 veces, respectivamente, en sujetos sanos. Cuando se inicie el tratamiento en sujetos que ya estén tomado sirolimus, éste debe reducirse (a alrededor de 1/10 de la dosis) con monitoreo frecuente de los niveles valle de sirolimus en sangre total al comienzo, durante la administración simultánea y al suspender el tratamiento con Spriafil® Suspensión oral, con ajustes de dosis de sirolimus respectivamente.
Rifabutina: posaconazol suspensión oral incrementó la Cmax y el ABC de rifabutina en 31% y 72% respectivamente. El uso concomitante de posaconazol suspensión oral y rifabutina debe evitarse a menos que el beneficio para el paciente sobrepase el riesgo. Si los medicamentos se llegan a administrar conjuntamente se recomienda el monitoreo cuidadoso de la cuenta celular sanguínea y de los eventos adversos relacionados con el incremento de niveles de rifabutina (ej. Uveítis).
Midazolam: La administración de dosis repetidas de posaconazol oral (200 mg de suspensión oral dos veces al día durante 7 días) incrementó la Cmax y el ABC de midazolam IV (0.4 mg dosis única) un promedio de 1.3 y 4.6 veces respectivamente; posaconazol 400 mg de suspensión oral dos veces al día por 7 días incrementó la Cmax y el ABC de midazolam IV en 1.6 y 6.2 veces, respectivamente. Ambas dosis de posaconazol suspensión oral incrementaron la Cmax y el ABC de midazolam oral (2 mg dosis oral única) en 2.2 y 4.5 veces, respectivamente. Además, posaconazol oral (200 mg o 400 mg de suspensión oral) prolongó la vida media terminal de midazolam de aproximadamente 3-4 horas a 8-10 durante la co-administración.
Se recomienda considerar ajustar la dosis de benzodiacepinas metabolizadas por CYP3A4 durante la co-administración con posaconazol suspensión oral.
Zidovudina (AZT), lamivudina (3TC), indinavir: Estudios clínicos demostraron que no se observaron efectos clínicamente significativos en zidovudina, lamivudina e indinavir cuando se administraron con posaconazol suspensión oral; por lo tanto, no se requieren ajustes de dosis de estos medicamentos al administrarse simultáneamente.
Inhibidores de la proteasa del VIH: Dado que los inhibidores de la proteasa del VIH son sustratos de CYP3A4 se espera que posaconazol suspensión oral eleve los niveles plasmáticos de estos agentes antirretrovirales. La administración de dosis repetidas de posaconazol oral (400 mg de suspensión oral dos veces al día durante 7 días) incrementó la Cmax y el ABC de atazanavir (300 mg una vez al día durante 7 días) un promedio de 2.6 veces y 3.7 veces, respectivamente, en sujetos sanos. La administración de dosis repetidas de posaconazol oral (400 mg de suspensión oral dos veces al día durante 7 días) incrementó la Cmax y el ABC de atazanavir en menor proporción cuando se administró reforzado con ritonavir (300 mg de atazanavir más 100 mg de ritonavir una sola vez al día durante 7 días) un promedio de 1.5 veces y 2.5 veces respectivamente, en sujetos sanos. Se recomienda el monitoreo frecuente de eventos adversos y toxicidad relacionados a los agentes antiretrovirales que son sustratos de CYP3A4 durante la co-administración con posaconazol suspensión oral.
Inhibidores de la HMG-CoA reductasa principalmente metabolizados a través del CYP3A4: La administración de dosis repetidas de posaconazol oral (50, 100, y 200 mg de suspensión oral una vez al día por 13 días) incrementó la Cmax y el ABC de simvastatina (40 mg dosis única) un promedio de 7.4 a 11.4 veces, y 5.7 a 10.6 veces, respectivamente. Mayores concentraciones de inhibidores de HMG-CoA reductasa en plasma pueden estar relacionadas con rabdomiólisis. La co-administración de posaconazol suspensión oral e inhibidores de la HMG-CoA reductasa principalmente metabolizada a través de la CYP3A4 está contraindicada.
Bloqueadores de los canales de calcio metabolizados a través de CYP3A4: A pesar de que no se ha analizado in vitro o in vivo, se recomienda un monitoreo frecuente para vigilar los eventos adversos y la toxicidad de bloqueadores de los canales de calcio durante la administración simultánea con Spriafil® Suspensión oral. Puede requerirse un ajuste de la dosis de los bloqueadores de los canales de calcio.
Digoxina: La administración de otros azoles se ha asociado con incrementos en los niveles de digoxina. Por lo tanto, posaconazol podría incrementar las concentraciones plasmáticas de digoxina y los niveles de digoxina requieren ser monitoreados cuando se inicia o descontinúa el tratamiento con posaconazol.
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
No se conoce ninguna.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
Spriafil® Suspensión oral debe administrarse con una comida o con un suplemento alimenticio líquido de 240 mL. La suspensión oral de Spriafil® se debe agitar bien antes del uso.
Instrucciones importantes para la administración de Spriafil® Suspensión oral
Dosis y Duración
Tabla 6. Dosis recomendada para Spriafil® Suspensión oral de acuerdo con la indicación
|
Indicación |
Dosis y duración de la terapia |
|
Profilaxis de infecciones fúngicas invasivas |
200 mg (5 mL) tres veces al día. La duración de la terapia se basa en el grado de recuperación de la neutropenia o inmunosupresión. |
|
Infecciones fúngicas invasivas (IFI) refractarias / pacientes intolerantes con IFI |
400 mg (10 ml) dos veces al día*. En pacientes que no toleran una comida o un suplemento alimenticio, Spriafil® Suspensión oral debe administrarse a una dosis de 200 mg (5 mL) cuatro veces al día. La duración del tratamiento deberá basarse en la gravedad de la enfermedad subyacente del paciente, la recuperación de la inmunosupresión y la respuesta clínica. |
|
Coccidioidomicosis |
400 mg (10 mL) dos veces al día*. En pacientes que no toleran una comida o un suplemento alimenticio, Spriafil® Suspensión oral debe administrarse a una dosis de 200 mg (5 mL) cuatro veces al día. La duración del tratamiento deberá basarse en la gravedad de la enfermedad subyacente del paciente, la recuperación de la inmunosupresión y la respuesta clínica. |
|
Candidiasis orofaríngea |
Dosis de carga de 200 mg (5 mL) una vez al día en el primer día, después 100 mg (2.5 mL) una vez al día durante 13 días |
|
Candidiasis esofágica u orofaríngea refractaria |
400 mg (10 mL) dos veces al día*. La duración del tratamiento deberá basarse en la gravedad de la enfermedad subyacente del paciente y la respuesta clínica. |
* El aumento de la dosis total diaria a más de 800 mg no incrementa la exposición a Spriafil® Suspensión oral de manera adicional.
Uso en insuficiencia renal: No se requiere ningún ajuste de dosis en insuficiencia renal, ya que Spriafil® Suspensión oral no se elimina de manera significativa a través del riñón, no se espera un efecto de la insuficiencia renal grave sobre la farmacocinética de posaconazol y no se recomienda ajuste de dosis.
Uso en insuficiencia hepática: Los datos farmacocinéticos son limitados en pacientes con insuficiencia hepática; por lo tanto, no puede hacerse ninguna recomendación de ajuste de la dosis. En el pequeño número de sujetos estudiados que tenían insuficiencia hepática, hubo un incremento de la vida media con la disminución de la función hepática.
Uso en niños: No se han establecido la seguridad y la eficacia en adolescentes y niños menores de 13 años de edad.
Vía de administración
La No-Intercambiabilidad entre Spriafil® Suspensión oral y Spriafil® Tabletas
Spriafil® Suspensión oral y Spriafil® Tabletas no deben usarse de manera intercambiable debido a las diferencias en dosificación para cada formulación. Por lo tanto, se deben seguir las recomendaciones específicas de dosificación para cada formulación.
Spriafil® Suspensión oral es sólo para administración oral.
Agitar bien Spriafil® Suspensión oral antes de usarlo.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
Durante los estudios clínicos, los pacientes que recibieron Spriafil® Suspensión oral hasta 1,600 mg/día no mostraron reacciones adversas diferentes a las observadas en pacientes con las dosis más bajas. Se produjo una sobredosis accidental en un paciente que tomó 1,200 mg dos veces al día durante 3 días. El investigador no observó reacciones adversas.
Spriafil® Suspensión oral no se elimina a través de la hemodiálisis.
Abuso y Dependencia
No existe abuso potencial conocido para Spriafil® Suspensión oral.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
Como se observó con otros azoles, se observaron efectos relacionados con la inhibición de la síntesis de hormonas esteroides en estudios de toxicidad de dosis repetidas con Spriafil® Suspensión oral. Los efectos supresores adrenales se observaron en estudios de toxicidad en ratas y perros a exposiciones equivalentes o mayores que aquellas obtenidas a dosis terapéuticas en humanos.
Se condujeron estudios de reproducción y desarrollo peri y postnatal en ratas con exposiciones menores a aquellas obtenidas con dosis terapéuticas en humanos, Spriafil® Suspensión oral produjo variaciones y malformaciones esqueléticas, distocia, prolongación de la gestación, menor tamaño promedio de la camada y viabilidad postnatal. En conejos, Spriafil® Suspensión oral fue embriotóxico en exposiciones mayores a aquellas obtenidas con dosis terapéuticas. Como se observa con otros agentes antimicóticos del tipo de los azoles, estos efectos en la reproducción se consideraron relacionados con un efecto sobre la esteroidogénesis.
Spriafil® Suspensión oral no fue genotóxico en estudios in vitro e in vivo. Los estudios de carcinogénesis no revelaron riesgos especiales para los humanos.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
Schering-Plough, S.A. de C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan,
C.P. 16090, Deleg. Xochimilco, Ciudad de México, México
XV. PRESENTACIÓN
Caja de cartón con frasco de vidrio etiquetado, con 105 mL de 40 mg/mL y cucharita dosificadora graduada.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese el frasco bien cerrado a no más de 25 °C.
Se recomienda que la cuchara se enjuague con agua después de cada administración y antes de su almacenamiento.
XVII. LEYENDAS DE PROTECCIÓN
Su venta requiere receta médica.
Literatura exclusiva para médicos.
No se deje al alcance de los niños.
No se use durante el embarazo ni lactancia.
Este medicamento puede producir somnolencia y afectar el estado de alerta, por lo que no deberá conducir vehículos automotores ni maquinaria pesada durante su uso.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
dpocmx@merck.com