
SPRIAFIL®
POSACONAZOL
Tabletas de liberación prolongada
1 Caja, 24 Tabletas, 100 mg
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Tableta
Liberación retardada
Cada TABLETA contiene:
Posaconazol 100 mg
Excipiente cbp 1 tableta
XIX. NÚMERO DE REGISTRO
Reg. No. 018M2017 SSA IV
Número Tracer: MK5592-MEX-2019-020174 y MK5592-MEX-2019-020292
IV. INDICACIONES TERAPÉUTICAS
Spriafil está indicado en el tratamiento profiláctico de infecciones fúngicas invasivas, tanto por levaduras como por mohos, en pacientes de 13 años de edad y mayores, que están en alto riesgo de desarrollar estas infecciones, como pacientes con neutropenia prolongada o receptores de trasplante de células madre hematopoyéticas (HSCT, por las siglas en inglés para hematopoietic stem cell transplant).
Spriafil está indicado en el tratamiento de las siguientes infecciones fúngicas en pacientes de 13 años de edad y mayores:
• Aspergillosis invasiva en pacientes con enfermedad refractaria a anfotericina B, itraconazol o voriconazol, o en pacientes que sean intolerantes a estos medicamentos. La refractariedad se define como la progresión de la infección o la ausencia de mejoría después de un mínimo de 7 días de dosis terapéuticas previas de terapia antimicótica efectiva.
• Candidiasis esofágica o candidemia en pacientes con una enfermedad refractaria a anfotericina B, fluconazol o itraconazol, o en pacientes que no toleran estos medicamentos. La refractariedad se define como la progresión de la infección o la ausencia de mejoría después de un periodo mínimo de tratamiento (fungemia persistente: 3 días; infecciones no fúngicas: 7 días; candidiasis esofágica: 14 días) de dosis terapéuticas anteriores de terapia antimicótica efectiva.
• Fusariosis, zigomicosis, criptococcosis, cromoblastomicosis y micetoma en pacientes con enfermedad refractaria a otra terapia antifúngica o pacientes que son intolerantes a otra medicación.
• Coccidioidomicosis.
V. FARMACOCINÉTICA Y FARMACODINAMIA
Farmacocinética y Farmacodinamia
Grupo Farmacoterapéutico
Antimicótico para uso sistémico, derivado del triazol, J02AC04
PROPIEDADES FARMACODINÁMICAS
Mecanismo de Acción
Posaconazol es un inhibidor potente de la enzima lanosterol 14α-demetilasa, que cataliza un paso esencial en la biosíntesis del ergosterol.
Efectos Farmacodinámicos
Microbiología
Posaconazol ha demostrado, in vitro y en infecciones clínicas, actividad contra los siguientes microorganismos: especies de Aspergillus (A. fumigatus, A. flavus, A. terreus, A. nidulans, A. niger, A. ustus, A. ochraceus), especies de Cándida (C. albicans, C. glabrata, C. krusei, C. parapsilosis), Cryptococcus neoformans, Coccidioides immitis, Fonsecaea pedrosoi, Histoplasma capsulatum, Pseudallescheria boydii y especies de Alternaria, Exophiala, Fusarium, Ramichloridium, Rhizomucor, Mucor y Rhizopus.
Spriafil exhibe también actividad in vitro contra las siguientes levaduras y mohos: Candida dubliniensis, C. famata, C. guilliermondii, C. lusitaniae, C. kefyr, C. rugosa, C. tropicalis, C. zeylanoides, C. inconspicua, C. lipolytica, C. norvegensis, C. pseudotropicalis, Cryptococcus laurentii, Kluyveromyces marxianus, Saccharomyces cerevisiae, Yarrowia lipolytica, especies de Pichia y Trichosporon, Aspergillus sydowii, Bjerkandera adusta, Blastomyces dermatitidis, Epidermophyton floccosum, Paracoccidioides brasiliensis, Scedosporium apiospermum, Sporothrix schenckii, Wangiella dermatitidis y especies de Absidia, Apophysomyces, Bipolaris, Curvularia, Microsporum, Paecilomyces, Penicillium y Trichophyton. Sin embargo, no se han establecido la seguridad y eficacia de Spriafil en el tratamiento de infecciones clínicas causadas por estos microorganismos en estudios clínicos.
Spriafil exhibe actividad antifúngica de amplio espectro contra algunas levaduras o mohos que en general no son susceptibles o son resistentes a otros azoles:
• Especies de Cándida (incluyendo cepas de C. albicans resistentes a fluconazol, voriconazol e itraconazol),
• C. krusei y C. glabrata que son inherentemente menos susceptibles a fluconazol,
• C. lusitaniae que es inherentemente menos susceptible a anfotericina B,
• Aspergillus (incluyendo cepas resistentes a fluconazol, voriconazol, itraconazol y anfotericina B),
• Organismos que previamente no se consideraron como susceptibles a los azoles como son los Zygomycetes (p. ej., especies de Absidia, Mucor, Rhizopus y Rhizomucor).
In vitro posaconazol exhibió actividad fungicida contra diferentes especies de:
• Aspergillus,
• Hongos dimórficos (Blastomyces dermatitidis, Histoplasma capsulatum, Penicillium marneffei, Coccidioides immitis),
• Algunas especies de Candida.
En modelos de infección en animales posaconazol demostró actividad contra una amplia variedad de infecciones fúngicas causadas por mohos o levaduras. Sin embargo, no se encontró una correlación consistente entre la concentración mínima inhibitoria y la eficacia.
Deben obtenerse los especímenes para cultivo fúngico y otros estudios relevantes de laboratorio (incluyendo histopatología) antes del tratamiento para aislar e identificar el (los) organismo(s) causal(es). La terapia puede instituirse antes de que se conozcan los resultados de los cultivos y otros estudios de laboratorio. Sin embargo, una vez que estos resultados estén disponibles, la terapia antimicótica deberá ajustarse de manera correspondiente.
Resistencia al fármaco
Las cepas de C. albicans resistentes a posaconazol no pueden generarse en el laboratorio; los mutantes de Aspergillus fumigatus espontáneos de laboratorio que exhiben una reducción en la susceptibilidad a posaconazol se desarrollaron a una frecuencia de 1x10-8 a 1x10-9. Los aislamientos clínicos de Cándida albicans y Aspergillus fumigatus que exhiben disminuciones significativas en la susceptibilidad a posaconazol son raros. En los casos raros en donde se notó una susceptibilidad disminuida, no se estableció una correlación clara entre la disminución de la susceptibilidad y la falla clínica. Se ha observado éxito clínico en pacientes infectados con organismos resistentes a otros azoles; consistente con estas observaciones posaconazol fue activo in vitro contra muchas cepas de Aspergillus y Cándida que desarrollaron resistencia a otros azoles y/o anfotericina B. No se han establecido los valores de corte para Spriafil para ningún hongo.
COMBINACIONES DE FÁRMACOS ANTIMICÓTICOS
Cuando se combinó posaconazol con anfotericina B o caspofungina in vitro e in vivo no hubo o solamente hubo un antagonismo muy pequeño y en algunas circunstancias hubo un efecto aditivo. Se desconoce la significancia clínica de estos resultados
PROPIEDADES FARMACOCINÉTICAS
Los hallazgos farmacocinéticos generales a lo largo del programa clínico en voluntarios sanos y pacientes fueron consistentes, en que posaconazol se absorbe lentamente y se elimina lentamente con un volumen de distribución extenso.
La exposición tras la administración múltiple de tabletas de posaconazol (200 ó 300 mg) una vez al día fue 1.3 veces mayor en voluntarios sanos que en los pacientes.
Absorción
Cuando se administra oralmente a voluntarios sanos, las tabletas de posaconazol se absorben con una mediana de Tmax de 4 a 5 horas. Las concentraciones plasmáticas en estado de equilibrio se obtienen hacia el Día 6 a la dosis de 300 mg (QD [una vez al día] después de una dosis de carga BID [dos veces al día] el Día 1).
La biodisponibilidad absoluta de la tableta oral es de aproximadamente 54%.
La biodisponibilidad relativa se investigó en la tableta de 100 mg, bajo condiciones de ayuno y la suspensión oral de 100 mg bajo condiciones de ayuno en adultos sanos. Bajo estas condiciones, la exposición plasmática a posaconazol para los dos tratamientos fue similar. Bajo condiciones de ayuno, la exposición a posaconazol después de la administración de una sola dosis de tableta fue 3.7 veces más que la de la suspensión oral.
Efecto de los alimentos en la absorción oral en voluntarios sanos
Las tabletas de posaconazol pueden tomarse con o sin alimentos.
En un estudio de dosis únicas (P112) que investigó el efecto de una comida rica en grasas, la biodisponibilidad de posaconazol después de la administración de tabletas de 300 mg (3 x 100 mg) en voluntarios sanos, la Cmax fue 16% más alta y el AUC0-72 horas fue 51% mayor ante la presencia de alimentos en relación con el estado de ayuno. Los resultados del estudio se resumen en la Tabla 1. No se considera que el efecto de los alimentos en la absorción de las tabletas de posaconazol sea significativo. En el momento de la selección final de la dosis de la tableta de 300 mg, se tomó en cuenta el efecto de los alimentos, basado en la información del estudio P5615 de farmacocinética/seguridad y la información de los estudios clínicos pivotales Fase 1b/Fase 3, en los cuales los pacientes tomaron tabletas de posaconazol independientemente de la ingesta de alimentos. Por lo tanto, las tabletas de posaconazol pueden ser administradas con o sin alimentos.
Tabla 1. Comparación estadística de farmacocinética plasmática de posaconazol después de la administración de dosis única de 300 mg de posaconazol (como 3 tabletas de 100 mg) a sujetos sanos bajo condiciones de ayuno y alimento
|
Condiciones de ayuno |
Condiciones de alimento (Comida rica en grasas) * |
Ayuno/Alimento |
|||
|
Parámetro Farmacocinético |
N |
GM (95% IC) |
N |
GM (95% IC) |
GMR (90% IC) |
|
Cmax† (ng/mL) |
14 |
893 (731, 1090) |
16 |
1,040 (915, 1180) |
1.16 (0.96, 1.41) |
|
AUC0-last‡ hr• ng/mL |
14 |
25,600 (21500, 30400) |
16 |
38700 (35000, 42700) |
1.51 (1.33, 1.72) |
|
Tmax§ (hr) |
14 |
5.00 (3.00, 8.00) |
16 |
6.0 (5.00, 24.00) |
NA |
GM= promedio geométrico de mínimos cuadrados; GMR= relación promedio geométrica de mínimos cuadrados;
IC= intervalo de confianza
* 48.5 g de grasa
† Cmax = concentración máxima observada
‡ AUC0-last = AUC0-72hr
§ Mediana (Min, Max) reportada para Tmax
Distribución
Posaconazol, después de la administración de la tableta, tiene un volumen de distribución aparente promedio de 394 L (42%), que oscila entre 294 - 583 L entre los estudios en voluntarios sanos. Posaconazol tiene una alta unión a proteínas (>98.0%), principalmente a la albúmina sérica.
Metabolismo
Posaconazol no cuenta con metabolitos principales circulantes y es poco probable que sus concentraciones sean alteradas por los inhibidores de las enzimas CYP450. De los metabolitos circulantes la mayoría son conjugados glucurónidos de Spriafil con sólo cantidades menores de metabolitos oxidativos (mediados por CYP450). Los metabolitos excretados en la orina y las heces representan aproximadamente 17% de la dosis administrada marcada radiactivamente.
Excreción
Posaconazol se excreta predominantemente en las heces (77% de la dosis marcada radiactivamente), eliminando el componente principal como fármaco original (66% de la dosis marcada radiactivamente). La depuración renal es una vía de eliminación menor, con 14% de la dosis marcada excretada en la orina (<0.2% de la dosis es el fármaco original).
Posaconazol tableta se elimina con una vida media promedio (t1/2) que oscila entre 26 y 31 horas y una depuración aparente promedio que va desde 7.5 hasta 11 L/hr.
Los parámetros de farmacocinética en pacientes y voluntarios sanos después de la administración de tabletas de posaconazol de 300 mg al día se encuentran en la Tabla 2. Los pacientes tienen una exposición aproximadamente 25% menor comparada con los voluntarios sanos después de dosis múltiples de tabletas de posaconazol. Las diferencias en la exposición entre voluntarios sanos y pacientes son mucho menores que las diferencias en la exposición reportadas para la suspensión oral de posaconazol.
Tabla 2. Farmacocinética de tabletas de posaconazol de liberación modificada en pacientes y voluntarios sanos
|
Población |
Dosis |
Promedio (%CV) |
||
|
Cmax (ng/mL) |
Tmaxa (hr) |
AUC(τ) (ng.hr/mL) |
||
|
Voluntarios sanos |
300 mg/día (n=12) |
2764 (21) |
3.98 (3 - 6) |
51618 (25) |
|
Pacientes |
300 mg/día (n=50) |
2090 (38) |
4 (1.3 - 8.1) |
37900 (42) |
La coadministración de alimentos o medicamentos que se sabe alteran el pH gástrico (antiácidos, ranitidina, esomeprazol) o la motilidad (metoclopramida) no muestra un efecto clínicamente significativo sobre la farmacocinética de posaconazol cuando se administró como una tableta de liberación modificada.
En la Tabla 3 se muestra una comparación de la exposición (Cavg) en los pacientes después de la administración de tabletas de liberación modificada y de la suspensión oral de posaconazol a dosis terapéuticas.
Tabla 3: Exposición Cavg promedio en estado de equilibrio de los estudios pivotales en pacientes con la tableta de liberación modificada y la suspensión oral de posaconazol
|
Tableta de liberación Modificada de posaconazol |
Suspensión oral de posaconazol |
|||
|
Profilaxis en LMA (Leucemia mielógena aguda) y TCMH (trasplante de células madre hematopoyéticas) |
Profilaxis en EICH (enfermedad de injerto contra huésped) |
Profilaxis en Neutropenia |
Tratamiento Aspergillosis Invasiva |
|
|
Estudio |
P05615 |
C98-316 |
P01899 |
P00041 |
|
Dosis |
300 mg QD |
200 mg TDS |
200 mg TDS |
POS 200 mg QID (hospitalizados) después 400 mg BD |
|
Cavg promedio (ng/mL) (%CV) |
=1970 (56%) * |
1122 (67%) |
583 (65%) |
841 (83%) |
|
Percentil |
Rango pCavg (ng/mL) |
Rango Cavg (ng/mL) |
Rango Cavg (ng/mL) |
Rango Cavg (ng/mL) |
|
Q1 Respuesta |
442-1223 N/A |
22-557 55.6% |
90-332 45.3% |
55-277 24% |
|
Q2 Respuesta |
1240-1710 N/A |
557-915 79.4% |
322-490 63.0% |
290-544 53% |
|
Q3 Respuesta |
1719-2291 N/A |
915-1563 82.5% |
490-734 53.7% |
550-861 53% |
|
Q4 Respuesta |
2304-9523 N/A |
550-861 53% |
734-2200 72.2% |
877-2010 71% |
Cavg promedio = concentración promedio cuando se mide en estado de equilibrio
* pCavg = Cavg previsto
Farmacocinética en Poblaciones Especiales
Pediátrica
El uso de posaconazol tabletas en pacientes de 13 a 17 años de edad se apoya en la evidencia de estudios adecuados y bien controlados de posaconazol suspensión oral.
Género
La farmacocinética de posaconazol es comparable en hombres y mujeres. No es necesario el ajuste de la dosis de Spriafil por razones de género.
Geriátrica
De los 230 pacientes tratados con posaconazol tabletas, 38 (17%) eran mayores de 65 años de edad. La farmacocinética de las tabletas de posaconazol es comparable en pacientes jóvenes y de edad avanzada. No se observaron diferencias generales en la seguridad entre los pacientes geriátricos y los pacientes más jóvenes; por lo tanto, no se recomienda ajustar la dosificación en pacientes geriátricos.
Raza
No hay información suficiente entre las diferentes razas con tabletas de posaconazol.
Peso
El modelo farmacocinético de posaconazol sugiere que los pacientes que pesan más de 120 kg pueden tener una exposición menor a posaconazol. Por lo tanto, se sugiere monitorear de cerca las infecciones fúngicas en pacientes que pesan más de 120 kg.
Insuficiencia renal
Después de la administración de una sola dosis, no se presentó insuficiencia renal leve y moderada (n= 18, Cl cr ≥ 20 ml/min/1.73 m2), no hubo ningún efecto sobre la farmacocinética de posaconazol, por lo tanto, no se requiere ningún ajuste de dosis. En sujetos con insuficiencia renal severa (n=6, Cl cr < 20 ml/min/1.73 m2), la exposición de posaconazol fue altamente variable (96 % de coeficiente de varianza CV) comparado con la exposición de otros grupos (<40 % CV). Sin embargo, ya que posaconazol no se elimina de manera significativa a través de la orina, no se espera ningún efecto de la insuficiencia renal severa sobre la farmacocinética de posaconazol y no se recomienda ningún ajuste de dosis. Posaconazol no es eliminado a través de hemodiálisis. Debido a la variabilidad en la exposición, los pacientes con insuficiencia renal severa deberán ser monitoreados estrechamente para infecciones micóticas.
No se ha llevado a cabo un estudio clínico específico con tabletas de posaconazol.
Insuficiencia hepática
En un número pequeño de sujetos (n=12) estudiados con insuficiencia hepática (Child-Pugh clase A, B o C), los valores de Cmax generalmente disminuyeron con la severidad de la disfunción hepática (545, 414 y 347 ng/mL) para los grupos leve, moderado y grave, respectivamente, aunque los valores de Cmax (promedio de 508 ng/mL) para los sujetos normales fueron consistentes con estudios anteriores en voluntarios sanos. Además, el incremento en la vida media de posaconazol también se asoció con una disminución en la función hepática (26.6, 35.3 y 46.1 horas para los grupos de insuficiencia leve, moderada y severa, respectivamente), porque todos los grupos tuvieron vidas medias más largas que los sujetos con función hepática normal (22.1 horas). Debido a la información limitada de farmacocinética en pacientes con insuficiencia hepática, no puede hacerse una recomendación para ajuste de dosis.
No se ha llevado a cabo un estudio clínico específico con tabletas de posaconazol.
ESTUDIOS CLÍNICOS
Farmacocinética y Seguridad de posaconazol Tabletas en Pacientes
El estudio 5615 fue un estudio multi-céntrico, no comparativo, realizado para evaluar las propiedades farmacocinéticas, la seguridad y la tolerabilidad de la tableta de posaconazol. El estudio 5615 se realizó en una población de pacientes similar a la estudiada previamente en el programa pivotal clínico de posaconazol suspensión oral. La información de farmacocinética y seguridad el estudio 5615 se extendió a la información existente (incluyendo información de eficacia) con la suspensión oral.
El estudio 5615 reclutó a un total de 230 pacientes. La parte 1 del estudio se diseñó para seleccionar una dosis para estudios adicionales en la Parte 2, después de evaluar primero la farmacocinética, la seguridad y la tolerabilidad en la población de pacientes neutropénicos en alto riesgo de una infección micótica. La Parte 2 del estudio se diseñó para evaluar la tableta de posaconazol en una población de pacientes más diversa, y para confirmar la exposición de la tableta de posaconazol en pacientes adicionales en riesgo de una infección micótica. La tableta de posaconazol se administró sin tener en cuenta la ingesta de alimentos, tanto en la Parte 1 como en la Parte 2 del estudio.
La población de pacientes de la Parte 1 incluyó a pacientes con leucemia mielógena aguda (LMA) o con síndrome mielodisplásico (SMD) que habían recibido recientemente quimioterapia y que habían desarrollado o se preveía que desarrollaran neutropenia significativa. Se evaluaron dos grupos de dosificación diferentes en la Parte 1: 200 mg dos veces al día en el Día 1, seguido de 200 mg una vez al día a partir de entonces (Parte 1A) y 300 mg dos veces al día el Día 1, seguido de 300 mg una vez al día a partir de entonces (Parte 1B).
La población de pacientes en la Parte 2 incluyó: 1) pacientes con LMA o SMD que habían recibido recientemente quimioterapia y que habían desarrollado o se esperaba que desarrollaran neutropenia significativa, ó 2) pacientes que habían sido sometidos a un trasplante de células madre hematopoyéticas (TCMH) y recibieron terapia inmunosupresora para la prevención o el tratamiento de la enfermedad de injerto contra huésped (EICH). Este tipo de pacientes habían sido estudiados previamente en un estudio clínico pivotal de suspensión oral de posaconazol. Con base en la farmacocinética y los resultados de seguridad de la Parte 1, todos los pacientes de la Parte 2 recibieron 300 mg dos veces al día el Día 1, seguido de 300 mg una vez al día a partir de entonces.
La población total de pacientes tenía una edad promedio de 51 años (rango = 19-78 años), el 93% eran de raza Blanca, el mayor grupo étnico era Hispano o Latino (84%), y el 62% eran pacientes del sexo masculino. El estudio trató a 110 (48%) pacientes con LMA (nuevo diagnóstico), 20 (9%) pacientes con LMA (primera recaída), 9 (4%) pacientes con SMD, y 91 (40%) pacientes con TCMH, como las enfermedades primarias en el ingreso al estudio.
Se recolectaron muestras de PK en serie el Día 1 y en el estado de equilibrio en el Día 8 para todos los pacientes de la Parte 1 y un subconjunto de los pacientes de la Parte 2. Este análisis de PK en serie demostró que el 90% de los pacientes tratados con la dosis de 300 mg una vez al día alcanzaron el estado de equilibrio de Cav entre 500-2,500 ng/mL. [Cav era la concentración promedio de posaconazol en estado de equilibrio, calculado como AUC /intervalo de dosis (24 horas).] Los pacientes con LMA/SMD con neutropenia después de la quimioterapia o los pacientes con TCMH que recibieron terapia inmunosupresora para prevenir o tratar la EICH que recibieron 300 mg una vez al día alcanzaron una Cav promedio en estado de equilibrio de 1,580 ng/mL. Los hallazgos de PK del estudio pivotal (Estudio 5615) respaldan una dosis diaria de 300 mg de posaconazol en tableta como profilaxis.
Farmacocinética y Seguridad de la Suspensión Oral de posaconazol en Pacientes
Aspergillosis invasiva
Eficacia en pacientes con enfermedad refractaria o intolerancia a tratamiento previo: Se demostró la eficacia y beneficio en la supervivencia de posaconazol oral para el tratamiento de aspergillosis invasiva en pacientes con enfermedad refractaria a anfotericina B (incluyendo formulaciones liposomales) o itraconazol, o en pacientes que fueron intolerantes a estos medicamentos, en 107 pacientes incluidos en un estudio clínico de rescate. A los pacientes se les administró suspensión oral de posaconazol, a 800 mg/día en dosis divididas. La mayoría de los pacientes estaban gravemente inmunocomprometidos, con condiciones subyacentes como malignidades hematológicas, incluyendo trasplante de médula ósea, trasplante de órgano sólido; tumores sólidos y/o SIDA. Un panel de expertos independientes revisó la información de todos los pacientes, incluyendo el diagnóstico de aspergillosis invasiva, refractariedad e intolerancia a tratamientos previos, así como el desenlace clínico, en forma paralela y ciega, con un grupo externo control de 86 pacientes tratados con terapia estándar, la mayoría al mismo tiempo y en los mismos lugares que los pacientes ingresados en el estudio de posaconazol. El éxito fue definido ya sea como resolución completa (respuesta completa) o una mejoría clínicamente significativa (respuesta parcial) de todos los signos, síntomas y hallazgos radiográficos atribuibles a la infección fúngica. La enfermedad estable y no progresiva y la falla fueron consideradas como falta de éxito. La mayoría de los casos de aspergillosis fueron considerados como refractarios tanto en el grupo de posaconazol (88%) como en el grupo externo de control (79%).
Como se muestra en la tabla 4, se observó una respuesta global exitosa al final del tratamiento en el 42% de los pacientes tratados con posaconazol, comparados con el 26% del grupo externo (P=0.006).
Tabla 4: Eficacia Global de Posaconazol al Final del Tratamiento para Aspergillosis Invasiva, en Comparación con un Grupo Externo de Control
|
Posaconazol SUSPENSIÓN ORAL |
Grupo de control externo |
|||
|
Respuesta global |
45/107 (42 %) |
22/86 (26 %) |
||
|
RAZON DE MOMIOS 4.06 (95% CI: 1.50, 11.04) P=0.006 |
||||
|
Sobrevivencia al día 365 |
(38 %) |
(22 %) |
||
|
Éxito por especie Todos confirmados micológicamente Aspergillus spp.* |
34/76 |
(45 %) |
19/74 |
(26 %) |
|
A. fumigatus |
12/29 |
(41 %) |
12/34 |
(35 %) |
|
A. flavus |
10/19 |
(53 %) |
3/16 |
(19 %) |
|
A. terreus |
4/14 |
(29 %) |
2/13 |
(15 %) |
|
A. niger |
3/5 |
(60 %) |
2/7 |
(29 %) |
* incluye otras especies menos comunes o especies desconocidas
Se observó un beneficio de posaconazol, comparado con el tratamiento estándar, como se muestra en la Figura 1 (p<0.001).
FIGURA 1: Análisis de Kaplan-Meier de Tiempo de Supervivencia para Sujetos con Aspergillus como Patógeno Primario
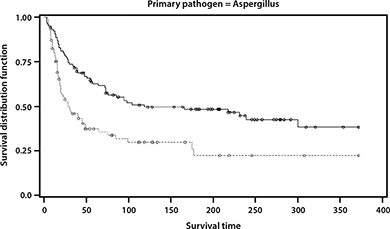
(Línea sólida = curva de supervivencia de posaconazol; curva punteada = curva de supervivencia de otra terapia de rescate). Todos los eventos que no fueron muerte se consideraron censurados.
Otros patógenos micóticos graves
Se ha demostrado que la suspensión oral de posaconazol es efectiva contra los siguientes patógenos adicionales cuando otras terapias han sido inefectivas o cuando el paciente ha desarrollado intolerancia a la terapia anterior.
Cándida: 11 de 23 pacientes respondieron a la terapia con suspensión oral de posaconazol. De los que respondieron, 5 eran pacientes infectados con VIH con enfermedad esofágica y 4 eran pacientes con candidemia. Más aún, en especies no albicans resistentes a fluconazol, se notó un desenlace exitoso en 4/5 casos con infección por C. krusei.
Zigomicosis: Se observaron respuestas exitosas a la terapia con suspensión oral de posaconazol en 7/13 pacientes con infecciones por zigomicetos. Los sitios de infección incluyeron senos, pulmón y piel. La mayoría de los pacientes tenía malignidades hematológicas subyacentes, la mitad de los cuales requirió un trasplante de médula ósea. Una mitad de los pacientes fueron incluidos con intolerancia al tratamiento anterior y la otra mitad como resultado de enfermedad refractaria al tratamiento previo. Se observó que tres pacientes tenían enfermedad diseminada, uno de los cuales tuvo un desenlace exitoso después de haber fracasado el tratamiento con anfotericina B.
Fusarium spp.: 11 de 24 pacientes fueron tratados exitosamente con suspensión oral de posaconazol. Cuatro de los que respondieron tenían enfermedad diseminada y un paciente tenía enfermedad localizada al ojo; el resto tuvo una variedad de sitios de infección. Siete de 24 pacientes tuvieron neutropenia grave a nivel basal. Además, 3/5 pacientes con infección debida a F. solani, que típicamente es resistente a la mayoría de los agentes anti-fúngicos, fueron tratados exitosamente.
Criptococo: 15 de 31 pacientes fueron tratados exitosamente con la suspensión oral de posaconazol. La mayoría de los pacientes estaban infectados con VIH, con meningitis criptococóccica refractaria.
Cromoblastomicosis / Micetoma: 9 de 11 pacientes fueron tratados exitosamente con la suspensión oral de posaconazol. Cinco de estos pacientes tenía cromoblastomicosis debida a Fonsecaea pedrosoi y 4 tenían micetoma, debido principalmente a especies de Madurella.
Coccidioidomicosis: Se demostró la eficacia de posaconazol en el tratamiento primario de coccidioidomicosis no meníngea, en 15 pacientes evaluables clínicamente, incluidos en un estudio abierto, no comparativo, para recibir 400 mg diarios de posaconazol durante 6 meses. La mayoría de los pacientes estaban sanos por otra parte y tenían infecciones en una variedad de sitios. Se observó una respuesta satisfactoria (definida como una mejoría de al menos 50% en la puntuación de Cocci, definida por el grupo de estudio de coccidioidomicosis, BAMSG), en 12 de 15 pacientes (80%) después de un promedio de 4 meses de tratamiento con posaconazol. En un estudio separado abierto, no comparativo, se evaluó la seguridad y eficacia de 400 mg de posaconazol dos veces al día, en 16 pacientes con coccidioidomicosis refractaria a tratamiento estándar. La mayoría habían sido tratados con anfotericina B (incluyendo formulaciones liposomales) y/o itraconazol o fluconazol durante meses a años antes del tratamiento con posaconazol. Al final del tratamiento con posaconazol, se alcanzó una respuesta satisfactoria (resolución completa o parcial de signos y síntomas presentes a nivel basal), determinada por un panel independiente, para 11/16 (69%) pacientes. Un paciente con enfermedad en el SNC que había fracasado al tratamiento con fluconazol tuvo un desenlace exitoso después de 12 meses de terapia con posaconazol.
Tratamiento de Candidiasis Orofaríngea (OPC) susceptible a azoles
Se terminó un estudio aleatorizado, doble-ciego, controlado, en pacientes infectados por VIH, con candidiasis orofaríngea susceptible a azoles. La variable primaria de eficacia fue la tasa de éxito clínico (definida como curación o mejoría) después de 14 días de tratamiento. Los pacientes fueron tratados con suspensión oral de posaconazol o fluconazol (ambos fueron administrados como sigue: 100 mg dos veces al día durante 1 día, seguido por 100 mg una vez al día durante 13 días).
En la Tabla 5 se muestran las tasas de respuesta clínica y micológica del estudio anterior.
Posaconazol y fluconazol demostraron tasas de éxito clínico equivalente al Día 14, así como a las 4 semanas después de terminar el tratamiento. Sin embargo, la suspensión oral de posaconazol demostró una tasa de respuesta micológica sostenida significativamente mejor que fluconazol.
Tabla 5: Tasas de Éxito Clínico y Respuesta Micológica en Candidiasis Orofaríngea
|
Punto final de evaluación |
Posaconazol Suspensión oral |
Fluconazol |
|
Tasa de éxito clínico en el Día 14 |
91.7% (155/169) |
92.5% (148/160) |
|
Tasa de éxito clínico 4 semanas después de haber concluido el tratamiento |
68.5% (98/143) |
61.8% (84/136) |
|
Tasa de respuesta micológica 4 semanas después del finalizar el tratamiento* |
40.6% (41/101) |
26.4% (24/91) |
* Estadísticamente significativo (P=0.0376)
La tasa de éxito clínico se definió como el número de casos evaluados que tuvieron una respuesta clínica (curación o mejoría) dividido entre el número total de casos elegibles para análisis.
La tasa de respuesta micológica se definió como éxito micológico (≤ 20 UFC/mL) dividido por el número total de casos elegibles para el análisis.
Tratamiento de Candidiasis Orofaríngea refractaria a azoles (rOPC) (Estudios 330 y 298)
El parámetro primario de eficacia en el Estudio 330 fue la tasa de éxito clínico (curación o mejoría) después de 4 semanas de tratamiento. Pacientes infectados con VIH fueron tratados con 400 mg de suspensión oral de posaconazol dos veces al día con una opción para tratamiento adicional durante un periodo de mantenimiento de 3 meses. Se alcanzó una tasa de éxito clínico del 75% (132/176) y una tasa de respuesta micológica del 36.5% (46/126) (≤20 UFC/mL), después de 4 semanas de tratamiento con posaconazol. Las tasas de éxito clínico variaron de 71% a 100% inclusive, para todas las especies de Cándida resistentes a azoles identificadas a nivel basal, incluyendo C. glabrata y C. krusei.
De los pacientes totales tratados en este estudio, 43 tenían candidiasis esofágica (CE) refractaria a azoles, ya sea sola o en combinación con OPC (candidiasis orofaríngea). Todos los pacientes con CE refractaria a azoles tuvieron una CE confirmada por endoscopia a nivel basal. La tasa de éxito clínico después de 4 semanas fue de 74.4%.
En el Estudio 298, el punto final primario de eficacia fue la tasa de éxito clínico (curación o mejoría) después de 3 meses de tratamiento. Se trató un total de 100 pacientes infectados con VIH y con OPC, con 400 mg de posaconazol dos veces al día hasta por 15 meses. Sesenta de estos pacientes habían sido tratados previamente en el Estudio 330. Se alcanzó una tasa global de éxito clínico (curación o mejoría) del 85.6% (77/90) después de 3 meses de tratamiento con posaconazol y de 80.6% (25/31) para pacientes no tratados previamente.
La exposición promedio a posaconazol, basada en los días reales de dosificación fue de 102 días (rango: 1- 544 días). Sesenta y siete por ciento (67%, 10/15) de los pacientes tratados con posaconazol durante al menos 12 meses tuvieron éxito clínico continuo en la última evaluación.
De los pacientes tratados en el Estudio 298, 15 con CE refractaria a azoles se habían tratado previamente en el Estudio 330. Sesenta y siete por ciento (67%, 10/15) de los pacientes se consideraron curados al final del tratamiento y 33% (5/15) fueron considerados como mejoría. Para esos pacientes, la duración del tratamiento varió de 81 a 651 días.
Profilaxis de Infecciones Fúngicas Invasivas (IFIs) (Estudios 316 y 1899)
Se realizaron dos estudios grandes, aleatorizados, controlados, utilizando suspensión oral de posaconazol como profilaxis para la prevención de IFIs, entre pacientes de alto riesgo.
El Estudio 316 fue aleatorizado, doble ciego, que comparó la suspensión oral de posaconazol (200 mg tres veces al día) con cápsulas de fluconazol (400 mg una vez al día) como profilaxis contra infecciones fúngicas invasivas en recipientes de TCMH alogénico, con enfermedad de injerto contra huésped (EICH). El punto final primario de eficacia fue la incidencia de IFIs probadas/probables a las 16 semanas post-aleatorización, determinado por un panel de expertos externos independientes y cegados. Un punto final secundario clave fue la incidencia de IFIs probadas/probables durante el periodo de tratamiento (de la primera a la última dosis del medicamento de estudio + 7 días). La duración promedio de la terapia fue comparable entre los dos grupos de tratamiento (posaconazol: 80 días; fluconazol: 77 días).
El Estudio 1899 fue un estudio aleatorizado, con el evaluador ciego, que comparó a la suspensión oral de posaconazol (200 mg tres veces al día), con suspensión de fluconazol (400 mg una vez al día), o solución oral de itraconazol (200 mg dos veces al día), como profilaxis contra IFIs en pacientes neutropénicos que estaban recibiendo quimioterapia citotóxica para leucemia mielógena aguda o síndromes mielodisplásicos. El punto final primario de eficacia fue la incidencia de IFIs probadas/probables, determinadas por un panel de expertos independiente cegados, durante el periodo con tratamiento. Un punto final secundario clave fue la incidencia de IFIs probadas/probables a los 100 días después de la aleatorización. La duración promedio de la terapia fue comparable entre los dos grupos de tratamiento (posaconazol: 29 días; fluconazol/itraconazol: 25 días).
En ambos estudios de profilaxis, la aspergillosis fue la infección intercurrente más común. Hubo significativamente menos casos de infecciones intercurrentes por Aspergillus en los pacientes que recibieron profilaxis con posaconazol, cuando se compararon con los pacientes control que recibieron fluconazol o itraconazol. Ver la Tabla 6 para los resultados de ambos estudios.
Tabla 6: Resultados de los Estudios Clínicos en Profilaxis de Infecciones Fúngicas Invasivas.
|
Estudio |
Posaconazol Suspensión oral |
Controla |
Valor de P |
|
Proporción (%) de pacientes con IFI´s Probadas/Probables |
|||
|
En periodo de tratamientob |
|||
|
1899d |
7/304 (2) |
25/298 (8) |
0.0009 |
|
316e |
7/291 (2) |
22/288 (8) |
0.0038 |
|
Periodo de tiempo fijoc |
|||
|
1899d |
14/304 (5) |
33/298 (11) |
0.0031 |
|
316d |
16/301 (5) |
27/299 (9) |
0.0740 |
|
Proporción (%) de pacientes con aspergillosis Probada/Probable |
|||
|
En periodo de tratamientob |
|||
|
1899d |
2/304 (1) |
20/298 (7) |
0.0001 |
|
316e |
3/291 (1) |
17/288 (6) |
0.0013 |
|
Periodo de tiempo fijoc |
|||
|
1899d |
4/304 (1) |
26/298 (9) |
< 0.0001 |
|
316d |
7/301 (2) |
21/299 (7) |
0.0059 |
FLU=fluconazol ITZ=itraconazol POS= posaconazol
a: FLU/ITZ (1899; FLU (316)
b: En el estudio 1899 el periodo comprende desde la aleatorización hasta la última dosis del medicamento más 7 días; en el estudio 316 fue el periodo desde la primera dosis hasta la última dosis del medicamento del estudio más 7 días.
c: En el estudio 1899, éste fue el periodo de aleatorización a los 100 días después de la aleatorización; en el estudio 316 fue el periodo desde el día basal hasta los 111 días post-basal
d: Todos los aleatorizados
e: Todos los tratados
En el Estudio 1899, se observó una disminución significativa de la mortalidad por cualquier causa a favor de posaconazol [POS 49/304 (16%) vs FLU/ITZ 67/298 (22%) p= 0.048]. Basado en las estimaciones de Kaplan-Meier, la probabilidad de supervivencia hasta el día 100 después de la aleatorización, fue significativamente más alta para los que recibieron posaconazol; este beneficio en la supervivencia fue demostrado cuando el análisis consideró todas las causas de muerte (P= 0.0354) (Figura 2), así como las muertes relacionadas con IFI (P= 0.0209).
Figura 2: Mortalidad por cualquier causa en el Estudio 1899 (POS vs FLU/ITZ; P=0.0354)
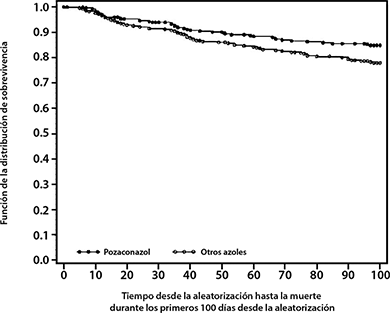
En el Estudio 316, la mortalidad global fue similar (POS; 25%; FLU, 28%); sin embargo, la proporción de muertes relacionadas con IFI fue significativamente más baja en el grupo POS (4/301), comparado con el grupo FLU (12/299; P= 0.0413).
VI. CONTRAINDICACIONES
• En pacientes con hipersensibilidad a posaconazol o a alguno de los componentes del producto.
• A pesar de que no se estudió in vitro o in vivo, la coadministración de posaconazol con ciertos fármacos metabolizados a través del sistema CYP3A4: terfenadina, astemizol, cisaprida, pimozida y quinidina está contraindicada, ya que se puede producir un aumento de las concentraciones plasmáticas de estos fármacos, que puede originar prolongación del intervalo QT y raros casos de taquicardia ventricular polimorfa (torsade de pointes).
• La administración concomitante de inhibidores de la HMG-CoA reductasa que son metabolizados principalmente a través del CYP3A4 está contraindicada ya que las mayores concentraciones plasmáticas de estos fármacos pueden causar rabdomiólisis.
• Aunque no se ha estudiado in vitro o in vivo, posaconazol puede aumentar las concentraciones plasmáticas de los alcaloides de ergotamina que puede provocar ergotismo. Está contraindicada la administración concomitante de posaconazol y alcaloides de ergotamina.
VII. PRECAUCIONES GENERALES
Hipersensibilidad: No hay información relativa a sensibilidad cruzada entre posaconazol y otros agentes antimicóticos azoles. Posaconazol deberá prescribirse con precaución a pacientes con hipersensibilidad a otros azoles.
Toxicidad hepática: En los estudios clínicos, se reportaron reacciones hepáticas poco frecuentes (p. ej., elevaciones de leves a moderadas de ALT, AST, fosfatasa alcalina, bilirrubina total y/o hepatitis clínica). Las elevaciones en las pruebas de función hepática fueron, por lo general, reversibles al suspender el tratamiento y en algunos casos estas pruebas se normalizaron sin la interrupción del tratamiento y rara vez requirieron la descontinuación del medicamento. En raras ocasiones se reportaron reacciones hepáticas más severas (incluyendo casos que progresaron a resultados fatales) en pacientes con condiciones médicas serias subyacentes (p. ej., neoplasias hematológicas) durante el tratamiento con Spriafil.
Prolongación del intervalo QT: Algunos azoles se han relacionado con una prolongación del intervalo QT. Los resultados de un análisis de electrocardiograma (ECG) correlacionado en el tiempo en voluntarios sanos, no mostraron ningún aumento en el intervalo QTc promedio. Sin embargo, posaconazol no debe administrarse con medicamentos que prolonguen el intervalo QTc y que sean metabolizados a través del sistema CYP3A4.
Alteraciones en los electrólitos: Especialmente los que involucran niveles de potasio, magnesio o calcio, deben ser monitoreados y corregidos cuando sea necesario antes y durante el tratamiento con posaconazol.
Toxicidad por Vincristina: La administración concomitante de antifúngicos del tipo de los azoles, incluyendo posaconazol tabletas, con vincristina ha sido asociada con neurotoxicidad y otras reacciones adversas serias como convulsiones, neuropatía periférica, síndrome de secreción inadecuada de la hormona antidiurética e íleo paralítico. Utilice los antifúngicos del tipo de los azoles, incluyendo posaconazol tabletas, en pacientes que reciben alcaloides de la vinca, incluyendo vincristina, solo cuando no existan otras opciones de tratamiento antifúngico. (Ver sección Interacciones Medicamentosas y de Otro Género).
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
No existe información suficiente sobre el uso de posaconazol en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva. Se ha demostrado que posaconazol causa malformaciones esqueléticas en ratas cuando se exponen a dosis menores a las terapéuticas en humanos. En conejos, posaconazol fue embriotóxico a exposiciones mayores a las obtenidas a dosis terapéuticas. Se desconoce el riesgo potencial en seres humanos. Posaconazol no debe utilizarse durante el embarazo a menos que el beneficio potencial para la madre supere claramente el riesgo potencial para el feto.
Posaconazol se excreta en la leche de ratas en periodo de lactancia. La excreción de posaconazol en leche materna humana no se ha investigado. Posaconazol no debe utilizarse durante la lactancia a menos que el beneficio para la madre supere claramente el riesgo para el lactante.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
Seguridad de las Tabletas de posaconazol
La seguridad de las tabletas de posaconazol se evaluó en 230 pacientes reclutados en el estudio clínico pivotal. Los pacientes fueron reclutados en un estudio de farmacocinética y seguridad no comparativo de tabletas de posaconazol, administradas como profilaxis antifúngica. Los pacientes estaban Inmunocomprometidos con enfermedades subyacentes, incluyendo malignidad hematológica, neutropenia post-quimioterapia, enfermedad de injerto contra huésped (EICH) y después de un trasplante de células madre hematopoyéticas.
El tratamiento con posaconazol fue administrado durante una duración mediana de 28 días. Veinte pacientes recibieron una dosis diaria de 200 mg y 210 pacientes recibieron una dosis diaria de 300 mg (después de una dosis dos veces al día en el Día 1 en cada cohorte).
Las reacciones adversas relacionadas con el tratamiento más frecuentemente (≥5%) reportadas con las tabletas de posaconazol (300 mg una vez al día) fueron náusea y diarrea.
La reacción adversa reportada con mayor frecuencia que llevó a la descontinuación de las tabletas de posaconazol 300 mg una vez al día fue náusea.
Reacciones Adversas Relacionadas con el Tratamiento (RARTs) Reportadas en Estudios de Posaconazol Tabletas y Estudios de Suspensión Oral.
Las reacciones adversas más comunes relacionadas con el tratamiento de posaconazol tabletas y Estudios de Suspensión Oral reportadas en toda la población de voluntarios sanos y pacientes se muestran en la Tabla 7.
|
Tabla 7: Reacciones Adversas relacionadas con el tratamiento (RART) Reportadas en Sujetos tratados con Posaconazol Tabletas y Suspensión Oral por sistema corporal. Incluye todos los RART con incidencia del 1% o mayor Común (>1/100, <1/10) |
|
|
Trastornos hematológicos y del sistema linfático Común: |
Neutropenia |
|
Trastornos del metabolismo y de la nutrición Común: |
Anorexia, desequilibrio electrolítico, hipocalemia |
|
Trastornos del sistema nervioso Común: |
Mareo, cefalea, parestesias, somnolencia |
|
Trastornos gastrointestinales Común: |
Dolor abdominal, diarrea, dispepsia, flatulencia, boca seca, náusea, vómito, estreñimiento |
|
Trastornos hepato-biliares Común: |
Pruebas de función hepática elevadas (incluyendo AST, ALT, fosfatasa alcalina, GGT, bilirrubina) |
|
Trastornos de la piel y del tejido subcutáneo Común |
Exantema, prurito |
|
Trastornos generales y alteraciones en el lugar de la administración Común |
Astenia, fatiga, pirexia (fiebre) |
Experiencia Post-Comercialización
Se han reportado los siguientes eventos adversos en la post-comercialización:
Trastornos Endocrinos: pseudoaldosteronismo
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Posaconazol se metaboliza mediante glucuronidación con UDP (enzimas de fase 2) y es un sustrato para la salida de la glucoproteína-P (P-gp). Por lo tanto, los inhibidores o inductores de estas vías de depuración pueden afectar las concentraciones plasmáticas de posaconazol.
Rifabutina (dosis de 300 mg una vez al día) disminuyó la Cmax (concentración máxima en plasma) y el AUC de posaconazol en 43% y 49% respectivamente. El uso concomitante de posaconazol y rifabutina debe evitarse a menos que el beneficio para el paciente sobrepase el riesgo.
Fenitoína (dosis de 200 mg una vez al día) disminuyó la Cmax y el AUC de posaconazol en 41% y 50% respectivamente. El uso concomitante de posaconazol y fenitoína debe evitarse a menos que el beneficio para el paciente sobrepase el riesgo.
Antagonistas de los Receptores H2, Inhibidores de la Bomba de Protones y Antiácidos:
Posaconazol Tabletas
No se observaron efectos clínicamente relevantes cuando las tabletas de posaconazol se utilizaron concomitantemente con antiácidos, antagonistas de los receptores H2 e inhibidores de la bomba de protones. No se requiere ajuste de la dosificación de las tabletas de posaconazol cuando las tabletas de posaconazol se utilizan concomitantemente con antiácidos, antagonistas de los receptores H2 e inhibidores de la bomba de protones.
Agentes de motilidad gastrointestinal:
No se observó un efecto clínicamente significativo sobre la farmacocinética de las tabletas de posaconazol al administrarse concomitantemente con metoclopramida. No se requiere ajuste de la dosificación de las tabletas de posaconazol cuando se administran concomitantemente con metoclopramida.
Glipizida (10 mg en dosis única) no tuvo un efecto clínicamente significativo en la Cmax y el AUC de posaconazol.
Efavirenz (400 mg una vez al día) disminuyó la Cmax y el AUC de posaconazol en 45% y 50%, respectivamente. Debe evitarse el uso concomitante de posaconazol y efavirenz a menos que el beneficio para el paciente compense el riesgo.
Fosamprenavir: Combinar fosamprenavir con posaconazol puede llevar a una disminución en las concentraciones plasmáticas de posaconazol. Si se requiere la administración concomitante, se recomienda un monitoreo estrecho por la posibilidad de infecciones micóticas intercurrentes. La administración de dosis repetidas de fosamprenavir (700 mg BID x 10 días) disminuyó la Cmax y el AUC de posaconazol (200 mg de suspensión oral QD en primer día, 200 mg de suspensión oral BID el segundo día y entonces 400 mg de suspensión oral BID x 8 días) en 21% y 23%, respectivamente.
Efectos de posaconazol sobre otros medicamentos:
Posaconazol no se metaboliza de manera clínicamente significativa, a través del sistema del citocromo P450. Sin embargo, el posaconazol es un inhibidor de CYP3A4 y, por consiguiente, los niveles plasmáticos de fármacos que se metabolizan a través de esta vía enzimática pueden aumentar cuando se administran con posaconazol.
Alcaloides de ergotamina: A pesar de que no se ha estudiado in vitro o in vivo, posaconazol puede aumentar la concentración plasmática de los alcaloides de ergotamina (ergotamina y dihidroergotamina) que puede dar lugar a ergotismo. La administración simultánea de posaconazol y alcaloides del ergot está contraindicada.
Alcaloides de la vinca: Gran parte de los alcaloides de la vinca (como la vincristina y vinblastina) son sustratos del CYP3A4. La administración concomitante de antifúngicos del tipo de los azoles, incluyendo posaconazol tabletas, con la vincristina ha sido asociada con reacciones adversas serias (ver sección Precauciones Generales). Posaconazol tabletas puede aumentar las concentraciones plasmáticas de los alcaloides de la vinca lo cual puede llevar a una neurotoxicidad y a otras reacciones adversas serias. Por lo tanto, utilice los antifúngicos del tipo de los azoles, incluyendo posaconazol tabletas, en pacientes que reciben alcaloides de la vinca, incluyendo vincristina, solo cuando no existan otras opciones de tratamiento antifúngico.
Ciclosporina: en pacientes de trasplante cardiaco bajo dosis estables de ciclosporina, dosis de 200 mg de suspensión oral de posaconazol una vez al día incrementaron las concentraciones de ciclosporina, lo que requirió de reducciones en la dosis. Al iniciar el tratamiento con posaconazol en pacientes que ya están recibiendo ciclosporina, debe reducirse la dosis de esta última (p. ej., a alrededor de tres cuartos de la dosis actual). En adelante, deberán monitorearse cuidadosamente los niveles sanguíneos de ciclosporina durante la administración concomitante y en la descontinuación del tratamiento con posaconazol, deberá ajustarse como se requiera la dosis de ciclosporina.
Tacrolimus: posaconazol aumentó la Cmáx y el AUC de tacrolimus (dosis única de 0.05 mg/kg) en un 121% y 358%, respectivamente. Cuando se inicia el tratamiento con posaconazol en pacientes que ya están recibiendo tacrolimus debe reducirse la dosis de tacrolimus (p. ej., a aproximadamente un tercio de la dosis actual). Posteriormente, deberán monitorearse cuidadosamente los niveles sanguíneos de tacrolimus durante la administración simultánea y al suspender posaconazol. La dosis de tacrolimus deberá ajustarse según sea necesario.
Sirolimus: La administración de dosis repetidas de posaconazol oral (400 mg de la suspensión oral dos veces al día durante 16 días) incrementó la Cmax y el AUC de sirolimus (2 mg dosis única) un promedio de 6.7 veces y 8.9 veces, respectivamente, en sujetos sanos. Al iniciar el tratamiento en pacientes que ya están tomando sirolimus, deberá reducirse la dosis de este último (p. ej., a alrededor de 1/10 de la dosis actual), con monitoreo frecuente de las concentraciones de sirolimus en sangre total. Deberán obtenerse las concentraciones de sirolimus al iniciar, durante la coadministración y a la descontinuación del tratamiento con posaconazol, ajustando como se requiera la dosis de sirolimus.
Rifabutina: Posaconazol incrementó la Cmax y el AUC de rifabutina en 31% y 72% respectivamente. Debe evitarse el uso concomitante de posaconazol y rifabutina a menos que el beneficio para el paciente sobrepase el riesgo. Si los medicamentos se llegan a administrar conjuntamente se recomienda el monitoreo cuidadoso de la cuenta celular sanguínea y de los eventos adversos relacionados con el incremento en los niveles de rifabutina (p. ej., uveítis).
Midazolam: La administración de dosis repetidas de posaconazol oral (200 mg de suspensión oral dos veces al día por 7 días) incrementó la Cmax y el AUC de midazolam IV (0.4 mg en dosis única) un promedio de 1.3 y 4.6 veces, respectivamente. La suspensión oral de posaconazol a una dosis de 400 mg dos veces al día durante 7 días incrementó la Cmax y el AUC de midazolam IV en 1.6 y 6.2 veces, respectivamente. Ambas dosis de posaconazol incrementaron la Cmax y el AUC de midazolam oral (2 mg en dosis oral única) en 2.2 y 4.5 veces, respectivamente. Además, posaconazol oral (200 mg ó 400 mg de suspensión oral) prolongaron la vida media terminal promedio de midazolam, de aproximadamente 3-4 horas a 8-10 horas durante la administración concomitante.
Se recomienda que se consideren ajustes de dosis de benzodiacepinas, metabolizadas por CYP3A4, durante la administración concomitante con posaconazol.
Zidovudina (AZT), lamivudina (3TC), indinavir: Estudios Clínicos demostraron que no se observaron efectos clínicamente significativos en zidovudina, lamivudina e indinavir cuando se administraron con posaconazol; por lo tanto, no se requieren ajustes de dosis de estos medicamentos administrados de manera concomitante.
Inhibidores de Proteasa de VIH: Como los inhibidores de proteasa de VIH son substratos de CYP3A4, se espera que posaconazol incremente los niveles plasmáticos de estos agentes anti-retrovirales. La administración de dosis repetidas de posaconazol oral (400 mg de suspensión oral dos veces al día durante 7 días) incrementó la Cmax y el AUC de atazanavir (300 mg una vez al día durante 7 días) un promedio de 2.6 veces y 3.7 veces, respectivamente, en sujetos sanos. La administración de dosis repetidas de posaconazol oral (400 mg de suspensión oral dos veces al día durante 7 días) incrementó la Cmax y el AUC de atazanavir a un menor grado al ser administrado como régimen de refuerzo con ritonavir (300 mg de atazanavir más 100 mg de ritonavir una vez al día durante 7 días) con un promedio de 1.5 veces y 2.5 veces, respectivamente, en sujetos sanos. Se recomienda el monitoreo frecuente en busca de eventos adversos y toxicidad relacionada con agentes anti-retrovirales que son substratos de CYP3A4 durante la coadministración con posaconazol.
Inhibidores de HMG-CoA reductasa metabolizados principalmente a través de CYP3A4: La administración de dosis repetidas de posaconazol oral (50, 100 y 200 mg de suspensión oral una vez al día durante 13 días) incrementó la Cmax y el AUC de simvastatina (40 mg en dosis única) un promedio de 7.4 a 11.4 veces y 5.7 a 10.6 veces, respectivamente. El incremento en las concentraciones plasmáticas de inhibidores de HMG Co-A reductasa puede asociarse con rabdomiólisis. Está contraindicada la coadministración de posaconazol e inhibidores de HMG-CoA reductasa, metabolizados principalmente por CYP3A4.
Bloqueadores de los canales de calcio metabolizados a través de CYP3A4: A pesar de que no se ha analizado in vitro o in vivo, se recomienda un monitoreo frecuente para vigilar los eventos adversos y la toxicidad de los bloqueadores de los canales de calcio durante la administración simultánea con posaconazol. Puede requerirse un ajuste de la dosis de los bloqueadores de los canales de calcio.
Digoxina: La administración de otros azoles se ha asociado con incrementos en los niveles de digoxina. Por lo tanto, posaconazol podría incrementar las concentraciones plasmáticas de digoxina y los niveles de digoxina requieren ser monitoreados cuando se inicia o descontinua el tratamiento con posaconazol.
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
Ninguna conocida.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
Spriafil Tabletas se puede tomar sin tener en cuenta la ingesta de alimentos.
Instrucciones importantes para la administración de Spriafil Tabletas
Dosis y Duración
Tabla 8. Dosis recomendada para Spriafil Tabletas de acuerdo con la indicación
|
Indicación |
Dosis y duración de la terapia |
|
Profilaxis de micosis invasivas |
Dosis de carga de 300 mg (tres tabletas de 100 mg) dos veces al día el primer día, después 300 mg (tres tabletas de 100 mg) una vez al día a partir de entonces. Cada dosis se puede tomar sin tener en cuenta la ingesta de alimentos. La duración de la terapia se basa en la recuperación de la neutropenia o inmunosupresión. Para los pacientes con leucemia mielógena aguda o síndromes mielodisplásicos, la profilaxis con Spriafil debe empezar varios días antes del inicio previsto de la neutropenia y debe continuar durante 7 días después de que el recuento de neutrófilos se eleve por arriba de 500 células por mm3. |
|
Infecciones fúngicas invasivas (IFI) refractarias / pacientes con IFI intolerantes a la terapia de primera línea |
Dosis de carga de 300 mg (tres tabletas de 100 mg) dos veces al día el primer día, después 300 mg (tres tabletas de 100 mg) una vez al día a partir de entonces. |
|
Coccidioidomicosis |
La duración de la terapia debe basarse en la gravedad de la enfermedad subyacente, la recuperación de la inmunosupresión, y la respuesta clínica. |
|
Candidiasis esofágica refractaria |
Dosis de carga de 300 mg (tres tabletas de 100 mg) dos veces al día el primer día, después 300 mg (tres tabletas de 100 mg) una vez al día a partir de entonces. Cada dosis se puede tomar sin tener en cuenta la ingesta de alimentos. La duración de la terapia debe basarse en la gravedad de la enfermedad subyacente, la recuperación de la inmunosupresión, y la respuesta clínica. |
Uso en insuficiencia renal: No se requiere ajuste de dosis en insuficiencia renal, ya que posaconazol no se elimina de manera significativa a través del riñón, no se espera un efecto de la insuficiencia renal grave sobre la farmacocinética de posaconazol y no se recomienda algún ajuste de dosis.
Uso en insuficiencia hepática: La información de farmacocinética en pacientes con insuficiencia hepática es limitada; por lo tanto, no puede hacerse ninguna recomendación de ajuste de la dosis. En el pequeño número de sujetos estudiados que tenían insuficiencia hepática, hubo un incremento de la vida media con disminución de la función hepática.
Uso en niños: No se han establecido la seguridad y la eficacia en adolescentes y niños menores de 13 años de edad.
Vía de Administración
La No-Intercambiabilidad entre Spriafil Tabletas y Spriafil Suspensión Oral
Spriafil Tabletas y Spriafil Suspensión Oral no deben usarse de manera intercambiable debido a las diferencias en dosificación para cada formulación. Por lo tanto, se deben seguir las recomendaciones específicas de dosificación para cada formulación.
Spriafil Tabletas es sólo para administración oral.
Las tabletas de Spriafil deben tragarse enteras y no dividirse, triturase, o masticarse.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
No hay experiencia con la sobredosis de tabletas de posaconazol.
Posaconazol no se elimina a través de hemodiálisis.
Abuso y Dependencia
No existe abuso potencial para posaconazol.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
Como se observó con otros azoles, también se observaron efectos relacionados con la inhibición de la síntesis de hormonas esteroideas en estudios de toxicidad de dosis repetidas con posaconazol. Los efectos supresores adrenales se observaron en estudios de toxicidad en ratas y perros a exposiciones equivalentes o mayores que las obtenidas a dosis terapéuticas en humanos.
Se condujeron estudios de reproducción y desarrollo peri y postnatal en ratas. A exposiciones menores a las obtenidas con dosis terapéuticas en humanos, posaconazol produjo variaciones y malformaciones esqueléticas, distocia, prolongación de la gestación, menor tamaño promedio de la camada y viabilidad postnatal. En conejos, posaconazol fue embriotóxico a exposiciones mayores a las obtenidas con dosis terapéuticas. Como se observa con otros agentes antimicóticos del tipo de los imidazoles, estos efectos en la reproducción se consideraron relacionados con un efecto sobre la esteroidogénesis.
Posaconazol no fue genotóxico en estudios in vitro e in vivo. Los estudios de carcinogénesis no revelaron riesgos especiales para los humanos.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
Schering-Plough, S.A. DE C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan,
C.P. 16090, Xochimilco,
Ciudad de México, México
XV. PRESENTACIÓN
Caja con 24 tabletas de 100 mg
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese a no más de 30 °C.
Consérvese la caja bien cerrada.
XVII. LEYENDAS DE PROTECCIÓN
Su venta requiere receta médica. No se deje al alcance de los niños. No se use durante el embarazo ni lactancia. Este medicamento puede producir somnolencia y afectar el estado de alerta, por lo que no deberá conducir vehículos automotores ni maquinaria pesada durante su uso. Literatura exclusiva para médicos.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
dpocmx@merck.com