
TERFUCINA
AMFOTERICINA B
Solución inyectable
1 Caja, 1 Frasco ámpula con liofilizado y ampolleta de diluyente, 50/12 mg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada frasco ámpula con liofilizado contiene:
Amfotericina 50 mg
Excipiente c.s
Frasco ámpula con diluyente:
Agua para inyectable esterilizada 12 mL
Descripción: Amfotericina B liposomal es un sistema de administración de fármacos en liposomas bicapa único. Los liposomas están cerrados, vesículas esféricas creados mediante la mezcla de sustancias amfofílicas de proporciones específicas tales como fosfolípidos y colesterol de manera que se organizan en múltiples membranas bicapas concéntricas cuando se hidrata en soluciones acuosas. Los liposomas bicapas únicos entonces se forman por micro emulsión de vesículas multilamelares utilizando un homogeneizador. Amfotericina B liposomal consta de estos liposomas bicapa unilamelares con amfotericina B intercaladas dentro de la membrana. Debido a la naturaleza y la cantidad de sustancias amfofílicas usadas, y el resto lipofílico en la molécula de amfotericina B, el fármaco es una parte integral de la estructura global de los liposomas de Amfotericina B liposomal. Amfotericina B liposomal contiene liposomas verdaderos que son de menos de 100 nm de diámetro. Una representación esquemática del liposoma se presenta a continuación.
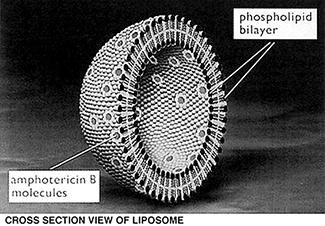
Nota: La encapsulación liposomal o incorporación en un complejo lipídico puede afectar sustancialmente las propiedades funcionales de un fármaco en relación con las del fármaco no encapsulado o no lipídico fármaco asociado. Además, los diferentes productos de lípidos complejos o liposomales con un ingrediente activo común pueden variar de unos a otros en la composición química y forma física del componente lipídico. Tales diferencias pueden afectar a las propiedades funcionales de estos productos farmacéuticos.
INDICACIONES TERAPÉUTICAS:
Amfotericina B liposomal está indicado para el siguiente:
• Terapia empírica por presunta infección por hongos en pacientes neutropénicos febriles.
• Tratamiento de la meningitis criptocócica en pacientes infectados por el VIH.
• Tratamiento de pacientes con especies de Aspergillus, especies de Candida y/o infecciones de especies de Criptococcus refractario a la amfotericina B desoxicolato, o en pacientes con insuficiencia renal o toxicidad inaceptable impiden el uso de la amfotericina B desoxicolato.
• Tratamiento de la leishmaniosis visceral. En pacientes inmunocomprometidos con leishmaniosis visceral tratados con Amfotericina B liposomal, las tasas de recaída fueron altas tras la liquidación inicial de parásitos.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética: El ensayo utilizado para medir la amfotericina B en el suero después de la administración de Amfotericina B liposomal no distingue la amfotericina B que forma un complejo con los fosfolípidos de Amfotericina B liposomal de la amfotericina B que no es un complejo. El perfil farmacocinético de la amfotericina B tras la administración de Amfotericina B liposomal se basa en las concentraciones séricas totales de amfotericina B. El perfil farmacocinético de la amfotericina B se determinó en pacientes con trasplante de médula ósea y cáncer neutropénico febril que recibieron infusiones de 1-2 horas de 1 a 5 mg/kg/día de Amfotericina B liposomal durante 3 a 20 días.
La farmacocinética de amfotericina B después de la administración de Amfotericina B liposomal es no lineal de tal manera que hay un aumento proporcional mayor que en las concentraciones séricas con un aumento de la dosis a partir de 1 a 5 mg/kg/día. Los parámetros farmacocinéticos de amfotericina B totales (media ± SD) después de la primera dosis y en el estado estacionario se muestran en la tabla de abajo.
Parámetros farmacocinéticos de Amfotericina B liposomal
|
Dosis (mg/kg/día): |
1 |
2.5 |
5 |
|||
|
Día |
1 n = 8 |
Último n = 7 |
1 n = 7 |
Último n = 7 |
1 n = 12 |
Último n = 9 |
|
Parámetros |
||||||
|
Cmax (mcg/mL) |
7.3 ± 3.8 |
12.2 ± 4.9 |
17.2 ± 2.1 |
31.4 ± 17.8 |
57.6 ± 21 |
83 ± 35.2 |
|
AUC0-24 (mcg• hr/mL) |
27 ± 14 |
60 ± 20 |
65 ± 33 |
197 ± 183 |
269 ± 69 |
555 ± 311 |
|
T1/2 (hr) |
10.7 ± 6.4 |
7 ± 2.1 |
8.1 ± 2.3 |
6.3 ± 2 |
6.4 ± 2.1 |
6.8 ± 2.1 |
|
Vss (L/Kg) |
0.44 ± 0.27 |
0.14 ± 0.05 |
0.40 ± 0.37 |
0.16 ± 0.10 |
0.16 ± 0.10 |
0.10 ± 0.07 |
|
CL (mL/hr/kg) |
39 ± 22 |
17 ± 6 |
51 ± 44 |
22 ± 15 |
21 ± 14 |
11 ± 6 |
Distribución: Sobre la base de las concentraciones de amfotericina B totales medidas dentro de un intervalo de dosificación (24 horas) después de la administración de Amfotericina B liposomal, la vida media promedio fue de 7-10 horas. Sin embargo, en base a la concentración de amfotericina B total medida hasta 49 días después de la administración de Amfotericina B liposomal, la vida media promedio fue de 100-153 horas. La vida media de eliminación terminal larga es probablemente una redistribución lenta de los tejidos. Las concentraciones en estado estacionario se alcanzaron generalmente dentro de los 4 días de dosificación.
Aunque variable, las concentraciones medias de amfotericina B permanecieron relativamente constantes con la administración repetida de la misma dosis en el rango de 1 a 5 mg/kg/día, indicando que no hay acumulación significativa del fármaco en el suero.
Metabolismo: No se conocen las rutas metabólicas de la amfotericina B después de la administración de Amfotericina B liposomal.
Excreción: La remoción media en el estado estacionario fue independiente de la dosis. La excreción de la amfotericina B tras la administración de Amfotericina B liposomal no ha sido estudiada.
Farmacocinética en poblaciones especiales:
Insuficiencia renal: No se ha estudiado el efecto de la insuficiencia renal sobre la disposición de la amfotericina B después de la administración de Amfotericina B liposomal. Sin embargo, Amfotericina B liposomal se ha administrado con éxito a pacientes con insuficiencia renal preexistente.
Insuficiencia hepática: No se conoce el efecto de la insuficiencia hepática sobre la disposición de la amfotericina B después de la administración de Amfotericina B liposomal.
Pacientes pediátricos y ancianos: No se ha estudiado la farmacocinética de la amfotericina B después de la administración de Amfotericina B liposomal en pacientes pediátricos y ancianos; sin embargo, Amfotericina B liposomal se ha utilizado en pacientes pediátricos y ancianos.
Género y Etnicidad: No se conoce el efecto del género o la etnia sobre la farmacocinética de amfotericina B después de la administración de Amfotericina B liposomal.
Farmacodinamia: La amfotericina B, el ingrediente activo de Amfotericina B liposomal, actúa mediante la unión al componente de esterol, ergosterol, de la membrana celular de los hongos susceptibles. Se forman canales transmembranales que conducen a alteraciones en la permeabilidad celular a través de los cuales los iones monovalentes (Na+, K+, H+, Cl-) y se filtran fuera de la célula dando como resultado la muerte celular. Mientras que la amfotericina B tiene una mayor afinidad por el componente de ergosterol de la membrana celular fúngica, también puede unirse al componente de colesterol de la célula del mamífero que conduce a la citotoxicidad. Se ha demostrado que Amfotericina B lipsomal, la preparación liposomal de amfotericina B, penetra la pared celular de ambas formas extracelulares e intracelulares de los hongos susceptibles.
Actividad in vitro e in vivo: Amfotericina B liposomal ha demostrado actividad in vitro comparable a la amfotericina B contra los siguientes organismos: Aspergillus fumigatus, Aspergillus flavus, Candida albicans, Candida krusei, Candida lusitaniae, Candida parapsilosis, Candida tropicalis, Criptococcus neoformans y Blastomices dermatitidis.
Resistencia a los fármacos: Los mutantes con disminución de la susceptibilidad a la amfotericina B han sido aislados de varias especies de hongos después del paso en serie en medio de cultivo que contiene el fármaco, y de algunos pacientes que reciben tratamiento prolongado. Estudios in vitro e in vivo de combinación de fármacos sugieren que los imidazoles pueden inducir resistencia a la amfotericina B. Sin embargo, la relevancia clínica de resistencia a los medicamentos no ha sido establecida.
Pruebas de Sensibilidad: Se han desarrollado métodos estandarizados de las pruebas de sensibilidad antifúngica in vitro para levaduras de prueba (1, 2, 3) y hongos filamentosos (4, 5). La relevancia clínica de los resultados de la prueba no siempre es clara.
CONTRAINDICACIONES: Amfotericina B liposomal está contraindicado en aquellos pacientes que han demostrado o han sido hipersensibles al desoxicolato de amfotericina B o cualquiera de los componentes de la fórmula a menos que, a juicio del médico tratante, el beneficio del tratamiento supera el riesgo.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No se han realizado estudios adecuados y bien controlados de Amfotericina B liposomal en mujeres embarazadas. Infecciones fúngicas sistémicas han sido tratadas con éxito en las mujeres embarazadas con desoxicolato de amfotericina B, pero el número de casos reportados ha sido pequeño.
Estudios de fase II tanto en ratas como en conejos han concluido que Amfotericina B liposomal no tuvo ningún potencial teratogénico en estas especies. En ratas, se estimó la dosis maternal no tóxica de Amfotericina B liposomal de 5 mg/kg (equivalente a 0.16 a 0.8 veces el rango de dosis clínica humana recomendada de 1 a 5 mg/kg) y en conejos, 3 mg/kg (equivalente de 0.2 a 1 veces el rango de dosis clínica recomendada en humanos), basado en la corrección de área de superficie corporal. Los conejos que recibieron las dosis más altas (equivalente de 0.5 a 2 veces la dosis recomendada en humanos) de Amfotericina B liposomal experimentaron una mayor tasa de abortos espontáneos que los que hicieron los grupos de control. Amfotericina B liposomal sólo debe utilizarse durante el embarazo si los posibles beneficios que derivan superan a los riesgos potenciales involucrados.
Lactancia: Muchos fármacos se excretan en la leche humana. Sin embargo, no se sabe si Amfotericina B liposomal se excreta en la leche humana. Debido al potencial de reacciones adversas graves en los lactantes, se debe decidir sin interrumpir la lactancia o si se suspende el fármaco teniendo en cuenta la importancia del fármaco para la madre.
Uso pediátrico: Los pacientes pediátricos de edad de 1 mes a 16 años, con sospecha de infección por hongos (terapia empírica), confirmaron infecciones sistémicas por hongos o con leishmaniosis visceral han sido tratados con éxito con Amfotericina B liposomal. En los estudios que incluyeron 302 pacientes pediátricos administrados con Amfotericina B liposomal, no hubo evidencia de diferencias en la eficacia o seguridad de Amfotericina B liposomal en comparación con los adultos. Dado que los pacientes pediátricos han recibido Amfotericina B liposomal en dosis comparables a las utilizadas en los adultos en función del peso corporal por kilogramo, no se requiere ajuste de la dosis en esta población. No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de un mes.
REACCIONES SECUNDARIAS Y ADVERSAS: Los siguientes eventos adversos se basan en la experiencia de 592 pacientes adultos (295 tratados con Amfotericina B liposmal y 297 tratados con desoxicolato de amfotericina B) y 95 pacientes pediátricos (48 tratados con Amfotericina B liposomal y 47 tratados con desoxicolato de amfotericina B) en el Estudio 94-0-002, un estudio doble ciego, aleatorio, multicéntrico en pacientes neutropénicos febriles. Amfotericina B liposomal y amfotericina B se infundieron por más de dos horas.
La incidencia de eventos adversos comunes (incidencia de 10% o mayor) que ocurre con Amfotericina B liposomal en comparación con desoxicolato de amfotericina B, independientemente de la relación de fármaco del estudio, se muestra en la siguiente tabla:
Eventos adversos comunes
|
Eventos Adversos por el Sistema corporal |
Amfotericina B liposomal n = 343% |
Amfotericina B n = 344% |
|
Cuerpo en General |
||
|
Dolor abdominal |
19.8 |
21.8 |
|
Astenia |
13.1 |
10.8 |
|
Dolor de espalda |
12 |
7.3 |
|
Reacciones de transfusión de productos sanguíneos |
18.4 |
18.6 |
|
Escalofríos |
47.5 |
75.9 |
|
Infección |
11.1 |
9.3 |
|
Dolor |
14 |
12.8 |
|
Sepsis |
14 |
11.3 |
|
Sistema Cardiovascular |
||
|
Dolor en el pecho |
12 |
11.6 |
|
Hipertensión |
7.9 |
16.3 |
|
Hipotensión |
14.3 |
21.5 |
|
Taquicardia |
13.4 |
20.9 |
|
Sistema Digestivo |
||
|
Diarrea |
30.3 |
27.3 |
|
Hemorragia gastrointestinal |
9.9 |
11.3 |
|
Náuseas |
39.7 |
38.7 |
|
Vómitos |
31.8 |
43.9 |
|
Trastornos metabólicos y nutricionales |
||
|
Aumento de fosfatasa alcalina |
22.2 |
19.2 |
|
Aumento de ALT (SGPT) |
14.6 |
14 |
|
Aumento de AST (SGOT) |
12.8 |
12.8 |
|
Bilirrubinemia |
18.1 |
19.2 |
|
Aumento de BUN |
21 |
31.1 |
|
Aumento de creatinina |
22.4 |
42.2 |
|
Edema |
14.3 |
14.8 |
|
Hiperglucemia |
23 |
27.9 |
|
Hipernatremia |
4.1 |
11 |
|
Hipervolemia |
12.2 |
15.4 |
|
Hipocalcemia |
18.4 |
20.9 |
|
Hipopotasemia |
42.9 |
50.6 |
|
Hipomagnesemia |
20.4 |
25.6 |
|
Edema periférico |
14.6 |
17.2 |
|
Sistema Nervioso |
||
|
Ansiedad |
13.7 |
11 |
|
Confusión |
11.4 |
13.4 |
|
Dolor de cabeza |
19.8 |
20.9 |
|
Insomnio |
17.2 |
14.2 |
|
Sistema Respiratorio |
||
|
Aumento de la tos |
17.8 |
21.8 |
|
Disnea |
23 |
29.1 |
|
Epistaxis |
14.9 |
20.1 |
|
Hipoxia |
7.6 |
14.8 |
|
Trastorno pulmonar |
17.8 |
17.4 |
|
Derrame pleural |
12.5 |
9.6 |
|
Rinitis |
11.1 |
11 |
|
Piel y anexos |
||
|
Prurito |
10.8 |
10.2 |
|
Rash |
24.8 |
24.4 |
|
Sudoración |
7 |
10.8 |
|
Sistema urogenital |
||
|
Hematuria |
14 |
14 |
El Amfotericina B liposomal fue bien tolerado. El Amfotericina B liposomal tuvo una menor incidencia de escalofríos, hipertensión, hipotensión, taquicardia, hipoxia, hipopotasemia, y diversos eventos relacionados con la disminución de la función renal en comparación con desoxicolato de amfotericina B.
En pacientes pediátricos (16 años de edad o menos) en un estudio doble ciego, Amfotericina B liposomal en comparación con desoxicolato de amfotericina B tuvo una menor incidencia de hipopotasemia (37% versus 55%), escalofríos (29% versus 68%), vómitos (27% versus 55%) y la hipertensión (10% versus 21%). Tendencias similares, aunque con una incidencia algo menor, fueron observados en el Estudio 104-14 abierto, aleatorio involucrando 205 pacientes pediátricos con neutropenia febril (141 tratados con Amfotericina B liposomal y 64 tratados con desoxicolato de amfotericina B). Los pacientes pediátricos parecen tener una mayor tolerancia que las personas mayores a los efectos nefrotóxicos de desoxicolato de amfotericina B.
Los siguientes eventos adversos se basan en la experiencia de 244 pacientes (202 adultos y 42 pacientes pediátricos) de los cuales 85 pacientes fueron tratados con Amfotericina B liposomal 3 mg/kg, 81 pacientes fueron tratados con Amfotericina B liposomal 5 mg/kg y 78 pacientes tratados con complejo lipídico de amfotericina B, 5 mg/kg en el Estudio 97-0-034, un estudio aleatorio, doble ciego, multicéntrico, en pacientes neutropénicos febriles. Amfotericina B lipsomal y complejo lipídico de amfotericina B se infundieron por más de dos horas. La incidencia de eventos adversos ocurrió en más del 10% de los sujetos en uno o más grupos, independientemente de la relación con el fármaco de estudio se resume en la siguiente tabla:
Eventos Adversos comunes
|
Eventos Adversos por el Sistema corporal |
Amfotericina B liposomal 3 mg/kg/día N = 85 % |
Amfotericina B liposomal 5 mg/kg/día N = 81 % |
Complejo lipídico de Amfotericina B 5 mg/Kg/día N = 78 % |
|
Cuerpo en General |
|||
|
Dolor abdominal |
12.9 |
9.9 |
11.5 |
|
Astenia |
8.2 |
6.2 |
11.5 |
|
Escalofríos/rigores |
40 |
48.1 |
89.7 |
|
Sepsis |
12.9 |
7.4 |
11.5 |
|
Reacción a la transfusión |
10.6 |
8.6 |
5.1 |
|
Sistema Cardiovascular |
|||
|
Dolor en el pecho |
8.2 |
11.1 |
6.4 |
|
Hipertensión |
10.6 |
19.8 |
23.1 |
|
Hipotensión |
10.6 |
7.4 |
19.2 |
|
Taquicardia |
9.4 |
18.5 |
23.1 |
|
Sistema Digestivo |
|||
|
Diarrea |
15.3 |
17.3 |
14.1 |
|
Náuseas |
25.9 |
29.6 |
37.2 |
|
Vómitos |
22.4 |
25.9 |
30.8 |
|
Trastornos metabólicos y nutricionales |
|||
|
Aumento de fosfatasa alcalina |
7.1 |
8.6 |
12.8 |
|
Bilirrubinemia |
16.5 |
11.1 |
11.5 |
|
Aumento de BUN |
20 |
18.5 |
28.2 |
|
Aumento de creatinina |
20 |
18.5 |
48.7 |
|
Edema |
12.9 |
12.3 |
12.8 |
|
Hiperglucemia |
8.2 |
8.6 |
14.1 |
|
Hipervolemia |
8.2 |
11.1 |
14.1 |
|
Hipocalcemia |
10.6 |
4.9 |
5.1 |
|
Hipopotasemia |
37.6 |
43.2 |
39.7 |
|
Hipomagnesemia |
15.3 |
25.9 |
15.4 |
|
Prueba anormal de funciones del hígado |
10.6 |
7.4 |
11.5 |
|
Sistema Nervioso |
|||
|
Ansiedad |
10.6 |
7.4 |
9 |
|
Confusión |
12.9 |
8.6 |
3.8 |
|
Dolor de cabeza |
9.4 |
17.3 |
10.3 |
|
Sistema Respiratorio |
|||
|
Disnea |
17.6 |
22.2 |
23.1 |
|
Epistaxis |
10.6 |
8.6 |
14.1 |
|
Hipoxia |
7.1 |
6.2 |
20.5 |
|
Trastorno pulmonar |
14.1 |
13.6 |
15.4 |
|
Piel y anexos |
|||
|
Rash |
23.5 |
22.2 |
14.1 |
Los siguientes eventos adversos se basan en la experiencia de 267 pacientes (266 pacientes adultos y 1 paciente pediátrico) de los cuales 86 pacientes fueron tratados con Amfotericina B liposomal 3 mg/kg, 94 pacientes fueron tratados con Amfotericina B liposomal 6 mg/kg y 87 pacientes tratados con 0.7 mg/kg de desoxicolato de amfotericina B en el Estudio 94-0-013 un ensayo multicéntrico aleatorio doble ciego comparativo, en el tratamiento de la meningitis criptocócica en pacientes VIH positivos. La incidencia de eventos adversos que ocurren en más del 10% de los sujetos en uno o más grupos, independientemente de la relación con el fármaco del estudio se resume en la siguiente tabla:
Terapia criptocócica de la meningitis
Eventos adversos comunes
|
Eventos Adversos por el Sistema corporal |
Amfotericina B liposomal 3 mg/kg/día N = 85 % |
Amfotericina B liposomal 5 mg/kg/día N = 81 % |
Complejo lipídico de Amfotericina B 5 mg/Kg/día N = 78 % |
|
Cuerpo en General |
|||
|
Dolor abdominal |
7 |
7.4 |
10.3 |
|
Infección |
12.8 |
11.7 |
6.9 |
|
Complicación Procesal |
8.1 |
9.6 |
10.3 |
|
Sistema Cardiovascular |
|||
|
Flebitis |
9.3 |
10.6 |
25.3 |
|
Sistema Digestivo |
|||
|
Anorexia |
14 |
9.6 |
11.5 |
|
Estreñimiento |
15.1 |
14.9 |
20.7 |
|
Diarrea |
10.5 |
16 |
10.3 |
|
Náusea |
16.3 |
21.3 |
25.3 |
|
Vómito |
10.5 |
21.3 |
20.7 |
|
Sistema Linfático y hemático |
|||
|
Anemia |
26.7 |
47.9 |
43.7 |
|
Leucopenia |
15.1 |
17 |
17.2 |
|
Trombocitopenia |
5.8 |
12.8 |
6.9 |
|
Trastornos metabólicos y nutricionales |
|||
|
Bilirrubinemia |
0 |
8.5 |
12.6 |
|
Aumento de BUN |
9.3 |
7.4 |
10.3 |
|
Aumento de creatinina |
18.6 |
39.4 |
43.7 |
|
Hiperglucemia |
9.3 |
12.8 |
17.2 |
|
Hipervolemia |
12.8 |
17 |
13.8 |
|
Hipocalcemia |
31.4 |
51.1 |
48.3 |
|
Hipopotasemia |
29.1 |
48.9 |
40.2 |
|
Hipomagnesemia |
11.6 |
8.5 |
9.2 |
|
Prueba anormal de funciones del hígado |
12.8 |
4.3 |
9.2 |
|
Sistema Nervioso |
|||
|
Mareo |
7 |
8.5 |
10.3 |
|
Insomnio |
22.1 |
17 |
20.7 |
|
Sistema respiratorio |
|||
|
Incremento de Tos |
8.1 |
2.1 |
10.3 |
|
Piel y anexos |
|||
|
Rash |
4.7 |
11.7 |
4.6 |
Reacciones relacionadas a la Infusión: En el Estudio 94-0-002, el estudio grande, doble ciego de pacientes neutropénicos febriles pediátricos y adultos, sin premedicación para evitar la reacción relacionada con la perfusión se administró antes de la primera dosis del fármaco del estudio (día 1). Los pacientes tratados con Amfotericina B liposomal tuvieron una menor incidencia de la fiebre relacionada con la infusión (17% versus 44%), escalofríos/rigores (18% versus 54%) y vómitos (6% versus 8%) en el día 1 en comparación con los pacientes tratados con desoxicolato de amfotericina B.
La incidencia de reacciones relacionadas con la perfusión en el Día 1 en pacientes pediátricos y adultos se resume en la siguiente tabla:
Incidencia del Día 1 infusiones relacionadas con las Reacciones (IRR) por Edad del paciente
|
Pacientes Pediátricos (≤ 16 años de edad) |
Pacientes adultos (> 16 años de edad) |
|||
|
Amfotericina B liposomal |
Amfotericina B |
Amfotericina B liposomal |
Amfotericina B |
|
|
Número total de pacientes que recibieron al menos una dosis del fármaco del estudio |
48 |
47 |
295 |
297 |
|
Pacientes con fiebre† Incremento ≥ 1.0°C |
6 (13%) |
22 (47%) |
52 (18%) |
128 (43%) |
|
Pacientes con escalofrío/rigores |
4 (8%) |
22 (47%) |
59 (20%) |
165 (56%) |
|
Pacientes con náuseas |
4 (8%) |
4 (9%) |
38 (13%) |
31 (10%) |
|
Pacientes con vómito |
2 (4%) |
7 (15%) |
19 (6%) |
21 (7%) |
|
Pacientes con otras reacciones |
10 (21%) |
13 (28%) |
47 (16%) |
69 (23%) |
† Día 1 la temperatura del cuerpo aumentó por encima de la temperatura tomada 1 hora antes de la infusión (temperatura pre infusión) o por encima del valor más bajo de infusión (se registró la temperatura sin pre infusión).
Eventos cardiorrespiratorios, a excepción de vasodilatación (sofocos), durante todo el estudio las infusiones del fármaco fueron más frecuentes en los pacientes tratados con amfotericina B como se resume en la siguiente tabla:
Eventos de Incidencia cardiorrespiratorios relacionados con Infusión
|
Evento |
Amfotericina B liposomal n = 343 |
Amfotericina B N = 344 |
|
Hipotensión |
12 (3.5%) |
28 (8.1%) |
|
Taquicardia |
8 (2.3%) |
43 (12.5%) |
|
Hipertensión |
8 (2.3%) |
39 (11.3%) |
|
Vasodilatación |
18 (5.2%) |
2 (0.6%) |
|
Disnea |
16 (4.7%) |
25 (7.3%) |
|
Hiperventilación |
4 (1.2%) |
17 (4.9%) |
|
Hipoxia |
1 (0.3%) |
22 (6.4%) |
El porcentaje de pacientes que recibieron medicamentos, ya sea para el tratamiento o la prevención de reacciones relacionadas con la perfusión (por ejemplo, acetaminofén, difenhidramina, meperidina e hidrocortisona) fue menor en los pacientes tratados con Amfotericina B liposomal en comparación con los pacientes tratados con desoxicolato de amfotericina B.
En el estudio de terapia empírica 97-0-034, el día 1, en donde no se administró pre medicación, la incidencia global de la infusión de eventos relacionados con escalofríos/rigores fue significativamente menor en los pacientes administrados con Amfotericina B liposomal en comparación con complejo lipídico de amfotericina B. Fiebre, escalofríos/rigores y la hipoxia fueron significativamente menores para cada grupo de Amfotericina B liposomal en comparación con el grupo de complejo lipídico de amfotericina B. De la infusión relacionada con evento de hipoxia se reportó el 11.5% de los pacientes tratados con complejos lipídicos de amfotericina B en comparación con el 0% de los pacientes administrados 3 mg/kg por día Amfotericina B liposomal y el 1.2% de los pacientes tratados con 5 mg/kg por día Amfotericina B liposomal.
Incidencia del Día 1 infusiones relacionadas con las Reacciones (IRR) de Escalofríos/rigores Estudio 97-0-034 de terapia empírica
|
Amfotericina B liposomal |
Lípido complejo de amfotericina B 5 mg/Kg/día |
|||
|
3 mg/Kg/día |
5 mg/Kg/día |
BOTH |
||
|
Número total de Pacientes |
85 |
81 |
166 |
78 |
|
Pacientes con escalofríos/Rigores (día 1) |
16 (18.8%) |
19 (23.5%) |
35 (21.1%) |
62 (79.5%) |
|
Pacientes con otras reacciones notables |
||||
|
Fiebre (> aumento 1.0°C en la temperatura) |
20 (23.5%) |
16 (19.8%) |
36 (21.7%) |
45 (57.7%) |
|
Náuseas |
9 (10.6%) |
7 (8.6%) |
16 (9.6%) |
9 (11.5%) |
|
Vómitos |
5 (5.9%) |
5 (6.2%) |
10 (6%) |
11 (14.1%) |
|
Hipertensión |
4 (4.7%) |
7 (8.6%) |
11 (6.6%) |
12 (15.4%) |
|
Taquicardia |
2 (2.4%) |
8 (9.9%) |
10 (6%) |
14 (17.9%) |
|
Disnea |
4 (4.7%) |
8 (9.9%) |
12 (7.2%) |
8 (10.3%) |
|
Hipoxia |
0 |
1 (1.2%) |
1 (< 1%) |
9 (11.5%) |
Día 1 la temperatura del cuerpo aumenta por encima de la temperatura se toma 1 hora antes de la infusión (temperatura pre infusión) o por encima del valor más bajo de infusión (temperatura registrada sin pre infusión).
No se les administró pre medicación a los pacientes para prevenir reacciones relacionadas con la infusión antes de la infusión del fármaco de estudio Día 1.
En el Estudio 94-0-013, un ensayo multicéntrico aleatorio, doble ciego comparando Amfotericina B liposomal y desoxicolato de amfotericina B como terapia inicial para la meningitis criptocócica, para prevenir la pre medicación les permitió reacciones relacionadas con la perfusión. Los pacientes tratados con Amfotericina B liposomal tuvieron una menor incidencia de fiebre, escalofrío/rigores y los eventos adversos respiratorios que se resumen en la siguiente tabla:
Estudio 94-0-013. Incidencia de reacciones relacionadas con la infusión
|
Amfotericina B liposomal 3 mg/kg |
Amfotericina B liposomal 6 mg/kg |
Amfotericina B |
|
|
Número total de pacientes que recibieron al menos una dosis del fármaco del estudio |
86 |
94 |
87 |
|
Pacientes con incremento de fiebre de > 1°C |
6 (7%) |
8 (9%) |
24 (28%) |
|
Pacientes con escalofríos/rigor |
5 (6%) |
8 (9%) |
42 (48%) |
|
Pacientes con náuseas |
11 (13%) |
13 (14%) |
18 (20%) |
|
Pacientes con vómito |
14 (16%) |
13 (14%) |
16 (18%) |
|
Eventos respiratorios adversos |
0 |
1 (1%) |
8 (9%) |
Ha habido algunos informes de sofoco, dolor de espalda con o sin opresión en el pecho y dolor en el pecho asociado con la administración de Amfotericina B liposomal; en ocasiones esto ha sido grave. Cuando se observaron estos síntomas, la reacción se desarrolló dentro de unos pocos minutos después del inicio de la infusión y desapareció rápidamente cuando se detuvo la infusión. Los síntomas no ocurren con cada dosis y por lo general no se repite en las administraciones subsiguientes cuando se ralentiza la velocidad de infusión.
Toxicidad y la suspensión de las dosis: En el Estudio 94-0-002, se observó una incidencia significativamente menor de grado 3 o 4 de toxicidad en el grupo de Amfotericina B liposomal en comparación con el grupo de amfotericina B. Además, casi tres veces más pacientes administrados con amfotericina B requieren una reducción de la dosis debido a la toxicidad o la interrupción del fármaco del estudio debido a una reacción a la infusión relacionada en comparación con los administrados con Amfotericina B liposomal.
En el estudio de tratamiento empírico 97-0-034, una mayor proporción de pacientes en el grupo del complejo lipídico de amfotericina B descontinuaron el medicamento del estudio debido a un evento adverso que en los grupos de Amfotericina B liposomal.
Eventos adversos menos comunes: Los siguientes eventos adversos también han sido reportados en un 2% a 10% de Amfotericina B liposomal a pacientes tratados que reciben quimioterapia o trasplante de médula ósea, o han tenido la enfermedad del VIH en seis ensayos clínicos comparativos:
Cuerpo en general: Abdomen alargado, reacción alérgica, celulitis, reacción inmunológica mediada por células, edema facial, injerto versus enfermedad huésped, malestar general, dolor de cuello y complicación procedimental.
Sistema cardiovascular: Arritmia, fibrilación auricular, bradicardia, paro cardiaco, cardiomegalia, hemorragia, hipotensión postural, enfermedad cardiaca valvular, trastorno vascular y vasodilatación (sofocos).
Sistema digestivo: Anorexia, estreñimiento, sequedad de boca/nariz, dispepsia, disfagia, eructos, incontinencia fecal, flatulencia, hemorroides, goma/hemorragia oral, hematemesis, daño hepatocelular, hepatomegalia, pruebas de función hepática anormal, íleo, mucositis, trastorno rectal, estomatitis, estomatitis ulcerativa y enfermedad hepática veno-oclusiva.
Sistema Hemático y linfático: Anemia, trastorno de la coagulación, equimosis, sobrecarga de líquidos, petequias, la protrombina disminuyó, aumentó la protrombina, y trombocitopenia.
Metabólica y Trastornos Nutricionales: Acidosis, amilasa aumentó, hipercloremia, hiperpotasemia, hipermagnesemia, hiperfosfatemia, hiponatremia, hipofosfatemia, hipoproteinemia, lactato deshidrogenasa aumentado, aumento de nitrógeno no proteico (NPN) y alcalosis respiratoria.
Sistema músculo esquelético: Artralgia, dolor de huesos, distonía, mialgia y rigores.
Sistema nervioso: Agitación, coma, convulsiones, tos, depresión, disestesia, mareos, alucinaciones, nerviosismo, parestesia, somnolencia, alteración de pensar y temblor.
Sistema respiratorio: Asma, atelectasia, hemoptisis, hipo, hiperventilación, síntomas de tipo gripal, edema pulmonar, faringitis, neumonía, insuficiencia respiratoria y sinusitis.
Piel y apéndices: Alopecia, piel seca, herpes simple, inflamación en el lugar de la inyección, erupción maculopapular, púrpura, decoloración de la piel, trastornos de la piel, úlceras en la piel, urticaria y erupciones vesiculobullosas.
Órganos de los sentidos: Conjuntivitis, ojos secos y hemorragia ocular.
Sistema urogenital: Función anormal renal, insuficiencia aguda de riñón, insuficiencia renal aguda, disuria, insuficiencia renal, nefropatía tóxica, incontinencia urinaria y hemorragia vaginal.
Experiencia post-comercialización:
Las siguientes experiencias adversas poco frecuentes han sido reportadas en la vigilancia posterior, además de las mencionados anteriormente: Angioedema, eritema, urticaria, broncoespasmo, cianosis/hipoventilación, edema pulmonar, agranulocitosis, cistitis hemorrágica y rabdomiólisis.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Ningún estudio a largo plazo en animales se ha realizado para evaluar el potencial carcinogénico de Amfotericina B liposomal. Amfotericina B liposomal no ha sido probado para determinar su potencial mutagénico. Un segmento I de estudio de reproducción en ratas encontró un ciclo estrogénico anormal (diestro prolongado) y la disminución de número de cuerpos lúteos en los grupos de dosis alta (10 y 15 mg/kg, dosis equivalentes a dosis humanas de 1.6 y 2.4 mg/kg basadas en consideraciones de superficie área del cuerpo). Amfotericina B liposomal no afectó la fertilidad o días para la cópula. No hubo efectos sobre la función reproductora masculina.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No hay estudios clínicos formales de interacciones farmacológicas que se hayan realizado con Amfotericina B liposomal. Sin embargo, los siguientes fármacos se sabe que interactúan con amfotericina B y pueden interactuar con Amfotericina B liposomal.
Agentes antineoplásicos: El uso concomitante de agentes antineoplásicos puede aumentar el potencial de toxicidad renal, broncoespasmo e hipotensión. Agentes antineoplásicos deben administrarse concomitantemente con precaución.
Corticosteroides y corticotropina (ACTH): El uso concomitante de corticoides y ACTH puede potenciar la hipopotasemia que podría predisponer al paciente a la disfunción cardiaca. Si se utiliza de forma concomitante los electrólitos séricos y la función cardiaca, deben ser estrechamente monitorizados.
Glucósidos digitálicos: El uso concomitante puede inducir hipopotasemia y puede potenciar la toxicidad digitálica. Cuando se administra de forma concomitante, los niveles séricos de potasio deben vigilarse estrechamente.
Flucitosina: El uso simultáneo de flucitosina puede aumentar la toxicidad de la flucitosina posiblemente por el aumento de su captación celular y/o alterar su excreción renal.
Azoles (por ejemplo, ketoconazol, miconazol, clotrimazol, fluconazol, etc.): En estudios de animales in vitro e in vivo de la combinación de amfotericina B e imidazoles sugieren que los imidazoles pueden inducir resistencia a los hongos por la amfotericina B. La terapia de combinación debe administrarse con precaución, especialmente en pacientes inmunocomprometidos.
Transfusiones de leucocitos: La toxicidad pulmonar aguda ha sido reportada en pacientes que reciben simultáneamente amfotericina B intravenosa y transfusiones de leucocitos.
Otros medicamentos nefrotóxicos: El uso simultáneo de amfotericina B y otros medicamentos nefrotóxicos puede aumentar el potencial de toxicidad renal inducida por fármacos. Se recomienda seguimiento intensivo de la función renal en pacientes que requieren una combinación de medicamentos nefrotóxicos.
Relajantes del músculo esquelético: La hipopotasemia inducida por amfotericina B puede aumentar el efecto curariforme de relajantes musculares (por ejemplo, tubocurarina) debido a la hipopotasemia. Cuando se administra de forma concomitante, los niveles séricos de potasio deben vigilarse estrechamente.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Pruebas de laboratorio: El efecto de Amfotericina B liposomal sobre la función renal y hepática y en los electrólitos séricos se evaluó a partir de los valores de laboratorio medidos repetidamente en el Estudio 94-0-002. La frecuencia y la magnitud de las anomalías de las pruebas hepáticas fueron similares en los grupos de Amfotericina B liposomal y amfotericina B. La nefrotoxicidad se definió como el aumento de los valores de creatinina al 100% o más respecto a los niveles previos al tratamiento en pacientes pediátricos, los valores de creatinina y el aumento de 100% o más respecto a los niveles previos al tratamiento en pacientes adultos siempre que la concentración pico de creatinina fuera > 1.2 mg/dL. La hipopotasemia se define como los niveles de potasio ≤ 2.5 mmol/L en cualquier momento durante el tratamiento.
La incidencia de nefrotoxicidad, concentración de creatinina sérica pico media, cambio desde el inicio de la creatinina sérica media y, la incidencia de hipopotasemia en el estudio aleatorio, doble ciego fueron menores en el grupo de Amfotericina B liposomal como se resume en la siguiente tabla:
Estudio 94-0-002. Evidencia de nefrotoxicidad de laboratorio
|
Amfotericina B liposomal |
Amfotericina B |
|
|
Número total de pacientes que recibieron al menos una dosis del fármaco del estudio |
343 |
344 |
|
Nefrotoxicidad |
64 (18.7%) |
116 (33.7%) |
|
Pico medio de Creatinina |
1.24 mg/dL |
1.52 mg/dL |
|
Cambio desde el inicio de la creatinina media |
0.48 mg/dL |
0.77 mg/dL |
|
Hipocalcemia |
23 (6.7%) |
40 (11.6%) |
El efecto de Amfotericina B liposomal (3 mg/kg/día) frente a la amfotericina B (0.6 mg/kg/día) sobre la función renal en pacientes adultos que participaron en este estudio se ilustra en la siguiente figura:
Cambio en la creatinina a través del tiempo promedio en el Estudio 94-0-002
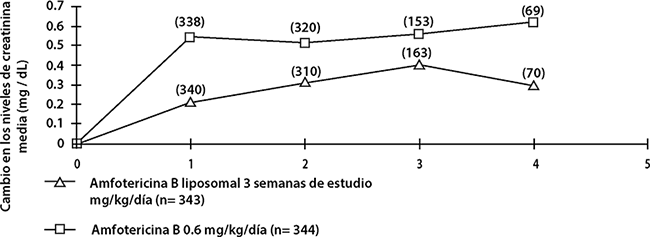
En el estudio de tratamiento empírico 97-0-034, la incidencia de nefrotoxicidad, medida por el aumento de la creatinina sérica respecto al valor basal fue significativamente menor en los pacientes administrados con Amfotericina B liposomal (grupos de dosis individuales y combinados) en comparación con complejo lipídico de amfotericina B.
Incidencia de nefrotoxicidad Terapia empírica del Estudio 97-0-034
|
Amfotericina B liposomal |
Complejo lipídico de Amfotericina B 5 mg/kg/día |
|||
|
3 mg/kg/día |
5 mg/kg/día |
Ambos |
||
|
Número total de paciente |
85 |
81 |
166 |
78 |
|
Número de Nefrotoxicidad |
||||
|
1.5 X valor de creatinina sérica basal |
25 (29.4%) |
21 (25.9%) |
46 (27.7%) |
49 (62.8%) |
|
2 X valor de creatinina sérica basal |
12 (14.1%) |
12 (14.8%) |
24 (14.5%) |
33 (42.3%) |
El siguiente gráfico muestra las concentraciones medias de creatinina sérica en el estudio de uso compasivo y muestra que hay una caída de las concentraciones de pretratamiento para todos los pacientes, especialmente aquellos con (superior a 1.7 mg/dl) elevadas concentraciones de creatinina del pretratamiento.

La incidencia de nefrotoxicidad en el Estudio 94-0-013, ensayo comparativo en la meningitis criptocócica, fue menor en los grupos de Amfotericina B liposomal como se muestra en la siguiente tabla:
Evidencia Laboratorio de nefrotoxicidad del Estudio 94-0-013
|
Amfotericina B liposomal 3 mg/kg |
Amfotericina B liposomal 6 mg/kg |
Amfotericina B |
|
|
Número total de pacientes que recibieron al menos una dosis del fármaco de prueba |
86 |
94 |
87 |
|
Número con Nefrotoxicidad (%) |
|||
|
1.5 X valor de creatinina sérica basal |
30 (35%) |
44 (47%) |
52 (60%) |
|
2 X valor de creatinina sérica basal |
12 (14%) |
20 (21%) |
29 (33%) |
PRECAUCIONES GENERALES: Al igual que con cualquier producto que contiene amfotericina B el fármaco debe ser administrado por personal con formación médica. Durante el periodo inicial de tratamiento, los pacientes deben estar bajo estrecha observación clínica. Amfotericina B liposomal ha demostrado ser significativamente menos tóxica que el desoxicolato de amfotericina B; sin embargo, todavía se pueden producir reacciones adversas.
Pruebas de laboratorio: El manejo del paciente debe incluir una evaluación de laboratorio; renal, hepática y la función hematopoyética, y los electrólitos séricos (particularmente magnesio y potasio).
Interacciones-Laboratorio: fosfato sérico falsa elevación: Falsas elevaciones de fosfato sérico pueden ocurrir cuando se analizan las muestras de los pacientes que recibieron Amfotericina B liposomal utilizando el ensayo PHOSm (por ejemplo, utilizados en analizadores de Cultivo de Beckman incluyendo el Synchron LX20). Este ensayo está diseñado para la determinación cuantitativa de fósforo inorgánico en muestras de suero, plasma u orina humanos.
DOSIS Y VÍA DE ADMINISTRACIÓN: Amfotericina B liposomal debe administrarse por infusión intravenosa, usando un dispositivo de infusión controlada, durante un periodo de aproximadamente 120 minutos.
Se puede utilizar un filtro de membrana en línea para la infusión intravenosa de Amfotericina B liposomal; EL DIÁMETRO MEDIO DEL PORO DEL FILTRO NO ES INFERIOR A 1.0 MICRAS.
Nota: Una línea intravenosa existente debe ser lavada con Inyección de dextrosa al 5% antes de la infusión de Amfotericina B liposomal. Si esto no es factible, Amfotericina B liposomal debe ser administrado a través de una línea separada.
El tiempo de infusión puede reducirse a aproximadamente 60 minutos en pacientes en los que se tolera bien el tratamiento. Si el paciente experimenta molestias durante la infusión, la duración de la infusión puede incrementarse.
La dosis inicial recomendada de Amfotericina B liposomal para cada indicación para pacientes adultos y pediátricos es la siguiente:
|
Indicación |
Dosis (mg/kg/día) |
|
Terapia empírica |
3 |
|
Infecciones fúngicas sistémicas: Aspergillus Candida Criptococcus |
3-5 |
|
La meningitis criptocócica en pacientes infectados por el VIH |
6 |
La dosificación y velocidad de infusión debe ser individualizada a las necesidades del paciente específico para garantizar la máxima eficacia y reducir al mínimo la toxicidad sistémica o eventos adversos.
Las dosis recomendadas para la leishmaniasis visceral se presentan a continuación:
|
Leishmaniasis visceral |
Dosis 9 mg/kg/día |
|
Pacientes inmunocompetentes |
3 (días 1-5) y 3 en los días 14, 21 |
|
Pacientes inmunocomprometidos |
4 (días 1-5) y 4 en los días 10, 17, 24, 31, 38 |
Para los pacientes inmunocompetentes que no alcanzan depuración parasitaria con la dosis recomendada, puede ser útil una dosis de repetición de la terapia.
Para los pacientes inmunocomprometidos quienes no depuran los parásitos o que experimentan recaídas, se recomienda el asesoramiento de expertos en relación con el tratamiento adicional.
Instrucciones de reconstitución, filtración y dilución: Lea esta sección completa con cuidado antes de comenzar la Reconstitución.
Amfotericina B liposomal debe ser reconstituido utilizando agua estéril inyectable (sin un agente bacteriostático). Los viales de Amfotericina B liposomal que contienen 50 mg de amfotericina B se preparan como sigue:
Reconstitución:
1. Agregar asépticamente 12 ml de agua estéril para uso inyectable, a cada frasco ámpula Amfotericina B liposomal para producir una preparación que contiene 4 mg de amfotericina B/mL. PRECAUCIÓN: NO RECONSTITUIR CON SOLUCIÓN SALINA O ADICIONAR SOLUCIÓN SALINA A LA CONCENTRACIÓN RECONSTITUIDA O MEZCLAR CON OTROS FÁRMACOS. El uso de cualquier otra solución de las recomendadas, o la presencia de un agente bacteriostático en la solución, puede provocar la precipitación de Amfotericina B liposomal.
2. Inmediatamente después de la adición de agua, AGITAR ENÉRGICAMENTE EL FRASCO ÁMPULA durante 30 segundos para dispersar por completo la Amfotericina B liposomal. Amfotericina B liposomal forma una suspensión translúcida amarilla. Inspeccione visualmente el frasco ámpula para detectar partículas y continuar agitando hasta que esté completamente dispersado.
Filtración y dilución:
3. Calcular la cantidad de Amfotericina B liposomal reconstituida (4 mg/mL) para ser posteriormente diluida.
4. Retirar esta cantidad de Amfotericina B liposomal reconstituido en una jeringa estéril.
5. Siempre colocar el filtro de 5 micrones a la jeringa. Inyectar el contenido de la jeringa a través del filtro, en la cantidad apropiada de solución de dextrosa al 5%. (Utilice sólo un filtro por vial de Amfotericina B liposomal.)
6. Amfotericina B liposomal debe ser diluido con solución de dextrosa 5% hasta una concentración final de 1 a 2 mg/ml antes de la administración. Las concentraciones más bajas (0.2 a 0.5 mg/ml) pueden ser apropiadas para los bebés y niños pequeños para proporcionar un volumen suficiente para perfusión. DESCARTAR LOS FRASCOS ÁMPULAS PARCIALMENTE USADOS.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La toxicidad de Amfotericina B liposomal debida a la sobredosis no se ha definido. Se han administrado Dosis diarias repetidas de hasta 10 mg/kg en pacientes pediátricos y 15 mg/kg en pacientes adultos en ensayos clínicos sin ninguna toxicidad relacionada con la dosis reportada.
Administración: Si se produce una sobredosis, cesar la administración inmediatamente. Deben ser instituidas medidas de apoyo sintomáticos. Debe darse particular atención a la vigilancia de la función renal. Hemodiálisis o diálisis peritoneal no parecen afectar de forma significativa la eliminación de Amfotericina B liposomal.
PRESENTACIÓN: Caja con frasco ámpula con liofilizado, un frasco ámpula con diluyente, un filtro de 5 micras e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Frasco-ámpula con liofilizado: Conservar a temperatura no superior a 25°C.
Amfotericina B liposomal reconstituido concentrado (no diluido): Hecha la mezcla el producto se conserva durante 24 horas en refrigeración entre 2°-8°C. No se congele.
Amfotericina B liposomal diluido en Dextrosa al 5%: Una vez diluido conservar a temperatura ambiente y realizar la infusión dentro de las primeras 6 horas.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. Literatura exclusiva para profesionales de la salud. Si no se administra todo el producto, deséchese el sobrante. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. No se administre si el cierre ha sido violado. Diluir Amfotericina B liposomal con solución de Dextrosa al 5%. No se deje al alcance de los niños. No use en el embarazo y lactancia. No conservar frascos-ámpula parcialmente usados. No reconstituir con soluciones salinas o mezclar con otros medicamentos o electrólitos. Este medicamento deberá ser administrado únicamente por personal entrenado. Este medicamento es de alto riesgo. Este medicamento debe ser usado bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica.
Reporte las sospechas de reacción adversa al correo farmacovigilancia@cofepris.gob.mx
Fabricante del Liofilizado
Hecho en México por:
Industrias Químico Farmacéuticas Americanas,
S.A. de C.V.
Circuito Cerrillo II, Mza. 3 Lote 2 y 3
Parque Industrial Lerma, C.P. 52000, Lerma, México, México
Para:
Zurich Pharma, S.A. de C.V.
Carretera México-Querétaro Km. 71.5
Col. Noxtongo, C.P. 42850
Tepeji del Río Ocampo, Hidalgo, México
Fabricante del Diluyente
Hecho en México por:
ZURICH PHARMA, S.A. de C.V.
Carretera México-Querétaro Km. 71.5
Col. Noxtongo, C.P. 42850
Tepeji del Río Ocampo, Hidalgo, México
Reg. Núm. 436M2016 SSA IV
163300404M0035