
TRANSKRIP
HIDRALAZINA, VALPROATO DE MAGNESIO
Tabletas de liberación prolongada
1 Caja, 7/21 Tabletas de liberación prolongada, 83/700 mg/mg
1 Caja, 7/21 Tabletas de liberación prolongada, 182/700 mg/mg
1 Caja, 28/84 Tabletas de liberación prolongada, 83/700 mg/mg
1 Caja, 28/84 Tabletas de liberación prolongada, 182/700 mg/mg
1 Caja, 14/42 Tabletas de liberación prolongada, 83/700 mg/mg
1 Caja, 14/42 Tabletas de liberación prolongada, 182/700 Miligramos
FORMA FARMACÉUTICA Y FORMULACIÓN:
Acetiladores Rápidos:
Cada TABLETA amarilla DE LIBERACIÓN PROLONGADA contiene:
Clorhidrato de Hidralazina 182 mg
Excipiente cbp 1 tableta
Cada TABLETA blanca DE LIBERACIÓN PROLONGADA contiene:
Valproato de Magnesio 700 mg
Excipiente cbp 1 tableta
Acetiladores Lentos:
Cada TABLETA amarilla DE LIBERACIÓN PROLONGADA contiene:
Clorhidrato de Hidralazina 83 mg
Excipiente cbp 1 tableta
Cada TABLETA blanca DE LIBERACIÓN PROLONGADA contiene:
Valproato de Magnesio 700 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS: TRANSKRIP es clorhidrato de hidralazina y valproato de magnesio de liberación prolongada con especificidad distintiva para el tipo de acetilación rápida o lenta de cada paciente. TRANSKRIP es un agente antitumoral dual de última generación incluido y clasificado en el marco de las denominadas terapias epigenéticas, las cuales están dirigidas contra blancos moleculares. TRANSKRIP es el primer agente representativo de la terapia epigenética que combina individualmente el clorhidrato de hidralazina, un inhibidor de las metiltransferasas de ADN con el valproato de magnesio, un inhibidor de las desacetilasas de histonas. Estas dos enzimas son cruciales para el desarrollo y progresión del cáncer así como de la resistencia al tratamiento; ya que la hipermetilación del ADN y la desacetilación de histonas, apagan la expresión de genes supresores de tumores.
TRANSKRIP está indicado en asociación con la quimioterapia de primera línea en el tratamiento del cáncer cérvico uterino metastásico, recurrente o persistente.
FARMACOCINÉTICA Y FARMACODINAMIA: La epigenética es la disciplina científica que estudia las modificaciones del medio que actúan sobre el ADN, principalmente por medio de la metilación y la modificación en las histonas, que alteran la expresión de los genes. También, la epigenética es referida como el estudio de los cambios heredables que se producen en la función génica sin que se presenten alteraciones en el código genético del individuo o cambios en la secuencia de su ADN (la cadena de pares de bases del ADN de cada individuo).
Por lo tanto, la investigación epigenética da por resultado que el control de la constitución biológica del individuo no es sólo ejercido por la secuencia del ADN, sino que la metilación del ADN y las modificaciones de las HISTONAS, proteínas que regulan y empaquetan el ADN, situadas a intervalos regulares a lo largo de la cadena. Éstas activan o inactivan los genes por lo que se reconocen como importantes reguladores de la actividad génica.
Es conocido que las propiedades que caracterizan a la célula maligna y por lo tanto al cáncer, son el resultado de la acumulación progresiva y sistemática de cambios en la información genética. La pérdida, amplificación, translocación y mutación del ADN son eventos centrales en la etiopatogenia del cáncer, en los últimos años se han sucedido avances importantes en caracterizar el papel que desempeñan otros eventos bioquímicos fundamentales para el desarrollo y progresión del cáncer dando lugar al establecimiento de la terapéutica transcripcional o epigenética. Así pues, los mecanismos epigenéticos de control transcripcional juegan un papel de gran importancia en la inactivación de genes responsables del crecimiento y diferenciación celular, y por lo tanto en el desarrollo de cáncer. Los mecanismos epigenéticos más estudiados son la metilación del ADN y la desacetilación de HISTONAS.
En este sentido, el objetivo de los "fármacos epigenéticos" es "despertar a los genes que están "dormidos" para que logren expresarse e inhiban los tumores". Cada individuo tiene su propia genética y epigenética, así mismo todos los tumores sin excepción tienen alteraciones genéticas y epigenéticas. En los tumores cancerígenos hay una hipermetilación regional del ADN y desacetilación de histonas. Por ello, el conocimiento de estos procesos es la base para el desarrollo de nuevos tratamientos para el cáncer, que invirtieran en el proceso epigenético alterado.
En el desarrollo del cáncer existen cambios genéticos y epigenéticos a nivel celular que activan e inactivan oncogenes y genes supresores respectivamente. La metilación del ADN y la desacetilación de histonas son los dos fenómenos epigenéticos responsables del silenciamiento transcripcional de genes supresores de tal manera que el uso de terapia epigenética transcripcional con agentes desmetilantes e inhibidores de las desacetilasas de histonas como TRANSKRIP (hidralazina y valproato de magnesio) son capaces de modular la expresión de genes en pacientes con cáncer cuyos tumores son resistentes al tratamiento, es decir, la terapia transcripcional puede cambiar el patrón de resistencia tumoral por lo que el uso de TRANSKRIP (hidralazina y valproato de magnesio) incrementa la eficacia de la quimioterapia y la radioterapia.
La hidralazina usada ampliamente en el pasado como antihipertensivo, en la actualidad está prácticamente en desuso para este fin, principalmente por el advenimiento de antihipertensivos más selectivos y eficaces; sin embargo, estudios recientes en oncología han demostrado que este fármaco es capaz de inhibir el crecimiento de varias líneas celulares malignas y muy importantemente que tiene la capacidad de revertir la resistencia a quimioterapia.
Por otra parte y dentro de la misma línea de investigación, se ha descrito que el valproato de magnesio, un fármaco conocido por su indicación antiepiléptica y para trastornos bipolares, tiene actividad antitumoral, que no sólo depende de su capacidad de inhibir el crecimiento y la metástasis, sino que además induce diferenciación in vitro e in vivo en líneas celulares malignas.
El silenciamiento transcripcional de genes supresores de tumores por la metilación del ADN y la desacetilación de histonas son dos eventos determinantes para el desarrollo y progresión de los tumores, en consecuencia, existe un marcado sinergismo en el efecto reactivante de la expresión génica entre un agente desmetilante y un inhibidor de las desacetilasas de histonas, tal y como son fármacos los contenidos en TRANSKRIP (hidralazina y valproato de magnesio).
Dado que los datos experimentales sugieren que la manipulación farmacológica tendiente a re-expresar genes supresores en las enfermedades malignas puede tener un efecto terapéutico al afectar negativamente el crecimiento tumoral y modular positivamente la respuesta a otros tratamientos, actualmente la terapia va dirigida a la reactivación de los genes supresores inactivados transcripcionalmente, utilizando una combinación de inhibidores de la metilación e inhibidores de desacetilasas de histonas TRANSKRIP (hidralazina y valproato de magnesio).
La actividad antitumoral de los inhibidores de desacetilasas de histonas y metilación se ha estudiado extensamente. Los inhibidores de desacetilasas de histonas suprimen la actividad de estas enzimas lo que conduce a un aumento en la acetilación de histonas, que consecuentemente induce mayor expresión de genes específicos que a su vez producen cambios favorables para revertir el fenotipo transformado como son la inducción de arresto celular, diferenciación y apoptosis. Por su parte, también los inhibidores de la metilación inducen la re-expresión de genes supresores silenciados por metilación.
TRANSKRIP incluye dos principios activos no combinados con efectos inhibitorios sobre la carcinogénesis: hidralazina, un fármaco con propiedades desmetilantes del ADN y el valproato de magnesio con capacidad de bloquear la actividad de desacetilasas de histonas clase I y II por al menos dos mecanismos: Uniéndose al sitio catalítico de la enzima y produciendo un incremento en la degradación de la enzima por ubiquitinación. La combinación de hidralazina y valproato de magnesio que contiene TRANSKRIP por sus efectos epigenéticos, es capaz de incrementar la expresión de moléculas clase I en la superficie de las células e incrementar la citotoxicidad de linfocitos estimulados y retados con péptidos de E6 y E7. El resultado de la dualidad farmacológica de TRANSKRIP es una sinergia de efectos antitumorales que producen mayor susceptibilidad al efecto citotóxico de la quimioterapia manifestados por la inhibición del crecimiento tumoral y la modificación de su re-expresión génica.
Debido a que existen dos patrones metabólicos para la disposición de hidralazina, el de acetiladores rápidos y lentos en función de la velocidad de reacción y cantidad disponible de la enzima N-acetiltransferasa (NAT2). TRANSKRIP está desarrollado técnicamente dentro de un moderno formato de liberación prolongada y con indicaciones farmacocinéticas precisas que se adaptan a las características del metabolismo de cada paciente en lo que se refiere a la velocidad de acetilación rápida (R) o lenta (L). La acetilación rápida se hereda con carácter autosómico dominante, la acetilación lenta tiene carácter recesivo, de forma que únicamente la presentan clínicamente los homocigotos. Esta vía metabólica afecta a fármacos como isoniazida, hidralazina, fenelcina, dapsona, sulfamidas y procainamida. Los acetiladores rápidos pueden presentar problemas por acumulación de los metabolitos, algunos de los cuales pueden ser tóxicos. Es el caso de la hepatotoxicidad por isoniazida.
En los acetiladores lentos se acumula el fármaco original en el organismo, lo que incrementa su toxicidad (lupus eritematoso inducido por hidralazina, isoniazida y procainamida, neurotoxicidad por isoniazida). Las manifestaciones clínicas desaparecen al suprimir el medicamento. De aquí la denominación distintiva del producto como R o L respectivamente, esta ventaja permite que TRANSKRIP pueda adecuarse a cada tipo de paciente y ofrecer, con una dosis diaria, un efecto sostenido con menores fluctuaciones séricas y mínimos o nulos efectos adversos.
TRANSKRIP incluye en su presentación farmacéutica dos fármacos por separado, éstos se encuentran contenidos en tabletas fácilmente identificables por su color, amarillo para el clorhidrato de hidralazina y blanco para el valproato de magnesio.
Cada tableta, independientemente del principio activo que contenga, está conformada por una matriz polimérica que envuelve las moléculas del fármaco para permitir su liberación lenta y constante.
Después de su ingestión simultánea, los dos componentes de TRANSKRIP son absorbidos completamente por el tracto gastrointestinal, asegurando las concentraciones plasmáticas requeridas para el tratamiento; sin embargo, por ser una dualidad de principios activos autónomos presentan comportamientos farmacocinéticos particulares cada uno:
TRANSKRIP componente Clorhidrato de hidralazina de liberación controlada: La formulación de liberación prolongada retrasa su eliminación y se obtienen niveles significativos del fármaco en plasma durante 24 horas.
Los niveles plasmáticos en acetiladores lentos son casi del doble de los obtenidos con acetiladores rápidos, y en el caso del parámetro del Área Bajo la Curva (AUC) la cantidad de fármaco biodisponible en plasma, es aún mayor la diferencia. La máxima concentración de hidralazina en plasma se obtiene en 4 y 3 horas, respectivamente (mientras que en tabletas normales se obtiene en 1/2 hora), y la vida media aparente en ambos casos aumenta de 1 hora (tabletas de liberación inmediata) a 8 horas.
Comparación de parámetros farmacocinéticos de hidralazina entre acetiladores rápidos y acetiladores lentos
|
Parámetro |
Ac. lentos |
Ac. rápidos |
|
Área Bajo la Curva (AUC) ng/h/ml |
6034.67 ± 1899.76 |
2751.32 ± 954.64 |
|
Cmax (ng/mL) |
470.40 + 162.81 |
208.43 + 56.93 |
|
Tmax (h) |
4.42 + 3.19 |
2.84+2.54 |
|
TMR (h) |
13.87 + 6.30 |
14.00 + 6.10 |
|
t½ (h) |
7.94 + 4.18 |
8.24 + 4.59 |
Es importante comparar estos niveles con los alcanzados por una formulación de liberación inmediata de hidralazina. Cuando se administran 100 mg de hidralazina por vía oral se obtiene una Cmax de alrededor de 2000 ng/mL; si la dosis es de 50 mg, este valor alcanza aproximadamente 400 ng/mL. Dada la concentración terapéutica reportada, se concluye que la formulación alcanza niveles inferiores a la Cmax de una formulación de liberación inmediata de 100 mg, y en acetiladores rápidos se alcanzan niveles más altos a la Cmax de una formulación con 50 mg del fármaco.
Los estudios in vitro realizados con hidralazina demuestran que se necesita una dosis de 10 μM (equivalente a 1.96 μg/mL (o 1960 ng/mL) para ver el efecto desmetilante. Con la formulación utilizada, tanto en los acetiladores rápidos como lentos, la biodisponibilidad de la hidralazina expresada como área bajo la curva en ng/h/mL es suficiente para lograr desmetilación del ADN (6034.61 ± 1899.76 y 2751.32 ± 954.64, para lentos y rápidos respectivamente). Con respecto a la toxicidad del clorhidrato de hidralazina de liberación prolongada, estudios en voluntarios sanos demostraron que en acetiladores rápidos no se observaron efectos colaterales ni se registraron cambios en la presión arterial o ritmo cardiaco. Sin embargo, los individuos con fenotipo de acetilador lento, muestran efectos tales como taquicardia sinusal, cefalea y lipotimia. Los resultados clínicos y la incidencia de efectos adversos indicaron la necesidad de reducir la dosis para los acetiladores lentos donde las concentraciones de hidralazina en plasma alcanzan mayores niveles que en los acetiladores rápidos. Para obtener niveles plasmáticos similares en ambos tipos de acetiladores, TRANSKRIP ofrece una presentación farmacéutica para acetiladores rápidos y lentos. Los estudios clínicos fase II realizados con TRANSKRIP indican que los niveles plasmáticos de hidralazina son similares en los pacientes con fenotipo rápido o lento que reciben la dosis de 182 mg o 83 mg al día respectivamente, ya que las medianas de concentración plasmáticas registradas son de 299 ng/ml para acetiladores rápidos y 309 ng/ml para lentos.
TRANSKRIP componente Valproato de Magnesio de liberación controlada: La biodisponibilidad del valproato de magnesio es cercana al 100%. Alcanza su máxima concentración plasmática (Cmax) en un plazo aproximado de 7-14 horas. La vida media de valproato de magnesio en sangre después de una dosis única es de 8 a 16-18 horas en adultos. Después de una dosis única los niveles séricos máximos de valproato de magnesio (expresados en μg/mL) corresponden a 6 ó 7 veces la dosis ingerida (expresada en mg/kg).
Los estudios clínicos fase II realizados con TRANSKRIP muestran que los niveles plasmáticos de valproato de magnesio que se alcanzan a la dosis de 30 mg/Kg de peso al día, son en promedio de 87.5 μg/mL, variando desde 78 a 187.5 μg/mL a través de los ciclos de quimioterapia.
TRANSKRIP componente Clorhidrato de hidralazina de liberación controlada: Se distribuye ampliamente en los tejidos.
Su volumen de distribución es de 0.3 a 8.2 L/kg.
Se fija a las proteínas plasmáticas en 85-90%.
TRANSKRIP componente Valproato de Magnesio de liberación controlada: Se distribuye ampliamente en el líquido extracelular y sangre.
Su volumen de distribución es entre 0.1 y 0.4 L/kg.
La vida media terminal parece ser de 15 a 17 horas y es independiente de la dosis administrada. El valproato de magnesio se une a las proteínas plasmáticas en 90%.
TRANSKRIP componente Clorhidrato de hidralazina de liberación controlada: El clorhidrato de hidralazina es metabolizado extensamente. El principal metabolito recuperado en plasma es la hidrazona de ácido pirúvico con poca actividad farmacológica. Por otra parte, la N-acetilación del fármaco ocurre en el hígado e intestino, la tasa de acetilación está determinada por los polimorfismos de la enzima N-acetiltransferasa-2 (NAT2). El compuesto acetilado es inactivo por lo cual se requieren mayores dosis que en acetiladores lentos.
TRANSKRIP componente Valproato de Magnesio de liberación controlada: El valproato de magnesio es metabolizado casi por completo vía glucuronidación, sus principales metabolitos son el valproato de glucurónido, el ácido-2-propil-2-pentanoico y 2-propil-3-exo-pentanoico, que tiene actividad equivalente a un 15% de la del valproato de magnesio.
TRANSKRIP componente Clorhidrato de hidralazina de liberación controlada: Se elimina por vía renal del 3 al 14% y por heces del 3 al 12%.
TRANSKRIP componente Valproato de Magnesio de liberación controlada: Una vez conjugado el valproato de magnesio se excreta rápidamente por la orina. Cerca del 70% de la dosis administrada (1-3% inalterada) se elimina por esta vía.
El clorhidrato de hidralazina contenido en la fórmula dual de TRANSKRIP inhibe la actividad de la enzima ADN metiltransferasa tanto in vitro como in vivo y reduce la expresión de los genes DNMT1 y DNMT3a en rangos micromolares de concentración (IC10 μM). Las ADN metiltransferasas son enzimas que catalizan la adición de un grupo metilo (CH3) al carbono 5 del anillo de las citocinas (proceso llamado metilación del ADN).
En las neoplasias se ha encontrado una mayor expresión y/o actividad de dichas enzimas produciendo hipermetilación del ADN que a su vez produce apagamiento de genes supresores de tumores.
El clorhidrato de hidralazina por lo tanto al reducir la actividad enzimática y la expresión a nivel del RNA mensajero de las ADN metiltransferasas lleva a una reducción de la metilación global del ADN y a la desmetilación de la región promotora o reguladora de genes supresores del cáncer con su consecuente reactivación de la expresión.
Por su parte el valproato de magnesio contenido en la fórmula dual de TRANSKRIP inhibe las desacetilasas de histonas (HDACs) clase I (HDACs 1-3) en rangos de 0.7-1 mM, y a las HDACs clase II subclases 4, 5 y 7 en concentraciones de 1-1.5 mM. Las HDACs son enzimas que catalizan la remoción de grupos acetilos (CH3) de las histonas y otras proteínas como el producto del gen supresor p53. La hipoacetilación resultante determina a su vez que la cromatina (ADN asociado a proteínas tipo histonas) adopte una configuración cerrada que impide o dificulta la transcripción génica. Por lo cual, el valproato de magnesio, al inhibir estas enzimas favorece la relajación de la cromatina y, como consecuencia, la expresión génica.
El fundamento de asociar el clorhidrato de hidralazina con el valproato de magnesio en TRANSKRIP reside en que la hipermetilación del ADN y la hipoacetilación de histonas cooperan para inducir el apagamiento de genes importantes para el desarrollo de los tumores por lo tanto ambos medicamentos sinergizan la expresión génica y el efecto antitumoral.
Estudios preclínicos: Estudios in vitro en un panel de líneas celulares malignas, entre las que se incluyen líneas de cáncer de mama positivas y negativas al receptor de estrógenos así como de carcinoma cervicouterino, indican que la hidralazina tiene un efecto inhibitorio sobre el crecimiento de las mismas por detención del ciclo celular o apoptosis, efecto que se observa entre las 48 y 120 horas posteriores, lo cual se correlaciona con su efecto desmetilante del ADN. Dado que es conocido que la hipermetilación del ADN produce resistencia a la quimioterapia, en un modelo de cáncer de mama resistente a doxorrubicina, se ha demostrado que la hidralazina por su capacidad inhibitoria sobre la metilación del ADN, revierte la hipermetilación y restituye la sensibilidad a la quimioterapia. También se ha demostrado que la hidralazina reduce selectivamente la presión intersticial en los tumores en comparación con los tejidos normales, el aumento de la presión intersticial es por sí sólo un factor pronóstico adverso que se asocia a la reducción en los niveles intratumorales de los agentes de quimioterapia.
A su vez, en múltiples estudios de la misma naturaleza realizados en un gran número de líneas celulares malignas se ha demostrado que el valproato de magnesio produce un efecto inhibitorio potente sobre el crecimiento de las líneas celulares malignas al producir detención del ciclo celular o apoptosis, inhibición de la angiogénesis, inhibición de las metástasis, diferenciación celular y reconocimiento inmune del tumor por el huésped. Así mismo, tanto la hidralazina como el valproato de magnesio por separado producen un efecto de radiosensibilización en líneas celulares malignas.
Estudios realizados en carcinomas cervicouterinos indican que TRANSKRIP disminuye los niveles de las oncoproteínas E6 y E7, cruciales para el desarrollo de este tumor e induce activación transcripcional y aumento de la acetilación de p53 lo cual aumenta los niveles de la proteína proapoptótica bax. Así mismo, TRANSKRIP no sólo incrementa las moléculas del complejo mayor de histocompatibilidad de clase I en la superficie de las células de cáncer cervicouterino, sino que aumenta el reconocimiento y la lisis de las mismas por los linfocitos de las pacientes con este tumor.
Los estudios in vitro e in vivo de la combinación de hidralazina y valproato de magnesio demuestran un marcado sinergismo en su capacidad reactivante de la expresión génica, acción que ha sido demostrada en experimentos en líneas celulares malignas analizadas por ensayos de expresión en microhileras (microarrays), posterior al tratamiento con ambos medicamentos. Esta mayor eficacia de la combinación no se limita sólo a la expresión génica sino que en algunas líneas celulares el efecto citotóxico también se ve incrementado. Además, TRANSKRIP produce un marcado aumento de la actividad antitumoral de compuestos quimioterápicos tales como el cisplatino, doxorrubicina y gemcitabina in vitro, mientras que el componente de valproato de magnesio aumenta la eficacia de varios compuestos incluyendo ácido all-trans retinoico, interferón alfa, epirrubicina, idarrubicina, imatinib y vortezomib. Cuando la combinación se evalúa en modelos in vivo (ratones inmunodeficientes a los cuales se les injertan tumores malignos humanos) se observa con TRANSKRIP un importante efecto antitumoral y una potenciación del efecto de la quimioterapia citotóxica. Además, en modelos murinos con metástasis a pulmón, TRANSKRIP muestra un efecto dramático de reducción en el número y tamaño de las lesiones metastásicas.
Estúdio clínico fase I de hidralazina: Se realizó un estudio fase I con hidralazina oral en pacientes con cáncer de cérvix para investigar su capacidad desmetilante del ADN y reactivador de la expresión de genes supresores en los tumores primarios antes y después del tratamiento con hidralazina oral a dosis de 50 mg, 75 mg, 100 mg o 150 mg al día, cuatro pacientes por cada nivel de dosis. Se analizaron los genes APC, MGMT, ER, GSTP1, DAPK, RAR beta, FHIT y p16 mediante PCR específica de metilación en los tumores antes y después de 10 días del tratamiento con hidralazina.
Los resultados indican que el 70% de los tumores pre-tratamiento tenían por lo menos un gen metilado, siendo las frecuencias de desmetilación del 40% con 50 mg al día, 52% con 75 mg al día, 43% con 100 mg al día y 32% con 150 mg al día. De los 12 casos informativos para evaluar la re-expresión, en nueve de ellos (75%) los genes se desmetilaron y reactivaron. No se observaron efectos colaterales grado 3 o 4 de acuerdo a los criterios comunes de toxicidad del Instituto Nacional de Cáncer de los Estados Unidos (CTCNCI). Los efectos grado 1 y 2 observados fueron náusea, fatiga, mareo, bochornos, dolor de cabeza y palpitaciones.
Estudio clínico fase I de valproato de magnesio: Se realizó un estudio fase I con valproato de magnesio en pacientes con carcinoma cervicouterino. Cohortes de 4 pacientes recibieron valproato de magnesio a las dosis de 20 mg/Kg, 30 mg/Kg ó 40 mg/Kg, repartidas en tomas de cada 8 horas. Las pacientes fueron sometidas a biopsia del tumor, así como toma de muestra de sangre periférica un día antes de iniciar el tratamiento, mismo que tomaron durante 5 días. El día seis se volvió a tomar muestra de tejido y sangre para el análisis.
Se realizó análisis de Western Blot para evaluar la acetilación de histonas H3 y H4, así como la medición de la actividad HDAC (actividad de desacetilasa de histona) y los niveles de valproato de magnesio. En todas las dosis utilizadas, se alcanzaron niveles por arriba de 70 μg/mL (promedio 107.3, mediana 96.5 rango 73.6 a 170.2). La mayoría de las pacientes (en todos los niveles de dosis), presentaron incremento de la acetilación de histonas en H3 y H4, así como una clara inhibición de la actividad de HDACs. En relación a la toxicidad, no se observaron cambios en las pruebas de laboratorio y la única toxicidad observada fue somnolencia grado 1 y 2.
Estudios clínicos fase II: Se han realizado estudios clínicos fase II en diversos tipos tumorales para investigar el efecto antitumoral de la combinación asociado a quimioterapia y quimiorradioterapia.
Estudio fase II: TRANSKRIP en cáncer de mama: Este estudio se realizó en 16 pacientes con cáncer de mama localmente avanzado estadio IIB a IIIA que recibieron 4 ciclos cada 21 días de adriamicina y ciclofosfamida neoadyuvante más hidralazina a 182 mg al día para los acetiladores rápidos y 83 mg al día para los lentos valproato de magnesio a 30 mg/Kg al día, hasta el día 21 del cuarto ciclo. El tratamiento fue bien tolerado y comparado con controles históricos, la toxicidad no se incrementó, excepto la presencia de somnolencia grado 2 (no incapacitante en todos los casos) e hipotensión grado 1 definida por cambios en las cifras de presión arterial que no requirió manejo, incluyendo hipotensión ortostática transitoria. Se observó 1 (6.6%) respuesta patológica completa; sin embargo, el porcentaje de piezas quirúrgicas con residual menor de 3 cm es más alto de lo que puede predecirse en base a un programa informático desarrollado para predecir la respuesta al tratamiento neoadyuvante (fue del 80% versus 38%), así mismo, la negatividad de los ganglios axilares fue mayor del porcentaje esperado.
Estos resultados demuestran que la combinación de hidralazina y valproato de magnesio incrementa la eficacia de la quimioterapia neoadyuvante. El análisis de los cambios moleculares en los tumores post-tratamiento, indica que a los 8 días de iniciado el tratamiento con hidralazina y valproato, hubo disminución estadísticamente significativa de la metilación global del ADN y de la actividad de HDAC.
En relación a la expresión génica global, los resultados indican que en las biopsias post-tratamiento con hidralazina y valproato de magnesio se regularon hacia arriba 1090 genes, muchos de ellos conocidos por su participación en la carcinogénesis y que se han visto apagados en el cáncer de mama destacando aumento en p21, p53 y nm23, genes supresores conocidos asociados a inducción de arresto de la proliferación, apoptosis y antimetástasis así como genes HLA clase I los cuales participan en el reconocimiento inmune del huésped contra el tumor. El análisis de las vías de señalización inducidas por TRANSKRIP indica que se incrementa la expresión de genes de proteínas ribosomales las cuales son genes supresores y que podrían inducir apoptosis al producir estrés ribotóxico.
La otra vía incrementada es la de fosforilación oxidativa, lo cual es muy significativo ya que las células malignas y en particular las resistentes, exhiben baja capacidad de oxidación fosforilativa por lo que TRANSKRIP restaura la capacidad del tumor para sufrir apoptosis.
Por otra parte, TRANSKRIP regula hacia abajo la expresión de oncogenes tales como v-ski, S100A8 y MDR/TAP5, este último, miembro de la familia de los genes que confieren multirresistencia a drogas que ha sido predominantemente encontrado en las células “stem” de los tumores, lo cual indica claramente el efecto de TRANSKRIP para revertir la resistencia a la quimioterapia.
Estudio fase II: TRANSKRIP en cáncer cervicouterino: Este estudio se realizó en 18 pacientes con carcinoma cervicouterino estadio IIIB mismos que recibieron quimiorradioterapia concomitante con cisplatino (40 mg/m2) seguido de braquiterapia. Las pacientes, previa tipificación del fenotipo acetilador, recibieron 182 u 83 mg al día de hidralazina más valproato de magnesio a 30 mg/kg repartido en 1 tableta cada 8 horas hasta el último día de la braquiterapia. Las 18 pacientes evaluadas lograron una respuesta clínica completa (100%).
Esta respuesta es claramente superior ya que controles históricos tratados sólo con quimiorradioterapia con cisplatino obtienen respuesta completa en sólo el 75% de los casos. Dentro de la toxicidad observada se ha evidenciado un incremento leve en la toxicidad hematológica grado 3 y 4 comparado con controles históricos; sin embargo, ninguna requirió hospitalización para manejo de la toxicidad y en cuanto a la toxicidad no hematológica sólo se ha observado somnolencia grado 2 e hipotensión grado 1 definida por cambios en las cifras de presión arterial que no requiere manejo incluyendo hipotensión ortostática transitoria.
De acuerdo al diseño del estudio, éste demuestra la eficacia del TRANSKRIP ya que se requirió que al menos 15 de las 18 pacientes tuvieran respuesta clínica completa para considerar aceptada la hipótesis de alterna la cual fue: el porcentaje de respuestas clínicas completas se aumentara de 75% a 96%. En relación a la expresión génica global, los resultados indican que en las biopsias post-tratamiento con hidralazina y valproato de magnesio se regularon hacia arriba alrededor de 1,000 genes dentro de los cuales destacan los genes observados en los carcinomas de mama que son los genes que codifican para proteínas ribosomales y fosforilación oxidativa principalmente.
Estudio fase II: TRANSKRIP más quimioterapia en pacientes con tumores sólidos que han mostrado progresión a la quimioterapia paliativa: Este ensayo incluyó un total de 27 pacientes, de los cuales 17 fueron evaluables para toxicidad y 15 para respuesta. Los tumores primarios de esos 15 pacientes fueron (cérvix 3, mama 3, pulmón 1, testículo no seminoma 1 y ovario 7 pacientes). El diseño fue MinExpSize de dos fases, de etiqueta abierta, de un brazo en el cual se incluyeron pacientes con tumores avanzados que mostraron progresión a la primera, segunda, tercera o cuarta línea de quimioterapia, al segundo o tercer ciclo. En ese momento se incluyeron al estudio, agregándose TRANSKRIP y continuaron con el mismo esquema de quimioterapia al cual mostraron progresión para evitar la interpretación de que la respuesta pudiera deberse al cambio de esquema de quimioterapia. El tamaño de muestra se consideró de 15 pacientes evaluables estimando una probabilidad de beneficio clínico (respuesta completa, respuesta parcial o estabilización de la enfermedad) del 10% de continuar sólo con la misma o de 40% de probabilidad de obtener beneficio clínico al agregar TRANSKRIP . Con esos parámetros, el error tipo alfa fue de 0.043 y la fuerza de 0.818%. Los criterios de inclusión al estudio fueron: mayores de 18 años, diagnóstico histológico de malignidad, enfermedad medible o evaluable, estado general de 0, 1 o 2 de acuerdo a los criterios del Eastern Cooperative Oncology Group (ECOG), función hematológica y renal normal, función hepática con niveles de bilirrubinas, transaminasas menor de 1.5 veces el límite superior normal además del consentimiento informado. Dentro de los criterios de exclusión figuraron la historia de alergia a la hidralazina o el valproato, historia o condición actual de cualquier enfermedad de la colágena y del sistema nervioso central, insuficiencia cardiaca e hipotensión postural diagnosticada por un facultativo.
El diagnóstico y líneas de tratamiento previo a su inclusión al estudio se muestran en el siguiente cuadro:
|
Tumor |
Líneas de tratamiento previo |
|
Cérvix |
1era. Carboplatino/paclitaxel |
|
Cérvix |
1era. Carboplatino/paclitaxel |
|
2nda. Capecitabina |
|
|
3era. Carboplatino/vinorelbina |
|
|
Cérvix |
1era. Carboplatino/paclitaxel |
|
2nda. Vinorelbina |
|
|
3era. Paclitaxel |
|
|
Ovario |
1era. Carboplatino/paclitaxel |
|
2nda. Gemcitabina |
|
|
Ovario |
1era. Carboplatino/ciclofosfamida |
|
2nda. Etopósido oral |
|
|
3era. Topotecan |
|
|
Ovario |
1era. Carboplatino/ciclofosfamida |
|
2nda. Topotecán |
|
|
Ovario |
1era. Carboplatino/paclitaxel |
|
2nda. Gemcitabina |
|
|
3era. Vinorelbina |
|
|
Ovario |
1era. Carboplatino/paclitaxel |
|
2nda. Gemcitabina |
|
|
Ovario |
1era. Carboplatino/paclitaxel |
|
2nda. Carboplatino/ciclofosfamida |
|
|
3era. Carboplatino/paclitaxel |
|
|
Ovario |
1era. Carboplatino |
|
2nda. Paclitaxel |
|
|
3era. Paclitaxel/carboplatino |
|
|
Mama |
1era. FAC |
|
2nda. Radioterapia con Mitomicina C |
|
|
3era. Paclitaxel semanal |
|
|
Mama |
1era. Carboplatino |
|
2nda. Paclitaxel |
|
|
3era. Carboplatino/paclitaxel |
|
|
Mama |
1era. Doxorrubicina/Ciclofosfamida |
|
2nda. Paclitaxel |
|
|
3era. 5FU/Gemcitabina |
|
|
4ta. Tamoxifén + ácido zoledrónico |
|
|
5ta. Anastrozol |
|
|
Testículo NSGCTC * |
1era. Ciclofosfamida, etopósido, carboplatino |
|
2nda. BEP |
|
|
3era. Cisplatino/paclitaxel |
|
|
4a. CISCA |
|
|
Pulmón NSCLC+ |
1era. Vinorelbina/carboplatino |
|
2nda. Pemetrexato |
El tratamiento fue bien tolerado encontrando un beneficio clínico en 12 (80%) de las 15 pacientes (4 respuestas parciales y 8 estabilizaciones de la enfermedad). Las repuestas parciales se observaron en cáncer de cérvix y ovario, mientras que las estabilizaciones de la enfermedad en cáncer de cérvix, mama, ovario, pulmón y testículo. Los pacientes con respuesta o estabilización refirieron mejoría en los síntomas tales como tos, disnea y dolor. La evaluación de la respuesta por sitios de lesiones primarias o metastásicas (16 en total) demostró 1 (6.6%) respuesta completa, 3 (18.75%) parciales y 9 (56.2%) de estabilización. Las respuestas se observaron a pesar de que la intensidad de la dosis de la quimioterapia durante la administración TRANSKRIP se redujo, lo cual indica que el beneficio clínico deriva de TRANSKRIP y no de mayor dosis o apego a la quimioterapia durante el protocolo. La evaluación molecular en la sangre periférica de los pacientes demostró inhibición de la actividad de las desacetilasas de histonas, inhibición de la metilación global del ADN y desmetilación de la regiones promotoras de al menos un gen en el 50% de las pacientes. La mediana de enfermedad libre de progresión fue de 4.5 meses y la mediana de supervivencia global fue de 6 meses. La toxicidad encontrada se observa en el siguiente cuadro:
Escala CTC Versión 2.0: Grado I efecto adverso leve, grado II efecto adverso moderado, grado III efecto adverso severo, grado IV efecto adverso grave
|
Ninguna % |
Grado I % |
Grado II % |
Grado III % |
Grado IV % |
|
|
Anemia |
7 (41.1) |
3 (17.5) |
3 (17.5) |
3 (17.5) |
1 (5.8) |
|
Neutropenia |
8 (47) |
1 (5.8) |
1 (5.8) |
4 (23.5) |
3 (17.5) |
|
Trombocitopenia |
8 (47) |
1 (5.8) |
4 (23.5) |
4 (23.5) |
|
|
Leucopenia |
7 (41.1) |
2 (11.7) |
2 (11.7) |
3 (17.5) |
3 (17.5) |
|
Hipoalbuminemia |
2 (11.7) |
6 (35) |
5 (29.4) |
4 (23.5) |
|
|
Renal |
17 (100) |
||||
|
Hepática |
15 (88.2) |
1 (5.8) |
1 (5.8) |
||
|
Pérdida de peso |
15 (88.2) |
2 (11.7) |
|||
|
Astenia |
3 (17.5) |
9 (52.8) |
5 (29.4) |
||
|
Hiporexia |
7 (41.1) |
7 (41.1) |
3 (17.5) |
||
|
Náusea |
7 (41.1) |
6 (35) |
4 (23.5) |
||
|
Vómito |
10 (58) |
4 (23.5) |
3 (17.5) |
||
|
Edema |
5 (29.4) |
7 (41.1) |
5 (29.4) |
||
|
Mucositis |
17 (100) |
||||
|
Disnea |
16 (94.1) |
1 (5.8) |
|||
|
Infección |
9 (52.8) |
3 (17.5) |
1 (5.8) |
4 (23.5) |
|
|
Dermatitis |
12 (70) |
5 (29.4) |
|||
|
Constipación |
15 (88.2) |
2 (11.7) |
|||
|
Diarrea |
16 (94.1) |
1 (5.8) |
|||
|
Ataque isquémico transitorio (AIT) |
16 (94.1) |
1 (5.8) |
|||
|
Trombosis de venas profundas |
16 (94.1) |
1 (5.8) |
|||
|
Dolor pélvico |
16 (94.1) |
1 (5.8) |
|||
|
Dolor abdominal |
12 (70) |
4 (23.5) |
1 (5.8) |
||
|
Somnolencia |
3 (17.5) |
7 (41.1) |
4 (23.5) |
3 (17.5) |
|
|
Temblor |
10 (58) |
4 (23.5) |
2 (11.7) |
1 (5.8) |
|
|
Insomnio |
16 (94.1) |
1 (5.8) |
|||
|
Discinesia |
16 (94.1) |
1 (5.8) |
|||
|
Mareo |
14 (83) |
3 (17.5) |
|||
|
Cefalea |
13 (76.4) |
3 (17.5) |
1 (5.8) |
En total 57 pacientes que han recibido TRANSKRIP han sido evaluados para toxicidad demostrando su seguridad, ya que los efectos adversos no hematológicos grados 3 y 4 son poco frecuentes y manejables mientras que parece que existe un leve incremento de la toxicidad hematológica pero por la naturaleza de los estudios este efecto no puede atribuirse con toda certeza a TRANSKRIP . En ningún caso se ha observado hipotensión que requiera tratamiento. En los estudios fase I administrando separadamente hidralazina y valproato de magnesio (16 y 12 pacientes respectivamente) no se observó ninguna toxicidad grado 3 y 4 lo cual confirma la seguridad del producto. En relación a la eficacia de los estudios fase II combinando TRANSKRIP con quimioterapia o radioterapia, un total de 54 pacientes han sido evaluados destacando: I) respuestas clínicas completas en el 100% de 18 casos de cáncer cervicouterino; II) Respuestas clínicas globales del 81% en 16 pacientes con cáncer localmente avanzado de mama (5 completas y 8 parciales); y III) beneficio clínico, un beneficio clínico en 12 (80%) de las 15 pacientes (4 respuestas parciales y 8 estabilizaciones de la enfermedad).
Con los datos anteriores se inició un estudio aleatorizado de fase III doble ciego controlado con placebo de TRANSKRIP asociado a la quimioterapia estándar en cáncer cervicouterino metastásico, recurrente o persistente.
La hipótesis del estudio es que TRANSKRIP asociado al cisplatino y topotecán incrementará la supervivencia libre de enfermedad de 4-6 a 7.6 meses, en comparación al régimen de cisplatino topotecán más placebo. Éste es un estudio con tamaño de muestra total de 143 pacientes calculada con alfa 0.5 y poder 80%.
El estudio inició en Junio del 2007 y se realizó un análisis preliminar a los primeros 23 pacientes evaluables para respuesta y toxicidad; de éstos, 12 fueron asignados a QT- TRANSKRIP y 11 a QT-Placebo.
Se administraron un total de 53 y 50 ciclos de quimioterapia, respectivamente. Los efectos tóxicos observados en ambos grupos, calificados de acuerdo con los criterios comunes de toxicidad y eventos adversos (CTCAE v3.0) se muestran en el siguiente cuadro. Para aquellas en el grupo QT-Placebo la leucopenia y neutropenia grado 3 se registraron en 12.1% y 18.2% de los ciclos administrados, respectivamente. Comparativamente, en el grupo QT- TRANSKRIP se registró mayor frecuencia de neutropenia grado 3 y 4 (31.9% y 11.6%), respectivamente. La proporción de trombocitopenia grado 4 fue similar en ambos grupos (3%). En relación a la toxicidad no hematológica, pese a que es baja la frecuencia de somnolencia grado 3 o 4 en el grupo QT- TRANSKRIP , este efecto no fue observado en ningún ciclo aplicado en el grupo QT-Placebo. Por otra parte, el vértigo (grados 1 y 2) se observó en 7.7% de los ciclos analizados en el grupo QT- TRANSKRIP y en ninguno con QT-placebo; la frecuencia de neuropatía fue mayor en las mujeres tratadas con QT- TRANSKRIP (5.8% vs 1.5%). La elevación de transaminasas fue poco común en ambos grupos, pero fue mayor en aquellas que recibieron QT-placebo. Además, se detectó hipomagnesemia en 21% de los ciclos analizados del grupo QT-Placebo vs. 0% en el QT- TRANSKRIP , se observó hipoalbuminemia en prácticamente la totalidad de los ciclos estudiados en ambos grupos. Finalmente, la hipotensión (reducción de las cifras de tensión arterial hasta un máximo de 90/60 mm Hg) asintomática se detectó en 16% de los ciclos de QT-Placebo y en 11.6% de aquellos con QT- TRANSKRIP , ningún caso presentó toxicidad grado 2 (necesitó corrección con líquidos o medicamentos) o de mayor grado. En el grupo QT-Placebo se contabilizaron retrasos en la aplicación del tratamiento en el 36.4% de los ciclos, en la mayoría por toxicidad hematológica y no mayor de una semana de retraso. En comparación, los retrasos de aplicación se documentaron en el 56.5% en el grupo QT- TRANSKRIP . Igual que en el grupo control, la mayoría por causa hematológica y el retraso no mayor de una semana.
Cuadro 1. Toxicidad hematológica y no hematológica. QT-Placebo (11 pacientes, 50 ciclos). QT- TRANSKRIP (12 pacientes 53 ciclos)
|
Toxicidad |
QT-Placebo |
QT- TRANSKRIP |
||||
|
Cualquier grado |
Grado 3 (%) |
Grado 4 (%) |
Cualquier grado (%) |
Grado 3 (%) |
Grado 4 (%) |
|
|
Hemoglobina |
90.9 |
4.5 |
53.6 |
2.9 |
1.4 |
|
|
Plaquetas |
3 |
3 |
15.9 |
2.9 |
||
|
Leucocitos |
68.2 |
12.1 |
78.2 |
10.1 |
1.4 |
|
|
Neutrófilos |
54.5 |
18.2 |
4.5 |
68.1 |
31.9 |
11.6 |
|
Náusea |
75.7 |
3 |
46.4 |
1.4 |
||
|
Vómito |
43.9 |
3 |
18.8 |
1.4 |
||
|
Diarrea |
6 |
5.8 |
1.4 |
|||
|
Fatiga |
75.7 |
55.1 |
1.4 |
1.4 |
||
|
Somnolencia |
13.6 |
31.9 |
7.2 |
1.4 |
||
|
Estreñimiento |
3 |
7.2 |
||||
|
AST |
10.6 |
5.8 |
||||
|
ALT |
12.1 |
2.3 |
||||
|
Albúmina |
100 |
97.1 |
||||
|
Magnesio |
21.2 |
1.5 |
||||
|
Vértigo |
7.7 |
|||||
|
Neuropatía |
1.5 |
5.8 |
1.4 |
|||
|
Hipotensión |
16.6 |
11.6 |
||||
En relación a la eficacia, en el grupo de QT-Placebo se han observado 1 respuesta parcial (9%), 4 (36.6%) enfermedad estable y 6 (54.5%) progresiones; mientras que en el grupo de QT- TRANSKRIP , las cifras son 4 (33.3%), 4 (33.3%) y 4 (33.3%), respectivamente. El beneficio clínico (RP + EE) es de 45% y 66.6% respectivamente (p < 0.1527).
Esta diferencia aunque todavía no es significativa muestra una tendencia fuerte a favor del grupo de QT-TRANSKRIP..
En estrecha relación con la tendencia a las mejores respuestas del tratamiento con QT-TRANSKRIP el “endpoint” u objetivo principal del estudio es la evaluación de la supervivencia libre de progresión. Los resultados de este análisis preliminar muestran una diferencia ya estadísticamente significativa hacia una mejoría en este parámetro como muestran los siguientes datos y figura:
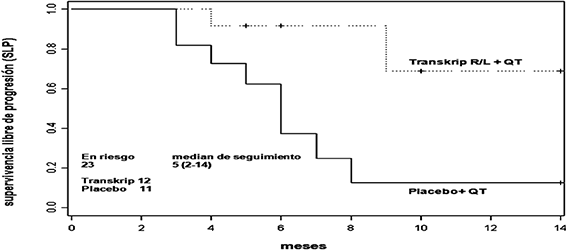
A una mediana de seguimiento de 5 meses (2-14), la probabilidad de supervivencia libre de progresión a 1 año es del 68% y 12% y la mediana de supervivencia libre de progresión no se ha alcanzado y es de 6 meses para el grupo de QT- TRANSKRIP y QT-Placebo respectivamente. Esta diferencia es estadísticamente significativa (RR = 0.164, SE = 0.132, p = 0.024).
Esos datos apoyan la indicación del TRANSKRIP asociado a quimioterapia como primera línea de tratamiento en pacientes con carcinoma cervicouterino metastásico, recurrente o persistente.
CONTRAINDICACIONES: TRANSKRIP está contraindicado en pacientes con hipersensibilidad conocida al valproato de magnesio, hidralazina o componentes de la fórmula.
TRANSKRIP está contraindicado durante el embarazo y lactancia, a menos que esta última sea suspendida.
TRANSKRIP al contener valproato de magnesio, está contraindicado en pacientes con disfunción hepática, puesto que éste incrementa la fracción de fármaco libre en sangre debido a la menor concentración de albúmina.
La hidralazina contenida en TRANSKRIP está contraindicada en pacientes con aneurisma aórtico, taquicardia grave e insuficiencia cardiaca con volumen-minuto cardiaco elevado (por ejemplo en la tirotoxicosis), enfermedad arterial coronaria, cardiopatías valvulares (estenosis aórtica o mitral).
TRANSKRIP no debe emplearse en presencia de Lupus Eritematoso Sistémico (LES) Idiopático y enfermedades relacionadas con el mismo.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: Está contraindicado el uso de TRANSKRIP durante el embarazo debido al riesgo potencial de teratogénesis ya que ha sido documentada la incidencia de espina bífida. En caso de requerir del tratamiento durante la lactancia materna, se recomienda suspender evitar la incidencia de efectos adversos.
REACCIONES SECUNDARIAS Y ADVERSAS:
Gastrointestinales: Náusea, vómito, diarrea, dolor abdominal, constipación, hiporexia, pérdida de peso.
Sistema nervioso central: Somnolencia, cefalea, temblor, mareo, discinesia, insomnio.
Cardiovasculares: Disnea, edema, ataque isquémico transitorio, trombosis venosa.
Hematológicas: Trombocitopenia, leucopenia, neutropenia, anemia.
Otras: Hipoalbuminemia, dolor pélvico, dermatitis, infección, mucositis, astenia, alteraciones hepáticas y renales.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: El valproato de magnesio y el clorhidrato de hidralazina pueden producir teratogénesis. El valproato de magnesio incrementa la aparición de defectos del tubo neural (riesgo de espina bífida 1 a 2%) en el feto en madres que reciben el fármaco durante el primer trimestre.
El clorhidrato de hidralazina ha mostrado en estudios preclínicos con animales, producir malformaciones de los huesos del cráneo y paladar hendido en el feto.
En estudios en animales con valproato de magnesio, se ha encontrado un aumento en la incidencia de fibrosarcomas subcutáneos y adenomas pulmonares benignos en roedores machos a los que se administró hasta tres veces la dosis humana durante dos años.
El clorhidrato de hidralazina aumentó la incidencia de adenomas y adenocarcinomas pulmonares en roedores machos a los que se administró hasta ochenta veces la dosis humana. No existen reportes que señalen algún efecto del valproato de magnesio sobre la fertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Hasta el momento no existe alguna interacción conocida entre el clorhidrato de hidralazina y el valproato de magnesio.
|
Valproato de magnesio |
|
|
Ácido acetilsalicílico |
Precaución al coadministrar en pacientes pediátricos, la unión a proteínas y el metabolismo del valproato de magnesio puede disminuir y aumentar su fracción libre. |
|
Amitriptilina |
El valproato de magnesio incrementa sus niveles séricos. |
|
Carbamazepina |
Cambio en la concentración de CBZ o disminución del valproato de magnesio. |
|
Clofibrato |
El valproato de magnesio puede ser desplazado por competencia de su unión a proteínas. |
|
Clonazepam |
El empleo concomitante puede aumentar los efectos sobre el SNC. |
|
Clorpromacina |
La vida media puede aumentar; el aclaramiento renal puede disminuir. |
|
Cimetidina |
La vida media pueden aumentar; el aclaramiento renal puede disminuir. |
|
Depresores del SNC |
El empleo concomitante puede aumentar los efectos sobre el SNC. |
|
Diazepam |
El valproato de magnesio inhibe el metabolismo y desplaza al diazepam de su unión a proteínas plasmáticas. |
|
Eritromicina |
Eritromicina puede incrementar las concentraciones plasmáticas de valproato de magnesio, produciendo toxicidad. |
|
Etosuximida |
El valproato de magnesio inhibe el metabolismo de etosuximida produciendo un descenso hasta del 53% de su nivel sérico. |
|
Fenobarbital |
El valproato de magnesio potencializa el efecto anticonvulsionante del fenobarbital, por lo cual debe reducirse la dosis. El fenobarbital aumenta el aclaramiento del valproato de magnesio, disminuyendo su acción terapéutica. |
|
Fenitoína |
El valproato de magnesio aumenta el efecto y las fracciones libres de fenitoína. Incrementa el metabolismo del valproato de magnesio y disminuye el efecto terapéutico.Pueden presentarse efectos tóxicos debidos a la fenitoína. |
|
Fluoxetina |
Incremento de los niveles séricos de fluoxetina. |
|
Lamotrigina |
Disminución de las concentraciones plasmáticas de Valproato de Magnesio. |
|
Rifampicina |
Incremento de la eliminación de valproato de magnesio. |
|
Warfarina |
Inhibición del metabolismo de warfarina con reducción de los niveles séricos. |
|
Clorhidrato de hidralazina |
|
|
Clorhidrato de piridoxina |
Antagonizar de acción. |
|
Diuréticos tiazidicos |
Retención de sodio con edema y aumento de peso. |
|
Diazóxido |
Hipotensión. |
Interacciones clorhidrato de Hidralazina y quimioterapia: Incrementa el área bajo la curva (AUC) y disminuye la eliminación de tauromustina (no disponible para uso clínico) en animales de experimentación. El efecto vasodilatador y acidificador intracelular del clorhidrato de hidralazina incrementa la citotoxicidad del clorambucil y melfalán.
Interacciones valproato de magnesio y quimioterapia: La interacción farmacológica a través de modificaciones metabólicas es bastante conocida entre los medicamentos antiepilépticos y los antineoplásicos. A diferencia de antiepilépticos como la fenitoína, fenobarbital y carbamazepina que son inductores enzimáticos y aumentan el metabolismo de ciertos fármacos antitumorales, el valproato de magnesio es un inhibidor de la actividad de algunas isoenzimas del sistema citocromo hepático P450, por lo que podría incrementar la toxicidad por su uso concomitante con la quimioterapia.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Puede presentarse neutropenia, hiperamonemia y alteraciones en la coagulación, principalmente trombocitopenia. Se han observado elevaciones de transaminasa glutámico oxalacética, glutámico pirúvica y anticuerpos antinucleares.
PRECAUCIONES GENERALES: El valproato de magnesio se une fuertemente a las proteínas, por lo que puede desplazar a otros fármacos que tienen la misma propiedad y deberá tomarse en cuenta en pacientes con alteraciones hepáticas, hematológicas y en pacientes diabéticos.
Se sugiere realizar pruebas de función hepática antes de iniciar el tratamiento y dos meses después de que éste se establezca. La incidencia de hepatotoxicidad usualmente se ha observado durante los primeros seis meses de tratamiento con dosis superiores a los 50 mg/kg/día y disminuye considerablemente con la edad. La hepatotoxicidad fatal o severa puede ser precedida por síntomas no específicos, como malestar, debilidad, letargo, edema facial, anorexia y vómito.
Se han reportado casos de pancreatitis en pacientes que han recibido valproato de magnesio. En algunos de los casos se han descrito hemorragias, con progresión rápida desde los síntomas iniciales hasta la muerte. Los pacientes y familiares deben ser advertidos acerca de la aparición de dolor abdominal, náusea, vómito y/o anorexia, así como síntomas de pancreatitis, lo cual requiere una pronta evaluación médica. En caso de un diagnóstico positivo, el valproato de magnesio debe ser descontinuado.
La hidralazina puede acentuar la hipotensión ortostática y la presencia de mareo o vértigo, por lo que debe ser empleada con precaución en pacientes que presenten depleción de volumen o que estén recibiendo otros agentes hipotensores. La hidralazina puede generar una respuesta presora paradójica. En pacientes con aumento en la presión intracraneal puede producir incremento de la isquemia cerebral. La hidralazina debe ser utilizada con precaución en pacientes con antecedentes de accidentes vasculares cerebrales.
La hidralazina generalmente se considera segura para emplearse en pacientes con disminución de la función renal; sin embargo, debe ser empleada con precaución en casos de insuficiencia renal severa.
Algunos pacientes particularmente los acetiladores lentos presentan un riesgo mayor que los pacientes acetiladores rápidos (siempre y cuando no se corrija la dosis de acuerdo al tipo de acetilador), de desarrollar un síndrome lupus-like (Lupus Eritematoso Sistémico) inducido por la hidralazina, debido a su capacidad desmetilante –hipometilación de células T4 lo que induce auto-reactividad. Debido a que la dosis de TRANSKRIP se ajusta al fenotipo acetilador, no se espera que ocurra este síndrome en los pacientes que reciban esta terapia epigenética.
Se recomienda efectuar determinaciones y conteos completos de los componentes hematológicos además de titulación de anticuerpos antinucleares antes de iniciar la terapéutica y en caso de presentarse artralgia, fiebre y dolor en el pecho durante el transcurso de la misma.
DOSIS Y VÍA DE ADMINISTRACIÓN: Oral.
TRANSKRIP asociado al tratamiento con quimioterapia de primera línea para el carcinoma cervicouterino metastásico, recurrente o persistente.
TRANSKRIP se debe iniciar desde una semana antes del primer día de la quimioterapia y en administración diaria continua hasta el fin de la misma. Si el paciente muestra respuesta parcial o enfermedad estable, se debe continuar TRANSKRIP hasta la evidencia de la progresión. Dado que la efectividad de TRANSKRIP después de la progresión a un esquema de quimioterapia no se ha estudiado, queda a juicio del oncólogo si continua TRANSKRIP asociado una segunda o tercera línea de quimioterapia.
Acetiladores Rápidos:
TRANSKRIP R: Administrar una tableta amarilla con 182 mg de Clorhidrato de Hidralazina cada 24 horas y el número necesario de tabletas blancas conteniendo cada una 700 mg de Valproato de magnesio repartidas en tres tomas (cada 8 horas) correspondiente a una dosis de 30 mg/Kg de peso corporal. La dosis de 30 mg/Kg de peso podrá modificarse hacia arriba o abajo con el objetivo de mantener niveles de valproato de magnesio en sangre entre 50 y 120 μg/mL.
Las tabletas deberán ingerirse simultáneamente.
Acetiladores Lentos:
TRANSKRIP L: Administrar una tableta amarilla con 83 mg de Clorhidrato de Hidralazina cada 24 horas y el número necesario de tabletas blancas conteniendo cada una 700 mg de Valproato de magnesio repartidas en tres tomas (cada 8 horas) correspondiente a una dosis de 30 mg/kg de peso corporal. La dosis de 30 mg/Kg de peso podrá modificarse hacia arriba o abajo con el objetivo de mantener niveles de valproato de magnesio en la sangre entre 50 y 120 μg/mL.
Usualmente se administra a 1 tableta de hidralazina y 3 de Valproato de Magnesio, repartidas en tres tomas.
Nota: Para la adecuada dosificación de TRANSKRIP , LABORATORIOS ALPHARMA S.A. DE C.V., contribuirá en la determinación del tipo de acetilación en los pacientes.
Las tabletas deberán ingerirse simultáneamente.
Modificación de dosis:
Las dosis del componente valproato de magnesio se reducirá de acuerdo a lo siguiente: Si el paciente presenta somnolencia grado 3 (definida por: obnubilación, estupor, dificultad para despertar que interfiere con las actividades de la vida diaria) y/o ataxia grado 3 (definida por incoordinación moderada que interfiera con las actividades de la vida diaria) se suspenderá el valproato por 3 días o hasta que la toxicidad sea al menos grado 2 y se reiniciará a 20 mg/kg. Si después de 7 días no se presenta somnolencia grado 3 se incrementará a 30 mg/Kg y se continuará a esta dosis hasta la finalización del tratamiento.
Las dosis de hidralazina se reducirán de acuerdo a lo siguiente: Si el paciente presenta hipotensión grado 3 (sostenida por un periodo mayor de 24 horas, la cual requiere terapia y atención médica continua pero se resuelve sin consecuencias fisiológicas persistentes) se suspenderá la hidralazina por 3 días o hasta que la toxicidad sea al menos grado 2 y se reiniciará al 50% de la dosis. Si después de 7 días no se presenta hipotensión grado 3 se incrementará al 75% de la dosis y se continuará a esta dosis hasta la finalización del tratamiento.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La DL50 del valproato de magnesio se ha calculado de 1000 a 2000 mg/kg. Esto sugiere que deberían tomarse demasiadas tabletas y aún así no se llegaría hasta la DL50. Cuando, por cualquier razón se excede la ingesta de valproato de magnesio, muy por arriba de la dosis prescrita, pueden presentarse molestias gastrointestinales y depresión del SNC manifestadas como temblor, debilidad, ataxia, pérdida del reflejo extensor y somnolencia. Pudiera presentarse degeneración de grasa hepática en aquellas personas con algún padecimiento preexistente.
Cuando se administra valproato de magnesio con algún otro fármaco, los signos tóxicos dependerán del grado de afinidad a las proteínas del otro medicamento. Así por ejemplo, en caso de sobredosis del valproato de magnesio (36 g) tomado con fenobarbital (1 g) y fenitoína (300 mg) se ha reportado coma.
La DL50 del clorhidrato de hidralazina se ha calculado en animales de experimentación (ratas) de 173 a 187 mg/kg. En humanos se ha reportado supervivencia hasta con 10 gramos vía oral. Los síntomas de una sobredosis incluyen hipotensión, taquicardia, rubor generalizado, arritmia, isquemia miocárdica y choque.
No existe antídoto específico para TRANSKRIP : Se emplearon las medidas de soporte cardiovascular como expansores de plasma, vasopresores con precaución, betabloqueadores y digitalización. La función renal deberá ser monitoreada. Se ha utilizado hemodiálisis y hemoperfusión. Mantener cuidadosamente una excreción urinaria adecuada. Naloxona ha revertido los efectos depresores sobre el SNC.
PRESENTACIONES: Caja con 7 tabletas de liberación prolongada (amarillas) de clorhidrato de hidralazina de 83 o 182 mg y 21 tabletas de liberación prolongada (blancas) de valproato de magnesio de 700 mg.
Caja con 14 tabletas de liberación prolongada (amarillas) de clorhidrato de hidralazina de 83 o 182 mg y 42 tabletas de liberación prolongada (blancas) de valproato de magnesio de 700 mg.
Caja con 28 tabletas de liberación prolongada (amarillas) de clorhidrato de hidralazina de 83 o 182 mg y 84 tabletas de liberación prolongada (blancas) de valproato de magnesio de 700 mg.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. No se use en el embarazo y/o lactancia. Si se administra junto con fenobarbital, deberá reducirse la dosis de este último. En pacientes diabéticos puede dar falsos positivos para las cetonas. Deberá usarse con precaución en pacientes que estén utilizando anticoagulantes. Debe administrarse con precaución en pacientes con enfermedad hepática preexistente.
Hecho en México por:
LABORATORIOS ALPHARMA, S.A. de C.V.
Boulevard Pípila No. 1, Esq. Av. del Conscripto,
Col. Manuel Ávila Camacho, C. P. 11610,
Deleg. Miguel Hidalgo, México, D.F.
Reg. Núm. 091M2009, SSA IV