
TRESIBA
INSULINA DEGLUDEC
Solución inyectable
1 Caja, 1 Pluma precargada, 3 ml, 200 U/ml
1 Caja, 3 Pluma precargada, 3 ml, 200 U/ml
1 Caja, 1 Pluma precargada, 3 ml, 100 U/ml
1 Caja, 5 Pluma precargada, 3 ml, 100 U/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada ml de SOLUCIÓN INYECTABLE contiene:
Insulina degludec*
equivalente a 100 U 3.66 mg o 200 U 7.32 mg
Vehículo cbp 1 ml
Una unidad (U) de insulina degludec corresponde a una unidad internacional (UI) de insulina humana y a una unidad de todos los demás análogos de insulina.
Una pluma precargada FlexTouch® 100 U/ml contiene 3 ml de solución equivalentes a 300 unidades de insulina degludec.
Una pluma precargada FlexTouch® 200 U/ml contiene 3 ml de solución equivalente a 600 unidades de insulina degludec.
Excipientes.
Glicerol.
Metacresol.
Fenol.
Acetato de zinc.
Ácido clorhídrico (para ajuste de pH).
Hidróxido de sodio (para ajuste de pH).
Agua para inyectables.
* Análogo de insulina TETM de origen ADN recombinante expresado en Saccharomyces cerevisiae.
INDICACIONES TERAPÉUTICAS: Tratamiento de diabetes mellitus tipos 1 y 2 en adultos, adolescentes y niños a partir de 1 año de edad.
TRESIBA® es un tipo de insulina basal de acción ultra-prolongada para administración subcutánea, para usarse una vez al día en cualquier momento del día.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
Absorción: La acción ultra-prolongada de la insulina degludec se deriva de su estructura molecular especialmente diseñada. Tras la inyección subcutánea, se forman multi-hexámeros solubles y estables, creando así un depósito de insulina en el tejido subcutáneo. Los monómeros de insulina degludec se separan gradualmente de los multi-hexámeros, dando como resultado un paso lento y continuo de insulina degludec a la circulación. La concentración en suero en estado estacionario se alcanza a los 2-3 días de la administración diaria de TRESIBA®.
A lo largo de un periodo de 24 horas con el tratamiento de una vez al día, la exposición de la insulina degludec se distribuyó uniformemente entre las primeras y las segundas 12 horas. La proporción entre ABCIDeg,0-12h,SS, y ABCIDeg,Total,SS fue del 0.5.
Distribución: La afinidad de la insulina degludec a la albúmina en suero corresponde a una unión con proteínas plasmáticas de > 99% en el plasma humano.
Biotransformación: La degradación de la insulina degludec es similar a la de la insulina humana; todos los metabolitos formados son inactivos.
Eliminación: La vida media después de la administración subcutánea de TRESIBA® está determinada por la velocidad de absorción desde el tejido subcutáneo. La vida media de TRESIBA® es aproximadamente de 25 horas, con independencia de la dosis.
Linealidad: La proporcionalidad de la dosis en la exposición total se observa tras la administración subcutánea dentro del rango de dosis terapéutico. En comparación directa, los requisitos de bioequivalencia se cumplen para TRESIBA® 100 Unidades/ml y TRESIBA® 200 Unidades/ml (basándose en ABCIDeg,T,SS, y Cmáx,IDeg,SS).
Género: No hay diferencia entre sexos en cuanto a las propiedades farmacocinéticas de TRESIBA®.
Adultos mayores, raza, insuficiencia renal y hepática:
No hay diferencias en la farmacocinética de la insulina degludec entre pacientes adultos mayores y adultos más jóvenes, entre razas o entre sujetos sanos y pacientes con insuficiencia renal o hepática.
Población pediátrica: Las propiedades farmacocinéticas de la insulina degludec en niños (1-11 años) y adolescentes (12-18 años) en estado estacionario fueron comparables con las de los adultos con diabetes mellitus tipo 1. La exposición total después de una sola dosis fue, sin embargo, más alta en niños y adolescentes que en adultos con diabetes mellitus tipo 1.
Propiedades farmacodinámicas:
Clase farmacológica: Fármacos utilizados en diabetes. Insulina y análogos de acción prolongada para inyección. Código ATC: A10AE06.
TRESIBA® es una insulina basal de acción ultra prolongada. Mecanismo de acción: La insulina degludec se une específicamente al receptor de insulina humana y produce los mismos efectos farmacológicos que ésta.
El efecto hipoglucemiante de la insulina degludec se debe a que facilita la absorción de la glucosa al unirse a los receptores de insulina en las células musculares y adiposas, y a que inhibe al mismo tiempo la producción hepática de glucosa.
Efectos farmacodinámicos: TRESIBA® es una insulina basal que forma multi-hexámeros solubles cuando se inyecta por vía subcutánea, dando lugar a la formación de un depósito desde el que se absorbe de forma continua y lenta a la circulación, produciendo el efecto hipoglucemiante ultra-prolongado, plano y estable de TRESIBA® (ver figura 1). A lo largo de un periodo de 24 horas con el tratamiento de una vez al día, el efecto hipoglucemiante de TRESIBA®, a diferencia del de la insulina glargina, se distribuyó uniformemente entre las primeras y las segundas 12 horas (ABCGIR,0-12h,SS/ABCGIR,total,SS = 0.5).
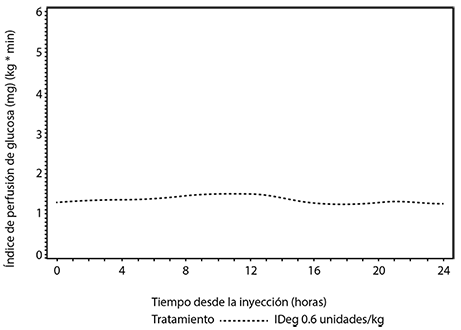
Figura 1. Perfil del índice de perfusión de glucosa (GIR), estado estacionario suavizado-Perfil medio 0-24 horas-IDeg 100 unidades/ml 0.6 unidades/kg-Estudio 1987.
La duración de la acción de TRESIBA® es superior a 42 horas dentro del rango de dosis terapéutico.
Este efecto se estabiliza de 2 a 3 días después de la administración de la dosis.
La acción hipoglucemiante de la insulina degludec en estado estacionario muestra una variabilidad día a día cuatro veces más baja en términos de Coeficiente de Variación (CV) del efecto hipoglucemiante durante 0-24 horas (ABCGIR,T,ss) y 2-24 horas ( ABCG1R2-24h, SS) que la insulina glargina, véase Tabla 1.
Tabla 1. Variabilidad día-a-día intra-pacientes en el efecto hipoglucemiante de TRESIBA® e insulina glargina (100 unidades/ml) en estado estacionario en pacientes con Diabetes Mellitus tipo 1
|
Insulina degludec (N26) (CV%) |
Insulina glargina (100 unidades/ml) (N27) (CV%) |
|
|
Variabilidad día-a-día en el efecto hipoglucemiante durante un intervalo de dosificación (ABCGIR,T,SS) |
20 |
82 |
|
Variabilidad día-a-día en el efecto hipoglucemiante de 2-24 horas (AUCGIR2-24h,SS) |
22 |
92 |
CV: Coeficiente de variación intra-paciente en %.
SS: Estado estacionario.
ABCGIR,2-24h: Efecto metabólico en las últimas 22 horas del intervalo de dosificación (es decir no influido por insulina I.V. durante el periodo de preinclusión con clamp).
El efecto hipoglucemiante total de TRESIBA® aumenta de manera lineal al aumento de la dosis.
El efecto hipoglucemiante total es comparable para TRESIBA® 100 unidades/ml y 200 unidades/ml tras la administración de la misma dosis en los dos productos.
No hay diferencia clínicamente significativa en la farmacodinamia de TRESIBA® entre pacientes adultos mayores y adultos más jóvenes.
Eficacia clínica y datos de seguridad: Se realizaron 11 estudios clínicos multi-nacionales de 26 o 52 semanas de duración como estudios de tratamiento a meta, aleatorizados, controlados, paralelos y abiertos, en los que se administró TRESIBA® a 4275 pacientes (1102 con diabetes mellitus tipo 1 y 3173 con diabetes mellitus tipo 2).
Además, se realizaron dos estudios clínicos de tratamiento a meta de 64 semanas de duración, controlados, doble ciego, aleatorizados cruzados, en pacientes con diabetes mellitus tipo 1 (501 pacientes) y diabetes mellitus tipo 2 (721 pacientes), respectivamente.
Los estudios doble ciego, cruzados (Tabla 2 y 3) se realizaron en pacientes con al menos un factor de riesgo para la hipoglucemia. Los pacientes se aleatorizaron a una de las dos secuencias de tratamiento: TRESIBA®/insulina glargina (100 unidades/ml) o insulina glargina (100 unidades/ml)/TRESIBA® una vez al día; los pacientes también se aleatorizaron a una dosis matutina o vespertina. En ambos estudios, se confirmó que la reducción en HbA1c desde el inicio hasta el final del estudio no fue inferior en comparación con la insulina glargina (100 unidades/ml). En los pacientes con diabetes mellitus tipo 1, TRESIBA® redujo significativamente las tasas de eventos hipoglucémicos graves y de eventos sintomáticos graves o confirmados por glucosa sanguínea (general y nocturnos), tanto en el mantenimiento como en el periodo completo de tratamiento en comparación con la insulina glargina (100 unidades/ml). En los pacientes con diabetes mellitus tipo 2, TRESIBA® redujo significativamente las tasas de eventos hipoglucémicos graves o sintomáticos confirmados por glucosa sanguínea (general y nocturnos), tanto en el mantenimiento como en el periodo completo de tratamiento, y redujo la tasa de eventos hipoglucémicos graves en el periodo completo de tratamiento en comparación con la insulina glargina (100 unidades/ml).
Tabla 2. Resultados del estudio clínico doble ciego, cruzado en pacientes con diabetes mellitus tipo 1
|
TRESIBA®1 |
Insulina glargina (100 unidades/ml)1 |
|||
|
N |
501 |
|||
|
HbA1c (%) |
||||
|
Valor incial |
7,6 |
|||
|
Final del tratamiento |
6,9 |
6,9 |
||
|
GPA (mg/dl) |
||||
|
Valor inicial |
169.2 |
|||
|
Final del tratamiento |
135.0 |
151.2 |
||
|
Periodo de mantenimiento² |
Periodo completo de tratamiento |
|||
|
TRESIBA®1 |
Insulina glargina (100 unid./ml)1 |
TRESIBA®1 |
Insulina glargina (100 unid./ml)1 |
|
|
Tasa de hipoglucemia (por paciente año de exposición) |
||||
|
Hipoglucemia grave |
0,69 |
0,92 |
0.87 |
1.05 |
|
Índice: 0,65 [0,48; 0,89] |
Índice: 0,74 [0,61; 0,90] |
|||
|
Hipoglucemia3 grave o sintomática confirmada por la BG |
22,01 |
24,63 |
20,45 |
21,68 |
|
Índice: 0,89 [0,85; 0,94] |
Índice: 0,94 [0,91; 0,98] |
|||
|
Hipoglucemia3 grave o nocturna sintomática confirmada por la BG |
2,77 |
4,29 |
2,81 |
3,72 |
|
Índice: 0,64 [0,56; 0,73] |
Índice: 0,75 [ 0,68; 0,83] |
|||
1 En un régimen una vez al día + insulina asparta para cubrir los requerimientos de insulina durante las comidas.
2 Episodios desde la semana 16 en cada periodo de tratamiento.
3 La hipoglucemia sintomática confirmada por glucosa sanguínea (BG) se definió como episodios confirmados por un valor de glucosa en plasma menor a 55.8 mg/dl, con síntomas compatibles con la hipoglucemia. La hipoglucemia nocturna confirmada se definió como episodios ocurridos entre la medianoche y las 6 a.m.
Tabla 3. Resultados del estudio clínico doble ciego, cruzado en usuarios que antes se administraban insulina basal con diabetes mellitus tipo 2
|
TRESIBA®1 |
Insulina glargina (100 unidades/ml)1 |
|||
|
N |
721 |
|||
|
HbA1c (%) |
||||
|
Valor incial |
7,6 |
|||
|
Fin del tratamiento |
7.1 |
7.0 |
||
|
GPA (mg/dl) |
||||
|
Valor inicial |
136.8 |
|||
|
Fin del tratamiento |
108.0 |
109.8 |
||
|
Periodo de mantenimiento² |
Periodo completo de tratamiento |
|||
|
TRESIBA®1 |
Insulina glargina (100 unidades/ml)1 |
TRESIBA®1 |
Insulina glargina (100 unidades/ml)1 |
|
|
Tasa de hipoglucemia (por paciente año de exposición) |
||||
|
Hipoglucemia grave |
0.05 |
0.09 |
0.04 |
0.09 |
|
0.54 [0.21; 1.42] |
Índice: 0.49 [0.26; 0.94] |
|||
|
Hipoglucemia3 grave o sintomática confirmada por la BG |
1.86 |
2.65 |
2.20 |
2.75 |
|
Índice: 0.70 [0.61; 0.80] |
Índice: 0.77 [0.70; 0.85] |
|||
|
Hipoglucemia3 grave o nocturna sintomática confirmada por la BG |
0.55 |
0.94 |
0.72 |
0.88 |
|
Índice: 0.58 [0.46; 0.74] |
Índice: 0.75 [0.64; 0.89] |
|||
1 En un régimen una vez al día ± OAD (cualquier combinación de metformina, inhibidor de la dipeptidil peptidasa tipo 4, inhibidor de la alfa glucosidasa, tiazolidi nedionas e inhibidor del cotransportadorr sodio-glucosa tipo 2).
2 Episodios desde la semana 16 en cada periodo de tratamiento.
3 La hipoglucemia sintomática confirmada por glucosa sanguínea (BG) se definió como episodios confirmados por un valor una glucosa en plasma inferior a 55.8 mg/dl, con síntomas compatibles con hipoglucemia. La hipoglucemia nocturna confirmada se definió como episodios ocurridos entre la medianoche y las 6 a.m.
En los estudios abiertos, el efecto de TRESIBA® se comprobó en pacientes con diabetes mellitus tipo 1 (Tabla 5), en pacientes sin tratamiento previo de insulina (inicio de insulina en diabetes mellitus tipo 2, Tabla 6), y en pacientes que recibieron insulina previamente (intensificación de insulina en diabetes mellitus tipo 2), con un horario de administración tanto fijo como flexible. Se confirmó la no inferioridad de la reducción de HbA1c, desde el valor inicial hasta el final del estudio, en todos los estudios con respecto a todos los comparadores (insulina detemir e insulina glargina). Mientras que las mejoras en HbA1c no fueron inferiores en comparación con otros productos de insulina, respecto a sitagliptina, TRESIBA® fue significativamente superior desde el punto de vista estadístico en la reducción de HbA1c.
En diabetes mellitus tipo 2, un estudio clínico abierto y de tratamiento a meta para el inicio con insulina, mostró un índice 36% menor de hipoglucemia nocturna confirmada con TRESIBA® una vez al día en comparación con insulina glargina (100 U/ml) ambos en combinación con medicamentos antidiabéticos orales (OADs) (Figura 2). En un estudio clínico de tratamiento a meta para evaluar el régimen de basal bolo en pacientes con diabetes mellitus tipo 2, TRESIBA® mostró un riesgo reducido de hipoglucemia en general, así como de hipoglucemia nocturna en comparación con insulina glargina (100 U/ml) (Figura 3). La Hipoglucemia confirmada se definió como episodios confirmados a través de glucosa en plasma < 55.8 mg/dl o cuando el paciente necesitó la asistencia de un tercero. La Hipoglucemia nocturna confirmada se definió como episodios entre la media noche y las 6 a.m.
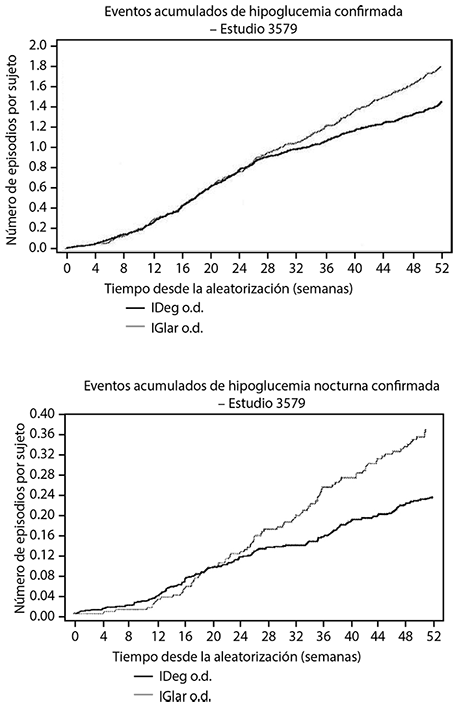
Figura 2. Episodios de hipoglucemia confirmados (arriba) y episodios de hipoglucemia nocturnos confirmados; Emergentes por el tratamiento-Función Media Acumulativa. Diabetes mellitus tipo 2 en un Estudio de ADO basal de 52 semanas.
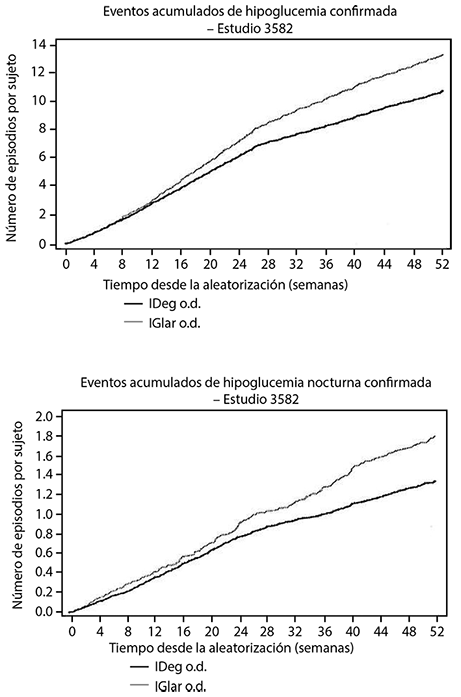
Figura 3. Episodios de hipoglucemia confirmados (arriba) y episodios de hipoglucemia nocturnos confirmados: -Emergentes por el tratamiento-Función media acumulativa-Diabetes mellitus tipo 2 en un estudio de 52 semanas de combinado basal bolo y ADO.
En un meta-análisis planeado de forma prospectiva en siete estudios abiertos confirmatorios, de tratamiento a meta en pacientes con diabetes mellitus tipo 1 y diabetes mellitus tipo 2, TRESIBA® fue superior en cuanto a un número más bajo de episodios de hipoglucemia confirmados surgidos durante el tratamiento (determinado por un beneficio en diabetes mellitus tipo 2, véase Tabla 4) y episodios de hipoglucemia nocturna confirmada en comparación con insulina glargina (100 unidades/ml) (administrada según la etiqueta). La reducción de hipoglucemia se alcanzó con un nivel promedio de GPA inferior con TRESIBA® en comparación con insulina glargina (100 unidades/ml).
Tabla 4. Resultados del meta-análisis de hipoglucemia
|
Hipoglucemia confirmadaª |
||
|
Índice de riesgo estimado (Insulina degludec/Insulina glargina) (100 unidades/ml) |
Total |
Nocturna |
|
Diabetes mellitus Tipo 1 + Tipo 2 (combinada) |
0.91* |
0.74* |
|
Periodo de mantenimientob |
0.84* |
0.68* |
|
Pacientes geriátricos ≥ 65 años |
0.82 |
0.65* |
|
Diabetes mellitus tipo 1 |
1.10 |
0.83 |
|
Periodo de mantenimientob |
1.02 |
0.75* |
|
Diabetes mellitus tipo 2 |
0.83* |
0.68* |
|
Periodo de mantenimientob |
0.75* |
0.62* |
|
Únicamente terapia basal sin tratamiento previo de insulina |
0.83* |
0.64* |
* Estadísticamente significativo.
a Se define hipoglucemia confirmada como episodios confirmados por glucosa en plasma < 55.8 mg/dl o cuando el paciente requiera asistencia de terceras personas. Hipoglucemia nocturna confirmada se definió como episodios ocurridos entre la medianoche y las 6 a.m.
b Episodios desde la semana 16.
No hay un desarrollo clínicamente relevante de anticuerpos anti-insulina después del tratamiento prolongado con TRESIBA®.
En un estudio clínico de 104 semanas, el 57% de los pacientes con diabetes tipo 2 tratados con TRESIBA® (insulina degludec) en combinación con metformina alcanzaron el objetivo de HbA1c < 7.0%. El resto de pacientes continuaron en un estudio abierto de 26 semanas y fueron aleatorizados para agregar a su tratamiento o liraglutida o una dosis única de insulina asparta (con la comida principal). En el grupo de insulina degludec + liraglutida, la dosis de insulina se redujo un 20% para minimizar el riesgo de hipoglucemia. La adición de liraglutida resultó en una mayor reducción, de forma estadísticamente significativa, de la HbA1c (-0.73% para liraglutida frente a -0.40% para el comparador, en términos estimados) y del peso corporal (-3.03 frente a 0.72 kg, en términos estimados). La tasa de episodios de hipoglucemia (por paciente/año de exposición) fue menor, de forma estadísticamente significativa, cuando se añadió liraglutida en comparación con la adición de una dosis única de insulina asparta (1.0 frente a 8.15; razón: 0.13; IC 95%: 0.08 a 0.21).
Evaluación cardiovascular: DEVOTE fue un estudio clínico aleatorizado, doble ciego, de duración determinada por eventos, con una duración media de 2 años que comparó la seguridad cardiovascular de TRESIBA® versus insulina glargina (100 unidades/ml) en 7,637 pacientes con diabetes mellitus tipo 2 con alto riesgo de eventos cardiovasculares.
El análisis primario fue el tiempo desde la aleatorización hasta la aparición del primer evento adverso cardiovascular mayor (MACE, por sus siglas en inglés) de 3 componentes definidos como: muerte cardiovascular, infarto de miocardio no fatal o accidente cerebrovascular no fatal.
El estudio fue diseñado como un estudio de no inferioridad para excluir un margen de riesgo preespecificado de 1.3 para el cociente de riesgo de MACE comparando TRESIBA® con la insulina glargina. Se confirmó la seguridad cardiovascular de TRESIBA® en comparación con la insulina glargina (Figura 4). Además, el análisis de MACE compuesto de 3 puntos en los subgrupos se alinearon con el análisis primario (Tabla 5).

N: Número de sujetos con un primer evento confirmado por el EAC (por sus siglas en inglés) durante el estudio.
%: Porcentaje de sujetos con un primer evento confirmado por el EAC en relación con el número de sujetos aleatorizados.
EAC: Comité de Adjudicación de Eventos.
CV: Cardiovascular(es).
IM: infarto de miocardio.
IC: Intervalo de confianza del 95%.
Figura 4. Diagrama de bosque del análisis del MACE compuesto de 3 puntos y los criterios de valoración individuales cardiovasculares en DEVOTE .
Tabla 5. Análisis del MACE compuesto de 3 puntos en los subgrupos en DEVOTE
|
TRESIBA®1 |
Insulina glargina (100 unidades/ml)1 |
||
|
N (%) |
N (%) |
Cociente de riesgo, (IC del 95%) |
|
|
Sexo |
|||
|
Masculino |
226 (9.4) |
225 (9.5) |
0.99, [0.83; 1.20] |
|
Femenino |
99 (7.0) |
131 (9.1) |
0.76, [0.59; 0.99] |
|
Edad |
|||
|
≥ 65 años |
185 (9.3) |
189 (9.6) |
0.97, [0.79; 1.19] |
|
< 65 años |
140 (7.6) |
167 (9.0) |
0.84, [0.67; 1.05] |
|
Duración de diabetes |
|||
|
< 15 años |
176 (8.8) |
190 (10.0) |
0.87, [0.71; 1.07] |
|
≤ 15 años |
149 (8.2) |
166 (8.6) |
0.95, [0.76; 1.18] |
|
Grupo de riesgo CV |
|||
|
Enfermedad CV establecida |
293 (8.97) |
325 (10.02) |
0.89, [0.76; 1.04] |
|
Factores de riesgo para enfermedad CV |
29 (5.39) |
30 (5.29) |
1.03, [0.62; 1.72] |
|
HbA1c al inicio del estudio |
|||
|
< 8.0% |
121 (7.18) |
141 (8.08) |
0.89, [0.70; 1.13] |
|
≥ 8.0% |
200 (9.58) |
212 (10.44) |
0.91, [0,75; 1,11] |
|
Régimen previo de insulina |
|||
|
Basal bolo |
172 (9.77) |
210 (11.97) |
0.80, [0.66; 0.98] |
|
Sólo basal |
111 (7.63) |
101 (7.01) |
1.10, [0.84; 1.43] |
|
Nunca antes tratado con insulina |
42 (6.95) |
45 (7.21) |
0.96, [0.63; 1.46] |
1 Adicional al tratamiento convencional para la diabetes y enfermedad cardiovascular.
Se lograron mejoras similares en la HbA1c con TRESIBA® e insulina glargina, con una mayor reducción en la GPA con TRESIBA® (Tabla 6).
TRESIBA® fue superior en comparación con insulina glargina en términos de una menor tasa de eventos hipoglucémicos graves y una menor proporción de sujetos con hipoglucemia grave. La tasa de hipoglucemia nocturna grave fue significativamente menor para TRESIBA® en comparación con insulina glargina (Tabla 6).
Tabla 6. Resultados de DEVOTE
|
TRESIBA®1 |
Insulina glargina (100 unidades/ml)1 |
|
|
N |
3,818 |
3,819 |
|
Media HbA1c (%) |
||
|
Valor inicial |
8.44 |
8.41 |
|
2 años de tratamiento |
7.50 |
7.47 |
|
Diferencia: 0.008 [-0.05; 0.07] |
||
|
GPA (mg/dl) |
||
|
Valor inicial |
169.7 |
173.3 |
|
2 años de tratamiento |
128.2 |
135.7 |
|
Diferencia: -7.2 [-10.3; -4.1] |
||
|
Tasa de hipoglucemia (por 100 pacientes años de observación) |
||
|
Grave |
3.70 |
6.25 |
|
Tasa: 0.60 [0.48; 0.76] |
||
|
Grave nocturna2 |
0.65 |
1.40 |
|
Tasa: 0.47 [0.31; 0.73] |
||
|
Proporción de pacientes con hipoglulcemia (porcentaje de pacientes) |
||
|
Grave |
4.9 |
6.6 |
|
Tasa estimada: 0.73 [0.60; 0.89] |
||
1 Adicional al tratamiento convencional para la diabetes y enfermedad cardiovascuar.
2 La hipoglucemia grave nocturna se definió como episodios entre la medianoche y las 6 a.m.
Población pediátrica: Se ha estudiado la eficacia y seguridad de TRESIBA® en niños y adolescentes con diabetes mellitus tipo 1 en un estudio clínico 1:1 aleatorizado y controlado de 26 semanas (n = 350), seguido de un periodo de extensión de 26 semanas (n = 280). Los pacientes en el grupo de TRESIBA® incluyeron 43 niños entre 1-5 años, 70 niños de 6-11 años y 61 adolescentes de 12-17 años. TRESIBA® administrado una vez al día mostró una reducción similar de HbA1c en la semana 52 y una mayor reducción de GPA desde el nivel basal frente al comparador, insulina detemir, administrado una o dos veces al día. Esto se logró con una dosis diaria de TRESIBA® un 30% menor en comparación con insulina detemir. Las tasas (eventos por paciente-año de exposición) de hipoglucemia grave (definición ISPAD; 0.51 frente a 0.33), hipoglucemia confirmada (57.71 frente a 54.05) e hipoglucemia nocturna confirmada (6.03 frente a 7.60) fueron comparables con TRESIBA® e insulina detemir. En ambos grupos de tratamiento, los niños de 6-11 años tuvieron una tasa de hipoglucemia confirmada numéricamente mayor que en los otros grupos de edad. En el grupo de TRESIBA®, se observó una tasa de hipoglucemia grave numéricamente mayor en niños de 6-11 años. Tasa de episodios de hiperglucemia con cetosis fue significativamente menor para TRESIBA® en comparación con insulina detemir, 0.68 y 1.09, respectivamente. La frecuencia, tipo y gravedad de reacciones adversas en la población pediátrica no indican diferencias con la experiencia en la población general con diabetes. El desarrollo de anticuerpos fue escaso y no tuvo impacto clínico. Los datos de eficacia y seguridad para pacientes adolescentes con diabetes mellitus tipo 2 se han extrapolado de los datos de pacientes adolescentes y adultos con diabetes mellitus tipo 1 y pacientes adultos con diabetes mellitus tipo 2. Los resultados apoyan el uso de TRESIBA® en pacientes adolescentes con diabetes mellitus tipo 2.
CONTRAINDICACIONES: Hipersensibilidad a la sustancia activa o a cualquiera de los excipientes enlistados en la sección Forma farmacéutica y formulación.
Embarazo, lactancia, menores de 1 año.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No se use durante el embarazo ni la lactancia.
Embarazo: No hay experiencia clínica respecto al uso de TRESIBA® en mujeres embarazadas.
Estudios de reproducción animal no han revelado ninguna diferencia entre la insulina degludec e insulina humana con respecto a la embriotoxicidad y la teratogenicidad.
En general, se recomienda la intensificación del control de glucosa en la sangre y supervisión cuidadosa de las mujeres embarazadas con diabetes a lo largo del embarazo o cuando se está planeando un embarazo. Los requisitos de insulina usualmente disminuyen en el primer trimestre y aumentan de manera subsecuente durante el segundo y tercer trimestre. Después del parto, las necesidades de insulina normalmente regresan rápidamente a los valores previos al embarazo.
Lactancia: No hay experiencia clínica con el uso de TRESIBA® durante la lactancia. En ratas, se detectó insulina degludec en la leche secretada, la concentración en la leche fue menor que en el plasma.
Se desconoce si la insulina degludec es secretada en la leche humana. No se prevén efectos metabólicos en los recién nacidos/bebés alimentados con leche materna.
Fertilidad: Estudios de reproducción animal con insulina degludec no han revelado ningún efecto adverso en la fertilidad.
REACCIONES SECUNDARIAS Y ADVERSAS: Las reacciones adversas listadas en esta sección son consideradas esperadas con el medicamento.
Resumen del perfil de seguridad: La reacción adversa reportada con mayor frecuencia durante el tratamiento es la hipoglucemia (vease la sección "Descripción de reacciones adversas seleccionadas" a continuación) Lista de reacciones adversas a partir de estudios clínicos: Las reacciones adversas enlistadas a continuación se basan en datos de los estudios clínicos y se clasifican de acuerdo con la Clasificación por Órganos y Sistemas de MedDRA.
|
Clasificación por Órganos y Sistemas |
Término preferido |
Frecuencia |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
0.05% |
|
Urticaria |
0.05 |
|
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia |
93.0%-99.4% en sujetos con diabetes tipo 1 17.3%-81.9% en sujetos con diabetes tipo 2 |
|
Trastornos de la piel y tejido subcutáneo |
Lipodistrofia |
0.2% |
|
Trastornos generales y condiciones en el sitio de administración |
Reacciones en el sitio de inyección |
2.4% |
|
Edema periférico |
0.4% |
Descripción de reacciones adversas seleccionadas:
Trastornos del sistema inmunológico: Es posible que ocurran reacciones alérgicas con preparaciones de insulina. Las reacciones alérgicas de tipo inmediato a la insulina en sí o a los excipientes puede potencialmente poner en riesgo la vida.
Se reportaron con frecuencia rara, la hipersensibilidad a TRESIBA® (manifestada con inflamación de la lengua y labios, diarrea, náuseas, cansancio y prurito) y urticaria.
Hipoglucemia: Puede ocurrir hipoglucemia si la dosis de insulina es demasiado alta en relación con la necesidad de la insulina. La hipoglucemia grave puede causar pérdida del conocimiento y/o convulsiones y puede resultar en daño temporal o permanente de la función cerebral o incluso la muerte. Los síntomas de hipoglucemia ocurren por lo general de manera repentina y pueden ser: sudor frío, piel fría y pálida, fatiga, nerviosismo o temblores, ansiedad, cansancio inusual o debilidad, confusión, dificultades para concentrarse, somnolencia, hambre excesiva, cambios en la visión, dolor de cabeza, náuseas y palpitaciones.
Lipodistrofia: La lipodistrofia (incluye la lipohipertrofia y lipoatrofia) puede ocurrir en el sitio de inyección. La rotación continua de los sitios de inyección dentro del área de inyección particular puede ayudar a reducir el riesgo de desarrollar estas reacciones.
Reacciones en el sitio de inyección: Reacciones en el sitio de inyección (incluyendo hematoma en el sitio de inyección, dolor, hemorragia, eritema, nódulos, inflamación, decoloración, prurito, calor y masas en el sitio de inyección) ocurrieron en pacientes tratados con TRESIBA®. Por lo general, estas reacciones son leves y temporales y normalmente desaparecen durante el tratamiento continuo.
Población pediátrica: TRESIBA® se ha administrado en niños y adolescentes de hasta 18 años de edad para investigar las propiedades farmacocinéticas (Consulte la sección Propiedades Farmacocinéticas). La seguridad y eficacia se han demostrado en un estudio a largo plazo en niños desde 1 año a menores de 18 años. La frecuencia, tipo y gravedad de reacciones adversas en la población pediátrica no señalan diferencias con la experiencia en la población con diabetes en general (véase sección Farmacocinética y Farmacodinamia-Eficacia clínica y datos de seguridad).
Otras poblaciones especiales: Con base en los resultados de estudios clínicos, la frecuencia, tipo y gravedad de las reacciones adversas observadas en pacientes adultos mayores y en pacientes con insuficiencia renal o hepática no indican alguna diferencia con la experiencia más amplia en la población general.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos no clínicos no revelaron inquietudes de seguridad para los humanos con base en estudios de seguridad farmacológica, toxicidad de dosis repetida, potencial carcinogénico y toxicidad a la reproducción.
La relación entre la potencia mitogénica y la potencia metabólica de la insulina degludec es comparable con la insulina humana.
En estudios de 52 semanas, se dosificó a ratas Sprague-Dawley por vía subcutánea con insulina degludec a 3.3, 6.7 y 10 U/kg/día (aproximadamente 5 veces la dosis humana a 0.75 U/kg/día, con base en el ABC en plasma) e insulina humana (insulina NPH) a 6.7 U/kg/día. No se registró aumento en la incidencia de hiperplasia o de tumores benignos o malignos en hembras dosificadas con insulina degludec cuando se comparó con las hembras de control.
Además, no se observaron cambios en la proliferación del epitelio de las glándulas mamarias cuando se comparó la insulina degludec (hasta 10 U/kg/día) con el control del vehículo.
En un estudio combinado de fertilidad y embrio-fetal aplicado en ratas macho y hembra, el tratamiento con insulina degludec de hasta 21 U/kg/día antes del apareamiento y en ratas hembra durante la gestación no tuvo efecto en el rendimiento del apareamiento y fertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Gran cantidad de productos medicinales son conocidos por interactuar con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir la necesidad de insulina: Productos medicinales antidiabéticos orales, agonistas del receptor de GLP-1, inhibidores de monoamina oxidasa (MAOI), beta bloqueadores, inhibidores de la enzima convertidora de la angiotensina (ACE), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden incrementar los requerimientos de insulina: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormona de crecimiento y danazol.
Los beta bloqueadores pueden enmascarar los síntomas de hipoglucemia. Octreotida/Lanreotida pueden incrementar o disminuir los requerimientos de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucémico de la insulina.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han observado.
PRECAUCIONES GENERALES:
Hipoglucemia: La omisión de alguna comida o el ejercicio físico extenuante no planeado pueden causar hipoglucemia.
Puede ocurrir hipoglucemia si la dosis de insulina es demasiado alta en relación con los requisitos de insulina (consulte las secciones Reacciones secundarias y adversas, Interacciones medicamentosas y de otro género y Manifestaciones y manejo de la sobredosificación o ingesta accidental).
En niños debe tenerse cuidado de adecuar las dosis de insulina (especialmente en regímenes basal bolo) con la ingestión de alimentos y actividades físicas para minimizar el riesgo de hipoglucemia.
Los pacientes cuyo control de glucosa en sangre mejore significativamente (por ejemplo, por medio de tratamiento intensificado con insulina) pueden experimentar un cambio en sus síntomas usuales de alerta para hipoglucemia y, por lo tanto, deben recibir las recomendaciones pertinentes. Los síntomas usuales de advertencia de hipoglucemia pueden desaparecer en pacientes que padecen diabetes de larga duración.
Las enfermedades concomitantes, en especial las infecciones y fiebre, usualmente aumentan la necesidad de insulina del paciente. Las enfermedades concomitantes del riñón, hígado o las enfermedades que afectan las glándulas suprarrenales, pituitaria o tiroides pueden requerir cambios en la dosis de insulina.
Como sucede con otros productos con insulina basal, el efecto prolongado de TRESIBA® puede retardar la recuperación de una hipoglucemia.
Hiperglucemia: Se recomienda la administración de insulina de acción rápida en situaciones de hiperglucemia grave.
Una dosificación inadecuada y/o la suspensión del tratamiento en pacientes que requieren insulina pueden causar hiperglucemia y potencialmente cetoacidosis diabética. Asimismo, las enfermedades concomitantes, en especial las infecciones, pueden causar hiperglucemia y por tanto generar un incremento en la necesidad de insulina.
Por lo general, los primeros síntomas de hiperglucemia se desarrollan gradualmente después de un periodo de horas o días. Los síntomas incluyen: sed, aumento en la frecuencia de la micción, náuseas, vómito, somnolencia, rubor y sequedad en la piel, sequedad de boca y pérdida del apetito, así como aliento con olor a acetona. En la diabetes mellitus tipo 1, los eventos de hiperglucemia sin tratar con el tiempo causan cetoacidosis diabética, que es potencialmente mortal.
Cambio de otros productos de insulina: El cambio en el paciente a otro tipo, marca o fabricante de insulina debe realizarse bajo supervisión médica y puede resultar en la necesidad de cambio en la dosis.
Combinación de tiazolidinedionas y productos medicinales de insulina: Se han reportado casos de insuficiencia cardiaca congestiva cuando se utilizaron tiazolidinedionas en combinación con insulina, en especial en pacientes con factores de riesgo para el desarrollo de insuficiencia cardiaca. Se deberá tener esto en cuenta si se considera el tratamiento con la combinación de tiazolidinedionas y TRESIBA®. Si se utiliza esta combinación, deberá monitorearse al paciente y buscar signos y síntomas de insuficiencia cardiaca, aumento de peso y edema. Deben discontinuarse las tiazolidinedionas si aparecen signos de deterioro en los síntomas cardiacos.
Trastorno ocular: La intensificación de la terapia con insulina con una mejora abrupta del control glucémico puede asociarse con el empeoramiento temporal de la retinopatía diabética, mientras que el control glucémico mejorado a largo plazo disminuye el riesgo de progresión de retinopatia diabética.
Prevención de errores de medicación: Se debe instruir a los pacientes para que revisen siempre la etiqueta de la insulina antes de cada inyección con el fin de evitar mezclas accidentales entre las dos diferentes concentraciones de TRESIBA®, así como otros productos de insulina. Los pacientes deben verificar visualmente las unidades indicadas en el contador de dosis de la pluma. Por lo tanto, el requisito para que los pacientes se autoinyecten es que puedan leer el contador de dosis en la pluma. Se debe instruir a los pacientes ciegos o a aquellos que tengan problemas de visión para que siempre obtengan ayuda/asistencia de otra persona con buena vista y que esté capacitada en el uso del dispositivo de insulina.
Anticuerpos anti-insulina: La administración de insulina puede provocar la formación de anticuerpos anti-insulina. En raras ocasiones, la presencia de dichos anticuerpos anti-insulina puede requerir un ajuste de la dosis de insulina para corregir una tendencia a hiper- o hipoglucemia.
Efectos en las capacidades para manejar y utilizar maquinaria: La capacidad del paciente para concentrarse y reaccionar puede verse afectada como resultado de la hipoglucemia. Esto puede constituir un riesgo en situaciones donde estas capacidades son de especial importancia (por ejemplo, al conducir un auto o al operar maquinaria).
Deberá indicarse a los pacientes que tomen sus precauciones para evitar la hipoglucemia en especial mientras manejan. Esto es de particular importancia para quienes tengan una percepción reducida o ausente de los signos de advertencia de hipoglucemia o tengan episodios frecuentes de hipoglucemia. Se debe considerar la conveniencia de conducir en estas circunstancias.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Inyección subcutánea.
Posología: TRESIBA® es una insulina basal de acción ultra prolongada para administración subcutánea una vez al día en cualquier momento del día, de preferencia a la misma hora diariamente.
La potencia de los análogos de insulina, como insulina degludec, se expresa en unidades (U). Una (1) unidad (U) de insulina degludec corresponde a una unidad internacional (UI) de insulina humana y a 1 unidad de todos los análogos de otras insulinas.
En pacientes adultos con diabetes mellitus tipo 2 se puede administrar TRESIBA® solo o en cualquier combinación con medicamentos antidiabéticos orales y bolo de insulina (Véase la sección "Propiedades farmacodinámicas"-Eficacia clínica y seguridad).
En pacientes con diabetes mellitus tipo 1, TRESIBA® debe combinarse con insulina de acción rápida/corta para cubrir las necesidades de insulina a la hora de los alimentos.
Deberá dosificarse TRESIBA® de acuerdo con las necesidades individuales de cada paciente. Se recomienda optimizar el control glucémico mediante el ajuste de la dosis con base en la glucosa en plasma en ayuno.
Como con todos los productos de insulina, podría requerirse un ajuste de dosis si el paciente realiza un aumento de actividad física, cambia su dieta regular o durante una enfermedad concomitante.
TRESIBA® 100 unidades/ml y TRESIBA® 200 unidades/ml solución inyectable en pluma precargada: TRESIBA® está disponible en dos concentraciones. En ambas, la dosis necesaria se selecciona en unidades. los incrementos de dosis, sin embargo, son distintos para cada concentración de TRESIBA®.
• Con TRESIBA® 100 unidades/ml se puede administrar una dosis de 1-80 unidades por inyección, en incrementos de 1 unidad.
• Con TRESIBA® 200 unidades/ml se puede administrar una dosis de 2-160 unidades por inyección, en incrementos de 2 unidades. La dosis se proporciona en la mitad del volumen de los productos de insulina basal de 100 unidades/ml.
El contador de dosis muestra el número de unidades sin importar la concentración y no se debe realizar una conversión de la dosis al transferir a un paciente a una nueva concentración.
Flexibilidad en la hora de la dosificación: En ocasiones, cuando no sea posible administrar a la misma hora del día, TRESIBA® ofrece flexibilidad respecto al horario de administración de la insulina (véase "Propiedades farmacodinámicas"). Siempre se debe asegurar que pasen un mínimo de 8 horas entre las inyecciones. No hay experiencia clínica con la flexibilidad en el horario de administración de TRESIBA® en niños y adolescentes.
Se recomienda a los pacientes que olviden una dosis, que se la administren al darse cuenta del olvido y a continuación reanudar su esquema común de dosificación una vez al día.
Inicio:
Pacientes con diabetes mellitus tipo 2: La dosis inicial diaria recomendada es de 10 unidades, seguida de ajustes individuales en la dosis.
Pacientes con diabetes mellitus tipo 1: TRESIBA® debe administrarse una vez al día en combinación con una insulina de acción rápida a la hora de la comida y requiere posteriores ajustes individuales en la dosis.
Transferencia o cambio desde otros medicamentos de insulina: Se recomienda un estricto control glucémico durante el cambio y en las siguientes semanas después del cambio. Puede ser necesario ajustar la dosis y el horario de administración de los productos de insulina de acción rápida o corta administradas de forma simultánea o del tratamiento concomitante con otros antidiabéticos.
Pacientes con diabetes mellitus tipo 2: En los pacientes con diabetes tipo 2 que reciben tratamiento una vez al día con insulina basal, basal-bolo, premezcla o mezclada por el paciente, el cambio de insulina basal a TRESIBA® puede hacerse unidad a unidad, basándose en la dosis de insulina basal previa y ajustando la dosis posteriormente de forma individual.
Se debe considerar una reducción de la dosis del 20%, en base a la dosis de insulina basal previa seguida de ajustes de dosis individuales en los siguientes casos:
• Se cambia a TRESIBA® desde insulina basal dos veces al día.
• Se cambia a TRESIBA® desde insulina glargina (300 unidades/ml).
Pacientes con diabetes mellitus tipo 1: Para la mayoría de los pacientes con diabetes tipo 1, se debe considerar una reducción de la dosis del 20% en base a la dosis de insulina basal previa o al componente basal de un régimen de infusión subcutánea continua de insulina, con posteriores ajustes de la dosis individual en función de la respuesta glucémica.
Poblaciones especiales:
Adultos mayores (≥ 65 años de edad): TRESIBA® puede utilizarse en pacientes adultos mayores. Se debe intensificar el monitoreo glucémico y ajustar la dosis de insulina de manera individual (consulte "Propiedades farmacocinéticas").
Insuficiencia renal y hepática: TRESIBA® puede utilizarse en pacientes con insuficiencia renal y hepática. Se debe intensificar el monitoreo glucémico y se debe ajustar la dosis de insulina de forma individual (consulte "Propiedades farmacocinéticas").
Población pediátrica: TRESIBA® puede usarse en adolescentes y niños a partir de 1 año de edad (véase Propiedades famacodinámicas). Al cambiar de insulina basal a TRESIBA®, se debe considerar una reducción de la dosis de insulina basal e insulina en bolo de manera individual con el fin de minimizar el riesgo de hipoglucemia (véase Reacciones secundarias y adversas).
Las propiedades farmacocinéticas de la insulina degludec en niños (1 a 11 años) y en adolescentes (12 a 18 años) en estado estacionario fueron comparables a las observadas en adultos con diabetes mellitus tipo 1. Sin embargo, la exposición total después de una sola dosis fue mayor en niños y adolescentes que en adultos con diabetes mellitus tipo 1.
Método de administración: TRESIBA® es únicamente para uso subcutáneo.
TRESIBA® no debe administrarse por vía intravenosa porque podría causar hipoglucemia grave.
TRESIBA® no debe administrarse por vía intramuscular porque podría cambiar la absorción.
TRESIBA® no debe utilizarse con bombas de infusión de insulina.
TRESIBA® se administra por vía subcutánea mediante una inyección en el muslo, la zona superior del brazo o la pared abdominal. Los puntos de inyección siempre se deben rotar dentro de la misma región con el fin de reducir el riesgo de lipodistrofia.
TRESIBA® es una pluma precargada FlexTouch® diseñada para utilizarse con agujas de inyección NovoFine®.
TRESIBA® FlexTouch® 100 Unidades/ml suministra de 1 a 80 Unidades en incrementos de 1 unidad.
TRESIBA® FlexTouch® 200 Unidades/ml suministra de 2 a 160 Unidades en incrementos de 2 unidades.
Adicional al uso de TRESIBA® hay otras acciones complementarias que deben considerarse de la Norma Oficial Mexicana NOM-015-SSA2-2010, "Para la prevención, tratamiento y control de la diabetes mellitus".
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Las reacciones adversas listadas en esta sección son consideradas esperadas con el medicamento.
No puede definirse una sobredosis específica de insulina. Sin embargo, la hipoglucemia se puede desarrollar en fases secuenciales si se dosifica más insulina de la necesaria a un paciente.
Los episodios hipoglucémicos leves pueden tratarse con la administración oral de glucosa u otros productos que contengan azúcar. Por lo tanto, se recomienda que el paciente siempre lleve consigo productos con contenido de glucosa.
Los episodios de hipoglucemia grave en donde el paciente es incapaz de tratarse por sí mismo pueden tratarse con glucagón (0.5 a 1 mg) administrado por vía intramuscular o subcutánea aplicado por una persona capacitada o con glucosa por vía intravenosa aplicada por un profesional de la salud. La glucosa debe administrarse por vía intravenosa si el paciente no responde al glucagón después de 10 o 15 minutos. Después de que recupere la consciencia, se recomienda la administración de carbohidratos orales al paciente para prevenir una recaída.
PRESENTACIONES:
Solución de 3 ml en un cartucho (vidrio tipo I) con un émbolo (halobutilo) y un Protector de goma laminada (halobutilo/poliisopreno) contenido en una pluma precargada multidosis desechable de polipropileno.
TRESIBA® 100 U/ml, solución inyectable en pluma precargada FlexTouch® multidosis.
Caja con 1 pluma precargada de 3 ml y 7 agujas NovoFine® (Reg. Núm. 625C94, SSA) de 32G x 6 mm Caja con 1 o 5 plumas precargadas de 3 ml.
TRESIBA® 200 U/ml, solución inyectable en pluma precargada FlexTouch® multidosis. Caja con 1 pluma precargada de 3 ml y 7 agujas NovoFine® (Reg. Núm. 625C94, SSA) de 32G x 6 mm.
Caja con 1 o 3 plumas precargadas de 3 ml.
No todas las presentaciones pueden estar comercializadas.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Antes del primer uso: Almacenar en el refrigerador (de 2°C a 8°C) lejos del elemento de congelación. No congelar.
Mantenga la tapa en la pluma para protegerla de la luz.
Después de abrir por primera vez o al llevarse como repuesto:
No almacenar a más de 30ºC. Puede almacenarse en el refrigerador (2ºC-8ºC). Conservar la tapa en la pluma para protegerla de la luz.
Después de abrir por primera vez, el producto se puede almacenar por un máximo de 8 semanas. No almacenar a más de 30ºC. Puede almacenarse en el refrigerador (2ºC-8ºC).
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No administre si la solución no es clara e incolora o si contiene partículas en suspensión o si el cierre está roto. Si TRESIBA® ha estado congelado no debe utilizarlo. No se use en embarazo, lactancia ni en menores de 1 año. TRESIBA®: La pluma precargada FlexTouch® está diseñada para utilizarse con agujas de inyección NovoFine® con una longitud de hasta 8 mm. FlexTouch® 100 U/ml suministra de 1 a 80 U en incrementos de 1 unidad. FlexTouch® 200 U/ml suministra de 2 a 160 U en incrementos de 2 unidades. Debe seguir las instrucciones detalladas que se encuentran en el instructivo incluido con el producto. TRESIBA® debe utilizarse sólo para una persona. La pluma precargada no debe rellenarse. Debe desechar la aguja después de cada inyección. Su venta requiere receta médica. Manténgase fuera del alcance de los niños. Cualquier material de desecho debe ser eliminado de acuerdo a los requerimientos locales. Para instrucciones detalladas de uso véase el instructivo. Las sustancias adicionadas a TRESIBA® pueden causar degradación de la insulina degludec. TRESIBA® no debe ser agregado a fluidos de infusión. Este medicamento no debe ser mezclado con ningún otro producto.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Titular del Registro:
Novo Nordisk A/S
Novo Allé
Bagsvaerd, 2880
Dinamarca
Representante Legal:
NOVO NORDISK MÉXICO, S.A. de C.V.
Homero 1500, piso 3, Col. Polanco
C.P. 11560, Miguel Hidalgo
Ciudad de México, México
Reg. Núm. 248M2012, SSA IV
®Marca registrada