
TREWIX
EMTRICITABINA, TENOFOVIR
Tableta
1 Caja, 1 Frasco(s), 30 Tabletas, 200/300 mg/mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Tenofovir Disoproxil succinato 300 mg (equivalente a 245 mg de Tenofovir Disoproxil)
Emtricitabina 200 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS: La asociación de Emtricitabina/Tenofovir, está indicado en combinación con otros agentes antirretrovirales (tales como los inhibidores no nucleósidos de la transcriptasa reversa o los inhibidores de proteasa) para el tratamiento de la infección por el VIH-1 en adultos.
Información adicional importante respecto al empleo de Emtricitabina/Tenofovir para el tratamiento de la infección por el VIH-1:
• No se recomienda emplear Emtricitabina/Tenofovir como componente de un regimen triple de análogos nucleósidos.
• No se debe coadministrar Emtricitabina/Tenofovir con Emtricitabina/Tenofovir Disoproxil/Efavirenz, Emtricitabina, Tenofovir Disoproxil ni productos que contengan Lamivudina (véase VII. Precauciones generales).
• En pacientes con tratamiento previo, el uso de Emtricitabina/Tenofovir debe basarse en los análisis de laboratorio y tratamientos previos (véase V. Farmacocinética y farmacodinamia).
Estudios clínicos: El estudio clínico 934 avala el uso de tabletas de Truvada® (medicamento de referencia) para el tratamiento de la infección por VIH-1. Los datos adicionales que avalan el uso de este se obtuvieron del estudio 903, en el que se administraron Lamivudina y Tenofovir Disoproxil, juntos a pacientes adultos sin tratamiento previo y del estudio clínico 303, en el que la Emtricitabina y la Lamivudina demostraron patrones de eficacia, seguridad y resistencia comparables como parte de regímenes multifármaco. Para obtener información adicional sobre estos estudios, consulte la información de prescripción de Tenofovir y Emtricitabina.
Estudio 934: Se informan los datos obtenidos tras 144 semanas en el estudio 934, un estudio multicéntrico, aleatorizado, abierto y con control activo, en que se comparó Emtricitabina + Tenofovir, administrados en asociación con Efavirenz, frente a la asociación en dosis fijas de Zidovudina y Lamivudina, asociadas a Efavirenz, en 511 pacientes sin tratamiento previo con antirretrovirales. De la 96ª a la 144ª semanas del estudio, los pacientes recibieron Truvada® (medicamento de referencia) con Efavirenz en lugar de Emtricitabina + Tenofovir con Efavirenz. Los pacientes tenían una media de edad de 38 años (límites 18 y 80 años), el 86% eran varones, el 59% eran de raza blanca, y el 23%, de raza negra. El recuento promedio inicial de linfocitos CD4+ fue de 245 linfocitos/mm3 (límites 2 y 1191), y la mediana del ARN del VIH-1 inicial en el plasma fue de 5.01 log10 copias/ml (límites 3.56 y 6.54). Los pacientes se estratificaron según el recuento inicial de linfocitos CD4+ (< o 3200 linfocitos/mm3); el 41% tenía recuentos de linfocitos CD4+ < 200 linfocitos/mm3, y el 51% de los pacientes tenía cargas víricas iniciales > 100,000 copias/ml. En la tabla 1 se presentan los resultados del tratamiento después de 48 y de 144 semanas de tratamiento, en los pacientes que no presentaban resistencia al Efavirenz al inicio.
Tabla 1. Resultados del tratamiento asignado aleatoriamente en la 48a y la 144a semanas (estudio 934)
|
Resultados |
En la 48a semana |
En la 144a semana |
||
|
FTC+T+EFV (n=244) |
AZT/3TC+EFV (n=243) |
FTC+T+EFV (n=227)a |
AZT/3TC+EFV (n=229)a |
|
|
Sensibles al tratamientob |
84% |
73% |
71% |
58% |
|
Fracaso virológicoc |
2% |
4% |
3% |
6% |
|
Rebrote |
1% |
3% |
2% |
5% |
|
Nunca se suprimió |
0% |
0% |
0% |
0% |
|
Cambio en la pauta antirretroviral |
1% |
1% |
1% |
1% |
|
Muerte |
<1% |
1% |
1% |
1% |
|
Se suspendió debido a una reacción adversa |
4% |
9% |
5% |
12% |
|
Se suspendió por otros motivosd |
10% |
14% |
20% |
22% |
a Se excluyó del análisis a los pacientes que respondieron al tratamiento en la 48ª semana o en la 96ª semana (ARN del VIH-1<400 copias/ml), pero que no dieron su consentimiento para continuar el estudio después de la 48ª semana o de la 96ª semana.
b Los pacientes lograron y mantuvieron el ARN del VIH-1 confirmado < 400 copias/ml hasta la 48ª y la 144ª semanas.
c Incluye rebrote vírico confirmado y fracaso confirmado en lograr < 400 copias/ml hasta la 48ª y la 144ª semanas.
d Incluye los pacientes perdidos en el seguimiento, retirada o abandono del paciente, incumplimiento, violación del protocolo y otros motivos.
Hasta la 48a semana, el 84% de los pacientes del grupo tratado con Emtricitabina + Tenofovir y el 73% de los pacientes tratados con Zidovudina y Lamivudina lograron y mantuvieron el ARN del VIH-1 < 400 copias/ml (hasta la 144a semana, 71% y 58%, respectivamente). En este estudio abierto, la diferencia en la proporción de pacientes que lograron y mantuvieron el ARN del VIH-1 <400 copias/ml después de 48 semanas de tratamiento es principalmente el resultado del mayor número de suspensiones debidas a reacciones adversas y a otros motivos en el grupo tratado con Zidovudina y Lamivudina.
Además, el 80% de los pacientes del grupo tratado con Emtricitabina + Tenofovir y el 70% de los pacientes tratados con Zidovudina y Lamivudina lograron y mantuvieron el ARN del VIH-1 < 50 copias/ml hasta la 48a semana (hasta la 144ª semana 64% y 56%, respectivamente). En la 48ª semana, el aumento medio con respecto a los valores iniciales del recuento de linfocitos CD4+ fue de 190 linfocitos/mm3 en el grupo tratado con Emtricitabina + Tenofovir, y de 158 linfocitos/mm3 en el grupo que recibió Zidovudina y Lamivudina (en la 144ª semana 312 y 271 linfocitos/mm3, respectivamente.
A las 48 semanas, siete pacientes del grupo tratado con Emtricitabina + Tenofovir y cinco pacientes del grupo tratado con Zidovudina y Lamivudina experimentaron una nueva reacción de clase C, según el código de los CDC (10 y 6 pacientes, respectivamente hasta las 144 semanas).
FARMACOCINÉTICA Y FARMACODINAMIA: Las tabletas contienen una combinación de Emtricitabina y Tenofovir Disoproxil en una dosis fija. Emtricitabina, un análogo nucleósido sintético de la citidina. El Tenofovir Disoproxil es convertido in vivo en Tenofovir, un análogo (nucleótido) fosfonato nucleósido acíclico de la 5’-monofosfato adenosina. Tanto la Emtricitabina como el Tenofovir exhiben actividad inhibidora contra la transcriptasa reversa del VIH-1.
Emtricitabina: El nombre químico de la Emtricitabina es 5-fluoro-1-(2R,5S)-[2-(hidroximetil)-1,3-oxatiolan-5-il]citosina.
La Emtricitabina es el enantiómero (-) de un análogo tío de la citidina, el cual se diferencia de otros análogos de la citidina en que tiene una fluorina en la posición 5.
La Emtricitabina tiene una fórmula molecular de C8H10FN3O3S y un peso molecular de 247.24. Tiene la siguiente fórmula estructural:
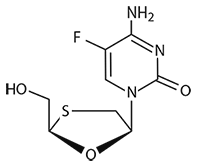
La Emtricitabina es un polvo cristalino blanco a incoloro con una solubilidad de 112 mg/ml en agua a 25ºC. El coeficiente de partición (Log p) para la Emtricitabina es -0.43 y el pKa es de 2.65.
Tenofovir Disoproxil: El Tenofovir Disoproxil es un fosfonato orgánico que es el éster disoproxil de tenofovir. El nombre químico del tenofovir disoproxil es [[(2R)-1-(6-aminopurin-9-il)propan-2-il]oximetil-(propan-2-iloxicarboniloximetoxi)fosforil]oximetil propan-2-il carbonato.
Éste tiene una fórmula molecular de C19H30N5O10P y un peso molecular de 519.448 g/mol.
Tiene la siguiente fórmula estructural:
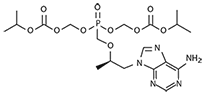
El Tenofovir Disoproxil es un polvo cristalino blanco a opaco con una solubilidad de 13.4 mg/ml en agua a 25ºC. El coeficiente de partición (Log p) para el Disoproxil Tenofovir es de 1.25 y el pKa es de 3.75. Todas las dosificaciones se expresan en términos del Tenofovir Disoproxil, excepto cuando se hace notar lo contrario.
Las tabletas de Emtricitabina/Tenofovir se administran por vía oral. Cada tableta recubierta contiene 200 mg de Emtricitabina y 300 mg de Tenofovir Disoproxil succinato (que equivalen a 245 mg de Tenofovir Disoproxil) como ingredientes activos.
Para obtener información adicional sobre el mecanismo de acción, la actividad antiviral, la resistencia y la resistencia cruzada, consulte la información de prescripción de Emtricitabina y Tenofovir Disoproxil (por separado).
Mecanismo de acción: Emtricitabina/Tenofovir es una asociación de dosis fijas de fármacos antirretrovirales.
Emtricitabina: La Emtricitabina, un análogo nucleósido sintético de la histidina, es fosforilada por enzimas celulares para formar la 5’-trifosfato Emtricitabina. La 5’-trifosfato Emtricitabina inhibe la actividad de la transcriptasa reversa (TR) del VIH-1 por competencia con el substrato natural 5’-trifosfato desoxicitidina y es incorporada al ADN viral incipiente, lo que resulta en la terminación de la cadena. La 5’-trifosfato Emtricitabina es un inhibidor débil de las polimerasas a, β, e del ADN de los mamíferos y de la polimerasa del ADN mitocondrial.
Tenofovir Disoproxil: El Tenofovir Disoproxil es un di éster fosfonato nucleósido acíclico análogo del monofosfato de adenosina. El Tenofovir Disoproxil requiere hidrólisis di éster inicial para su conversión a Tenofovir y fosforilaciones subsecuentes por las enzimas celulares para formar di fosfato de Tenofovir. El di fosfato de Tenofovir inhibe la actividad de la TR del VIH-1 por competencia con el substrato natural 5’-trifosfato desoxiadenosina y, una vez incorporado al ADN, por su terminación. El di fosfato de Tenofovir es un inhibidor débil de las ADN-polimerasas a, β y de la ADN-polimerasa mitocondrial y en mamíferos.
Actividad antiviral:
Emtricitabina y Tenofovir Disoproxil: En estudios de combinación para evaluar la actividad antiviral en cultivo celular de la combinación de Emtricitabina y Tenofovir se observaron efectos antivirales sinérgicos.
Emtricitabina: Se valoró la actividad antiviral de la Emtricitabina contra cepas de laboratorio y clínicas del VIH, en líneas de células linfoblastoides, en la línea cellular MAGI-CCR5 y en células mononucleares de sangre periférica. Los valores de la concentración eficaz al 50% (CE50) para la Emtricitabina estuvieron dentro del rango de 0.0013-0.64 μM (0.0003-0.158 μg/ml). En estudios de combinación de la Emtricitabina con otros inhibidores nucleósidos de la transcriptasa reversa (Abacavir, Lamivudina, Estavudina, Zalcitabina, Zidovudina), con inhibidores no nucleósidos de la transcriptasa reversa (Delavirdina, Efavirenz, Nevirapina), o con inhibidores de proteasa (Amprenavir, Nelfinavir, Ritonavir, saquinavir), se observaron efectos de aditivos a sinérgicos. La Emtricitabina exhibió actividad antiviral en cultivo celular contra el VIH-1 tipos A, B, C, D, E, F y G (los valores de la CE50 variaron de 0.007-0.075 μM) y mostró actividad específica contra el VIH-2 (los valores de la CE50 variaron de 0.007-1.5 μM).
Tenofovir Disoproxil: Se valoró la actividad antiviral de Tenofovir contra cepas de laboratorio y clínicas del VIH-1 en líneas de células linfoblastoides, en células de monocitos/macrófagos primarios y en linfocitos de sangre periférica. Los valores de la CE50 para Tenofovir estuvieron en el rango de 0.04-8.5 μM. En los estudios de combinación del Tenofovir con los inhibidores nucleósidos de la transcriptasa reversa (Abacavir, Didanosina, Lamivudina, Estavudina, Zalcitabina, Zidovudina), con inhibidores no nucleósidos de la transcriptasa reversa (Delavirdina, Efavirenz, Nevirapina), o con inhibidores de proteasa (Amprenavir, Indinavir, Nelfinavir, Ritonavir, saquinavir), se observaron efectos de aditivos a sinérgicos. Tenofovir exhibió actividad antiviral en cultivo celular contra VIH-1 tipos A, B, C, D, E, F, G y O (los valores de la CE50 variaron de 0.5-2.2 μM) y actividad específica de cepas contra el VIH-2 (los valores de CE50 fueron de entre 1,6 μM y 4,9 μM).
Resistencia:
Emtricitabina y Tenofovir Disoproxil: Se han seleccionado en un cultivo celular cepas de VIH-1 con susceptibilidad reducida a la combinación de Emtricitabina y Tenofovir. Mediante el análisis del genotipo de estas cepas se identificaron substituciones del aminoácido M184V/I y/o del K65R en la transcriptasa reversa viral.
En un estudio clínico con pacientes sin tratamiento previo (estudio 934, véase Indicaciones terapéuticas, Estudios clínicos) se realizó un análisis de resistencia en inóculos de VIH-1 de todos los pacientes que habían experimentado fracaso virológico confirmado con > 400 copias/ml de ARN del VIH-1 a la semana 144 o que habían abandonado el estudio en forma prematura. El desarrollo de sustituciones asociadas con la resistencia al Efavirenz fue muy frecuente y similar en todos los grupos de tratamiento. Se observó la sustitución de aminoácidos M184V, asociada con resistencia a Emtricitabina y Lamivudina en 2/19 de los inóculos aislados de pacientes analizados en el grupo tratado con Emtricitabina + Tenofovir Disoproxil, y en 10/29 de los inóculos aislados de pacientes analizados en el grupo tratado con Zidovudina y Lamivudina. En las 144 semanas del estudio 934, ninguno de los pacientes que participan en el estudio 934 ha desarrollado una sustitución K65R detectable en su VIH-1 según un análisis genotípico estándar.
Emtricitabina: Se han aislado, en cultivo celular e in vivo, cepas de VIH-1 resistentes a la Emtricitabina. El análisis genotípico de estos aislados reveló que la susceptibilidad reducida a la Emtricitabina se asocia con una mutación en el codón 184 del gen de la TR del VIH-1, lo cual resultó en una substitución del aminoácido metionina por valina o isoleucina (M184V/I).
Tenofovir Disoproxil: Se han aislado en un cultivo celular cepas del VIH-1 con susceptibilidad reducida al Tenofovir.
Estos virus expresaron una sustitución K65R en la TR y mostraron una reducción de 2-4 veces en la susceptibilidad al Tenofovir.
En pacientes näive, los inóculos de 8/47 (17%) pacientes analizados desarrollaron la sustitución K65R en el grupo tratado con Tenofovir Disoproxil después de 144 semanas, 7 casos se produjeron en las primeras 48 semanas de tratamiento y 1 en la semana 96. En pacientes ya previamente tratados con otros fármacos antirretrovirales 14/304 (5%) cepas aisladas de pacientes que tuvieron falla virológica hasta las 96 semanas mostraron una susceptibilidad reducida al Tenofovir > 1.4 veces (mediana 2.7). El análisis genotípico de estas cepas resistentes reveló una mutación en el gen de la TR del VIH-1 que resulta en la substitución del aminoácido K65R.
Resistencia cruzada:
Emtricitabina y Tenofovir Disoproxil: Se ha detectado resistencia cruzada con ciertos inhibidores nucleósidos de la transcriptasa reversa. Las substituciones M184V/I y/o K65R seleccionadas en cultivo celular con la combinación de Emtricitabina y Tenofovir también se observaron en algunos aislados del VIH-1 de sujetos que tuvieron falla al tratamiento con Tenofovir en combinación ya sea con Lamivudina o con Emtricitabina y también con Abacavir o Didanosina. Por consiguiente, puede ocurrir resistencia cruzada entre estos fármacos en pacientes cuyo virus contenga una o ambas substituciones de estos aminoácidos.
Emtricitabina: Los aislados resistentes a la Emtricitabina (M184V/I) tuvieron resistencia cruzada a Lamivudina y Zalcitabina, pero conservaron la susceptibilidad en cultivo celular a Didanosina, Estavudina, Tenofovir, Zidovudina y a los inhibidores no nucleósidos de la TR (Delavirdina, Efavirenz y Nevirapina). Las cepas del VIH-1 que contienen la substitución K65R, seleccionada in vivo con Abacavir, Didanosina, Tenofovir y Zalcitabina mostraron susceptibilidad reducida a la Emtricitabina.
Los virus que contienen sustituciones que confieren susceptibilidad reducida a Estavudina y Zidovudina (M41L, D67N, K70R, L210W, T215Y/F, K219Q/E) o Didanosina (L74V) permanecieron sensibles a la Emtricitabina. El VIH-1 que contiene la substitución K103N asociada con la resistencia a los inhibidores no nucleósidos de la TR fue sensible a la Emtricitabina.
Tenofovir Disoproxil: Las cepas del VIH-1 de pacientes (n=20) cuyo virus expresó una media de 3 sustituciones de aminoácido en la TR asociadas a Zidovudina (M41L, D67N, K70R, L210W, T215Y/F o K219Q/E/N) mostraron una disminución de 3.1 veces en la susceptibilidad al Tenofovir. El VIH-1 resistente a múltiples nucleósidos con una sustitución de inserción doble T69S en la TR mostró susceptibilidad reducida al Tenofovir.
Farmacología clínica:
Farmacocinética: La administración de una tableta de Truvada® (medicamento de referencia) es bioequivalente en sujetos sanos en ayunas (n=39), a una cápsula de Emtricitabina (200 mg) más una tableta de Tenofovir Disoproxil (300 mg).
Emtricitabina: En la tabla 2 se resumen las propiedades farmacocinéticas de Emtricitabina. Después de la administración oral de Emtricitabina, la Emtricitabina se absorbe rápidamente y las concentraciones pico en plasma ocurren 1-2 horas post-dosis. La unión in vitro de la Emtricitabina a las proteínas del plasma humano es menor al 4% y es independiente de la concentración en el rango entre 0.02-200 μg/ml. Después de la administración de Emtricitabina radio marcada, se recuperó aproximadamente 86% en la orina y 13% se recuperó como metabolitos. Los metabolitos de Emtricitabina incluyen los 3’diastereómeros sulfóxido y su conjugado de ácido glucorónico. La Emtricitabina es eliminada mediante una combinación de filtración glomerular y secreción tubular activa. Después de una sola dosis oral de Emtricitabina, la vida media de Emtricitabina en plasma es aproximadamente de 10 horas.
Tenofovir Disoproxil: Las propiedades farmacocinéticas del Tenofovir Disoproxil se resumen en la tabla 2. Después de la administración oral de Tenofovir Disoproxil, las concentraciones máximas de Tenofovir en suero se consiguen en 1.0 ± 0.4 horas. La unión in vitro de Tenofovir a las proteínas del plasma humano es menor de 0.7% y es independiente de la concentración entre los límites de 0.01-25 μg/ml. Aproximadamente 70-80% de la dosis intravenosa de Tenofovir se recuperó como fármaco sin cambios en la orina. Tenofovir se elimina mediante una combinación de filtración glomerular y de secreción tubular activa. Después de una sola dosis oral de Tenofovir Disoproxil, la semivida de eliminación terminal de Tenofovir es de 17 horas aproximadamente.
Tabla 2. Parámetros farmacocinéticos de dosis única de Emtricitabina y Tenofovir en adultosa
|
Emtricitabina |
Tenofovir |
|
|
Biodisponibilidad oral en ayunob (%) |
92 (83.1-106.4) |
25 (NC-45.0) |
|
Eliminación plasmática terminal vida mediab (h) |
10 (7.4-18.0) |
17 (12.0-25.7) |
|
Cmáx.c (μg/ml) |
1.8 ± 0.72d |
0.30 ± 0.09 |
|
AUCc (μg• h/ml) |
10.0 ± 3.12d |
2.29 ± 0.69 |
|
CL/Fc (ml/min) |
302 ± 94 |
1043 ± 115 |
|
CLrenalc (ml/min) |
213 ± 89 |
243 ± 33 |
ª NC = No calculada.
b Mediana (rango).
c Promedio (± DE).
d Datos presentados como valores de estado estable.
Efectos de los alimentos sobre la absorción oral: Emtricitabina/Tenofovir se puede administrar con o sin alimentos. La administración de Emtricitabina/Tenofovir después de una comida alta en grasas (784 kcal; 49 gramos de grasas) o de una comida ligera (373 kca; 8 g de grasas) retardó el tiempo de la Cmáx. de Tenofovir en aproximadamente 0.75 horas. La media del incremento del ABC y de la Cmáx. de Tenofovir fue de 35% y 15%, respectivamente, cuando se administró con una comida alta en grasas o con una comida ligera, comparada con la administración en estado de ayuno. En los estudios previos de seguridad y eficacia, Tenofovir Disoproxil se tomó en condiciones de haber ingerido alimentos. La exposición sistémica a Emtricitabina (ABC y Cmáx.) no fue afectada cuando se administró Emtricitabina/Tenofovir, ya sea con una comida alta en grasas o con una comida ligera.
Poblaciones especiales:
Raza:
Emtricitabina: No se detectaron diferencias farmacocinéticas debidas a la raza, luego de la administración de Emtricitabina.
Tenofovir Disoproxil: La cantidad de sujetos de grupos raciales y étnicos aparte del grupo de raza blanca reclutados en los estudios clínicos fue insuficiente para determinar adecuadamente las diferencias farmacocinéticas potenciales entre estas poblaciones después de la administración de Tenofovir Disoproxil.
Género: Las farmacocinéticas de Emtricitabina y Tenofovir Disoproxil son similares en los pacientes masculinos y femeninos.
Pacientes pediátricos y geriátricos: No se han realizado estudios farmacocinéticos de Tenofovir en pacientes pediátricos (<18 años). No se han evaluado completamente las farmacocinéticas de Emtricitabina y Tenofovir en ancianos (mayores de 65 años).
Pacientes con daño de la función renal: Las farmacocinéticas de Emtricitabina y Tenofovir se alteran en los pacientes con daño renal (véase Precauciones generales). En los pacientes con depuración de creatinina menor de 50 ml/min, la Cmáx. y el ABCo-a de la Emtricitabina y de Tenofovir se incrementaron.
Se recomienda modificar el intervalo de la dosis de Emtricitabina/Tenofovir en los pacientes con depuración de creatinina de 30-49 ml/min.
No debe administrarse Emtricitabina/Tenofovir a pacientes con depuración de creatinine menor de 30 ml/min. ni a pacientes con enfermedad renal en etapa terminal que requieren diálisis (véase Dosis y vía de administración).
Pacientes con daño hepático: Se han estudiado las farmacocinéticas de Tenofovir luego de una dosis de 300 mg de Tenofovir Disoproxil en pacientes no infectados por el VIH con daño hepático moderado a severo. No hubo alteraciones substanciales en las farmacocinéticas de Tenofovir en los pacientes con daño hepático, comparados con los pacientes sin daño hepático. Las farmacocinéticas de Emtricitabina/Tenofovir o Emtricitabina no han sido estudiadas en pacientes con daño hepático; sin embargo, la Emtricitabina no es metabolizada significativamente por las enzimas del hígado, por lo que la repercusión del daño hepático debe ser limitada.
CONTRAINDICACIONES: Emtricitabina/Tenofovir está contraindicado en los pacientes que previamente han mostrado hipersensibilidad a alguno de los componentes del producto. Menores de 18 años, embarazo y lactancia.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
Embarazo: Categoría B.
Emtricitabina: La incidencia de variaciones fetales y malformaciones no se incrementó en los estudios de toxicidad embrionaria fetal efectuados con Emtricitabina en ratones, con exposiciones (ABC) aproximadamente 60 veces más altas, y en conejos con exposiciones aproximadamente 120 veces más altas que las observadas en humanos con la dosis diaria recomendada.
Tenofovir Disoproxil: Los estudios de la reproducción se efectuaron en ratas y en conejos con dosis hasta 14 y 19 veces mayores a las humanas según las comparaciones de la superficie corporal, y no revelaron evidencia de deterioro de la fertilidad ni daño sobre el feto a causa del Tenofovir.
Sin embargo, no hay estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta en humanos, durante el embarazo Emtricitabina/Tenofovir solamente debe emplearse cuando sea estrictamente necesario.
Madres que amamantan: Los centros para el control y la prevención de las enfermedades recomiendan que las madres infectadas con el VIH-1 no deben amamantar a sus hijos para evitar el riesgo de transmisión postnatal del VIH-1. Los estudios en ratas han demostrado que Tenofovir se secreta en la leche. No se sabe si Tenofovir se excreta en la leche humana. Tampoco se sabe si la Emtricitabina se excreta en la leche humana. Debido al potencial de transmisión del VIH-1 y al potencial de reacciones adversas serias en los infantes alimentados al seno, debe indicarse a las madres que no amamanten a sus bebés si están recibiendo Emtricitabina/Tenofovir.
REACCIONES SECUNDARIAS Y ADVERSAS:
En otros apartados de la información para prescribir se tratan las siguientes reacciones adversas:
• Acidosis láctica o hepatomegalia grave con esteatosis (véase Precauciones generales).
• Exacerbaciones agudas y graves de la hepatitis B (véase Precauciones generales).
• Nueva aparición o empeoramiento de la disfunción renal (véase Precauciones generales).
• Disminución de la densidad de mineral ósea (véase Precauciones generales).
• Síndrome de reconstitución inmunológica (véase Precauciones generales).
Toxicología o farmacología en animales: Se administró Tenofovir y Tenofovir Disoproxil a ratas, perros y monos en estudios de toxicología, en exposiciones (basadas en el ABC) mayores o iguales a 6 veces a las observadas en humanos, que causaron toxicidad ósea. En los monos la toxicidad ósea se diagnosticó como osteomalacia. La osteomalacia observada en los monos pareció ser reversible al reducir la dosis o discontinuar el Tenofovir. En las ratas y perros la toxicidad ósea se manifestó como disminución de la densidad mineral ósea. No se conocen los mecanismos intrínsecos de la toxicidad ósea.
Se observaron signos de toxicidad renal en cuatro especies animales. Hubo incrementos en los valores de creatinina sérica, nitrógeno de urea en sangre, glucosuria, proteinuria, fosfaturia y/o calciuria y disminución de fosfato en suero de diversos grados en esos animales. Estos signos de toxicidad se observaron en exposiciones (basadas en el ABC) dos a veinte veces mayores que las observadas en humanos. No se conoce la relación de las alteraciones renales, en particular la fosfaturia con la toxicidad ósea.
Reacciones adversas, experiencia en ensayos clínicos: Debido a que los ensayos clínicos se realizan en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco y puede que no reflejen las tasas observadas en la práctica.
Las reacciones adversas más frecuentes (incidencia ≥10%, cualquier gravedad) que se produjeron en el estudio 934, un estudio clínico con control activo de Efavirenz. Emtricitabina y Tenofovir Disoproxil, consisten en diarrea, náuseas, fatiga, cefalea, mareos, depresión, insomnio, anomalías de los sueños y erupción cutánea. Véase también en la tabla 3 la frecuencia de las reacciones adversas aparecidas con el tratamiento (grados 2-4) que se produjeron en ≥5% de los pacientes tratados con Efavirenz, Emtricitabina y Tenofovir Disoproxil en este estudio.
La decoloración de la piel, manifestada por hiperpigmentación de las palmas de las manos o de las plantas de los pies, generalmente fue leve y asintomática. Se desconocen su mecanismo y su importancia clínica.
Estudio 934:
Reacciones adversas aparecidas con el tratamiento: En el estudio 934 se administró a 511 pacientes sin tratamiento antirretroviral previo Tenofovir Disoproxil + Emtricitabina asociado a Efavirenz (n=257), o bien Zidovudina y Lamivudina asociados a Efavirenz (n=254). Por lo general, las reacciones adversas observadas en este estudio fueron coherentes con las observadas en otros estudios en pacientes con o sin tratamiento previo, tratados con Tenofovir Disoproxil o Emtricitabina (tabla 3).
Tabla 3. Algunas reacciones adversas aparecidas durante el tratamientoa (grados 2-4), notificadas en ≥5% de cualquier grupo de tratamiento del estudio 934 (0 a 144 semanas)
|
FTC+T+EFVb |
AZT/3TC+EFV |
|
|
n=257 |
n=254 |
|
|
Trastorno digestivo |
||
|
Diarrea |
9% |
5% |
|
Náuseas |
9% |
7% |
|
Vómitos |
2% |
5% |
|
Trastornos generales y estado del lugar de la administración |
||
|
Fatiga |
9% |
8% |
|
Infecciones e infestaciones |
||
|
Sinusitis |
8% |
4% |
|
Infecciones en las vías respiratorias superiores |
8% |
5% |
|
Nasofaringitis |
5% |
3% |
|
Trastornos del sistema nervioso |
||
|
Cefalea |
6% |
5% |
|
Mareos |
8% |
7% |
|
Trastornos psiquiátricos |
||
|
Depresión |
9% |
7% |
|
Insomnio |
5% |
7% |
|
Trastornos de la piel y el tejido subcutáneo |
||
|
Erupciones cutáneasc |
7% |
9% |
a Las frecuencias de las reacciones adversas se basan en todos los acontecimietos adversos que aparecen con el tratamiento, con independencia de la relación con el fármaco del estudio.
b De la 96a a la 144a semanas del estudio, los pacientes recibieron Truvada® con Efavirenz en lugar de Tenofovir Disoproxil + Emtricitabina con Efavirenz.
c Las erupciones consisten en erupciones cutáneas, erupciones exfoliativas, erupción generalizada, erupción macular, erupción maculopapular, erupción prurítica y erupción vesicular.
Además de las reacciones que se describen más arriba en el estudio 934, otras reacciones adversas que se presentaron en al menos el 5% de los pacientes tratados con Emtricitabina o Tenofovir Disoproxil junto con otros antirretrovirales en estudios clínicos fueron ansiedad, artralgia, aumento de la tos, dispepsia, fiebre, mialgia, dolor, dolor abdominal, dolor lumbar, parestesia, neuropatía periférica (incluso neuritis periférica y neuropatía), neumonía y rinitis.
Además de las anomalías de laboratorio descritas más arriba en el estudio 934, se produjeron aumentos de 3° o 4° grado de la bilirrubina (> 2,5xLSN), la amilasa pancreática (> 2,0 x LSN), la glucosa sérica (< 40 o > 250 mg/dl) y la lipasa sérica (> 2,0xLSN) hasta en el 3% de los pacientes tratados con Emtricitabina o Tenofovir Disoproxil con otros antirretrovirales en ensayos clínicos.
Reacciones adversas, experiencia post-comercialización: Se han detectado las siguientes reacciones adversas durante el empleo posterior a la aprobación de Tenofovir Disoproxil. Debido a que se reportaron voluntariamente por una población de tamaño no conocido, no siempre es posible calcular de manera fiable su frecuencia ni establecer una relación causal con la exposición al fármaco.
Trastornos del sistema inmune: Reacción alérgica.
Trastornos del metabolismo y la nutrición: Hipofosfatemia, acidosis láctica.
Trastornos respiratorios, torácicos y mediastinales: Disnea.
Trastornos gastrointestinales: Dolor abdominal, aumento de la amilasa, pancreatitis.
Trastornos hepatobiliares: Aumento en las enzimas hepáticas (con mayor frecuencia, aumento de la AST, la ALT, la gamma GT), hepatitis.
Trastornos de tejidos cutáneos y subcutáneos: Erupción cutánea.
Trastornos de tejidos musculosqueléticos y conectivos: Miopatía, osteomalacia (ambas asociadas con tubulopatía renal proximal).
Trastornos renales y urinarios: Insuficiencia renal, insuficiencia renal aguda, síndrome de Fanconi, tubulopatía proximal, proteinuria, incremento de la creatinina, necrosis tubular aguda, diabetes insípida nefrogénica, poliuria, nefritis intersticial (incluidos casos agudos).
Trastornos generales y afecciones en el lugar de la administración: Astenia.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Emtricitabina: En los estudios de carcinogénesis a largo plazo, no se observaron aumentos relacionados con el fármaco en la incidencia de tumores en ratones a dosis de hasta 750 mg/kg/día (26 veces la exposición sistémica humana a la dosis terapéutica de 200 mg/día) ni en ratas, a dosis de hasta 600 mg/kg/día (31 veces la exposición sistémica humana la dosis terapéutica).
La Emtricitabina no fue genotóxica en la prueba bacteriana de mutación reversa (prueba de Ames), en la prueba de linfoma de ratón ni en la prueba de micronúcleo de ratón.
La Emtricitabina no afectó la fertilidad de las ratas machos en exposiciones 140 veces mayores a las de los humanos, aproximadamente, ni en ratones machos y hembras con exposiciones (ABC) 60 veces mayores a las de los humanos, administrando la dosis recomendada de 200 mg diarios. La fertilidad fue normal en las crías de los ratones expuestos diariamente desde antes del nacimiento (in útero) hasta la madurez sexual en exposiciones diarias (ABC) aproximadamente 60 veces mayores a la exposición humana, a la dosis recomendada de 200 mg diarios.
Tenofovir Disoproxil: Los estudios de carcinogénesis con Tenofovir Disoproxil por vía oral, a largo plazo, en ratones y ratas fueron efectuados con exposiciones hasta 16 veces más altas aproximadamente (ratones) y 5 veces (ratas) a las observadas en humanos, con la dosis terapéutica para la infección por el VIH. Con la dosis alta administrada a ratones hembras hubo incremento de los adenomas hepáticos, con exposiciones 16 veces más altas que en los humanos. En las ratas el estudio fue negativo en cuanto a hallazgos carcinógenos, con exposiciones hasta 5 veces más altas que en los humanos a la dosis terapéutica.
El Tenofovir Disoproxil fue mutagénico en la prueba de linfoma de ratón in vitro y fue negativo en una prueba de mutagénesis bacteriana in vitro (prueba de Ames). En una prueba de micronúcleo de ratón in vivo, el Tenofovir Disoproxil fue negativo cuando se administró los ratones machos.
No hubo efectos sobre la fertilidad, el apareamiento y el desarrollo embrionario temprano cuando se administró Tenofovir Disoproxil a las ratas machos en una dosis equivalente a 10 veces la dosis humana de acuerdo con la superficie corporal, según las comparaciones efectuadas 28 días antes del apareamiento y en las ratas hembras a los 15 días previos al apareamiento hasta los siete días de la gestación. Sin embargo, hubo una alteración del ciclo estral de las ratas hembras.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se han realizado estudios de interacciones medicamentosas con Emtricitabina/Tenofovir en tabletas. Se han realizado estudios de interacciones medicamentosas con Emtricitabina y con Tenofovir Disoproxil (por separado). En este apartado se explican las interacciones clínicamente relevantes observadas con Emtricitabina y Tenofovir Disoproxil.
Didanosina: La administración concomitante de Emtricitabina/Tenofovir y Didanosina debe efectuarse con cautela y se deben vigilar en forma cuidadosa las reacciones adversas asociadas a la Didanosina. La Didanosina debe discontinuarse en los pacientes que presentan estas reacciones adversas. Cuando se administró Tenofovir Disoproxil junto con Didanosina, la Cmáx. y el ABC de la Didanosina administrada ya sea en la formulación buffer o con la capa entérica, se incrementaron significativamente (véase la Tabla 4). No se conoce el mecanismo de esta interacción. Las concentraciones altas de Didanosina pueden potenciar las reacciones adversas que se asocian a ésta, entre las que se incluye la pancreatitis y la neuropatía. Se ha observado la supresión de los recuentos de células CD4+ en pacientes que recibieron Tenofovir con Didanosina en dosis de 400 mg diarios. En los adultos que pesan más de 60 kg la dosis de Didanosina debe reducirse a 250 mg cuando se administra concomitantemente Emtricitabina/Tenofovir. No hay datos disponibles para recomendar un ajuste de la dosis de Didanosina para los pacientes que pesan menos de 60 kg. Cuando se administran concomitantemente Emtricitabina/Tenofovir y Didanosina se pueden tomar en condiciones de ayuno o con una comida ligera (menos de 400 kcal, 20% de grasas). La administración concomitante de la formulación de las tabletas buffer de Didanosina con Emtricitabina/Tenofovir debe hacerse en condiciones de ayuno.
Tabla 4. Interacciones con medicamentos: Parámetros farmacocinéticos para la Didanosina en presencia de Tenofovir Disoproxil
|
Didanosina dosis (mg)/método de administracióna |
Tenofovir Disoproxil método de administracióna |
n |
% diferencia (90% CI) vs. Didanosina 400 mg solo, en ayunob |
|
|
Cmáx |
AUC |
|||
|
Tabletas con buffer |
||||
|
400 una vez al díac x 7 días |
En ayuno 1 hora después de Didanosina |
14 |
h 28 (h 11 a h 48) |
h 44 (h 31 a h 59) |
|
Cápsulas con capa entérica |
||||
|
400 una vez, en ayuno |
Con alimentos, 2 horas después de Didanosina |
26 |
h 48 (h 25 a h 76) |
h 48 (h 31 a h 67) |
|
400 una vez, con alimentos |
Simultáneo con Didanosina |
26 |
h 64 (h 41 a h 89) |
h 60 (h 44 a h 79) |
|
250 una vez, en ayuno |
Con alimentos, 2 horas después de Didanosina |
28 |
-10 (-22 a h 3) |
ó |
|
250 una vez, en ayuno |
Simultáneo con Didanosina |
28 |
ó |
h 14 (0 a h 31) |
|
250 una vez, con alimentos |
Simultáneo con Didanosina |
28 |
-29 (-39 a h 18) |
-11 (-23 a h 2) |
a Administración con alimentos fue con comida ligera (~373 kcal, 20% grasa).
b Incremento = h Disminución = - Sin efecto = ó.
c Incluye 4 sujetos con peso < 60 kg que recibieron ddl 250 mg.
Atazanavir: Se ha observado que Atazanavir incrementa las concentraciones de Tenofovir (véase Tabla 5). El mecanismo de esta interacción no se conoce. Los pacientes que reciben Atazanavir y Emtricitabina/Tenofovir deben vigilarse en cuanto a las reacciones adversas asociadas a Emtricitabina/Tenofovir. Este medicamento debe discontinuarse en los pacientes que presentan reacciones adversas asociadas al mismo.
Tenofovir disminuye el ABC y la Cmín. de Atazanavir (véase Tabla 6). Cuando se administra en forma concomitante con Emtricitabina/Tenofovir, se recomienda administrar 300 mg de Atazanavir con 100 mg de Ritonavir. No debe administrarse Atazanavir sin Ritonavir, en forma concomitante con Emtricitabina/Tenofovir.
Tabla 5. Interacciones con medicamentos: Cambios en los parámetros de la farmacocinética para Tenofovir en presencia del medicamento administrado en forma concomitantea
|
Medicamento coadministrado |
Dosis del medicamento coadministrado (mg) |
n |
% Cambio en los parámetros farmacocinéticos del Tenofovirb (90% IC) |
||
|
Cmáx |
AUC |
Cmin |
|||
|
Abacavir |
300 una vez |
8 |
ó |
ó |
NC |
|
Adefovir dipivoxil |
10 una vez |
22 |
ó |
ó |
NC |
|
Atazanavirc |
400 una vez al día x 14 días |
33 |
h 14 (h 8 a h 20) |
h 24 (h 21 a h 28) |
h 22 (h 15 a h 30) |
|
Didanosina (capa entérica) |
400 una vez |
25 |
ó |
ó |
ó |
|
Didanosina (con buffer) |
250 o 400 una vez al día x 7 días |
14 |
ó |
ó |
ó |
|
Efavirenz |
600 una vez al día x 14 días |
29 |
ó |
ó |
ó |
|
Emtricitabina |
200 una vez al día x 7 días |
17 |
ó |
ó |
ó |
|
Indinavir |
800 tres veces al día x 7 días |
13 |
h 14 (-3 a h 33) |
ó |
ó |
|
Lamivudina |
150 dos veces al día x 7 días |
15 |
ó |
ó |
ó |
|
Lopinavir/Ritonavir |
400/100 dos veces al día x 14 día |
24 |
ó |
h 32 (h 25 a h 38) |
h 51 (h 37 a h 66) |
|
Nelfinavir |
1250 dos veces por día x 14 días |
9 |
ó |
ó |
ó |
|
Saquinavir/Ritonavir |
1000/100 dos veces por día x 14 días |
5 |
ó |
ó |
h 23 (h 16 a h 30) |
Los pacientes recibieron Tenofovir Disoproxil 300 mg una vez al día.
Aumenta = h; Disminuye = -; Sin efecto = ó; NC = No calculado.
Sulfato de Atazanavir: Información para prescribir.
Lopinavir/Ritonavir: Se ha demostrado que la asociación de Lopinavir y Ritonavir aumenta las concentraciones de Tenofovir (véase tabla 5). Se desconoce el mecanismo de esta interacción. Se debe controlar a los pacientes que reciben la asociación de Lopinavir y Ritonavir con Emtricitabina/Tenofovir, a fin de detectar reacciones adversas asociadas a Emtricitabina/Tenofovir. Se debe suspender la administración de Emtricitabina/Tenofovir en los pacientes que presentan reacciones adversas asociadas a Emtricitabina/Tenofovir.
Tabla 6. Interacciones con medicamentos: Cambios en los parámetros farmacocinéticos para el medicamento administrado concomitantemente en presencia de Tenofovir
|
Medicamento coadministrado |
Dosis del medicamento coadministrado (mg) |
n |
% Cambio en los parámetros farmacocinéticos del medicamento coadministradoa (90% IC) |
||
|
Cmáx |
AUC |
Cmin |
|||
|
Abacavir |
300 una vez |
8 |
h 12 (-1 a h 26) |
ó |
NA |
|
Adefovir dipivoxil |
10 una vez |
22 |
ó |
ó |
NA |
|
Atazanavirb |
400 una vez al día x 14 días |
34 |
-21 (-27 a -14) |
-25 (-30 a -19) |
-40 (-48 a -32) |
|
Atazanavirb |
Atazanavir/Ritonavir 300/100 una vez al día x 42 días |
10 |
-28 (-50 a -5) |
-25c (-42 a -3) |
h 23c (-46 a h 10) |
|
Efavirenz |
600 una vez al día x 14 días |
30 |
ó |
ó |
ó |
|
Emtricitabina |
200 una vez al día x 7 días |
17 |
ó |
ó |
h 20 (h 12 a h 29) |
|
Indinavir |
800 tres veces al día x 7 días |
12 |
-11 (-30 a h 12) |
ó |
ó |
|
Lamivudina |
150 dos veces al día x 7 días |
15 |
-24 (-34 a -12) |
ó |
ó |
|
Lopinavir Ritonavir |
Lopinavir/Ritonavir 400/100 dos veces al día x 14 días |
24 |
ó |
ó |
ó |
|
Methadonad |
40-110 una vez al día x 14 díase |
13 |
ó |
ó |
ó |
|
Nelfinavir metabolito M8 |
1250 dos veces por día x 14 días |
29 |
ó ó |
ó ó |
ó ó |
|
Anticonceptivos oralesf |
Etinil estradiol/norgestimate (Orto-Tricyclen®) una vez al día x 7 días |
20 |
ó |
ó |
ó |
|
Ribavirina |
600 una vez |
22 |
ó |
ó |
NA |
|
Saquinavir Ritonavir |
Saquinavir/Ritonavir 1000/100 dos veces por día x 14 días |
32 |
h 22 (h 6 a h 41) ó |
h 29 g (h 12 a h 48) ó |
h 47 g (h 23 a h 76) h 23 (h 3 a h 46) |
a Aumento = h; Disminución = -; Sin efecto = ó; NA = No aplica.
b Reyataz, Información para prescribir.
c En pacientes VIH positivos, la combinación de Tenofovir con 300 mg de Atazanavir más 100 mg de Ritonavir produjo valores de ABC y Cmín. de Atazanavir 2.3 y 4 veces más altos que los valores observados tras la administración de una dosis de 400 mg de Atazanavir solo.
d Las concentraciones de metadona fue equivalente al administrarla sola o junto con Tenofovir disoproxil.
e Los sujetos fueron mantenidos en su dosis habitual de metadona. No se reportaron alteraciones farmacodinámicas, tales como intoxicación por opiáceos o signos de abstinencia.
f Las concentraciones de etinil estradiol y de su metabolito farmacológicamente activo, el 17-deacetil norgestimato fueron equivalentes al administrarse solo o junto con Tenofovir Disoproxil.
No se prevé que los aumentos en los valores de AUC y Cmín sean clínicamente relevantes; en consecuencia, no se requieren ajustes de dosis cuando Tenofovir y saquinavir reforzado con Ritonavir se administran en forma simultánea.
Fármacos que afectan a la función renal: La Emtricitabina y el Tenofovir se excretan principalmente por los riñones mediante una combinación de filtración glomerular y de secreción tubular activa. No se han observado interacciones medicamento a medicamento debidas a la competencia por la excreción renal; sin embargo, la administración concomitante de Emtricitabina/Tenofovir con medicamentos que se eliminan mediante secreción tubular activa puede incrementar las concentraciones de Emtricitabina, Tenofovir y/o del medicamento administrado concomitantemente. Se incluyen algunos ejemplos, aunque no se limitan a estos, Aciclovir, Adefovir, dipivoxil, cidofovir, ganciclovir, valaciclovir y valganciclovir. Los medicamentos que disminuyen la función renal pueden incrementar las concentraciones de Emtricitabina y/o de Tenofovir.
Evaluación de otras interacciones medicamentosas: Las farmacocinéticas en estado de equilibrio de Emtricitabina y Tenofovir no fueron afectadas cuando se administraron juntos versus cuando se administraron solos.
Los estudios clínicos e in vitro de las farmacocinéticas de la interacción con medicamentos revelaron que el potencial de interacciones mediadas por la CYP que involucran a la Emtricitabina y al Tenofovir con otros medicamentos, es bajo.
No se han observado interacciones con medicamentos clínicamente significativas entre la emtricitabina y famciclovir, indinavir, estavudina, tenofovir disoproxil y zidovudina (véase tablas 7 y 8). Asimismo no se han observado interacciones con medicamentos clínicamente significativas entre tenofovir disoproxil y abacavir, adefovir dipivoxil, efavirenz, emtricitabina, indinavir, lamivudina, metadona, nelfinavir, anticonceptivos orales, ribavirin y saquinavir/ritonavir en los estudios efectuados en voluntarios sanos (véase tablas 5 y 6).
Tabla 7. Interacciones con medicamentos: Cambios en los parámetros farmacocinéticos para la emtricitabina en presencia del medicamento administrado concomitantementea
|
Medicamento coadministrado |
Dosis del medicamento coadministrado (mg) |
Dosis de Emtricitabina (mg) |
n |
% Cambio de los parámetros en la farmacocinética de la emtricitabinab (90% IC) |
||
|
Cmáx |
AUC |
Cmín |
||||
|
Tenofovir |
300 una vez al día x 7 días |
200 una vez al día x 7 días |
17 |
ó |
ó |
h 20 (h 12 a h 29) |
|
Zidovudina |
300 dos veces por día x 7 días |
200 una vez por día x 7 días |
27 |
ó |
ó |
ó |
|
Indinavir |
800 x 1 |
200 x 1 |
12 |
ó |
ó |
NA |
|
Famciclovir |
500 x 1 |
200 x 1 |
12 |
ó |
ó |
NA |
|
Estavudina |
40 x 1 |
200 x 1 |
6 |
ó |
ó |
NA |
a Todos los estudios de Interacción fueron conducidos en voluntarios sanos.
b h = Aumento; - = Disminución; ó = Sin efecto; NA = No aplicable.
Tabla 8. Interacciones con medicamentos: cambios en los parámetros de la farmacocinética para el medicamento administrado en forma concomitante en presencia de Emtricitabinaa
|
Medicamento coadministrado |
Dosis del medicamento coadministrado (mg) |
Dosis de Emtricitabina (mg) |
n |
% Cambio de los parámetros farmacocinéticos del medicamento coadministradob (90% IC) |
||
|
Cmáx |
AUC |
Cmín |
||||
|
Tenofovirtenofo |
300 una vez al día x 7 días |
200 una vez al día x 7 días |
17 |
ó |
ó |
ó |
|
Indinavir |
800 x 1 |
200 x 1 |
12 |
ó |
ó |
NA |
|
Zidovudina |
300 dos veces por día x 7 días |
200 una vez por día x 7 días |
27 |
h 17 (h 0 a h 38) |
h 13 (h 5 a h 20) |
ó |
|
Famciclovir |
500 x 1 |
200 x 1 |
12 |
ó |
ó |
NA |
|
Estavudina |
40 x 1 |
200 x 1 |
6 |
ó |
ó |
NA |
a Todos los estudios de interacción fueron conducidos en voluntarios sanos.
b h = Aumento; - = Disminución; ó = Sin efecto; NA = No aplicable.
Después de dar dosis múltiples a sujetos VIH negativos que reciben tratamiento de mantenimiento con metadona o anticonceptivos orales, o dosis únicas de ribavirina, las farmacocinéticas de Tenofovir en estado de equilibrio fueron similares a aquellas observadas en los estudios previos, lo que indica la falta de interacciones clínicamente significativas entre estos agentes y Tenofovir Disoproxil.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Estudio 934: Por lo general, las alteraciones en los resultados de las pruebas de laboratorio observadas en este estudio fueron coherentes con las observadas en otros estudios de Tenofovir Disoproxil o Emtricitabina (tabla 9).
Tabla 9. Anomalías de laboratorio significativas notificadas en ≥ 1% de los pacientes de cualquiera de los grupos de tratamiento del estudio 934 (0 a 144 semanas)
|
FTC+T+EFVa |
AZT/3TC+EFV |
|
|
n = 257 |
n = 254 |
|
|
Cualquier anomalía de laboratorio = 3° grado |
30% |
26% |
|
Colesterol en ayunas (> 240 mg/dl) |
22% |
24% |
|
Creatinacinasa (V: >990 U/I) (M: >845 U/I) |
9% |
7% |
|
Amilasa sérica (> 175 U/I) |
8% |
4% |
|
Fosfatasa alcalina (> 550 U/I) |
1% |
0% |
|
AST (V: >180 U/I) (M: >170 U/I) |
3% |
3% |
|
ALT (V: > 215 U/I) (M: > 170 U/I) |
2% |
3% |
|
Hemoglobina (< 8,0 mg/dl) |
0% |
4% |
|
Hiperglucemia (> 250 mg/dl) |
2% |
1% |
|
Hematuria (> 75 hematíes/CAR) |
3% |
2% |
|
Glucosuria (≥ 3+) |
< 1% |
1% |
|
Neutrófilos (< 750/mm3) |
3% |
5% |
|
Triglicéridos en ayunas (> 750 mg/dl) |
4% |
2% |
a De la 96a. a la 144a. semanas del estudio, los pacientes recibieron Truvada® (medicamento de referencia) con Efavirenz en lugar de Tenofovir Disoproxil + Emtricitabina con Efavirenz.
PRECAUCIONES GENERALES:
Acidosis láctica/hepatomegalia severa con esteatosis: Se han reportado casos de acidosis láctica y hepatomegalia severa con esteatosis, incluyendo algunos casos de muerte con el empleo de los análogos nucleósidos solos o en combinación con otros antirretrovirales. La mayoría de estos casos se ha observado en mujeres. La obesidad y la exposición prolongada a los nucleósidos pueden ser factores de riesgo. Debe tenerse especial precaución cuando se administran análogos nucleósidos a un paciente con factores de riesgo conocidos para enfermedad del hígado; sin embargo, también se han reportado casos en pacientes sin factores de riesgo conocidos. El tratamiento con Emtricitabina/Tenofovir debe suspenderse en cualquier paciente que presenta datos clínicos o de laboratorio sugestivos de acidosis láctica o de hepatotoxicidad importante (entre los cuales se puede incluir hepatomegalia y esteatosis aun en ausencia de elevaciones importantes de transaminasas).
Pacientes con infección concomitante por VIH-1 y virus de la hepatitis B (VHB): Se recomienda que todos los pacientes con VIH-1 sean examinados en busca del virus de la hepatitis B (VHB) crónica antes de iniciar el tratamiento antirretroviral. Emtricitabina/Tenofovir no está aprobado para el tratamiento de la infección crónica por el virus de la hepatitis B y no se ha establecido la seguridad y la eficacia Emtricitabina/Tenofovir en pacientes infectados concomitantemente con VHB y VIH-1.
Se han reportado exacerbaciones agudas graves de la hepatitis B en pacientes, en pacientes coinfectados con VHB y VIH-1 que han suspendido la administración de Emtricitabina o Tenofovir disoproxil. En algunos de estos pacientes infectados por el VHB y tratados con Emtricitabina, las exacerbaciones de hepatitis B se asociaron con descompensación hepática e insuficiencia hepática. La función hepática debe monitorearse de manera muy estrecha con observación clínica y pruebas de laboratorio, por lo menos durante varios meses en aquellos pacientes que están infectados concomitantemente con VIH y VHB y que discontinúan Emtricitabina/Tenofovir. Si es conveniente, se puede justificar el inicio del tratamiento para la hepatitis B.
Nueva aparición o empeoramiento de la disfunción renal: Emtricitabina y tenofovir se eliminan principalmente por el riñón. Se ha reportado daño renal, incluso casos de insuficiencia renal aguda y síndrome de Fanconi (lesión tubular renal con hipofosfatemia severa), asociados con el uso de Tenofovir Disoproxil (véase Reacciones secundarias y adversas, Experiencia post-comercialización).
Se recomienda calcular la eliminación de creatinina en todos los pacientes antes de iniciar la terapia y según se requiera clínicamente durante el tratamiento con Emtricitabina/Tenofovir. Debe realizarse el monitoreo rutinario de la eliminación de creatinina calculada y el fósforo sérico en todos los pacientes con riesgo de trastornos renales.
Se recomienda el ajuste del intervalo de dosis Emtricitabina/Tenofovir y el estricto monitoreo de la función renal en todos los pacientes con eliminación de creatinina de 30 a 49 ml/min. (véase Dosis y vía de administración). No hay datos de seguridad ni eficacia disponibles sobre pacientes con disfunción renal que hayan recibido Emtricitabina/Tenofovir siguiendo estas pautas de dosificación, por lo que el beneficio potencial de la terapia con Emtricitabina/Tenofovir debe evaluarse en relación con el riesgo potencial de toxicidad renal. No se debe administrar Emtricitabina/Tenofovir a pacientes con eliminación de creatinina < 30 ml/min. o a pacientes que necesiten hemodiálisis.
Debe evitarse tomar Emtricitabina/Tenofovir concurrentemente con medicamentos nefrotóxicos o luego de haber tomado estos medicamentos en fecha reciente.
Administración concomitante de productos relacionados: Emtricitabina/Tenofovir es una combinación de dosis fijas. No debe administrarse en forma concomitante con Emtricitabina/Tenofovir Disoproxil/Efavirenz, Emtricitabina o Tenofovir Disoproxil. Debido a la similitud entre Emtricitabina y Lamivudina, Emtricitabina/Tenofovir no debe administrarse en forma concomitante con otros medicamentos que contengan Lamivudina, entre los que se incluye Lamivudina/Zidovudina, Lamivudina o Abacavir sulfato/Lamivudina o Abacavir sulfato/Lamivudina/Zidovudina.
Disminución de la densidad ósea: Se debe plantear la vigilancia de la densidad ósea para los pacientes infectados por el VIH-1 que tienen antecedentes de fracturas patológicas o con riesgo de osteopenia. Si bien no se ha estudiado el efecto de los suplementos de calcio y vitamina D, dichos suplementos pueden ser beneficiosos para todos los pacientes. Se debe obtener asesoramiento adecuado si se sospecha la presencia de anomalías óseas.
Tenofovir Disoproxil: En un estudio de 144 semanas de duración, en pacientes sin tratamiento previo con antirretrovirales, se observaron disminuciones en la densidad de mineral óseo (DMO) en la columna lumbar y en la cadera, en ambos grupos de tratamiento del estudio. En la semana 144, hubo una disminución en el porcentaje medio significativamente superior respecto al valor inicial de la DMO de la columna lumbar en los pacientes tratados con Tenofovir disoproxil + lamivudine + efavirenz, en comparación con los pacientes tratados con estavudina + lamivudina + efavirenz. Los cambios en la DMO en la cadera fueron similares en los dos grupos de tratamiento. En ambos grupos, la mayor parte de la disminución de la DMO se produjo en las primeras 24 a 48 semanas del estudio y se mantuvo durante 144 semanas. El 28% de los pacientes tratados con Tenofovir disoproxil frente al 21% de los pacientes del grupo de comparación experimentaron una disminución de al menos el 5% de la DMO en la columna o del 7% de la DMO en la cadera. Se notificaron fracturas clínicamente relevantes (sin incluir los dedos de los pies y las manos) en cuatro pacientes del grupo tratado con Tenofovir disoproxil y en seis pacientes del grupo de comparación. El tenofovir disoproxil se asoció con aumentos significativos en los marcadores bioquímicos del metabolismo óseo (fosfatasa alcalina sérica específica del tejido óseo, osteocalcina sérica, telopéptido C sérico y telopéptido N urinario), lo que sugiere un mayor recambio óseo. Las concentraciones de hormona paratiroides en el suero y de 1,25-vitamina D también fueron más altas en los pacientes tratados con Tenofovir disoproxil. Se desconocen los efectos de los cambios asociados a Tenofovir disoproxil en la DMO y de los marcadores bioquímicos en la salud ósea a largo plazo y en el riesgo futuro de fracturas. Para obtener información adicional consulte la ficha técnica de Tenofovir disoproxil.
Se han notificado casos de osteomalacia (asociada a tubulopatía renal proximal) en relación con el uso de Tenofovir disoproxil (véase Reacciones secundarias y adversas).
Redistribución de la grasa: En los pacientes que han recibido tratamiento antirretroviral se ha observado redistribución/acumulación de la grasa del cuerpo, incluida la obesidad central, aumento de la grasa dorso cervical (giba de búfalo), adelgazamiento periférico, facial, crecimiento de las mamas y "aspecto cushingoide". El mecanismo y las consecuencias a largo plazo de estas reacciones se desconocen por ahora. No se ha establecido una relación causal.
Síndrome de reconstitución inmunológica: Se han informado casos de síndrome de reconstitución inmunológica en pacientes tratados con terapia antirretroviral de combinación, incluidos Emtricitabina y Tenofovir disoproxil. Durante la fase inicial del tratamiento antirretroviral de combinación, los pacientes cuyo sistema inmunológico responde pueden desarrollar una respuesta inflamatoria ante infecciones oportunistas residuales o indolentes (tales como infección por Mycobacterium avium, citomegalovirus, neumonía por Pneumocystis jirovecii (PCP) o tuberculosis), que pueden requerir evaluación y tratamiento adicionales.
Uso pediátrico: No se recomienda la administración de Emtricitabina/Tenofovir a pacientes menores de 18 años, ya que es una tableta de combinación de dosis fijas que contiene un componente, Tenofovir disoproxil, cuya seguridad y eficacia aún no se han establecido para pacientes de estas edades.
Uso geriátrico: Los estudios clínicos de Emtricitabina o Tenofovir disoproxil no incluyeron una cantidad suficiente de sujetos mayores de 65 años para determinar si ellos tenían una respuesta diferente a la de los sujetos más jóvenes. Por lo general, la dosis para los ancianos debe seleccionarse con cautela, teniendo en mente la mayor frecuencia de disminución de la función hepática, renal o cardiaca en estos pacientes, así como las enfermedades concomitantes y otros tratamientos con medicamentos.
Información para pacientes: Se debe informar a los pacientes de lo siguiente:
• Emtricitabina/Tenofovir no cura la infección por el VIH-1 y los pacientes pueden seguir presentando enfermedades asociadas con esta infección, incluso las infecciones oportunistas. Los pacientes deben permanecer bajo el cuidado de un médico cuando utilizan Emtricitabina/Tenofovir.
• No se ha comprobado que el uso de Emtricitabina/Tenofovir reduzca el riesgo de transmisión del VIH-1 a otras personas por medio del contacto sexual o la contaminación con sangre.
• Se desconocen los efectos a largo plazo de Emtricitabina/Tenofovir.
• Los comprimidos de Emtricitabina/Tenofovir son sólo para administración por vía oral.
• Es importante tomar Emtricitabina/Tenofovir en un tratamiento de asociación a un intervalo de dosificación regular, para evitar que el paciente olvide tomar las dosis.
• Se ha notificado la aparición de acidosis láctica y hepatomegalia grave con esteatosis, incluso casos mortales. El tratamiento con Emtricitabina/Tenofovir debe interrumpirse en cualquier paciente que presente síntomas clínicos que indiquen la presencia de acidosis láctica o hepatotoxicidad pronunciada (incluso náuseas, vómitos, molestias gástricas poco habituales o inesperadas y debilidad) (véase Precauciones generales).
• Se debe realizar a todos los pacientes con infección por el VIH-1 la prueba para detectar la presencia del virus de la hepatitis B (VHB) antes de iniciar el tratamiento antirretroviral.
• Se han notificado casos de exacerbación aguda grave de la hepatitis B en los pacientes con infección concomitante por el VHB y el VIH-1 que han interrumpido la administración de Emtricitabina o Tenofovir disoproxil.
• Se han notificado casos de disfunción renal, entre ellos, casos de insuficiencia renal aguda y síndrome de Fanconi, en relación con el uso de Tenofovir disoproxil. Se debe evitar el uso de Emtricitabina/Tenofovir con el uso reciente o concomitante de un medicamento nefrotóxico (véase Precauciones generales). Puede ser necesario ajustar el intervalo de dosificación de Emtricitabina/Tenofovir en los pacientes con disfunción renal (véase Dosis y vía de administración).
• Emtricitabina/Tenofovir no debe administrarse concomitantemente con Emtricitabina/Tenofovir Disoproxil/Efavirenz, Emtricitabina o Tenofovir Disoproxil; ni con fármacos que contengan Lamivudina, como Lamivudina y Zidovudina, Lamivudina, sulfato de Abacavir y Lamivudina o sulfato de Abacavir, Lamivudina y Zidovudina (véase Precauciones generales).
• Se ha observado disminución de la densidad ósea con el uso de Tenofovir Disoproxil. Se debe plantear la vigilancia de la densidad ósea en los pacientes que tengan antecedentes de fracturas patológicas o con riesgo de osteopenia (véase Precauciones generales).
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis recomendada: La dosis de Emtricitabina/Tenofovir es de una tableta (que contiene 200 mg de emtricitabina y 300 mg de tenofovir disoproxil succinato) una vez al día, por vía oral, con o sin los alimentos.
Ajuste de la dosis por daño renal: Hubo exposiciones considerablemente incrementadas al medicamento cuando se administró Emtricitabina o Tenofovir disoproxil fumarato a pacientes con daño renal moderado a severo (véase la información para prescribir de Emtricitabina o Tenofovir disoproxil). Por consiguiente, el intervalo de la dosis de Emtricitabina/Tenofovir debe ajustarse en los pacientes que tienen depuración de creatinina inicial de 30-49 ml/min. utilizando las recomendaciones que aparecen en la Tabla 10. Las recomendaciones de ajuste de intervalo de dosis se basan en modelos de datos farmacocinéticos de dosis única en sujetos no infectados con VIH. No se ha evaluado clínicamente la seguridad y la eficacia de las recomendaciones para el ajuste del intervalo de la dosis, en pacientes con disfunción renal moderada, por consiguiente, la respuesta clínica al tratamiento y a la función renal debe monitorearse cuidadosamente en estos pacientes (véase Precauciones generales).
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve (eliminación de creatinina de 50-80 ml/min). Debe realizarse un monitoreo rutinario de la eliminación de creatinina calculada y el fósforo sérico en todos los pacientes con disfunción renal leve (véase Precauciones generales).
Tabla 10. Ajuste de la dosis en pacientes con depuración de creatinina alterada
|
Aclaramiento de creatinina (ml/min)a |
|||
|
=50 |
30-49 |
<30 (Incluyendo pacientes que requieran hemodiálisis) |
|
|
Intervalo de dosis recomendado |
cada 24 horas |
Cada 48 horas |
Truvada® no debe ser administrado |
a Calculado utilizando el peso corporal (sin grasa).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: En caso de sobredosis, se debe evaluar al paciente en busca de toxicidad y si es necesario se aplican las medidas estándar de tratamiento.
Emtricitabina: Se dispone de poca experiencia clínica con dosis mayores a la terapéutica de Emtricitabina. En un estudio de farmacología clínica se administraron dosis únicas de Emtricitabina de 1200 mg a 11 pacientes. No se reportaron reacciones adversas.
El tratamiento con hemodiálisis remueve aproximadamente el 30% de la dosis de Emtricitabina en un periodo de 3 horas de diálisis, iniciando en las primeras 1.5 horas de la sobredosis (velocidad del flujo sanguíneo de 400 ml/min. y una velocidad del flujo del dializado de 600 ml/min. Se desconoce si la Emtricitabina se puede remover mediante diálisis peritoneal.
Tenofovir Disoproxil: Se dispone de poca experiencia con dosis mayores a la dosis terapéutica de 300 mg de Tenofovir Disoproxil. En un estudio se administraron 600 mg de Tenofovir Disoproxil a 8 pacientes por vía oral durante 28 días, y no se reportaron reacciones adversas graves. No se conocen los efectos que aparecen con dosis más altas.
Tenofovir es removido eficientemente mediante hemodiálisis, con un coeficiente de extracción de 54% aproximadamente. Después de una sola dosis de 300 mg de Tenofovir Disoproxil, una sesión de hemodiálisis de 4 horas removió aproximadamente el 10% de la dosis de Tenofovir administrada.
PRESENTACIÓN: Emtricitabina/Tenofovir disponible en tabletas recubiertas. Cada tableta recubierta contiene 200 mg de Emtricitabina y 300 mg de Tenofovir Disoproxil succinato (el cual es equivalente a 245 mg de Tenofovir Disoproxil). Las tabletas son de color blanco en forma de capleta y ambas caras lisas, con cubierta de película fina de color blanco. Cada frasco con tapa a prueba de niños contiene 30 tabletas y un desecante (saco de gel de sílice) e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Almacene a no más de 30ºC.
Mantenga el recipiente cerrado herméticamente.
Distribuya solamente en el recipiente original.
No se use si al abrir el frasco el sello está roto o ausente.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Conserve el frasco bien tapado a temperatura ambiente, a no más de 30ºC y en lugar seco. Contiene un desecante no ingerible, consérvese dentro del envase. No se deje al alcance de los niños. Su venta requiere receta médica. Léase instructivo anexo.
Reporte las sospechas de reación adversa al correo:
farmacovigilancia@cofepris.gob.mx
farmacovigilancia@laboratorioscorne.com
Hecho en México por:
LABORATORIOS CORNE, S.A. de C.V.
Ocampo Nº 167-A, Las Encinas General Escobedo,
C.P. 66050, Nuevo León, México
Distribuido por:
Laboratorios Corne, S.A. de C.V.
Ocampo Nº 167-A, Las Encinas General Escobedo,
C.P. 66050, Nuevo León, México.
Laboratorios Corne, S.A. de C.V.,
Oriente 171 No. 296 Bodega 3-A,
Col. Ampliación San Juan de Aragón,
C.P. 07470, Alc. Gustavo A. Madero,
Ciudad de México, México.
Reg. Núm. 014M2020 SSA IV