
VITAROS
ALPROSTADIL
Crema tópica
1 Caja, 1 Dispensador con sobre individual,
1 Caja, 2 Dispensador con sobre individual,
1 Caja, 4 Dispensador con sobre individual,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada dispensador contiene:
|
Alprostadil |
300 mcg |
|
Excipiente cbp 100 mg |
|
INDICACIONES TERAPÉUTICAS:
Tratamiento de hombres a partir de los 18 años de edad con disfunción eréctil, la cual es la incapacidad de alcanzar o mantener una erección del pene suficiente para un desempeño sexual satisfactorio.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Fármacos usados en disfunción eréctil.
Código ATC: G04BE01
Mecanismo de acción:
Alprostadil es químicamente idéntico a la prostaglandina E1, cuyas acciones incluyen vasodilatación de los vasos sanguíneos en los tejidos eréctiles del cuerpo cavernoso y el aumento en el flujo sanguíneo arterial cavernoso, causando la rigidez del pene.
Después de la aplicación de Alprostadil VITAROS® crema tópica la aparición de la erección es dentro de 5 a 30 minutos. Alprostadil tiene una vida media en hombres corta y una mejoría en las erecciones que puede durar de 1 a 2 horas después de la dosis.
Eficacia:
Los dos estudios pivote de fase 3 evaluaron la eficacia de VITAROS® en pacientes con disfunción eréctil. Con relación al placebo, se observó una mejoría estadísticamente significativa general en los grupos de tratamiento de 100, 200 y 300 mcg en cada uno de los puntos finales, es decir, dominio de la función eréctil (EF) de la clasificación del IIEF (Índice Internacional de Función Eréctil) y un aumento en el éxito en la penetración vaginal y eyaculación. Adicionalmente, también hubo mejorías estadísticamente significativas en los grupos de tratamiento en comparación con el placebo en diversas variables de eficacia secundarias, incluyendo los otros dominios del IIEF (función orgásmica, satisfacción del coito y satisfacción general), Evaluación del Paciente de la Erección (PSAE) y el Cuestionario Global de Evaluación (GAQ).
Subpoblación de eficacia:
Se observaron mejorías similares de todos los pacientes dentro de las subpoblaciones (pacientes diabéticos, cardiacos, prostatectomía, hipertensos y paciente que fallaron con la terapia previa con Viagra) y los dos grupos de edad (≤ 65 años de edad y > 65 años) en los dominios del IIEF EF.
Propiedades farmacocinéticas:
Absorción:
La biodisponibilidad absoluta por la vía tópica no fue determinada. En un estudio farmacocinético, los pacientes con disfunción eréctil fueron tratados con 100 mg de Alprostadil VITAROS® Crema tópica a dosis de 100, 200 y 300 mcg de Alprostadil. Los niveles plasmáticos de PGE1 y su metabolito, PGE0 fueron bajos o no detectables en la mayoría de los sujetos en la mayoría de las muestras sanguíneas post dosis y no se pudieron estimar los parámetros farmacocinéticos. Los valores de Cmax y AUC de 15-ceto-PGE0 fueron bajos y mostraron una proporción menor a la dosis en el incremento sobre los rangos de dosis de 100-300 mcg. La concentración plasmática máxima de 15-ceto-PGE0 se alcanzó dentro de una hora después de la administración.
Parámetros farmacocinéticos promedio (SD) para 15-ceto-PGE0
|
Parámetro |
Placebo (N=5) |
VITAROS® 100 mcg (N=5) |
VITAROS® 200 mcg (N=5) |
VITAROS® 300 mcg (N=5) |
|
AUCa (pg*hr/mL) |
388 (256) |
439 (107) |
504 (247) |
960 (544) |
|
Cmax (pg/mL) |
23 (19) |
202 (229) |
120 (103) |
332 (224) |
|
Tmax (hr) |
6 (8) |
0.6 (0.4) |
1 (0.7) |
0.7 (0.3) |
|
T1/2 (hr) |
4 (--)b |
5 (3) |
3 (1)c |
6 (6) |
a AUC es el área bajo la curva de la concentración plasmática desde el tiempo cero hasta las 24 horas.
b Sólo 1 sujeto presentó suficientes datos para la estimación de la vida media.
c Sólo 3 sujetos produjeron suficientes datos para la estimación de la vida media.
SD = Desviación estándar.
Distribución:
Después de la administración de Alprostadil en el meato y el glande del pene, Alprostadil se absorbe rápidamente en el cuerpo esponjoso y el cuerpo cavernoso a través de los vasos colaterales. El resto pasa a la circulación venosa pélvica a través de las venas drenando el cuerpo esponjoso.
Metabolismo:
Después de la administración tópica, PGE1 es metabolizado rápidamente de manera local por oxidación enzimática del grupo 15-hidroxilo a 15-ceto-PGE1. El 15-ceto-PGE1 retiene solamente el 1-2 % de la actividad biológica de PGE1 y se reduce rápidamente para formar el metabolito inactivo más abundante, 13, 14-dihidro, 15-ceto-PGE que es eliminado principalmente por hígado y riñones.
Excreción:
Después de la administración intravenosa de Alprostadil marcado con tritio en hombres, el fármaco marcado desaparece rápidamente de la sangre en los primeros 10 minutos y sólo un poco de radiactividad permanece en la sangre después de 1 hora. Los metabolitos de Alprostadil son excretados principalmente por los riñones con aproximadamente el 90% de la dosis intravenosa eliminada en la orina dentro de las primeras 24 horas después de la administración. El resto se excretó en heces. No existe evidencia de retención de Alprostadil o sus metabolitos en los tejidos después de la administración intravenosa.
Farmacocinética en poblaciones especiales:
Enfermedad pulmonar:
Los pacientes con enfermedad pulmonar pueden tener una capacidad reducida de eliminar el fármaco. En pacientes con síndrome de estrés respiratorio del adulto, la extracción pulmonar de PGE1 administrada intravenosamente se redujo aproximadamente en un 15% en comparación con los pacientes del grupo control con una función respiratoria normal.
Género:
Los efectos del género sobre la farmacocinética de VITAROS® no ha sido estudiado y no se han llevado a cabo estudios de farmacocinética en parejas femeninas.
Pacientes geriátricos y pediátricos:
Los efectos de la edad en la farmacocinética de Alprostadil tópico no se ha estudiado. VITAROS® Crema Tópica no está indicado para uso en niños o en individuos menores a 18 años de edad.
CONTRAINDICACIONES:
VITAROS® Crema Tópica no debe usarse en pacientes con alguna de las siguientes condiciones:
• Desórdenes relevantes como hipotensión ortostática, infarto al miocardio y síncope.
• Hipersensibilidad conocida a Alprostadil o alguno de los ingredientes de VITAROS® Crema Tópica.
• Condiciones que pueden predisponer a priapismo, como anemia de células falciformes o drepanocitemia, trombocitopenia, policitemia o mieloma múltiple o leucemia.
• Anatomía anormal del pene como hipospadias severas, en pacientes con deformación anatómica del pene, como curvatura y en pacientes con uretritis y balanitis (inflamación/infección del glande del pene).
• Predisposición a trombosis venosa o que presenten síndrome de hiperviscosidad y que por lo tanto tengan un riesgo aumentado para priapismo (erección rígida que dure 4 o más horas).
• VITAROS® Crema Tópica no debe utilizarse en pacientes en los que la actividad sexual no es aconsejable como en hombres con condiciones cardiovasculares inestables o cerebrovasculares inestables.
• VITAROS® Crema Tópica no se debe utilizar para mantener relaciones sexuales con una mujer con potencial de embarazo a menos que la pareja utilice un condón como barrera.
• No usar en tratamientos de fertilidad asistida ni con planes reproductivos (planeando embarazarse).
• VITAROS® Crema Tópica no se debe utilizar para mantener relaciones sexuales con una mujer embarazada.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
No existen datos sobre el uso de VITAROS® Crema Tópica en mujeres embarazadas. La exposición indirecta a Alprostadil en mujeres es probablemente baja.
Los datos con dosis mayores de Alprostadil en animales muestran toxicidad reproductiva (ver la sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
Las mujeres embarazadas no deben ser expuestas a VITAROS® Crema Tópica.
Lactancia:
No se sabe si la exposición indirecta de mujeres lactando a Alprostadil VITAROS® Crema Tópica llevará a una excreción significativa en leche materna. Por lo tanto, no se recomienda la exposición a VITAROS® Crema Tópica en mujeres amamantando.
Fertilidad:
Se observó atrofia de túbulos seminíferos de los testículos en conejos machos después de dosis repetidas con formulaciones que contenían Alprostadil. No se sabe si VITAROS® Crema Tópica tiene un efecto sobre la fertilidad humana en hombres.
REACCIONES SECUNDARIAS Y ADVERSAS:
Los eventos adversos más comunes relacionados al fármaco reportados por pacientes durante los estudios clínicos fueron reacciones locales urogenitales transitorias en o cerca del sitio de aplicación, incluyendo ardor, dolor, comezón, hormigueo y eritema del pene después de la aplicación los cuales fueron de leve a moderado en intensidad y transitorios, durando de 1 a 2 horas. Estos eventos adversos locales fueron bien tolerados por muchos pacientes y fueron comparables entre dosis de Alprostadil.
Los eventos adversos más comúnmente reportados en el tratamiento con VITAROS® Crema Tópica se presentan en la siguiente tabla. (Muy común ≥ 1/10; Común ≥ 1/100, < 1/10; No común ≥ 1/1000, < 1/100; Raros ≥ 1/10000, < 1/1000; Muy raros < 1/10000).
El priapismo (una erección que dura más de 4 horas) es una condición seria que requiere de pronto tratamiento médico.
|
Clasificación órgano sistema (MedDRA) |
Frecuencia |
Reacción adversa |
|
Desórdenes del sistema nervioso |
No común |
Hiperestesia |
|
Desórdenes de los sistemas vasculares* |
No común |
Mareos Síncope Hipotensión |
|
Desórdenes de la piel y el tejido subcutáneo |
Común |
Erupción |
|
Desórdenes del tejido músculo esquelético y conectivo |
No común |
Dolor en extremidades |
|
Desórdenes renales y urinarios |
Común |
Dolor uretral |
|
No común |
Estenosis uretral Inflamación del tracto urinario |
|
|
Desórdenes del sistema reproductivo y de senos o mamas |
Común |
Ardor en el pene Dolor en el pene Eritema en el pene Dolor genital Incomodidad genital Eritema genital Aumento en la erección Prurito genital Edema en el pene Balanitis Hormigueo en el pene Palpitaciones en el pene Entumecimiento del pene En las parejas femeninas: Sensación de ardor vulvovaginal Vaginitis |
|
No común |
Comezón en el pene Erupciones genitales Dolor escrotal Plenitud genital Rigidez excesiva Pérdida de sensación del pene Erección prolongada/priapismo En las parejas femeninas: Prurito vulvovaginal |
|
|
Desórdenes generales y condiciones en el sitio de administración |
No común |
Dolor en el sitio de aplicación |
Poblaciones especiales:
No existe una clara indicación de que Alprostadil aumente el riesgo de eventos cardiovasculares diferentes a los efectos vasodilatadores, pero no puede excluirse que pacientes con enfermedades o factores de riesgo sobresalientes tengan un riesgo mayor en combinación con un aumento en la actividad física sexual que está asociada con el uso de Alprostadil.
Reporte de sospecha de reacciones adversas:
El reporte de sospecha de reacciones adversas después de la autorización del producto farmacéutico es importante. Permite continuar con el monitoreo del balance riesgo/beneficio del producto.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Alprostadil, DDAIP y VITAROS® Crema Tópica (incluyendo DDAIP) no han mostrado potencial genotóxico.
No se han conducido estudios de carcinogenicidad a largo plazo con Alprostadil o VITAROS® Crema Tópica.
La evaluación de carcinogenicidad del excipiente, DDAIP, no encontró formación de tumores con la administración tópica en ratones y subcutáneamente en ratas. En el modelo transgénico de ratón TgAC, la administración de DDAIP a una concentración de 1.0% y 2.5% (50 y 125 mg/kg/día) indujo papilomas en machos y hembras respectivamente. Este efecto no es probablemente relevante para humanos, ya que ésta es causada por el efecto de irritación.
Alprostadil no tiene efecto sobre el conteo de esperma o su morfología. Sin embargo, el excipiente DDAIP provocó atrofia de los túbulos seminíferos en los testículos de conejos cuando se administró localmente a una concentración del 5% (Y niveles de dosis de 2.5, 5 y 10 mg/kg/día). No se pudo analizar un efecto espermatotóxico y la relevancia para una posible reducción en la fertilidad masculina en humanos es por lo tanto desconocido. DDAIP administrado subcutáneamente en ratas no tuvo efecto en la fertilidad.
Alprostadil ha demostrado ser embriotóxico (disminución en el peso fetal) cuando se administra como un bolo subcutáneo en ratas preñadas a dosis bajas. Altas dosis resultaron en resorciones, número reducido de fetos vivos, aumento en las incidencias de variaciones viscerales y esqueléticas y malformaciones y toxicidad materna. La administración intravaginal de PGE1 en conejas preñadas resultó en no daño del feto. Por lo que no debe ser usado con fines de procrear o en Tratamientos de Reproducción Asistida (TRA).
Los estudios de toxicidad reproductiva para DDAIP fueron llevados a cabo después de la administración subcutánea a ratas y conejos. No se observaron efectos en ratas, pero en conejos la fetotoxicidad incluyó aumentos en las malformaciones vistas a dosis altas, que se debió probablemente a la toxicidad materna. No fueron evidentes efectos en el desarrollo post natal en ratas. Por lo que no debe ser usado con fines de procrear o en Tratamientos de Reproducción Asistida (TRA) ni exponer a mujeres embarazadas a VITAROS® Crema Tópica.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
No se realizaron estudios de interacción de farmacocinética y farmacodinámica con VITAROS® Crema Tópica. Con base en la naturaleza del metabolismo (ver “Farmacocinética”) las interacciones fármaco-fármaco son consideradas como improbables.
Inhibidores de la fosfodiesterasa-5 (PDE-5):
No se ha estudiado la seguridad y eficacia para VITAROS® Crema Tópica en combinación con otros tratamientos para la disfunción eréctil, especialmente para el tratamiento con inhibidores de Fosfodiesterasa-5 (PDE-5) o sildenafil, tadalafil y vardenafil. Por lo tanto, VITAROS® Crema Tópica no debe ser usada en combinación con inhibidores de la PDE-5. Puesto que ambos VITAROS® Crema Tópica y los inhibidores de PDE-5 tienen efectos cardiovasculares, no se puede excluir un aumento aditivo en el riesgo cardiovascular.
Implantes de pene; fármacos alfa bloqueadores; relajantes del músculo liso:
No se han llevado a cabo estudios de interacción con implantes de pene o relajantes del músculo liso como papaverina; fármacos usados para inducir erecciones como alfa bloqueadores (p. ej., fentolamina intracavernosa, thimoxamina). Existe un riesgo de priapismo (erección anormalmente prolongada y dolorosa) cuando se usa en combinación.
Simpaticomiméticos, descongestivos, Supresores del apetito:
No se han llevado a cabo estudios para VITAROS® Crema Tópica en combinación con simpaticomiméticos, descongestivos y supresores del apetito. Cuando se usan en combinación puede haber una reducción en el efecto de Alprostadil (inhibición farmacológica de inhibición).
Anticoagulantes; Inhibidores de agregación plaquetaria:
No se han llevado a cabo estudios de interacción para VITAROS® Crema Tópica en combinación con anticoagulantes e inhibidores de agregación plaquetaria. Cuando se usan en combinación puede haber un riesgo aumentado de sangrado uretral, hematuria.
Fármacos antihipertensivos y vasoactivos:
Los pacientes tratados concomitantemente con fármacos antihipertensivos y vasoactivos pueden mostrar un riesgo aumentado de hipotensión, especialmente en pacientes ancianos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
No se conocen a la fecha.
PRECAUCIONES GENERALES:
Priapismo:
Las erecciones prolongadas, con duración mayor a las 4 horas (priapismo), aunque raras, fueron observadas con el uso de alprostadil VITAROS® Crema Tópica. El priapismo fue observado en los dos estudios de 3 meses en un paciente (0.06%) y en el estudio de más de 6 meses en 5 pacientes (0.4%), incluyendo 4 (0.3%) en el estudio conducido con una dosis de 200 mcg y 1 paciente (0.1%) con la del grupo administrado con 300 mcg. Si el priapismo ocurre, el paciente debe buscar inmediatamente asistencia médica. Si no es tratado inmediatamente, el resultado puede ser daño permanente en tejido peneano y pérdida permanente de potencia.
Hipotensión y Síncope:
La hipotensión sintomática (mareos) y el síncope ocurrieron en un pequeño porcentaje de pacientes (6/1280, ó 0.5%) durante los estudios clínicos fase 3. Los pacientes deben ser prevenidos de realizar actividades como manejar o realizar actividades riesgosas tras la administración de Alprostadil Crema Tópica.
Insuficiencia Hepática:
La farmacocinética de alprostadil VITAROS® Crema Tópica no ha sido formalmente estudiada en pacientes con insuficiencia hepática.
Insuficiencia Renal:
No se han estudiado los parámetros farmacocinéticos de Alprostadil VITAROS® Crema Tópica en pacientes con insuficiencia renal.
Pacientes con Enfermedades Neurológicas:
No se han conducido estudios clínicos en pacientes con una historia de enfermedad neurológica o lesión espinal.
Precauciones de administración:
VITAROS® Crema Tópica debe ser aplicado de acuerdo con las instrucciones proporcionadas más adelante. La exposición inadvertida intrauretral puede resultar en ardor del pene o sensación de palpitación y dolor. La exposición intrauretral repetida de VITAROS® Crema Tópica a mayor plazo es desconocida.
Enfermedad de transmisión sexual:
Los pacientes deben ser informados de que VITAROS® Crema Tópica no ofrece protección contra el contagio de enfermedades transmitidas sexualmente. Los pacientes y parejas que usen VITAROS® Crema Tópica necesitan ser asesoradas acerca de medidas de protección que son necesarias para protegerse de la propagación de agentes transmitidos sexualmente, incluyendo al virus de inmunodeficiencia humana (VIH).
Eventos adversos en la pareja sexual:
Los profesionales de la salud deben alentar a sus pacientes de informar a sus parejas sexuales de que están usando VITAROS® Crema Tópica. Las parejas de los usuarios de VITAROS® Crema Tópica pueden experimentar eventos adversos, más comúnmente irritación vaginal. Por ello es recomendable el uso de un condón como barrera.
Los efectos de VITAROS® Crema Tópica en la mucosa oral y anal no han sido estudiados. Se debe usar un condón para el sexo oral (felación) o sexo anal.
Uso en parejas en edad fértil; Mujeres Embarazadas o en lactancia:
VITAROS® Crema Tópica no tiene propiedades anticonceptivas. Se recomienda que las parejas que usen VITAROS® Crema Tópica usen un método anticonceptivo adecuado si la pareja femenina se encuentra en edad fértil.
No existe información sobre los efectos en el embarazo temprano a los niveles recibidos de Alprostadil VITAROS® Crema Tópica por las parejas femeninas. Se debe usar un condón de barrera para el coito sexual con mujeres en edad reproductiva, mujeres embarazada o en lactancia.
Uso con condones de látex:
Sólo se investigaron condones basados en materiales de látex y el empleo de otros materiales pudiera no excluir el posible riesgo de ocurrencia de daño del condón.
Efectos en la habilidad de usar y manejar maquinaria.
No se han desarrollado estudios sobre los efectos de la capacidad de conducir y operar maquinaria. Si bien se han reportado mareos y síncope (desvanecimientos) raramente en los estudios clínicos con VITAROS® Crema Tópica, se recomienda que los pacientes eviten estas actividades, como manejar o hacer tareas riesgosas, donde se pudieran lesionar en caso de presentar un síncope dentro de 1 a 2 horas después de la administración de VITAROS® Crema Tópica.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de Administración: Tópica, meato uretral.
Dosis:
La dosis de VITAROS® es de 300 mcg aplicados en la punta del pene (meato).
VITAROS® Crema Tópica debe ser usado cuando sea necesario para lograr una erección. Cada dispensador individual de VITAROS® Crema Tópica es para una sola dosis y debe desecharse apropiadamente después de su uso.
El inicio del efecto es dentro de los 5 a 30 minutos después de la administración. La duración del efecto es de aproximadamente 1 a 2 horas. Sin embargo, la duración real variará de paciente a paciente. Cada paciente debe ser instruido por un profesional médico sobre la técnica correcta para la administración de VITAROS® Crema Tópica antes de la auto administración.
La frecuencia máxima de uso es no más de 2 a 3 veces por semana y solamente una vez cada periodo de 24 horas.
La dosis inicial debe ser recomendada por un médico. Una dosis inicial de 300 mcg de dosis puede ser considerada especialmente en pacientes con disfunción eréctil severa, co-morbilidad o falla de los inhibidores de PDE-5.
Los pacientes deben ser instruidos sobre la técnica apropiada de administración, se les debe proporcionar información sobre posibles efectos colaterales (como mareos, desmayos) y la necesidad de evitar operar maquinaria hasta que se observe su tolerancia al fármaco.
Técnica de administración:
Aplicar VITAROS® Crema Tópica en la punta del pene (meato) dentro de los 5 a 30 minutos antes de intentar el coito siguiendo las instrucciones que a continuación se mencionan:
1. Lavar sus manos antes de aplicar VITAROS® Crema Tópica.
2. VITAROS® se administra a través de un dispensador que contiene la dosis exacta para una sola aplicación.
3. Abrir completamente el sobre de aluminio tirando a lo largo del borde punteado.
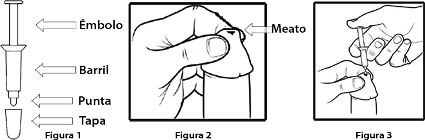
4. Retirar el dispensador del sobre de aluminio. Guardar el sobre para desechar el dispensador después de usar. El dispensador se encuentra compuesto por 4 partes que debe identificar: émbolo, barril, punta y tapa (vea figura 1).
5. Retirar la tapa de la punta del dispensador. Ver la Fig. 1.
6. Tomar la punta del pene con una mano y presione suavemente abriendo el orificio (meato) del pene. Ver la Fig. 2 (Nota: si usted no está circuncidado, primero retraiga y sujete la piel del prepucio antes de abrir el meato del pene).
7. Sujetar el dispensador entre sus dedos por encima del pene, como se indica en la figura 3 y dirija la punta del dispensador a la apertura del pene, por encima, sin introducir el aplicador en el pene.
8. Empujar el émbolo con el pulgar hasta que toda la crema sea expulsada del dispensador, sobre la abertura y la piel circundante. (Ver la Figura 3). Nota: No inserte la punta del dispensador dentro la apertura del pene.
9. Sujetar el pene en posición vertical, hacia arriba, por aproximadamente 30 segundos con la finalidad de permitir la penetración de la crema.
10. Cualquier exceso de crema por fuera del meato debe frotarse y distribuirse cuidadosamente en la piel circundante al sitio de aplicación con la punta del dedo. El exceso de crema variará de acuerdo con el paciente y es normal que la mitad de la dosis se encuentre circundante a la apertura del pene.
11. Reemplazar la tapa del dispensador y colocar en la bolsa abierta, doble y deseche como basura doméstica.
12. Lavar las manos después de aplicar VITAROS® Crema Tópica. La crema puede irritar los ojos.
13. No se emplee un segundo dispensador. Recuerde, cada dispensador contiene una dosis para una sola administración dentro de un periodo de 24 horas.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
No se ha reportado sobredosificación con VITAROS® Crema Tópica que requiera tratamiento. Las sobredosis con VITAROS® Crema tópica resulta en hipotensión, síncope, mareos, dolor en el pene y posible priapismo (erección rígida que dura más de 4 horas). El priapismo puede resultar en un empeoramiento permanente de la función eréctil. Los pacientes en que se sospeche sobredosis que desarrollen estos síntomas deben estar bajo supervisión médica hasta que se hayan solucionados los síntomas sistémicos o locales.
Si se presenta una erección prolongada que dure 4 horas o más, el paciente debe ser aconsejado para buscar ayuda médica. Se pueden tomar las siguientes acciones:
• El paciente debe reposar en posición supina o de lado. Aplicar alternativamente una bolsa de hielo, 2 minutos en cada ingle (esto puede causar la apertura refleja de las válvulas venosas). Si no se observa respuesta después de 10 minutos, discontinuar el tratamiento.
• Si este tratamiento no es efectivo y la erección rígida se extendiera más allá de las 6 horas, se debe llevar a cabo una aspiración del pene. Utilizando una técnica aséptica, insertar una aguja tipo mariposa en el cuerpo cavernoso y aspirar 20 a 50 mL de sangre. Esto puede producir la detumescencia del pene. Si fuera necesario, el procedimiento puede repetirse del lado contrario del pene.
• Si aún no se logra un tratamiento efectivo, se recomienda una inyección intracavernosa de fármacos α-adrenérgicos. A pesar de la usual contraindicación para la administración de vasoconstrictores en el pene, ésta no aplica en el tratamiento de priapismo; se debe actuar cuidadosamente cuando se decida realizar esta opción. Durante el procedimiento se debe monitorear continuamente la presión sanguínea y la frecuencia cardiaca. Se requiere de extrema precaución en pacientes con enfermedad coronaria, hipertensión no controlada, isquemia cerebral y en sujetos que reciben inhibidores de la monoamino oxidasa. En este último caso, se debe contar con las instalaciones adecuadas para manejar una crisis hipertensiva.
• Se debe preparar una solución de 200 mcg/mL de fenilefrina, e inyectar de 0.5 a 1.0 mL de la solución cada 5-10 minutos. Alternativamente, se debe usar una solución de 20 mcg/mL de adrenalina. De ser necesario, luego de esta administración puede realizarse una aspiración de sangre con aguja tipo mariposa (butterfly). La dosis máxima debe ser de 1 mg de fenilefrina , o 100 mcg de adrenalina (5 mL de solución).
• Como alternativa, se puede usar metaraminol, pero se debe notar que se han reportado crisis hipertensivas fatales. Si esto aún no es suficiente para resolver el priapismo, el paciente debe ser referido para su manejo quirúrgico inmediato.
PRESENTACIONES:
Caja con 1 dispensador en sobre individual e instructivo anexo.
Caja con 2 dispensadores en sobres individuales e instructivo anexo.
Caja con 4 dispensadores en sobres individuales e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese en refrigeración de 2°C-8°C.
No congelar.
Consérvese en el sobre original para protegerlo de la luz.
LEYENDAS DE PROTECCIÓN:
No ingerible. No congelar. Consérvese en el sobre original para protegerlo de la luz. Los sobres sin abrir deben mantenerse fuera del refrigerador por el paciente a una temperatura por debajo de 30°C por hasta 3 días antes de su uso. Al final de este periodo, el producto será desechado si no se usa. Su venta requiere receta médica. Literatura exclusiva para médicos. No se deje al alcance de los niños. Las mujeres embarazadas no deben exponerse a VITAROS®. No se recomienda el uso de VITAROS® durante la lactancia.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
safety.mailbox.mexico@ferring.com
Hecho en Canadá por:
Groupe Parima Inc.
4450 Cousens, Montreal, Quebec, H4S 1X6, Canadá
Para:
Ferring International Center SA
Chemin de la Vergognausaz 50, 1162 St-Prex, Suiza
Distribuido en México por:
FERRING, S.A. de C.V.
Av. Nemesio Diez Riega, Mz 2, Lote 15 No. 15
Parque Industrial Cerrillo II
C.P. 52000, Lerma, México, México
O
Hecho en Canadá por:
Groupe Parima Inc.
4450 Cousens, Montreal, Quebec, H4S 1X6, Canadá
Para:
Ferring International Center SA
Chemin de la Vergognausaz 50, 1162 St-Prex, Suiza
Acondicionado y Distribuido en México por:
FERRING, S.A. de C.V.
Av. Nemesio Diez Riega, Mz 2, Lote 15 No.15
Parque Industrial Cerrillo II
C.P. 52000, Lerma, México, México
Reg. Núm. 007M2017, SSA IV
173300415T0049