
XELTETRA-M
CLORHIDRATO DE MINOCICLINA
Cápsulas
1 Caja, 24 Cápsulas, 50 mg
1 Caja, 12 Cápsulas, 100 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada CÁPSULA contiene:
Clorhidrato de minociclina equivalente a 50, 100 mg, de minociclina base
Excipiente cbp 1 cápsula
INDICACIONES TERAPÉUTICAS:
El clorhidrato de minociclina está indicado en el tratamiento de las siguientes infecciones causadas por cepas sensibles de los siguientes microorganismos: Acné causado por Propionibacterium acnes, Linfogranuloma venéreo causado por Chlamydia trachomatis. Ricketssia sp. (fiebre manchada de las montañas Rocallosas, tifo epidémico y otras variedades de tifo, fiebre Q y otras rickettsiosis humanas). Infecciones del tracto respiratorio causadas por Mycoplasma pneumoniae. Psitacosis (ornitosis) causado por Chlamydia psittaci. Tracoma causado por Chlamydia tracomatis, aunque, según pruebas de inmunofluorescencia, el agente antiinfeccioso no siempre es eliminado. Conjuntivitis por inclusión causada por Chlamydia tracomatis.
Uretritis no gonocóccica, infecciones endocervical o rectal en adultos causadas por Ureaplasma urealyticum o Chlamydia tracomatis. Fiebre recurrente debida a Borrelia recurrentes. Chancroide causado por Haemophilus ducreyi. Plaga debida a Yersinia pestis. Tularemia debida a Francisella tularensis. Bartonelosis causada por Bartonella bacilliformis. Cólera causada por Vibrio cholerae. Infecciones en el feto causadas por Campylobacter fetos. Brucelosis secundaria a Brucella sp. (junto con estreptomicina).
Granuloma inguinal causado por Calymmatobacterium granulomatis. XELTETRA-M® está indicado en infecciones causadas por cepas susceptibles de los siguientes microorganismos gram negativos cuando las pruebas bacteriológicas indican una susceptibilidad apropiada al fármaco: Escherichia coli. Enterobacter aerogenes. Shigella sp. Especies de Acinetobacter.
Infecciones del tracto respiratorio causadas por Haemuphilus influenzae. Infecciones del tracto respiratorio y del tracto urinario causadas por especies de Klebsiella. XELTETRA-M® también está indicado para el tratamiento de las infecciones causadas por cepas susceptibles gram positivas: Infecciones del tracto respiratorio superior causadas por Streptococcus pneumoniae. Infecciones de la piel y tejidos blandos causadas por Staphylococcus aureus.
(Nota: la minociclina no es el medicamento de primera elección para el tratamiento de infecciones estafilocóccicas de cualquier tipo). Cuando la penicilina está contraindicada, el clorhidrato de minociclina es un tratamiento alternativo en las siguientes infecciones Uretritis no complicada en hombres debida a Neisseria gonorrhoeae y para el tratamiento de otras infecciones gonocóccicas. Infecciones en la mujer causadas por Neisseria gonorrhoeae. Meningitis causada por Neisseria meningitidis. Sífilis causada por Treponema pallidum y subespecies pallidum. Frambesia causadas por Treponema pallidum y subespecies pertenue. Listeriosis causada por Listeria monocytogenes. Antrax debida a Bacillus anthracis. Infección de Vincent causada por Fusobacterium fusiforme.
Actimomicosis causada por Actinomyces israelli. Infecciones causadas por Clastridium spp. XELTETRA-M® está también indicado para el tratamiento de portadores asintomáticos de Neisseria meningitidis para eliminar a los meningococos nasofaríngeos. Para que la utilidad del clorhidrato de minociclina en el tratamiento de los portadores asintomáticos de meningococos se pueda conservar, se debe establecer el estado de portador con base en procedimientos diagnósticos de laboratorio incluyendo serotipificación y pruebas de susceptibilidad. Se recomienda que el uso del clorhidrato de minociclina se reserve para situaciones en donde el riesgo para meningitis meningocóccica es alto. No se indica el uso del clorhidrato de minociclina en el tratamiento de una infección meningocóccica. En casos de colitis amibiana aguda, la minociclina puede ser un buen tratamiento adyuvante a los fármacos amebicidas. Aunque no se han realizado estudios de eficacia controlados, los datos clínicos limitados muestran que el uso de clorhidrato de minociclina en el tratamiento de infecciones por Mycobacterium marinum ha sido útil.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética: El clorhidrato de minociclina se absorbe rapidamente y casi por completo en el tracto gastrointestinal después de la administración oral. Se distribuye a casi todos los tejidos debido a su alto grado lipofílico. Estudios han demostrado que se puede encontrar al clorhidrato de minociclina en altas concentraciones en el tejido pulmonar y moco del hombre. Se metaboliza ampliamente y su vida media sérica es de aproximadamente 16 horas. En los pacientes con disfunción hepática la vida media sérica oscila entre 10.7 y 16.9 hrs. Principalmente se elimina en la bilis y una pequeña cantidad es recuperada en la orina en su forma activa. La cantidad de principio activo recuperado en las heces después de una administración oral se encuentra en un rango del 20-34%.
Farmacodinamia:
Microbiología: Las tetraciclinas son primariamente bacteriostáticas y se piensa que ejercen su efecto antimicrobiano mediante inhibición de la síntesis proteica.
XELTETRA-M® es una tetraciclina semisintética con espectro antibacteriano comparable con otras tetraciclinas, con actividad sobre una amplia variedad de microorganismos tanto grampositivos como gramnegativos. Es común que se presente una resistencia cruzada de organismos grampositivos y gramnegativos a las tetraciclinas. Casi todas las cepas de S. Pyogenes son resistentes al clorhidrato de minociclina. Por lo cual, el clorhidrato de minociclina no debe administrarse para enfermedades estreptocócicas a menos que el organismo haya demostrado ser susceptible. Porque muchas cepas de organismos gram positivos y gram negativos son resistentes a las tetraciclinas (ver Indicaciones), se recomienda realizar pruebas de susceptibilidad y cultivos.
CONTRAINDICACIONES:
XELTETRA-M® está contraindicado en personas con hipersensibilidad conocida a las tetraciclinas o a cualquier componente de la fórmula del producto, embarazo, lactancia, menores de 8 años, insuficiencia renal y hepática.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Los resultados de estudios en animales indican que las tetraciclinas atraviesan la barrera placentaria y se encuentran en tejidos fetales, pudiendo tener efecfos tóxicos sobre el feto en desarrollo (a menudo relacionados con retardo del desarrollo esquelético). También se ha observado evidencia de embriotoxicidad en animales tratados durante las fases tempranas del embarazo. XELTETRA-M® igual que otros antibióticos de la clase de las tetraciclinas atraviesan la placenta y pueden ocasionar daño fetal cuando se administra a la mujer embarazada. Se debe de advertir del daño potencial al feto a las mujeres que toman el clorhidrato de minociclina durante el embarazo o a la paciente que se embaraza durante la ingesta del medicamento. El uso de tetraciclinas durante el desarrollo dental (última mitad del embarazo) puede causar decoloración de los dientes. También se ha reportado hipoplasia del esmalte. Las tetraciclinas administradas durante el último trimestre forman un complejo estable con calcio en todo el esqueleto del feto humano. Se ha observado en niños prematuros a quienes se les han administrado tetraciclinas orales en dosis de 25 mg/kg cada 6 hrs disminución en el ritmo de crecimiento del peroné. Se ha mostrado que los cambios en el ritmo de crecimiento son reversibles cuando se discontinúa el medicamento. En el seguimiento post comercialización se han documentado anormalidades congénitas incluyendo acortamiento de las extremidades.
El clorhidrato de minociclina se excreta a través de la leche materna, por lo tanto, se debe tomar la decisión de descontinuar la lactancia o descontinuar la minociclina.
REACCIONES SECUNDARIAS Y ADVERSAS:
Las reacciones adversas se enlistan según la tabla de frecuencia de categorías CIOMS bajo las clases Medra de sistemas/órganos.
Común ≥ 1%.
Poco común ≥ 0.1% y < 1%.
Muy rara < 0.01%.
|
Trastornos generales y condiciones del sitio de administración |
|
|
Poco común |
Fiebre |
|
Muy rara |
Decoloración de las secreciones |
|
Trastornos del sistema linfático y hematopoyético |
|
|
Rara |
Eosinofilia, leucopenia neutropenia, trombocitopenia |
|
Muy raras |
Anemia hemolítica, pancitopenia |
|
Frecuencia indeterminada |
Agranulocitosis |
|
Trastornos cardiacos |
|
|
Muy rara |
Miocarditis, pericarditis |
|
Trastornos del oído y laberínticos |
|
|
Rara |
Alteración de la audición, tinnitus |
|
Trastornos endocrinos |
|
|
Muy rara |
Función tiroidea anormal, decoloración café negruzca de la tiroides |
|
Trastornos gastrointestinales |
|
|
Rara |
Diarrea, náusea, estomatitis, decoloración de los dientes incluyendo decoloración de los dientes del adulto. |
|
Muy rara |
Dispepsia, disfagia, hipoplasia del esmalte, enterocolitis, esofagitis, ulceración esofágica, glositis, pancreatitis, colitis pseudomembranosa. |
|
Frecuencia indeterminada |
Decoloración de la cavidad oral (incluyendo lengua, labios y encías) |
|
Trastornos hepatobiliaris |
|
|
Rara |
Elevación de las enzimas hepáticas, hepatitis |
|
Muy rara |
Colestasis intrahepática, insuficiencia hepática (incluyendo muertes), hiperbilirrubinemia, ictericia |
|
Frecuencia indeterminada |
Hepatitis autoinmune |
|
Trastornos del sistema inmune |
|
|
Rara |
Reacciones anafilácticas/anafilactoides (incluyendo shock), incluyendo muertes |
|
Frecuencia indeterminada |
Hipersensibilidad |
|
Trastornos del metabolismo y la nutrición |
|
|
Rara |
Anorexia |
|
Trastornos musculoesqueléticos, del tejido conectivo y hueso |
|
|
Rara |
Artralgia, síndrome parecido al lupus, mialgia |
|
Muy rara |
Artritis, decoloración del hueso, exacerbación del lupus eritematoso sistémico, rigidez y edema de las articulaciones |
|
Trastornos del sistema nervioso |
|
|
Común |
Mareo |
|
Rara |
Cefalea, hipoestesia, parestesia, pseudotumor, cerebral, vértigo |
|
Muy rara |
Abombamiento de la fontanela |
|
Frecuencia indeterminada |
Convulsiones, sedación |
|
Trastornos renales y urinarios |
|
|
Rara |
Aumento de BUN |
|
Muy rara |
Insuficiencia renal aguda, nefritis intersticial |
|
Trastornos del sistema reproductivo y mama |
|
|
Muy rara |
Balanitis |
|
Trastornos respiratorios, torácicos y mediastinales |
|
|
Rara |
Tos, disnea |
|
Muy rara |
Broncoespasmo, exacerbación del asma, eosinofilia pulmonar. |
|
Frecuencia indeterminada |
Pneumonitis |
|
Trastornos de piel y tejido subcutáneo |
|
|
Rara |
Alopecia, eritema multiforme, eritema nodoso, erupción fija por medicamentos, hiperpigmentación de la piel, fotosensibilidad, prurito, erupciones y urticaria |
|
Trastornos de piel y tejido subcutáneo |
|
|
Muy rara |
Angioedema, dermatitis exfoliativa, hiperpigmentación de uñas, Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, vasculitis |
|
Infecciones e infestaciones |
|
|
Muy rara |
Candidiasis oral y anogenital, vulvovaginitis |
Durante el posmercadeo, ha habido reportes de carcinoma de tiroides en pacientes que reciben terapia con minociclina. No se ha establecido una relación causal entre el uso de minociclina y el carcinoma de tiroides. Se han reportado los siguientes síndromes. En algunos casos involucrando estos síndromes se reportaron muertes. Igual que con otras reacciones adversas serias, si se reconoce cualquiera de estos síndromes, el medicamento deberá de suspenderse inmediatamente. Síndrome de hipersensibilidad que consiste en una reacción cutánea (como rash o dermatitis exfoliativa) eosinofilia y una o más de las siguientes: hepatitis, neumonitis, nefritis, miocarditis, pericarditis. Pueden presentarse fiebre y linfadenopatías. Síndrome parecido al lupus que consiste en la presencia de anticuerpos. Antinucleares positivos, artralgias, artritis, rigidez o edema de articulaciones; y una o más de las siguientes manifestaciones: fiebre, mialgia, hepatitis rash vasculitis.
Síndrome de tipo Enfermedad del suero que consiste en fiebre, urticaria o rash, artralgias, artritis, rigidez o edema de articulaciones. Puede presentarse eosinofilia.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Estudios de tumorigenicidad a largo plazo por la administración diaria de clorhidrato de minociclina en ratas revelaron evidencia de producción de tumor tiroideo. También se ha encontrado que el clorhidrato de minociclina causa decoloración de la glándula tiroides en animales (ratas, ratones, perros y monos) y produce hiperplasia tiroidea en ratas y perros.
Además, existe evidencia de actividad oncogénica en estudios con ratas con un antibiótico relacionado (oxitetraciclina) (por ejemplo, tumores adrenales y pituitarios). A pesar de que no se han realizado estudios de mutagenicidad con el clorhidrato de minociclina, se han obtenido resultados positivos en estudio in vitro en células mamíferas para antibióticos relacionados (clorhidrato de tetraciclina y oxitetraciclina). Existen estudios que han demostrado que el clorhidrato de minociclina altera la fertilidad en ratas macho.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Se ha demostrado que las tetraciclinas disminuyen la actividad de la protrombina en plasma. Una terapia anticoagulante concomitante puede requerir reducir la dosis de los anticoagulantes. Los medicamentos bacteriostáticos pueden interferir con la acción bactericida de la penicilina.
Evitar administrar medicamentos de la clase de las tetraciclinas en conjunto con la penicilina. El uso concomitante de anticonceptivos orales y tetraciclina puede reducir la eficacia de losanticonceptivos. La absorción de las tetraciclinas se altera con los antiácidos que contengan aluminio, calcio o magnesio. La absorción de clorhidrato de minociclina se altera con las preparaciones que contengan hierro. La absorción del clorhidrato de minociclina se altera con las comidas, leche y otros productos lácteos. Se debe evitar la administración de isotretinoína u otros retinoides sistémicos o retinol poco antes, durante y poco después de la terapia con clorhidrato de minociclina. Cada uno de estos agentes usados de manera independiente ha sido asociado con pseudotumor cerebral. Incremento de riesgo de ergotismo cuando se administran alcaloides de la ergotamina o sus derivados junto con tetraciclinas.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: En tratamientos a largo plazo deberán monitorearse las funciones hematopoyéticas hepáticas y renales. Pueden ocurrir elevaciones falsas de los niveles urinarios de catecolaminas debido a interferencia con las pruebas de fluorescencia.
PRECAUCIONES GENERALES: Han ocurrido otros eventos serios muy raros con el clorhidrato de minociclina incluyendo el síndrome de Stevens-Johnson y necrolisis epidérmica tóxica (ver eventos adveros). Se debe descontinuar el clorhidrato de minociclina si se sospecha cualquiera de estas reacciones cutáneas serias. Se ha reportado con el uso de tetraciclinas la presencia de pseudotumor cerebral (hipertensión intracraneana benigna). Las manifestaciones clínicas habituales son cefalea y visión borrosa. Se ha reportado con el uso de tetraciclinas en infantes el abombamiento de fontanelas. Ambas condiciones y sus síntomas relacionados usualmente se resuelven al descontinuar la administración de tetraciclinas; sin embargo, la posibilidad de secuelas permanentes existe. Se ha observado fotosensibilidad en algunos individuos que toman tetraciclinas. Se debe advertir a los pacientes que mientras estén ingiriendo tetraciclinas deben de evitar la luz solar directa ya que puede presentarse una reacción exagerada de quemadura solar por exposición a la luz solar.
Uso en pacientes con insuficiencia hepática: Se ha reportado hepatotoxicidad con la ingesta de clorhidrato de minociclina, por lo tanto, debe de usarse con mucha cautela en pacientes con insuficiencia hepática y cuando se usa junto con otros medicamentos hepatotóxicos.
Uso en pacientes con insuficiencia renal: La acción anti-anabólica de las tetraciclinas puede causar un incremento en la concentración sérica de nitrógeno ureico (BUN). En pacientes con una insuficiencia renal significativa, los niveles séricos altos de tetraciclina pueden llevar a azotemia, hiperfosfatemia y acidosis. Si existe insuficiencia renal, aún las dosis orales comunes pueden llevar a una acumulación excesiva sistémica del fármaco y a una posible toxicidad hepática. En pacientes con insuficiencia renal, la dosis diaria definida no deberá exceder 200 mg en 24 horas. Monitoreo de laboratorio: Se deberán de realizar evaluaciones periódicas por medio de exámenes. de laboratorio del funcionamiento de los órganos incluyendo el hematopoyético, renal y hepático. Uso pediátrico: El clorhidrato de minociclina no se recomienda para usarse en niños menores de 8 años de edad a menos que los beneficios esperados con la terapia pesen más que los riesgos.
Uso en pacientes geriátricos: Los estudios clínicos realizados con el clorhidrato de minociclina no incluyeron un número suficiente de sujetos de edad 65 años o mayores para poder determinar si su respuesta era diferente a la de sujetos más jóvenes. La selección de la dosis para un paciente geriátrico debe de ser cuidadosa, usualmente se inicia con el rango inferior de la dosis calculada dado que existe en estos pacientes la alta frecuencia de Trastornos del sistema hepático, renal y cardiaco, enfermedades concomitantes e ingesta de otras terapias medicamentosas.
Efectos sobre la capacidad para conducir maquinaria: Los pacientes que reciben XELTETRA-M® deben de tener precaución al conducir un vehículo o al estar usando maquinaria peligrosa. Efectos sobre el SNC, incluyendo mareo, hipotensión postural o vértigo han sido reportados con el uso del clorhidrato de minociclina. Estos síntomas pueden desaparecer durante el tratamiento y usualmente desaparecen cuando el medicamento se descontinúa.
Advertencias:
Pocas veces, se han asociado a la administración de clorhidrato de minociclina, reacciones anafilácticas/anafilactoides incluyendo shock y muertes. (Ver Reacciones adversas).
XELTETRA-M® como cualquier otro antibiótico del grupo de las tetraciclinas, puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos del grupo de las tetraciclinas durante el desarrollo dental (última mitad del embarazo, infancia y niñez hasta los 8 años de edad), puede causar decoloración permanente de los dientes (amarillo-gris-café). Esta reacción adversa es más común durante el uso prolongado del medicamento, pero también se ha observado luego de tratamientos cortos repetidos.
También se ha reportado hipoplasia del esmalte dental. Las tetraciclinas no deben de usarse durante el desarrollo dental a menos que el beneficio esperado sea mayor que los riesgos.
DOSIS Y VÍA DE ADMINISTRACIÓN: La duración del tratamiento debe ser guiada por la severidad de la infección y la evolución clínica y bacteriológica del paciente.
Adultos: La dosis oral usual es de 200 mg inicialmente, seguida de una dosis de 100 mg cada 12 horas. El total de la dosis diaria definida no debe exceder de 400 mg en 24 horas. En el tratamiento del acné, la dosis recomendada es de 100 mg diarios administrados dos veces al día. En el tratamiento de infecciones gonocócicas no complicadas u otras infecciones como uretritis y ano-rectales, la dosis oral inicial es de 200 mg, seguida de 100 mg cada 12 horas por un mínimo de 4 días. En el tratamiento de uretritis gonocócica no complicada en hombres, la dosis recomendada es de 100 mg cada 12 horas por 5 días. En el tratamiento de la sífilis, la dosis usual de clorhidrato de minociclina deberá ser administrada por un periodo de 10 a 15 días. En el tratamiento del estado portador meningocócico, la dosis recomendada es 100 mg cada 12 horas por 5 días.
Infecciones por Micobacterium marinum: Aunque la dosis óptima no ha sido establecida, 100 mg cada 12 horas por 6 u 8 semanas pueden ser utilizados con muy buenos resultados en un número limitado de casos. En el tratamiento de infección rectal, endocervical o uretral no complicada en adultos causada por Chlamydia trachomatis o Ureplasma urealyticum, la dosis recomendada es de 100 mg cada 12 horas por al menos 7 días. Para disminuir el riesgo de irritación o ulceración esofágica, las cápsulas deben ingerirse con suficiente cantidad de agua (por lo menos 1 vaso).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Los eventos adversos que más comúnmente se observan en un caso de sobredosis son mareo, náusea y vómito. No se conoce un antídoto específico para el clorhidrato de minociclina. En el caso de sobredosis deberá de descontinuarse la medicación, proporcionar tratamiento sintomático e instituir medidas de soporte. El clorhidrato de minociclina no se remueve en cantidades significativas con hemodiálisis o diálisis peritoneal.
DESCRIPCIÓN: XELTETRA-M® es un agente antiinfeccioso que pertenece a la clase de las tetraciclinas. El nombre químico es clorhidrato de 4-7,bis(dimetilamino)-1,4,4a,5a,6,11,12a-octahidro-3, 10,12,12a-tetrahidroxi-1,11-dioxo-2-naftacenecarboxamida. El clorhidrato de minociclina es un polvo amarillo cristalino relativamente soluble o soluble en agua, poco soluble en alcohol e insoluble en cloroformo y éter. Se disuelve en soluciones alcalinas, hidróxidos y carbonatos. XELTETRA-M® es un derivado semisintético de la tetraciclina. Su estructura química es:
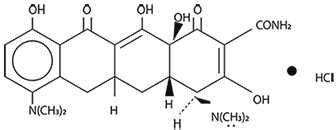
PRESENTACIONES:
Caja con 24 cápsulas de 50 mg cada una en envase de burbuja.
Caja con 12 cápsulas de 1OO mg cada una en envase de burbuja.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a no más de 30ºC y en lugar seco. Protéjase de la luz, humedad y calor excesivo.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para el profesional de la salud. Su venta requiere receta médica. No se deje al alcance de los niños. No se use en el embarazo y la lactancia. En pedacimiento renales o hepáticos deberá usarse este producto bajo estricto control médico. No se administre a menores de 8 años. ANTIBIÓTICO. El uso incorrecto de este producto puede causar resistencia bacteriana.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx.
Reg. Núm. 203M2018, SSA IV
® Marca registrada
CENTRO INTERNACIONAL
DE COSMIATRÍA, S.A.P.I. de C.V.