
ZIENT
EZETIMIBA
Tabletas
1 Caja, 7 Tabletas, 10 mg
1 Caja, 10 Tabletas, 10 mg
1 Caja, 14 Tabletas, 10 mg
1 Caja, 21 Tabletas, 10 mg
1 Caja, 28 Tabletas, 10 mg
1 Caja, 30 Tabletas, 10 mg
1 Caja, 60 Tabletas, 10 mg
1 Caja, 7 Tabletas, 10 mg
1 Caja, 10 Tabletas, 10 mg
1 Caja, 14 Tabletas, 10 mg
1 Caja, 21 Tabletas, 10 mg
1 Caja, 28 Tabletas, 10 mg
1 Caja, 30 Tabletas, 10 mg
1 Caja, 60 Tabletas, 10 mg
III. FORMA FARMACÉUTICA Y FORMULACIÓN
ZIENT (ezetimiba) pertenece a una nueva clase de compuestos reductores de los lípidos que inhiben selectivamente la absorción intestinal de colesterol y de esteroles vegetales relacionados con él.
Cada TABLETA contiene:
Ezetimiba 10 mg
Excipiente cbp 1 tableta
El nombre químico de ZIENT (ezetimiba) es 1-(4-fluorofenil)-3(R)-[3-(4-fluorofenil)-3(S)-hidroxipropil]-4(S)- (4-hidroxifenil)-2-acetidinona. Su fórmula empírica es C24H21F2NO3, tiene un peso molecular de 409.4, y su fórmula estructural es:
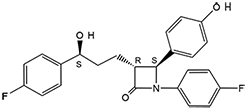
La ezetimiba es un polvo cristalino blanco, libremente soluble a muy soluble en etanol, metanol y acetona y prácticamente insoluble en agua. Tiene un punto de fusión de unos 163 °C, y es estable a la temperatura ambiente.
Ingredientes activos:
Cada comprimido de ZIENT para administración por vía oral contiene 10 mg de ezetimiba.
Ingredientes inactivos:
Cada comprimido con 10 mg contiene croscarmelosa sódica, lactosa monohidratada, estearato de magnesio, celulosa microcristalina, povidona y laurilsulfato de sodio.
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 580M2002 SSA IV
IV. INDICACIONES TERAPÉUTICAS
Hipercolesterolemia primaria
Administrado con un inhibidor de la HMG-CoA reductasa (estatina) o solo, ZIENT está indicado como tratamiento adjunto a la dieta para disminuir las concentraciones elevadas de colesterol total, colesterol de las lipoproteínas de baja densidad (C-LDL), apolipoproteína B (Apo B), triglicéridos (TG) y colesterol de las lipoproteínas de no alta densidad (C-no-HDL) y para aumentar el colesterol de las lipoproteínas de alta densidad (C-HDL) en los pacientes adultos y adolescentes (de 10 hasta 17 años de edad) con hipercolesterolemia primaria (familiar heterocigótica y no familiar).
ZIENT, administrado en combinación con fenofibrato, está indicado como tratamiento adjunto a la dieta para la reducción de concentraciones elevadas de colesterol total, C-LDL, Apo B y colesterol no-HDL en pacientes adultos con hiperlipidemia mixta.
Prevención de Eventos Cardiovasculares Mayores en la Enfermedad Renal Crónica
ZIENT, administrado con simvastatina, está indicado para reducir el riesgo de eventos cardiovasculares mayores, en pacientes con enfermedad renal crónica.
Hipercolesterolemia familiar homocigótica
Administrado con una estatina, ZIENT está indicado para disminuir las concentraciones elevadas de colesterol total y de C-LDL en pacientes adultos y adolescentes (10 a 17 años de edad) con hipercolesterolemia familiar homocigótica, los cuales pueden recibir también tratamientos adjuntos (por ejemplo, aféresis de LDL).
Sitosterolemia homocigótica (fitosterolemia)
ZIENT está indicado para disminuir las concentraciones elevadas de sitosteroles y de campesterol en los pacientes con sitosterolemia familiar homocigótica.
V. FARMACOCINÉTICA Y FARMACODINAMIA
MECANISMO DE ACCIÓN
ZIENT es activo y potente por vía oral, con un particular mecanismo de acción que difiere del de otras clases de compuestos reductores del colesterol (como las estatinas, los secuestradores de ácidos biliares [resinas], los fibratos y los estanoles vegetales). El objetivo molecular de la ezetimiba es el transportador de esterol, Niemann-PickC1-Como 1 (NPC1L1), el cual es el responsable de la absorción intestinal del colesterol y fitoesteroles.
La ezetimiba se fija al borde en cepillo de las células del intestino delgado e inhibe la absorción del colesterol, por lo que disminuye la llegada de colesterol intestinal al hígado. Como consecuencia, disminuye la reserva hepática de colesterol y aumenta la depuración de colesterol de la sangre. La ezetimiba no aumenta la excreción de ácidos biliares (como los secuestradores de ácidos biliares) ni inhibe la síntesis de colesterol en el hígado (como las estatinas).
En un estudio clínico de dos semanas en 18 pacientes hipercolesterolémicos, ZIENT inhibió 54% la absorción de colesterol intestinal en comparación con un placebo. Al inhibir la absorción de colesterol intestinal, la ezetimiba disminuye la llegada de colesterol al hígado. Las estatinas disminuyen la síntesis hepática de colesterol, y juntos, esos dos mecanismos distintos proporcionan una disminución complementaria del colesterol. Administrado con una estatina, ZIENT disminuye el colesterol total, el C- LDL, la Apo B, C-no-HDL y los triglicéridos y aumenta el C-HDL en los pacientes con hipercolesterolemia más que uno u otro medicamento solo. La administración de ZIENT con fenofibrato es eficaz para mejorar el colesterol total sérico, C- LDL, Apo B, TG, C-HDL y colesterol no-HDL en pacientes con hiperlipidemia mixta.
Los estudios clínicos demuestran que las concentraciones elevadas de colesterol total, C-LDL y Apo B (la principal proteína de las LDL) favorecen la aterosclerosis humana. Además, las concentraciones disminuidas de C-HDL también se asocian con el desarrollo de aterosclerosis. Los estudios epidemiológicos han revelado que la morbilidad y la mortalidad cardiovasculares varían en proporción directa con las concentraciones de colesterol total y de C-LDL y en proporción inversa con las de C-HDL. Como las LDL, las lipoproteínas ricas en colesterol y triglicéridos, como las de muy baja densidad (VLDL), las de densidad intermedia (IDL) y sus residuos, también pueden favorecer el desarrollo de la aterosclerosis.
Se hizo una serie de estudios preclínicos para determinar la selectividad de la ezetimiba para inhibir la absorción de colesterol. Ezetimiba inhibió la absorción del colesterol marcado con 14C, sin ningún efecto sobre la absorción de triglicéridos, ácidos grasos, ácidos biliares, progesterona, etinilestradiol, o las vitaminas liposolubles A y D.
Farmacocinética
Absorción
Tras su administración por vía oral, la ezetimiba es absorbida rápidamente y transformada extensamente por conjugación en un glucurónido fenólico con actividad farmacológica (glucurónido de ezetimiba). El glucurónido de ezetimiba alcanza concentraciones plasmáticas máximas promedio (Cmáx) en una a dos horas, y la ezetimiba en cuatro a doce horas. No se puede determinar la biodisponibilidad absoluta de la ezetimiba, por ser ésta prácticamente insoluble en medios acuosos apropiados para ser inyectados.
La administración concomitante de alimentos (altos en grasas o sin grasas) no tuvo ningún efecto sobre la biodisponibilidad de la ezetimiba administrada por vía oral en forma de comprimidos de ZIENT con 10 mg. ZIENT se puede administrar con o sin alimentos.
Distribución
Se unen a las proteínas plasmáticas humanas 99.7% de la ezetimiba y 88 a 92% del glucurónido de ezetimiba.
Metabolismo
La ezetimiba es metabolizada principalmente en el intestino delgado y en el hígado por conjugación con el ácido glucurónico (una reacción de fase II), y después es excretada con la bilis. En todas las especies estudiadas se ha observado un metabolismo oxidativo mínimo (una reacción de fase I). La ezetimiba y el glucurónido de ezetimiba son las principales formas del medicamento que se detectan en el plasma; constituyen 10 a 20% y 80 a 90%, respectivamente, del total en el plasma. Ambas formas son eliminadas lentamente del plasma, con indicios de un reciclamiento enterohepático significativo. La vida media de la ezetimiba y de su glucurónido es de 22 horas aproximadamente.
Eliminación
Tras la administración oral de 20 mg de 14C-ezetimiba a personas, la ezetimiba total representó aproximadamente 93% de la radiactividad total en el plasma. En un periodo de diez días se recuperó aproximadamente 78% de la radiactividad en las heces y 11% en la orina. A las 48 horas, no hubo radiactividad detectable en el plasma.
Características en grupos especiales de pacientes
Niños
La absorción y el metabolismo de la ezetimiba son similares en los niños, los adolescentes (10 a 18 años) y los adultos. Basándose en la ezetimiba total, no hay diferencias farmacocinéticas entre los adolescentes y los adultos. No hay datos farmacocinéticos disponibles en niños menores de diez años.
Pacientes de edad avanzada
Las concentraciones plasmáticas de ezetimiba total son aproximadamente el doble en los pacientes de edad avanzada (≥65 años) que en pacientes más jóvenes (de 18 a 45 años). La disminución del C-LDL y el perfil de seguridad son similares en los de edad avanzada y en los jóvenes tratados con ZIENT, por lo que no es necesario hacer ningún ajuste de la dosificación en los de edad avanzada.
Insuficiencia hepática
Después de una sola dosis de 10 mg de ezetimiba, el promedio del área bajo la curva (ABC) de ezetimiba total fue aproximadamente 1.7 veces mayor en los pacientes con insuficiencia hepática leve (puntuación de Child-Pugh de 5 o 6) que en los sujetos sanos. En un estudio con dosis múltiples (10 mg diarios) durante 14 días en pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9), el promedio de ABC de ezetimiba total fue aproximadamente cuatro veces mayor los Días 1 y 14 que en los sujetos sanos. No es necesario ajustar la dosificación en los pacientes con insuficiencia hepática leve. Debido a que se desconocen los efectos de la exposición aumentada a la ezetimiba en los pacientes con insuficiencia hepática moderada o grave (puntuación de Child-Pugh mayor de 9), no se recomienda tratar con ezetimiba a esos pacientes (véase VII. PRECAUCIONES GENERALES).
Insuficiencia renal
En ocho pacientes con enfermedad renal grave (promedio de depuración de la creatinina ≤30 mL/min/1.73 m2), después de una sola dosis de 10 mg de ezetimiba, el promedio del ABC de ezetimiba total fue aproximadamente 1.5 veces mayor que en nueve sujetos sanos. Ese resultado no se considera clínicamente importante. No es necesario ajustar la dosificación en los pacientes con deterioro renal.
En otro paciente de ese estudio (con trasplante renal y recibiendo varios medicamentos, incluyendo ciclosporina), la exposición a la ezetimiba total fue 12 veces mayor.
Sexo
Las concentraciones plasmáticas de ezetimiba total son ligeramente mayores (menos de 20%) en las mujeres que en los hombres. La disminución del C-LDL y el perfil de seguridad son similares en los hombres y en las mujeres tratados con ezetimiba, por lo que no es necesario hacer ningún ajuste de la dosificación según el sexo del paciente.
Raza
Basándose en un meta-análisis de estudios farmacocinéticos, no hubo diferencias farmacocinéticas entre las personas de raza negra y las de raza blanca.
ESTUDIOS CLÍNICOS
Hipercolesterolemia primaria
Monoterapia
En dos estudios multicéntricos de 12 semanas, doble ciego y controlados con placebo en 1,719 pacientes con hipercolesterolemia primaria, 10 mg diarios de ZIENT disminuyeron significativamente el colesterol total, el C-LDL, la Apo B, C-no-HDL y los triglicéridos y aumentaron el C-HDL significativamente en comparación con el placebo (Tabla 1). El C-LDL disminuyó en todos los grupos de edad, sexo, raza y concentración basal. Además, ZIENT no tuvo ningún efecto sobre las concentraciones plasmáticas de las vitaminas liposolubles A, D y E ni sobre el tiempo de protrombina, ni alteró la producción de corticosteroides.
Tabla 1. Promedios de Respuesta a ZIENT en Pacientes con Hipercolesterolemia Primaria (Cambio % Promedio del valor Basal)
|
Grupo de tratamiento |
N |
C total |
C-LDL |
Apo B |
C-no-HDL |
TGa |
C-HDL |
|
|
Estudio 1 |
Placebo |
205 |
+1 |
+1 |
-1 |
+1 |
-1 |
-1 |
|
ZIENT |
622 |
-12 |
-18 |
-15 |
-16 |
-7 |
+1 |
|
|
Estudio 2 |
Placebo |
226 |
+1 |
+1 |
-1 |
+2 |
+2 |
-2 |
|
ZIENT |
666 |
-12 |
-18 |
-16 |
-16 |
-9 |
+1 |
|
|
Datos conjuntos de los estudios 1 y 2 |
Placebo |
431 |
0 |
+1 |
-2 |
+1 |
0 |
-2 |
|
ZIENT |
1,288 |
-13 |
-18 |
-16 |
-16 |
-8 |
+1 |
a Triglicéridos: Mediana del cambio % desde el valor inicial.
Coadministración con una estatina
Inicio de ZIENT al mismo tiempo que una estatina
En cuatro estudios multicéntricos, doble ciego y controlados con placebo de 12 semanas de duración en 1,187 pacientes con hipercolesterolemia, se administraron 10 mg diarios de ZIENT solo o con diversas dosis de atorvastatina, simvastatina, pravastatina o lovastatina. En general, el aumento del grado de disminución del C-LDL fue independiente de la dosis o de la estatina específica empleada. Además, la disminución del C- LDL obtenida con la co-administración de ZIENT con la menor dosis ensayada de cualquiera de las estatinas (10 mg) fue similar o mayor que la obtenida con la mayor dosis ensayada de la respectiva estatina administrada sola (Tabla 2).
Tabla 2. Cambio porcentual promedio desde el nivel basal, de la concentración plasmática de C-LDL calculada, obtenido con ZIENT y estatinas
|
Estudio con atorvastatina |
Estudio con simvastatina |
Estudio con pravastatina |
Estudio con lovastatina |
|
|
Placebo |
+4 |
-1 |
-1 |
0 |
|
ZIENT |
-20 |
-19 |
-20 |
-19 |
|
10 mg de estatina |
-37 |
-27 |
-21 |
-20 |
|
ZIENT + 10 mg de estatina |
-53 |
-46 |
-34 |
-34 |
|
20 mg de estatina |
-42 |
-36 |
-23 |
-26 |
|
ZIENT + 20 mg de estatina |
-54 |
-46 |
-40 |
-41 |
|
40 mg de estatina |
-45 |
-38 |
-31 |
-30 |
|
ZIENT + 40 mg de estatina |
-56 |
-56 |
-42 |
-46 |
|
80 mg de estatina |
-54 |
-45 |
- |
- |
|
ZIENT + 80 mg de estatina |
-61 |
-58 |
- |
- |
|
Datos conjuntos con todas las dosis de estatina |
-44 |
-36 |
-25 |
-25 |
|
Datos conjuntos con todas las dosis de ZIENT + estatina |
-56 |
-51 |
-39 |
-40 |
En un análisis conjunto de todas las dosis de ZIENT + estatina, ZIENT tuvo un efecto beneficioso sobre el colesterol total, la Apo B, C-no-HDL, los triglicéridos y el C-HDL (Tabla 3).
Tabla 3. Análisis conjunto del Cambio % Promedio de las Concentraciones Basales de Colesterol total, Apo B, C-no-HDL, Triglicéridos y C-HDL
|
Colesterol total |
Apo B |
C-no-HDL |
Triglicéridosa |
C-HDL |
|
|
ZIENT + atorvastatina |
-41 |
-45 |
-52 |
-33 |
+7 |
|
Atorvastatina sola |
-32 |
-36 |
-41 |
-24 |
+4 |
|
ZIENT + simvastatina |
-37 |
-41 |
-47 |
-29 |
+9 |
|
Simvastatina sola |
-26 |
-30 |
-34 |
-20 |
+7 |
|
ZIENT + pravastatina |
-27 |
-30 |
-36 |
-21 |
+8 |
|
Pravastatina sola |
-17 |
-20 |
-23 |
-14 |
+7 |
|
ZIENT + lovastatina |
-29 |
-33 |
-38 |
-25 |
+9 |
|
Lovastatina sola |
-18 |
-21 |
-23 |
-12 |
+4 |
a Mediana del cambio porcentual
Adición de ZIENT al tratamiento en curso con una estatina
En un estudio multicéntrico, doble ciego y controlado con placebo de ocho semanas de duración, 769 pacientes con hipercolesterolemia que ya estaban recibiendo monoterapia con una estatina y cuya concentración de C-LDL no había llegado a la meta establecida en el Programa Nacional de Educación sobre el Colesterol de Estados Unidos (100 a 160 mg/dL, dependiendo de las características iniciales) fueron distribuidos al azar para recibir 10 mg diarios de ZIENT o un placebo añadidos a su tratamiento con la estatina.
Entre los pacientes que no habían alcanzado la meta de C-LDL durante el tratamiento con la estatina sola (~82%), al final del estudio sí la alcanzaron 72% de los que recibieron ZIENT y 19% de los que recibieron el placebo.
En comparación con el placebo, ZIENT añadido al tratamiento previo con la estatina significativamente disminuyó el colesterol total, el C-LDL, la Apo B, C-no-HDL y los triglicéridos y aumentó el C-HDL (Tabla 4). Las disminuciones del C-LDL al añadir ZIENT fueron consistentes con todas las estatinas.
Tabla 4. Promedio de respuesta a la Adición de ZIENT al Tratamiento previo con una Estatinaa en Pacientes con Hipercolesterolemia (Cambio % Promedio del valor Basal)
|
Tratamiento (Dosis Diaria) |
N |
C total |
C-LDL |
Apo B |
C-no-HDL |
TGb |
C-HDL |
|
Estatina previa + placebo |
390 |
-2 |
-4 (-6 mg/dLc) |
-3 |
-3 |
-3 |
+1 |
|
Estatina previa + ZIENT |
379 |
-17 |
-25 (-36 mg/dLc) |
-19 |
-23 |
-14 |
+3 |
a Porcentaje de pacientes que recibieron cada estatina: atorvastatina 40%, simvastatina 31%, otras 29% (pravastatina, fluvastatina, cerivastatina, lovastatina)
b Mediana del cambio porcentual del valor basal
c Cambio del valor basal de C-LDL (138 mg/dL en el grupo de estatina + ZIENT y 139 mg/dL en el grupo de estatina + placebo)
El valor mediano de proteína C reactiva disminuyó 10% con la adición de ZIENT a la estatina, y 0% con la adición del placebo, con respecto al valor basal.
En un estudio multicéntrico doble ciego de 14 semanas se distribuyó al azar a 621 pacientes con hipercolesterolemia que tenían más de 130 mg/dL de C-LDL y estaban tomando 10 mg diarios de atorvastatina para recibir 20 mg de atorvastatina o 10 mg de ZIENT además de los 10 mg de atorvastatina. La dosis diaria de atorvastatina se podía aumentar hasta los 80 mg en el grupo de atorvastatina y hasta los 40 mg en el grupo de atorvastatina más ZIENT en los pacientes que no llegaban a la meta de concentración de C-LDL (<100 mg/dL). El promedio inicial de C-LDL era de 187 mg/dL, y aproximadamente 60% de los pacientes tenían hipercolesterolemia familiar heterocigótica. Al final del estudio hubo una diferencia significativa en el porcentaje de pacientes que alcanzaron la meta de C-LDL entre el grupo de atorvastatina más ZIENT (22%) y el grupo de monoterapia con atorvastatina (7%). En la semana 4 hubo una diferencia significativa en la disminución del C-LDL entre los pacientes que recibieron ZIENT + 10 mg de atorvastatina (24%) y los que recibieron 20 mg de atorvastatina (9%). En el subgrupo de los pacientes con hipercolesterolemia familiar heterocigótica se obtuvieron resultados similares en el porcentaje de los que alcanzaron la meta de C-LDL y en el porcentaje de disminución del C-LDL.
En un estudio de diseño similar en 100 pacientes con hipercolesterolemia que estaban tomando 20 mg diarios de simvastatina y no habían alcanzado la meta de C-LDL, la adición de 10 mg diarios de ZIENT al ajuste de la dosificación de simvastatina en comparación con sólo ese ajuste produjo beneficios similares a los observados en el estudio con atorvastatina descrito antes. Por ejemplo, hubo diferencias significativas en el porcentaje de pacientes que alcanzaron la meta de C-LDL (27% con ZIENT + simvastatina y 3% con la simvastatina sola) y en el grado de disminución del C-LDL (24% con ZIENT + simvastatina y 11% con la simvastatina sola).
Coadministración con Fenofibrato
En un estudio clínico multicéntrico, doble ciego, controlado con placebo, en pacientes con hiperlipidemia mixta, 625 pacientes recibieron tratamiento hasta por 12 semanas y 576 hasta por 1 año. Los pacientes fueron distribuidos al azar para recibir placebo, ZIENT solo, 160 mg de fenofibrato solo, o ZIENT y 160 mg de fenofibrato.
ZIENT co-administrado con fenofibrato disminuyó significativamente el colesterol total, C-LDL, Apo B, y colesterol no-HDL comparado con fenofibrato administrado solo. La disminución porcentual en TG y el aumento porcentual en C-HDL para ZIENT co-administrado con fenofibrato fueron comparables a los resultados obtenidos con fenofibrato administrado solo (ver Tabla 5).
Tabla 5: Respuesta a ZIENT y Fenofibrato Iniciados Concomitantemente en Pacientes con Hiperlipidemia Mixta (Cambio % Promedioa desde Nivel Basal sin Tratamientob Hasta la Semana 12)
|
Tratamiento (Dosis Diaria) |
N |
C-Total |
C-LDL |
Apo B |
TGa |
C-HDL |
C- no-HDL |
|
Placebo |
63 |
0 |
0 |
-1 |
-9 |
3 |
0 |
|
ZIENT |
185 |
-12 |
-13 |
-11 |
-11 |
4 |
-15 |
|
Fenofibrato 160 mg |
188 |
-11 |
-6 |
-15 |
-43 |
19 |
-16 |
|
ZIENT + Fenofibrato 160 mg |
183 |
-22 |
-20 |
-26 |
-44 |
19 |
-30 |
a Para triglicéridos, mediana del cambio porcentual desde el nivel basal
b Basal – sin hipolipemiante
La mejoría en los puntos finales para lípidos después de un año de tratamiento fue consistente con los datos a 12 semanas que se proporcionan.
Estudios Clínicos en Pacientes Pediátricos (10 a 17 años de edad)
En un estudio multicéntrico, doble ciego, controlado, 142 niños y 106 niñas postmenarca, de 10 a 17 años de edad (edad promedio 14.2 años) con hipercolesterolemia familiar heterocigótica (HHeF) fueron seleccionados al azar para recibir ZIENT y simvastatina co-administradas o simvastatina sola. La inclusión en el estudio requirió 1) un nivel entre 160 y 400 mg/dL de C-LDL al inicio del tratamiento y 2) un historial médico y presentación clínica consistente con HHeF. Los pacientes recibieron la co-administración de ZIENT y simvastatina (10 mg, 20 mg o 40 mg) o simvastatina sola (10 mg, 20 mg o 40 mg) por 6 semanas, ZIENT co-administrado con simvastatina 40 mg o simvastatina 40 mg sola durante las 27 semanas siguientes, y ZIENT co-administrado con simvastatina (10 mg, 20 mg o 40 mg) en forma abierta por las 20 semanas subsecuentes.
En la semana 6, la coadministración de ZIENT y simvastatina (todas las dosis) disminuyó significativamente el C-total, C-LDL, Apo B, y colesterol no-HDL, más que simvastatina sola (todas las dosis). Los resultados para los TG y el C-HDL fueron similares para los dos grupos del tratamiento (véase tabla 6). En la semana 33, la coadministración de ZIENT y simvastatina disminuyó significativamente el C-total, C-LDL, Apo B, TG, y colesterol no-HDL, más que simvastatina sola. El aumento en el C-HDL fue similar para los dos grupos del tratamiento. Además, en la semana 33, significativamente más pacientes recibieron ZIENT y simvastatina 40 mg (63%) logrando la meta ideal para el C-LDL (<110 mg/dL) según la Academia Americana de Pediatría (AAP) comparado con aquellos que recibieron simvastatina 40 mg sola (el 27%). En la semana 53, el cambio promedio respecto al inicio para la coadministración de ZIENT y simvastatina (todas las dosis) fue: -39% (C- total); -49% (C-LDL); -23% (Apo B); +3% (C-HDL); -17% (TG); y -46% (C-no-HDL).
Tabla 6. Respuesta a la Co-administración de ZIENT y Simvastatina en Pacientes Adolescentes con Hipercolesterolemia Familiar Heterocigótica (Cambioa % Promedio Del Nivel Basal sin Tratamientob)
|
Tratamiento (Dosis Diaria) |
N |
C-Total |
C-LDL |
Apo B |
C-HDL |
TGa |
C-no-HDL |
|
Semana 6 |
|||||||
|
Datos agrupados Todas las dosis de ZIENT + simvastatina |
126 |
-38 |
-49 |
-39 |
+7 |
-17 |
-47 |
|
Todas las dosis de simvastatina |
120 |
-26 |
-34 |
-27 |
+6 |
-12 |
-33 |
|
ZIENT + simvastatina por dosis |
|||||||
|
ZIENT + simvastatina 10 mg |
43 |
-37 |
-47 |
-37 |
+4 |
-18 |
-44 |
|
ZIENT + simvastatina 20 mg |
40 |
-37 |
-50 |
-39 |
+10 |
-17 |
-47 |
|
ZIENT + simvastatina 40 mg |
43 |
-40 |
-52 |
-41 |
+6 |
-13 |
-49 |
|
Simvastatina por dosis |
|||||||
|
10 mg |
39 |
-23 |
-30 |
-23 |
+3 |
-4 |
-28 |
|
20 mg |
39 |
-26 |
-34 |
-27 |
+10 |
-12 |
-33 |
|
40 mg |
42 |
-30 |
-39 |
-29 |
+7 |
-20 |
-37 |
|
Semana 33 |
|||||||
|
ZIENT + simvastatina 40 mg |
126 |
-42 |
-54 |
-43 |
+5 |
-20 |
-51 |
|
Simvastatina 40 mg |
120 |
-29 |
-38 |
-28 |
+4 |
-13 |
-36 |
a Para los triglicéridos, mediana del cambio porcentual desde el nivel basal
b Valor inicial – sin ningún medicamento hipolipemiante
No se han estudiado en niños la seguridad y eficacia de ZIENT co-administrado con dosis de simvastatina superiores a 40 mg diarios. No se ha estudiado la eficacia a largo plazo de la terapia con ZIENT en la niñez para reducir la morbilidad y mortalidad en la edad adulta.
Hipercolesterolemia familiar homocigótica
Se hizo un estudio para determinar la eficacia de ZIENT en el tratamiento de la hipercolesterolemia familiar homocigótica. En ese estudio de 12 semanas, doble ciego y con distribución al azar, se incluyeron 50 pacientes con diagnóstico clínico y/o genotípico de hipercolesterolemia familiar homocigótica, con o sin aféresis de LDL concomitante, que ya estaban recibiendo atorvastatina o simvastatina (40 mg diarios). Se distribuyó al azar a los pacientes en tres grupos de tratamiento: Atorvastatina o simvastatina (80 mg diarios), 10 mg diarios de ZIENT más 40 mg diarios de atorvastatina o simvastatina, o 10 mg diarios de ZIENT más 80 mg diarios de atorvastatina o simvastatina. Los resultados se muestran en la Tabla 7. ZIENT, administrado con atorvastatina (40 u 80 mg) o con simvastatina (40 u 80 mg), disminuyó significativamente el C-LDL en comparación con el aumento de la dosificación de simvastatina o de atorvastatina de 40 a 80 mg diarios.
Tabla 7. Promedios de respuesta a ZIENT en Pacientes con Hipercolesterolemia Familiar Homocigótica (Cambio % Promedio del Valor Basal)
|
Tratamiento (dosis diaria) |
N |
C-LDL |
|
Atorvastatina (80 mg) o simvastatina (80 mg) |
17 |
-7 |
|
ZIENT + atorvastatina (40, 80 mg) o simvastatina (40, 80 mg) |
33 |
-21 |
|
Análisis por subgrupos: ZIENT + atorvastatina (80 mg) o simvastatina (80 mg) |
17 |
-27 |
Prevención de Eventos Vasculares Mayores en la Enfermedad Renal Crónica (ERC)
El estudio de Protección Cardíaca y Renal, SHARP (Study of Heart and Renal Protection), fue un estudio multinacional, con distribución al azar, controlado con placebo, doble ciego realizado en 9,438 pacientes con enfermedad renal crónica, un tercio de los cuales fueron sometidos a diálisis al inicio del estudio. Para el primer año, los pacientes fueron asignados al azar en una proporción de 4:4:1, respectivamente, a una dosis fija de ZIENT 10 mg con simvastatina 20 mg, placebo o simvastatina 20 mg al día. Se incluyó un brazo de simvastatina sola por 1 año para permitir la comparación de ZIENT combinado con simvastatina con simvastatina sola, en materia de seguridad y lípidos. Después de un año el grupo simvastatina sola se reasignó al azar en un proporción 1:1 para recibir una dosis fija de ZIENT 10 mg con simvastatina 20 mg o placebo. Un total de 4,650 pacientes fueron asignados a ZIENT 10 mg combinado con simvastatina 20 mg y 4,620 a placebo, y fueron seguidos durante una mediana de 4.9 años. Los pacientes tenían una edad promedio de 62 años, de los cuales 63% eran hombres, 72% Caucásicos, 23% diabéticos y, para aquellos no sometidos a diálisis, la tasa promedio estimada de filtración glomerular (TFGe) fue de 26.5 mL/min/1.73 m2. No hubo criterios de inclusión para los lípidos. El promedio de C-LDL al inicio del estudio fue de 108 mg/dL. Para la medición de 1 año, el C-LDL fue reducido un 26% con simvastatina 20 mg en monoterapia y 38% con ZIENT 10 mg combinado con simvastatina 20 mg en relación al placebo. A la mitad del estudio (2.5 años), la reducción promedio de C-LDL con ZIENT 10 mg combinado con simvastatina 20 mg fue del 32% en relación al placebo. En todas las mediciones de lípidos se incluyó a pacientes que no tomaban más el medicamento del estudio.
La comparación principal especificada por el protocolo SHARP fue el análisis por intención de tratar de los “eventos vasculares mayores” (EVM, definido como IM no fatal o muerte cardiaca, accidente cerebrovascular, o cualquier procedimiento de revascularización) sólo en los pacientes inicialmente asignados al azar a los grupos de ZIENT combinado con simvastatina (n = 4,193) o placebo (n = 4,191). El análisis secundario incluyó el mismo compuesto analizado para la cohorte total de los pacientes distribuidos al azar a ZIENT combinado con simvastatina (n = 4,650) o a placebo (n = 4,620) (al inicio del estudio o al año 1), así como los componentes de este compuesto.
El análisis del punto final primario mostró que ZIENT combinado con simvastatina redujo significativamente el riesgo de eventos vasculares mayores (749 pacientes con eventos en el grupo con placebo vs. 639 en el grupo de ZIENT combinado con simvastatina) con una reducción del riesgo relativo del 16% (p = 0.001) (véase Figura 1).
La reducción del riesgo para el compuesto de EVM fue direccionalmente consistente (es decir, ZIENT combinado con simvastatina numéricamente superior que placebo) con el de la cohorte entera de pacientes para los siguientes subgrupos basales pre-definidos: edad, sexo, diálisis vs. no-diálisis, TFGe, diabetes, enfermedad aterosclerótica preexistente, presión arterial, o terciles de C-LDL al inicio.
Figura 1. Efecto de ZIENT Combinado con Simvastatina en el Punto Final Primario de Riesgo de Eventos Vasculares Mayores.
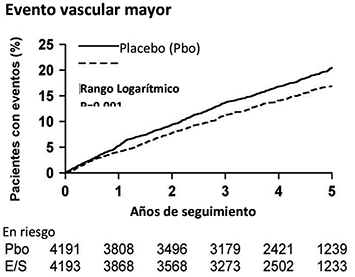
Los componentes individuales de los EVM en todos los pacientes aleatorizados se presentan en la Tabla 8. ZIENT combinado con simvastatina redujo significativamente el riesgo de accidente cerebrovascular y cualquier revascularización, con diferencias numéricas no significativas que favorece a ZIENT combinado con simvastatina en IM no fatal y muerte cardiaca.
Tabla 8. Eventos Vasculares Mayores por Grupo de Tratamiento en todos los Pacientes distribuidos al Azar en el Estudio SHARPa
|
Desenlace |
ZIENT 10 mg combinado con simvastatina 20 mg (N=4,650) |
Placebo (N=4,620) |
Razón de riesgo (95% IC) |
Valor de P |
|
Evento Vascular Mayor |
701 (15.1%) |
814 (17.6%) |
0.85 (0.77-0.94) |
0.001 |
|
IM no-fatal |
134 (2.9%) |
159 (3.4%) |
0.84 (0.66-1.05) |
0.12 |
|
Muerte cardiaca |
253 (5.4%) |
272 (5.9%) |
0.93 (0.78-1.10) |
0.38 |
|
Cualquier accidente cerebrovascular |
171 (3.7%) |
210 (4.5%) |
0.81 (0.66-0.99) |
0.038 |
|
Accidente cerebrovascular no hemorrágico |
131 (2.8%) |
174 (3.8%) |
0.75 (0.60-0.94) |
0.011 |
|
Accidente cerebrovascular hemorrágico |
45 (1.0%) |
37 (0.8%) |
1.21 (0.78-1.86) |
0.40 |
|
Cualquier revascularización |
284 (6.1%) |
352 (7.6%) |
0.79 (0.68-0.93) |
0.004 |
|
Evento Aterosclerótico Mayor (EAM)b |
526 (11.3%) |
619 (13.4%) |
0.83 (0.74-0.94) |
0.002 |
a Análisis de intención de tratar de todos los pacientes del estudio SHARP distribuidos al azar a ZIENT combinado con simvastatina o placebo ya sea al inicio o a 1 año.
b EAM; definido como el compuesto de infarto al miocardio no fatal, muerte coronaria, accidente cerebrovascular no hemorrágico, cualquier revascularización.
Sitosterolemia homocigótica (fitosterolemia)
Se realizó un estudio para determinar la eficacia de ZIENT en el tratamiento de la sitosterolemia homocigótica. En ese estudio multicéntrico, doble ciego y controlado con placebo de ocho semanas se distribuyó al azar a 37 pacientes con sitosterolemia homocigótica para recibir 10 mg diarios de ZIENT (n=30) o placebo (n=7). ZIENT disminuyó significativamente las concentraciones basales de los dos esteroles vegetales principales (21% el sitosterol y 24% el campesterol). En contraste, en los pacientes que recibieron el placebo aumentaron 4% el sitosterol y 3% el campesterol desde el nivel basal. En los pacientes tratados con ZIENT la disminución de los esteroles vegetales fue progresiva en el transcurso del estudio.
Las disminuciones del sitosterol y del campesterol fueron similares en los pacientes que tomaron ZIENT y secuestradores de ácidos biliares (n=8) y en los que no tomaron secuestradores de ácidos biliares (n=21).
VI. CONTRAINDICACIONES
Hipersensibilidad a cualquiera de los componentes de este producto.
Cuando se vaya a administrar ZIENT con una estatina o con fenofibrato, consúltese la información para prescribir de ese medicamento.
VII. PRECAUCIONES GENERALES
Cuando se vaya a administrar ZIENT con una estatina o con fenofibrato, consúltese la información para prescribir de ese medicamento.
Enzimas hepáticas
En estudios controlados en pacientes a los que se les co-administraron ZIENT y una estatina se han observado aumentos sucesivos de las transaminasas (al triple o más del límite superior de sus valores normales). Cuando se co-administre ZIENT con una estatina, se deben hacer pruebas de funcionamiento hepático al iniciar el tratamiento y de acuerdo con las recomendaciones sobre el empleo de esa estatina. (Véase IX. REACCIONES SECUNDARIAS Y ADVERSAS).
En un estudio clínico controlado en el que más de 9,000 pacientes con enfermedad renal crónica fueron distribuidos al azar para recibir ZIENT 10 mg combinado con simvastatina 20 mg al día (n = 4,650) o placebo (n = 4,620) (mediana de seguimiento 4.9 años), la incidencia del incremento consecutivo de transaminasas (>3 X ULN) fue de 0.7% para ZIENT combinado con simvastatina y 0.6% para placebo. (Véase IX. REACCIONES SECUNDARIAS Y ADVERSAS).
Músculo-esquelético
En estudios clínicos, no hubo exceso de miopatía o rabdomiólisis asociados con ZIENT comparado con el grupo de control relacionado (placebo o estatina solos). Sin embargo, la miopatía y la rabdomiólisis son reacciones adversas conocidas a las estatinas y otros fármacos reductores de lípidos. En estudios clínicos, la incidencia de creatin cinasa más de 10 veces el límite superior normal fue de 0.2% con ZIENT contra 0.1% con placebo, y 0.1% con ZIENT administrado junto con una estatina contra 0.4% con la estatina sola.
En la experiencia después de la comercialización, se han reportado casos de miopatía y rabdomiólisis independientemente de la causalidad. La mayoría de los pacientes que desarrollaron rabdomiólisis estaban tomando una estatina antes de iniciar con ZIENT. Sin embargo, la rabdomiólisis ha sido reportada muy raramente con la monoterapia con ZIENT y muy raramente al agregar ZIENT a medicamentos conocidos por estar asociados con un riesgo incrementado de rabdomiólisis. A todos los pacientes que inicien tratamiento con ZIENT se les debe notificar del riesgo de miopatía y decirles que reporten lo más pronto posible cualquier dolor, sensibilidad o debilidad muscular inexplicables. ZIENT así como cualquier estatina que el paciente esté tomando al mismo tiempo debe ser inmediatamente suspendido si se sospecha o diagnostica miopatía. La presencia de estos síntomas y un nivel de creatin cinasa mayor a 10 veces el límite superior normal indican miopatía.
En un estudio clínico en el que más de 9,000 pacientes con enfermedad renal crónica fueron distribuidos al azar para recibir ZIENT 10 mg combinado con simvastatina 20 mg al día (n = 4,650) o placebo (n = 4,620) (mediana de seguimiento 4.9 años), la incidencia de miopatía/rabdomiólisis fue de 0.2% para ZIENT combinado con simvastatina y 0.1% para placebo. (Véase IX. REACCIONES SECUNDARIAS Y ADVERSAS).
Insuficiencia hepática
Debido a que se desconocen los efectos del incremento en la exposición a ezetimiba en los pacientes con insuficiencia hepática moderada o grave, no se recomienda tratar con ZIENT a esos pacientes (véase V. FARMACOCINÉTICA Y FARMACODINAMIA, Características en grupos especiales de pacientes).
Fibratos
La co-administración de ezetimiba con fibratos que no sean fenofibrato no ha sido estudiada. Por consiguiente no se recomienda emplear al mismo tiempo ZIENT y fibratos (que no sean fenofibrato) (véase X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
Fenofibrato
Si se sospecha de colelitiasis en un paciente que tome ZIENT y fenofibrato, están indicados estudios de la vesícula biliar y se debe considerar un tratamiento hipolipemiante alternativo (ver IX. REACCIONES SECUNDARIAS Y ADVERSAS).
Ciclosporina
Se debe tener cuidado cuando se administre ezetimiba en pacientes tratados con ciclosporina. Las concentraciones de ciclosporina deben ser monitoreadas en pacientes que tomen ZIENT y ciclosporina (véase X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
Anticoagulantes
Si ZIENT se agrega a la warfarina, a otro anticoagulante cumarínico, o a fluindiona, la Proporción Normalizada Internacional (PNI) debe ser apropiadamente vigilada. (véase X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
Empleo en pacientes pediátricos
La seguridad y la efectividad de ZIENT co-administrado con simvastatina en pacientes de 10 a 17 años de edad con hipercolesterolemia familiar heterocigótica han sido evaluadas en estudios clínicos controlados en niños y niñas que tenían al menos un año post-menarquia. Los pacientes adolescentes tratados con ZIENT y hasta 40 mg/día de simvastatina tuvieron un perfil de experiencias adversas similar al de los adultos tratados con ZIENT y simvastatina. En un estudio controlado, no hubo efecto detectable en el crecimiento o en la maduración sexual de las y los adolescentes, o algún efecto en la duración del ciclo menstrual de las muchachas (Véase XIII. DOSIS Y VÍA DE ADMINISTRACIÓN, IX. REACCIONES SECUNDARIAS Y ADVERSAS y V. FARMACOCINÉTICA Y FARMACODINAMIA, Estudios Clínicos, Estudios clínicos en pacientes pediátricos (10 a 17 años de edad). ZIENT no ha sido estudiado en pacientes menores de 10 años de edad o en muchachas pre-menárquicas.
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
EMBARAZO
No hay datos clínicos sobre la administración de ezetimiba a mujeres embarazadas. Los estudios en animales sobre la administración de ezetimiba sola no indican efectos perjudiciales directos ni indirectos sobre el embarazo, el desarrollo embrionario y fetal, el parto ni el desarrollo post-natal (véase XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD, Desarrollo fetal). Sin embargo, se debe tener precaución cuando se prescriba ezetimiba a una mujer embarazada.
No se observaron efectos teratogénicos sobre el desarrollo embrio-fetal, cuando se administró ezetimiba con lovastatina, simvastatina, pravastatina o atorvastatina en los estudios en ratas gestantes. En conejas gestantes se observó una incidencia baja de malformaciones esqueléticas (véase XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD, Desarrollo fetal).
Cuando se vaya a administrar ezetimiba con una estatina, consúltese la información para prescribir de esa estatina.
LACTANCIA
Los estudios en ratas han mostrado que la ezetimiba es excretada en la leche. No se sabe si también es excretado en la leche humana, por lo que no se debe administrar ZIENT a mujeres lactantes, a menos que el beneficio potencial justifique el posible riesgo para el lactante.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
Los estudios clínicos de hasta 112 semanas de duración en los que se administraron 10 mg diarios de ZIENT solo (n= 2,396), con una estatina (n= 11,308), o con fenofibrato (n= 185), los pacientes demostraron que: ZIENT fue generalmente bien tolerado, las reacciones adversas fueron usualmente leves y pasajeras, y los efectos colaterales reportados y la tasa de descontinuación del tratamiento por reacciones adversas tuvieron una incidencia similar a lo reportado con el placebo.
Se reportaron las siguientes reacciones adversas comunes (incidencia de ≥1/100, <1/10) o poco comunes (incidencia de ≥1/1,000, <1/100) relacionadas con el medicamento en los pacientes que tomaron ZIENT solo (n = 2,396) y en una mayor incidencia que placebo (n = 1,159), o en los pacientes que toman ZIENT co-administrado con una estatina (n = 11,308) y en una mayor incidencia que una estatina administrada sola (n = 9,361),
Con ZIENT solo:
Investigaciones:
Poco comunes: aumento de ALT y/o AST; aumento en sangre de la CPK; aumento de gamma- glutamiltransferasa; pruebas anormales de la función hepática
Trastornos respiratorios, torácicos y mediastinales:
Poco comunes: tos
Trastornos gastrointestinales:
Comunes: dolor abdominal; diarrea; flatulencia
Poco comunes: dispepsia; enfermedad por reflujo gastroesofágico; náusea
Trastornos musculoesqueléticos y del tejido conectivo:
Poco comunes: artralgia; espasmos musculares; dolor de cuello
Trastornos del metabolismo y nutrición:
Poco comunes: disminución del apetito
Trastornos vasculares:
Poco comunes: rubefacción; hipertensión
Trastornos generales y relacionados al sitio de administración
Comunes: fatiga
Poco comunes: dolor en el pecho, dolor
Con ZIENT y una estatina:
Investigaciones:
Comunes: aumento de ALT y/o AST
Trastornos del sistema nervioso:
Comunes: cefalea
Poco comunes: parestesia
Trastornos gastrointestinales:
Poco comunes: sequedad de boca; gastritis
Trastornos de la piel y tejido subcutáneo
Poco comunes: prurito, erupción cutánea, urticaria
Trastornos musculoesqueléticos y del tejido conectivo:
Comunes: mialgia
Poco comunes: dolor de espalda; debilidad muscular; dolor en extremidades
Trastornos generales y relacionados al sitio de administración
Poco comunes: astenia; edema periférico
Con ZIENT y fenofibrato:
Trastornos gastrointestinales:
Comunes: dolor abdominal.
En un estudio clínico multicéntrico, doble ciego, controlado con placebo en pacientes con hiperlipidemia mixta, 625 pacientes recibieron tratamiento hasta por 12 semanas y 576 hasta por 1 año. Este estudio no fue diseñado para comparar grupos de tratamiento para eventos poco comunes. Las tasas de incidencia (IC de 95%) para aumentos clínicos importantes (a más del triple del límite superior de sus valores normales, consecutivos) en las transaminasas séricas fue de 4.5% (1.9, 8.8) y 2.7% (1.2, 5.4) para la monoterapia con fenofibrato y ZIENT co-administrado con fenofibrato, respectivamente, ajustado para exposición al tratamiento. Las tasas de incidencia correspondientes para colecistectomía fueron 0.6% (0.0, 3.1) y 1.7% (0.6, 4.0) para la monoterapia con fenofibrato y ZIENT co-administrado con fenofibrato, respectivamente (véase VII. PRECAUCIONES GENERALES). No se presentaron aumentos de la CPK a más de diez veces el límite superior de los valores normales en ninguno de los grupos de tratamiento en este estudio.
Pacientes con Enfermedad Renal Crónica
En el estudio de Protección Cardíaca y Renal, SHARP (Study of Heart and Renal Protection) (véase V. ESTUDIOS CLÍNICOS, Prevención de Eventos Vasculares Mayores en la Enfermedad Renal Crónica (ERC)), participaron más de 9,000 pacientes tratados con una dosis fija de ZIENT 10 mg con simvastatina 20 mg al día (n = 4,650) o placebo (n = 4,620), los perfiles de seguridad fueron comparables durante una mediana de seguimiento de 4.9 años. En este estudio se registraron únicamente los eventos adversos graves y los abandonos debidos a eventos adversos. Las tasas de descontinuación debida a eventos adversos fueron comparables (10.4% en pacientes tratados con ZIENT combinado con simvastatina, y 9.8% en los pacientes tratados con placebo). La incidencia de miopatía / rabdomiólisis fue de 0.2% en los pacientes tratados con ZIENT combinado con simvastatina, y 0.1% en los pacientes tratados con placebo. Se produjeron elevaciones consecutivas de las transaminasas (> 3 veces LSN) en el 0.7% de los pacientes tratados con ZIENT combinado con simvastatina, comparado con 0.6% de los pacientes tratados con placebo (ver VII. PRECAUCIONES GENERALES). En este ESTUDIO, no hubo aumentos estadísticamente significativos en la incidencia de eventos adversos pre-definidos, incluyendo el cáncer (9.4% para ZIENT combinado con simvastatina, 9.5% para placebo), hepatitis, colecistectomía, o complicaciones de los cálculos biliares o pancreatitis.
En un estudio que incluyó pacientes adolescentes (de 10 hasta 17 años de edad) con hipercolesterolemia familiar heterocigótica (n= 248), la seguridad y el perfil de tolerabilidad del grupo que recibió la co-administración de ZIENT y simvastatina fue similar al de los adultos que recibieron la co-administración de ZIENT y simvastatina (véase VII. PRECAUCIONES GENERALES, Empleo en pacientes pediátricos y V. ESTUDIOS CLÍNICOS, Estudios Clínicos en Pacientes Pediátricos [10 a 17 años de edad]).
Experiencia después de la comercialización
Se han reportado las siguientes reacciones adversas en la experiencia después de la comercialización, independientemente de la valoración de la causalidad:
Trastornos sanguíneos y del sistema linfático: trombocitopenia
Trastornos del sistema nervioso: mareos; parestesia
Trastornos gastrointestinales: pancreatitis; estreñimiento
Trastornos de la piel y tejido subcutáneo: eritema multiforme
Trastornos musculoesqueléticos y del tejido conectivo: mialgia; miopatía/rabdomiólisis (véase VII. PRECAUCIONES GENERALES)
Trastornos generales y relacionados al sitio de administración: astenia
Trastornos del sistema inmune: reacciones de hipersensibilidad, incluyendo anafilaxis, angioedema, erupción cutánea y urticaria
Trastornos hepatobiliares: hepatitis; colelitiasis; colecistitis
Trastornos psiquiátricos: depresión
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Los estudios preclínicos han mostrado que la ezetimiba no induce las enzimas metabolizadoras de medicamentos del citocromo P450. No se ha observado ninguna interacción de importancia clínica entre la ezetimiba y medicamentos que son metabolizados por los citocromos P450 1A2, 2D6, 2C8, 2C9 y 3A4 o por la N-acetiltransferasa.
La co-administración de ezetimiba no tuvo ningún efecto sobre la farmacocinética de la dapsona, el dextrometorfano, la digoxina, los anticonceptivos orales (etinilestradiol y levonorgestrel), la glipicida, la tolbutamida o el midazolam. La co-administración de cimetidina no tiene ningún efecto sobre la biodisponibilidad de la ezetimiba.
Antiácidos: La administración concomitante de antiácidos disminuyó la rapidez de absorción de la ezetimiba, pero no modificó su biodisponibilidad. Esa disminución de la rapidez de absorción de la ezetimiba no se considera clínicamente importante.
Colestiramina: La administración concomitante de colestiramina disminuyó 55% aproximadamente el promedio del área bajo la curva de concentración de la ezetimiba total (ezetimiba + glucurónido de ezetimiba). Esa interacción puede hacer que sea menor la disminución adicional del C-LDL debida a la co-administración de ezetimiba y colestiramina.
Ciclosporina: En un estudio realizado con ocho pacientes con trasplante renal y depuración de creatinina >50 mL/min que recibían dosis estables de ciclosporina, la administración de una dosis única de 10 mg de ezetimiba incrementó 3.4 veces (rango de 2.3 a 7.9 veces) el área bajo la curva promedio de la ezetimiba, en comparación con los datos reportados en otro estudio realizado con sujetos sanos (n=17). En otro estudio, un paciente con trasplante renal con insuficiencia renal grave (depuración de creatinina de 13.2 mL/min/1.73 m2) que recibió múltiples medicamentos, incluyendo ciclosporina, tuvo una concentración 12 veces mayor de ezetimiba en comparación con los pacientes del grupo control.
En un estudio cruzado de dos periodos en doce sujetos sanos, la administración diaria de 20 mg de ezetimiba durante 8 días con una dosis única de 100 mg de ciclosporina en el Día 7 produjo un incremento promedio de 15% en el ABC de la ciclosporina (rango del 10% de disminución a 51% de aumento) comparado con una sola dosis de 100 mg de ciclosporina sola (véase VII. PRECAUCIONES GENERALES).
Fibratos: La seguridad y eficacia de ezetimiba co-administrada con fenofibrato han sido evaluadas en un estudio clínico (ver IX. REACCIONES SECUNDARIAS Y ADVERSAS y V. ESTUDIOS CLÍNICOS, Co-administración con fenofibrato); la co-administración de ezetimiba con otros fibratos no ha sido estudiada. Los fibratos pueden aumentar la excreción de colesterol con la bilis y producir así colelitiasis. En un estudio preclínico en perros, la ezetimiba aumentó el contenido de colesterol de la bilis (ver XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD). Aunque se desconoce la importancia de ese resultado preclínico para los seres humanos, no se recomienda la co-administración de ZIENT y fibratos (que no sean fenofibrato) hasta que se estudie su uso en pacientes.
Fenofibrato: En un estudio de farmacocinética, la administración concomitante de fenofibrato incrementó la concentración total de ezetimiba aproximadamente 1.5 veces. Este incremento no se considera clínicamente significativo.
Gemfibrozilo: En un estudio de farmacocinética, la administración concomitante de gemfibrozilo incrementó la concentración total de ezetimiba aproximadamente 1.7 veces. Este incremento no se considera clínicamente significativo. No hay información clínica disponible.
Estatinas: No se observó ninguna interacción farmacocinética de importancia clínica cuando se co- administró ezetimiba con atorvastatina, simvastatina, pravastatina, lovastatina, fluvastatina o rosuvastatina.
Anticoagulantes:
En un estudio clínico de 12 hombres adultos sanos, la administración concomitante de ezetimiba (10 mg una vez al día) no tuvo un efecto significativo en la biodisponibilidad de los tiempos de warfarina o protrombina. Ha habido reportes después de la comercialización de incrementos en la Proporción Normalizada Internacional en pacientes que han agregado ZIENT a warfarina o fluindiona. La mayoría de estos pacientes también tomaban otros medicamentos (véase VII. PRECAUCIONES GENERALES).
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
En los estudios clínicos controlados con ezetimiba sola, la incidencia de aumentos clínicamente importantes de las transaminasas séricas (ALT y/o AST al triple o más del límite superior de sus valores normales, consecutivo) fue similar con ZIENT (0.5%) y con un placebo (0.3 %). En los estudios en los que se co-administraron ZIENT y una estatina, la incidencia fue de 1.3% con la co-administración y de 0.4% con la estatina sola. Generalmente esos aumentos de las transaminasas fueron asintomáticos, no se asociaron con colestasis, y volvieron a los valores normales al suspender o al continuar el tratamiento. (Véase VII. PRECAUCIONES GENERALES).
Los aumentos clínicamente importantes de la CPK (más de 10 veces el límite superior normal) observados en pacientes tratados con ezetimiba administrada sola o en combinación con una estatina fueron similares a los aumentos observados con placebo o con la estatina sola, respectivamente.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
El paciente debe estar bajo una dieta reductora de los lípidos apropiada y debe continuarla durante el tratamiento con ZIENT.
Uso en Pacientes con Hipercolesterolemia Primaria
La dosis recomendada de ZIENT es de 10 mg una vez al día, solo, con una estatina o con fenofibrato. ZIENT se puede administrar a cualquier hora del día, con o sin alimentos.
Empleo en pacientes con insuficiencia renal/enfermedad renal crónica
Monoterapia
No es necesario ajustar la dosis de ZIENT en pacientes con insuficiencia renal (véase V. FARMACOCINÉTICA Y FARMACODINAMIA, Características en grupos especiales de pacientes)
Terapia combinada con simvastatina
No es necesario ajustar la dosis de ZIENT o simvastatina en pacientes con insuficiencia renal leve (TFG estimada ≥60 mL/min/1.73 m2). En los pacientes con enfermedad renal crónica y tasa de filtración glomerular estimada <60 mL/min/1.73 m2, la dosis administrada de ZIENT es de 10 mg y la dosis de simvastatina es de 20 mg una vez al día por la noche. En estos pacientes, el uso de dosis más altas de simvastatina debe ser estrictamente monitoreado. (Véase VII. PRECAUCIONES GENERALES, V. FARMACOCINÉTICA Y FARMACODINAMIA, Características en grupos especiales de pacientes y V. ESTUDIOS CLÍNICOS, Prevención de eventos vasculares mayores en la enfermedad renal crónica (ERC).
Empleo en pacientes de edad avanzada
No es necesario hacer ningún ajuste de la dosificación en los pacientes de edad avanzada (véase V. FARMACOCINÉTICA Y FARMACODINAMIA, Características en grupos especiales de pacientes).
Empleo en pacientes pediátricos
Niños y adolescentes ≥ 10 años: No es necesario hacer ningún ajuste de la dosificación (véase V. FARMACOCINÉTICA Y FARMACODINAMIA, Características en grupos especiales de pacientes).
Niños <10 años: No se recomienda el tratamiento con ZIENT.
Empleo en pacientes con insuficiencia hepática
No es necesario hacer ningún ajuste de la dosificación en los pacientes con insuficiencia hepática leve (puntuación de Child-Pugh de 5 a 6). No se recomienda el tratamiento con ezetimiba en los pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9) o grave (puntuación de Child-Pugh mayor de 9). (Véase V. FARMACOCINÉTICA Y FARMACODINAMIA, Características en grupos especiales de pacientes y VII. PRECAUCIONES GENERALES).
Co-administración con secuestradores de ácidos biliares
ZIENT debe administrarse ≥2 horas antes o ≥4 horas después de la administración de cualquier secuestrador de ácidos biliares.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
En estudios clínicos, la administración de 50 mg diarios de ezetimiba a 15 personas sanas hasta por 14 días, de 40 mg diarios a 18 pacientes con hipercolesterolemia primaria por hasta 56 días, y 40 mg diarios a 27 pacientes con sitosterolemia homocigótica por 26 semanas fue generalmente bien tolerada.
Se han reportado pocos casos de sobredosificación con ZIENT, la mayoría no se ha asociado con reacciones adversas. Las reacciones adversas reportadas no han sido graves. En caso de una sobredosis, se deben aplicar medidas sintomáticas y de sostén.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
Carcinogenicidad
En los estudios de dos años en ratones y ratas la ezetimiba no fue cancerígena.
Mutagénesis
Ezetimiba no fue genotóxica en una serie de pruebas in vivo e in vitro.
La ezetimiba y sus combinaciones con atorvastatina, simvastatina, pravastatina o lovastatina no fueron genotóxicos en una serie de pruebas in vivo e in vitro.
Reproducción
La ezetimiba no afectó la fertilidad de las ratas machos o hembras.
Desarrollo fetal
La ezetimiba no fue teratógena en las ratas ni en los conejos, y no tuvo ningún efecto sobre el desarrollo fetal o post-natal.
La administración concomitante de ezetimiba y estatinas no fue teratógena en las ratas. En conejas gestantes se observó una incidencia baja de malformaciones esqueléticas (fusión de esternebras, fusión y disminución del número de vértebras caudales) cuando se les administró ezetimiba (1,000 mg/kg, 146 o más veces mayor que la exposición humana a la dosificación de 10 mg diarios, basándose en el ABC0-24h de ezetimiba total) con lovastatina (2.5 y 25 mg/kg), simvastatina (5 y 10 mg/kg), pravastatina (25 y 50 mg/kg) o atorvastatina (5, 25 y 50 mg/kg). La exposición a la forma farmacológicamente activa de la estatina varió entre 1.4 (atorvastatina) a 547 (lovastatina) veces mayor que la exposición humana con 10 mg diarios (simvastatina o atorvastatina) o con 20 mg diarios (lovastatina y pravastatina), basándose en el ABC0-24h.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
SCHERING-PLOUGH, S.A. de C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan, C.P. 16090, Alcaldía Xochimilco, Ciudad de México, México.
XV. PRESENTACIÓN
Caja con 7, 10, 14, 21, 28, 30 y 60 comprimidos de 10 mg.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese a no más de 30 °C y en lugar seco. Manténgase en el empaque original.
XVII. LEYENDAS DE PROTECCIÓN
Su venta requiere receta médica. Literatura exclusiva para médicos. No se deje al alcance de los niños.
Por favor reporte cualquier sospecha de reacción adversa a: farmacovigilancia@cofepris.gob.mx y
dpocmx@merck.com