
ALTRULINE
SERTRALINA
Tabletas recubiertas
Tabletas recubiertas, 25 Miligramos
Tabletas recubiertas, 50 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: La sertralina está disponible en TABLETAS recubiertas para la administración oral que contienen clorhidrato de sertralina equivalente a 25 mg y 50 mg de sertralina y en CÁPSULAS que contienen clorhidrato de sertralina equivalente a 100 mg.
INDICACIONES TERAPÉUTICAS: La sertralina está indicada para el tratamiento de los síntomas de la depresión, incluyendo depresión acompañada por síntomas de ansiedad, en pacientes con o sin antecedentes de manía. Después de una respuesta satisfactoria, el continuar con la terapia de sertralina ha sido eficaz en la prevención de la recaída del episodio inicial de depresión o de la recurrencia de nuevos episodios depresivos.
La sertralina está indicada en el tratamiento del trastorno obsesivo compulsivo (TOC). Después de la respuesta inicial, la sertralina ha sido asociada con una eficacia sostenida, seguridad y tolerancia hasta por dos años en el tratamiento de TOC.
La sertralina está indicada para el tratamiento de pacientes pediátricos con TOC.
La sertralina está indicada para el tratamiento del trastorno de pánico, con o sin agorafobia. Después de la respuesta satisfactoria, la continuación con la terapia de sertralina es efectiva para prevenir la recaída del episodio inicial de trastorno de pánico.
La sertralina está indicada para el tratamiento del trastorno de estrés postraumático (TEPT). Después de la respuesta satisfactoria, la continuación con la terapia de sertralina es efectiva para prevenir la recaída del episodio inicial de TEPT.
La sertralina está indicada para el tratamiento de la fobia social (trastornos de ansiedad social). Luego de una satisfactoria respuesta, la terapia continua con sertralina es efectiva para prevenir la recaída del episodio inicial de fobia social.
La sertralina está indicada en el tramiento del trastorno disfórico pre-menstrual en mujeres adultas.
PARTICULARIDADES FARMACÉUTICAS:
Precauciones especiales para el almacenamiento: Almacénese a una temperatura menor de 30 °C.
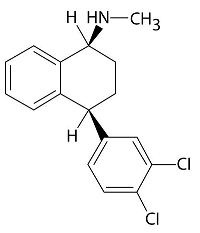
Estructura y nombre químico del principio activo: (1S,4S)-4-(3,4-Diclorofenil)-1,2,3,4-tetrahidro-N-metil-1-naftalenamina
Documento de producto referencia No.: 186
Fecha del documento local de producto: 2 de julio, 2009
Reemplaza: 4 de junio, 2009
PFIZER
® Marca registrada
PROPIEDADES FARMACODINÁMICAS: Sertralina es un inhibidor potente y selectivo de la captación neuronal de serotonina (5-HT), in vitro, lo cual resulta en una potenciación de los efectos de la 5-HT, en animales. Tiene sólo un efecto muy débil sobre la recaptación neuronal de norepinefrina y dopamina. A dosis clínicas, la sertralina bloquea la captación de serotonina en las plaquetas del ser humano. La sertralina está desprovista de actividad estimulante, sedante o anticolinérgica o cardiotoxicidad en animales. En estudios controlados, en voluntarios normales, la sertralina no produjo sedación ni tampoco interfirió con la capacidad psicomotora. De acuerdo con su inhibición selectiva de la captación de 5-HT, la sertralina no aumenta la actividad catecolaminérgica. La sertralina no tiene afinidad por los receptores muscarínicos (colinérgicos), serotoninérgicos, dopaminérgicos, adrenérgicos, histaminérgicos, GABA, ni de las benzodiacepinas. La administración crónica de sertralina en animales estuvo asociada con una regulación a la baja de los receptores cerebrales de norepinefrina, tal como se observa con otros medicamentos antidepresivos y antiobsesivos clínicamente eficaces.
La sertralina no ha demostrado producir potencial de abuso. En un estudio aleatorizado, a doble ciego, controlado con placebo, sobre la exposición comparativa al abuso con sertralina, alprazolam y d-anfetamina en seres humanos, la sertralina no produjo efectos positivos subjetivos, indicativos de potencial de abuso. Por el contrario, los individuos calificaron, tanto el alprazolam como la d-anfetamina, significativamente más alto que al placebo, con las medidas de preferencia del medicamento, euforia y potencial de abuso. La sertralina no produjo ni la estimulación ni la ansiedad asociada con la anfetamina o la sedación y la deficiencia psicomotora, asociada con el alprazolam. La sertralina no funciona como un refuerzo positivo, en monos rhesus, entrenados para autoadministrarse cocaína, ni tampoco sustituye, a manera de estímulo discriminatorio, a la d-anfetamina o al pentobarbital en dichos monos.
Estudios clínicos:
Trastorno depresivo mayor: Se realizó un estudio que involucró a pacientes ambulatorios deprimidos que habían respondido al final de una fase inicial de tratamiento abierto de ocho semanas con 50-100 mg/día de sertralina. Estos pacientes (N = 295) fueron aleatorizados para continuar por 44 semanas con 50-200 mg/día de sertralina o placebo a doble ciego. Se observó una tasa de recidiva significativa y estadísticamente más baja en los pacientes que tomaron sertralina, en comparación con los que recibieron placebo. La dosis media para los pacientes que finalizaron fue de 70 mg/día.
Trastorno obsesivo compulsivo (TOC): En un estudio a largo plazo, los pacientes que cumplieron con los criterios de la DSM-III-R para TOC que habían respondido durante un ensayo de 52 semanas a simple ciego con 50-200 mg/día de sertralina (n = 224) fueron aleatorizados para continuar con sertralina o la sustitución de placebo hasta un máximo de 28 semanas de observación por discontinuación debido a recidiva o respuesta clínica insuficiente. Los pacientes que recibieron el tratamiento continuo con sertralina experimentaron una tasa significativamente más baja de suspensión debido a recidiva o respuesta clínica insuficiente, en las semanas posteriores, en comparación con aquellos que recibieron placebo. Este patrón fue demostrado en sujetos de ambos sexos.
Trastorno de pánico: En un estudio a largo plazo, los pacientes que cumplieron con los criterios de la DSM-III-R para trastorno de pánico que habían respondido durante un ensayo abierto de 52 semanas con 50-200 mg/día (n = 183) de sertralina fueron aleatorizados para continuar con sertralina o la sustitución de placebo hasta un máximo de 28 semanas de observación por discontinuación debido a recidiva o respuesta clínica insuficiente. Los pacientes que recibieron el tratamiento continuo con sertralina experimentaron una tasa significativamente más baja de suspensión debido a recidiva o respuesta clínica insuficiente, en las siguientes 28 semanas, en comparación con las semanas posteriores, en comparación con aquellos que recibieron placebo. Este patrón fue demostrado en sujetos de ambos sexos.
Trastorno de estrés postraumático (TEPT): En un estudio a largo plazo, los pacientes que cumplieron con los criterios de la DSM-III-R para TEPT que habían respondido durante un ensayo abierto de 24 semanas con 50-200 mg/día de sertralina (n = 96) fueron aleatorizados para continuar con sertralina o para la sustitución de placebo hasta un máximo de 28 semanas de observación por recidiva. Los pacientes que recibieron el tratamiento continuo con sertralina experimentaron tasas significativamente más bajas de recidiva en las 28 semanas posteriores, en comparación con aquellos que recibieron placebo. Este patrón fue demostrado en sujetos de ambos sexos.
Fobia social (trastorno de ansiedad social): En un estudio para prevención de la recaída de fobia social, los pacientes que respondieron al final de la semana 20 en un estudio de dosis flexible, multicéntrico, comparativo de sertralina (50 mg-200 mg/día) con placebo, fueron aleatorizados nuevamente para un curso adicional de 24 semanas, ya sea para continuar con el tratamiento de sertralina (50 mg-200 mg/día), o sustitución por placebo, mientras que los que respondieron a placebo, se mantuvieron con placebo. Los pacientes que continuaron tratados con sertralina experimentaron un índice de recaída estadística y significativamente más bajo en este estudio de 24 semanas que los pacientes aleatorizados al tratamiento de sustitución por placebo.
PROPIEDADES FARMACOCINÉTICAS:
CONTRAINDICACIONES: La sertralina está contraindicada en pacientes con hipersensibilidad conocida a la sertralina.
El uso concomitante en pacientes que toman pimozida está contraindicado (véase Interacción con otros medicamentos y otras formas de interacción).
El uso concomitante en pacientes que toman inhibidores de la monoamina oxidasa (IMAOs) está contraindicado (véase Advertencias especiales y precauciones especiales para el uso).
EMBARAZO Y LACTANCIA: Se han efectuado estudios de reproducción en ratas y conejos a dosis hasta de 20 y 10 veces la dosificación mg/kg máxima diaria en seres humanos, respectivamente. No hubo evidencias de teratogenicidad en ningún nivel de dosis. Al nivel de dosis correspondiente aproximadamente de 2.5 a 10 veces la dosis mg/kg máxima diaria en seres humanos, sin embargo, sertralina estuvo asociada con un retardo en la dosificación de los fetos, probablemente secundaria a los efectos sobre las membranas.
Hubo una reducción en la supervivencia neonatal después de la administración materna de sertralina a dosis aproximadamente 5 veces la dosis en mg/kg máxima en seres humanos. Se han descrito efectos similares en cuanto a supervivencia neonatal para otros medicamentos antidepresivos. Se desconoce la importancia clínica de estos efectos.
No existen estudios adecuados ni bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales, no siempre predicen la respuesta en los seres humanos, la sertralina deberá utilizarse durante el embarazo, sólo si los beneficios esperados sobrepasan los riesgos.
Estudios aislados en un grupo reducido de madres en periodo de lactancia y sus hijos mostraron niveles insignificantes o indetectables de sertralina en el suero de los lactantes, a pesar de que los niveles en la leche materna fueron más concentrados que en el suero materno. El uso durante la lactancia no está recomendado, a no ser que a juicio del médico, el beneficio supere el riesgo.
Si la sertralina es utilizada durante el embarazo y/o lactancia, el médico deberá estar enterado del reporte de síntomas posteriores a la comercialización, incluyendo aquellos compatibles con las reacciones de retiro que se han reportado en algunos neonatos cuyas madres han recibido antidepresivos tipo ISRS entre ellos sertralina.
DEBE UTILIZARSE CON PRECAUCIÓN EN EL ÚLTIMO TRIMESTRE DE EMBARAZO Y EN LOS PRIMEROS 6 MESES DE LACTANCIA, BAJO ESTRICTA VIGILANCIA MÉDICA.
Las mujeres con potencial de embarazo deben emplear métodos anticonceptivos adecuados, si están tomando sertralina.
La exposición a ISRS durante una etapa tardía del embarazo puede tener un mayor riesgo a la hipertensión pulmonar persistente del recién nacido (HPPRN). HPPRN se produce cada 1 o 2 por 1000 nacidos vivos en la población en general y se asocia con una alta morbilidad y mortalidad neonatal. En un estudio retrospectivo controlado con casos de 377 mujeres cuyos bebés nacieron con HPPRN y 836 mujeres cuyos bebés nacieron saludables, el riesgo de desarrollar HPPRN fue aproximadamente seis veces más altos para los bebés expuestos a ISRS después de la semana 20 de gestación en comparación con bebés que no sufrieron exposición a antidepresivos durante el embarazo. Un estudio de 831,324 bebés nacidos en Suecia durante el periodo 1997-2005 encontró una proporción de riesgo HPPRN de 2.4 (95% CI 1.2-4.3) asociado con un reporte de uso de ISRS durante el inicio del embarazo, y una proporción de riesgo de HPPRN de 3.6 (95% CI 1.2-8.3) asociado con una combinación de reportes de uso de ISRS durante el inicio del embarazo y en una etapa final del mismo.
EFECTOS INDESEABLES: La siguiente tabla enumera los eventos adversos más comunes asociados con el tratamiento con ALTRULINE* (incidencia de al menos 5% para ALTRULINE* y al menos el doble para placebo con al menos una de las indicaciones).
|
Tabla 1. |
||||||||
|
Depresión/otros* |
Trastorno obsesivo compulsivo |
Pánico |
Trastorno de estrés postraumático |
|||||
|
Cuerpo/evento adverso |
ALTRULINE* (N=861) |
Placebo (N=853) |
ALTRULINE* (N=533) |
Placebo (N=373) |
ALTRULINE* (N=430) |
Placebo (N=275) |
ALTRULINE* (N=374) |
Placebo (N=376) |
|
Alteración en el sistema nervioso autónomo |
||||||||
|
Falla en la eyaculación |
7 |
<1 |
17 |
2 |
19 |
1 |
11 |
1 |
|
Sequedad de boca |
16 |
9 |
14 |
9 |
15 |
10 |
11 |
6 |
|
Incremento de la sudoración |
8 |
3 |
6 |
1 |
5 |
1 |
4 |
2 |
|
Alteraciones en el SNC y periférico |
||||||||
|
Somnolencia |
13 |
6 |
15 |
8 |
15 |
9 |
13 |
9 |
|
Temblor |
11 |
3 |
8 |
1 |
5 |
1 |
5 |
1 |
|
Mareo |
12 |
7 |
17 |
9 |
10 |
10 |
8 |
5 |
|
General |
||||||||
|
Fatiga |
11 |
8 |
14 |
10 |
11 |
6 |
10 |
5 |
|
Dolor |
1 |
2 |
3 |
1 |
3 |
3 |
4 |
6 |
|
Malestar |
<1 |
1 |
1 |
1 |
7 |
14 |
10 |
10 |
|
Trastornos gastrointestinales |
||||||||
|
Dolor abdominal |
2 |
2 |
5 |
5 |
6 |
7 |
6 |
5 |
|
Anorexia |
3 |
2 |
11 |
2 |
7 |
2 |
8 |
2 |
|
Constipación |
8 |
6 |
6 |
4 |
7 |
3 |
3 |
3 |
|
Diarrea/heces blandas |
18 |
9 |
24 |
10 |
20 |
9 |
24 |
15 |
|
Dispepsia |
6 |
3 |
10 |
4 |
10 |
8 |
6 |
6 |
|
Náuseas |
26 |
12 |
30 |
11 |
29 |
18 |
21 |
11 |
|
Trastornos psiquiátricos |
||||||||
|
Agitación |
6 |
4 |
6 |
3 |
6 |
2 |
5 |
5 |
|
Insomnio |
16 |
9 |
28 |
12 |
25 |
18 |
20 |
11 |
|
Disminución de la libido |
1 |
<1 |
11 |
2 |
7 |
1 |
7 |
2 |
|
TDPM dosis diaria |
TDPM dosis para fase lútea |
|||||||
|
Cuerpo/Evento adverso |
ALTRULINE* (N=121) |
Placebo (N=122) |
ALTRULINE* (N=136) |
Placebo (N=127) |
ALTRULINE* (N=344) |
Placebo (N=268) |
||
|
Trastornos del sistema nervioso autónomo |
||||||||
|
Falla en la eyaculación |
N/A |
N/A |
N/A |
N/A |
14 |
- |
||
|
Sequedad de boca |
6 |
3 |
10 |
3 |
12 |
4 |
||
|
Incremento de la sudoración |
6 |
<1 |
3 |
0 |
11 |
2 |
||
|
Trastornos del SNC y periférico |
||||||||
|
Somnolencia |
7 |
<1 |
2 |
0 |
9 |
6 |
||
|
Temblor |
2 |
0 |
<1 |
<1 |
9 |
3 |
||
|
Mareo |
6 |
3 |
7 |
5 |
14 |
6 |
||
|
General |
||||||||
|
Fatiga |
16 |
7 |
10 |
<1 |
12 |
6 |
||
|
Dolor |
6 |
<1 |
3 |
2 |
1 |
3 |
||
|
Malestar |
9 |
5 |
7 |
5 |
8 |
3 |
||
|
Trastornos gastrointestinales |
||||||||
|
Dolor abdominal |
7 |
<1 |
3 |
3 |
5 |
5 |
||
|
Anorexia |
3 |
2 |
5 |
0 |
6 |
3 |
||
|
Constipación |
2 |
3 |
1 |
2 |
5 |
3 |
||
|
Diarrea/heces blandas |
13 |
3 |
13 |
7 |
21 |
8 |
||
|
Dispepsia |
7 |
2 |
7 |
3 |
13 |
5 |
||
|
Náuseas |
23 |
9 |
13 |
3 |
22 |
8 |
||
|
Trastornos psiquiátricos |
||||||||
|
Agitación |
2 |
<1 |
1 |
0 |
4 |
2 |
||
|
Insomnio |
17 |
11 |
12 |
10 |
25 |
10 |
||
|
Disminución de la libido |
11 |
2 |
4 |
2 |
9 |
3 |
||
|
Tabla 2. |
||
|
Cuerpo/evento adverso |
ALTRULINE* (N=2799) |
Placebo (N=2394) |
|
Trastornos del sistema nervioso autónomo |
||
|
Falla en la eyaculación |
14 |
1 |
|
Sequedad de boca |
14 |
8 |
|
Incremento de la sudoración |
7 |
2 |
|
Trastornos en el SNC y periférico |
||
|
Somnolencia |
13 |
7 |
|
Mareos |
12 |
7 |
|
Dolor de cabeza |
25 |
23 |
|
Parestesias |
2 |
1 |
|
Temblor |
8 |
2 |
|
Trastornos en piel y apéndices |
||
|
Rash |
3 |
2 |
|
Trastornos gastrointestinales |
||
|
Anorexia |
6 |
2 |
|
Constipación |
6 |
4 |
|
Diarrea/heces blandas |
20 |
10 |
|
Dispepsia |
8 |
4 |
|
Náusea |
25 |
11 |
|
Vómitos |
4 |
2 |
|
General |
||
|
Fatiga |
12 |
7 |
|
Trastornos psiquiátricos |
||
|
Agitación |
5 |
3 |
|
Ansiedad |
4 |
3 |
|
Insomnio |
21 |
11 |
|
Disminución de la líbido |
6 |
2 |
|
Nerviosismo |
5 |
4 |
|
Sentidos especiales |
||
|
Visión anormal |
3 |
2 |
|
Tabla 3. |
||||||||
|
Evento adverso |
Trastornos depresivo mayor/otros, TDPM, pánico, TEPT, TDPM y fobia social (N=2799) |
Trastornos depresivo mayor/otros |
TOC (N=533) |
Pánico |
TEPT (N=374) |
TDPM dosis diaria |
TDPM dosis fase lútea |
Ansiedad social |
|
Dolor abdominal |
- |
- |
- |
- |
- |
- |
- |
1% |
|
Agitación |
- |
1% |
- |
2% |
- |
- |
- |
- |
|
Ansiedad |
- |
- |
- |
- |
- |
- |
- |
2% |
|
Diarrea/heces blandas |
2% |
2% |
2% |
1% |
- |
2% |
- |
- |
|
Mareos |
- |
- |
1% |
- |
- |
- |
- |
- |
|
Boca seca |
- |
1% |
- |
- |
- |
- |
- |
- |
|
Dispepsia |
- |
- |
- |
1% |
- |
- |
- |
- |
|
Falla en la eyaculación |
1% |
1% |
1% |
2% |
- |
N/A |
N/A |
2% |
|
Fatiga |
- |
- |
- |
- |
- |
- |
- |
2% |
|
Dolor de cabeza |
1% |
2% |
- |
- |
1% |
- |
- |
2% |
|
Sensación de calor |
- |
- |
- |
- |
- |
- |
1% |
- |
|
Insomnio |
2% |
1% |
3% |
2% |
- |
- |
1% |
3% |
|
Náusea |
3% |
4% |
3% |
3% |
2% |
2% |
1% |
2% |
|
Nerviosismo |
- |
- |
- |
- |
- |
2% |
- |
- |
|
Palpitación |
- |
- |
- |
- |
- |
- |
1% |
- |
|
Somnolencia |
1% |
1% |
2% |
2% |
- |
- |
- |
- |
|
Tremor |
- |
2% |
- |
- |
- |
- |
- |
- |
Esta tabla contiene la incidencia de efectos adversos de tipo sexual reportado por al menos 2% de los pacientes que toman ALTRULINE* en los ensayos placebo-control.
|
Tabla 4. |
||
|
Eventos adversos |
ALTRULINE* |
Placebo |
|
Falla en la eyaculación (principalmente eyaculación retrasada) |
14% |
1% |
|
Disminución de la líbido |
6% |
1% |
EFECTOS SOBRE LA CAPACIDAD DE MANEJO Y USO DE MAQUINARIA: Los estudios clínicos farmacológicos han demostrado que la sertralina no tiene ningún efecto sobre el desempeño psicomotor. Sin embargo, como los fármacos psicotrópicos pueden deteriorar las habilidades mentales o físicas requeridas para el desempeño de tareas potencialmente peligrosas, como el manejo de un auto u operación de maquinaria, debe prevenirse al paciente respecto a esto.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
Inhibidores de la monoamino oxidasa: (Véanse Contraindicaciones y Precauciones especiales y advertencias especiales para el uso).
Pimozida: El aumento en los niveles de pimozida se ha demostrado en un estudio de una dosis baja única de pimozida (2 mg) con la coadministración de sertralina. Estos aumentos en los niveles no estuvieron asociados a cambios en el electrocardiograma. Aunque se desconoce el mecanismo de esta interacción, debido al limitado índice terapéutico de pimozida, la administración concomitante de sertralina y pimozida está contraindicada.
Medicamentos depresores del SNC y alcohol: La coadministración de 200 mg diarios de sertralina no potenció los efectos del alcohol, carbamazepina, haloperidol o fenitoína sobre la capacidad cognoscitiva o psicomotora en personas saludables. Sin embargo, no se recomienda el uso concomitante de sertralina y alcohol.
Litio: En estudios controlados con placebo, llevados a cabo en voluntarios sanos la coadministración de litio con sertralina no alteró significativamente la farmacocinética del litio; sin embargo, produjo un aumento en el temblor, en relación con placebo, indicando una posible interacción farmacocinética. Cuando se coadministre la sertralina con medicamentos, tales como el litio, el cual puede actuar vía mecanismos serotoninérgicos, los pacientes deben ser monitorizados apropiadamente.
Fenitoína: Un ensayo controlado con placebo en voluntarios sanos sugiere que la administración crónica de 200 mg/día de sertralina no produce una inhibición clínicamente importante del metabolismo de la fenitoína. Sin embargo, se recomienda que las concentraciones de fenitoína en el plasma sean monitorizadas después del inicio de la terapia con sertralina, con ajustes apropiados en la dosis de fenitoína. Además, la coadministración de fenitoína puede causar una reducción de los niveles plasmáticos de sertralina.
Sumatriptan: Se han presentado reportes poco usuales, posteriores a la comercialización que describen pacientes con debilidad, hiperreflexia, descoordinación, confusión, ansiedad y agitación después del uso de sertralina y sumatriptan. Se aconseja una observación apropiada del paciente, en caso de justificarse clínicamente el tratamiento concomitante con sertralina y sumatriptan. (Véase Precauciones especiales y advertencias especiales para el uso).
Otros fármacos serotoninérgicos: (Véase Precauciones especiales y advertencias especiales para el uso).
Fármacos que se fijan a proteínas: Dado que la sertralina se fija a las proteínas del plasma, debe considerarse la posibilidad de interacción con otras drogas que se fijan a las proteínas plasmáticas. Sin embargo, en tres estudios formales de interacción con diazepam, tolbutamida y warfarina, respectivamente, la sertralina no mostró efectos significativos sobre la fijación a proteínas del sustrato (véase Otras interacciones medicamentosas).
Warfarina: La coadministración de 200 mg al día de sertralina con warfarina, produjo un aumento pequeño, pero estadísticamente significativo en el tiempo de protrombina, cuyo significado clínico se desconoce. Por lo tanto, deberá vigilarse cuidadosamente el tiempo de protrombina cuando se inicie o suspenda el tratamiento con sertralina (véase CYP 2C9).
Otras interacciones medicamentosas: Se han realizado estudios formales de interacción de fármacos con sertralina. La coadministración de 200 mg al día de sertralina con diazepam o tolbutamida produjo cambios pequeños, pero estadísticamente significativos en algunos parámetros farmacocinéticos. La coadministración con cimetidina causó una disminución sustancial en el aclaramiento de la sertralina. Se desconoce el significado clínico de estos cambios. La sertralina no tuvo efectos sobre la capacidad beta-adrenérgica de bloqueo del atenolol. No se observaron interacciones de sertralina en dosis de 200 mg al día con glibenclamida o digoxina.
Terapia electroconvulsiva (TEC): No existen estudios clínicos que establezcan los riesgos o beneficios del uso combinado de la terapia electroconvulsiva y sertralina.
Fármacos metabolizados a través de la isoenzima (CYP) 2D6 del citocromo P-450: Existe una variabilidad entre los antidepresivos en la medida en que estos inhiben la actividad de la isoenzima CYP 2D6. La importancia clínica de esto depende de la extensión de la inhibición y del índice terapéutico del fármaco coadministrado. Los sustratos CYP 2D6 con un índice terapéutico limitado incluyen a los antidepresivos tricíclicos (ATC) y a los antiarrítmicos clase IC, como propafenona y flecainida. En estudios formales de interacción, la dosificación crónica 50 mg al día de sertralina, mostró una elevación mínima (promedio 23%-37%) de los niveles plasmáticos de desipramina en estado de equilibrio (un marcador de la actividad de la isoenzima CYP 2D6).
Fármacos metabolizados por otras enzimas del CYP (CYP 3A3/4, CYP 2C9, CYP 2C19, CYP 1A2) – CYP 3A3/4: Los estudios de interacción in vivo han demostrado que la administración crónica de 200 mg al día de sertralina no inhibe la hidroxilación 6-ß del cortisol endógeno dependiente de la enzima CYP 3A3/4 o del metabolismo de la carbamazepina o terfenadina. Además, la administración crónica de 50 mg al día de sertralina no inhibe el metabolismo de alprazolam mediado por la CYP 3A3/4. Los datos sugieren que la sertralina no es un inhibidor clínicamente significativo de la CYP 3A/34.
CYP 2C9: La ausencia aparente de efectos clínicamente significativos de la administración crónica de 200 mg al día de sertralina sobre las concentraciones plasmáticas de tolbutamida, fenitoína y warfarina sugieren que la sertralina no es un inhibidor clínicamente significativo de la CYP 2C9.
CYP 2C19: La ausencia aparente de efectos clínicamente significativos de la administración crónica de 200 mg al día de sertralina sobre las concentraciones plasmáticas de diazepam sugiere que la sertralina no es un inhibidor clínicamente significativo de la CYP 2C19.
CYP 1A2: Los estudios in vitro indican que la sertralina tiene poco o ningún potencial de inhibir la CYP 1A2.
INFORMACIÓN DE ESTUDIOS CLÍNICOS:
Los efectos secundarios que ocurrieron con una frecuencia significativamente mayor con sertralina que con placebo en estudios de dosis múltiples para tratar la depresión fueron:
Trastornos gastrointestinales:
— Frecuente: Aumento del apetito.
— Poco frecuente: Disfagia, caries, eructos esofagitis, gastroenteritis.
— Raro: Melena, glositis, hiperplasia de las encías, estomatitis, tenesmus, colitis, diverticulitis, incontinencia fecal, gastritis, hemorragia rectal, hemorragia de la úlcera péptica, proctitis, estomatitis ulcerativa, edema en la lengua, ulceración en la lengua.
Trastornos del metabolismo y nutrición:
— Poco frecuente: Sed.
— Raros: Hipoglicemia.
Trastornos del sistema nervioso central y periférico:
— Frecuente: Hipertonía, hipoestesia.
— Poco frecuente: Confusión, hiperkinesia, vértigo, ataxia migraña, coordinación anormal, hiperestesia, calambres en las piernas, nistagmus, hipokinesia.
— Raros: Disfonía, coma, diskinesia, hipotonía, ptosis, coreoatetosis, hipoflejos.
Trastornos psiquiátricos:
— Frecuentes: Bostezos, disfunción sexual masculina y femenina.
— Poco frecuente: Depresión, amnesia, paranoia, bruxismo, labilidad emocional, apatía, sueños anormales, euforia, reacciones de paranoia, alucinaciones, reacciones agresivas, depresión agravada, delirios.
— Raro: Síndrome de abstinencia, ideas suicidas, incremento de la libido, sonambulismo e ilusión.
Trastornos del sistema reproductor:
— Poco frecuente: Desórdenes menstruales, dismenorrea, sangrado intermenstrual, hemorragia vaginal, amenorrea, leucorrea.
— Raros: En las mujeres dolor en el pecho, menorragia, balanopostitis, crecimiento del pecho, vaginitis atrófica, mastitis aguda en mujeres.
Trastornos de piel y tejidos subcutáneos:
— Poco frecuente: Prurito, acné urticaria, alopecia, piel seca, rash eritematoso, reacciones de fotosensibilidad, rash maculopapular.
— Raro: Rash folicular, eczema, dermatitis, dermatitis por contacto, erupciones bulosas, hipertricosis, decoloración de la piel y rash pustular.
Trastornos del sistema nervioso autónomo:
— Frecuente: Impotencia.
— Poco frecuente: Enrojecimiento, salivación, piel fría y sudorosa, midriasis.
— Raro: Glaucoma, priapismo y vasodilatación.
Cardiovascular:
— Frecuente: Palpitaciones, dolor de pecho.
— Poco frecuente: Hipertensión, taquicardia, mareos posturales, hipotensión postural, edema periorbital, edema periférico, hipotensión, isquemia periférica, síncope, edema, edema depediente.
— Raro: Dolor de pecho precordial, dolor de pecho subesternal, hipertensión agravada, infarto del miocardio, trastorno cerebro-vascular.
Desórdenes endocrinos:
— Raro: Exoftalmos, ginecomastia.
General:
— Frecuente: Dolor de espalda, astenia, malestar general, aumento de peso.
— Poco frecuente: Fiebre, rigidez, edema generalizado.
— Raro: Edema en la cara, estomatitis aftosa.
Trastornos vestibulares y auditivos:
— Raro: Hiperacusia, trastornos del laberinto.
Hematopoyético y linfático:
— Raro: Anemia, hemorragia en la cámara anterior del ojo.
Trastornos del sistema biliar y linfático:
— Raro: Función hepática anormal.
Trastornos del sistema musculoesquelético:
— Frecuente: Mialgia.
— Poco frecuente: Artralgia, distonía, artrosis, calambres musculares, debilidad muscular.
Trastornos del sistema respiratorio:
— Frecuente: Rinitis.
— Poco frecuente: Tos, disnea, infecciones del tracto respiratorio superior, epistaxis, broncoespasmo, sinusitis.
— Raro: Hiperventilación, bradipnea, estridor, apnea, bronquitis, hemoptisis, hipoventilación, laringismo y laringitis.
Sentidos especiales:
— Frecuente: Tinitus.
— Poco frecuente: Conjuntivitis, dolor de oído, dolor de ojos, acomodación anormal.
— Raro: Xeroftalmia, fotofobia, diplopia, lagrimación anormal, escotoma, defecto en el campo visual.
Trastornos del sistema urinario:
— Poco frecuente: Micción frecuente, poliuria, retención urinaria, disuria, nicturia, incontinencia urinaria.
— Raro: Cistitis, oliguria, pielonefritis, hematuria, dolor renal, estranguria.
Estudios de laboratorio: En hombres, aumento asintomático de las transaminasas séricas se han reportado de forma infrecuente en asociación con la ingesta de ALTRULINE*. Esto sucede usualmente durante la 1 a la 9 semana de tratamiento y disminuye luego de la descontinuación de la droga.
La terapia con ALTRULINE* se ha asociado con pequeños incrementos en el colesterol total (aproximadamente 3%) y triglicéridos (aproximadamente 5%) y pequeñas disminuciones en el ácido úrico sérico (aproximadamente 7%) al parecer sin importancia clínica.
El perfil de efectos secundarios comunmente observados en los estudios a doble ciego, controlados con placebo en pacientes con TOC, trastorno de pánico, TPET, y fobia social fue similar al observado en los ensayos clínicos en pacientes con depresión.
Información posterior a la comercialización:
Trastornos del sistema sanguíneo: Leucopenia y trombocitopenia.
Trastornos cardiacos: Palpitaciones y taquicardia.
Trastornos de oído y laberinto: Tinitus.
Trastornos endocrinológicos: Hiperprolactinemia, hipotiroidismo y síndrome de secreción inapropiada de hormona antidiurética.
Trastornos oculares: Midriasis y visión anormal.
Trastornos gastrointestinales: Dolor abdominal, estreñimiento, pancreatitis y vómito.
Trastornos generales y condiciones en el sitio de administración: Astenia, dolor toráxico, edema periférico, fatiga, fiebre y malestar.
Trastornos hepatobiliares: Eventos hepáticos serios (incluyendo hepatitis, ictericia e insuficiencia hepática) y elevaciones asintomáticas en transaminasas séricas (TGO y TGP).
Trastornos del sistema inmunológico: Reacción alérgica, alergia y reacción anafilactoide.
Investigaciones: Resultados anormales en laboratorio clínico, función plaquetaria alterada, aumento en el colesterol sérico, disminución de peso y aumento de peso.
Trastornos del metabolismo y de la nutrición: Aumento en el apetito e hiponatremia.
Trastornos musculoesqueléticos y de tejido conectivo: Artralgia y calambres musculares.
Trastornos del sistema nervioso central: Coma, convulsiones, cefalea, hipoestesia, migraña, trastornos del movimiento (incluyendo síntomas extrapiramidales como hipercinesia, hipertonía, crujido de dientes, o anormalidades en la marcha), contracciones musculares involuntarias, parestesia y síncope.
También se reportaron signos y síntomas asociados con el síndrome de la serotonina: En algunos casos asociados con el uso concomitante de medicamentos serotoninérgicos que comprenden agitación, confusión, diaforesis, diarrea, fiebre, hipertensión, rigidez y taquicardia.
Trastornos psiquiátricos: Reacción agresiva, agitación, ansiedad, síntomas depresivos, euforia, alucinación, disminución de la libido en mujeres, disminución de la libido en hombres, paroniria y psicosis.
Trastornos renales y urinarios: Enuresis, incontinencia urinaria y retención urinaria.
Trastornos del sistema reproductor y de los senos: Galactorrea, ginecomastia, irregularidades menstruales y priapismo.
Trastornos respiratorios, toráxicos y mediastinales: Broncoespasmo y bostezo.
Trastornos de piel y tejido subcutáneo: Alopecia, angioedema, edema facial, edema periorbital, reacción de fotosensibilidad en la piel, prurito, púrpura, rash (incluyendo reportes poco usuales de trastornos exfoliativos serios en piel, p. ej., el síndrome de Stevens Johnson y necrólisis epidérmica) y urticaria.
Trastornos vasculares: Sangrado anormal (como epistaxis, sangrado gastrointestinal o hematuria), sofocos e hipertensión.
Otros: Se han reportado síntomas después de la suspensión de sertralina, los cuales incluyen agitación, ansiedad, vértigo, cefalea, náuseas y parestesia.
Abuso y dependencia
Dependencia física y psicológica: En un estudio comparativo, randomizado a doble ciego, placebo-control, del abuso de ALTRULINE*, alprazolam y anfetaminas en humanos, el ALTRULINE* no presentó los signos positivos indicativos de abuso potencial, tales como euforia o predilección por la droga, que fueron observadas con las otras drogas. Los estudios clínicos de pre-mercadeo no revelan ningún síndrome por la suspensión del medicamento o comportamiento para volver a ingerir el medicamento. En estudios en animales, el ALTRULINE* no demostró estímulo o potencial de abuso similar al de barbituratos. Pero como con cualquier sustancia que actúa a nivel del sistema nervioso central, los médicos deben evaluar cuidadosamente la historia del paciente sobre abuso de drogas y seguir a los pacientes de cerca, observándolos para determinar si existen signos de abuso.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES ESPECIALES PARA EL USO:
Síndrome serotoninérgico (SS) o síndrome neuroléptico maligno (SNM): Se ha reportado el desarrollo de síndromes que potencialmente amenazan la vida como síndrome serotoninérgico (SS) o síndrome neuroléptico maligno (SNM) con cambio de inhibidores selectivos de la recaptura de serotonina (ISRSs), incluyendo el tratamiento con sertralina. El riesgo de SS o SNM con ISRSs se incrementa con el uso concomitante de fármacos serotoninérgicos (incluyendo triptanos), con fármacos que afectan el metabolismo de serotonina (incluyendo IMAOs), antipsicóticos y otros antagonistas de la dopamina.
Los síntomas de SS pueden incluir: Cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión sanguínea lábil, hipertermia), aberraciones neuromusculares (p. ej., hiperreflexia, incoordinación) y/o síntomas gastrointestinales (p. ej., náusea, vómito, diarrea). Algunos signos de SS, incluyen hipertermia, rigidez muscular, inestabilidad autonómica con posible fluctuación rápida de los signos vitales y cambios del estado mental parecidos al SNM. Se debe monitorear la aparición de signos y síntomas de SS y SMN en los pacientes (ver Contraindicaciones).
Inhibidores de la monoamino oxidasa: Se han reportado casos de reacciones serias, a veces fatales, en pacientes que recibieron sertralina en combinación con un inhibidor de la monoamino oxidasa (IMAO), incluyendo el IMAO selectivo, selegilina, el IMAO reversible, moclobemida, y fármacos IMAO, p. ej.: Linezolid.
Algunos casos se presentaron con características que asemejan al síndrome serotoninérgico cuyos síntomas incluyen: Hipertermia, rigidez, mioclonía, inestabilidad autónoma con posibles fluctuaciones rápidas de signos vitales, cambios en el estado mental que comprenden confusión, irritabilidad y agitación extrema que pueden llegar a delirio y coma. Por lo tanto, la sertralina no debe ser usada en combinación con un IMAO, ni en un plazo menor de los 14 días posteriores a la suspensión del tratamiento con estos fármacos. En forma similar, deberán transcurrir al menos 14 días después de haber suspendido el tratamiento con sertralina para iniciar la administración de un IMAO. (Véase Contraindicaciones).
Otros fármacos serotoninérgicos: La coadministración de sertralina con otros fármacos que aumentan los efectos de la neurotransmisión serotoninérgica, como el triptófano, la fenfluramina o agonistas 5-HT o el medicamento herbolario hierba de San Juan (Hypericum perforatum) deben tratarse con precaución y evitarse cuando sea posible, debido al potencial de interacción farmacodinámica (véase Interacción con otros medicamentos y otras formas de interacción).
Cambio de los fármacos inhibidores selectivos de la recaptación de serotonina (ISRS), antidepresivos o antiobsesivos: Existe experiencia controlada limitada con respecto al periodo óptimo de cambio de los fármacos ISRS, antidepresivos o antiobsesivos a la sertralina. Deberá ponerse en práctica un juicio médico prudente y tener cuidado cuando se hace el cambio, particularmente desde agentes de acción prolongada como la fluoxetina. No se ha establecido la duración del periodo de lavado que debe intervenir antes de pasar de un ISRS a otro.
Activación de manía/hipomanía: Durante los ensayos previos a la comercialización, se presentó hipomanía o manía en aproximadamente 0.4% de los pacientes tratados con sertralina. También se ha informado de la activación de la manía/hipomanía en una pequeña proporción de pacientes con trastorno afectivo mayor, tratados con otros medicamentos antidepresivos y antiobsesivos disponibles en el mercado.
Convulsiones: Las convulsiones son un riesgo potencial con fármacos antidepresivos y antiobsesivos. Se reportaron convulsiones en aproximadamente 0.08% de los pacientes tratados con sertralina en el programa de desarrollo para depresión. No se reportaron convulsiones en los pacientes tratados con sertralina en el programa de desarrollo para pánico. Durante el programa de desarrollo para TOC, cuatro de aproximadamente 1,800 pacientes expuestos a la sertralina experimentaron convulsiones (aproximadamente 0.2%). Tres de estos pacientes eran adolescentes, dos con trastorno de convulsión y uno con historia familiar de trastorno de convulsión, ninguno de los cuales estaba recibiendo un medicamento anticonvulsivo. En todos estos casos, la relación con la terapia de sertralina fue incierta. Puesto que la sertralina no se ha evaluado en pacientes con algún trastorno convulsivo, ésta deberá evitarse en pacientes con epilepsia inestable y deberá vigilarse cuidadosamente a los pacientes con epilepsia controlada. La sertralina debe suspenderse en cualquier paciente que desarrolle convulsiones.
Suicidio: Debido a que la posibilidad de intento de suicidio es inherente a la depresión y puede persistir hasta que se alcance una remisión significativa, deberá supervisarse a los pacientes durante el curso inicial del tratamiento.
Todos los pacientes pediátricos que sean tratados con antidepresivos para cualquier indicación deben ser observados de cerca para detectar el empeoramiento clínico, actitud suicida o cambios inusuales de comportamiento, especialmente durante los primeros meses de tratamiento, cuando hay cambios en la dosis, ya sea aumentos o disminuciones. Los pacientes adultos también deben ser observados de cerca.
Hemorragia/sangrado anormal: Han habido reportes de anormalidades en el sangrado cutáneo, tal como equimosis y púrpura con los ISRS. Se recomienda tener precaución con pacientes que están tomando ISRS, particularmente en el uso concomitante de fármacos que se conoce afectan la función plaquetaria (por ej., antipsicóticos y fenotiazinas, la mayoría de los antidepresivos triciclicos, la aspirina y los fármacos anti-inflamatorios no esteroideos (AINES) así como en pacientes con una historia de trastornos de sangrado (ver Interacción con otros medicamentos y otras formas de interacción).
Hiponatremia: La hiponatremia puede ocurrir como resultado del tratamiento con ISRSo ISRN incluyendo la sertralina. En muchos casos, la hiponatremia parece ser el resultado de un síndrome de secreción inapropiada de la hormona antidiurética (SIADH). Se han reportado casos de niveles de sodio sérico por debajo de 110 mmol/L. Los pacientes de edad avanzada pueden tener mayor riesgo de desarrollar hiponatremia con ISRSo ISRN. También los pacientes que toman diuréticos o que de alguna otra forma presentan depleción del volumen pueden tener un mayor riesgo (ver Uso en personas de edad avanzada). Se debe considerar la descontinuación de sertralina en pacientes con hiponatremia sintomática y debe instituirse una intervención médica apropiada. Los signos y síntomas de la hiponatremia incluyen cefalea, dificultad para concentrarse, trastornos de la memoria, confusión, debilidad e inestabilidad lo cual puede conducir a caídas. Los signos y síntomas asociados con los casos más severos y/o agudos han incluido alucinaciones, síncope, convulsiones, coma, paro respiratorio y muerte.
Debido a la comorbilidad bien establecida entre TOC y la depresión, el trastorno de pánico y la depresión, TEPT y la depresión, y la fobia social y la depresión, deben observarse las mismas precauciones observadas cuando se tratan pacientes con depresión al tratar pacientes con TOC, trastornos de pánico, TEPT o fobia social.
Uso en insuficiencia hepática: La sertralina se metaboliza extensamente por el hígado. Un estudio farmacocinético con dosis múltiples, en sujetos con cirrosis leve, estable, demostró una vida media de eliminación prolongada y un ABC y Cmáx aproximadamente tres veces mayores, en comparación con individuos normales. No hubo diferencias significativas en la fijación de proteínas plasmáticas observada entre los dos grupos. El uso de sertralina en pacientes con enfermedad hepática debe ser abordado con precaución. Deberá usarse una dosis más baja o menos frecuente en pacientes con disfunción hepática.
Uso en insuficiencia renal: La sertralina se metaboliza extensamente. La excreción del fármaco intacto en la orina es una ruta menor de eliminación. En estudios de pacientes con insuficiencia renal leve a moderada (aclaramiento de creatinina de 30-60 ml/min) o con insuficiencia renal moderada a severa (aclaramiento de creatinina de 10-29 ml/min), los parámetros farmacocinéticos de dosis diversas (ABC0-24 o Cmáx), no fueron significativamente diferentes, en comparación con los controles. Las vidas medias fueron similares y no hubo diferencias en la fijación a proteínas plasmáticas en todos los grupos estudiados. Este estudio indica que, como se esperaba de la baja excreción renal de la sertralina, la dosificación de ésta no tiene que ajustarse con base en el grado de insuficiencia renal.
Pérdida de peso: La pérdida significativa de peso puede ser un efecto indeseable como resultado del tratamiento con sertralina para algunos pacientes, pero en promedio, los pacientes en estudios, han presentado una pérdida de 1 a 2 onzas de peso en comparación con pequeños cambios con placebo. Es raro que los pacientes deban descontinuar el tratamiento por pérdida de peso.
Descontinuación del tratamiento con ALTRULINE*:
Se han observado eventos espontáneos que ocurren al descontinuar la sertralina u otros ISRS o ISRN, particularmente cuando es de forma abrupta, que incluyen los siguientes: Disforia, irritabilidad, agitación, mareos, disturbios sensoriales (ej.: Parestesias como sensación de shock eléctrico), ansiedad, confusión, dolor de cabeza, letargo, labilidad emocional, insomnio e hipomania. Mientras que estos síntomas por lo general son autolimitados, se han reportado síntomas serios al descontinuar el tratamiento.
Los pacientes deben ser monitoreados cuando se descontinua el tratamiento con ALTRULINE*. Se recomienda una suspensión gradual más que un cese abrupto, siempre que sea posible. Si aparecen síntomas de intolerancia se debe considerar una reducción de la dosis. Subsecuentemente, el médico puede seguir disminuyendo la dosis pero de una forma más gradual.
Sangrado anormal: Se han reportado episodios de sangrado en pacientes tratados con drogas psicotrópicas que interfieren con la recaptación de serotonina. Subsecuentemente estudios epidemiológicos, ambos de tipo caso-control y de cohorte, han demostrado una asociación entre el uso de drogas psicotrópicas que interfieren con la recaptación de serotonina y la ocurrencia de sangrado gastrointestinal. A pesar de que estos estudios se enfocaron en el sangrado gastrointestinal superior, hay una razón para que creer que el sangrado en otros lugares también puede ser similarmente potenciado.
Débil efecto uricosúrico: La sertralina está asociada con una disminución del ácido úrico de aproximadamente 7%. El significado clínico de este débil efecto uricosúrico es desconocido.
Uso en pacientes con enfermedades concomitantes: La experiencia clínica de sertralina con enfermedades asociadas es limitada. Se recomienda precaución al utilizar sertralina en pacientes con enfermedades o condiciones que pueden afectar el metabolismo o la respuesta hemodinámica.
Pacientes con historial de infarto del miocardio o enfermedad cardiaca inestable se excluyeron de los estudios clínicos durante los ensayos de pre-mercadeo. Sin embargo, los electrocardiogramas de 774 pacientes que recibieron sertralina en un estudio a doble ciego fueron evaluados y la información indicó que sertralina no está asociado con el desarrollo de anormalidades significativas en el ECG.
Función de las plaquetas: Se han presentado pocos reportes de alteración en la función de las plaquetas y/o resultados anormales en estudios de laboratorio en pacientes tomando sertralina, no es claro si la sertralina tiene un rol causal.
Información para pacientes: Los profesionales en la salud le deben informar al paciente, a sus familias o responsables acerca de los beneficios y los riesgos asociados con el tratamiento de ALTRULINE* y deben aconsejarlos en cuanto a su uso.
Los pacientes deben ser advertidos en cuanto a lo siguiente:
Empeoramiento clínico o riesgo de suicidio: Los pacientes, sus familias o responsables deben ser alertados en cuanto a la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresión, impulsividad, hipomanía, manía, otros cambios inusuales en el comportamiento, empeoramiento de la depresión, ideas suicidas, especialmente en pacientes mayores durante el tratamiento con antidepresivos y cuando la dosis es ajustada hacia arriba o hacia abajo. Las familias o encargados de los pacientes deben ser alertados que deben observar la aparición de estos síntomas diariamente, ya que los cambios pueden ser abruptos. Estos cambios deben ser indicados al profesional de la salud, especialmente si son severos, esto puede estar asociado a un incremento del pensamiento suicida y comportamiento y puede indicar la necesidad de un monitoreo y la posibilidad de cambios en la dosis.
Los pacientes deben ser informados de que a pesar de que el ALTRULINE* ha demostrado que los sujetos normales pueden realizar las tareas que requieren habilidades mentales y motoras complejas en los experimentos de laboratorio, las drogas que actúan a nivel del sistema nervioso central pueden afectar a los individuos. Por lo tanto, los pacientes deben ser informados que hasta que no aprendan como responden al ALTRULINE*, deben realizar de forma cuidadosa las actividades cuando requieran de estar alerta, tales como manejar un carro y operar maquinaria.
Los pacientes deben ser informados que deben tener cuidado al utilizar de forma concomitante el ALTRULINE* y los AINES no selectivos, aspirina y otras dorgas que afecten la coagulación ya que la combinación de drogas psicotrópicas que interfieren con la recaptación de serotonina y estos agentes han sido asociados con un incremento en el riesgo de sangrado.
Los pacientes deben ser informados que a pesar de que el ALTRULINE* no ha mostrado en experimentos con sujetos normales el incrementar la falla motora o mental causada por el alcohol, el uso concomitante de ALTRULINE* y alcohol no se recomienda.
Los pacientes deben ser advertidos que aunque ninguna interacción adversa entre ALTRULINE* y los productos OTC es conocido el riesgo potencial existe. Por lo que el uso de cualquier producto OTC debe ser iniciado cautelosamente de acuerdo con las direcciones de uso para los productos OTC.
Las mujeres deben advertir a su médico si quedan embarazadas o intentan estarlo durante la terapia.
Las pacientes deben indicar a su médico si están amamantando.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: La sertralina debe ser administrada una vez al día, en la mañana o por la noche.
Las tabletas de sertralina pueden administrarse con o sin alimentos. Las cápsulas de sertralina deben ser administradas con alimentos.
Tratamiento inicial:
Depresión y TOC: El tratamiento de sertralina debe ser administrado a una dosis de 50 mg/día.
Trastorno de pánico, TEPT y fobia social: La terapia debe iniciarse con 25 mg/día. Después de una semana, la dosis debe incrementarse a 50 mg una vez al día. Este régimen de dosificación ha demostrado reducir la frecuencia de los efectos secundarios que emergen con el tratamiento precoz, característicos del trastorno del pánico.
Trastorno disfórico pre-menstrual: El tratamiento debe iniciarse a una dosis de 50 mg/día, durante el ciclo menstrual o limitado a la fase lútea del ciclo menstrual, dependiendo de la evaluación del médico.
Titulación:
Para todas las indicaciones: Los pacientes que no responden a una dosis de 50 mg pueden beneficiarse de aumentos en la dosis. Los cambios en la dosis deben hacerse a intervalos de por lo menos una semana, hasta un máximo de 200 mg/día.
Los cambios en la dosis no deben efectuarse con más frecuencia que una vez a la semana debido a la vida media de eliminación de 24 horas de la sertralina.
El inicio del efecto terapéutico puede ser visto en el transcurso de 7 días. Sin embargo, periodos más prolongados son usualmente necesarios para demostrar una respuesta terapéutica, especialmente en TOC.
Mantenimiento: La dosificación durante la terapia a largo plazo debe mantenerse al nivel efectivo más bajo, con ajustes adicionales subsecuentes dependiendo de la respuesta terapéutica.
Uso en niños: La seguridad y eficacia de sertralina han sido establecidas en pacientes pediátricos con TOC con edades de 6 a 17 años. La administración de sertralina en pacientes pediátricos con TOC (con edades de 13 a 17 años) debería comenzar con 50 mg/día. La terapia para los pacientes pediátricos con TOC (6 a 12 años) debería iniciarse con 25 mg/día, aumentando a 50 mg/día después de una semana. Las dosis posteriores pueden aumentarse en caso de falta de respuesta, con incrementos de 50 mg/día, hasta un máximo de 200 mg/día, según sea necesario. En un estudio clínico en pacientes de 6 a 17 años con depresión o TOC, la sertralina pareció tener un perfil farmacocinético similar al encontrado en adultos. Sin embargo, los pesos corporales de los niños, generalmente más bajos que los pesos de los adultos, deben tomarse en consideración al aumentar la dosis de 50 mg, con el fin de evitar dosificaciones excesivas.
Titulación en niños y adolescentes: La sertralina tiene una vida media de eliminación de aproximadamente un día; los cambios en la dosis deben ocurrir a intervalos no menores de una semana.
Uso en adultos mayores: Puede utilizarse en los adultos mayores el mismo rango de dosis que en pacientes más jóvenes. Más de 700 adultos mayores >65 años han participado en estudios clínicos que han demostrado la eficacia de sertralina en esta población de pacientes. El patrón y la incidencia de las reacciones adversas en estos pacientes fue similar a la observada en pacientes más jóvenes.
Uso en insuficiencia hepática: El uso de sertralina en pacientes con enfermedad hepática debe ser abordado con precaución. Debe usarse una dosis menor o menos frecuente en pacientes con daño hepático. (Véase Advertencias especiales y precauciones especiales para el uso).
Uso en insuficiencia renal: Sertralina es extensamente metabolizada. La excreción del fármaco intacto por la orina es una ruta menor de eliminación. Es de esperarse que por la baja excreción renal de sertralina, no sea necesario ajustar la dosis con base en el grado de daño renal. (Véase Advertencias especiales y precauciones especiales para el uso).
Cambio hacia o desde tratamientos con inhibidores de la monoamino oxidasa –IMAOs: Al menos 14 días deben mediar entre la descontinuación de un IMAO y el inicio de la terapia con sertralina. A su vez, 14 días deben mediar entre la suspensión del tratamiento con sertralina y el inicio de una terapia con un IMAO.
Tratamiento de mujeres durante el tercer trimestre de embarazo: Los neonatos expuestos a sertralina u otros ISRSs o ISRNs, avanzado en el tercer trimestre han desarrollado complicaciones que requieren hospitalización, soporte respiratorio y alimentación por medio de sonda (ver Precauciones). Cuando se trate una mujer durante el tercer trimestre de embarazo, el médico debe evaluar cuidadosamente el riesgo/beneficio del tratamiento con sertralina. El médico debe considerar la reducción.
Descontinuación del tratamiento con ALTRULINE*: Se han reportado síntomas asociados a la suspensión del tratamiento con ALTRULINE* u otros ISRSs e ISRNs (ver Precauciones). Los pacientes deben ser monitoreados al descontinuar el tratamiento. Se recomienda una reducción gradual siempre que sea posible. Si aparecen síntomas de intolerancia luego de una disminución en la dosis o luego del cese del tratamiento, entonces se debe considerar una reducción de la dosis. Subsecuentemente, el médico puede seguir disminuyendo la dosis pero de una forma más gradual.
SOBREDOSIS: De acuerdo con la evidencia disponible la sertralina tiene un amplio margen de seguridad en caso de sobredosis. Se han reportado sobredosis aisladas de sertralina hasta de 13.5 g. Se han reportado muertes por sobredosis que comprometen a la sertralina, principalmente en combinación con otros fármacos y/o alcohol. Por esta razón, cualquier sobredosificación debe tratarse en forma intensa. Los síntomas de sobredosis incluyen efectos adversos mediados por la serotonina, como somnolencia, molestias gastrointestinales (como náuseas y vómito), taquicardia, temblor, agitación y mareos. El efecto menos frecuentemente reportado fue coma.
No hay antídotos específicos para la sertralina. Se debe establecer y mantener una vía aérea y asegurar la oxigenación y ventilación adecuada, en caso necesario. El carbón activado, que puede ser usado con un catártico, puede ser tan efectivo o más que el lavado gástrico, por lo que debe tomarse en consideración cuando se trate de una sobredosis. No se recomienda la inducción de emesis. Se recomienda un monitoreo de los signos vitales y cardiacos, en conjunto con medidas generales de soporte y sintomáticas. Debido al gran volumen de distribución de la sertralina, la diuresis forzada, diálisis, hemoperfusión o transfusión probablemente no sean de beneficio.