
APIDRA
INSULINA
Solución inyectable
1 Cartucho(s), 3 mL Solución inyectable, 100 U/mL
1 Vial(es), 10 mL 100 U/mL
1 Cartucho(s), 2 mL Dispositivo, SoloStar
COMPOSICIÓN:
Fórmula:
Cada mL de SOLUCIÓN INYECTABLE contiene: 3,49 mg de insulina glulisina equivalentes a 100 U de insulina humana.
Cada cartucho contiene 3 mL equivalentes a 300 U de insulina glulisina.
Cada vial contiene 10 mL equivalentes a 1000 U de insulina glulisina.
Los excipientes de todas las presentaciones son: m-cresol, trometamol, cloruro de sodio, polisorbato 20, hidróxido de sodio, ácido clorhídrico y agua para inyección cs.
INDICACIONES TERAPÉUTICAS:
Indicaciones:
Diabetes mellitus, cuando se requiera el tratamiento con insulina.
Acción farmacológica:
Farmacodinamia:
Mecanismo de acción:
La actividad principal de las insulinas y los análogos de insulina, incluida la insulina glulisina, es la regulación del metabolismo de la glucosa. Las insulinas reducen los niveles de glucosa en sangre mediante la estimulación de la captación de la glucosa periférica por el músculo esquelético, el tejido adiposo y por inhibición de la producción hepática de glucosa. Las insulinas inhiben la lipólisis en el adipocito, inhiben la proteólisis e incrementan la síntesis de proteínas.
Luego de su administración subcutánea, APIDRA® tiene un inicio de acción más rápido y la duración del efecto más corto en comparación con la insulina humana regular.
Farmacocinética:
Absorción y biodisponibilidad:
Los perfiles farmacocinéticos en voluntarios sanos y pacientes con diabetes (tipo 1 o 2) demostraron que la absorción de insulina glulisina fue aproximadamente dos veces más rápida respecto a la insulina humana regular, con aproximadamente el doble de altura en la concentración pico.
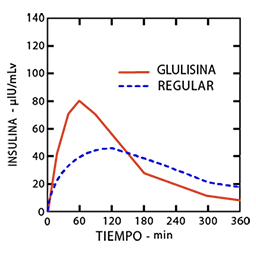
Figura 1: Perfil farmacocinético de la insulina glulisina e insulina humana regular en pacientes diabéticos tipo 1 luego de una dosis de 0,15 U/kg.
Distribución y eliminación:
Luego de su administración subcutánea, la insulina glulisina se elimina más rápidamente que la insulina humana regular con una vida media aparente de 42 minutos en comparación con 86 minutos.
FARMACOCINÉTICA Y FARMACODINAMIA:
Clase farmacológica:
Insulina glulisina:
Análogo de insulina humana recombinante.
Agente antidiabético.
Código ATC: A10AB06.
La insulina glulisina difiere de la insulina humana en que el aminoácido asparagina de la posición B3 es reemplazado por lisina y la lisina en la posición B29 es reemplazada por ácido glutámico.
La insulina glulisina es producida por la tecnología de ADN recombinante, empleando una cepa de Escherichia coli (K12).
CONTRAINDICACIONES:
Hipersensibilidad a la insulina glulisina o a los componentes de la fórmula.
PRECAUCIONES:
Debido a la corta duración de acción de APIDRA®, los pacientes con diabetes también requieren terapia con una insulina de acción prolongada o infusión de insulina por bomba para mantener un control adecuado de la glucosa.
Cualquier cambio de insulina debe ser efectuado con cautela y sólo bajo supervisión médica. Los cambios en la concentración de insulina, fabricante, tipo (ej., regular, NPH, análogos), especie (animal, humana) o método de elaboración (ADNr versus insulina de fuente animal), puede requerir un cambio en la posología. De ser necesario, se ajusta el tratamiento antidiabético oral concomitante.
Los requerimientos de insulina pueden variar durante condiciones intercurrentes tales como enfermedad, trastornos emocionales o estrés.
Hiperglucemia:
La utilización de dosis inadecuadas o la interrupción del tratamiento, especialmente en diabéticos insulino-dependientes, podría dar lugar a una hiperglucemia o cetoacidosis diabética; condiciones que son potencialmente letales.
Hipoglucemia:
El tiempo de aparición de una hipoglucemia depende del perfil de acción de las insulinas administradas y por lo tanto, puede cambiar cuando se modifica el régimen de tratamiento.
Las condiciones que podrían hacer que los primeros síntomas de aviso de una hipoglucemia sean diferentes o menos pronunciados, incluyen diabetes de larga duración, terapia insulínica intensiva, neuropatía diabética, medicamentos como betabloqueantes o después de pasar de una insulina de origen animal a una insulina humana.
También podría ser necesario un ajuste de la dosis si los pacientes incrementan la actividad física o si hacen un cambio en su plan de comidas habitual. El ejercicio realizado inmediatamente después de una comida podría incrementar el riesgo de hipoglucemia.
En comparación con la insulina humana soluble, si la hipoglucemia aparece después de una inyección con análogos de acción rápida, ésta podría aparecer antes.
Al igual que con todas las insulinas, bajo ciertas condiciones, los síntomas de alarma de hipoglucemia pueden cambiar, ser menos pronunciados o estar ausentes, por ejemplo:
• Si el control glucémico ha mejorado notablemente.
• Si la hipoglucemia se desarrolla gradualmente.
• En pacientes ancianos.
• En pacientes que presentan neuropatía autonómica.
• En pacientes con prolongado historial de diabetes.
• En pacientes que reciben tratamiento concomitante con otros medicamentos (ver Interacciones medicamentosas y de otro género).
Estas situaciones pueden ocasionar hipoglucemia grave (y posiblemente pérdida del conocimiento) antes de que el paciente sea consciente de su hipoglucemia.
Reacciones hipoglucémicas o hiperglucémicas no tratadas pueden causar pérdida de conocimiento, coma o muerte.
Las necesidades de insulina podrían alterarse durante una enfermedad o trastornos emocionales.
Insuficiencia renal:
En pacientes con deterioro de la función renal, los requerimientos de insulina pueden disminuir, como sucede con todas las insulinas (ver Farmacocinética y farmacodinamia).
Insuficiencia hepática:
En los pacientes con deterioro hepático, los requerimientos de insulina pueden disminuir debido a la capacidad reducida de gluconeogénesis y a la reducción del metabolismo de la insulina (ver Farmacocinética y farmacodinamia).
Dispositivos a ser usados con los cartuchos de APIDRA®:
Los cartuchos de APIDRA® sólo se deben usar con las plumas reutilizables de Sanofi, pregunte a su médico/farmacéutico. Estos cartuchos no se deben usar con otros dispositivos reutilizables ya que la exactitud de la dosis no ha sido determinada con dispositivos de otros fabricantes.
Bomba de infusión subcutánea continua:
El malfuncionamiento de la bomba de insulina, del set de infusión o errores en la manipulación, pueden conducir rápidamente a hiperglucemia, cetosis o cetoacidosis diabética. Es necesaria la pronta identificación y corrección de la causa de hiperglucemia, cetosis o cetoacidosis diabética.
Se puede requerir el uso temporal de inyecciones subcutáneas de APIDRA®. Los pacientes que usan terapia con bombas de infusión subcutánea continua de insulina tienen que estar entrenados para la administración de insulina inyectable y deben tener un sistema alternativo de administración de insulina (ver Administración).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo y lactancia:
No hay estudios clínicos controlados sobre el uso de APIDRA® en mujeres embarazadas.
Una cantidad limitada de datos (menos de 300 reportes de embarazo) en mujeres embarazadas expuestas a la insulina glulisina comercial, indican que no hay problemas de seguridad por el uso de insulina glulisina durante el embarazo, en el feto ni en el recién nacido.
Es importante para las pacientes con diabetes o antecedentes de diabetes gestacional, mantener un buen control metabólico antes y durante el embarazo. Los requerimientos de insulina pueden disminuir durante el primer trimestre y generalmente aumentan durante el segundo y tercer trimestre. Inmediatamente después del parto, los requerimientos de insulina decaen rápidamente. En estas pacientes es esencial un monitoreo cuidadoso del nivel de glucosa.
Las pacientes con diabetes deben informar a su médico si planean quedar embarazadas o si ya lo están.
Se desconoce si APIDRA® se excreta en la leche humana.
Las mujeres en periodo de lactancia pueden requerir ajustes en la dosis de insulina y en la dieta.
REACCIONES ADVERSAS:
Los eventos adversos observados son conocidos para esta clase farmacológica y por tanto son frecuentes con las insulinas.
Hipoglucemia: Es por lo general la reacción adversa más frecuente de la terapia con insulina, puede presentarse si la dosis de insulina es demasiado alta en relación con el requerimiento de la misma.
Alergia local: En ocasiones se puede presentar enrojecimiento, tumefacción y picazón en el sitio de inyección que se resuelve en pocos días o semanas.
En algunos casos, estas reacciones pueden estar relacionadas con factores diferentes a la insulina, como son los agentes irritantes de productos para limpieza de la piel o la técnica inapropiada de inyección.
Reacciones alérgicas sistémicas a la insulina: Tales reacciones a la insulina (incluyendo la insulina glulisina) o a los excipientes pueden estar asociadas, por ejemplo, con erupción cutánea (incluyendo prurito) en todo el cuerpo, dificultad respiratoria, sibilancias, reducción de la presión sanguínea, pulso rápido o sudoración. Los casos severos de alergia generalizada, incluyendo reacción anafiláctica, pueden poner en peligro la vida del paciente.
Al igual que con cualquier terapia insulínica, puede presentarse lipodistrofia en el sitio de la inyección y esta puede retardar la absorción local de la insulina. La rotación continua del sitio de aplicación en el área de inyección, puede ayudar a reducir o prevenir estas reacciones.
Se han reportado errores de medicación, en los que se han administrado otras insulinas particularmente de acción prolongada, en lugar de la insulina glulisina.
Lista tabulada de reacciones adversas:
A continuación se adjuntan las siguientes reacciones adversas procedentes de estudios clínicos según la clasificación por órganos y sistemas y en orden decreciente de incidencia (muy frecuentes: ≥ 1/10; frecuentes: ≥ 1/100 a < 1/10; poco frecuentes: ≥ 1/1.000 a < 1/100; raras: ≥ 1/10.000 a <1/1.000; muy raras: < 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Clasificación de órganos del sistema MedDRA |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
No conocida |
|
Trastorno del metabolismo y de la nutrición |
Hipoglucemia |
Hiperglucemia (potencialmente conduce a una cetoacidosis diabética(1)) |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Reacciones en el lugar de la inyección. Reacciones de hipersensibilidad local |
Lipodistrofia |
|||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones sistémicas de hipersensibilidad |
(1) APIDRA 100 Unidades/mL solución inyectable en un vial: la mayoría de los casos estaban relacionados con errores en el manejo o fallo de la bomba cuando se usó APIDRA® en ISCI.
Descripción de las reacciones adversas seleccionadas:
Trastornos del metabolismo y de la nutrición:
Los síntomas de una hipoglucemia normalmente aparecen de repente. Estos podrían incluir sudores fríos, piel pálida y fría, fatiga, nerviosismo o temblor, ansiedad, cansancio inusual o debilidad, confusión, dificultad de concentración, somnolencia, hambre excesiva, cambios en la visión, dolor de cabeza, náuseas y palpitaciones. La hipoglucemia puede llegar a ser severa y podría llevar a pérdida de conocimiento y/o convulsiones que podrían dar como resultado deterioro temporal o permanente de la función del cerebro o incluso muerte.
Trastornos de la piel y del tejido subcutáneo:
Las reacciones de hipersensibilidad local (enrojecimiento, hinchazón y picor en el lugar de inyección) podrían ocurrir durante el tratamiento con insulina. Estas reacciones generalmente son transitorias y normalmente desaparecen durante el tratamiento continuado.
Podría aparecer lipodistrofia en el lugar de inyección como consecuencia de un error en la rotación de los lugares de inyección dentro de un área.
Trastornos generales y alteraciones en el lugar de administración:
Las reacciones sistémicas de hipersensibilidad podrían incluir urticaria, opresión torácica, disnea, dermatitis alérgica y prurito. Los casos graves de alergia generalizada que incluyen una reacción anafiláctica pueden causar la muerte.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCCIÓN Y EL USO DE MAQUINARIA:
Efectos sobre la capacidad de conducir y usar maquinarias:
La capacidad de concentración y reacción del paciente puede verse afectada por la hipoglucemia, hiperglucemia o como resultado del deterioro visual.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones:
Las sustancias que pueden aumentar el efecto hipoglucemiante y la sensibilidad a la hipoglucemia son: agentes antidiabéticos orales, inhibidores de la ECA, disopiramida, fibratos, fluoxetina, inhibidores de la MAO, pentoxifilina, propoxifeno, salicilatos y antibióticos sulfonamídicos.
Entre las sustancias que pueden disminuir el efecto hipoglucemiante se incluyen: corticosteroides, danazol, diazóxido, diuréticos, glucagón, isoniazida, estrógenos y progestágenos (ej., en los anticonceptivos orales), derivados de la fenotiazina, somatropina, agentes simpaticomiméticos (ej., epinefrina, salbutamol, terbutalina), hormonas tiroideas, inhibidores de la proteasa y medicamentos antipsicóticos atípicos (ej., olanzapina y clozapina).
Los betabloqueadores, clonidina, sales de litio y alcohol pueden potenciar o debilitar el efecto hipoglucemiante de la insulina. La pentamidina puede causar hipoglucemia, algunas veces seguida de hiperglucemia.
Además, bajo la influencia de productos medicinales simpaticolíticos tales como betabloqueadores, clonidina, guanetidina y reserpina, los signos de contraregulación adrenérgica pueden estar reducidos o ausentes.
Relacionada a excipientes:
Este medicamento contiene sodio. Debe tenerse en cuenta en los pacientes con una dieta baja en sodio.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis y administración:
General:
APIDRA® es un análogo de insulina humana recombinante que ha demostrado ser equipotente a la insulina humana. Una unidad de APIDRA® tiene el mismo efecto hipoglucemiante que una unidad de insulina humana regular. Después de la administración subcutánea, el inicio de acción es más rápido y su duración es menor.
APIDRA® debe administrarse por inyección durante los 15 minutos previos o posteriores a los alimentos.
La dosis de APIDRA® debe ser individualizada y definida con base en la recomendaciones del médico y según las necesidades del paciente.
APIDRA® normalmente debe utilizarse en regímenes que incluyen una insulina de acción prolongada o un análogo de insulina basal.
Se recomienda el monitoreo de glucosa en sangre para todos los pacientes con diabetes.
Poblaciones especiales:
Niños:
APIDRA® puede ser administrado a niños a partir de los 4 años de edad. La administración a niños menores de 4 años no ha sido estudiada.
Ancianos:
La hipoglucemia puede ser difícil de reconocer en los ancianos (ver Precauciones).
Alteración de la función hepática:
En los pacientes con alteración de la función hepática, los requerimientos de insulina pueden disminuir (ver Precauciones).
Alteración de la función renal:
En los pacientes con alteración de la función renal, los requerimientos de insulina pueden disminuir (ver Precauciones).
Administración:
APIDRA® se administra por vía subcutánea o por bomba de infusión externa. APIDRA® debe administrarse subcutáneamente por inyección en la pared abdominal, muslo o región deltoidea, o por infusión subcutánea continua en la pared abdominal.
Al igual que con todas las insulinas, los sitios de inyección y de infusión (abdomen, muslo o músculo deltoides) deben rotarse de una inyección a la siguiente. La velocidad de absorción y en consecuencia, el inicio y la duración de acción pueden verse afectados por el ejercicio físico y otras variables.
Mezcla de insulinas para inyección subcutánea:
APIDRA® se puede mezclar con insulina humana NPH.
En este caso se debe llenar primero la jeringa con APIDRA® y luego se mezcla la insulina humana NPH. La preparación debe aplicarse inmediatamente.
Bomba de infusión subcutánea continua de insulina:
APIDRA® se puede utilizar para infusión subcutánea continua de insulina (ISCI) en adecuados sistemas de bombas para infusión de insulina. Los pacientes que usen ISCI deben ser instruidos sobre el uso del sistema de bomba.
El equipo de infusión y el reservorio de APIDRA®, se tienen que cambiar cada 48 horas con la técnica aséptica. Estas instrucciones pueden diferir del manual de instrucciones de la bomba. Es importante que los pacientes sigan las instrucciones específicas de APIDRA® cuando usen este producto, de lo contrario se pueden producir eventos adversos serios.
Cuando se utilice una bomba de infusión, APIDRA® no se debe mezclar con diluyentes ni con otra insulina.
Los pacientes que se administran APIDRA® con ISCI, deben contar con un sistema alternativo de aplicación de insulina por si falla el sistema de bomba.
MODO DE EMPLEO:
Preparación y manejo:
General:
Antes de su primer uso, APIDRA® tiene que conservarse a temperatura ambiente de 1 a 2 horas.
APIDRA® solo debe emplearse si la solución es clara, incolora, sin partículas sólidas visibles y si su consistencia es como la del agua.
Las instrucciones/manuales acerca del uso de APIDRA® en una bomba o en las plumas tienen que seguirse cuidadosamente.
Un vial, cartucho, sistema de cartucho o SoloStar® vacío nunca se debe reutilizar y debe ser descartado apropiadamente.
Viales:
Antes de retirar la insulina del vial por primera vez, remueva la tapa plástica protectora.
No agite el vial vigorosamente, ya que esto puede causar la formación de burbujas. Las burbujas pueden interferir con la medición correcta de la dosis.
Cartuchos y sistemas de cartuchos:
Los cartuchos y sistemas de cartuchos de APIDRA® no están diseñados para la mezcla de otras insulinas en el cartucho.
Si las plumas reutilizables funcionan mal, la solución se puede extraer del cartucho o del sistema de cartucho con una jeringa (adecuada para la insulina 100 U/mL) y luego se inyecta.
Información para el paciente:
Se han reportado errores accidentales en la administración de la insulina glulisina por confusión con otras insulinas, particularmente las de acción prolongada. Para evitar estos errores, los pacientes deben verificar el nombre de la insulina en la etiqueta y empaque antes de cada aplicación.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis:
Signos y síntomas: Hipoglicemia por sobredosis de insulina en relación con la ingesta de alimento, el gasto de energía o ambos.
Manejo: Los episodios leves/moderados de hipoglucemia usualmente se pueden tratar con carbohidratos orales. Se pueden requerir ajustes en la dosificación del producto, los hábitos alimenticios y la actividad física.
Los episodios más severos que conducen a coma, convulsiones o deterioro neurológico pueden ser tratados con glucagón intramuscular/subcutáneo o con glucosa concentrada intravenosa.
Puede ser necesaria la ingesta sostenida de carbohidratos y la observación, porque la hipoglucemia puede recurrir después de la recuperación clínica aparente.
PRESENTACIONES:
APIDRA® 100 U/mL SOLUCIÓN INYECTABLE: 1 cartucho de 3 mL.
APIDRA® 100 U/mL SOLUCIÓN INYECTABLE: 1 cartucho de 3 mL en el dispositivo SoloStar®.
APIDRA® 100 U/mL SOLUCIÓN INYECTABLE: 1 vial de 10 mL
No todas las presentaciones están disponibles en todos los países.
ESTRUCTURA QUÍMICA DE LA INSULINA GLULISINA:

Nombre Químico: 3B-lisina 29B–ácido glutámico–insulina humana
Elaborado Por:
Sanofi-Aventis Deutschland GmbH,
Bruningstrabe 50, D 65926 Frankfurt am Main, Alemania.
Imp./Dist:
Bolivia: Quimiza Ltda.
Q.F. Dra. Jenny Flores. Venta bajo receta médica.
Sanofi-aventis de Colombia S.A., Bogotá.
Sanofi-aventis del Ecuador S.A., Quito-Ecuador.
Sanofi-aventis de Venezuela S.A.
Insulin Glulisine CCDS v.10 (LRC 23 Jul 2013)
Revisión: Septiembre 2018
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Almacenamiento:
Los viales, cartuchos, sistemas de aplicación de cartuchos o SoloStar® de APIDRA® que no estén abiertos, deben ser almacenados en el refrigerador, entre 2°C y 8°C. APIDRA® no se debe almacenar en el congelador y no se debe congelar. Descarte si se congela.
Viales/cartuchos/sistema de cartuchos y SoloStar® abiertos (en uso): Los viales, cartuchos, sistemas de aplicación de cartuchos y Solostar® de APIDRA®, estén o no refrigerados, tienen que ser utilizados antes de 28 días. De lo contrario, se tienen que descartar. Si no es posible mantenerlos refrigerados, el vial abierto/cartucho/sistema de cartuchos o el SoloStar® en uso se pueden mantener sin refrigeración durante 28 días, lejos del calor y de la luz, en tanto que la temperatura no sea mayor a 25°C.
Después de colocar el cartucho o el sistema de cartucho en una pluma, este no puede almacenarse en el refrigerador.
Sets de Infusión:
Los sets de infusión (reservorios, tubos y catéteres) y el APIDRA® en el reservorio deben ser descartados luego de dos días de uso o si fueron expuestos a una temperatura que exceda los 37°C.
TODO MEDICAMENTO DEBE CONSERVARSE FUERA DEL ALCANCE DE LOS NIÑOS
BIBLIOGRAFÍA:
Bibliografía:
1. CSR 3001
2. CSR 3002
3. CSR 3004
4. CMC report
5. CSR 1012
6. CSR 3006
7. Clinical Overview: Update of Insulin Glargine (LANTUS and Optisulin), Insulin Glulisine (APIDRA) and Insulin Human (Insuman and Insulin Human Winthrop) Product Information. Rationale for changes. May 2010.
8. Pharmaceutical development - AllSTAR - Performance test (ISO 11608-1)
9. Pharmaceutical development-JuniorSTAR-Performance test (ISO 11608-1)
10. 1Clinical Overview: Insulin glulisine–Diabetic ketoacidosis. Authored by Zoran Doder and Svetoslav Dimitrov. 25 february 2013.
11. Clinical Overview: Insulin glulisine–Pregnancy exposure summary. Authored by Zoran Doder. February 2012.
12. Clinical Overview: Insulin Glulisine–Risk of Insulin Mix-ups. Authored by Ana- Carolina Giuseppi. 4 December 2008.
13. APIDRA cumulative-overview-medication-errors. Authored by Zoran Doder. August 2009.
14. CSR 1016
15. Study 1016
16. Study 1004
17. CSR 1964D-3301
18. CSR 1008
19. CSR 1004
20. CSR 1017
21. CSR 1010
22. CS R 1011
23. Summary of Product Characteristics: APIDRA–Approved by European Union. 3 April 2018.