ATROVENT REPUBLICA DOMINICANA
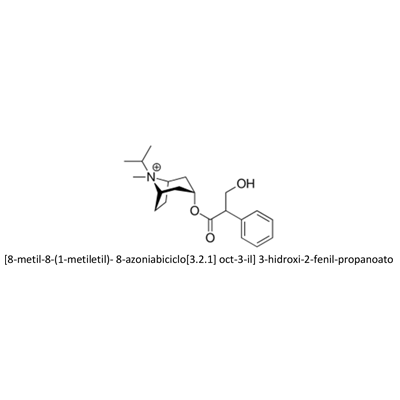
IPRATROPIO
Solución en aerosol
Envase(s), Solución en aerosol, 10 mL
Envase(s), Solución en aerosol, 10 mL
FORMA FARMACÉUTICA: Solución en aerosol (10mL=200 pulsaciones)
INDICACIONES TERAPÉUTICAS:
Para la prevención y tratamiento de la disnea en:
• Enfermedad pulmonar obstructiva crónica (EPOC).
• Asma leve a moderada en adultos y niños, si no están indicados los agonistas β2 o como complemento a los agonistas β2 durante ataques agudos de asma.
PROPIEDADES FARMACOLÓGICAS:
• Propiedades farmacodinamias:
Grupo farmacoterapéutico: Otros fármacos para las enfermedades obstructivas de vías respiratorias, inhalantes/anticolinérgicos
Código ATC: R03BB01
El Bromuro de Ipratropio es un compuesto de amonio cuaternario con propiedades anticolinérgicas (parasimpaticolíticas). En los estudios preclínicos, inhibe los reflejos mediatizados vagalmente al antagonizar la acción de la acetilcolina, el transmisor liberado de los nervios vagales. Los anticolinérgicos impiden el aumento de la concentración intracelular de Ca++ provocado por la interacción de la acetilcolina con el receptor muscarínico del músculo liso bronquial. La liberación del Ca++ se produce mediante el sistema del segundo mensajero formado por IP3 (inositol trifosfato) y DAG (diacilglicerol).
La broncodilatación subsiguiente a la inhalación de ATROVENT (Ipratropio) es principalmente un efecto localizado y específico en los pulmones, no sistémico.
La evidencia clínica y preclínica indica que ATROVENT (Ipratropio) no tiene efectos adversos sobre la secreción mucosa de las vías respiratorias, el aclaramiento mucociliar ni en el intercambio gaseoso.
Estudios clínicos: Los estudios clínicos con una duración de tratamiento de hasta 3 meses en los que se comparó la formulación con CFC (ATROVENT en inhalador de dosis medidas) contra la formulación sin CFC (ATROVENT solución en aerosol) en pacientes adultos y pediátricos con asma y EPOC han demostrado que las dos formulaciones son equivalentes terapéuticamente.
En estudios controlados de 90 días en pacientes con broncoespasmo asociado con enfermedad pulmonar obstructiva crónica (bronquitis crónica y enfisema), se produjeron mejorías significativas en la función pulmonar al cabo de 15 minutos. Estas mejorías alcanzaron un máximo a las 1-2 horas y persistieron durante 4-6 horas.
En estudios controlados de 90 días en pacientes con broncoespasmo asociado con el asma, se produjeron mejoras significativas de la función pulmonar (incremento del 15% en el VEF1) en el 51% de los pacientes.
• Propiedades farmacocinéticas:
Absorción: El efecto terapéutico de ATROVENT se produce por una acción local en las vías respiratorias. El transcurso de tiempo de la broncodilatación y de la farmacocinética sistémica no corren en paralelo.
Después de la inhalación, del 10 al 30% de una dosis se deposita generalmente en los pulmones, dependiendo de la formulación y la técnica de inhalación. La mayoría de la dosis se ingiere y pasa a través del tracto gastrointestinal.
La porción de la dosis depositada en los pulmones alcanza rápidamente la circulación (en minutos).
La excreción renal acumulada (0 - 24 horas) del compuesto original es por debajo del 1% de una dosis oral y aproximadamente del 3 al 13% de una dosis inhalada. Con base en estos datos, se estima que la biodisponibilidad sistémica total de las dosis orales e inhaladas de Bromuro de Ipratropio es del 2% y 7 – 28% respectivamente.
Tomando esto en cuenta, las porciones ingeridas de las dosis de Bromuro de Ipratropio no contribuyen significativamente a la exposición sistémica.
Distribución: Los parámetros cinéticos que describen la disposición del Ipratropio se calcularon a partir de las concentraciones plasmáticas después de la administración intravenosa. Se observó un descenso bifásico rápido de las concentraciones plasmáticas. El volumen aparente de distribución en estado estacionario (Vdss) es de aproximadamente 176 L (equivalente a 2.4 L/kg). El fármaco se une mínimamente (menos del 20%) a las proteínas plasmáticas. Los datos preclínicos indican que el compuesto de amonio cuaternario Ipratropio no atraviesa la placenta ni la barrera hematoencefálica.
Los metabolitos conocidos muestran poca o nula afinidad a los receptores muscarínicos y deben ser considerados inefectivos.
Biotransformación: Después de la administración intravenosa, aproximadamente el 60% de la dosis se metaboliza, probablemente en gran medida por oxidación en el hígado.
Los metabolitos conocidos, son formados por hidrólisis, deshidratación o eliminación del grupo hidroximetilo en el resto de ácido trópico.
Eliminación: La semivida de eliminación terminal es de aproximadamente 1.6 horas.
El Ipratropio tiene una depuración total de 2.3 L/min y una depuración renal de 0.9 L/min.
Después de la inhalación de Bromuro de Ipratropio con HFA 134a como propelente, la excreción renal acumulada durante 24 horas fue de aproximadamente 12%.
En un estudio de balance de excreción, la excreción renal acumulada (6 días) de radiactividad relacionada con el fármaco (incluyendo al compuesto original y todos los metabolitos) fue de 9.3% después de la administración oral y 3.2% después de la inhalación. La radiactividad total excretada a través de las heces fue del 88.5% después de la administración oral y del 69.4% después de la inhalación. La radiactividad relacionada con el fármaco después de la administración intravenosa se excreta principalmente a través de los riñones. La semivida de eliminación de la radiactividad relacionada con el fármaco (compuesto original y metabolitos) es de 3.6 horas.
• Datos preclínicos sobre seguridad:
Se ha investigado ampliamente la tolerabilidad local y sistémica del Bromuro de Ipratropio en varias especies animales usando diferentes vías de administración.
Toxicidad de una sola dosis: La toxicidad aguda por inhalación, y por administración oral o intravenosa se evaluó en varias especies de roedores y no roedores.
Al administrarse por inhalación, la dosis letal mínima en cobayos machos fue de 199 mg/kg. En ratas, no se observó mortalidad hasta las dosis más altas técnicamente factibles (0.05 mg/kg después de 4 horas de administración o 160 pulsaciones de Bromuro de Ipratropio a una dosis de 0.02 mg/pulsación).
Los valores de la DL50 oral para ratones, ratas y conejos fueron de 1585, 1925 y 1920 mg/kg respectivamente. Los valores de la DL50 para ratones y ratas y perros fueron de 13.6, 15.8 y aproximadamente 18.2 mg/kg respectivamente.
Los síntomas clínicos incluyeron midriasis, mucosa oral seca, disnea, temblor, espasmos y/o taquicardia.
Toxicidad de dosis repetidas: Se han realizado estudios de toxicidad de dosis repetidas en ratas, conejos, perros y monos Rhesus. En estudios de inhalación hasta 6 meses en ratas, perros y monos Rhesus, los niveles sin efectos adversos observados (NOAEL) fueron de 0.38 mg/kg/día, 0.18 mg/kg/día y 0.8 mg/kg/día respectivamente. Se observó sequedad en la mucosa oral y taquicardia en perros. No se observaron lesiones histopatológicas relacionadas con el Bromuro de Ipratropio en el sistema broncopulmonar o en ningún otro órgano. En ratas, el NOAEL después de 18 meses de administración oral fue de 0.5 mg/kg/día.
Los estudios de toxicidad por inhalación de dosis repetidas en ratas por hasta 6 meses y en perros por hasta 3 meses con otras formulaciones (formulación intranasal, formulación es con el propelente alterno HFA 134a y formulaciones con polvo de lactosa) no revelaron información adicional sobre el perfil general de toxicidad del Bromuro de Ipratropio. La administración intranasal durante un período de hasta 6 meses reveló un nivel sin efecto (NOEL) > 0.20 mg/kg/día en perros y confirmó los resultados de estudios anteriores con la administración intranasal hasta por 13 semanas. Los estudios de toxicidad de dosis repetidas de Bromuro de Ipratropio han demostrado que los perfiles toxicológicos de la formulación con HFA y la formulación convencional con CFC son similares.
Tolerabilidad local: Una solución acuosa de Bromuro de Ipratropio (0.05 mg/kg) fue localmente bien tolerada cuando se administró a ratas por inhalación (administración única durante 4 horas). En el estudio de toxicidad de dosis repetidas, el Bromuro de Ipratropio fue localmente bien tolerado.
Inmunogenicidad: No se produjo anafilaxia activa ni reacciones anafilácticas cutáneas pasivas en cobayos.
Genotoxicidad y carcinogenicidad: No hubo evidencia de genotoxicidad in vitro (prueba de Ames) ni in vivo (ensayo de micronúcleos, prueba letal dominante en ratones, ensayo citogenético en células de la médula ósea de hámster chino).
No se demostró ningún efecto tumorigénico ni carcinogénico en los estudios a largo plazo en ratones y ratas.
Toxicidad reproductiva y del desarrollo: Se han realizado estudios para investigar la posible influencia del Bromuro de Ipratropio en la fertilidad, toxicidad embrionaria y fetal, y en el desarrollo peri y postnatal en ratones, ratas y conejos.
Dosis orales altas (1000 mg/kg/día en ratas y 125 mg/kg/día en conejos) fueron maternotóxicas para ambas especies y embriotóxicas y fetotóxicas en ratas y causaron un menor peso fetal. No se observaron malformaciones relacionadas con el Bromuro de Ipratropio. No se tuvieron efectos adversos sobre la reproducción con las dosis más altas técnicamente viables para la inhalación del aerosol en dosis medidas (1.5 mg/kg/día en ratas y 1.8 mg/kg/día en conejos).
DATOS FARMACÉUTICOS:
Lista de excipientes:
Norflurano
Ácido cítrico (Ph. Eur.)
Etanol (alcohol) anhidro
Agua purificada
Incompatibilidades: No procede.
Periodo de validez: 3 años.
Precauciones especiales de conservación: Consérvese a no más de 30 °C.
CONTRAINDICACIONES:
ATROVENT solución en aerosol está contraindicado en pacientes con hipersensibilidad a la sustancia activa, a la atropina u otros derivados de la atropina (como el Bromuro de Ipratropio) o a cualquiera de los excipientes indicados en la sección 6.1.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
Hipersensibilidad: Se pueden presentar reacciones inmediatas de hipersensibilidad después del uso de ATROVENT solución en aerosol conforme lo demostrado, por ejemplo, por casos raros de exantema, urticaria, angioedema, edema orofaríngeo, broncoespasmos y anafilaxis.
Broncoespasmo paradójico: Al igual que con otros medicamentos inhalados, ATROVENT solución en aerosol puede causar broncoespasmo paradójico que pueda poner la vida en riesgo. Si se presenta broncoespasmo paradójico, inmediatamente deberá suspenderse el ATROVENT solución en aerosol y reemplazarse con un tratamiento alterno.
Poblaciones especiales:
Complicaciones oculares: Se debe tener cuidado para que ni la solución ni la niebla entren en contacto con los ojos.
ATROVENT solución en aerosol debe utilizarse con precaución en pacientes con alguna predisposición al glaucoma de ángulo estrecho.
Si el producto entra en contacto con los ojos de manera accidental durante su uso, se pueden presentar complicaciones oculares leves y reversibles. Existe el riesgo de un ataque agudo de glaucoma, particularmente en pacientes con glaucoma de ángulo estrecho; los síntomas característicos son dolor ocular, visión borrosa, halos visuales o imágenes coloridas, enrojecimiento de los ojos y edema de la córnea.
Si se presentan midriasis y trastornos leves de acomodación, se puede dar un tratamiento con gotas mióticas.
En caso de presentar eventos de complicaciones severas oculares, también se debe consultar al oftalmólogo.
Como el inhalador se utiliza en conjunto con una boquilla y se opera de forma manual, el riesgo de que la neblina entre a los ojos es bajo.
Efecto sobre los riñones y las vías urinarias: En pacientes con trastornos de micturación (como en la hipertrofia prostática o la obstrucción del cuello de la vejiga), el beneficio del tratamiento con Bromuro de Ipratropio debe evaluarse cuidadosamente contra el posible riesgo de agravamiento de la retención urinaria.
Trastornos de motilidad gastrointestinal: Los pacientes con fibrosis quística tienen mayor probabilidad de desarrollar trastornos de motilidad gastrointestinal.
Este medicamento contiene 9 mg de alcohol (etanol) por pulsación. La cantidad en cada pulsación de este medicamento es equivalente a menos de 1 mL de cerveza o 1 mL de vino.
La pequeña cantidad de alcohol que contiene este medicamento no produce ningún efecto perceptible.
FERTILIDAD, EMBARAZO Y LACTANCIA:
Embarazo y lactancia: No hay datos de uso en mujeres embarazadas o en periodo de lactancia.
Aunque a la fecha no se han identificado efectos teratogénicos, ATROVENT solución en aerosol no se debe utilizar durante el embarazo (especialmente durante el primer trimestre) ni durante la lactancia, a menos que el médico tratante lo considere necesario tras una cuidadosa evaluación de los beneficios y de los riesgos.
Los riesgos del tratamiento inadecuado deben asignarse con base en esta evaluación.
Fertilidad: No se dispone de datos clínicos sobre la fertilidad del Bromuro de Ipratropio. Los estudios preclínicos realizados con Bromuro de Ipratropio no mostraron efectos adversos sobre la fertilidad (véase la sección 5.3).
REACCIONES ADVERSAS:
Como todos los medicamentos, ATROVENT solución en aerosol puede causar efectos colaterales.
a) Resumen del perfil de seguridad: Muchas de las reacciones adversas indicadas se pueden atribuir a las propiedades anticolinérgicas de ATROVENT.
b) Tabla de reacciones adversas: Las reacciones adversas indicadas se identificaron en los datos de los estudios clínicos y en la vigilancia posterior a la comercialización. Su frecuencia se define usando la siguiente convención:
|
Muy frecuente |
(≥1/10) |
|
Frecuente |
(≥1/100-<1/10) |
|
Poco frecuente |
(≥1/1000 -<1/100) |
|
Rara |
(≥1/10,000 -< 1/1000) |
|
Muy rara |
(<1/10,000) |
|
Desconocida |
(La frecuencia no se puede calcular a partir de los datos disponibles) |
|
Trastornos del sistema inmunológico |
|
|
Poco frecuentes: |
Reacciones anafilácticas, hipersensibilidad |
|
Trastornos del sistema nervioso |
|
|
Frecuentes: |
Cefalea, mareos |
|
Trastornos oculares |
|
|
Poco frecuente: |
Visión borrosa, midriasis, incremento de la presión intraocular (algunas veces con dolor ocular), halos visuales o luces difusas, hiperemia conjuntiva y edema de la córnea, glaucoma |
|
Rara: |
Trastornos de la acomodación |
|
Trastornos cardiacos |
|
|
Poco frecuentes: |
Palpitaciones, taquicardia (supraventricular) |
|
Rara: |
Fibrilación auricular |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Frecuentes: |
Tos, irritación de garganta |
|
Poco frecuentes: |
Broncoespasmo (paradójico), laringoespasmo, edema faríngeo y sequedad de la garganta. |
|
Trastornos gastrointestinales |
|
|
Frecuentes: |
Sequedad de la boca, trastornos del sentido del gusto, trastornos de la movilidad gastrointestinal, náuseas |
|
Poco frecuentes: |
Estreñimiento, diarrea, dolor abdominal, vómito, estomatitis, edema bucal. |
|
Trastornos de la piel y tejido cutáneo |
|
|
Poco frecuentes: |
Exantema, prurito y angioedema |
|
Rara: |
Urticaria |
|
Trastornos renales y urinarios |
|
|
Poco frecuentes: |
Retención urinaria |
c) Reacciones adversas frecuentes: Como con cualquier otro medicamento inhalado, ATROVENT también se puede relacionar con irritación local en la garganta. Las reacciones adversas las frecuencias de las reportadas en los estudios clínicos fueron cefalea, irritación de la garganta, tos, sequedad de la boca, trastornos de la movilidad gastrointestinal (incluyendo estreñimiento, diarrea y vómito), náuseas y mareos.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: No se han realizado estudios de los efectos sobre la capacidad de conducir y utilizar máquinas. Sin embargo, se les debe indicar a los pacientes que pueden ocurrir efectos indeseables tales como mareos, trastornos de la acomodación, midriasis y visión borrosa durante el tratamiento con ATROVENT solución en aerosol. Por lo tanto, se requiere precaución al conducir o utilizar máquinas.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
No se ha estudiado el uso crónico de ATROVENT inhalado junto con otros fármacos anticolinérgicos por lo que no se recomienda esta combinación.
Los agentes β-adrenérgicos y los derivados de la xantina (como la teofilina) pueden potenciar el efecto terapéutico.
Otros medicamentos anticolinérgicos, como los que contienen pirenzepina, pueden aumentar tanto los efectos terapéuticos como los adversos.
DOSIFICACIÓN Y MÉTODO DE ADMINISTRACIÓN:
Dosificación: La dosificación debe adaptarse a las necesidades individuales del paciente.
Se recomiendan las siguientes dosificaciones para adultos y niños mayores de 6 años:
Tratamiento preventivo y tratamiento de mantenimiento: 1 - 2 pulsaciones varias veces al día
Dosis diaria promedio: 1- 2 pulsaciones 3 - 4 veces al día.
Las recomendaciones de dosis son las mismas para niños < 6 años de edad. Como no se tiene suficiente experiencia en este grupo etario, la inhalación del producto debe estar supervisada médicamente.
Un requisito de dosis creciente sugiere que puede necesitarse de modalidades terapéuticas adicionales, y, por lo tanto, no se debe exceder una dosis diaria total de 12 pulsaciones.
Nota importante:
El paciente debe monitorearse médicamente durante el tratamiento.
Si la condición del paciente no muestra una mejoría satisfactoria o se deteriora a pesar del tratamiento, debe buscarse consejo médico para que, en caso de ser necesario, se puedan hacer modificaciones al plan de tratamiento, incluyendo la adición de corticosteroides, agonistas β2 o teofilina. En caso de disnea aguda o que empeore rápidamente, se le debe indicar al paciente que obtenga ayuda inmediatamente.
En caso de alguna exacerbación aguda de la enfermedad pulmonar obstructiva crónica, se puede indicar el tratamiento con Atrovent solución para nebulización.
Modo de administración: El uso correcto del inhalador es esencial para el tratamiento exitoso. Atrovent solución en aerosol es para utilizarse exclusivamente mediante inhalación.
De manera ideal, el aerosol debe administrarse con el paciente sentado o de pie.
Antes de utilizar el inhalador por primera vez, realice dos aplicaciones.
Cada vez que se utilice el inhalador, se debe realizar la siguiente secuencia de operaciones:
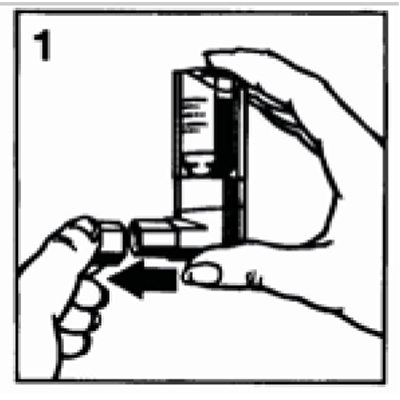
1. Retirar la tapa protectora (Figura 1).
2. Exhalar completamente.
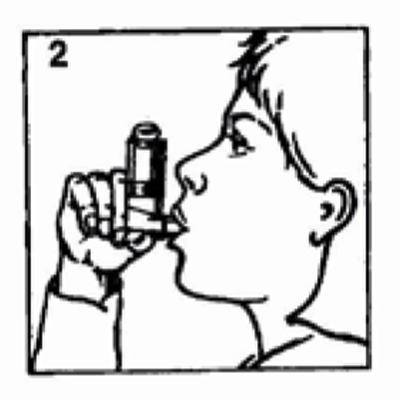
3. Mantener el inhalador como se muestra en la figura 2 y apretar firmemente con los labios. La flecha y la base del envase deben dirigirse hacia arriba.
4. Inhalar profundamente, presionando firmemente la base del envase al mismo tiempo, con lo cual se libera una dosis medida. Mantener la respiración por algunos segundos, luego retirar la boquilla de la boca y exhalar lentamente.
5. Después del uso, volver a colocar la tapa protectora.
Se debe tener cuidado para asegurar que la niebla no entre en contacto con los ojos.
Los niños que tomen el producto deben hacerlo bajo la supervisión de un adulto.
Otra información: Si el inhalador no se ha utilizado por más de tres días, la válvula se debe activar una vez antes de volverse a usar.
La boquilla debe limpiarse una vez a la semana de la siguiente manera:
Es importante mantener limpia la boquilla del inhalador para asegurar que no se acumule medicamento y bloquee el rocío.
Para limpiarla, primero retire la tapa protectora y el envase de la boquilla. Enjuague la boquilla completamente con agua tibia hasta que se elimine cualquier suciedad visible.
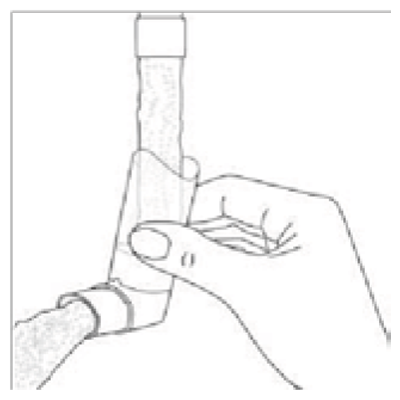
Después de limpiar, agite la boquilla y deje secar al aire sin usar calor. Una vez que la boquilla esté seca, volver a colocar el envase y la tapa protectora.
El no respirar hacia el interior de la boquilla ayudará a mantenerla limpia.
IMPORTANTE:
La boquilla se ha diseñado especialmente para usarse con ATROVENT solución en aerosol con el fin de asegurar que siempre se obtenga la dosis correcta. La boquilla no debe utilizarse con otros inhaladores de dosis medidas, y ATROVENT solución en aerosol no debe utilizarse con otras boquillas distintas a la proporcionada con el producto.
SOBREDOSIS: A la fecha no se han encontrado signos específicos de sobredosis.
Sin embargo, debido al amplio margen terapéutico y el hecho de que el producto se administre de manera tópica, no se esperan síntomas anticolinérgicos graves. Se pueden presentar eventos adversos anticolinérgicos sistémicos leves tales como sequedad bucal, trastornos de acomodación e incremento de la frecuencia cardiaca.
PRESENTACIÓN:
Naturaleza y contenido del envase: Solución presurizada (10 mL = 200 pulsaciones) en un recipiente de acero inoxidable con una válvula dosificadora, provista de una boquilla de plástico (PP) removible y una tapa verde de plástico.
Tamaños del empaque: El empaque de venta al público contiene 10 mL de solución.
Precauciones especiales para la eliminación y otro manejo: Al agitar el envase se sabrá si queda algo de líquido remanente en él. La cantidad aproximada del líquido en el envase se puede calcular de la siguiente manera: retirar la boquilla, colocar el envase en un recipiente lleno de agua y observar su posición (ver la figura a continuación).
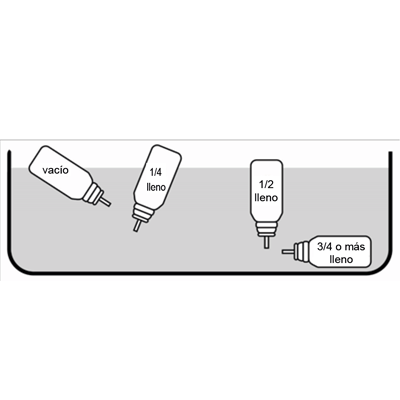
La cantidad aproximada de líquido en el envase está indicada por la posición del envase en el agua.
Deseche los medicamentos no utilizados o el material de desecho de acuerdo con los requisitos nacionales.
Titular de la autorización de comercialización
Hecho en Alemania por:
Boehringer Ingelheim Pharma GmbH & Co. KG. Binger Straβe 173, 55216 Ingelheim am Rhein, Alemania
Para:
BOEHRINGER INGELHEIM PROMECO, S.A. DE C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocan,
C.P. 16090, Deleg. Xochimilco, D.F., México
® Marca registrada
Logo: Boehringer Ingelheim.
SmPC 0260-03
Fecha de la revisión del texto: Abril 2022
LEYENDAS DE PROTECCIÓN:
Agítese bien antes de usarse.
No se deje al alcance de los niños. No se use cerca del fuego o flama.
No fume o encienda flama cuando se aplique.
No exponga el envase a los rayos del sol o lugares excesivamente calientes, ni los perfore o los arroge al fuego.
Evite el contacto con los ojos.
El empleo de este medicamento durante el embarazo y lactancia queda bajo la resposabilidad del médico. Durante el empleo dirigir la válvula hacia abajo.
PELIGRO-INFLAMABLE