
CADUET
AMLODIPINO, ATORVASTATINA
Tabletas
Tabletas,
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Ingredientes activos: Besilato de amlodipina, atorvastatina cálcica.
Las TABLETAS para administración oral, contienen besilato de amlodipina y atorvastatina cálcica, equivalen-tes a potencias de dosis de 5 mg/10 mg, 5 mg/20 mg, 5 mg/40 mg y 5 mg/80 mg de amlodipina/atorvastatina respectivamente.
FORMA FARMACÉUTICA: Tabletas
INDICACIONES TERAPÉUTICAS: El producto con la combinación amlodipina/atorvastatina (referido en adelante como “amlodipina/atorvastatina” en este documento), está indicado para las siguientes poblaciones de pacientes:
1. Pacientes con riesgo cardiovascular aumentado, debido a la presencia de dos factores modificables de riesgo, hipertensión y dislipidemia; y/o
2. Pacientes con riesgo cardiovascular aumentado, debido a la presencia de ECC (Enfermedad Cardiaca Coronaria), expresada como angina con el factor de riesgo modificable de dislipidemia; y/o
3. Prevención de complicaciones cardiovasculares en pacientes hipertensos (ver más adelante - Prevención de complicaciones cardiovasculares):
En dichos pacientes con múltiples factores de riesgo cardiovascular, amlodipina/atorvastatina está indicado para:
Hipertensión: El componente amlodipina está indicado como para el tratamiento de primera elección de la hipertensión y puede ser utilizado como único agente para controlar la presión arterial en la mayoría de los pacientes. Los pacientes que no han sido controlados adecuadamente con un agente antihipertensivo único (diferente a la amlodipina), pueden beneficiarse con la adición del componente amlodipina del amlodipina/atorvastatina, en la misma forma que se beneficiarían por la adición de la amlodipina sola.
La amlodipina también está indicada para disminuir el riesgo de enfermedad coronaria fatal e infarto del miocardio no-fatal, así como para disminuir el riesgo de accidentes cerebrovasculares.
Enfermedad de arteria coronaria: El componente amlodipina está indicado para disminuir el riesgo de procedimientos de revascularización coronaria y necesidad de hospitalización debida a angina de pecho, en los pacientes con enfer-medad de arteria coronaria.
Angina crónica estable: El componente amlodipina está indicado como tratamiento de primera elección en la isquemia miocárdica, ya sea debida a obstrucción fija (angina estable) y/o a vasoespasmo/vasoconstricción (angina de Prinzmetal o variante) de la vasculatura coronaria. Amlodipina/atorvastatina puede ser utilizado, cuando la clínica del paciente sugiera un posible componente vasoespástico/vasoconstrictor, aún cuando no se haya confirmado vasoespasmo/vasoconstricción. Amlodipina/atorvastatina puede ser utilizado solo o en combinación con otras drogas antianginosas, en los pacientes con una angina que sea refractaria a los nitratos y/o a dosis adecuadas de bloqueadores beta.
Dislipidemia: El componente atorvastatina está indicado como un adjunto de la dieta, para el tratamiento de pacientes con el colesterol total, LDL-colesterol, apolipoproteína B y triglicéridos elevados y para incrementar la HDL-colesterol en pacientes con hipercolesterolemia primaria (hipercolesterolemia familiar y no-familiar heterocigota), hiperlipidemia combinada (mixta) (Tipos IIa y IIb de Fredrickson), niveles elevados de triglicéridos séricos (Tipo IV de Fredrickson) y de pacientes con disbetalipoproteinemia (Tipo III de Fredrickson), que no responden adecuadamente a la dieta.
El componente atorvastatina también está indicado para la reducción del colesterol total y LDL-colesterol, en pacientes con hipercolesterolemia familiar homocigota, cuando la respuesta a la dieta y otras intervenciones no-farmacológicas sean inadecuadas.
Prevención de complicaciones cardiovasculares: En pacientes sin enfermedad cardiovascular clínicamente evidente y con o sin dislipidemia, pero con múltiples factores de riesgo de enfermedad coronaria, tales como hábito de fumar, hipertensión, diabetes, HDL-C baja o una historia familiar de enfermedad cardiaca coronaria temprana, la atorvastatina está indicada para:
• Disminuir el riesgo de enfermedad cardiaca coronaria fatal e infarto del miocardio no-fatal,
• Disminuir el riesgo de accidente cerebrovascular,
• Disminuir el riesgo de procedimientos de revascularización y de angina de pecho.
Pacientes Pediátricos (10-17 años de edad): La atorvastatina está indicada como un adjunto de la dieta, para la reducción de los niveles del C-total, LDL-C y apo B, en muchachos y muchachas postmenárquicas, de 10 a 17 años de edad, con hipercolesterolemia familiar heterocigota si, después probar un tratamiento con dieta, están presentes los siguientes hallazgos:
a. La LDL-C sigue siendo ≥ 190 mg/dL o
b. La LDL-C sigue siendo ≥ 160 mg/dL y:
Existe una historia familiar positiva de enfermedad cardiovascular prematura o están presentes dos o más factores de riesgo de enfermedad cardiovascular (ECV) en el paciente pediátrico.
PROPIEDADES FARMACODINÁMICAS:
Farmacodinamia de amlodipina/atorvastatina: El componente besilato de amlodipina del amlodipina/atorvastatina, se describe químicamente como bencenosulfonato de (R.S.) 3-etil-5-metil-2-(2-aminoetoximetil)-4-(2-clorofenil)-1,4-dihidro-6-metil-3,5-piridinodicarboxilato. Su fórmula empírica es C20H25CIN2O5•C6H6O3S. El componente atorvastatina cálcica del amlodipina/atorvastatina, se describe químicamente como sal cálcica trihidratada de [R-(R*, R*)]-2-(4-fluorofenil)-β,δ-dihidroxi-5-(1-metiletil)-3-fenil-4-[(fenilamino)carbonilo]-1H-pirrol- 1-ácido heptanoico (2:1). La fórmula empírica de la atorvastatina cálcica, es (C33H34FN2O5)2Ca•3H2O. A continuación se muestran las fórmulas estru cturales:
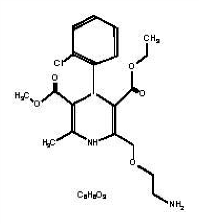
Besilato de amlodipina
Atorvastatina cálcica
Mecanismo del amlodipina/atorvastatina:
Amlodipina/atorvastatina combina dos mecanismos de acción: La acción del antagonista dihidropiridina del calcio (antagonista del ión calcio o bloqueador del canal lento) amlodipina y la acción de la inhibición de la reductasa de la H mg-CoA de la atorvastatina. El componente amlodipina del amlodipina/atorvastatina, inhibe el influjo transmembrana de los iones calcio hacia la musculatura vascular lisa y el músculo cardiaco. El componente atorvastatina del amlodipina/atorvastatina, es un inhibidor competitivo selectivo de la reductasa de la H mg-CoA, que es la enzima limitativa de la velo-cidad, que convierte la 3-hidroxi-3-metilglutaril-coenzima A a mevalonato, un precursor de los este-roles, incluido el colesterol.
Estudios clínicos de la amlodipina y atorvastatina combinadas en pacientes con hipertensión y dislipidemia: En un estudio doble-ciego, controlado con placebo de 1.660 pacientes con hipertensión y dislipidemia comórbidas, se comparó el tratamiento una vez al día con ocho combinaciones de dosis de amlodipina y atorvastatina, (5/10, 10/10, 5/20, 10/20, 5/40, 10/40, 5/80 o 10/80 mg) versus amlodipina sola (5 mg o 10 mg), atorvastatina sola (10 mg, 20 mg, 40 mg u 80 mg) y placebo. Además de la hipertensión y dislipidemia concomitantes, 15% de los pacientes tenían diabetes mellitus, 22% eran fumadores y 14% tenían una historia familiar positiva de enfermedad cardiovascular. A las ocho semanas, todos los ocho grupos de las combinaciones de tratamiento, demostraron disminuciones estadísticamente significativas relacionadas con la dosis de la presión arterial sistólica (PAS), de la presión arterial diastólica (PAD) y de la LDL-C, en comparación con el placebo, sin ninguna modificación general del efecto de alguno de los componentes, sobre la PAS, PAD y LDL-C (véase la tabla de la página siguiente).
|
Eficacia de los tratamientos combinados en la reducción de la PA Sistólica |
||||||
|
Parámetro/Análisis |
ATO 0 mg |
ATO 10 mg |
ATO 20 mg |
ATO 40 mg |
ATO 80 mg |
|
|
AML 0 mg |
Cambio promedio (mmHg) |
-3,0 |
-4,5 |
-6,2 |
-6,2 |
-6,4 |
|
Diferencia versus placebo (mmHg) |
- |
-1,5 |
-3,2 |
-3,2 |
-3,4 |
|
|
AML 5 mg |
Cambio promedio (mmHg) |
-12,8 |
-13,7 |
-15,3 |
-12,7 |
-12,2 |
|
Diferencia versus placebo (mmHg) |
-9,8 |
-10,7 |
-12,3 |
-9,7 |
-9,2 |
|
|
AML 10 mg |
Cambio promedio (mmHg) |
-16,2 |
-15,9 |
-16,1 |
-16,3 |
-17,6 |
|
Diferencia versus placebo (mmHg) |
-13,2 |
-12,9 |
-13,1 |
-13,3 |
-14,6 |
|
|
Eficacia de los tratamientos combinados en la reducción de la PA Diastólica |
||||||
|
Parámetro/Análisis |
ATO 0 mg |
ATO 10 mg |
ATO 20 mg |
ATO 40 mg |
ATO 80 mg |
|
|
AML 0 mg |
Cambio promedio (mmHg) |
-3,3 |
-4,1 |
-3,9 |
-5,1 |
-4,1 |
|
Diferencia versus placebo (mmHg) |
- |
-0,8 |
-0,6 |
-1,8 |
-0,8 |
|
|
AML 5 mg |
Cambio promedio (mmHg) |
-7,6 |
-8,2 |
-9,4 |
-7,3 |
-8,4 |
|
Diferencia versus placebo (mmHg) |
-4,3 |
-4,9 |
-6,1 |
-4,0 |
-5,1 |
|
|
AML 10 mg |
Cambio promedio (mmHg) |
-10,4 |
-9,1 |
-10,6 |
-9,8 |
-11,1 |
|
Diferencia versus placebo (mmHg) |
-7,1 |
-5,8 |
-7,3 |
-6,5 |
-7,8 |
|
|
Eficacia de los tratamientos combinados en la reducción de la LDL-C (% del cambio) |
||||||
|
Parámetro/Análisis |
ATO 0 mg |
ATO 10 mg |
ATO 20 mg |
ATO 40 mg |
ATO 80 mg |
|
|
AML 0 mg |
% cambio prom |
-1,1 |
-33,4 |
-39,5 |
-43,1 |
-47,2 |
|
AML 5 mg |
% cambio prom |
-0,1 |
-38,7 |
-42,3 |
-44,9 |
-48,4 |
|
AML 10 mg |
% cambio prom |
-2,5 |
-36,6 |
-38,6 |
-43,2 |
-49,1 |
En un estudio abierto, 1.220 pacientes con hipertensión comórbida y dislipidemia, recibieron una titulación de dosis electiva con amlodipina/atorvastatina, durante en periodo de 14 semanas. Para su ingreso al estudio, se requería que los pacientes tuviesen una presión arterial descontrolada (estuviesen o no usando drogas antihipertensivas al reclutarlos; se permitió que los pacientes siguieran con sus antihipertensivos previos, diferentes a bloqueadores de los canales de calcio, durante el periodo de titulación de 14 semanas), pero podían ingresar con una LDL-C controlada o descontrolada. Como resultado, ningún paciente ingresó al estudio con ambos parámetros, presión arterial y LDL-C, controlados y en el 62% de ellos estaban descontrolados ambos. El tratamiento con amlodipina/atorvastatina redujo en -17,1 mmHg la media de la presión arterial sistólica y en -9,6 mmHg la diastólica, con una reducción de -32,7% en la LDL-C, resultando en el control de ambas, la presión arterial y la LDL-C, en el 58% de esos pacientes (la presión arterial y la LDL-C controladas se definieron, respectivamente, como <140/90 mmHg y <160 mg/dL para los pacientes con hipertensión y dislipidemia comórbidas solamente; <140/90 mmHg y <130 mg/dL para los pacientes con hipertensión y dislipidemia comórbidas, más 1 factor de riesgo cardiovascular adicional, excluyendo enfermedad cardiaca coronaria y diabetes mellitus; y <130/85 mmHg y <100 mg/dL para los pacientes con hipertensión y dislipidemia comórbidas más enfermedad cardiaca coronaria, diabetes mellitus u otra enfermedad aterosclerótica). Solamente el 13% de los pacientes de este estudio usaron amlodipina/atorvastatina como tratamiento inicial para la hipertensión y dislipidemia comórbidas, mientras que el componente amlodipina del amlodipina/atorvastatina representó el tratamiento añadido para la hipertensión en el 56% de los pacientes, incluyendo a aquellos para quienes el componente atorvastatina del amlodipina/atorvastatina, representaba el tratamiento inicial para la dislipidemia (20%), una sustitución de la atorvastatina tomada anteriormente (18%) o un cambio desde otra estatina (18%).
Cuando se evaluaron en función del uso de medicamentos antihipertensivos e hipolipemiantes en el reclutamiento, los resultados mostraron que ambas, la presión arterial y la LDL-C, habían sido controladas en el 65% de los pacientes que usaron amlodipina/atorvastatina como el tratamiento inicial de la hipertensión y dislipidemia comórbidas y en el 55% a 64% de los pacientes en quienes el componente amlodipina del amlodipina/atorvastatina, constituyó el tratamiento añadido para la hipertensión (55% de esos pacientes ya habían usado anteriormente medicamentos hipolipemiantes diferentes a la amlodipina, 58% de ellos ya habían usado previamente la atorvastatina y el 64% no habían usado anteriormente medicamentos hipolipemiantes).
Farmacodinamia de la amlodipina: La amlodipina es un inhibidor del influjo de los iones de calcio (bloqueador del canal lento o antagonista de los iones calcio) e inhibe el flujo transmembrana de los iones de calcio hacia el interior de la musculatura cardiaca y vascular lisa.
El mecanismo de la acción antihipertensiva de la amlodipina, se debe a un efecto relajante directo sobre la musculatura vascular lisa. El mecanismo exacto mediante el cual la amlodipina alivia la angina de pecho no se ha determinado completamente, pero reduce la carga isquémica total a través de las siguientes acciones:
1. La amlodipina dilata las arteriolas periféricas y por lo tanto reduce la resistencia periférica total (post-carga) en contra de la cual trabaja el corazón. Dado que la frecuencia cardiaca permanece estable, esta descarga del corazón disminuye el consumo de energía miocárdica y los requerimientos de oxígeno.
2. El mecanismo de acción de la amlodipina probablemente involucra la dilatación de las arterias coronarias principales y de las arteriolas coronarias, tanto en las regiones normales como en las isquémicas. Esta dilatación aumenta el suministro de oxígeno miocárdico en los pacientes con espasmo de las arterias coronarias (angina de Prinzmetal o variante) y atenúa la vasoconstricción coronaria inducida por el cigarrillo.
En los pacientes con hipertensión, la dosificación una vez al día proporciona reducciones clínicamente significativas de la presión arterial, tanto en las posiciones supina como de pie, durante todo el intervalo de 24 horas. Debido a que su acción se inicia lentamente, la hipotensión aguda no es una característica de la administración de la amlodipina.
En los pacientes con angina de pecho, la administración de la amlodipina una vez por día incrementa el tiempo total de ejercicio, el tiempo hasta la aparición de la angina y el tiempo hasta 1 mm de depresión en el segmento ST y disminuye la frecuencia de los ataques anginosos y del consumo de tabletas de nitroglicerina.
La amlodipina no ha sido asociada con ningún efecto metabólico adverso o cambios en los lípidos plasmáticos y es adecuada en pacientes con asma, diabetes mellitus y gota.
Uso en pacientes con enfermedad de arteria coronaria (EAC): Los efectos de la amlodipina sobre la morbilidad y mortalidad cardiovascular, la progresión de la aterosclerosis coronaria y la aterosclerosis carotidea, fueron estudiados en el estudio de evaluación prospectiva aleatorizada de los efectos vasculares del NORVASC (PREVENT). Este fue un estudio multicéntrico, aleatorizado, doble-ciego, controlado con placebo, de 825 pacientes con enfermedad arterial coronaria definida por angiografía, que fueron seguidos durante tres años. La población incluyó pacientes con antecedentes de infarto de miocardio (IM) (45%), angioplastia coronaria transluminal percutánea (ACTP) en línea-base (42%) o angina de pecho (69%). La severidad de la EAC varió desde la enfermedad de un vaso (45% de los pacientes), hasta enfermedad de más de tres (3+) vasos (21%). Se excluyeron del estudio los pacientes con hipertensión no controlada (PAD >95 mmHg). Los eventos cardiovasculares mayores fueron adjudicados en forma ciega por un comité de puntos finales. Aunque no hubo efectos demostrables sobre la progresión de las lesiones coronarias, la amlodipina detuvo la progresión del engrosamiento de las capas íntima y media carotídeas. En los pacientes tratados con amlodipina, se observó una reducción significativa (-31%) en el punto final combinado de muerte cardiovascular, infarto del miocardio (IM), accidente cerebrovascular, ACTP, injerto de derivación de arteria coronaria (IDAC), hospitalización por angina inestable y agravamiento de la insuficiencia cardiaca congestiva. En los pacientes tratados con amlodipina también se observó una reducción significativa (-42%) de procedimientos de revascularización (ACTP e IDAC). Se observó un número menor de hospitalizaciones (-33%) por angina inestable entre los pacientes tratados con amlodipina, que en los del grupo que recibió placebo.
La efectividad de la amlodipina para prevenir eventos clínicos en pacientes con enfermedad de arteria coronaria (EAC), se evaluó en un estudio independiente, multicéntrico, aleatorizado, doble-ciego, controlado con placebo de 1.997 pacientes, comparación de amlodipina vs. enalapril para limitar eventos de trombosis (CAMELOT). De ellos, 663 pacientes fueron tratados con 5-10 mg de amlodipina y 655 con placebo, además del tratamiento médico estándar con estatinas, bloquedores-beta, diuréticos y aspirina, durante 2 años. Los resultados claves de eficacia, están presentados en la Tabla 1. Los resultados indican que el tratamiento con amlodipina estuvo asociado con menos hospitalizaciones por angina y procedimientos de revascularización, en los pacientes con EAC.
|
Tabla 1. Incidencia de resultados clínicamente significativos del CAMELOT |
|||
|
CAMELOT |
|||
|
Resultados clínicos N (%) |
Amlodipina (N=663) |
Placebo (N=655) |
Reducción del Riesgo (valor-p) |
|
Punto Final CV Compuesto* |
110 (16,6) |
151 (23,1) |
31% (0,003) |
|
Hospitalización por Angina |
51 (7,7) |
84 (12,8) |
42% (0,002) |
|
Revascularización Coronaria |
78 (11,8) |
103 (15,7) |
27% (0,033) |
|
* 1. Definido en el CAMELOT como muerte cardiovascular, IM no-fatal, paro cardiaco resucitado, revascularización coronaria, hospitalización por angina de pecho, hospitalización por insuficiencia cardiaca congestiva, accidente cerebrovascular o AIT fatal o no-fatal, cualquier diagnóstico de PVD en un sujetos sin diagnóstico previo de PVD o cualquier admisión para un procedimiento para el tratamiento de PVD. 2. El punto final CV compuesto, fue el punto final primario en el CAMELOT. |
|||
Estudio tratamiento para prevenir el ataque Cardiaco (ALLHAT)L: Se realizó un estudio aleatorizado, doble-ciego de morbilidad-mortalidad, denominado estudio de tratamiento antihipertensivo e hipolipemiante para hrevenir el ataque cardiaco (ALLHAT), para comparar nuevas farmacoterapias: 2,5-10 mg/d de amlodipina (bloqueador de los canales de calcio) o 10-40 mg/d de lisinopril (inhibidor de la ECA), como terapias de primera línea respecto a 12,5-25 mg/d del diurético tiazídico clortalidona, en la hipertensión leve a moderada.
Un total de 33.357 pacientes hipertensos, con edades de 55 años o más, fueron aleatorizados y seguidos durante 4,9 años en promedio. Los pacientes tenían por lo menos un factor de riesgo adicional de ECC, incluyendo infarto del miocardio o accidente cerebrovascular por >6 meses o documentación de otra ECV aterosclerótica (en total 51,5%), diabetes tipo 2 (36,1%), HDL-C <35 mg/dL (11,6%), hipertrofia ventricular izquierda diagnosticada por electrocardiograma o ecocardiografía (20,9%), hábito de fumar actual (21,9%).
El punto final primario estaba compuesto de ECC fatal o infarto del miocardio no-fatal. No hubo diferencia significativa en el punto final primario entre el tratamiento a base de amlodipina y el tratamiento a base de clortalidona: RR 0,98, IC 95% [0,90-1,07] p=0,65. Además, no hubo diferencia significativa en la mortalidad por todas las causas entre el tratamiento a base de amlodipina y el tratamiento a base de clortalidona: RR 0,96, IC 95% [0,89-1,02] p=0,20.
Uso en pacientes con insuficiencia cardiaca: Estudios hemodinámicos y estudios clínicos controlados basados en el ejercicio en pacientes con insuficiencia cardiaca clases II-IV NYHA, han mostrado que la amlodipina no produce deterioro clínico, evaluado mediante la tolerancia al ejercicio, la fracción de eyección ventricular izquierda y la sintomatología clínica.
Un estudio controlado con placebo (PRAISE), diseñado para evaluar pacientes con insuficiencia cardiaca clase III-IV NYHA recibiendo diuréticos e inhibidores de la enzima convertidora de angiotensina (ECA), demostró que la amlodipina no incrementa el riesgo de mortalidad o de mortalidad y morbilidad combinadas, en pacientes con insuficiencia cardiaca.
En un estudio de seguimiento a largo-plazo, controlado con placebo (PRAISE-2), de amlodipina en pacientes con insuficiencia cardiaca clase III-IV NYHA sin síntomas clínicos o hallazgos objetivos sugestivos de una enfermedad isquémica subyacente, recibiendo dosis estables de inhibidores de la ECA, digitálicos y diuréticos, la amlodipina no tuvo efecto sobre la mortalidad total o cardiovascular. En esta misma población, a la amlodipina se asoció con más informes de edema pulmonar, a pesar de que no hubo diferencia significativa en la incidencia de agravamiento de la insuficiencia cardiaca, en comparación con el placebo.
Uso en pacientes pediátricos (6-17 años de edad): La eficacia de la amlodipina en pacientes pediátricos hipertensos de 6 a 17 años de edad, se demostró en un estudio aleatorizado, doble-ciego, controlado con placebo, de 8 semanas, en 268 pacientes con hipertensión. Todos los pacientes fueron aleatorizados a los brazos de tratamiento de 2,5 mg o 5 mg y recibieron seguimiento durante 4 semanas, después de las cuales fueron aleatorizados para seguir con 2,5 mg o 5 mg de amlodipina o placebo, durante 4 semanas adicionales. En comparación con los valores de línea-base, el tratamiento una vez al día con 5 mg de amlodipina resultó en reducciones estadísticamente significativas en las presiones sanguíneas sistólica y diastólica. Ajustadas por placebo, la reducción promedio de la presión arterial sistólica en posición sentada, se estimó en 5,0 mmHg para la dosis de 5 mg de amlodipina y en 3,3 mmHg para la dosis de 2,5 mg de amlodipina. Los análisis de los subgrupos indicaron que los pacientes pediátricos más jóvenes, con edades de 6 a 13 años, tuvieron resultados de eficacia comparables a los de los pacientes pediátricos mayores, con edades de 14 a 17 años.
Farmacodinamia de la atorvastatina: La atorvastatina es un inhibidor selectivo y competitivo de la H mg-CoA reductasa, enzima limitativa de la velocidad de conversión de la 3-hidroxi-3-metilglutaril-coen-zima A en mevalonato, un precursor de los esteroles, incluyendo al colesterol. En los pacientes con hipercolesterolemia familiar (HF) homocigota y heterocigota, formas de hipercolesterolemias no-familiares y dislipidemia mixta, la atorvastatina reduce el colesterol total (C-total), la LDL-colesterol (lipoproteína de baja densidad del colesterol) y la apo B (apolipoproteína B). La atorvastatina también reduce la VLDL-colesterol (lipoproteína de muy baja densidad del colesterol) y los TG (triglicéridos) y produce incrementos variables de la HDL-colesterol (lipoproteína de alta densidad del colesterol).
La atorvastatina baja los niveles plasmáticos de colesterol y lipoproteínas, a través de la inhibición de la reductasa de la H mg-CoA y de la síntesis de colesterol en el hígado, así como por el incremento del número de los receptores hepáticos de la LDL en la superficie de la célula, para lograr una mayor captación y catabolismo de esta lipoproteína.
La atorvastatina baja la producción de la LDL y el número de partículas de esta lipoproteína. La atorvastatina produce un incremento profundo y sostenido de la actividad de los receptores de la LDL, acoplado con un cambio favorable en la calidad de las partículas circulantes de LDL. La atorvastatina es eficaz para disminuir la LDL en los pacientes con hipercolesterolemia familiar homocigota, una población que normalmente no ha respondido a la medicación hipolipemiante.
La atorvastatina y algunos de sus metabolitos son farmacológicamente activos en los humanos. El sitio primario de acción de la atorvastatina es el hígado, que es el sitio principal de la síntesis del colesterol y de la eliminación de la LDL. La disminución de la LDL-colesterol, se correlaciona mejor con la dosis del fármaco, que con la concentración sistémica del mismo. La individualización de la dosis del fármaco se debe establecer con base en la respuesta terapéutica (véase Posología dosis y método de administración).
En un estudio de dosis-respuesta, la atorvastatina (10-80 mg) redujo el C-total (30-46%), la LDL-colesterol (41-61%), la apo B (34-50%) y los TG (14-33%). Estos resultados son consistentes en pa-cientes con hipercolesterolemia familiar heterocigota, formas de hipercolesterolemia no-familiares e hiperlipidemia mixta, incluyendo a los pacientes con diabetes mellitus no-dependiente de la insulina.
En los pacientes con hipertrigliceridemia aislada, la atorvastatina disminuye el C-total, la LDL-colesterol, la VLDL-colesterol, la apo B, los TG y el colesterol no asociado a la HDL, y aumenta la HDL-C. En los pacientes con disbetalipoproteinemia, la atorvastatina disminuye la LDI-C (lipoproteína de densidad intermedia del colesterol).
En pacientes con hiperlipoproteinemia Tipos IIa y IIb de Fredrickson, de 24 estudios controlados combinados, las medianas de los aumentos porcentuales desde línea-base en la HDL-colesterol fueron de 5,1-8,7% para la atorvastatina (10-80 mg), en forma no-relacionada con la dosis. Además, el análisis de estos datos combinados demostró disminuciones significativas, asociados con la dosis, en las relaciones C-total/HDL-colesterol y LDL-colesterol/HDL-colesterol, que variaron desde -29 a -44% y desde -37 a -55%, respectivamente.
Los efectos de la atorvastatina sobre los eventos isquémicos y la mortalidad total, fueron investigados en el estudio reducción de la isquemia miocárdica con la reducción agresiva del colesterol (MIRACL). En este estudio multicéntrico, aleatorizado, doble-ciego, controlado con placebo, se le hizo seguimiento a 3.086 pacientes con síndromes coronarios agudos, angina inestable o infarto del miocardio sin ondas Q. Los pacientes fueron tratados con cuidados convencionales, incluyendo dieta y 80 mg al día de atorvastatina o placebo, con una duración promedio de 16 semanas. Los niveles finales de la LDL-colesterol, el C-total, la HDL-colesterol y los TG, fueron 72, 147, 48 y 139 mg/dL, respectivamente, en el grupo atorvastatina, y 135, 217, 46 y 187 mg/dL, respectivamente, en el grupo placebo. La atorvastatina redujo significativamente el riesgo de eventos isquémicos y muerte, en 16%. El riesgo de experimentar rehospitalización por angina de pecho, con evidencia documentada de isquemia miocárdica, se redujo significativamente en 26%. La atorvastatina redujo, en un grado similar, el riesgo de eventos isquémicos y muerte en toda la extensión del intervalo de valores de la LDL-colesterol en línea-base. Adicionalmente la atorvastatina redujo, en grados similares, el riesgo de eventos isquémicos y muerte en los pacientes con IM sin ondas Q y angina inestable, en hombres y mujeres y en pacientes ≤65 años de edad y >65 años de edad.
Prevención de complicaciones cardiovasculares: En el brazo hipolipemiantes del estudio anglo-escandinavo de desenlaces cardiacos (ASCOT-LLA), se evaluó el efecto de la amlodipina sobre la enfermedad coronaria fatal y no-fatal en 10.305 pacientes hipertensos de 40-80 años de edad (media de 63 años), sin infarto de miocardio previo y con niveles de C-total <6,5 mmoles/L (251 mg/dL). Además, todos los pacientes presentaban por lo menos 3 de los siguientes factores de riesgo cardiovascular: género masculino, edad >55 años, hábito de fumar, diabetes, historia de ECC en un familiar de primer grado, C-total: HDL >6, enfermedad vascular periférica, hipertrofia ventricular izquierda, evento cerebrovascular previo, anormalidad ECG específica, proteinuria/albuminuria. En este estudio doble-ciego, controlado con placebo, los pacientes fueron tratados con terapia antihipertensiva (PA buscada <140/90 mmHg para los pacientes no-diabéticos, <130/80 mmHg para los pacientes diabéticos) y se asignaron para recibir o 10 mg de atorvastatina (n=5.168) o placebo (n=5.137). Como el efecto de la atorvastatina, comparado con el placebo, superó el nivel de significación durante un análisis de ínterin, el ASCOT-LLA fue terminado tempranamente a los 3,3 años, en vez de 5 años. Adicionalmente, la presión arterial estuvo bien controlada y similar en los pacientes asignados a atorvastatina y a placebo. Esos cambios persistieron du-rante todo el periodo de tratamiento.
La atorvastatina redujo significativamente la frecuencia de los siguientes eventos:
|
Evento |
Disminución del riesgo (%) |
No de eventos (atorvastatina vs. placebo) |
valor-p |
|
Eventos coronarios (ECC + IM no-fatal) |
36% |
100 vs. 154 |
0,0005 |
|
Eventos cardiovasculares totales y procedimientos de revascularización |
20% |
389 vs. 483 |
0,0008 |
|
Eventos coronarios totales |
29% |
178 vs. 247 |
0,0006 |
|
Accidente cerebrovascular fatal y no-fatal |
26% |
89 vs. 119 |
0,0332 |
La mortalidad total y la mortalidad cardiovascular no disminuyeron significativamente, aunque se observó una tendencia favorable.
En el estudio colaborativo de atorvastatina y diabetes (CARDS), se evaluó el efecto de la atorvastatina sobre enfermedad cardiovascular fatal y no-fatal en 2.838 pacientes de 40-75 años de edad, con diabetes tipo 2, sin una historia previa de enfermedad cardiovascular y con una LDL ≤4,14 mmoles/L (160 mg/dL) y TG ≤6,78 mmoles/L (600 mg/dL). Adicionalmente, todos los pacientes tenían por lo menos 1 de los siguientes factores de riesgo: hipertensión, hábito de fumar actual, retinopatía, microalbuminuria o macroalbuminuria.
En este estudio aleatorizado, doble-ciego, multicéntrico, controlado con placebo, los pacientes fueron tratados o con 10 mg diarios de atorvastatina (n=1.428) o con placebo (n=1.410), para una mediana de seguimiento de 3,9 años. Como el efecto del tratamiento con atorvastatina sobre el punto final primario alcanzó las reglas de eficacia predefinidas, el CARDS fue terminado 2 años antes de lo previsto.
El efecto de reducción del riesgo absoluto y relativo de la atorvastatina, es el siguiente:
|
Evento |
Disminución del riesgo relativo (%) |
No. de eventos (atorvastatina vs. placebo) |
valor-p |
|
Eventos cardiovasculares mayores [AMI fatal y no-fatal, IM silente, muerte por ECC aguda, angina inestable, IDAC, ACTP, revascularización, accidente cerebrovascular] |
37% |
83 vs. 127 |
0,0010 |
|
IM (AMI fatal y no-fatal, IM silente) |
42% |
38 vs. 64 |
0,0070 |
|
Accidente cerebrovascular (Fatal y no-fatal) |
48% |
21 vs. 39 |
0,0163 |
|
AMI = Infarto agudo del miocardio; IDAC = Injerto de derivación de arteria coronaria; ECC = Enfermedad cardiaca coronaria; IM = Infarto del miocardio; ACTP = Angioplastia coronaria transluminal percutánea. |
|||
No hubo evidencia en el efecto del tratamiento por el género, edad o nivel de la LDL-C en línea-base.
Se observó una disminución de 27% en el riesgo relativo de muerte (82 muertes en el grupo placebo, comparado con 61 muertes en el brazo tratamiento), con una significación estadística limítrofe (p=0,0592).
La incidencia global de eventos adversos o de eventos adversos serios, fue similar entre los grupos de tratamiento.
Aterosclerosis: En el estudio reversión de aterosclerosis con hipolipemiante agresivo (REVERSAL), se evaluó durante la angiografía, por ultrasonido intravascular (USIV), el efecto de la atorvastatina 80 mg y la pravastatina 40 mg sobre la aterosclerosis coronaria, en pacientes con enfermedad cardiaca coronaria. En este estudio clínico multicéntrico, aleatorizado, doble-ciego, controlado, el USIV se realizó en línea-base y a los 18 meses en 502 pacientes. En el grupo atorvastatina (n=253), la mediana del cambio porcentual desde línea-base en el volumen total del ateroma (el criterio primario del estudio), fue -0,4% (p=0,98) en el grupo atorvastatina y +2,7% (p=0,001) en el grupo pravastatina (n=249). Cuando se compararon con los de la pravastatina, los efectos de la atorvastatina fueron estadísticamente signi-ficativos (p=0,02).
En el grupo atorvastatina, la LDL-C se redujo en promedio a 2,04 mmoles/L ± 0,8 (78,9 mg/dL ± 30) desde una línea-base de 3,89 mmoles/L ± 0,7 (150 mg/dL ± 28) y en el grupo pravastatina la LDL-C se redujo en promedio a 2,85 mmoles/L ± 0,7 (110 mg/dL ± 26) desde una línea-base de 3,89 mmo-les/L ± 0,7 (150 mg/dL ± 26) (p<0,0001). La atorvastatina también redujo significativamente los ni-veles promedios de TC en 34,1% (pravastatina: -18,4%, p<0,0001), los niveles promedios de TG en 20% (pravastatina: -6,8%, p<0,0009) y la media de apolipoproteína B en 39,1% (pravastatina: -22,0%, p<0,0001). La atorvastatina aumentó la media de la HDL-C en 2,9% (pravastatina: +5,6%, p=NS). Hubo una disminución promedio de 36,4% en el CRP en el grupo atorvastatina, comparado con una disminución de 5,2% en el grupo pravastatina (p<0,0001).
Los perfiles de seguridad y tolerabilidad de los dos grupos de tratamiento, fueron comparables.
Accidente cerebrovascular recurrente: En el estudio prevención de accidente cerebrovascular por reducción agresiva de los niveles de colesterol (SPARCL), se evaluó el efecto de 80 mg diarios de atorvastatina o placebo sobre el accidente cerebrovascular, en 4.731 que habían tenido un accidente cerebrovascular o un ataque isquémico transitorio (AIT) en los 6 meses precedentes y no tenían historia de enfermedad cardiaca coronaria (ECC). Los pacientes eran en un 60% varones, de 21-92 años de edad (edad promedio 63 años) y tenían en promedio una LDL en línea-base de 133 mg/dL (3,4 mmoles/L). El nivel promedio de LDL-C durante el tratamiento con atorvastatina, fue de 73 mg/dL (1,9 mmoles/L) y de 129 mg/dL (3,3 mmoles/L) durante el tratamiento con placebo. La mediana de la duración del seguimiento, fue de 4,9 años.
La atorvastatina, en dosis de 80 mg, redujo el riesgo del punto final primario de accidente cerebrovascular fatal o no-fatal en 15% (HR 0,85; IC 95%, 0,72-1,00; p=0,05 o 0,84; IC 95%, 0,71-0,99; p=0,03 después de ajustar por factores de línea-base) en comparación con placebo. La atorvastatina, en dosis de 80 mg, redujo significativamente el riesgo de eventos coronarios mayores (HR 0,67; IC 95%, 0,51-0,89; p=0,006), de cualquier evento de ECC (HR 0,60; IC 95% CI, 0,48-0,74; p<0,001) y de procedimientos de revascularización (HR 0,57; IC 95% CI, 0,44-0,74; p<0,001).
En los análisis post-hoc, 80 mg de atorvastatina redujeron la incidencia de accidente cerebrovascular isquémico (218/2365, 9,2% vs. 274/2366, 11,6%, p=0,01) y la aumentó la incidencia de accidente ce-rebrovascular hemorrágico (55/2365, 2,3% vs. 33/2366, 1,4%, p=0,02), en comparación con placebo. La incidencia de accidente cerebrovascular hemorrágico fatal, fue similar entre los grupos (17 atorvastatina vs. 18 placebo). La reducción del riesgo de eventos cardiovasculares con 80 mg de atorvastatina, quedó demostrada en todos los grupos de pacientes, excepto en aquellos que ingresaron al estudio con un accidente cerebrovascular hemorrágico y tenían un accidente cerebrovascular hemorrágico recurrente (7 atorvastatina vs. 2 placebo), donde el número de eventos era tan pequeño, que no fue posible discernir el riesgo o beneficio.
En pacientes tratados con 80 mg de atorvastatina, hubo menos accidentes cerebrovasculares de cualquier tipo (265 atorvastatina vs. 311 placebo) y menos eventos de ECC (123 atorvastatina vs. 204 placebo). La mortalidad total fue similar entre los grupos de tratamiento (216 atorvastatina vs. 211 placebo). La incidencia global de eventos adversos y de eventos adversos serios, fue similar entre los grupos de tratamiento.
Hipercolesterolemia familiar heterocigota en pacientes pediátricos: En un estudio doble-ciego, controlado con placebo, seguido por una fase abierta, 187 muchachos u muchachas posmenárquicas de 10-17 años de edad (edad promedio 14,1 años), con hipercolesterolemia familiar (HF) heterocigota o hipercolesterolemia, fueron aleatorizados para recibir atorvastatina (n=140) o placebo (n=47) durante 26 semanas y luego todos ellos recibieron atorvastatina durante 26 semanas, La inclusión en el estudio requería 1) un nivel de LDL-C ≥190 mg/dL en línea-base o 2) un nivel de LDL-C ≥160 mg/dL en línea-base y una historia familiar positiva de HF o enfermedad cardiovascular prematura, en un pariente de primer o segundo grado, El valor promedio de LDL-C en línea-base fue 218,6 mg/dL (rango: 138,5-385,0 mg/dL) en el grupo atorvastatina, comparado con 230,0 mg/dL (rango: 160,0-324,5 mg/dL) en el grupo placebo, La dosis de atorvastatina (una vez al día) fue 10 mg durante las primeras 4 semanas, con titulación posterior hasta 20 mg si el nivel de LDL-C era >130 mg/dL, El número de pacientes atorvastatina que requirieron la titulación hasta 20 mg después de la Semana 4 de la fase doble-ciega, fue de 80 (57,1%),
La atorvastatina disminuyó significativamente el nivel plasmático de C-total, LDL-C, triglicéridos y apolipoproteína B, durante la fase doble-ciega de 26 semanas (véase la Tabla 5).
|
Tabla 5. Efectos hipolipemiantes de la atorvastatina en muchachos y muchachas adolescentes con hipercolesterolemia familiar heterocigota o hipercolesterolemia severa (Media del cambio porcentual desde línea-base hasta el punto-final en la población intención de tratar) |
||||||
|
Dosis |
N |
C-Total |
LDL-C |
HDL-C |
TG |
Apoliproteína B |
|
Placebo |
47 |
-1,5 |
-0,4 |
-1,9 |
1,0 |
0,7 |
|
Atorvastatina |
140 |
-31,4 |
-39,6 |
2,8 |
-12,0 |
-34,0 |
La media alcanzada del valor de LDL-C, fue 130,7 mg/dL (rango: 70,0-242,0 mg/dL) en el grupo atorvastatina, comparada con 228,5 mg/dL (rango: 152,0-385,0 mg/dL) en el grupo placebo, durante la fase doble-ciega de 26 semanas.
En este estudio controlado y limitado, no hubo efectos detectables sobre el crecimiento o la maduración sexual de los varones o en la duración del ciclo menstrual en las hembras. La atorvastatina no ha sido estudiada en estudios clínicos controlados, involucrando pacientes prepúberes o pacientes menores de 10 años. No se ha estudiado la seguridad y eficacia de dosis superiores a 20 mg, en estudios clínicos controlados en niños. No se ha establecido la eficacia a largo-plazo del tratamiento con atorvastatina en la niñez, para reducir la morbilidad y mortalidad en la edad adulta.
PROPIEDADES FARMACOCINÉTICAS:
Farmacocinética y metabolismo:
Absorción:
En estudios con amlodipina/atorvastatina: Después de la administración oral de amlodipina/atorvastatina, se observaron dos picos de concentraciones plasmáticas diferentes. El primero, observado dentro de 1 y 2 horas después de la dosificación, es atribuible a la atorvastatina; el segundo, observado entre 6 y 12 horas después de la dosificación, es atribuible a la amlodipina. La velocidad y la magnitud de absorción (biodisponibilidad) de la amlodipina y atorvastatina, desde amlodipina/atorvastatina, no fue significativamente diferente de la biodisponibilidad de la amlodipina y la amlodipina coadministradas en una misma tableta de amlodipina y atorvastatina, como se evidenció por la Cmáx: 101% (IC 90%: 98, 104) y el ABC: 100% (IC 90%: 97, 103) para el componente amlodipina y Cmáx: 94% (IC 90%: 85, 104) y ABC: 105% (IC 90%: 99, 111) para el componente atorvastatina, respectivamente.
La biodisponibilidad del componente amlodipina del amlodipina/atorvastatina, no se vio afectada bajo condiciones de alimentación, como se evidenció por la Cmáx: 105% (IC 90%: 99, 111) y el ABC: 101% (IC 90%: 97, 105), con relación al estado de ayuno. Aunque los alimentos disminuyeron la velocidad y la magnitud de la absorción de la atorvastatina desde el amlodipina/atorvastatina en aproximadamente 32% y 11%, respectivamente, como se evidenció por la Cmáx: 68% (IC 90%: 60, 79) y el ABC: 89% (IC 90%: 83, 95), con relación al estado de ayuno, también se evidenciaron disminuciones similares en las concentraciones plasmáticas con atorvastatina tomada como la monoterapia en presencia de alimentos, sin disminución del efecto sobre la LDL-C (véase más adelante).
En estudios con amlodipina: Después de la administración oral de dosis terapéuticas la amlodipina es bien absorbida, obteniéndose los niveles máximos en sangre entre 6-12 horas post-dosis. La biodisponibilidad absoluta ha sido estimada entre 64% y 80%. El volumen de distribución es aproximadamente de 21 L/kg. Estudios in vitro han demostrado que aproximadamente 97,5% de la amlodipina circulante se encuentra unida a proteínas plasmáticas.
La absorción de la amlodipina no se ve afectada por el consumo de alimentos.
En estudios con atorvastatina: La atorvastatina es absorbida rápidamente después de su administración oral; las concentraciones plasmáticas máximas se presentan después de 1 a 2 horas. La magnitud de la absorción y las concentraciones plasmáticas de atorvastatina, aumentan en proporción a la dosis de atorvastatina. Las tabletas de atorvastatina tienen una biodisponibilidad de 95% a 99%, en comparación con las soluciones. La biodisponibilidad absoluta de atorvastatina es aproximadamente de 14% y la disponibilidad sistémica de la actividad inhibitoria de la reductasa de la H mg-CoA, es aproximadamente de 30%. La baja disponibilidad sistémica es atribuida a su depuración presistémica en la mucosa gastrointestinal y/o su metabolismo hepático de primer paso. Aunque la presencia de alimentos disminuye la velocidad y la magnitud de absorción del fármaco en aproximadamente 25% y 9%, respectivamente, evidenciado por los parámetros Cmáx y ABC, la reducción de la LDL-C es similar, independientemente de si se administra con o sin alimentos. Las concentraciones plasmáticas de atorvastatina son más bajas (aproximadamente 30% para Cmáx y ABC), después de la administración vespertina del fármaco, en comparación con la administración matutina. Sin embargo, la disminución de la LDL-C es la misma, independientemente de la hora del día en que se administre el fármaco (véase Posología y método de administración).
Distribución:
En estudios con atorvastatina: El volumen de distribución promedio de la atorvastatina, es aproximadamente 381 litros. La atorvastatina se une en ≥98% a las proteínas plasmáticas. Una relación eritrocitos/plasma de aproximadamente 0,25, indica una pobre penetración en los eritrocitos.
Metabolismo y excreción:
En estudios con amlodipina: La vida media de eliminación terminal en plasma, es de aproximadamente 35-50 horas y es compatible con su dosificación una vez al día. Los niveles plasmáticos en estado estacionario se alcanzan después de 7-8 días de dosificación consecutiva. La amlodipina es metabolizada extensamente en el hígado a metabolitos inactivos, con 10% de droga inalterada y 60% de metabolitos, excretados en la orina.
En estudios con atorvastatina: La atorvastatina se metaboliza extensamente a derivados orto- y para-hidroxilados y varios productos de beta-oxidación. La inhibición in vitro de la reductasa de la H mg-CoA por los metabolitos orto- y para-hidroxilados, es equivalente a la que produce la atorvastatina, aproximadamente el 70% de la actividad inhibitoria circulante de la reductasa de la H mg-CoA, se atribuye a los metabolitos activos. Varios estudios in vitro sugieren la importancia del metabolismo de la atorvastatina por la isoenzima 3A4 del citocromo P-450 hepático, lo cual es compatible con el aumento de las concentraciones plasmáticas de la atorvastatina en los seres humanos, después su administración simultánea con eritromicina, un inhibidor conocido de esta isoenzima. Estudios in vitro también indican que la atorvastatina es un inhibidor débil de la isoenzima 3A4 del citocromo P-450, La coadministración de la atorvastatina, no produjo efectos clínicamente significativos en las concentraciones plasmáticas de la terfenadina, un compuesto metabolizado predominantemente por la 3A4 del citocromo P-450; por lo tanto, no es probable que la atorvastatina altere significativamente la farmacocinética de otros substratos de la 3A4 P-450. (Véase Interacción con otros medicamentos y otras formas de interacción). En los animales, el metabolito orto-hidroxi sufre glucuronidación posterior.
La atorvastatina y sus metabolitos se eliminan principalmente en la bilis, después de su metabolismo hepático y/o extrahepático; sin embargo, este fármaco no parece experimentar recirculación entero-hepática. La vida media de eliminación plasmática promedio de la atorvastatina en los humanos, es de aproximadamente 14 horas, pero la vida media de su actividad inhibitoria de la reductasa de la H mg-CoA es de 20 a 30 horas, debido a la contribución de sus metabolitos activos. Después de su administración oral, se recupera en la orina menos del 2% de una dosis de atorvastatina.
Poblaciones especiales:
Insuficiencia hepática:
En estudios con atorvastatina: Las concentraciones plasmáticas de atorvastatina aumentan marcadamente (aproximadamente 16 veces para la Cmáx y 11 veces para el ABC), en los pacientes con enfermedad hepática alcohólica crónica (clasificación B de Child-Pugh). (Véase Contraindicaciones),
Insuficiencia renal (véase Posología y método de administración)
En estudios con amlodipina: Las variaciones en las concentraciones plasmáticas de amlodipina, no se correlacionan con el grado de deterioro renal. La amlodipina no es dializable.
En estudios con atorvastatina: La enfermedad renal no tiene influencia sobre las concentraciones plasmáticas, ni en los efectos sobre los lípidos, de la atorvastatina. Por consiguiente, en los pacientes con disfunción renal no es necesario un ajuste de las dosis.
Género:
En estudios con atorvastatina: Las concentraciones plasmáticas de la atorvastatina en la mujer, difieren (aproximadamente 20% superiores para la Cmáx y 10% inferiores para el ABC) de las observadas en hombres. Sin embargo, no se evidenciaron diferencias clínicamente significativas en sus efectos sobre los lípidos, entre hombres y mujeres.
Edad avanzada:
En estudios con amlodipina: El tiempo para alcanzar las concentraciones plasmáticas pico de la amlodipina, es similar en sujetos de edad avanzada y jóvenes. En los pacientes de edad avanzada, la depuración de la amlodipina tiende a disminuir, con consecuentes incrementos en el ABC y en la vida media de eliminación. Los incrementos en el ABC y la vida media de eliminación en los pacientes con insuficiencia cardiaca congestiva, fueron los esperados en pacientes del grupo etario en cuestión. La amlodipina se toleró igualmente bien, cuando se usó en dosis similares en pacientes de edad avanzada o jóvenes.
En estudios con atorvastatina: Las concentraciones plasmáticas de atorvastatina son más altas (aproximadamente 40% en la Cmáx y 30% en el ABC) en sujetos saludables de edad avanzada ≥ 65 años), que en los adultos jóvenes. El estudio ACCESS evaluó específicamente pacientes de edad avanzada, con respecto al logro de sus objetivos del tratamiento NCEP. Este estudio incluyó 1.087 pacientes menores de 65 años, 815 pacientes mayores de 65 años y 185 pacientes mayores de 75 años de edad. No se encontraron diferencias, con respecto a la seguridad, eficacia o alcance de los objetivos lipídicos, entre los pacientes de edad avanzada y la población total.
Pediatría:
En estudios con amlodipina: En un estudio clínico de exposición crónica, 73 pacientes pediátricos hipertensos, con edades de 12 meses hasta menos que o igual a 17 años, se dosificó la amlodipina en una dosis diaria promedio de 0,17 mg/kg, La depuración de los sujetos, con una mediana de peso de 45 kg, fue 23,7 L/hr y 17,6 L/hr para los varones y hembras, respectivamente. Estos valores están en un rango similar al estimado publicado de 24,8 L/hr en un adulto de 70 kg. El promedio estimado para el volumen de distribución para un paciente de 45 kg, fue 1.130 L (22,11 L/kg), Se observó un efecto de mantenimiento de la presión arterial durante el intervalo de dosificación de 24 horas, con poca fluctuación pico-valle. La comparación de los valores de los parámetros observados en este estudio, con los parámetros farmacocinéticos históricos de los adultos, indica que la dosificación una vez al día es apropiada.
CONTRAINDICACIONES: Amlodipina/atorvastatina está contraindicado en pacientes que tengan:
1. Hipersensibilidad conocida a dihidropiridinas, amlodipina, atorvastatina o a algún otro componente de este medicamento,
2. Enfermedad hepática activa o aumentos persistentes inexplicados de las transaminasas séricas, que excedan tres veces el límite superior normal,
3. O en quienes estén embarazadas, amamantando o sean fértiles y no estén utilizando medidas anticonceptivas adecuadas. Amlodipina/atorvastatina solo se le debe administrar a mujeres en edad fértil, si es altamente improbable que conciban y han sido informadas de los peligros potenciales para el feto.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES PARA EL USO:
Uso en pacientes con insuficiencia cardiaca: En un estudio a largo plazo, controlado con placebo (PRAISE-2), en pacientes tratados con amlodipina con insuficiencia cardiaca NYHA III y IV de etiología no-isquémica, la amlodipina se asoció con una mayor cantidad de reportes de edema pulmonar, a pesar de que no hubo diferencia significativa en la incidencia de empeoramiento de la insuficiencia cardiaca, en comparación con el placebo (véase Propiedades farmacodinámicas).
Uso en pacientes con función hepática Insuficiente (Véase también la secciónContraindicaciones):
Efectos hepáticos: Igual que con otros agentes hipolipemiantes de clase de los inhibidores de la reductasa de la H mg-CoA, después del tratamiento con atorvastatina se han reportado elevaciones moderadas de las transaminasas séricas (> 3 x el limite superior normal [LSN]). La función hepática fue monitoreada en estudios clínicos de atorvastatina previos y posteriores a su comercialización, administrada en dosis de 10, 20, 40 y 80 mg.
En el 0,7% de los pacientes que recibieron la atorvastatina en esos estudios clínicos, se presentaron elevaciones persistentes de las transaminasas séricas (> 3 x LSN en dos o más ocasiones). La frecuencia de dichas anormalidades fue de 0,2%, 0,2%, 0,6% y 2,3%, para las dosis de 10, 20, 40 y 80 mg, respectivamente. Generalmente las elevaciones no estuvieron asociadas con ictericia u otros signos o síntomas clínicos. Cuando se redujo la dosis de atorvastatina, o se interrumpió o discontinuó el tratamiento con el fármaco, las concentraciones de las transaminasas volvieron a los niveles pretratamiento. La mayoría de los pacientes continuaron el tratamiento con una dosis menor de atorvastatina, sin secuelas.
Antes de iniciar el tratamiento y después en forma periódica, se deben efectuar exámenes de función hepática. A los pacientes que presenten cualquier signo o síntoma que sugiera un daño hepático, se les deben practicar exámenes de función hepática. Los pacientes que presenten niveles elevados de transaminasas, deben ser monitoreados hasta que la(s) anormalidad(es) se resuelva(n). Si persiste la elevación de ALAT o la ASAT en más de 3 veces el límite superior normal, se recomienda reducir la dosis o interrumpir el tratamiento con amlodipina/atorvastatina. La atorvastatina puede causar un au-mento en las transaminasas (véase Efectos indeseables).
Amlodipina/atorvastatina se debe emplear con precaución en pacientes que consuman cantidades sustanciales de alcohol y/o tengan una historia de enfermedad hepática. La enfermedad hepática activa o las elevaciones persistentes e inexplicables de las transaminasas, constituyen contraindicaciones para el uso de amlodipina/atorvastatina (véase Contraindicaciones).
Efectos sobre el músculo esquelético: Se ha reportado mialgia en pacientes tratados con atorvastatina (véase Efectos indeseables). La miopatía, definida como dolor o debilidad muscular, conjuntamente con aumentos de los valores de la creatinina fosfoquinasa (CPK) en > 10 x LSN, debe ser tomada en cuenta en cualquier paciente con mialgias difusas, musculatura débil y sensible al tacto o la presión, y/o con elevación pronunciada de la CPK. Los pacientes deben ser advertidos de que deben reportar inmediatamente cualquier dolor, hipersensibilidad o debilidad muscular inexplicados, especialmente si están acompañados por malestar general o fiebre. El tratamiento con amlodipina/atorvastatina se debe discontinuar si se presentan niveles marcadamente elevados de la CPK o se diagnostica o se sospecha una miopatía. El riesgo de una miopatía durante el tratamiento con los inhibidores de la reductasa de la H mg-CoA, aumenta con la administración concurrente de ciclosporina, derivados del ácido fíbrico, eritromicina, niacina o antimicóticos azólicos. Algunos de estos fármacos inhiben el metabolismo por la isoenzima 3A4 del citocromo P-450 (CYP) y/o el transporte del fármaco. La 3A4-CYP es la principal isozima involucrada en la biotransformación de la atorvastatina. Los médicos que consideren la posibilidad de un tratamiento combinado con atorvastatina y derivados del ácido fíbrico, eritromicina, fármacos inmunosupresores, antimicóticos azólicos o dosis hipolipemiantes de niacina, deben sopesar cuidadosamente los beneficios y riesgos potenciales y vigilar estrechamente a los pacientes para determinar la posible presencia de signos y síntomas de dolor; hipersensibilidad anormal o debilidad musculares, especialmente durante los meses iniciales de tratamiento y durante cualquier periodo de ajuste incremental de la dosis de cualquiera de los fármacos. En estas situaciones se deberían considerar determinaciones periódicas de la creatinina fosfoquinasa (CPK), aunque no hay seguridad de que con dicho monitoreo se vaya a prevenir la aparición de miopatía severa (véase Interacciones con otros medicamentos y otras formas de interacción). Amlodipina/atorvastatina puede causar un aumento de la creatinina fosfoquinasa, debido al componente atorvastatina (véase Efectos indeseables).
Al igual que para otros fármacos de la clase inhibidores de la reductasa de la H mg-CoA, se han reportado casos raros de rabdomiolisis con insuficiencia renal aguda, secundaria a mioglobinuria. El tratamiento con amlodipina/atorvastatina debe ser suspendido temporalmente o discontinuado, en cualquier paciente con una afección aguda seria que sugiera una miopatía o implique un factor de riesgo que predisponga al desarrollo de insuficiencia renal secundaria a la rabdomiolisis (por ejemplo, infección aguda severa, hipotensión, cirugía mayor, trauma, trastornos metabólicos, endocrinos y electrolíticos severos y convulsiones incontroladas). En estos casos se puede seguir controlando la hipertensión, con la dosis apropiada de amlodipina.
Accidente cerebrovascular hemorrágico – Un análisis post-hoc de un estudio clínico en 4.731 pacientes sin enfermedad cardiaca coronaria (ECC), que tuvieron un accidente cerebrovascular o ataque isquémico transitorio (AIT) en los seis meses previos, y se iniciaron con 80 mg de atorvastatina, reveló una mayor incidencia de accidente cerebrovascular hemorrágico en el grupo atorvastatina 80 mg, que en el grupo placebo (55 atorvastatina vs. 33 placebo). En los pacientes con accidente cerebrovas-cular hemorrágico al ingresar, hubo aparentemente un mayor riesgo de accidente cerebrovascular hemorrágico recurrente (7 atorvastatina vs. 2 placebo). Sin embargo, en los pacientes tratados con atorvastatina 80 mg hubo menos accidentes cerebrovasculares de cualquier tipo (265 vs. 311) menos eventos de ECC (123 vs. 204). (Véase Propiedades farmacodinámicas – Accidente cerebrovascular recurrente).
EMBARAZO Y LACTANCIA: Amlodipina/atorvastatina está contraindicado en el embarazo, debido al componente atorvastatina. Las mujeres en edad reproductiva, deben utilizar métodos anticonceptivos adecuados.
Amlodipina/atorvastatina solamente debe administrarse a mujeres en edad reproductiva, cuando sea muy improbable que tales pacientes queden embarazadas y después de haberles informado los riesgos potenciales para el feto.
Amlodipina/atorvastatina está contraindicado durante la lactancia, debido a su componente atorvastatina. No se sabe si la atorvastatina se excreta en la leche materna. Debido al riesgo potencial de reacciones adversas en los infantes lactantes, las mujeres que estén tomando amlodipina/atorvastatina no deben amamantar.
No se ha determinado la seguridad de la amlodipina en el embarazo o la lactancia en humanos. En estudios reproductivos llevados a cabo en animales, la amlodipina no demostró toxicidad, excepto por retraso del parto y prolongación del trabajo de parto en ratas, con un nivel de dosis que era 50 veces la dosis máxima recomendada en humanos.
EFECTOS INDESEABLES: La seguridad del tratamiento combinado con amlodipina y atorvastatina, se evaluó en estudios doble-ciegos, controlados con placebo, en 1.092 pacientes, tratados para hipertensión y dislipidemia concomitantes. En los estudios clínicos no se observaron eventos adversos peculiares, para la terapia de combinación de amlodipina y atorvastatina. Los eventos adversos se limitaron a aquellos reportados previamente con amlodipina y/o atorvastatina (por favor, vea las experiencias de eventos adversos respectivas, más adelante).
En general, el tratamiento combinado con amlodipina y atorvastatina, fue bien tolerado. En su mayor parte, los eventos adversos fueron de severidad leve o moderada. En estudios clínicos controlados, solo se requirió la discontinuación del tratamiento por eventos adversos o anormalidades de laboratorio en el 5,1% de los pacientes tratados con ambas, amlodipina y atorvastatina, en comparación con el 4,0% de los pacientes que recibían placebo.
La siguiente información proviene de estudios clínicos y de la experiencia post-comercialización con amlodipina y atorvastatina.
Experiencia con la amlodipina: La amlodipina es bien tolerada. En estudios clínicos controlados con placebo, involucrando pacientes con hipertensión o angina de pecho, los efectos secundarios más comúnmente observados fueron:
Sistema nervioso autónomo: Rubor/rubefacción.
El organismo como un todo: Fatiga.
Cardiovascular, general: Edema.
Sistema nervioso central y periférico: Mareo, cefalea.
Gastrointestinal: Dolor abdominal, náusea.
Frecuencia/ritmo cardiaco: Palpitaciones.
Psiquiátrico: Somnolencia.
En estos estudios clínicos no se observó ningún patrón de anormalidades clínicamente significativas en pruebas de laboratorio, relacionadas a la amlodipina.
Pacientes pediátricos (6-17 años de edad): La amlodipina es bien tolerada en niños. Los eventos adversos fueron similares a los observados en adultos. En un estudio de 268 niños, los eventos adversos reportados más frecuentemente fueron cefalea, astenia, mareo, dolor abdominal, vasodilatación y epistaxis. La mayoría de los eventos adversos fueron leves a moderados. Los eventos adversos severos (predominantemente cefalea), fueron experimentados por 7,2% con 2,5 mg de amlodipina, 4,5% con 5 mg de amlodipina y 4,6% con placebo. La causa más común para la discontinuación del estudio, fue hipertensión no-controlada. No hubo discontinuaciones debidas a anormalidades de laboratorio. No hubo cambio significativo en la frecuencia cardiaca.
En la experiencia postcomercialización, se han reportado los siguientes efectos indeseables con la amlodipina:
Sistema nervioso autónomo: Boca seca, sudoración aumentada, el organismo como un todo: astenia, dolor de espalda, malestar, dolor, aumento/disminución de peso.
Cardiovasculares, general: hipotensión, sincope
Sistema nervioso central y periférico: Hipertonía, hipoestesia/parestesia, neuropatía periférica, temblor.
Endocrinos: Ginecomastia.
Gastrointestinales: Alteraciones del hábito intestinal, dispepsia (incluyendo gastritis), hiperplasia gingival, pancreatitis, vómito.
Metabólicos/nutricionales: Hiperglucemia.
Musculoesqueléticos: Artralgia, calambres musculares, mialgia.
Plaquetas/sangrado/coagulación: Púrpura, trombocitopenia.
Psiquiátricos: Impotencia, insomnio, cambios de humor.
Respiratorios: Tos, disnea, rinitis.
Piel/apéndices: Alopecia, coloración de la piel, urticaria.
Sentidos especiales: Distorsión del gusto, zumbido.
Urinarios: Frecuencia urinaria aumentada, trastorno de micturición, nocturia.
Vasculares (extracardiacos): Vasculitis.
Visión: Trastornos visuales.
Glóbulos blancos/sistema del retículo endoplásmico: Leucopenia.
Hepatobiliares: Hepatitis, ictericia y también se han reportado, muy infrecuentemente, aumentos de las enzimas hepáticas (mayormente compatibles con colestasis). Se han reportado algunos casos lo suficientemente severos para requerir hospitalización, en asociación con el uso de la amlodipina.
En muchos casos, la asociación causal es incierta y raramente: Reacciones alérgicas incluyendo prurito, rash, angioedema y eritema multiforme.
Al igual que para otros bloqueadores de los canales de calcio, los siguientes efectos adversos se han reportados raramente y no ha sido posible desvincularlos de la historia natural de la enfermedad subyacente: Infarto de miocardio, arritmias (incluyendo bradicardia, taquicardia ventricular y fibrilación auricular) y dolor precordial.
Experiencia con la atorvastatina: Generalmente, la atorvastatina es bien tolerada. En general, las reacciones adversas han sido leves y transitorias. Menos de 2% de los pacientes fueron descontinuados de estudios clínicos por efectos secundarios atribuibles a la atorvastatina.
Los efectos adversos más frecuentes (≥1%) asociados con el tratamiento con atorvastatina, en pacientes participantes en estudios clínicos controlados, fueron:
Trastornos psiquiátricos: Insomnio.
Trastornos del sistema nervioso: Cefalea.
Trastornos gastrointestinales: Náusea, diarrea, dolor abdominal, dispepsia, estreñimiento, flatulencia.
Trastornos musculoesqueléticos y del tejido conectivo: Mialgia.
Trastornos generales y condiciones del sitio de administración: Astenia.
Los siguientes efectos adversos adicionales, han sido reportados en los estudios clínicos de atorvastatina:
Trastornos metabólicos y nutricionales: Hipoglucemia, hiperglucemia, anorexia.
Trastornos del sistema nervioso: Neuropatía periférica, parestesia.
Trastornos gastrointestinales: Pancreatitis, vómito.
Trastornos hepatobiliares: Hepatitis, ictericia colestásica.
Trastornos de la piel y el tejido subcutáneo: Alopecia, prurito, rash.
Trastornos musculoesqueléticos y del tejido conectivo: Miopatía, miositis, calambres musculares.
Trastornos del sistema reproductivo y las mamas: Impotencia.
No todos los efectos listados antes, han sido asociados causativamente con el tratamiento con atorvastatina.
Pacientes pediátricos (10-17 años de edad): Los pacientes tratados con atorvastatina, han experimentado un perfil de experiencias adversas gene-ralmente similar al de los pacientes tratados con placebo; las experiencias adversas observadas en ambos grupos, independientemente de su evaluación causativa, eran infecciones.
En la experiencia postcomercialización, se han reportado los siguientes efectos adversos adicionales con la atorvastatina:
Trastornos de la sangre y el sistema linfático: Trombocitopenia.
Trastornos del sistema inmunológico: Reacciones alérgicas (incluyendo anafilaxis).
Trastornos del metabolismo y la nutrición: Aumento de peso.
Trastornos del sistema nervioso: Hipoestesia, amnesia, mareo, disgeusia.
Trastornos del oído y el laberinto: Zumbido.
Trastornos de la piel y el tejido subcutáneo: Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme, erupciones bulosas, urticaria.
Trastornos musculoesqueléticos y del tejido conectivo: Rabdomiolisis, artralgia, dolor de espalda.
Trastornos generales y condiciones del sitio de administración: Dolor de pecho, edema periférico, malestar general, fatiga.
EFECTOS SOBRE LA CAPACIDAD PARA MANEJAR Y UTILIZAR MÁQUINAS: Con base en la información disponible sobre la amlodipina y la atorvastatina, es improbable que este medicamento deteriore la capacidad de un paciente para manejar o usar maquinaria.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: La información proveniente de un estudio de interacción droga-droga, que involucró la administración de 10 mg de amlodipina y 80 mg de atorvastatina a sujetos saludables, indicó que la farmacocinética de la amlodipina no se altera cuando se administran conjuntamente estas drogas. El efecto de la amlodipina sobre la farmacocinética de la atorvastatina, no mostró ningún efecto sobre la Cmáx: 91% (intervalo de confianza 90%: 80 a 103%), pero el área bajo la curva (ABC) de la atorvastatina aumentó en 18% (intervalo de confianza 90%: 109 a 127%), en presencia de la amlodipina.
No se han realizado estudios de interacción de drogas con amlodipina/atorvastatina y otros fármacos, pero si se han realizado estudios usando individualmente los componentes amlodipina y atorvastatina, como se describe a continuación:
En estudios con amlodipina: La amlodipina ha sido administrada en forma segura con diuréticos tiazídicos, bloqueadores-alfa, bloqueadores-beta, inhibidores de la enzima convertidora de la angiotensina, nitratos de acción prolongada, nitroglicerina sublingual, drogas antiinflamatorias no esteroideas, antibióticos y drogas hipoglucemiantes orales.
Datos “in vitro” de estudios con plasma humano, indican que la amlodipina no afecta la unión a las proteínas de las drogas evaluadas (digoxina, fenitoína, warfarina o indometacina).
En los estudios listados a continuación, no hubo cambios significativos en la farmacocinética de la amlodipina, ni de ninguna otra droga del estudio respectivo, cuando se administraron conjuntamente.
Estudios especiales: Efecto de otros agentes sobre la amlodipina:
Cimetidina: La coadministración de cimetidina con amlodipina, no alteró la farmacocinética de la amlodipina.
Jugo de toronja/pomelo: La coadministración de 240 mL de jugo de toronja con una dosis oral única de 10 mg de amlodipina en 20 voluntarios sanos, no tuvo efecto significativo sobre la farmacocinética de la amlodipina.
Aluminio/magnesio (antiácido): La coadministración de un antiácido conteniendo aluminio/magnesio con una dosis única de amlodipina, no tuvo efecto significativo sobre la farmacocinética de la amlodipina.
Sildenafil: Una dosis única de 100 mg de sildenafil en individuos con hipertensión esencial, no afectó los parámetros farmacocinéticos de la amlodipina. Cuando la amlodipina y el sildenafil se usaron en combinación, cada agente ejerció independientemente su propio efecto hipotensor.
Estudios especiales: Efecto de la amlodipina sobre otros agentes:
Digoxina: La coadministración de amlodipina con digoxina, no afectó los niveles séricos de la digoxina, ni su depuración renal, en voluntarios normales.
Etanol (alcohol): Dosis única o múltiples de 10 mg de amlodipina, no afectaron significativamente la farmacocinética del etanol.
Warfarina: La coadministración de amlodipina con warfarina, no alteró el tiempo de protrombina de la warfarina.
Ciclosporina: Estudios farmacocinéticos con ciclosporina, demostraron que la amlodipina no altera significativamente la farmacocinética de la ciclosporina.
Interacciones con pruebas de laboratorio: Ninguna conocida.
En estudios con atorvastatina: El riesgo de miopatía durante el tratamiento con drogas inhibidoras de la reductasa de la H mg-CoA, aumenta con la administración concurrente de ciclosporina, derivados del ácido fíbrico, niacina o inhibidores de la 3A4-P450 (eritromicina (ver después) y antimicóticos azólicos). (Véase Advertencias especiales y precauciones especiales en el uso: Efectos sobre el músculo esquelético).
Inhibidores de la 3A4-citocromo P450: La atorvastatina es metabolizada por la 3A4-citocromo P450. La administración concomitante de atorvastatina con inhibidores de la 3A4-citocromo P450 puede resultar en aumentos de las concentraciones plasmáticas de atorvastatina. La magnitud de los efectos de interacción y potenciación, dependerá de la variabilidad del efecto sobre la 3A4-citocromo P450.
Eritromicina/claritromicina: La coadministración de atorvastatina y eritromicina (500 mg cuatro veces al día) o claritromicina (500 mg dos veces al día), inhibidores conocidos de la 3A4-citocromo P-450, se asoció con concentraciones plasmáticas más altas de atorvastatina. (Véase Advertencias especiales y precauciones especiales en el uso: Efectos sobre el músculo esquelético).
Inhibidores de proteasa: La administración conjunta de atorvastatina e inhibidores de proteasa, conocidos inhibidores de la 3A4-citocromo P-450, se asoció con concentraciones plasmáticas de atorvastatina aumentadas.
Clorhidrato de diltiazem: La coadministración de atorvastatina (40 mg) con diltiazem (240 mg), se asoció con concentraciones plasmáticas más altas de atorvastatina.
Cimetidina: Se condujo un estudio de interacción de atorvastatina con cimetidina, y no se evidenciaron interacciones clínicamente significativas.
Jugo de toronja/pomelo: Contiene uno o más componentes que inhiben 3A4- CYP y pueden producir un aumento de las concentraciones plasmáticas de atorvastatina, especialmente con consumo excesivo de este jugo (>1,2 litros al día).
Inductores de la 3A4-citocromo P450: La administración concomitante de atorvastatina con inductores de la 3A4-citocromo P-450 (p.ej. efavirenz, rifampicina), puede resultar en disminuciones variables en las concentraciones plasmáticas de atorvastatina. Debido a la interacción dual de la rifampicina (inducción de la 3A4-citocromo P-450 e inhibición del transportador de captación por el hepatocito OATP1B1), no se recomienda la administración simultánea de atorvastatina con rifampicina, ya que la administración demorada de la atorvastatina después de la administración de la rifampicina, se ha asociado con una disminución significativa en las concentraciones plasmáticas de atorvastatina.
Antiácidos: La coadministración de atorvastatina con una suspensión antiácida oral, conteniendo hidróxidos de magnesio y aluminio, disminuyó las concentraciones plasmáticas de la atorvastatina en aproximadamente 35%; sin embargo, la reducción de la LDL-colesterol no se alteró.
Antipirina: Como la atorvastatina no afecta la farmacocinética de la antipirina, no se esperan interacciones con otros fármacos que son metabolizados por las mismas isozimas del citocromo.
Colestipol: Las concentraciones plasmáticas de atorvastatina fueron más bajas (aproximadamente 25%), cuando se administró el colestipol con la atorvastatina. Sin embargo, los efectos sobre los lípidos fueron mayores cuando se coadministraron la atorvastatina y el colestipol, que cuando se administró cada droga sola.
Digoxina: Cuando se coadministraron dosis repetidas de digoxina y 10 mg de atorvastatina, las concentraciones plasmáticas de digoxina en estado estacionario no resultaron afectadas. Sin embargo, las concentraciones de digoxina aumentaron aproximadamente en 20%, después de su administración con 80 mg de atorvastatina diariamente. Los pacientes que estén tomando digoxina, deben ser monitoreados apropiadamente.
Azitromicina: La administración conjunta de atorvastatina (10 mg diarios) y azitromicina (500 mg una vez al día), no produjo alteración de las concentraciones plas máticas de atorvastatina.
Warfarina: Se realizó un estudio de interacción de atorvastatina con warfarina y no se evidenciaron interacciones clínicamente significativas.
Otros tratamientos concomitantes: En estudios clínicos, la atorvastatina ha sido utilizada concomitantemente con agentes antihipertensivos y tratamiento de reemplazo estrogénico, sin evidencia de interacciones adversas clínicamente significativas. No se han efectuado estudios de interacción con agentes específicos.
INFORMACIÓN DE SEGURIDAD PRECLÍNICA:
Carcinogénesis:
En estudios con amlodipina: Ratas y ratones tratados con amlodipina en la dieta por dos años, en concentraciones calculadas para suministrarles niveles de dosis diarias de 0,5, 1,25 y 2,5 mg/kg/día, no mostraron evidencia de carcinogenicidad. La dosis más alta (para los ratones similar a, y para las ratas el doble de, la dosis máxima recomendada en clínica de 10 mg sobre una base de mg/m2), estuvo cerca de la dosis máxima tolerada por los ratones, pero no por las ratas.
En estudios con atorvastatina: La atorvastatina no fue carcinogénica en las ratas. La máxima dosis utilizada, fue 63 veces más alta que la dosis humana máxima (80 mg/día), sobre una base de mg/kg de peso corporal y de 8 a 16 veces más alta, con base en los valores del ABC(0-24). En un estudio de 2 años en ratones, las incidencias de los adenomas hepatocelulares en los machos y de carcinomas hepatocelulares en las hembras, se vieron aumentadas en los animales tratados con la dosis máxima usada, la cual era 250 veces más alta que la dosis humana máxima, sobre una base de mg/kg de peso corporal. La exposición sistémica, con base en el ABC(0-24), fue de 6 a 11 veces más alta.
Todos las demás drogas pertenecientes a esta clase similares químicamente, han inducido tumores, tanto en ratones como en ratas, en múltiplos de 12 a 125 veces sus dosis clínicas máximas recomendadas sobre una base de mg/kg peso corporal.
Mutagénesis:
En estudios con amlodipina: Los estudios de mutagenicidad no revelaron efectos relacionados con droga, ni a nivel genético, ni a nivel cromosómico.
En estudios con atorvastatina: La atorvastatina no demostró potencial mutagénico o clastogénico en cuatro pruebas in vitro con y sin activación metabólica, ni en un ensayo in vivo. Resultó negativa en la prueba de Ames con Salmonella typhimurium y Escherichia coli y en el ensayo in vitro de mutación anterógrada HGPRT en células de pulmón de hámster Chino. La atorvastatina no produjo aumentos significativos de las aberraciones cromosómicas en el ensayo in vitro de células pulmonares de hámster Chino y resultó negativa en el ensayo in vivo de micronúcleos de ratón.
Deterioro de la fertilidad:
En estudios con amlodipina: No hubo efecto sobre la fertilidad de ratas tratadas con amlodipina (machos por 64 días y hembras 14 días antes de aparearlas), en dosis de hasta 10 mg/kg/día (8 veces* la dosis máxima humana recomendada de 10 mg sobre una base de mg/m2).
*Con base en un peso de paciente de 50 kg
En estudios con atorvastatina: No se observaron efectos adversos sobre la fertilidad o la reproducción, en ratas machos que recibieron dosis de atorvastatina de hasta 175 mg/kg/día o en ratas hembras que recibieron dosis de hasta 225 mg/kg/día. Estas dosis son de 100 a 140 veces la dosis humana máxima recomendada, sobre una base de mg/kg, la atorvastatina no produjo efectos adversos sobre los parámetros de los espermatozoides o el semen, ni sobre la histopatología de los órganos reproductivos, en perros que recibieron dosis de 10, 40 o 120 mg/kg por dos años.
PFIZER
® Marca registrada
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN:
Consideraciones generales: Amlodipina/atorvastatina es un producto de combinación que apunta a las dolencias cardiovasculares concomitantes, hipertensión/angina y dislipidemia.
El rango de dosificación del amlodipina/atorvastatina, es de 5 mg/10 mg hasta una dosis máxima de 10 mg/80 mg, una vez al día. La dosis inicial y la dosis de mantenimiento se deben individualizar con base en ambas, la eficacia y la tolerabilidad de cada componente individual en el tratamiento de la hipertensión/angina y la dislipidemia. Se deben consultar las pautas actuales para establecer los objetivos del tratamiento de los pacientes, de acuerdo con sus características de línea-base. Las dosis se pueden ingerir en cualquier momento del día, con o sin alimentos.
Como componente de una intervención de riesgos múltiples, amlodipina/atorvastatina se debería usar adicionalmente a las intervenciones no-farmacoterapéuticas, incluyendo dieta apropiada, ejercicio y reducción del peso en los pacientes obesos, abandono del hábito de fumar y tratamiento de los problemas médicos subyacentes, cuando la respuesta a dichas intervenciones sea inadecuada.
Después de la iniciación y/o titulación del amlodipina/atorvastatina, se debe analizar los niveles de los lípidos y medir la presión arterial en el lapso de 2 a 4 semanas, ajustando la dosis de amlodipina y atorvastatina de acuerdo con los resultados. La titulación de la respuesta de presión arterial se puede hacer con mayor prontitud, si se justifica clínicamente.
Tratamiento inicial: Amlodipina/atorvastatina se puede usar para iniciar el tratamiento en pacientes con hiperlipidemia e hipertensión o angina. La dosis inicial recomendada de amlodipina/atorvastatina, se debería establecer con base en la combinación apropiada de las recomendaciones de los componentes amlodipina y atorvastatina, considerados por separado. La dosis máxima del componente amlodipina del amlodipina/atorvasta-tina, es 10 mg una vez al día. La dosis máxima del componente atorvastatina del amlodipina/atorvastatina, es 80 mg una vez al día.
Terapia de sustitución: Amlodipina/atorvastatina se puede sustituir por sus componentes titulados individualmente. Los pacientes pueden tomar la dosis equivalente de amlodipina/atorvastatina o una dosis de amlodipina/atorvastatina con cantidades mayores de amlodipina, atorvastatina o ambos, para efectos antianginosos, hipotensores o hipolipemiantes adicionales.
Amlodipina/atorvastatina se puede utilizar para proporcionar tratamiento adicional, en pacientes que estén tomando alguno de sus componentes. Como tratamiento inicial para una indicación y la continuación del tratamiento de la otra, la dosis inicial recomendada de amlodipina/atorvastatina se debe seleccionar continuando la dosis del componente usado previamente y la dosis inicial del componente que se está adicionando.
Medicación concomitante (Véase Interacción con otros medicamentos y otras formas de interacción): La amlodipina ha sido administrada en forma segura con diuréticos tiazídicos, bloquedores-alfa, bloqueadores-beta, inhibidores de la enzima convertidora de la angiotensina, nitratos de acción prolongada y con nitroglicerina sublingual. Amlodipina/atorvastatina también ha sido administrado en forma segura, con los medicamentos antes mencionados.
El componente atorvastatina del amlodipina/atorvastatina, puede ser usado en combinación con una resina enlazadora de ácidos biliares, para la obtención de un efecto hipolipemiante aditivo. En general se debería evitar la combinación de los inhibidores de la reductasa de la H mg-CoA y los fibratos (véase Advertencias especiales y precauciones especiales para el uso y Interacción con otros medicamentos y otras formas de interacción).
Poblaciones especiales y consideraciones posológicas especiales:
Enfermedad de Arteria Coronaria (EAC) (Estudios de amlodipina): Para los pacientes con enfermedad de arteria coronaria, el rango de dosis recomendado es 5-10 mg de amlodipina, una vez al día. En los estudios clínicos, la mayoría de los pacientes requirieron 10 mg una vez al día (véase Farmacodinamia de la Amlodipina - Uso en Pacientes con Enfermedad de Arteria Coronaria (EAC))
Hipercolesterolemia primaria e hiperlipidemia combinada (Mixta) (Estudios de atorvastatina): La mayoría de los pacientes se controlan con 10 mg de atorvastatina una vez al día. Una respuesta terapéutica es evidente en el lapso de dos semanas y la respuesta máxima se alcanza usualmente en el lapso de cuatro semanas. La respuesta se mantiene durante el tratamiento crónico.
Hipercolesterolemia familiar homocigota (Estudios de atorvastatina): En un estudio de caridad de pacientes con hipercolesterolemia familiar homocigota, la mayoría de los pacientes respondieron a 80 mg de atorvastatina, con más de 15% de disminución de la LDL-C (18%-45%).
Uso en pacientes con función hepática insuficiente: Amlodipina/atorvastatina no se debe usar en pacientes con insuficiencia hepática (véase Contraindicaciones y Advertencias y precauciones especiales para el uso).
Uso en pacientes con función renal insuficiente: No se requiere ajuste de la dosis en los pacientes con insuficiencia renal.
Uso en la edad avanzada: No se requiere ajuste de la dosis en los pacientes de edad avanzada.
Uso en niños: No se han realizado estudios para determinar la seguridad o eficacia del amlodipina/atorvastatina (producto de combinación), en poblaciones pediátricas. Sin embargo, se han realizado estudios con pacientes pediátricos con amlodipina sola y atorvastatina sola (véase a continuación).
Estudios con amlodipina: La dosis antihipertensiva oral en pacientes pediátricos con edades de 6-17 años, es 2,5 mg a 5 mg una vez al día. Las dosis mayores a 5 mg diarios no se han estudiado en pacientes pediátricos (véase Propiedades farmacodinámicas y Propiedades farmacocinéticas).
Se desconoce el efecto de la amlodipina sobre la presión arterial en pacientes menores de 6 años de edad.
Estudios con atorvastatina:
Hipercolesterolemia familiar heterocigota en pacientes pediátricos (10-17 años de edad) – La dosis inicial recomendada de atorvastatina es de 10 mg/día; la dosis máxima recomendada es 20 mg/día (no se han estudiado dosis mayores de 20 mg en esta población de pacientes). Las dosis se deben individualizar en función del objetivo del tratamiento recomendado (véase Indicaciones terapéuticas, y Propiedades farmacodinámicas). Se deben hacer ajustes con intervalos de 4 semanas o más.
SOBREDOSIFICACIÓN: No existe información relativa a la sobredosificación con amlodipina/atorvastatina en humanos.
Como la amlodipina y la atorvastatina se unen extensamente a las proteínas plasmáticas, no se espera que la hemodiálisis favorezca la depuración de la amlodipina/atorvastatina (véase Propiedades farmacocinéticas: Insuficiencia renal).
La información adicional sobre la ingestión de la amlodipina: Sugiere que una sobredosis masiva de la droga puede provocar vasodilatación periférica excesiva y posiblemente taquicardia refleja. Se ha reportado hipotensión sistémica marcada y probablemente prolongada, que ha llegado al shock con desenlace fatal. La administración de carbón activado a voluntarios sanos inmediatamente y hasta dos horas después de la ingestión de 10 mg de amlodipina, no mostró una disminución significativa de la absorción de la droga. El lavado gástrico puede ser meritorio en algunos casos. La hipotensión clínicamente significativa debida a sobredosis de amlodipina, requiere apoyo cardiovascular activo, incluyendo el monitoreo frecuente de las funciones cardiaca y respiratoria, elevación de las extremidades y control del volumen de líquido circulante y de la producción de orina. Un vasoconstrictor podría ser útil para restablecer el tono vascular y la presión arterial, siempre que su uso no esté contraindicado. El gluconato de calcio intravenoso podría ser beneficioso, para revertir los efectos del bloqueo de los canales de calcio.
La información adicional sobre la ingestión de la atorvastatina: Sugiere que no existe un tratamiento específico para la sobredosificación de atorvastatina. Si llegase a ocurrir una sobredosificación, el paciente debe ser tratado sintomáticamente, con implementación de medidas de soporte que se requieran.