
DIMUXON
MOMETASONA
Suspensión en spray nasal
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada aplicación proporciona aproximadamente 100 mg de suspensión acuosa que contiene 50 µg de furoato de mometasona.
Los ingredientes inactivos incluyen cloruro de benzalconio, ácido cítrico, glicerina, celulosa microcristalina y carboximetilcelulosa de sodio, polisorbato 80, agua purificada y citrato de sodio dihidratado.
FORMA FARMACEUTICA: Suspensión (Spray nasal).
ESTRUCTURA Y NOMBRE QUÍMICO:
Nombre propio: Furoato de mometasona.
Nombre químico:
1. Pregna-1,4-dieno-3,20-diona, 9,21-dicloro-17-[(2- furanilcarbonil) oxi]-11-hidroxi-16-metil-, (11 β, 16α)-
2. 9,21-Dicloro-11β, 17-dihidroxy-16α-metilpregna-1,4- dieno-3,20 -diona 17-(2-furoato)
3. 9,21-Dicloro-11β-hidroxi-16α-metil-3,20-dioxopregna- 1,4-dien -17-il furan-2-carboxylato
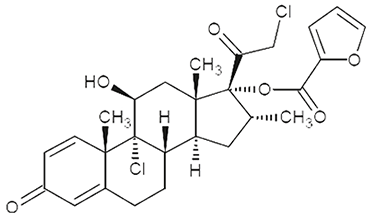
Fórmula molecular: C27H30Cl2O6
Peso molecular: 521.43
Fórmula estructural:
Propiedades fisicoquímicas:
Descripción: Polvo blanco a casi blanco.
pKa: 13.02 ±0.70.
Polimorfismo: No exhibido.
Solubilidad: Prácticamente insoluble en agua, ligeramente soluble en metanol, etanol (96%) e isopropanol, soluble en acetona, cloroformo y cloruro de metileno, libremente soluble en tetrahidrofurano, acetona y diclorometano.
Punto de fusión: Alrededor de 220º C con descomposición.
Coeficiente de partición: 3.59 ± 0.56 (Log P).
CLASE TERAPÉUTICA SEGÚN CLASIFICACIÓN ANATÓMICA TERAPÉUTICA (ATC):
RO1AD09
R - SISTEMA RESPIRATORIO
R01 - Preparados de uso nasal
R01A - Descongestivos y otros preparados nasales para uso tópico R01AD09 – Corticosteroides
MECANISMO DE ACCIÓN: El Furoato de Mometasona es un glucocorticosteroide tópico con propiedades antiinflamatorias locales a dosis que son mínimamente activas sistémicamente.
FARMACODINAMIA: En dos estudios clínicos que utilizan la exposición al antígeno nasal, la suspensión (spray nasal) de Furoato de Mometasona monohidratado ha mostrado una actividad antiinflamatoria en ambas respuestas alérgicas temprana y tardía. Esto ha sido demostrado por la diminución (vs. Placebo) en la actividad de la histamina y los eosinófilos y las reducciones (vs. estado basal) en eosinófilos, neutrófilos y en las proteínas de adhesión a la célula epitelial. La importancia clínica de estos hallazgos es desconocida.
Dos estudios Fase I llevados a cabo para evaluar la exposición sistémica y la tolerabilidad de la suspensión (spray nasal) de Furoato de Mometasona en niños de 3 a 12 años de edad no mostraron exposición sistémica clínicamente relevante a la suspensión (Spray nasal) de Furoato de Mometasona e indicaron que la suspensión (Spray nasal) de Furoato de Mometasona fue bien tolerado. Un tercer estudio Fase I en niños de edad entre 6 a 12 años mostró una velocidad normal de crecimiento de la pierna inferior a corto plazo.
Los resultados de los estudios Fase II y Fase III no indicaron evidencia de supresión del HPA (eje hipotálamo-pituitaria-adrenal), después del tratamiento con la suspensión (spray nasal) de Furoato de Mometasona monohidratado y demostraron que la suspensión (spray nasal) de Furoato de Mometasona monohidratado puede aliviar los síntomas alérgicos en pacientes pediátricos de edad entre 3 a 12 años con rinitis alérgica temporal o perene.
Propiedades farmacocinéticas:
Absorción: El Furoato de Mometasona monohidratado, administrado como un aerosol nasal, tiene una biodisponibilidad sistémica de <1% en plasma, utilizando un ensayo sensible con un límite de cuantificación inferior (LLOQ) de 0.25 pg/mL.
La suspensión de Furoato de Mometasona se absorbe muy poco en el tracto gastrointestinal, y la pequeña cantidad que se puede tragar y absorber experimenta un metabolismo de primer paso extenso antes de la excreción en la orina y la bilis.
Distribución: Se informó que la unión a proteínas in vitro para el Furoato de Mometasona era del 98% al 99% en un rango de concentración de 5 a 500 ng/mL.
Metabolismo: Los estudios han demostrado que cualquier porción de una dosis de Furoato de Mometasona que se ingiere y se absorbe se metaboliza extensamente a múltiples metabolitos. No hay metabolitos importantes detectables en el plasma. Tras la incubación in vitro, uno de los metabolitos menores formados es 6ß-hidroximometasonafuroato. En los microsomas hepáticos humanos, la formación del metabolito está regulada por el citocromo P-450 3A4 (CYP3A4).
Eliminación: Después de la administración intravenosa, la vida media efectiva de eliminación plasmática del Furoato de Mometasona es de 5.8 horas. Cualquier fármaco absorbido se excreta como metabolitos principalmente a través de la bilis, y en una medida limitada, en la orina.
FARMACOLOGÍA:
Animal:
Farmacodinamia: En un cultivo celular, el furoato de mometasona mostró ser al menos diez veces más potente que otros esteroides, incluyendo el dipropionato de beclometasona (BDP), la betametasona, la hidrocortisona y la dexametasona, en la inhibición de la síntesis/liberación de IL-6 y TNFa. Furoato de mometasona (IC50 = 0.12 nM) también fue al menos seis veces más potente que el BDP y la betametasona en la inhibición de la producción de IL-5.
En un modelo preclínico, el compuesto ha demostrado que reduce la acumulación de eosinófilos marcadamente en el lugar de una reacción alérgica. Por ejemplo, en ratos alérgicos con alergia mediada por IgE, furoato de mometasona inhalado en dosis tan bajas como 13 µg/kg infiltración de eosinófilos inhibidos dentro del fluido del lavado broncoalveolar y los bronquios del pulmón y bronquiolos. De manera adicional, el furoato de mometasona redujo el número de linfocitos y los niveles de ARN mensajero para las citoquinas proalérgicas IL-4 e IL-5.
El furoato de mometasona está desprovisto de una actividad androgénica, antiandrogénica, estrogénica o antiestrogénica, pero al igual que otros glucocorticosteroides, este exhibe alguna actividad antiuterotrópica y retrasa la abertura vaginal en modelos animales en dosis orales altas de 56 mg/kg/día y 280 mg/kg/día. En general, los estudios de actividad farmacodinámica, el furoato de mometasona no mostraron actividad mineralocorticoide. El FM no ejerció efectos prominentes en el sistema nervioso central o autonómico. No se observó un efecto significativo en la presión sanguínea, la frecuencia cardiaca o los registros ECG. El furoato de mometasona no alteró la secreción de ácido gástrico, pepsina o bilis. El furoato de mometasona aumentó el volumen de orina y la secreción de potasio únicamente en dosis muy altas administrada de manera subcutánea. No se observó ningún efecto en la función respiratoria básica. Estos resultados no sugieren ningún efecto adverso particular o clase de efectos asociados con la administración de furoato de mometasona.
Farmacocinética: La administración intranasal de la suspensión de furoato de mometasona resultó en cualquiera de las dos concentraciones del fármaco en plasma muy bajas/proporcionales a las dosis/independiente del género o no cuantificables. Se observaron resultados similares para la radioactividad total al momento de las dosis intranasales con el fármaco radiomarcado.
En comparación con el ABC después de la IV dosis, la biodisponibilidad absoluta del FM después de la administración intranasal fue menos que 1% en ratas y en perros y después de la administración de PO (suspensión) fue de 1.4% en ratas y 1.7% en ratones. En perros, las concentraciones del fármaco en el plasma fueron generalmente no cuantificables después de la administración de PO de la suspensión de FM. La farmacocinética del furoato de mometasona en el ratón, la rata y especialmente el perro, fue muy comparable con aquella obtenida en humanos.
Humano:
Farmacología: El furoato de mometasona inhibe de manera significativa la liberación de leucotrienos de pacientes alérgicos. Además, es un inhibidor de la producción de citoquinas Th2, IL-4 e IL-5, de las células humanas CD4+ T.
En dos estudios clínicos que utilizan la exposición al antígeno, la suspensión (spray nasal) de Furoato de Mometasona ha mostrado una actividad antiinflamatoria en ambas respuestas alérgicas de la fase tardía y temprana. Esto ha sido demostrado por las disminuciones (contra el placebo) en la histamina y en la actividad eosinófilica y en las reducciones (contra la línea de base)
en los eosinófilos, neutrófilos y en las proteínas de adhesión a la célula epitelial. La significancia clínica de estos hallazgos no es conocida.
En pacientes con rinitis alérgica temporal, la suspensión (spray nasal) de Furoato de Mometasona monohidratado demostró un inicio de la acción clínicamente significativo dentro de 12 horas de la primera dosis.
En niños, los resultados de las muestras de plasma ensayadas para la suspensión (spray nasal) de Furoato de Mometasona monohidratado de un estudio clínico (Fase III) y dos estudios Fase I de dosis múltiple confirmaron la ausencia general de las concentraciones sistémicas de plasma después de la administración intranasal de la suspensión (spray nasal) de Furoato de Mometasona monohidratado.
En pacientes con rinosinusitis aguda, donde están presentes los signos o los síntomas de infección bacteriana, la suspensión (spray nasal) de Furoato de Mometasona monohidratado, como tratamiento complementario a los antibióticos, produjo una disminución significativa en las puntuaciones totales de los síntomas, con respecto a los síntomas nasales (rinorrea purulenta, goteo posnasal y mala ventilación/congestión) y síntomas no nasales (dolor del seno, dolor facial/presión/sensibilidad y tos).
En pacientes con rinosinusitis aguda sin complicaciones leve-moderada, en donde no están presentes los signos y los síntomas de infección bacteriana, los ensayos clínicos demostraron la eficacia de la suspensión (spray nasal) de Furoato de Mometasona como una monoterapia efectiva. Además, no hubo actividad que sugiriera la recurrencia del aumento de la rinosinusitis o la predisposición a infecciones bacterianas después de la interrupción de la suspensión (spray nasal) de Furoato de Mometasona.
En niños, los resultados de las muestras de plasma ensayadas para el inhalador nasal acuoso monohidratado de Furoato de Mometasona de un estudio clínico (Fase III) y dos estudios Fase I de dosis múltiple confirmaron la ausencia general de las concentraciones sistémicas de plasma después de la administración intranasal de la suspensión (spray nasal) de Furoato de Mometasona.
Farmacocinética: El furoato de mometasona, administrado como un inhalador nasal acuoso, tiene una biodisponibilidad sistémica de <1% en plasma, utilizando un ensayo sensible con un límite de cuantificación inferior (LLOQ) de 0.25 pg / mL. La suspensión de furoato de mometasona se absorbe muy poco en el tracto gastrointestinal, y la pequeña cantidad que se puede absorber experimenta un metabolismo hepático de primer paso extenso antes de la excreción en la orina y la bilis.
CONTRAINDICACIONES: Pacientes que son hipersensibles a este medicamento o a cualquier ingrediente en la formulación o componente del envase.
DIMUXON® se debe utilizar con precaución, en todo caso, en pacientes con infecciones tuberculosas activas o inactivas del tracto respiratorio, o en infecciones virales, bacterianas, sistémicas no tratadas o herpes simple ocular.
EMBARAZO Y LACTANCIA:
Embarazo y Madres en Periodo de Lactancia: No existen estudios adecuados o bien controlados en mujeres embarazadas o en periodo de lactancia.
Como con otras preparaciones de corti costeroides nasales, la suspensión (Spray nasal) de Furoato de Mometasona debe utilizarse en mujeres embarazadas, madres lactantes o mujeres en edad reproductiva únicamente si el beneficio potencial justifica el riesgo potencial para la madre, el feto o el infante. Los infantes nacidos de madres que recibieron corticosteroides durante el embarazo deben ser observados cuidadosamente para el hipoadrenalismo.
Pediatría: La suspensión (Spray nasal) de Furoato de Mometasona monohidratado permitió el crecimiento normal en un ensayo clínico controlado con placebo en el que a los pacientes pediátricos se les administró la suspensión (Spray nasal) de Furoato de Mometasona monohidratado de 100 μg diarios durante un año.
No se ha estudiado la seguridad y eficacia de la suspensión (spray nasal) de Furoato de Mometasona monohidratado como tratamiento adyuvante de los antibióticos en los episodios agudos de rinosinusitis en niños menores de 12 años.
No se ha estudiado la seguridad y eficacia de la suspensión (spray nasal) de Furoato de Mometasona monohidratado para el tratamiento de los síntomas asociados con la rinosinusitis aguda no complicada de leve a moderada en niños menores de 12 años.
No se ha estudiado la seguridad y eficacia de la suspensión (spray nasal) de Furoato de Mometasona monohidratado para el tratamiento de pólipos nasales en niños y adolescentes menores de 18 años.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y MANEJAR MAQUINARIA:No se conocen.
REACCIONES ADVERSAS: Raras veces, se pueden presentar reacciones de hipersensibilidad inmediata (por ej. broncoespasmos, disnea) después de la administración intranasal del furoato de mometasona monohidratado. En muy pocas ocasiones se han reportado la anafilaxis y el angioedema.
En muy pocas ocasiones se han reportado trastornos del gusto y del olfato.
Ensayo clínico de reacciones adversas al medicamento: Debido a que los ensayos clínicos se realizan en condiciones muy específicas, las tasas de reacciones adversas observadas en los ensayos clínicos pueden no reflejar las tasas observadas en la práctica y no deben compararse con las tasas en los ensayos clínicos de otro medicamento. La información adversa sobre la reacción al medicamento de los ensayos clínicos es útil para identificar los eventos adversos relacionados con el fármaco y para aproximar las tasas.
Rinitis alérgica:
Adultos y adolescentes ≥12 años de edad: La Tabla 1 demuestra la incidencia de reacciones adversas relacionadas con el tratamiento asociadas con la suspensión (spray nasal) de Furoato de Mometasona monohidratado en base a los datos combinados de los ensayos clínicos.
|
Tabla 1: Reacciones adversas relacionadas con el tratamiento que tienen una incidencia de ≥1% y más comúnmente que el placebo |
||
|
Reacciones Adversas |
Inhalador nasal acuoso de Furoato de Mometasona Monohidratado* n = 3210 - n (%) |
Placebo n = 1671 n (%) |
|
Dolor de cabeza |
265 (8) |
101 (6) |
|
Epistaxis |
267 (8) |
89 (5) |
|
Faringitis |
124 (4) |
58 (3) |
|
* 50 μg a 800 μg de furoato de mometasona al día |
||
Los eventos adversos locales reportados relacionados con el tratamiento en estudios clínicos, dolor de cabeza, epistaxis (por ejemplo, hemorragia franca, moco teñido de sangre y manchas de sangre), faringitis y ulceración nasal se observan típicamente con el uso de un inhalador nasal con corticosteroides. Además, los siguientes eventos adversos ocurrieron a una frecuencia igual o menor que el placebo, quema nasal (2% vs. 3%) e irritación nasal (2% vs. 2%), respectivamente.
La epistaxis fue generalmente autolimitante y leve en severidad y se presentó en una incidencia más alta en comparación con el placebo (5%), pero en una incidencia comparable o más baja en comparación con los corticosteroides nasales activos de control estudiados (hasta 15%). La incidencia de todos los otros efectos fue comparable con la del placebo.
Pacientes pediátricos de 3 a 11 años de edad: En la población pediátrica, la incidencia de efectos adversos, p. ej. dolor de cabeza (3%), epistaxis (6%), irritación nasal (2%) y estornudos (2%) fue comparable al placebo.
Rinosinusitis aguda como tratamiento adyuvante a los antibióticos: En los pacientes adultos y adolescentes que reciben la suspensión (spray nasal) de Furoato de Mometasona monohidratado como tratamiento adyuvante para los episodios agudos de rinosinusitis, eventos adversos relacionados con el tratamiento, los cuales se presentan en una incidencia comparable con el placebo, incluyendo dolor de cabeza (2%), faringitis (1%), ardor nasal (1%) e irritación nasal (1%). La epistaxis fue leve en severidad y también se presentó en una incidencia comparable al placebo (5% vs. 4%, respectivamente).
Rinosinusitis aguda sin complicaciones leve a moderada: En pacientes tratados para la rinosinusitis aguda leve a moderada, la incidencia general de los eventos adversos fue comparable con el placebo y similar a aquella observada para los pacientes con rinitis alérgica.
Pólipos nasales: En pacientes tratados por pólipos nasales, la incidencia general de eventos adversos fue comparable con el placebo y similar a aquella observada para pacientes con rinitis alérgica.
Reacciones Adversas Menos Frecuentes al Medicamento del Ensayo Clínico (<1%): Las siguientes reacciones adversas adicionales relacionadas con el tratamiento se produjeron en ensayos clínicos en pacientes que utilizaron la suspensión (spray nasal) de Furoato de Mometasona monohidratado con una incidencia de <1% y tuvieron una incidencia mayor que el placebo*:
Trastornos de la sangre y del sistema linfático: linfadenopatía
Trastornos cardíacos: palpitaciones, taquicardia
Trastornos oculares: lagrimeo, conjuntivitis, ojos secos, visión anormal
Trastornos del oído y del laberinto: dolor de oído, tinnitus
Trastornos gastrointestinales: dolor abdominal, estreñimiento, diarrea, gastritis, náuseas, trastorno de la lengua, trastorno de los dientes
Trastornos generales y condiciones del sitio de administración: boca seca, alergia agravada, dolor en el pecho, edema, edema facial, fiebre, síntomas similares a la influenza, sed, perversión del gusto
Infecciones e infestaciones: herpes labial no herpético, infección, infección bacteriana
Investigaciones: aumento de las enzimas hepáticas
Trastornos musculoesqueléticos y del tejido conjuntivo: artralgia, mialgia
Trastornos del sistema nervioso: temblor, vértigo, migraña
Trastornos psiquiátricos: depresión, paranoia, somnolencia
Trastornos respiratorios, torácicos y mediastínicos: disfonía, bronquitis, disnea, laringitis, ulceración del tabique nasal, sinusitis, sibilancias
Trastornos de la piel y del tejido subcutáneo: acné, dermatitis, erupción eritematosa
Trastornos vasculares: hipertensión
* Eventos reportados por más de 1 paciente
Reacciones adversas a los medicamentos posteriores a la comercialización: Las siguientes reacciones adversas se han identificado durante el período posterior a la comercialización para la suspensión (spray nasal) de Furoato de Mometasona monohidratado: anafilaxia y angioedema, alteraciones en el olfato y perforación del tabique nasal. Debido a que estas reacciones se informan voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar con fiabilidad su frecuencia o establecer una relación causal con la exposición al fármaco.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
Interacción fármaco-fármaco: La suspensión (spray nasal) de Furoato de Mometasona ha sido administrada de manera concomitante con loratadina sin un efecto aparente en las concentraciones plasmáticas de loratadina o su metabolito principal. En estos estudios, las concentraciones plasmáticas de Furoato de Mometasona no fueron detectables usando un ensayo con un LLOQ de 50 pg/mL. La terapia de combinación fue bien tolerada.
Inhibidores del citocromo P450 3A4: Los estudios han demostrado que el Furoato de Mometasona se metaboliza principal y extensamente en el hígado de todas las especies investigadas y se metaboliza extensamente a múltiples metabolitos. Los estudios in vitro han confirmado el papel principal del citocromo CYP 3A4 en el metabolismo de este compuesto.
La administración concomitante con ketoconazol, un potente inhibidor de CYP 3A4, puede aumentar las concentraciones plasmáticas de Furoato de Mometasona.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO GENERAL: Durante la transferencia del corticosteroide sistémico al inhalador nasal acuoso de furoato de mometasona, algunos pacientes pueden experimentar síntomas de abstinencia de corticosteroides sistémicamente activos (p. Ej., Dolor articular y/o muscular, lasitud y depresión inicialmente) a pesar del alivio de los síntomas nasales y requerirán estímulo para continuar con la terapia de inhalación nasal acuoso de furoato de mometasona. Tal transferencia también puede desenmascarar afecciones alérgicas preexistentes como la conjuntivitis alérgica y el eccema, previamente suprimidas por la terapia sistémica con corticosteroides.
Rinosinusitis aguda: Los pacientes no deben utilizar la suspensión (spray nasal) de Furoato de Mometasona sin un antibiótico si está presente una infección bacteriana de los senos o se sospecha de una.
La suspensión (spray nasal) de Furoato de Mometasona no está indicado para tratar los síntomas del resfriado común. Para distinguir la rinosinusitis aguda de leve a moderada del resfriado común, los pacientes deben presentar síntomas de rinosinusitis aguda que persisten o aumentan durante al menos siete días antes de comenzar el tratamiento con el inhalador nasal de Furoato de Mometasona.
Si se observan signos o síntomas de infección bacteriana severa durante el tratamiento (como fiebre, dolor facial/dental unilateral severo persistente, hinchazón orbital o facial peri-orbital o empeoramiento de los síntomas después de una mejoría inicial), se le debe recomendar al paciente que consulte su médico inmediatamente, momento en el cual el médico puede aconsejar al paciente que deje de usar la suspensión (spray nasal) de Furoato de Mometasona.
No se ha evaluado la seguridad y eficacia de la suspensión (spray nasal) de Furoato de Mometasona monohidratado en el tratamiento de los síntomas asociados con la rinosinusitis aguda no complicada leve a moderada más allá de los 15 días.
Oído/Nariz/Garganta: La suspensión (Spray nasal) de Furoato de Mometasona no debe usarse en presencia de infección localizada no tratada que afecte a la mucosa nasal.
Debido al efecto inhibidor de los corticosteroides sobre la cicatrización de heridas, los pacientes que han experimentado una cirugía o traumatismo nasal reciente no deben usar un corticosteroide nasal hasta que se haya producido la cicatrización.
Después de 12 meses de tratamiento con suspensión (Spray nasal) de Furoato de Mometasona monohidratado, no hubo evidencia de atrofia de la mucosa nasal; también, el Furoato de Mometasona tendía a invertir la mucosa nasal más cerca de un fenotipo histológico normal. Al igual que con cualquier tratamiento a largo plazo, los pacientes que usan inhalador nasal acuoso de Furoato de Mometasona durante varios meses o más deben examinarse periódicamente para detectar posibles cambios en la mucosa nasal. Si se desarrolla una infección fúngica localizada de la nariz o la faringe, puede ser necesaria la interrupción de la terapia acuosa de pulverización nasal con Furoato de Mometasona o un tratamiento apropiado. La persistencia de irritación nasofaríngea puede ser una indicación para suspender la suspensión (Spray nasal) de Furoato de Mometasona.
Tras el uso de corticosteroides en aerosol intranasales, se han notificado muy raramente casos de perforación del tabique nasal.
Endocrino y metabolismo: No hay evidencia de supresión del eje hipotalámico-pituitario-adrenal (HPA) después de un tratamiento prolongado (12 meses) con la suspensión (Spray nasal) de Furoato de Mometasona monohidratado. Sin embargo, los pacientes que son transferidos de la administración a largo plazo de corticosteroides sistémicamente activos a la suspensión (spray nasal) de Furoato de Mometasona requieren atención cuidadosa. La retirada sistémica de corticosteroides en tales pacientes puede provocar insuficiencia suprarrenal durante varios meses hasta la recuperación del funcionamiento del eje HPA. Si estos pacientes presentan signos y síntomas de insuficiencia suprarrenal, se debe reanudar la administración sistémica de corticosteroides y se deben instituir otros modos de terapia y medidas apropiadas.
Inmune: Los pacientes que reciben corticosteroides potencialmente inmunodeprimidos deben ser advertidos del riesgo de exposición a ciertas infecciones (p. Ej., Varicela, sarampión) y de la importancia de obtener asesoramiento médico si se produce dicha exposición.
Oftalmológico: Tras el uso de corticosteroides en inhalador intranasal, se han notificado muy raramente casos de aumento de la presión intraocular.
Poblaciones especiales:
Embarazo y madres en periodo de lactancia: No existen estudios adecuados o bien controlados en mujeres embarazadas o en periodo de lactancia.
Como con otras preparaciones de corticosteroides nasales, la suspensión (spray nasal) de Furoato de Mometasona debe utilizarse en mujeres embarazadas, madres lactantes o mujeres en edad reproductiva únicamente si el beneficio potencial justifica el riesgo potencial para la madre, el feto o el infante. Los infantes nacidos de madres que recibieron corticosteroides durante el embarazo deben ser observados cuidadosamente para el hipoadrenalismo.
Pediatría: La suspensión (spray nasal) de Furoato de Mometasona monohidratado permitió el crecimiento normal en un ensayo clínico controlado con placebo en el que a los pacientes pediátricos se les administró la suspensión (Spray nasal) de Furoato de Mometasona monohidratado de 100 μg diarios durante un año.
No se ha estudiado la seguridad y eficacia de la suspensión (spray nasal) de Furoato de Mometasona monohidratado como tratamiento adyuvante de los antibióticos en los episodios agudos de rinosinusitis en niños menores de 12 años.
No se ha estudiado la seguridad y eficacia de la suspensión (spray nasal) de Furoato de Mometasona monohidratado para el tratamiento de los síntomas asociados con la rinosinusitis aguda no complicada de leve a moderada en niños menores de 12 años.
No se ha estudiado la seguridad y eficacia de la suspensión (spray nasal) de Furoato de Mometasona monohidratado para el tratamiento de pólipos nasales en niños y adolescentes menores de 18 años.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
Consideraciones de dosificación: Los efectos terapéuticos de los corticosteroides, a diferencia de aquellos descongestionantes, no son inmediatos. Ya que el efecto de la suspensión (spray nasal) de Furoato de Mometasona depende de su uso regular, los pacientes deben ser instruidos para que tomen la suspensión (spray nasal) en intervalos regulares y no, como con otros inhaladores nasales, como ellos lo sientan necesario.
En presencia de secreción excesiva de la mucosa nasal o edema de la mucosa nasal, el fármaco puede fallar en alcanzar el lugar de acción. En dichos casos, es aconsejable utilizar un vasoconstrictor nasal durante 2 a 3 días antes de iniciar el tratamiento con la suspensión (spray nasal) de Furoato de Mometasona.
Tratamiento de la rinitis alérgica estacional o perenne:
Adultos (incluyendo pacientes geriátricos) y niños de 12 años de edad o mayores: La dosis usual recomendada es de dos dosis (50 µg/aplicación) en cada fosa nasal una vez al día (dosis total diaria de 200 µg). Una vez que los síntomas estén controlados, la reducción de una dosis en cada fosa nasal (dosis diaria total de 100 µg) podría ser efectiva para el mantenimiento.
Si los síntomas son inadecuadamente controlados, la dosis podría aumentar a cuatro dosis en cada fosa nasal (dosis diaria total de 400 µg). Se recomienda la reducción de la dosis después de controlar los síntomas.
El inicio de acción clínicamente significativo ocurre tan pronto como 12 horas después de la primera dosis.
Niños entre las edades de 3 a 11 años: La dosis usual recomendada es de un dosis (50 µg/ aplicación) en cada fosa nasal una vez al día (dosis diaria total de 100 µg).
La administración a niños pequeños debe ser supervisada por un adulto.
Tratamiento adyuvante a los antibióticos en episodios agudos de rinosinusitis: La suspensión (spray nasal) de Furoato de Mometasona no debe ser utilizado en presencia de una infección localizada no tratada que involucre a la mucosa nasal.
Adultos (incluyendo a los pacientes geriátricos) y niños de 12 años de edad y mayores: La dosis usual recomendada es de dos dosis (50 µg/aplicación) en cada fosa nasal dos veces al día (dosis total diaria de 400 µg).
Si los síntomas son controlados de manera inadecuada, la dosis podría aumentar a cuatro dosis 50 µg/aplicación en cada fosa nasal dos veces al día (dosis total diaria de 800 µg).
Tratamiento de la rinosinusitis aguda sin complicaciones de leve a moderada: Los pacientes no deben utilizar la suspensión (spray nasal) de Furoato de Mometasona sin un antibiótico si la infección bacteriana de los senos está presente o se sospecha.
Adultos (incluyendo a los pacientes geriátricos) y niños de 12 años de edad y mayores: La dosis usual recomendada es de dos dosis 50 µg/aplicación en cada fosa nasal dos veces al día (dosis total diaria de 400 µg).
Si se observan signos o síntomas de infección bacteriana severa durante el tratamiento (tales como fiebre, dolor facial/dental unilateral severo persistente, hinchazón facial orbital o peri orbital o deterioro de los síntomas después de una mejora inicial), se le debe aconsejar al paciente que consulte a su médico inmediatamente momento en el cual el médico debe aconsejarle al paciente suspender el uso de la suspensión (spray nasal) de Furoato de Mometasona.
No se han evaluado la seguridad y la eficacia de la suspensión (spray nasal) de Furoato de Mometasona en el tratamiento de síntomas asociados con la rinosinusitis aguda de leve a moderada sin complicaciones más allá de 15 días.
Tratamiento de Pólipos Nasales:
Adultos (incluyendo a los pacientes geriátricos) y adolescentes de 18 años de edad y mayores: La dosis usual recomendada es de dos dosis 50 µg/aplicación en cada fosa nasal dos veces al día (dosis total diaria de 400 µg).
Una vez que los síntomas estén controlados, la reducción de la dosis a dos dosis 50 µg/aplicación en cada fosa nasal una vez al día (dosis diaria total de 200 µg) podría ser efectiva para el tratamiento continuo.
Los estudios de eficacia y seguridad de la suspensión (spray nasal) de Furoato de Mometasona para el tratamiento de pólipos nasales fueron de cuatro meses de duración.
Administración: Cada dosis proporciona aproximadamente 100 mg de suspensión de Furoato de Mometasona, que contiene 50 μg de Furoato de Mometasona. Antes de la administración, la dosis nasal de la suspensión (spray nasal) de Furoato de Mometasona debe cebarse accionando la bomba 10 veces (hasta que se observe una pulverización uniforme). Si la bomba de pulverización no se ha utilizado durante 14 días o más, se debe volver a aplicar con 2 actuaciones, hasta que se observe una pulverización uniforme, antes del próximo uso.
SOBREDOSIFICACIÓN: Debido a que la biodisponibilidad sistémica es <1% (utilizando un ensayo sensible con un límite de cuantificación menor de 0.25 pg/mL) después de la administración de Furoato de Mometasona a través de la suspensión (spray nasal) de Furoato de Mometasona monohidratado, es poco probable que la sobredosis requiera otra terapia que no sea la observación, seguida de la dosificación prescrita apropiada.
TOXICOLOGÍA: En una serie de estudios designados para maximizar la exposición al furoato de mometasona, no hubo un hallazgo único o especial con respecto a la vía de administración o la formulación. En estudios de toxicología de dosis única y múltiple y en estudios de toxicidad reproductiva, todos los
hallazgos fueron efectos típicos de la clase de glucocorticoide y obedecieron las bien establecidas relaciones dosis-respuesta y dosis-duración para los efectos farmacológicos sistémicos de los glucocorticoides. La dificultad y el parto prolongado observados en el Segmento I y el Segmento III de los estudios de reproducción podrían estar relacionados con el efecto progestacional del furoato de mometasona. Las reducciones en el aumento de peso materno, el peso del feto y la viabilidad de las crías y la incidencia de malformaciones típicas y de variaciones óseas (osificación reducida) fueron efectos de clase glucocorticoide.
Con base en los resultados de estudios de mutagenicidad múltiple y dos estudios de carcinogenicidad, cada uno en ratones y ratas, el furoato de mometasona no debería plantear un peligro genético o aumentar el riesgo de cáncer a pacientes expuestos en un entorno clínico. En particular, no hubo una relación dosis-respuesta estadísticamente significativa para ningún tipo de tumor ya sea en el estudio de carcinogenicidad de ratón o rata. En el estudio con ratones, se consideró que un aumento aparente en los tumores mesenquimales de la vejiga y de la vesícula seminal no tiene relevancia para evaluar el riesgo humano debido a que es un hallazgo específico de la especie y la raza sin una correlación humana. Un incremento aparente en la incidencia de hiperplasia celular pancreática en los grupos de dosis media y alta (1.0 y 2.0 µg/L, respectivamente) y neoplasia de células insulares en el grupo de dosis alta de las ratas macho se atribuyó a los efectos metabólicos bien establecidos de la administración prolongada de glucocorticoides (aumento en la glucosa y/o resistencia a la insulina). Los aumentos en la incidencia de tumores de células insulares son inducidos por otros esteroides y reflejan un mecanismo no genotóxico en una especie con una sensibilidad endocrinológica única.
Toxicidad Aguda: Se llevaron a cabo dos estudios de toxicidad aguda por inhalación en ratones (es decir, 4-hr exposición de todo el cuerpo a polvo de furoato de mometasona puro). En el primer estudio, las dosis medias estimadas fueron 582 mg/kg (en ratones) y 394 mg/kg (para las ratas), asumiendo una deposición del 100%. No se observaron signos clínicos en cualquiera de las especies durante el periodo de observación después de la exposición de 36-día. Sin embargo, se observaron pesos corporales más bajos en comparación con los valores antes del tratamiento en ambas especies. En el segundo estudio, las ratas fueron expuestas a la exposición de cuerpo entero a 0.68 mg/L de polvo micronizado de furoato de mometasona durante 4 horas y luego se observaron durante 3 semanas. Se presentó una pérdida de peso durante el periodo de observación; mientras que las observaciones clínicas principales fueron estertores, manchado ano-genital, heces blandas y emaciación. En la necropsia, varias ratas tenían pulmones decolorados, bazos pequeños y piel marrón decolorada.
Toxicidad de Dosis Múltiple: Se evaluó la potencial irritación intranasal de las suspensiones nasales acuosas de furoato de mometasona en perros Beagle a los que se les administraron dosis diarias de hasta 4.0 mg/perro durante tres días, una semana o un mes. Las suspensiones nasales acuosas no indujeron irritación en la mucosa nasal y no se observaron cambios relacionados con el compuesto después de un mes de administración.
La suspensión nasal acuosa de furoato de mometasona fue bien tolerada en los estudios de toxicidad conducidos en ratas y perros durante 6 meses. Las ratas recibieron dosis de hasta 0.600 mg/kg (0.18 mg/día; 70 veces las referencias propuestas para la dosis humana); los perros recibieron dosis de hasta 0.15 mg/kg (2.0 mg/día; 35 veces la dosis humana propuesta). Las ratas tratadas con 0.6 mg/kg experimentaron pérdida de cabello en la espalda durante las últimas 5 semanas, lo cual se correlacionó con la hipotricosis. La dosis sin efecto para los efectos farmacológicos en ratas fue de 0.050 mg/kg con base en bajos aumentos de peso corporal en dosis más altas.
Los perros tratados con 0.15 mg/kg demostraron recuentos de eosinófilos, los cuales fueron más bajos que antes de la prueba y los controles concurrentes después de 4, 13 y 26 semanas. Además, la respuesta ACTH en los grupos de dosis 0.045 y 0.15 mg/kg fue más bajo que el control. Estas diferencias estuvieron relacionadas con las dosis y se atribuyeron al furoato de mometasona. No estuvo presente la evidencia de irritación nasal en ninguna dosis ya sea en el estudio con ratas o perros.
No se identificaron órganos objetivos de toxicidad sistémica en cualquiera de los estudios.
La suspensión (spray nasal) de Furoato de Mometasona fue bien tolerado cuando se administró intranasalmente a perros durante un año en dosis de hasta 2.0 mg/día. En el grupo de dosis de 2.0 mg/día se observaron un aumento en la incidencia de alopecia, disminuciones mínimas en los linfocitos y en los eosinófilos, disminuciones en la respuesta basal y cortisol post-ACTH, pesos de la glándula adrenal más bajos, glándulas adrenales pequeñas o atrofiadas, atrofia epidérmica, atrofia linfoide esplénica mínima, atenuación epitelial focal mínima en los cornetes nasales y moco luminal retenido. Los perros tratados con ≥ 0.2 mg/día demostraron un incremento relacionado con la dosis en agregados linfoides más pequeños o ausentes. Con excepción de un moco luminal retenido mínimamente aumentado en el grupo de dosis de 2.0 mg/día, no hubo evidencia de irritación o inflamación en los cornetes nasales de los perros tratados con furoato de mometasona. Por lo tanto, los cambios en los agregados linfoides fueron considerados una respuesta corticosteroide localizada asociada con la aplicación y no se consideraron de importancia toxicológica.
Mutagenicidad: El furoato de mometasona no fue mutagénico en el ensayo de linfoma de ratón y el bioensayo de mutagenicidad microsomica de salmonella/mamífero. El furoato de mometasona fue negativo en el ensayo de micronúcleos de eritrocitos de la médula ósea de ratón, el ensayo de clastogenicidad en la médula ósea de la rata, el ensayo UDS en los hepatocitos de la rata y el ensayo de clastogenicidad de células germinales masculinas mitóticas y el ensayo de aberraciones cromosómicas celulares del pulmón del hámster chino. En dosis citotóxicas en los cultivos celulares del ovario del hámster chino, el furoato de mometasona indujo un incremento relacionado con la dosis en las aberraciones cromosómicas simples cuando se expusieron continuamente (7.5 horas) en la fase de no activación, pero no en presencia de la fracción S9 del hígado de la rata. Este hallazgo no es considerado de importancia en la evaluación del riesgo del furoato de mometasona, ya que la fase S9 del ensayo de la aberración cromosómica y todos los ensayos in vivo fueron negativos.
Carcinogenicidad: El potencial de carcinogenicidad del furoato de mometasona inhalado (aerosol con propulsor CFC y surfactante) en concentraciones de 0.25 a 2.0 µg/L se investigó en estudios de 24 meses en ratones y en ratas. Se observaron efectos típicos relacionados con el glucocorticoide, incluyendo
varias lesiones no neoplásticas. No se detectó ninguna relación dosis-respuesta estadísticamente significativa para ninguno de los tipos de tumores. Se considera que el aumento aparente en los tumores mesenquimales de la vejiga/vesícula seminal no tiene relevancia en la evaluación del riesgo carcinogénico en humanos ya que este es un hallazgo específico de la especie y de la raza sin una correlación humana. La mayor incidencia de hiperplasia de la célula de los islotes pancreáticos en ratas macho que recibieron 1.0 y 2.0 µg/L es atribuida a los efectos metabólicos bien establecidos (aumento en la glucosa y/o resistencia a la insulina) después de la administración prolongada de glucocorticoides.
Los incrementos en los tumores celulares de los islotes pancreáticos, los cuales son inducidos por otros esteroides, reflejan un mecanismo operativo no genotóxico en especies sensibles endocrinológicamente únicas.
Toxicología Reproductiva: En el Segmento subcutáneo I y III estudios, el furoato de mometasona fue bien tolerado en dosis de hasta 7.5 µg/kg (2.6 veces la dosis humana por inhalación). En 15 µg/kg, la gestación prolongada y la labor prolongada y difícil se presentaron con una reducción en la supervivencia de las crías y el aumento de peso corporal o aumento de peso corporal. No hubo efecto en la fertilidad. Al igual que otros glucocorticoides, el furoato de mometasona es un teratógeno en roedores y en conejos. Los estudios teratológicos fueron llevados a cabo en ratas, ratones y conejos por la vía oral, tópica (dérmica) y/o subcutánea. Se produjo una hernia umbilical en ratas a las que se les administraron ≥ 600 µg/kg dérmicamente, paladar hendido en ratones a los que se les administraron 180 µg/kg subcutáneamente y agenesia de la vesícula biliar, hernia umbilical y patas delanteras flexionadas en conejos a los que se les administraron ≥ 150 µg/kg dérmicamente. En estos estudios de teratogenicidad, también hubo reducciones en el aumento de peso corporal materno, efectos en el crecimiento fetal (peso corporal fetal más bajo y/u osificación retrasada) en ratas, conejos y ratones y supervivencia reducida de las crías en ratones.
DATOS FARMACEUTICOS:
Lista de excipientes: Furoato de Mometasona USP/EP (Micronizado)* Solución de Cloruro de Benzalconio NF/EP (50% p/v) Ácido Cítrico USP (Monohidratado)
Glicerina USP/ Glicerol EP Celulosa Microcristalina y CMC NF
Polisorbato 80 NF/EP/BP (Tween 80)
Incompatibilidades, por favor anexarlo junto con las Interacciones medicamentosas
Ver apartado de Interacciones
DENOMINACIÓN COMÚN INTERNACIONAL: Mometasona.
FECHA DE REVISION DE TEXTO Y VERSION DEL DOCUMENTO: Enero 2018.
DATOS CLINICOS:
Indicaciones terapéuticas: DIMUXON® Suspensión (Spray nasal) es indicada para:
• Uso en adultos, adolescentes y niños entre las edades de 3 y 11 años para tratar los síntomas de la rinitis alérgica estacional o perene.
• Uso en adultos y niños de 12 años de edad y mayores como tratamiento coadyuvante a los antibióticos en episodios agudos de rinosinusitis, en la están presentes los signos o los síntomas de infección bacteriana.
• Uso en adultos y niños de 12 años de edad y mayores en el tratamiento de los síntomas asociados con la rinosinusitis aguda moderada sin complicaciones en la que no están presentes los signos o los síntomas de infección bacteriana.
El tratamiento de pólipos nasales en pacientes adultos de 18 años de edad o mayores
DATOS CLÍNICOS DE SEGURIDAD: Se llevó a cabo un estudio clínico de eficacia entre Agosto y Noviembre de 2005 para demostrar la bioequivalencia. El estudio constó de un estudio clínico aleatorio doble ciego, multicéntrico, controlado con placebo, de grupo paralelo. De los 559 sujetos (hombres y mujeres) que completaron el periodo de preinclusión (Periodo 1) y fueron asignados aleatoriamente a uno de los tres tratamientos (Periodo 2), 506 sujetos reunieron los criterios para el análisis de equivalencia clínica y 555 sujetos fueron elegibles para el análisis de eficacia clínica. En este estudio no se determinaron los perfiles de concentración/ tiempo del fármaco y los parámetros farmacocinéticos.
La eficacia primaria y las medidas de equivalencia se basaron en el promedio de la TNSS Reflexiva de rinorrea en la mañana y en la tarde, congestión nasal, comezón nasal y estornudos.
El criterio de valoración fue el cambio en la TNSS Reflexiva desde el inicio al promedio de los datos de 14 días de tratamiento.
|
Mediciones |
Estadísticas1 |
Furoato de Mometasona (50 μg/dosis; 2 dosis por fosa nasal diariamente) |
Evaluación de Equivalencia2 |
|||
|
Prueba# |
Referencia† |
Placebo |
Proporción (Prueba/Ref) |
90% |
||
|
N |
(N=222) |
(N=221) |
(N=112) |
|||
|
rTNSS |
Media + SD |
-2.3* + 2.2 |
-2.3* + 2.4 |
-1.6 + 2.4 |
101 |
89 - 105 |
|
iTNSS |
Media + SD |
-2.1* + 2.1 |
-2.0* + 2.3 |
-1.6 + 2.4 |
104 |
87 - 121 |
|
# DIMUXON® (furoato de mometasona) 50 μg suspensión acuosa, spray nasal (Apotex Inc.) †Nasonex® Nasal Spray (furoato de mometasona), 50 μg (Schering Corporation) fue adquirido en E.U.A. 1 Con base en la población con intención de tratarse 2 Con base en los datos log-transformados de la población Por-Protocolo * Significativamente diferente del placebo (p<0.001) |
||||||
Se llevó a cabo un estudio aleatorio, de dosis única, de 2 vías, cruzado de biodisponibilidad comparativa, conducido bajo condiciones de ayuno, en voluntarios sanos hombres y mujeres.
Se midieron y compararon la velocidad y el grado de absorción del Furoato de Mometasona después de una dosis de 200 µg (total de 4 dosis de 50 µg, administrados como 2 dosis en cada fosa nasal) de DIMUXON® (furoato de mometasona) 50µg/aplicación medida del inhalador nasal acuoso (Apotex Inc.) y Nasonex® Nasal Spray (furoato de mometasona), 50 μg (Schering Corporation en 94 voluntarios. Los resultados de los datos medidos para 90 voluntarios están resumidos en la tabla siguiente:
|
Tabla de Resumen de los Datos de Biodisponibilidad Comparativos del Furoato de Mometasona |
||||
|
Parámetro |
Prueba# |
Referencia† |
Proporción de las Medias Geométricas (%) |
90% Intervalo de Confianza (%) |
|
AUCt |
32.14 |
34.66 |
92.7 |
85.4 – 100.6 |
|
(pg• h/mL) |
37.31 (67) |
40.86 (63) |
||
|
AUCinf |
50.66 |
52.77 |
96.0 |
84.8 – 108.6 |
|
(pg• h/mL) |
59.86 (66) |
69.98 (61) |
||
|
Cmáx |
6.76 |
6.58 |
102.7 |
95.8 – 110.2 |
|
(pg/mL) |
7.54 (57) |
7.57 (64) |
||
|
Tmáx§ (h) |
1.41 (39) |
1.54 (48) |
||
|
Tmedio§ (h) |
9.44 (72) |
9.63 (56) |
||
|
# Dimuxon®(furoato de mometasona) 50 μg/dosis medida del inhalador nasal acuoso (Apotex Inc.) |
||||
|
†Nasonex® Nasal Spray (furoato de mometasona), 50 μg (Schering Corporation) fue adquirido en E.U.A. |
||||
|
§ Expresado como medias aritméticas (CV%) únicamente. |
||||
Tratamiento de la rinosinusitis aguda no complicada de leve a moderada: En dos ensayos clínicos con 1954 pacientes de 12 años o más con rinosinusitis aguda no complicada de leve a moderada, el inhalador nasal de furoato de mometasona monohidratado de 200 μg dos veces al día fue eficaz para mejorar significativamente los síntomas de rinosinusitis aguda en comparación con placebo según lo evaluado por la puntuación de síntomas principal (MSS), por sus siglas en inglés, compuesto de síntomas (dolor facial/presión/sensibilidad, dolor de cabeza sinusal, rinorrea, goteo nasal posterior y congestión/congestión nasal) durante el período de tratamiento de 15 días (P02683 p <0.001; P02692 p = 0.038).
Un brazo de amoxicilina de 500 mg tres veces al día no fue significativamente diferente del placebo en la reducción de los síntomas de la rinosinusitis aguda no complicada de leve a moderada evaluada por el MSS (ver Tabla 2). El médico tratante consideró que menos sujetos tratados con la suspensión (spray nasal) de Furoato de Mometasona monohidratado de 200 μg dos veces al día eran fallas de tratamiento que aquellos tratados con placebo.
|
Tabla 2.Resultados Resumidos para la Puntuación del Síntoma Principal |
||||||||||||
|
MFNS 200 μg OD (A) |
MFNS 200 μg BID (B) |
Amoxicilina 500 mg TID (C) |
Placebo (D) |
|||||||||
|
N |
LS Mediaa |
N |
LS Mediaa |
N |
LS Mediaa |
N |
LS Mediaa |
|||||
|
P02683 |
||||||||||||
|
Iniciob |
243 |
8.17 |
234 |
8.28 |
251 |
8.53 |
252 |
8.36 |
||||
|
Días de la Puntuación Real 2-15 (evaluación primaria) |
240 |
4.16* |
234 |
3.80*^ |
249 |
4.40 |
247 |
4.61 |
||||
|
% Cambio desde el Inicio Días 2 a 15 |
240 |
-4.01 (-49.8%) |
233 |
-4.51 *† |
249 |
-4.13 (-49.3%) |
247 |
-3.75 (-45.6%) |
||||
|
P02692 |
||||||||||||
|
Iniciob |
229 |
7.69 |
236 |
7.70 |
233 |
7.55 |
242 |
7.72 |
||||
|
Días de la Puntuación Real 1-15c |
229 |
3.99 |
236 |
3.95* |
233 |
4.17 |
242 |
4.36 |
||||
|
% Cambio desde el Inicio Días 1 a 15c (evaluación primaria) |
229 |
-3.70 (-46.7%) |
236 |
-3.76*^ (-48.4%) |
233 |
-3.38 (-42.5%) |
242 |
-3.36 (-41.5%) |
||||
|
Comparaciones por Pares de Cambios en MSS desde la línea base e intervalo de confianza del 95% |
||||||||||||
|
A - B |
A - C |
A - D |
B - C |
B - D |
C - D |
|||||||
|
P02683 |
||||||||||||
|
Cambio a partir de la Línea Base Día 2 a 15 |
0.50 (0.10, 0.90) |
-12 (-0.28, 0.51) |
-0.26 (-0.66, 0.13) |
-0.38 (-0.78, 0.01) |
-0.76 (-1.16, -0.36) |
-0.38 (-0.76, 0.01) |
||||||
|
P02692 |
||||||||||||
|
% Cambio a partir de la Línea Base Días1 a 15c (evaluación primaria) |
0.06 (-0.32, 0.44) |
-0.32 (-0.70, 0.064) |
-0.34 (-0.72, 0.04) |
-0.38 (-0.76, -0.00) |
-0.40 (-0.78, -0.02) |
-0.02 (-0.40, 0.36) |
||||||
|
MFNS: suspensión (spray nasal) de furoato de mometasona monohidratado *P<0.05 vs. Placebo; ^P≤0.05 vs. Amoxiciclina; †P<0.05 vs. MFNS 200 µg OD. a: Se obtuvieron las medias LS a partir del modelo ANOVA con efectos para el tratamiento, lugar y duración de los síntomas (7 a 14 días o 15 a 28 días). b: En el estudio P02683, la línea de base fue una evaluación en el consultorio llevada a cabo conjuntamente por el sujeto y el médico. En el estudio P02692, la línea de base fue la media de tres evaluaciones diarias llevadas a cabo únicamente por el sujeto. c: El día 1 incluye la evaluación PM para los sujetos en P02692 únicamente. |
||||||||||||
Además, se llevó a cabo un periodo de seguimiento después del tratamiento de 14 días entre los cuatro grupos de tratamiento. Los resultados del estudio indicaron que el índice de recurrencia de la rinosinusitis fue comparable entre los grupos de tratamiento.
Tratamiento de Pólipos Nasales: En ensayos clínicos con poliposis nasal, el inhalador nasal de Furoato de Mometasona monohidratado mostró una mejoría significativa en comparación con el placebo en los criterios de valoración clínicamente relevantes de la congestión y el tamaño del pólipo nasal (ver Tabla 3).
|
Tabla 3: Efecto de la suspensión (spray nasal) de Furoato de Mometasona Monohidratado en Dos Ensayos Aleatorizados, Controlados |
|||||
|
MFNS 200 μg od |
MFNS 200 μg bid |
placebo |
Valor P para MFNS 200 μg od vs. placebo |
Valor P para MFNS 200 μg bid vs. placebo |
|
|
Estudio P01925 |
n =115 |
n = 122 |
n = 117 |
||
|
Grado de pólipo bilateral basal 1 |
4.21 |
4.27 |
4.25 |
||
|
Cambio medio desde el inicio en el grado de pólipo bilateral3 |
-1.15 |
-0.96 |
-0.50 |
<0.001 |
0.01 |
|
Congestión nasal basal2 |
2.29 |
2.35 |
2.28 |
||
|
Cambio medio desde el inicio en la congestión nasal4 |
-0.47 |
-0.61 |
-0.24 |
0.001 |
<0.001 |
|
Estudio P01926 |
n =102 |
n = 102 |
n = 106 |
||
|
Grado de pólipo bilateral basal1 |
4.00 |
4.10 |
4.17 |
||
|
Cambio medio desde el inicio en el grado de pólipo bilateral3 |
-0.78 |
-0.96 |
-0.62 |
0.33 |
0.04 |
|
Congestión nasal basal2 |
2.23 |
2.20 |
2.18 |
||
|
Cambio medio desde el inicio en la congestión nasal4 |
-0.42 |
-0.66 |
-0.23 |
0.01 |
<0.001 |
|
MFNS: suspensión (spray nasal) de furoato de mometasona monohidratado 1 el investigador calificó los pólipos en cada fosa nasal basándose en la visualización endoscópica, utilizando una escala de 0-3 donde 0 = sin pólipos; 1 = pólipos en el meato medio, que no alcanzan debajo del borde inferior del cornete medio; 2 = pólipos que alcanzan debajo del borde inferior del cornete medio pero no el borde inferior del cornete inferior; 3 = pólipos que llegan al borde del cornete inferior o por debajo, o pólipos medial al cornete medio (el puntaje refleja la suma de los grados de la fosa nasal izquierda y derecha). 2 congestión/obstrucción nasal se calificó a diario por el paciente utilizando una escala de 0-3 categórica donde 0 = sin síntomas; 1 = síntomas leves; 2 = síntomas moderados y 3 = síntomas severos. 3 a la última evaluación durante los cuatro meses completos del período de tratamiento 4 promediado durante el primer mes de tratamiento. |
|||||
PRESENTACIONES: Caja con Frasco dosificador con 140 aplicaciones.
PERIODO DE VALIDEZ: 24 meses.
Precauciones especiales de conservación.
Consérvese a temperatura ambiente a no más de 30°C
Naturaleza y contenido del envase: Caja con frasco dosificador
REFERENCIAS BIBLIOGRÁFICAS: PRODUCT MONOGRAPH, APO®-MOMETASONE, USP, HEALTH CANADA Drug Product Database, Fecha de revisión 11 de Marzo de 2013, Fecha de Consulta 24 de Enero de 2018. https://pdf.hres.ca/dpd_pm/00019609.PDF
APOTEX Inc.