
EMEND
APREPITANT
Cápsulas
1 Caja, 1 Cápsulas, 125 Miligramos
1 Caja, 2 Cápsulas, 80 Miligramos
COMPOSICIÓN:
Ingredientes activos: Cada CÁPSULA de EMEND® para administración oral contiene 80 mg o 125 mg de aprepitant.
Ingredientes inactivos: Cada CÁPSULA de EMEND® contiene los siguientes ingredientes inactivos: Sucrosa, celulosa microcristalina, hidroxipropil celulosa y laurilsultato de sodio. Los excipientes de la cubierta de la cápsula son: Gelatina y dióxido de titanio y también contiene laurilsulfato de sodio y dióxido de silicona. La cubierta de la cápsula de 125 mg también contiene óxido de hierro rojo y óxido de hierro amarillo.
FARMACODINAMIA: Fosaprepitant, un profármaco de aprepitant, cuando se administró por vía intravenosa se convirtió rápidamente en aprepitant.
Electrofisiología Cardiaca: En un estudio a fondo, aleatorizado, doble ciego, controlado positivo de QTc, una sola dosis de 200 mg de fosaprepitant no tuvo ningún efecto sobre el intervalo de QTc.
Ocupación del receptor cerebral NK1 evaluado por tomografía de emisión de positrones: Un estudio con tomografía de emisión de positrones en hombres jóvenes sanos administró una dosis sola de 165 mg de aprepitant o una sola dosis intravenosa de 150 mg de fosaprepitant, demostró una ocupación similar del receptor NK1 cerebral a Tmáx, (igual o mayor al 99%), 24 horas (igual o mayor al 99%), 48 horas (igual o mayor al 97%), y 120 horas (37 a 76%) posterior a la dosis. La ocupación de los receptores cerebrales NK1 por aprepitant correlaciona bien con las concentraciones plasmáticas de aprepitant.
EMEND® está indicado, en combinación con otros agentes antieméticos, para la prevención de la náusea y el vómito agudos y tardíos asociados con los ciclos iniciales y recurrentes de:
— Quimioterapia antineoplásica altamente emetogénica (ver Dosis y administración).
— Quimioterapia antineoplásica moderadamente emetogénica (ver Dosis y administración).
FARMACOCINÉTICA:
Absorción: La biodisponibilidad absoluta promedio de aprepitant (cápsulas de 125 u 80 mg) es aproximadamente de 60 a 65% y la concentración plasmática máxima (Cmáx) de aprepitant ocurre aproximadamente en 4 horas (Tmáx). La administración oral de las cápsulas con un desayuno estándar no tuvo efectos clínicamente significativos sobre la biodisponibilidad de aprepitant.
La farmacocinética de aprepitant no es lineal a través del rango de dosis clínica. En adultos jóvenes sanos, el aumento en el ABC0-8 fue 26% mayor que la dosis proporcional entre las dosis únicas de 80 mg y 125 mg administradas en estado de ayuno. Otro estudio clínico en adultos jóvenes sanos demostró que no hay un efecto clínicamente importante de la comida sobre la farmacocinética de una dosis única de 40 mg de EMEND®.
Después de la administración oral de una dosis única de 125 mg de EMEND® en el día 1 y 80 mg una vez al día en los días 2 y 3, el ABC0-24hr fue aproximadamente 19.5 µg•hr/ml y 20.1 µg•hr/ml en los días 1 y 3, respectivamente. La Cmáx de 1.5 µg/ml y 1.4 µg/ml fueron alcanzadas en aproximadamente 4 horas (Tmáx) en los días 1 y 3, respectivamente.
Distribución: Aprepitant se une en más del 95% a las proteínas plasmáticas. La media geométrica del volumen aparente de distribución en el estado de equilibrio (Vdss) es de aproximadamente 66 l en humanos.
Aprepitant atraviesa la placenta en ratas y atraviesa la barrera hematoencefálica en ratas y hurones. Los estudios PET en humanos indican que aprepitant atraviesa la barrerahematoencefálica (véase Farmacología clínica, Mecanismo de acción).
Metabolismo: Aprepitant experimenta un extenso metabolismo. En adultos jóvenes sanos, aprepitant representa aproximadamente el 24% de la radiactividad plasmática durante 72 horas después de una dosis oral única de 300 mg de dosis de [14C]-aprepitant, lo que indica una presencia considerable de metabolitos en el plasma. Siete metabolitos de aprepitant, que son sólo débilmente activos, se han identificado en el plasma humano. El metabolismo de aprepitant se produce en gran medida por oxidación en el anillo de morfolina y sus cadenas laterales. Los estudios in vitro con microsomas hepáticos humanos indicaron que aprepitant se metaboliza principalmente por CYP3A4 con un metabolismo menor por CYP1A2 y CYP2C19 y sin metabolismo por la CYP2D6, CYP2C9, o CYP2E1.
Eliminación: Aprepitant se elimina principalmente por metabolismo, aprepitant no se excreta por vía renal. Tras la administración de una dosis oral única de 300 mg de [14C]-aprepitant a sujetos sanos, el 5% de la radiactividad se recuperó en la orina y el 86% en las heces.
El aclaramiento plasmático aparente de aprepitant fue de aproximadamente de 60 a 84 ml/min. La vida media terminal aparente de aprepitant varió aproximadamente de 9 a 13 horas.
CONTRAINDICACIONES: EMEND® está contraindicado en pacientes con hipersensibilidad a cualquier componente del producto.
EMEND® no debe usarse simultáneamente con pimozida, terfenadina, astemizol o cisaprida. Una inhibición dosis-dependiente del citocromo P450 3A4 isoenzima (CYP3A4) por aprepitant podría dar lugar a concentraciones plasmáticas elevadas de estos medicamentos, lo que podría provocar reacciones graves o potencialmente mortales (ver Interacciones con otros medicamentos).
PRECAUCIONES/ADVERTENCIAS: EMEND®, un inhibidor dependiente de dosis de CYP3A4, debe usarse con precaución en pacientes que reciben concomitantemente medicamentos administrados por vía oral que se metabolizan principalmente a través de la CYP3A4 y con un rango terapéutico estrecho, tales como: Ciclosporina, tacrolimus, sirolimus, everolimus, alfentanilo, diergotamina, ergotamina, fentanilo y quinidina y algunos agentes quimioterapéuticos que son metabolizados por CYP3A4 (ver Interacciones con otros medicamentos). La inhibición moderada de CYP3A4 por aprepitant, 125 mg/80 mg, en el régimen de 3 días, podría dar lugar a concentraciones plasmáticas elevadas de estos medicamentos administrados simultáneamente por vía oral (ver Interacciones con otros medicamentos). El efecto de EMEND® sobre la farmacocinética de sustratos de CYP3A4 administrados por vía oral es mayor que el efecto de EMEND® sobre la farmacocinética de sustratos CYP3A4 administrados por vía intravenosa (Ver Interacciones medicamentosas).
La administración conjunta de EMEND® con warfarina puede resultar en un descenso clínicamente significativo, en relación con la razón internacional normalizada o RIN del tiempo de protrombina. En pacientes en tratamiento crónico con warfarina, el RIN debe ser monitoreado de cerca en el periodo de dos semanas, en particular, de 7 a 10 días, una vez iniciado el régimen de 3 días de EMEND® (125 mg/80 mg) con cada ciclo de quimioterapia (ver Interacciones con otros medicamentos).
La eficacia de los anticonceptivos hormonales durante y por 28 días después de la administración de EMEND® puede verse reducida. Deben utilizarse métodos anticonceptivos alternativos o de respaldo durante el tratamiento con EMEND® y durante un mes después de la última dosis de EMEND® (ver Interacciones con otros medicamentos).
USO EN PACIENTES DE EDAD AVANZADA: En estudios clínicos, se compararon la eficacia y seguridad de EMEND® en pacientes de edad avanzada (de 65 años o más) con las observadas en pacientes más jóvenes (menores de 65 años). No es necesario ajustar la dosis en pacientes de edad avanzada.
EMBARAZO: No hay estudios adecuados y bien controlados en mujeres embarazadas. EMEND® debe utilizarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para la madre y el feto.
MADRES EN PERIODO DE LACTANCIA: Aprepitant se excreta en la leche de ratas lactantes. No se sabe si este fármaco se excreta en la leche humana. Debido a que muchos fármacos se excretan en la leche humana y debido a los posibles efectos adversos de EMEND® en los lactantes, se debe decidir si se suspende la lactancia o si se suspende el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
EFECTOS SECUNDARIOS: La seguridad global de aprepitant se evaluó en aproximadamente 6500 individuos.
Prevención de la náuseas y vómitos inducidos por quimioterapia (CINV)
Quimioterapia altamente emetogénica: En dos estudios clínicos controlados en pacientes que reciben quimioterapia altamente emetogénica contra el cáncer, 544 pacientes fueron tratados con el régimen de 3 días de aprepitant durante el ciclo 1 de la quimioterapia y 413 de estos pacientes continuaron en la extensión de ciclos múltiples durante un máximo de 6 ciclos de quimioterapia. EMEND® (régimen oral de 3 días) se administró en combinación con ondansetrón y dexametasona y fue generalmente bien tolerado. La mayoría de las experiencias adversas reportadas en estos estudios clínicos fueron descritas como leves a moderadas en intensidad.
En el Ciclo 1, medicamentos relacionados con experiencias adversas clínicas en aproximadamente un 19% de los pacientes tratados con el régimen oral de 3 días de aprepitant en comparación con aproximadamente el 14% de los pacientes tratados con la terapia estándar. El tratamiento se suspendió debido a las experiencias relacionadas con los efectos adversos clínicos relacionados con el medicamento en el 0.6% de los pacientes tratados con el régimen de 3 días de aprepitant, en comparación con el 0.4% de los pacientes tratados con la terapia estándar.
Las experiencias adversas más frecuentes en pacientes tratados con el régimen de aprepitant y regímenes mayores que la terapia estándar fueron: Hipo (4.6%), elevación de la ALT (2.8%), dispepsia (2.6%), estreñimiento (2.4%), dolor de cabeza (2.0%) y disminución del apetito (2.0%).
En un estudio controlado adicional con sustancias activas, en 1,169 pacientes que recibieron el régimen oral de aprepitant de 3 días y quimioterapia altamente emetogénica, el perfil de los efectos adversos generalmente fue similar al observado en otros estudios con quimioterapia altamente emetogénica con regímenes de aprepitant de 3 días.
Quimioterapia moderadamente emetogénica: En dos estudios clínicos controlados en pacientes que recibieron quimioterapia moderadamente emetogénica, 868 pacientes fueron tratados con aprepitant durante el ciclo 1 de la quimioterapia y 686 de estos pacientes continuaron en la extensión de hasta 4 ciclos de quimioterapia. En ambos estudios, EMEND® en régimen de 3 días, se administró en combinación con ondansetrón y dexametasona y fue generalmente bien tolerado. La mayoría de las experiencias adversas reportadas en estos estudios clínicos fueron descritas como leves a moderadas en intensidad.
En el análisis combinado del ciclo 1 datos de estos dos estudios, reportaron experiencias adversas en aproximadamente un 14% de los pacientes tratados con el régimen oral de 3 días de aprepitant en comparación con aproximadamente el 15% de los pacientes tratados con la terapia estándar. El tratamiento se suspendió debido a acontecimientos adversos en el 0.7% de los pacientes tratados con el régimen oral de aprepitant en comparación con 0.2% de los pacientes tratados con la terapia estándar.
El efecto adverso que se comunicó con mayor incidencia en pacientes tratados con el régimen oral de 3 días de aprepitant comparado con el tratamiento estándar fue la fatiga (1.4%).
Quimioterapia alta y moderadamente emetogénica: Las siguientes experiencias adversas se observaron tanto en estudios con quimioterapia altamente emetogénica como quimioterapia moderadamente emetogénica en los pacientes tratados con el régimen oral de 3 días de aprepitant con una incidencia mayor que el tratamiento estándar: [Frecuentes (mayor o igual a 1/100, menor a 1/10) Poco frecuentes (mayor o igual a 1/1000, menor a 1/100), raros (mayor o igual a 1/10,000, menor a 1/1,000)].
— Infecciones e infestaciones:
• Raras: Candidiasis, infección por estafilococos.
— Trastornos sanguíneos y del sistema linfático:
• Poco frecuentes: Anemia, neutropenia febril.
— Trastornos del metabolismo y nutrición:
• Poco frecuentes: Disminución del apetito
• Raros: polidipsia.
— Trastornos psíquicos:
• Poco frecuentes: Ansiedad.
• Raros: desorientación, euforia.
— Trastornos del sistema nervioso:
• Poco frecuentes: Mareos, somnolencia.
• Raros: Desórdenes cognitivos, letargo, disgeusia.
— Trastornos oculares:
• Raros: Conjuntivitis.
— Trastornos del oído y del laberinto:
• Raros: Tinitus.
— Trastornos cardiacos:
• Poco frecuentes: Palpitaciones.
• Raros: Bradicardia, desordenes cardiovasculares.
— Trastornos vasculares:
• Poco frecuentes: Sofocos.
— Trastornos respiratorios, torácicos y mediastínicos:
• Frecuentes: Hipo.
• Raros: Dolor orofaríngeo, estornudos, tos, goteo retronasal, irritación de la garganta.
— Trastornos gastrointestinales:
• Frecuentes: Dispepsia.
• Poco frecuentes: Eructos, náuseas, enfermedad por reflujo gastroesofágico, molestias epigástricas, flatulencia.
• Raros: Heces duras, perforación de úlcera duodenal, colitis neutropénica, estomatitis, distensión abdominal.
— Piel y tejido subcutáneo:
• Poco frecuentes: Erupción cutánea, acné.
• Raros: Fotosensibilidad, hiperhidrosis, seborrea, lesiones cutáneas, prurito.
— Trastornos musculoesqueléticos y del tejido conjuntivo:
• Raros: Espasmos musculares, debilidad muscular.
— Trastornos renales y urinarios:
• Poco frecuentes: Disuria.
• Raros: Poliaquiuria.
— Trastornos generales y en el lugar de administración:
• Frecuentes: Fatiga.
• Poco frecuentes: Astenia, malestar general.
• Raros: Edema, molestias en el pecho, trastornos de la marcha.
— Trastornos de las pruebas de laboratorio:
• Frecuentes: Aumento de ALT.
• Poco frecuentes: Aumento de AST, aumento de fosfatasa alcalina.
• Raros: Disminución del chorro urinario, hematuria microscópica, hiponatremia, disminución de peso, glucosuria, descenso en el conteo de neutrófilos.
Los perfiles de reacciones adversas en la extensión de ciclos múltiples de HEC y los estudios de MEC durante un máximo de 6 ciclos de quimioterapia fueron generalmente similares a los observados en el ciclo 1.
En otro estudio de náuseas y vómitos inducidos por quimioterapia (CINV), el síndrome de Stevens-Johnson se reportó como una experiencia adversa grave en un paciente que estaba recibiendo aprepitant como quimioterapia antineoplásica.
Otros estudios: Las dosis únicas de 40 mg de EMEND® también se han estudiado para la prevención de la náusea postoperatoria y vómito (NVPO) en pacientes que no reciben quimioterapia y reciben anestesia general balanceada. En estos estudios, las reacciones adversas adicionales que se observaron con una incidencia mayor que con el comparador activo (ondansetrón) fueron: Aumento de ALT, dolor abdominal superior, ruidos intestinales anómalos, disartria, disnea, hipoestesia, insomnio, miosis, náuseas, trastornos sensitivos, molestias abdominales, agudeza visual disminuida, jadeos.
Además, dos reacciones adversas graves se registraron en los estudios de náuseas y vómitos inducidos por quimioterapia en pacientes que tomaban dosis altas de aprepitant: Un caso de estreñimiento y un caso de subíleo.
Uno de los casos de angioedema y urticaria fue reportado como una experiencia adversa grave de un paciente que estaba recibiendo aprepitant en un estudio no-CINV/no-PONV.
Experiencia Post comercialización: Se han identificado las siguientes reacciones adversas durante el uso post comercialización de aprepitant. Debido a que el reporte de estas reacciones es voluntario en un tamaño incierto de la población, no es posible estimar la frecuencia o establecer una relación causal con el fármaco.
Trastornos de la piel y tejido subcutáneo: Prurito, erupción cutánea, urticaria, raramente síndrome de Stevens-Johnson/necrolisis epidérmica tóxica.
Trastornos del sistema Inmune: Reacciones de hipersensibilidad incluyendo reacciones anafilácticas.
INTERACCIONES CON OTROS MEDICAMENTOS: Aprepitant es un sustrato, un inhibidor (dosis-dependiente) desde débil a moderado y un inductor de CYP3A4. Aprepitant es también un inductor de CYP2C9.
Efecto de aprepitant sobre la farmacocinética de otros fármacos: Como inhibidor moderado de CYP3A4 la dosis de aprepitant de 125 mg/80 mg, puede aumentar las concentraciones plasmáticas de medicamentos administrados por vía oral, de forma concomitante, que se metabolizan a través de CYP3A4. Aprepitant puede aumentar las concentraciones plasmáticas de los medicamentos administrados conjuntamente por vía intravenosa que son metabolizados a través de la CYP3A4 en menor medida.
EMEND® no se debe usar simultáneamente con pimozida, terfenadina, astemizol o cisaprida. Una inhibición dosis-dependiente de la CYP3A4 por aprepitant podría dar lugar a concentraciones plasmáticas elevadas de estos medicamentos, podría provocar reacciones graves o potencialmente mortales (ver Contraindicaciones). Se Debe tener precaución durante la administración conjunta de fosaprepitant y la administración, por vía oral, de sustancias activas que se metabolizan principalmente a través de la enzima CYP3A4 y con un rango terapéutico estrecho tales como: Ciclosporina, tacrolimus, sirolimus, everolimus, alfentanilo, diergotamina, ergotamina, fentanilo y quinidina.
Se ha demostrado que aprepitant induce el metabolismo de S (-) warfarina y tolbutamida, que se metaboliza a través de CYP2C9. La administración conjunta de EMEND® con estos medicamentos u otros medicamentos que se sabe que son metabolizados por CYP2C9, como la fenitoína, puede resultar en concentraciones plasmáticas más bajas de estos fármacos.
Es poco probable que EMEND® interactúe con medicamentos que son sustratos para el transportador de la P-glucoproteína, como queda demostrado por la falta de interacción de EMEND® con digoxina en un estudio clínico de interacción farmacológica clínica.
Antagonistas 5-HT3: En los estudios clínicos de interacciones medicamentosas, cuando se dio EMEND® en un régimen de 125 mg el día 1 y 80 mg en los días 2 y 3, no tuvo efectos clínicamente importantes sobre la farmacocinética de ondansetrón, granisetrón ni hidrodolasetrón (el metabolito activo de dolasetrón).
Corticosteroides
Dexametasona: EMEND®, cuando se administra en un régimen de 125 mg por vía oral con dexametasona administrada conjuntamente como 20 mg en el día 1 y EMEND®, administrado 80 mg al día por vía oral con dexametasona, administrada conjuntamente como 8 mg del segundo al quinto día, aumentó el ABC de dexametasona, un sustrato de CYP3A4 2.2 veces, en los días 1 y 5. Se debe reducir en aproximadamente un 50% la dosis oral usual de dexametasona al administrarse conjuntamente con EMEND® (125 mg/80 mg), para lograr una exposición de dexametasona similar a la obtenida cuando se administra sin EMEND®. La dosis diaria de dexametasona administrada en quimioterapia clínica inducida por las náuseas y los vómitos en estudios con EMEND® refleja una reducción aproximada del 50% de la dosis de dexametasona (ver Posología y administración).
Metilprednisolona: EMEND®, administrado en un régimen de 125 mg el día 1 y 80 mg al día durante los días 2 y 3, aumentó el ABC de metilprednisolona, un sustrato de CYP3A4, 1.3 veces el día 1 y 2.5 veces el día 3, al administrarse conjuntamente con metilprednisolona por vía intravenosa, 125 mg el día 1 y vía oral, 40 mg los días 2 y 3. La dosis habitual de metilprednisolona IV se debe reducir aproximadamente un 25% y la dosis habitual de metilprednisolona oral se debe reducir aproximadamente en un 50% cuando se administra conjuntamente con el régimen de EMEND® (de 125 mg/80 mg), para lograr una exposición de metilprednisolona similar a la obtenida cuando se da sin EMEND®.
Agentes quimioterapéuticos: En estudios clínicos, EMEND® (125 mg/80 mg) fue administrado con los siguientes agentes quimioterapéuticos metabolizados principalmente o en parte por CYP3A4: Etopósido, vinorelbina, docetaxel y paclitaxel. Las dosis de estos fármacos no se ajustaron para tener en cuenta las posibles interacciones medicamentosas.
Docetaxel: En un estudio farmacocinético independiente, EMEND (125 mg/80 mg) no tuvo influencia sobre la farmacocinética de docetaxel.
Vinorelbina: En un estudio farmacocinético independiente, EMEND (125 mg/80 mg) no tuvo influencia sobre la farmacocinética de la vinorelbina.
Warfarina: Una dosis única de 125 mg de EMEND® el día 1 y 80 mg por día, los días 2 y 3 fue administrada a sujetos sanos estabilizados, en un tratamiento crónico con warfarina. Aunque no hubo ningún efecto de EMEND® sobre el ABC plasmático de R (+) o S (-) la warfarina determinada en el día 3, se produjo un descenso del 34% en la S (-) warfarina (un sustrato de CYP2C9) acompañado de la concentración mínima de un 14 % de disminución en el tiempo de protrombina (reportado como la razón internacional normalizada o RIN) 5 días después de finalizar la administración de EMEND®. En pacientes en tratamiento crónico con warfarina, el tiempo de protrombina (RIN) debe ser estrechamente monitoreado durante un periodo de dos semanas, en particular, de 7 a 10 días, una vez iniciado el régimen de 3 días de EMEND® (125 mg/80 mg) con cada ciclo de quimioterapia.
Tolbutamida: EMEND®, administrado como 125 mg el día 1 y 80 mg/día los días 2 y 3, disminuyó el ABC de tolbutamida (un sustrato de CYP2C9) en un 23% el día 4, 28% el día 8, y 15% en día 15, cuando se administró una dosis única de tolbutamida 500 mg por vía oral antes de la administración del régimen de 3 días de EMEND® y en los días 4, 8 y 15.
Anticonceptivos orales: La administración de aprepitant, cuando se da una vez al día durante 14 días en forma de cápsulas de 100 mg con un anticonceptivo oral que contiene 35 mcg de etinil estradiol y 1 mg de noretindrona, disminuyó el ABC de etinilestradiol en un 43%, y disminuyó el ABC de noretisterona un 8%.
En otro estudio, se administró una dosis única de un anticonceptivo oral que contiene etinil estradiol y noretindrona en los días 1 a 21 con EMEND®, administrado en un régimen de 125 mg el día 8 y 80 mg/día los días 9 y 10 con ondansetrón 32 mg IV el día 8 y dexametasona oral administrada como 12 mg el día 8 y 8 mg por día, los días 9, 10 y 11. En el estudio, el ABC de etinilestradiol disminuyó un 19% el día 10 y hubo una disminución del 64% en concentraciones mínimas de etinil estradiol durante los días de 9 al 21. Si bien no hubo ningún efecto de EMEND® sobre el ABC de noretisterona en el día 10, hubo una disminución del 60% en las concentraciones mínimas de noretindrona durante los días de 9 al 21.
La eficacia de los anticonceptivos hormonales durante y por 28 días después de la administración de EMEND® puede verse reducida. Se deben utilizar métodos anticonceptivos alternativos o de respaldo durante el tratamiento con EMEND® y durante 1 mes después de la última dosis de EMEND®.
Midazolam: EMEND® aumentó el ABC de midazolam, un sustrato sensible de CYP3A4, en 2.3 veces el día 1 y 3.3 veces el día 5, cuando una dosis oral única de midazolam 2 mg se administra conjuntamente el día 1 y el día 5 en un régimen de EMEND® 125 mg el día 1 y 80 mg por día, los días 2 al 5. Se deben tener en cuenta los posibles efectos de las concentraciones plasmáticas de midazolam u otras benzodiazepinas metabolizadas a través de CYP3A4 (alprazolam, triazolam) al administrar estos fármacos conjuntamente con EMEND® (125 mg/80 mg).
En otro estudio con administración intravenosa de midazolam, EMEND® se administró como 125 mg el día 1 y 80 mg por día, los días 2 y 3 y midazolam 2 mg IV previo a la administración del régimen de 3 días de EMEND® y en Días 4, 8 y 15. EMEND® aumentó el ABC de midazolam en un 25% el día 4 y disminuyó el ABC de midazolam en un 19% el día 8 en relación con la dosificación de EMEND® en los Días 1 al 3. Estos efectos no se consideran clínicamente importantes. El ABC de midazolam el día 15 fue similar a la observada al inicio del estudio.
Un estudio adicional se completó con la administración intravenosa de midazolam y EMEND®. Se administraron 2 mg de midazolam una hora después de la administración oral de una dosis única de EMEND® 125 mg. El ABC plasmático de midazolam se incrementó en 1.5 veces. Este efecto no se consideró clínicamente importante.
Efecto de otros fármacos sobre la farmacocinética de aprepitant: Aprepitant es un sustrato de CYP3A4, por lo tanto, la administración conjunta de EMEND® con medicamentos que inhiben la actividad de CYP3A4 puede aumentar las concentraciones plasmáticas de aprepitant. En consecuencia, la administración concomitante de EMEND® con inhibidores fuertes del CYP3A4 (p. ej., ketoconazol) debe abordarse con precaución, pero la administración concomitante de EMEND® con inhibidores del CYP3A4 moderados (p. ej., diltiazem) no produce cambios clínicamente significativos en las concentraciones plasmáticas de aprepitant.
Aprepitant es un sustrato de CYP3A4, por lo tanto, la administración conjunta de EMEND® con medicamentos que inducen fuertemente la actividad de CYP3A4 (p. ej., rifampicina) puede aumentar las concentraciones plasmáticas de aprepitant reducido que puede resultar en disminución de la eficacia de EMEND®.
Ketoconazol: Al administrarse una dosis única de 125 mg de EMEND® el día 5 de un régimen de 10 días de 400 mg/día de ketoconazol, un inhibidor de CYP3A4, el ABC de aprepitant aumentó aproximadamente 5 veces y la terminal media de vida de aprepitant aumentó aproximadamente 3 veces. La administración concomitante de EMEND® con inhibidores potentes de CYP3A4 debe abordarse con precaución.
Rifampicina: Al administrarse una dosis única de 375 mg de EMEND® el día 9 de un régimen de 14 días de 600 mg/día de rifampicina, un potente inductor de CYP3A4, el ABC de aprepitant disminuyó aproximadamente 11 veces y la vida media disminuyó aproximadamente tres veces. La administración conjunta de EMEND® con medicamentos que inducen la actividad de CYP3A4 puede aumentar las concentraciones plasmáticas reducidas y disminución de eficacia de EMEND®.
Interacciones adicionales
Diltiazem: En pacientes con hipertensión leve a moderada, la administración de aprepitant una vez al día, como la formulación de comprimidos equivalente a 230 mg de la formulación de cápsula, con diltiazem 120 mg 3 veces al día durante 5 días, se tradujo en un aumento de 2 veces el ABC de aprepitant y un aumento simultáneo de 1.7 veces el ABC de diltiazem. Estos efectos farmacocinéticos no produjeron cambios clínicamente significativos en el ECG, la frecuencia cardíaca o presión arterial más allá de los cambios inducidos por el diltiazem solo.
Paroxetina: La administración conjunta de una dosis diaria de aprepitant, como una formulación de comprimidos comparables a 85 mg o 170 mg de la formulación de cápsula, con paroxetina 20 mg una vez al día, se tradujo en un descenso en el ABC en aproximadamente un 25% y la Cmáx en aproximadamente un 20% tanto de aprepitant como de paroxetina.
FARMACOLOGÍA CLÍNICA:
Mecanismo de Acción: Aprepitant tiene un modo de acción único; es un antagonista selectivo de alta afinidad de los receptores de la sustancia humana P neurocinasa (NK-1). Detecciones contra análisis demostraron que aprepitant fue, al menos, 3,000 veces más selectivo por el receptor NK-1 sobre otras enzimas, transportadores, canales iónicos y receptores, incluyendo receptores de dopamina y serotonina que son el objetivo de las terapias contra las náuseas y vómito inducidos por la quimioterapia (NVIQ) y las náuseas y vómito inducidos por los tratamientos post operatorios (NVPO).
Se ha demostrado pre-clínicamente, que los antagonistas del receptor NK1 inhiben la emesis inducida por agentes quimioterapéuticos citotóxicos, tales como cisplatino, a través de las acciones centrales. Estudios preclínicos y tomografía de emisión de positrones (PET) en seres humanos, con aprepitant, han demostrado que penetra al cerebro y ocupa los receptores cerebrales NK-1. Los estudios preclínicos muestran que aprepitant tiene una larga duración de la actividad central, inhibe tanto la fase aguda como tardía de la emesis inducida por cisplatino y aumenta la actividad antiemética del antagonista del receptor 5-HT3, ondansetrón y del corticosteroide dexametasona, contra la emesis inducida por cisplatino.
DOSIS Y ADMINISTRACIÓN:
Prevención de náuseas y vómitos inducidos por quimioterapia (CINV): EMEND® (aprepitant) está disponible en cápsulas para administración oral.
EMEND® se administra durante 3 días como parte de un régimen que incluye un corticosteroide y un antagonista 5-HT3.
Régimen de 3 días de EMEND®:
La dosis recomendada de EMEND® para el régimen de 3 días es de 125 mg por vía oral una hora antes de la quimioterapia (día 1) y 80 mg por vía oral una vez al día en la mañana los días 2 y 3.
En estudios clínicos, se utilizó el siguiente régimen para la prevención de náuseas y vómitos asociados con la quimioterapia antineoplásica altamente emetogénica:
|
Día 1 |
Día 2 |
Día 3 |
Día 4 |
|
|
EMEND* |
125 mg por vía oral |
80 mg por vía oral |
80 mg por vía oral |
nada |
|
Dexametasona** |
12 mg por vía oral |
8 mg por vía oral |
8 mg por vía oral |
8 mg por vía oral |
|
Ondansetrón† |
32 mg IV |
nada |
nada |
nada |
|
* EMEND® se administró por vía oral una hora antes de la quimioterapia el día 1 y en la mañana de los días 2 y 3. **La dexametasona se administró 30 minutos antes de la quimioterapia el día 1 y en la mañana de los días 2 a 4. Se escogió la dosis de dexametasona teniendo en cuenta las interacciones farmacológicas. †El ondansetrón se administró 30 minutos antes de la quimioterapia el día 1. |
||||
En un estudio clínico, el siguiente régimen se usó para prevenir la náusea y el vómito asociados con la quimioterapia anticancerosa moderadamente emetogénica:
|
Día 1 |
Día 2 |
Día 3 |
|
|
EMEND* |
125 mg por vía oral |
80 mg por vía oral |
80 mg por vía oral |
|
Dexametasona** |
12 mg por vía oral |
nada |
nada |
|
Ondansetrón† |
2x8 mg por vía oral |
nada |
nada |
|
* EMEND® se administró por vía oral una hora antes de la quimioterapia el día 1 y en la mañana de los Días 2 y 3. **La dexametasona se administró 30 minutos antes de la quimioterapia el día 1. Se escogió la dosis de dexametasona para suprimir las interacciones medicamentosas. †El ondansetrón cápsula de 8 mg se administró 30 a 60 minutos antes del tratamiento de quimioterapia y una cápsula de 8 mg se administró 8 horas después de la primera dosis el día 1. |
|||
También está disponible EMEND IV (fosaprepitant) de 150 mg que es un profármaco liofilizado de aprepitant para administración intravenosa en una dosis única y es administrado sólo en el día 1 sin ninguna cápsula de EMEND® en los días 2 y 3.
Información general: Ver Interacciones medicamentosas para información adicional sobre la administración conjunta de EMEND® y corticosteroides.
Consulte la información para prescribir completa sobre la administración conjunta de fármacos antieméticos.
EMEND® puede tomarse con o sin alimentos.
No es necesario ajustar la dosis basado en la edad, el sexo, la raza o el índice de masa corporal (IMC).
No es necesario ajustar la dosis en pacientes con insuficiencia renal grave (aclaramiento de creatinina menor a 30 ml/min) o en pacientes con insuficiencia renal crónica terminal en hemodiálisis.
No es necesario ajustar la dosis para los pacientes con insuficiencia hepática de leve a moderada (puntuación de Child-Pugh de 5 a 9). No existen datos clínicos en pacientes con insuficiencia hepática severa (Child-Pugh mayor a 9).
USO PEDIÁTRICO: No se ha establecido la seguridad y eficacia de EMEND® en pacientes pediátricos.
SOBREDOSIS: No hay información específica disponible sobre el tratamiento de la sobredosis con EMEND®. Las dosis únicas de hasta 600 mg de aprepitant fueron generalmente bien toleradas en sujetos sanos. El aprepitant fue generalmente bien tolerado cuando se administró como 375 mg una vez al día durante un máximo de 42 días a los pacientes en los estudios no CINV. En 33 pacientes con cáncer, la administración de una dosis única de 375 mg de aprepitant el día 1 y 250 mg una vez al día los días 2 a 5 fue generalmente bien tolerado.
Se reportaron somnolencia y cefaleas en un paciente que ingirió 1,440 mg de aprepitant.
En caso de sobredosis, EMEND® debe suspenderse, monitorear al paciente y administrar tratamiento de soporte general. Debido a la actividad antiemética de aprepitant, la emesis inducida puede no ser eficaz.
Aprepitant no puede eliminarse por hemodiálisis.
CLASE TERAPÉUTICA: EMEND* (aprepitant), es un antagonista del receptor de neurocinina 1 (NK1) de la sustancia P.
Química: Aprepitant es una sustancia estructuralmente novedosa, es un antagonista del receptor de la neurocinina 1 (NK-1); se describe químicamente como 5-[[(2R,3S)-2-[(1R)-1-[3,5bis(trifluorometil)fenil]etoxi]-3-(4-fluorofenil)-4-morfolinil]metil]-1,2-dihidro-3H-1,2,4-triazol-3-uno.
Su fórmula empírica es C23H21F7N4O3, y su fórmula estructural es:
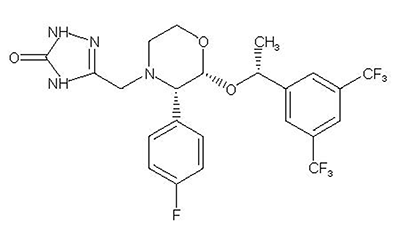
Aprepitant es un sólido cristalino, blanco a blanquecino, con un peso molecular de 534.43. Prácticamente es insoluble en agua. Aprepitant es escasamente soluble en etanol y acetato de isopropilo y ligeramente soluble en acetonitrilo.
* Copyright© 2011 Merck Sharp & Dohme Corp., una subsidiaria de Merck & Co., Inc., Whitehouse Station, NJ, USA Todos los derechos Reservados.
PRESENTACIÓN: EMEND® se presenta en cajas de 1 cápsula de 125 mg y 2 cápsulas de 80 mg.
Si requiere mayor información solicítela a la Dirección Médica al Teléfono: (507) 282-7200


ALMACENAMIENTO: Conservar a temperatura ambiente, menor a 30 °C.