
FLUARIX TETRA
ANTÍGENO INACTIVADO DEL VIRUS INFLUENZA CEPA A/CALIFORNIA/7/2009 (H1N1), ANTÍGENO INACTIVADO DEL VIRUS INFLUENZA CEPA B/BRISBANE/60/2008
Suspensión inyectable
Envase(s), 1 Jeringa(s) precargada(s), 0,5 ml,
Envase(s), 10 Jeringa(s) precargada(s), 0,5 ml,
CARACTERÍSTICAS FARMACÉUTICAS:
Lista de excipientes: Cloruro de sodio, fosfato disódico dodecahidratado, dihidrógeno fosfato de potasio, cloruro de potasio, cloruro de magnesio hexahidratado, succinato ácido de a-tocoferil, polisorbato 80, octoxinol 10 y agua para inyección.
Hidrocortisona, sulfato de gentamicina, ovoalbúmina, formaldehído y desoxicolato de sodio están presentes como residuos del proceso de fabricación.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: FLUARIX™ TETRA es una vacuna antigripal inactivada (virión fraccionado), que contiene antígenos (propagados en huevos embrionados) equivalentes a los siguientes tipos y subtipos:
Cepa de tipo A/California/7/2009 (H1N1)pdm09 (A/Christchurch/16/2010, NIB 74xp).
Cepa de tipo A/Hong Kong/4801/2014 (H3N2) (A/Hong Kong/4801/2014, NYMC X-263B).
B/Brisbane/60/2008.
B/Phuket/3073/2013.
Esta vacuna cumple con las cepas recomendadas por la OMS (hemisferio sur) para la temporada 2016.
Cada dosis de 0,5 ml de la vacuna contiene 15 µg de hemaglutinina de cada una de las cepas recomendadas.
FLUARIX™ TETRA cumple con los requisitos de la OMS para sustancias biológicas y vacunas antigripales y los requisitos de la Farmacopea Europea para vacunas antigripales.
FORMA FARMACÉUTICA: Suspensión inyectable.
INDICACIONES: FLUARIX™ TETRA es una vacuna tetravalente indicada para la inmunización activa de adultos y niños a partir de los 3 años de edad para la prevención de la enfermedad gripal causada por los tipos A y B del virus de la gripe incluidos en la vacuna.
FARMACODINAMIA: Mecanismo de acción:
FLUARIX™ TETRA proporciona inmunización activa contra cuatro cepas del virus de la gripe (dos subtipos A y dos tipos B) incluidas en la vacuna y induce anticuerpos humorales contra las hemaglutininas. Estos anticuerpos neutralizan los virus de la gripe.
No se ha establecido una correlación entre los niveles específicos del título de anticuerpos por inhibición de la hemaglutinación (IH) posteriores a la aplicación de vacunas con virus de la gripe inactivados y la protección contra la enfermedad gripal; no obstante, los títulos de anticuerpos por IH se han empleado como medida de la actividad vacunal. En algunos estudios de provocación realizados en seres humanos, los títulos de anticuerpos por IH ≥ 1:40 se han asociado a la protección contra la enfermedad gripal en hasta el 50 % de los sujetos.
Se recomienda la revacunación anual con la vacuna actual, dado que la inmunidad disminuye a medida que transcurre el año después de la vacunación y porque las cepas circulantes del virus de la gripe podrían cambiar de un año a otro.
Efectos farmacodinámicos: En estudios clínicos realizados en adultos (D QIV 001 y D QIV 008) y en niños de 3 a 17 años (D QIV 003), se evaluó la no inferioridad de FLUARIX™ TETRA frente a FLUARIX™ con respecto a la media geométrica de los títulos (MGT) de anticuerpos por IH el día 21 (para adultos) y el día 28 (para niños) y la tasa de seroconversión de IH (título recíproco 4 veces mayor o cambio desde un valor no detectable [< 10] hasta un valor de título recíproco ≥ 40).
En todos los estudios, la respuesta inmunitaria obtenida con FLUARIX™ TETRA contra las tres cepas en común no fue inferior a FLUARIX™. En comparación con FLUARIX™, FLUARIX™ TETRA obtuvo una respuesta inmunitaria superior contra la cepa B adicional incluida en FLUARIX™ TETRA.
Adultos a partir de los 18 años: En el estudio clínico D QIV 008, aproximadamente 1800 adultos a partir de los 18 años recibieron una dosis única de FLUARIX™ TETRA y aproximadamente 600 sujetos recibieron una dosis única de FLUARIX™ (Tabla 1).
|
Tabla 1: Los valores de MGT y las tasas de seroconversión posteriores a la vacunación: |
||
|
Adultos a partir de los 18 años |
FLUARIX™ TETRA N = 1809 |
FLUARIX™1 N = 608 |
|
MGT (intervalo de confianza del 95 %) |
||
|
A/H1N1 |
201,1 (188,1;215,1) |
218,4 (194,2;245,6) |
|
A/H3N2 |
314,7 (296,8;333,6) |
298,2 (268,4;331,3) |
|
B (Victoria)2 |
404,6 (386,6;423,4) |
393,8 (362,7;427,6) |
|
B (Yamagata)3 |
601,8 (573,3;631,6) |
386,6 (351,5;425,3) |
|
Tasa de seroconversión (intervalo de confianza del 95 %) |
||
|
A/H1N1 |
77,5 % (75,5;79,4) |
77,2 % (73,6;80,5) |
|
A/H3N2 |
71,5 % (69,3;73,5) |
65,8 % (61,9;69,6) |
|
B (Victoria) |
58,1 % (55,8;60,4) |
55,4 % (51,3;59,4) |
|
B (Yamagata) |
61,7 % (59,5;64,0) |
45,6 % (41,6;49,7) |
|
1 Contiene A/H1N1, A/H3N2 y B (linaje Victoria). 2 Cepa recomendada por la OMS durante la temporada 2010 2011. 3 Cepa B adicional incluida en FLUARIX™ TETRA recomendada en la temporada 2008 2009. |
||
Las tasas de seroprotección posteriores a la vacunación (título recíproco ≥ 40 en el día 21) correspondientes a FLUARIX™ TETRA fueron del 91,3 % contra A/H1N1, 96,8 % contra A/H3N2, 98,8 % contra B (Victoria) y 91,8 % contra B (Yamagata).
En el estudio clínico D QIV 001 (composición de la vacuna de la temporada 2007 2008), las tasas de seroprotección posteriores a la vacunación correspondientes a FLUARIX™ TETRA fueron del 92,3 % contra A/H1N1, 97,1 % contra A/H3N2, 97,1 % contra B (Victoria) y 98,1 % contra B (Yamagata).
Niños de 3 17 años de edad: En el estudio clínico (D QIV 003), aproximadamente 900 niños de 3 17 años recibieron una o dos dosis de FLUARIX™ TETRA o de FLUARIX™, respectivamente (Tabla 2).
|
Tabla 2: Los valores de MGT y las tasas de seroconversión posteriores a la vacunación |
||
|
Niños de 3 a 17 años |
FLUARIX™ TETRA N = 791 |
FLUARIX™1 N = 818 |
|
MGT (intervalo de confianza del 95 %) |
||
|
A/H1N1 |
386,2 (357,3;417,4) |
433,2 (401,0;468,0) |
|
A/H3N2 |
228,8 (215,0;243,4) |
227,3 (213,3;242,3) |
|
B (Victoria)2 |
244,2 (227,5;262,1) |
245,6 (229,2;263,2) |
|
B (Yamagata)3 |
569,6 (533,6;608,1) |
224,7 (207,9;242,9) |
|
Tasa de seroconversión (intervalo de confianza del 95%) |
||
|
A/H1N1 |
91,4 % (89,2;93,3) |
89,9 % (87,6;91,8) |
|
A/H3N2 |
72,3 % (69,0;75,4) |
70,7 % (67,4;73,8) |
|
B (Victoria) |
70,0 % (66,7;73,2) |
68,5 % (65,2;71,6) |
|
B (Yamagata) |
72,5 % (69,3;75,6) |
37,0 % (33,7;40,5) |
|
1 Contiene A/H1N1, A/H3N2 y B (linaje Victoria). 2 Cepa recomendada por la OMS durante la temporada 2010 2011. 3 Cepa B adicional incluida en FLUARIX™ TETRA recomendada en la temporada 2008 2009. |
||
Las tasas de seroprotección posteriores a la vacunación correspondientes a FLUARIX™ TETRA fueron del 96,6% contra A/H1N1, 98,0% contra A/H3N2, 97,3% contra B (Victoria) y 99,2% contra B (Yamagata).
Datos de seguridad preclínica: Los datos no clínicos revelan que no existen riesgos especiales para los seres humanos según los estudios convencionales sobre toxicidad aguda, tolerancia local, toxicidad de dosis repetidas y toxicidad en la reproducción/el desarrollo.
CONTRAINDICACIONES: FLUARIX™ TETRA no debe administrarse a sujetos que hayan presentado hipersensibilidad luego de una administración previa de FLUARIX™ TETRA o de vacunas antigripales, o que tienen hipersensibilidad conocida a cualquier componente de la vacuna.
ADVERTENCIAS Y PRECAUCIONES: Conforme a las buenas prácticas clínicas, la vacunación debe estar precedida por una revisión de la historia clínica (especialmente en relación con vacunaciones previas y la posible aparición de eventos no deseados) y un examen clínico.
Como sucede con todas las vacunas inyectables, siempre debe haber disponibilidad inmediata de atención médica y supervisión adecuadas en caso de que surja un evento anafiláctico después de administrar la vacuna.
Al igual que con otras vacunas, la vacunación con FLUARIX™ TETRA debe posponerse en sujetos que padezcan de enfermedad febril severa aguda. La presencia de una infección menor, como un resfriado, no debe ser motivo para aplazar la vacunación.
En los pacientes que están recibiendo tratamiento inmunosupresor o los pacientes con inmunodeficiencia, es posible que no se obtenga una respuesta inmunitaria adecuada.
FLUARIX™ TETRA no es eficaz contra todas las posibles cepas del virus de la gripe. FLUARIX™ TETRA está destinada a proporcionar protección contra aquellas cepas del virus con las cuales se elaboró la vacuna y contra cepas estrechamente relacionadas.
Como sucede con cualquier vacuna, es posible que no se obtenga una respuesta inmunitaria protectora en todas las personas vacunadas.
FLUARIX™ TETRA NO DEBE ADMINISTRARSE POR VÍA INTRAVASCULAR EN NINGÚN CASO.
Al igual que con otras vacunas administradas por vía intramuscular, se debe tener precaución al administrar FLUARIX™ TETRA a personas con trombocitopenia o cualquier trastorno de la coagulación, puesto que en estos sujetos puede producirse sangrado tras la administración intramuscular.
Puede presentarse síncope (desmayos) después, o incluso antes, de cualquier vacunación como una respuesta sicogénica a la inyección con aguja. Es importante que se tengan implementados los debidos procedimientos para evitar las lesiones por desmayos.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN: Conservar a una temperatura de + 2 °C a + 8 °C (en refrigerador)- No congelar- Conservar en el envase original a fin de proteger el producto de la luz.
EMBARAZO Y LACTANCIA: No se ha evaluado la seguridad de FLUARIX™ TETRA cuando se administra a mujeres embarazadas. Los estudios en animales realizados con FLUARIX Tetra no indican efectos perjudiciales directos ni indirectos relacionados con la toxicidad en la reproducción y el desarrollo (ver Información no clínica).
Durante el embarazo, FLUARIX™ TETRA debe emplearse únicamente cuando sea claramente necesario y cuando las posibles ventajas superen los potenciales riesgos para el feto.
No se ha evaluado la seguridad de FLUARIX™ TETRA cuando se administra a mujeres en período de lactancia. Se desconoce si FLUARIX™ TETRA se excreta en la leche materna de los seres humanos.
FLUARIX™ TETRA podrá emplearse durante la lactancia únicamente cuando las posibles ventajas superen los potenciales riesgos.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: Es poco probable que la vacuna produzca algún efecto sobre la capacidad para conducir vehículos y utilizar máquinas.
REACCIONES ADVERSAS: En dos estudios clínicos, se administró FLUARIX™ TETRA (más de 3000 adultos y 900 niños) o FLUARIX™ (más de 1000 adultos y 900 niños) a adultos a partir de los 18 años y a niños de 3 a 17 años. Se observaron tasas similares de eventos adversos no relatados espontáneamente por el paciente en los receptores de FLUARIX™ TETRA y de FLUARIX™.
Las reacciones adversas informadas con respecto a FLUARIX™ TETRA se indican de acuerdo con las siguientes categorías de frecuencia:
Muy frecuentes (≥ 1/10).
Frecuentes (≥ 1/100 a < 1/10).
Poco frecuentes (≥ 1/1000 a < 1/100).
Raras (≥ 1/10.000 a < 1/1000).
Muy raras (< 1/10.000).
|
Frecuencia |
Reacciones adversas |
|
Ensayos clínicos |
|
|
Muy frecuentes |
irritabilidad1, mialgia, dolor en el lugar de la inyección, fatiga |
|
Frecuentes |
Pérdida del apetito1, somnolencia1, dolor de cabeza, síntomas gastrointestinales (incluidos náuseas, vómitos, diarrea y/o dolor abdominal), artralgia, enrojecimiento en el lugar de la inyección4, hinchazón en el lugar de la inyección4, escalofríos, fiebre. |
|
Poco frecuentes |
Mareos2, erupción cutánea3, hematoma en el lugar de la inyección2, prurito en el lugar de la inyección. |
|
1 Informado como síntoma no relatado espontáneamente por el paciente en sujetos menores de 6 años. 2 Informado en sujetos adultos. 3 Informado en sujetos de 3 a 17 años. 4 Muy frecuente en sujetos de 3 a 17 años. |
|
|
Además, se informaron las siguientes reacciones adversas en ensayos previos con FLUARIX™: |
|
|
Frecuentes |
Sudoración, induración en el lugar de la inyección |
|
Vigilancia poscomercialización: No ha habido exposición poscomercialización a FLUARIX™ TETRA. Sin embargo, dado que las tres cepas de la gripe presentes en FLUARIX™ están incluidas en FLUARIX™ Tetra, los siguientes eventos adversos que se han observado con FLUARIX™ durante la vigilancia poscomercialización pueden presentarse en los pacientes que reciban FLUARIX™ Tetra luego de la aprobación. |
|
|
Raras |
linfadenopatía transitoria, reacciones alérgicas (incluidas reacciones anafilácticas), neuritis, encefalomielitis diseminada aguda, síndrome de Guillain-Barré*, urticaria, prurito, eritema, angioedema, síntomas pseudogripales, malestar. * Se han recibido informes espontáneos del síndrome de Guillain-Barré luego de la vacunación con Fluarix™; sin embargo, no se ha establecido una relación causal entre la vacunación y el síndrome de Guillain-Barré. |
INCOMPATIBILIDADES: Debido a la falta de estudios de compatibilidad, este producto farmacéutico no debe mezclarse con otros productos farmacéuticos.
Período de validez: La fecha de caducidad está indicada en la etiqueta y en el envase.
INTERACCIONES: No se han llevado a cabo estudios sobre interacciones. Si se administrara FLUARIX™ TETRA junto con otra vacuna inyectable, las vacunas deben administrarse siempre en lugares de inyección distintos.
Luego de la vacunación antigripal, pueden observarse resultados falsos positivos en las pruebas serológicas mediante el método ELISA para el VIH 1, la hepatitis C y especialmente el VLTH 1. Es posible que estos resultados falsos positivos transitorios se deban a reacciones cruzadas de la IgM obtenida con la vacuna. Por este motivo, para un diagnóstico definitivo de infección por VIH 1, hepatitis C o VLTH 1, se requiere un resultado positivo en una prueba confirmatoria específica para cada virus (p. ej., análisis Western blot o inmunotransferencia).
POSOLOGÍA Y ADMINISTRACIÓN: FLUARIX™ TETRA debe administrarse en forma de inyección única de 0,5 ml.
Los niños de entre 3 años y menos de 9 años que no han sido vacunados previamente contra la gripe deben recibir una segunda dosis de 0,5 ml después de un intervalo de al menos 4 semanas.
Las vacunas se deben administrar por vía intramuscular, preferentemente en el músculo deltoides o en la región anterolateral del muslo (según la masa muscular).
SOBREDOSIS: No hay datos suficientes.
INSTRUCCIONES PARA EL EMPLEO/MANEJO: La vacuna se presenta en forma de suspensión entre incolora y ligeramente opalescente.
Antes de la administración, debe agitarse la jeringa y se debe inspeccionar visualmente para detectar cualquier partícula extraña o variación en el aspecto físico. En caso de observar alguna de estas alteraciones, deseche la vacuna.
Instrucciones para la administración de la vacuna presentada en jeringa precargada con tapa de plástico rígido para punta:
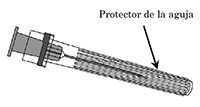
Aguja:
Jeringa:
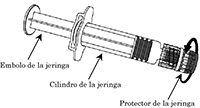
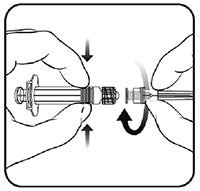
1 Sujete el cilindro de la jeringa con una mano (no sujete el émbolo de la jeringa) y desenrosque la tapa de la jeringa girándola en sentido contrario a las agujas del reloj.
2 Para colocar la aguja en la jeringa, gire la aguja en sentido de las agujas del reloj hacia el interior de la jeringa hasta que sienta que ha quedado fija (ver la ilustración).
3 Retire el protector de la aguja, que en ocasiones puede estar un poco apretado.
4 Administre la vacuna.
Cualquier producto no usado o material de desecho deberá eliminarse de conformidad con los requerimientos locales.
No todas las presentaciones existen en todos los países.
Version number: GDS01/IPI04(SH) / Date of issue: October 2015
© 2015 GSK group of companies.
Manufacturer: GlaxoSmithKline Biologicals, Branch of SmithKline Beecham Pharma GmbH & Co. KG, Dresden, Germany.
Tel: (49) 351 45610 Fax: (49) 351 4561211
FLUARIX es una marca comercial del Grupo de Compañías GSK.
GSK Pharmaceuticals CR S.A.
NATURALEZA Y CONTENIDO DEL ENVASE: 0,5 ml en jeringa precargada (vidrio tipo I); tamaño de empaque de 1 o 10.