
JARDIANZ DPP
EMPAGLIFLOZINA, LINAGLIPTINA
Tabletas recubiertas
1 Caja, 10 Tabletas recubiertas, 5/10 mg/mg
1 Caja, 10 Tabletas recubiertas, 5/25 mg/mg
1 Caja, 30 Tabletas recubiertas, 5/10 mg/mg
1 Caja, 30 Tabletas recubiertas, 5/25 mg/mg
1 Caja, 7 Tabletas recubiertas, 5/10 mg/mg
1 Caja, 7 Tabletas recubiertas, 5/25 mg/mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA recubierta contiene:
Linagliptina 5 mg
Empagliflozina 10 mg, 25 mg
Excipiente c.b.p. 1 tableta recubierta
Código ATC: A10BD19
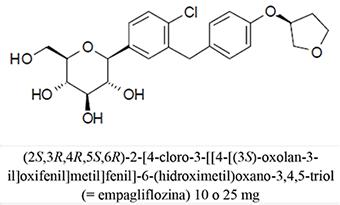
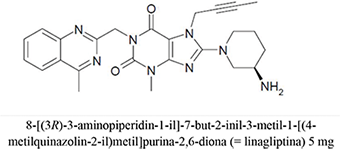
Formas farmacéuticas y concentraciones: Las tabletas de JARDIANZ® DPP son una combinación de empagliflozina y linagliptina disponible como:
• Las tabletas de 10 mg de empagliflozina/5 mg de linagliptina son de color amarillo pálido, triangulares en arco, de cara plana, con bordes biselados y recubiertas con película. Un lado está grabado con el símbolo de la empresa Boehringer Ingelheim; el otro lado está grabado con "10/5".
• Las tabletas de 25 mg de empagliflozina/5 mg de linagliptina son de color rosa pálido, triangulares en arco, de cara plana, con bordes biselados y recubiertas con película. Un lado está grabado con el símbolo de la empresa Boehringer Ingelheim; el otro lado está grabado con "25/5".
TOXICOLOGÍA NO CLÍNICA:
Carcinogénesis, mutagénesis, alteración de la fertilidad:
JARDIANZ® DPP: No se han realizado estudios de carcinogenicidad, mutagenicidad o alteración de la fertilidad con la combinación de empagliflozina y linagliptina. Se realizaron estudios generales de toxicidad en ratas de hasta 13 semanas con los componentes combinados. Estos estudios indicaron que la combinación de empagliflozina y linagliptina no causa toxicidad aditiva.
Empagliflozina: La carcinogénesis se evaluó en estudios de 2 años realizados en ratones CD-1 y ratas Wistar. La empagliflozina no aumentó la incidencia de tumores en ratas hembra que recibieron dosis de 100, 300 o 700 mg/kg/día (hasta 72 veces la exposición desde la dosis clínica máxima de 25 mg). En ratas macho, los hemangiomas del ganglio linfático mesentérico aumentaron significativamente con 700 mg/kg/día o aproximadamente 42 veces la exposición de una dosis clínica de 25 mg. La empagliflozina no aumentó la incidencia de tumores en ratones hembra que recibieron dosis de 100, 300 o 1000 mg/kg/día (hasta 62 veces la exposición de una dosis clínica de 25 mg). Se observaron adenomas y carcinomas en los túbulos renales en ratones macho a 1000 mg/kg/día, que es aproximadamente 45 veces la exposición de la dosis clínica máxima de 25 mg.
La empagliflozina no fue mutagénica ni clastogénica con o sin activación metabólica en el ensayo de mutagenicidad bacteriana Ames in vitro, el ensayo de células de linfoma de ratón L5178Y tk ± in vitro y un ensayo de micronúcleos in vivo en ratas.
La empagliflozina no tuvo efectos sobre el apareamiento, la fertilidad o el desarrollo embrionario temprano en ratas macho o hembra tratadas hasta la dosis alta de 700 mg/kg/día (aproximadamente 155 veces la dosis clínica de 25 mg en machos y hembras, respectivamente).
Linagliptina: La linagliptina no aumentó la incidencia de tumores en ratas macho y hembra en un estudio de 2 años a dosis de 6, 18 y 60 mg/kg. La dosis más alta de 60 mg/kg es aproximadamente 418 veces la dosis clínica de 5 mg/día según la exposición AUC. La linagliptina no aumentó la incidencia de tumores en ratones en un estudio de 2 años en dosis de hasta 80 mg/kg (machos) y 25 mg/kg (hembras), o aproximadamente 35 y 270 veces la dosis clínica según el AUC exposición. Las dosis más altas de linagliptina en ratones hembra (80 mg/kg) aumentaron la incidencia de linfoma en aproximadamente 215 veces la dosis clínica según la exposición del AUC.
La linagliptina no fue mutagénica ni clastogénica con o sin activación metabólica en el ensayo de mutagenicidad bacteriana de Ames, una prueba de aberraciones cromosómicas en linfocitos humanos y un ensayo de micronúcleos in vivo.
En estudios de fertilidad en ratas, la linagliptina no tuvo efectos adversos sobre el desarrollo embrionario temprano, el apareamiento, la fertilidad o la fecundidad de crías vivas hasta la dosis más alta de 240 mg/kg (aproximadamente 943 veces la dosis clínica según la exposición AUC).
INDICACIONES TERAPÉUTICAS:
Indicaciones y uso:
JARDIANZ® DPP es una combinación de empagliflozina y linagliptina indicada como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
La empagliflozina está indicada para reducir el riesgo de muerte cardiovascular en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida [consulte Estudios clínicos (14)].
Limitaciones de uso:
JARDIANZ® DPP no está recomendado en pacientes con diabetes mellitus tipo 1. Puede aumentar el riesgo de cetoacidosis diabética en estos pacientes [consulte Advertencias y precauciones (Cetoacidosis)].
JARDIANZ® DPP no se ha estudiado en pacientes con antecedentes de pancreatitis. Se desconoce si los pacientes con antecedentes de pancreatitis tienen un mayor riesgo de desarrollar pancreatitis mientras usan JARDIANZ® DPP [consulte Advertencias y precauciones (pancreatitis)].
No se recomienda el uso de JARDIANZ® DPP para mejorar el control glucémico en adultos con diabetes mellitus tipo 2 con una TFGe inferior a 30 mL/min/1.73 m2. Es probable que JARDIANZ® DPP sea ineficaz en este contexto debido a su mecanismo de acción.
CONTRAINDICACIONES:
• Pacientes en diálisis [consulte Uso en poblaciones específicas (Insuficiencia renal)].
• Hipersensibilidad a la empagliflozina, la linagliptina o cualquiera de los excipientes de JARDIANZ® DPP, se han presentado reacciones como anafilaxia, angioedema, afecciones exfoliativas de la piel, urticaria o hiperreactividad bronquial [consulte Advertencias y precauciones (Reacciones de hipersensibilidad) y Reacciones adversas].
ADVERTENCIAS Y PRECAUCIONES:
Pancreatitis: Se ha notificado pancreatitis aguda, incluida pancreatitis mortal, en pacientes tratados con linagliptina. En el ensayo CARMELINA [consulte Estudios clínicos], se notificó pancreatitis aguda en 9 (0.3%) pacientes tratados con linagliptina y en 5 (0.1%) pacientes tratados con placebo. Dos pacientes tratados con linagliptina en el ensayo CARMELINA sufrieron pancreatitis aguda con desenlace fatal. Ha habido informes posteriores a la comercialización de pancreatitis aguda, incluida pancreatitis mortal, en pacientes tratados con linagliptina.Preste especial atención a los posibles signos y síntomas de pancreatitis. Si se sospecha pancreatitis, suspenda JARDIANZ® DPP de inmediato e inicie el tratamiento correspondiente. Se desconoce si los pacientes con antecedentes de pancreatitis tienen un mayor riesgo de desarrollar pancreatitis mientras usan JARDIANZ® DPP.
Cetoacidosis: Se han identificado casos de cetoacidosis, una afección grave que pone en peligro la vida y requiere hospitalización urgente, en ensayos clínicos y vigilancia posterior a la comercialización en pacientes con diabetes mellitus tipo 1 y tipo 2 que utilizan inhibidores del cotransportador de sodio y glucosa 2 (SGLT2), incluida la empagliflozina. Se han notificado casos mortales de cetoacidosis en pacientes que toman empagliflozina. En ensayos controlados con placebo de pacientes con diabetes tipo 1, el riesgo de cetoacidosis aumentó en los pacientes que recibieron inhibidores de SGLT2 en comparación con los pacientes que recibieron placebo.JARDIANZ® DPP no está indicado para el tratamiento de pacientes con diabetes mellitus tipo 1 [consulte Indicaciones y uso].
Los pacientes tratados con JARDIANZ® DPP que presentan signos y síntomas compatibles con acidosis metabólica grave deben ser evaluados para detectar cetoacidosis independientemente de los niveles de glucosa en sangre que presenten, ya que la cetoacidosis asociada con JARDIANZ® DPP puede estar presente incluso si los niveles de glucosa en sangre son inferiores a 250 mg/g. Si se sospecha cetoacidosis, se debe suspender JARDIANZ® DPP, se debe evaluar al paciente y se debe instituir un tratamiento inmediato. El tratamiento de la cetoacidosis puede requerir reposición de insulina, líquidos y carbohidratos.
En muchos de los informes posteriores a la comercialización, y en particular en pacientes con diabetes tipo 1, la presencia de cetoacidosis no se identificó de inmediato y el inicio del tratamiento se retrasó porque los niveles de glucosa en sangre iniciales estaban por debajo de los que normalmente se esperan para la cetoacidosis diabética (a menudo menos de 250 mg/dL/día). Los signos y síntomas, al presentarse, fueron consistentes con la deshidratación y acidosis metabólica severa e incluyeron náuseas, vómitos, dolor abdominal, malestar generalizado y dificultad para respirar. En algunos casos, pero no en todos, los factores que predisponen a la cetoacidosis, como la reducción de la dosis de insulina, enfermedad febril aguda, ingesta calórica reducida, cirugía, trastornos pancreáticos que sugieren deficiencia de insulina (p. ej., diabetes tipo 1, antecedentes de pancreatitis o cirugía pancreática) y abuso de alcohol fueron identificados.
Antes de iniciar JARDIANZ® DPP, considere los factores en el historial del paciente que pueden predisponer a la cetoacidosis, incluida la deficiencia de insulina pancreática por cualquier causa, la restricción calórica y el abuso de alcohol.
Para los pacientes que se someten a una cirugía programada, considere suspender temporalmente JARDIANZ® DPP durante al menos 3 días antes de la cirugía [consulte Farmacología clínica (Farmacodinámica, Farmacocinética)].
Considere controlar la cetoacidosis y suspender temporalmente JARDIANZ® DPP en otras situaciones clínicas que predispongan a la cetoacidosis (p. ej., ayuno prolongado debido a una enfermedad aguda o después de una cirugía).
Asegúrese de que los factores de riesgo de cetoacidosis se resuelvan antes de reiniciar JARDIANZ® DPP. Instruir a los pacientes sobre los signos y síntomas de la cetoacidosis e indicarles que suspendan el uso de JARDIANZ® DPP y busquen atención médica de inmediato si se presentan signos y síntomas.
Hipovolemia: La empagliflozina puede causar hipovolemia intravascular que a veces puede manifestarse como hipotensión sintomática o cambios transitorios agudos en la creatinina [consulte Reacciones adversas (Experiencia en ensayos clínicos)]. Existen informes posteriores a la comercialización de insuficiencia renal aguda, algunos que requirieron hospitalización y diálisis, en pacientes con diabetes mellitus tipo 2 que recibieron inhibidores de SGLT2, incluida la empagliflozina. Los pacientes con función renal alterada (TFGe inferior a 60 mL/min/1.73 m2), los pacientes de edad avanzada o los pacientes que toman diuréticos de asa pueden tener un mayor riesgo de hipovolemia o hipotensión. Antes de iniciar JARDIANZ® DPP en pacientes con una o más de estas características, evalúe el estado del volumen y la función renal. En pacientes con hipovolemia, corrija esta condición antes de iniciar JARDIANZ® DPP. Monitorear signos y síntomas de hipovolemia, y la función renal después de iniciar el tratamiento.
Infección urinaria y pielonefritis: Se han notificado casos de infecciones graves del tracto urinario, incluidas urosepsis y pielonefritis, que requirieron hospitalización en pacientes que recibieron inhibidores de SGLT2, incluida la empagliflozina. El tratamiento con inhibidores de SGLT2 aumenta el riesgo de infecciones del tracto urinario. Evalúe a los pacientes en busca de signos y síntomas de infecciones del tracto urinario y trátelos de inmediato, si es necesario [consulte Reacciones adversas].
Hipoglucemia con el uso concomitante con insulina y secretagogos de insulina: Se sabe que la insulina y los secretagogos de insulina causan hipoglucemia. El riesgo de hipoglucemia aumenta cuando se usa JARDIANZ® DPP en combinación con un secretagogo de insulina (p. ej., sulfonilurea) o insulina. Por lo tanto, es posible que se requiera una dosis más baja del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia cuando se usa en combinación con JARDIANZ® DPP.
Fascitis necrotizante del perineo (gangrena de Fournier): Se han identificado informes de fascitis necrosante del perineo (gangrena de Fournier), una infección necrosante rara pero grave y potencialmente mortal que requiere intervención quirúrgica urgente, en pacientes con diabetes mellitus que reciben inhibidores de SGLT2, incluida empagliflozina. Se han notificado casos tanto en mujeres como en hombres. Los cuadros graves han incluido hospitalización, múltiples cirugías y muerte.
Los pacientes tratados con JARDIANZ® DPP que presenten dolor o sensibilidad, eritema o hinchazón en el área genital o perineal, junto con fiebre o malestar general, deben ser evaluados para detectar fascitis necrosante. Ante la sospecha, iniciar tratamiento inmediatamente con antibióticos de amplio espectro y, si es necesario, desbridamiento quirúrgico. Suspenda JARDIANZ® DPP, controle de cerca los niveles de glucosa en sangre y brinde una terapia alternativa adecuada para el control de la glucemia.
Infecciones genitales de origen micótico: La empagliflozina aumenta el riesgo de infecciones micóticas genitales [consulte Reacciones adversas (Experiencia en ensayos clínicos)]. Los pacientes con antecedentes de infecciones micóticas genitales crónicas o recurrentes tenían más probabilidades de desarrollar infecciones micóticas genitales. Supervisar y tratar según corresponda.
Reacciones de hipersensibilidad: Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad graves en pacientes tratados con linagliptina. Estas reacciones incluyen anafilaxia, angioedema y afecciones exfoliativas de la piel. El inicio de estas reacciones ocurrió predominantemente dentro de los primeros 3 meses después del inicio del tratamiento con linagliptina, y algunos informes ocurrieron después de la primera dosis.
También se ha informado angioedema con otros inhibidores de la dipeptidil peptidasa-4 (DPP-4). Tenga cuidado en un paciente con antecedentes de angioedema a otro inhibidor de DPP-4 porque se desconoce si dichos pacientes estarán predispuestos a angioedema con JARDIANZ® DPP.
Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad graves (p. ej., angioedema) en pacientes tratados con empaglifozina.
Si ocurre una reacción de hipersensibilidad, suspenda JARDIANZ® DPP, trate de inmediato según el estándar de atención y controle hasta que desaparezcan los signos y síntomas. JARDIANZ® DPP está contraindicado en pacientes con hipersensibilidad a la linagliptina, la empagliflozina o cualquiera de los excipientes de JARDIANZ® DPP [consulte Contraindicaciones].
Artralgia severa e incapacitante: Ha habido informes posteriores a la comercialización de artralgia grave e incapacitante en pacientes que toman inhibidores de la DPP-4. El tiempo de aparición de los síntomas después del inicio de la terapia con medicamentos varió de un día a años. Los pacientes experimentaron alivio de los síntomas al suspender el medicamento. Un subconjunto de pacientes experimentó una recurrencia de los síntomas al reiniciar el mismo fármaco o un inhibidor DPP-4 diferente. Considere como una posible causa de dolor articular intenso y suspenda el medicamento si corresponde.
Penfigoide ampolloso: Se informó penfigoide ampolloso en 7 (0,2%) pacientes tratados con linagliptina en comparación con ninguno de los pacientes tratados con placebo en el ensayo CARMELINA [consulte Estudios clínicos], y 3 de estos pacientes fueron hospitalizados debido a penfigoide ampolloso.Se han informado casos posteriores a la comercialización de penfigoide ampolloso que requirieron hospitalización con el uso de inhibidores de la DPP-4. En los casos informados, los pacientes generalmente se recuperaron con un tratamiento inmunosupresor tópico o sistémico y la interrupción del inhibidor de la DPP-4. Dígales a los pacientes que informen sobre el desarrollo de ampollas o erosiones mientras reciben JARDIANZ® DPP. Si se sospecha penfigoide ampolloso, se debe suspender JARDIANZ® DPP y se debe considerar la remisión a un dermatólogo para el diagnóstico y tratamiento adecuado.
Insuficiencia cardíaca: Se ha observado una asociación entre el tratamiento con inhibidores de DPP-4 y la insuficiencia cardíaca en ensayos de resultados cardiovasculares para otros dos miembros de la clase de inhibidores de DPP-4. Estos ensayos evaluaron pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica.
Considere los riesgos y beneficios de JARDIANZ® DPP antes de iniciar el tratamiento en pacientes con riesgo de insuficiencia cardíaca, como aquellos con antecedentes de insuficiencia cardíaca y antecedentes de insuficiencia renal, y observe a estos pacientes en busca de signos y síntomas de insuficiencia cardíaca durante la terapia. Informar a los pacientes sobre los síntomas característicos de la insuficiencia cardíaca y que informen inmediatamente sobre dichos síntomas. Si se desarrolla insuficiencia cardíaca, evalúe y maneje de acuerdo con los estándares de atención actuales y considere la interrupción de JARDIANZ® DPP.
REACCIONES ADVERSAS:
Las siguientes reacciones adversas importantes se describen a continuación y en otras partes del prospecto:
• Pancreatitis [consulte Advertencias y precauciones (Pancreatitis)].
• Cetoacidosis [consulte Advertencias y precauciones (Cetoacidosis)].
• Hipovolemia [consulte Advertencias y precauciones (Hipovolemia)].
• Urosepsis y pielonefritis [consulte Advertencias y precauciones (Urosepsis y pielonefritis)].
• Hipoglucemia con el uso concomitante con insulina y secretagogos de insulina [consulte Advertencias y precauciones (Hipoglucemia)].
• Fascitis necrosante del perineo (gangrena de Fournier) [consulte Advertencias y precauciones (Fascitis necrosante del perineo (gangrena de Fournier)].
• Infecciones micóticas genitales [consulte Advertencias y precauciones (Infecciones micóticas genitales)].
• Reacciones de hipersensibilidad [consulte Advertencias y precauciones (Reacciones de hipersensibilidad)].
• Artralgia grave e incapacitante [consulte Advertencias y precauciones (Artralgia grave e incapacitante)].
• Penfigoide ampolloso [consulte Advertencias y precauciones (Penfigoide ampolloso)].
• Insuficiencia cardíaca [consulte Advertencias y precauciones (Insuficiencia cardíaca)].
Experiencia en ensayos clínicos:
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Empagliflozina y linagliptina: La seguridad de la administración concomitante de empagliflozina (dosis diaria de 10 mg o 25 mg) y linagliptina (dosis diaria de 5 mg) se ha evaluado en un total de 1363 pacientes con diabetes tipo 2 tratados durante un máximo de 52 semanas en ensayos clínicos con control activo. Las reacciones adversas más comunes con la administración concomitante de empagliflozina y linagliptina según los análisis combinados de estos estudios se muestran en la Tabla 1.
Tabla 1. Reacciones adversas notificadas en ≥ 5% de los pacientes tratados con empagliflozina y linagliptina
|
Reacciones adversas |
JARDIANZ® DPP (%) 10 mg/5 mg n = 272 |
JARDIANZ® DPP (%) 25 mg/5 mg n = 273 |
|
Infección del tracto urinarioa |
12.5 |
11.4 |
|
Nasofaringitis |
5.9 |
6.6 |
|
Infección del tracto respiratorio superior |
7.0 |
7.0 |
a Agrupación predefinida de eventos adversos, que incluye, entre otros, infección del tracto urinario, bacteriuria asintomática, cistitis
Empagliflozina: Las reacciones adversas que ocurrieron en ≥ 2% de los pacientes que recibieron empagliflozina y con mayor frecuencia que en los pacientes que recibieron placebo incluyeron (10 mg, 25 mg y placebo): infección del tracto urinario (9.3%, 7.6% y 7.6%), micóticos genitales femeninos (5.4%, 6.4% y 1.5%), infección del tracto respiratorio superior (3.1%, 4.0% y 3.8%), aumento de la micción (3.4%, 3.2% y 1.0%), dislipidemia (3.9%, 2.9%, y 3.4%), artralgia (2.4%, 2.3% y 2.2%), infecciones micóticas genitales masculinas (3.1%, 1.6% y 0.4%) y náuseas (2.3%, 1.1% y 1.4%).
La sed (incluida la polidipsia) se notificó en el 0%, el 1.7% y el 1.5% con placebo, empagliflozina de 10 mg y empagliflozina de 25 mg, respectivamente.
La empagliflozina provoca una diuresis osmótica, que puede provocar una contracción del volumen intravascular y reacciones adversas relacionadas con la hipovolemia. Se informaron eventos relacionados con la hipovolemia (hipotensión y síncope) en 3 pacientes (1.1%) tratados con JARDIANZ® DPP más metformina.
Linagliptina: Las reacciones adversas notificadas en ≥ 2% de los pacientes tratados con linagliptina 5 mg y con mayor frecuencia que en los pacientes tratados con placebo incluyeron: nasofaringitis (7.0% y 6.1%), diarrea (3.3% y 3.0%) y tos (2.1% y 1.4%).
Otras reacciones adversas notificadas en estudios clínicos con el tratamiento de monoterapia con linagliptina fueron hipersensibilidad (p. ej., urticaria, angioedema, exfoliación cutánea localizada o hiperreactividad bronquial) y mialgia.
En el programa de ensayos clínicos, se notificó pancreatitis en 15.2 casos por exposición de 10 000 pacientes al año mientras se recibía tratamiento con linagliptina en comparación con 3.7 casos por exposición de 10 000 pacientes al año durante el tratamiento con el comparador (placebo y comparador activo, sulfonilurea). Se notificaron tres casos adicionales de pancreatitis después de la última dosis administrada de linagliptina.
Hipoglucemia: La Tabla 2 resume los informes de hipoglucemia con empagliflozina y linagliptina durante un período de tratamiento de 52 semanas.
Tabla 2. Incidencia de reacciones adversas hipoglucémicas generalesa y gravesb
|
Complemento de metformina (52 semanas) |
JARDIANZ® DPP (%) 10 mg/5 mg (n = 136) |
JARDIANZ® DPP (%) 25 mg/5 mg (n = 137) |
|
General |
2.2 |
3.6 |
|
Graves |
0 |
0 |
a Eventos hipoglucémicos generales: glucosa plasmática o capilar de menor o igual a 70 mg/dL o que requiere asistencia.
b Eventos hipoglucémicos graves: que requieren asistencia independientemente de la glucosa en sangre.
Pruebas de laboratorio:
Empagliflozina y linagliptina: Los cambios en los resultados de laboratorio en pacientes tratados con la combinación de empagliflozina y linagliptina incluyeron aumentos en el colesterol y el hematocrito en comparación con el valor inicial.
Empagliflozina:
Aumentos en la creatinina sérica y disminuciones en TFGe: El inicio de la empagliflozina provoca un aumento de la creatinina sérica y una disminución de la TFGe a las pocas semanas de iniciar el tratamiento y luego estos cambios se estabilizan. En un estudio de pacientes con insuficiencia renal moderada, se observaron cambios medios mayores. En un ensayo de resultados cardiovasculares a largo plazo, el aumento de la creatinina sérica y la disminución de la TFGe generalmente no excedieron 0.1 mg/dL y -9.0 mL/min/1.73 m2, respectivamente, en la semana 4 y se revirtieron después de la interrupción del tratamiento, lo que sugiere los cambios hemodinámicos pueden desempeñar un papel en los cambios de la función renal observados con empagliflozina.
Aumento del colesterol de lipoproteínas de baja densidad (LDL-C): Se observaron aumentos relacionados con la dosis en el colesterol de lipoproteínas de baja densidad (LDL-C) en pacientes tratados con empagliflozina. El C-LDL aumentó un 2.3%, 4.6% y 6.5% en pacientes tratados con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente. El rango de niveles basales medios de LDL-C fue de 90.3 a 90.6 mg/dL en todos los grupos de tratamiento.
Aumento del hematocrito: El hematocrito medio disminuyó un 1.3% en los pacientes tratados con placebo y aumentó un 2.8% en los pacientes tratados con empagliflozina 10 mg y un 2.8% en los pacientes tratados con empagliflozina 25 mg. Al final del tratamiento, el 0.6%, el 2.7% y el 3.5% de los pacientes con hematocritos inicialmente dentro del rango de referencia tenían valores por encima del límite superior del rango de referencia con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente.
Linagliptina:
Aumento de ácido úrico: Los cambios en los valores de laboratorio que ocurrieron con mayor frecuencia en el grupo de linagliptina y ≥ 1% más que en el grupo de placebo fueron aumentos en el ácido úrico (1.3% en el grupo de placebo, 2.7% en el grupo de linagliptina).
Aumento de la lipasa: En un ensayo clínico controlado con placebo con linagliptina en pacientes con diabetes mellitus tipo 2 con micro o macroalbuminuria, se observó un aumento medio del 30% en las concentraciones de lipasa desde el inicio hasta las 24 semanas en el brazo de linagliptina en comparación con una disminución media del 2% en el brazo de placebo. Se observaron niveles de lipasa mayores a 3 veces el límite superior normal en el 8.2% en comparación con el 1.7% de los pacientes en los brazos de linagliptina y placebo, respectivamente.
Aumento de amilasa: En un estudio de seguridad cardiovascular que comparó linagliptina versus glimepirida en pacientes con diabetes mellitus tipo 2, se observaron niveles de amilasa mayores a 3 veces el límite superior normal en el 1.0% en comparación con el 0.5% de los pacientes en los brazos de linagliptina y glimepirida, respectivamente.
Se desconoce la importancia clínica de las elevaciones de lipasa y amilasa con linagliptina en ausencia de otros signos y síntomas de pancreatitis. [Consulte Advertencias y precauciones (Pancreatitis)].
Experiencia posterior a la comercialización:
Se han identificado reacciones adversas adicionales durante el uso posterior a la aprobación de linagliptina y empagliflozina. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos gastrointestinales: Pancreatitis aguda, incluida la pancreatitis mortal [consulte Indicaciones y uso], estreñimiento, ulceración de la boca, estomatitis.
Trastornos del sistema inmunológico: Reacciones de hipersensibilidad que incluyen anafilaxia, angioedema y afecciones cutáneas exfoliativas.
Infecciones: Fascitis necrotizante del perineo (gangrena de Fournier), urosepsis y pielonefritis.
Trastornos del metabolismo y la nutrición: Cetoacidosis.
Trastornos musculoesqueléticos y del tejido conectivo: Rabdomiólisis, artralgia severa e incapacitante.
Trastornos renales y urinarios: Lesión renal aguda.
Trastornos de la piel y del tejido subcutáneo: Penfigoide ampolloso. Reacciones cutáneas (p. ej., erupción cutánea, urticaria)
INTERACCIONES CON FÁRMACOS:
Tabla 3. Interacciones clínicamente relevantes con JARDIANZ® DPP
|
Diuréticos |
|
|
Impacto clínico |
La coadministración de empagliflozina con diuréticos resultó en un aumento del volumen de orina y de la frecuencia de las micciones, lo que podría aumentar el potencial de depleción del volumen. |
|
Intervención |
Antes de iniciar JARDIANZ® DPP, evalúe el estado del volumen y la función renal. En pacientes con hipovolemia, corrija esta condición antes de iniciar JARDIANZ® DPP. Monitoree los signos y síntomas de hipovolemia y la función renal después de iniciar el tratamiento. |
|
Insulina o secretagogos de insulina |
|
|
Impacto clínico |
El riesgo de hipoglucemia aumenta cuando se usa JARDIANZ® DPP en combinación con un secretagogo de insulina (p. ej., sulfonilurea) o insulina. |
|
Intervención |
La coadministración de JARDIANZ® DPP con un secretagogo de insulina (p. ej., sulfonilurea) o insulina puede requerir dosis más bajas del secretagogo de insulina o insulina para reducir el riesgo de hipoglucemia. |
|
Inductores de la glicoproteína P o enzimas CYP3A4 |
|
|
Impacto clínico |
La rifampicina disminuyó la exposición a la linagliptina, lo que sugiere que la eficacia de la linagliptina puede reducirse cuando se administra en combinación con un inductor potente de la gp-P o CYP3A4 |
|
Intervención |
Se recomienda encarecidamente el uso de tratamientos alternativos cuando se va a administrar linagliptina con un inductor potente de la gp-P o del CYP3A4 |
|
Litio |
|
|
Impacto clínico |
El uso concomitante de un inhibidor de SGLT2 con litio puede disminuir las concentraciones séricas de litio |
|
Intervención |
Controle la concentración sérica de litio con más frecuencia durante el inicio de JARDIANZ® DPP y los cambios de dosis. |
|
Prueba de glucosa en orina positiva |
|
|
Impacto clínico |
Los inhibidores de SGLT2 aumentan la excreción de glucosa en orina y darán lugar a pruebas de glucosa en orina positivas. |
|
Intervención |
No se recomienda monitorear el control glucémico con pruebas de glucosa en orina en pacientes que toman inhibidores SGLT2. Use métodos alternativos para monitorear el control glucémico. |
|
Interferencia con el ensayo de 1,5-anhidroglucitol (1,5-AG) |
|
|
Impacto clínico |
Las mediciones de 1,5-AG no son confiables para evaluar el control glucémico en pacientes que toman inhibidores de SGLT2. |
|
Intervención |
No se recomienda monitorear el control glucémico con el ensayo 1,5-AG. Use métodos alternativos para monitorear el control glucémico. |
FARMACOLOGÍA CLÍNICA:
Mecanismo de acción:
JARDIANZ® DPP contiene: Empagliflozina, un inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT2), y linagliptina, un inhibidor de la dipeptidil peptidasa-4 (DPP-4).
Empagliflozina: La empagliflozina es un inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT2) es el transportador predominante responsable de la reabsorción de glucosa desde el filtrado glomerular hacia la circulación. Al inhibir SGLT2, la empagliflozina reduce la reabsorción renal de la glucosa filtrada y reduce el umbral renal para la glucosa y, por lo tanto, aumenta la excreción urinaria de glucosa.
Linagliptina: La linagliptina es un inhibidor de la DPP-4, una enzima que degrada las hormonas incretinas, el péptido 1 similar al glucagón (GLP-1) y el polipéptido insulinotrópico dependiente de glucosa (GIP). Así, la linagliptina aumenta las concentraciones de hormonas incretinas activas, estimulando la liberación de insulina de forma dependiente de la glucosa y disminuyendo los niveles de glucagón en la circulación. Ambas hormonas incretinas están implicadas en la regulación fisiológica de la homeostasis de la glucosa. Las hormonas incretinas se secretan a un nivel basal bajo a lo largo del día y los niveles aumentan inmediatamente después de la ingesta de alimentos. GLP-1 y GIP aumentan la biosíntesis de insulina y la secreción de las células beta pancreáticas en presencia de niveles de glucosa en sangre normales y elevados. Además, GLP-1 también reduce la secreción de glucagón de las células alfa pancreáticas, lo que da como resultado una reducción en la producción de glucosa hepática.
Farmacodinámica:
Empagliflozina:
Excreción de glucosa en orina: En pacientes con diabetes tipo 2, la excreción urinaria de glucosa aumentó inmediatamente después de una dosis de empagliflozina, y se mantuvo al final de un período de tratamiento de 4 semanas con un promedio de aproximadamente 64 gramos por día con 10 mg de empagliflozina y 78 gramos por día con 25 mg de empagliflozina una vez al día. Los datos de dosis orales únicas de empagliflozina en sujetos sanos indican que, en promedio, la elevación de la excreción urinaria de glucosa se aproxima al valor inicial en aproximadamente 3 días para las dosis de 10 mg y 25 mg.
Volumen urinario: En un estudio de 5 días, el aumento medio del volumen de orina en 24 horas desde el inicio fue de 341 ml el día 1 y de 135 ml el día 5 del tratamiento con 25 mg de empagliflozina una vez al día.
Electrofisiología cardíaca: En un estudio cruzado, aleatorizado, controlado con placebo, con comparador activo, a 30 sujetos sanos se les administró una dosis oral única de 25 mg de empagliflozina, 200 mg de empagliflozina (8 veces la dosis máxima recomendada), moxifloxacina y placebo. No se observó ningún aumento en el intervalo QTc con 25 mg o 200 mg de empagliflozina.
Linagliptina: La linagliptina se une a la DPP-4 de forma reversible y aumenta las concentraciones de hormonas incretinas. La linagliptina aumenta la secreción de insulina de forma dependiente de la glucosa y reduce la secreción de glucagón, lo que da como resultado una mejor regulación de la homeostasis de la glucosa. La linagliptina se une selectivamente a la DPP-4 e inhibe selectivamente la DPP-4, pero no la actividad in vitro de la DPP-8 o la DPP-9 en concentraciones que se aproximan a las exposiciones terapéuticas.
Electrofisiología cardíaca: En un estudio cruzado de 4 vías, aleatorizado, controlado con placebo, con comparador activo, a 36 sujetos sanos se les administró una dosis oral única de 5 mg de linagliptina, 100 mg de linagliptina (20 veces la dosis recomendada), moxifloxacina y placebo. No se observó aumento en el QTc ni con la dosis recomendada de 5 mg ni con la dosis de 100 mg. Con la dosis de 100 mg, las concentraciones plasmáticas máximas de linagliptina fueron aproximadamente 38 veces más altas que las concentraciones máximas después de una dosis de 5 mg.
Farmacocinética:
JARDIANZ® DPP: La administración de la combinación de dosis fija con alimentos no produjo cambios en la exposición general de empagliflozina o linagliptina; sin embargo, la exposición máxima disminuyó un 39% y un 32% para la empagliflozina y la linagliptina, respectivamente. No es probable que estos cambios sean clínicamente significativos.
Absorción:
Empagliflozina: La farmacocinética de la empagliflozina se ha caracterizado en voluntarios sanos y pacientes con diabetes tipo 2 y no se observaron diferencias clínicamente relevantes entre las dos poblaciones. Después de la administración oral, las concentraciones plasmáticas máximas de empagliflozina se alcanzaron 1,5 horas después de la dosis. Posteriormente, las concentraciones plasmáticas disminuyeron de manera bifásica con una fase de distribución rápida y una fase terminal relativamente lenta. El AUC y la Cmáx plasmáticos medios en estado estacionario fueron 1870 nmol• h/L y 259 nmol/L, respectivamente, con 10 mg de empagliflozina una vez al día, y 4740 nmol• h/L y 687 nmol/L, respectivamente, con 25 mg de empagliflozina una vez al día. La exposición sistémica a la empagliflozina aumentó de manera proporcional a la dosis en el rango de dosis terapéuticas. Los parámetros farmacocinéticos de una sola dosis y de estado de estacionario de la empagliflozina fueron similares, lo que sugiere una farmacocinética lineal con respecto al tiempo.
La administración de 25 mg de empagliflozina después de la ingesta de una comida rica en grasas y calorías resultó en una exposición ligeramente menor; el AUC disminuyó aproximadamente un 16% y la Cmáx disminuyó aproximadamente un 37%, en comparación con la condición en ayunas. El efecto observado de los alimentos sobre la farmacocinética de la empagliflozina no se consideró clínicamente relevante y la empagliflozina se puede administrar con o sin alimentos.
Linagliptina: La biodisponibilidad absoluta de la linagliptina es de aproximadamente el 30%. La comida rica en grasas redujo la Cmáx en un 15% y aumentó el AUC en un 4%; este efecto no es clínicamente relevante. La linagliptina se puede administrar con o sin alimentos.
Distribución:
Empagliflozina: El volumen de distribución aparente en estado estacionario se estimó en 73.81 según un análisis farmacocinético poblacional. Después de la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, el reparto de glóbulos rojos fue de aproximadamente 36,8% y la unión a proteínas plasmáticas fue de 86.2%.
Linagliptina: El volumen de distribución aparente medio en el estado estacionario después de una dosis intravenosa única de 5 mg de linagliptina en sujetos sanos es de aproximadamente 1110 L, lo que indica que la linagliptina se distribuye ampliamente en los tejidos. La unión a proteínas plasmáticas de la linagliptina depende de la concentración, disminuyendo de aproximadamente el 99% a 1 nmol/l al 75% al 89% a ≥ 30 nmol/l, lo que refleja la saturación de la unión a DPP-4 con el aumento de la concentración de linagliptina. A altas concentraciones, donde la DPP-4 está totalmente saturada, del 70% al 80% de la linagliptina permanece unida a las proteínas plasmáticas y del 20% al 30% no se une al plasma. La unión plasmática no se altera en pacientes con insuficiencia renal o hepática.
Eliminación:
Empagliflozina: La semivida de eliminación terminal aparente de la empagliflozina se estimó en 12,4 h y el aclaramiento oral aparente fue de 10.6 L/h según el análisis farmacocinético poblacional. Después de la administración una vez al día, se observó una acumulación de hasta un 22%, con respecto al AUC plasmático, en el estado estacionario, lo que coincidió con la vida media de la empagliflozina.
Linagliptina: La linagliptina tiene una vida media terminal de unas 200 horas en estado estacionario, aunque la vida media de acumulación es de unas 11 horas. El aclaramiento renal en el estado estacionario fue de aproximadamente 70 ml/min.
Metabolismo:
Empagliflozina: No se detectaron metabolitos principales de empagliflozina en plasma humano y los metabolitos más abundantes fueron tres conjugados de glucurónido (2-O-, 3-O- y 6-O-glucurónido). La exposición sistémica de cada metabolito fue inferior al 10% del material total relacionado con el fármaco. Los estudios in vitro sugirieron que la principal ruta de metabolismo de la empagliflozina en humanos es la glucuronidación por las uridina 5’-difosfo-glucuronosiltransferasas UGT2B7, UGT1A3, UGT1A8 y UGT1A9.
Linagliptina: Después de la administración oral, la mayoría (alrededor del 90%) de la linagliptina se excreta sin cambios, lo que indica que el metabolismo representa una vía de eliminación menor. Una pequeña fracción de la linagliptina absorbida se metaboliza a un metabolito farmacológicamente inactivo, que muestra una exposición en estado estacionario del 13.3% en relación con la linagliptina.
Excreción:
Empagliflozina: Tras la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, aproximadamente el 95.6% de la radiactividad relacionada con el fármaco se eliminó en heces (41.2%) u orina (54.4%). La mayor parte de la radiactividad relacionada con el fármaco recuperada en las heces era el fármaco original inalterado y aproximadamente la mitad de la radiactividad relacionada con el fármaco excretada en la orina era el fármaco original inalterado.
Linagliptina: Después de la administración de una dosis oral de [14C]-linagliptina a sujetos sanos, aproximadamente el 85% de la radiactividad administrada se eliminó a través del sistema enterohepático (80%) o la orina (5%) en los 4 días posteriores a la administración.
Poblaciones específicas:
Insuficiencia renal: JARDIANZ® DPP: No se han realizado estudios que caractericen la farmacocinética de empagliflozina y linagliptina después de la administración de JARDIANZ® DPP en pacientes con insuficiencia renal.
Empagliflozina: En pacientes con insuficiencia renal leve (TFGe: de 60 a menos de 90 mL/min/1,73 m2), moderada (TFGe: de 30 a menos de 60 mL/min/1.73 m2) y grave (TFGe: menos de 30 mL/min/1.73 m2) y pacientes en diálisis por falla renal, el AUC de empagliflozina aumentó aproximadamente un 18%, 20%, 66% y 48%, respectivamente, en comparación con sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron similares en pacientes con insuficiencia renal moderada y falla renal en comparación con sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron aproximadamente un 20% más altos en pacientes con insuficiencia renal leve y grave en comparación con sujetos con función renal normal. El análisis farmacocinético poblacional mostró que el aclaramiento oral aparente de empagliflozina disminuyó, con una disminución en la TFGe que conduce a un aumento en la exposición al fármaco. Sin embargo, la fracción de empagliflozina que se excretó sin cambios en la orina y la excreción urinaria de glucosa disminuyó con la disminución de la TFGe.
Linagliptina: Un estudio farmacocinético abierto evaluó la farmacocinética de 5 mg de linagliptina en pacientes masculinos y femeninos con diversos grados de insuficiencia renal crónica. El estudio incluyó a 6 sujetos sanos con función renal normal (aclaramiento de creatinina [CrCl] ≥ 80 ml/min), 6 pacientes con insuficiencia renal leve (CrCl 50 a < 80 ml/min), 6 pacientes con insuficiencia renal moderada (CrCl 30 a < 80 ml/min), 6 pacientes con insuficiencia renal moderada (CrCl 30 a < 50 mL/min), 10 pacientes con diabetes tipo 2 e insuficiencia renal grave (CrCl < 30 mL/min) y 11 pacientes con diabetes tipo 2 y función renal normal. El aclaramiento de creatinina se midió mediante mediciones del aclaramiento de creatinina en orina de 24 horas o se estimó a partir de la creatinina sérica según la fórmula de Cockcroft-Gault.
En condiciones de estado estacionario, la exposición a linagliptina en pacientes con insuficiencia renal leve fue comparable a la de sujetos sanos.
En pacientes con insuficiencia renal moderada en condiciones de estado estacionario, la exposición media de linagliptina aumentó (AUCτ,ss en un 71% y Cmáx en un 46%) en comparación con sujetos sanos. Este aumento no se asoció con una vida media de acumulación prolongada, una vida media terminal o un factor de acumulación aumentado. La excreción renal de linagliptina fue inferior al 5% de la dosis administrada y no se vio afectada por la disminución de la función renal. Los pacientes con diabetes tipo 2 e insuficiencia renal grave mostraron una exposición en estado estacionario aproximadamente un 40% mayor que la de los pacientes con diabetes tipo 2 y función renal normal (aumento del AUCτ,ss en un 42% y Cmáx en un 35%). Para ambos grupos de diabetes tipo 2, la excreción renal fue inferior al 7% de la dosis administrada.
Estos hallazgos fueron respaldados aún más por los resultados de los análisis farmacocinéticos poblacionales.
Insuficiencia hepática:
JARDIANZ® DPP: No se han realizado estudios que caractericen la farmacocinética de empagliflozina y linagliptina después de la administración de JARDIANZ® DPP en pacientes con insuficiencia hepática.
Empagliflozina: En pacientes con insuficiencia hepática leve, moderada y grave según la clasificación de Child-Pugh, el AUC de la empagliflozina aumentó aproximadamente un 23%, 47% y 75% y la Cmáx aumentó aproximadamente un 4%, 23% y 48%, respectivamente., en comparación con sujetos con función hepática normal.
Linagliptina: En pacientes con insuficiencia hepática leve (clase A de Child-Pugh), la exposición en estado estacionario (AUCτ,ss) de linagliptina fue aproximadamente un 25% más baja y la Cmáx, ss fue aproximadamente un 36% más baja que en sujetos sanos. En pacientes con insuficiencia hepática moderada (clase B de Child-Pugh), el AUCss de linagliptina fue aproximadamente un 14% más bajo y la Cmáx, ss fue aproximadamente un 8% más baja que en sujetos sanos. Los pacientes con insuficiencia hepática grave (Child-Pugh clase C) tuvieron una exposición comparable a la linagliptina en términos de AUC0-24 y aproximadamente un 23% menos de Cmáx en comparación con los sujetos sanos. Las reducciones en los parámetros farmacocinéticos observados en pacientes con insuficiencia hepática no resultaron en reducciones en la inhibición de DPP-4.
Efectos de la edad, el índice de masa corporal, el sexo y la raza:
Empagliflozina: Según el análisis farmacocinético de la población, la edad, el índice de masa corporal (IMC), el sexo y la raza (asiáticos versus principalmente blancos) no tienen un efecto clínicamente significativo sobre la farmacocinética de la empagliflozina [consulte Uso en poblaciones específicas (Uso geriátrico)].
Linagliptina: Según el análisis farmacocinético de la población, la edad, el índice de masa corporal (IMC), el sexo y la raza no tienen un efecto clínicamente significativo sobre la farmacocinética de la linagliptina [consulte Uso en poblaciones específicas (Uso geriátrico)].
Interacciones con fármacos:
Estudios farmacocinéticos de interacciones farmacológicas con JARDIANZ® DPP no se han realizado; sin embargo, dichos estudios se han realizado con los componentes individuales de JARDIANZ® DPP (empagliflozina y linagliptina).
Empagliflozina:
Evaluación in vitro de interacciones farmacológicas: La empagliflozina no inhibe, inactiva ni induce las isoformas CYP450. Los datos in vitro sugieren que la principal vía de metabolismo de la empagliflozina en humanos es la glucuronidación por las uridina 5’-difosfo-glucuronosiltransferasas UGT1A3, UGT1A8, UGT1A9 y UGT2B7. La empagliflozina no inhibe UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. Por lo tanto, no se anticipa ningún efecto de la empagliflozina con medicamentos administrados de manera concomitante que son sustratos de las isoformas principales de CYP450 o UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. No se ha evaluado el efecto de la inducción de UGT (p. ej., inducción por rifampicina o cualquier otro inductor de la enzima UGT) sobre la exposición a empagliflozina.
La empagliflozina es un sustrato para la glicoproteína P (P-gp) y la proteína resistente al cáncer de mama (BCRP), pero no inhibe estos transportadores de salida a dosis terapéuticas. Según los estudios in vitro, se considera poco probable que la empagliflozina cause interacciones con fármacos que son sustratos de la P-gp. La empagliflozina es un sustrato de los transportadores de captación humanos OAT3, OATP1B1 y OATP1B3, pero no de OAT1 y OCT2. La empagliflozina no inhibe ninguno de estos transportadores de captación humanos a concentraciones plasmáticas clínicamente relevantes y, por lo tanto, no se prevé ningún efecto de la empagliflozina con los fármacos administrados de forma concomitante que son sustratos de estos transportadores de captación.
Evaluación in vivo de interacciones farmacológicas: La farmacocinética de empagliflozina fue similar con y sin coadministración de metformina, glimepirida, pioglitazona, sitagliptina, linagliptina, warfarina, verapamilo, ramipril y simvastatina en voluntarios sanos y con o sin coadministración de hidroclorotiazida y torsemida en pacientes con diabetes tipo 2 (ver Figura 1). En sujetos con función renal normal, la coadministración de empagliflozina con probenecid resultó en una disminución del 30% en la fracción de empagliflozina excretada en la orina sin ningún efecto sobre la excreción de glucosa en orina de 24 horas. Se desconoce la relevancia de esta observación para los pacientes con insuficiencia renal.
Figura 1. Efecto de diversos medicamentos sobre la farmacocinética de la empagliflozina según se muestra como un intervalo de confianza del 90% de la media geométrica del AUC y relaciones Cmáx [las líneas de referencia indican el 100% (80%-125%)]
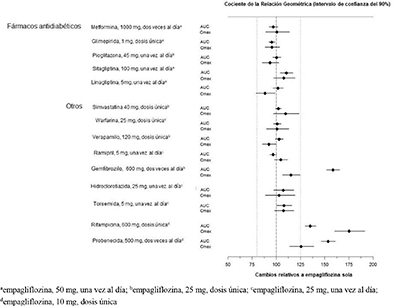
La empagliflozina no tuvo un efecto clínicamente relevante sobre la farmacocinética de la metformina, la glimepirida, la pioglitazona, la sitagliptina, la linagliptina, la warfarina, la digoxina, el ramipril, la simvastatina, la hidroclorotiazida, la torsemida y los anticonceptivos orales cuando se administraron conjuntamente en voluntarios sanos (consulte la Figura 2).
Figura 2. Efecto de la empagliflozina sobre la farmacocinética de varios medicamentos, como se muestra como un intervalo de confianza del 90% de la media geométrica del AUC y relaciones Cmáx [las líneas de referencia indican 100% (80%-125%)]
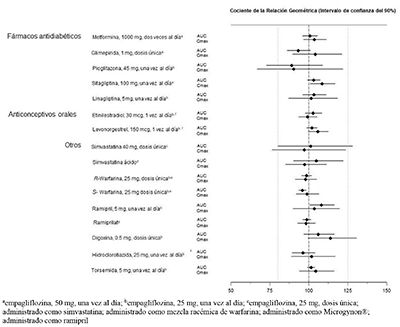
Linagliptina:
Evaluación in vitro de interacciones farmacológicas: La linagliptina es un inhibidor de débil a moderado de la isozima CYP CYP3A4, pero no inhibe otras isozimas CYP y no es un inductor de las isozimas CYP, incluidas CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 y 4A11.
La linagliptina es un sustrato de la glicoproteína P (P-gp) e inhibe el transporte de digoxina mediado por la P-gp en concentraciones elevadas. Según estos resultados y los estudios de interacción farmacológica in vivo, se considera poco probable que la linagliptina provoque interacciones con otros sustratos de la P-gp a concentraciones terapéuticas.
Evaluación in vivo de interacciones farmacológicas: Los inductores potentes de CYP3A4 o P-gp (p. ej., rifampicina) reducen la exposición a la linagliptina a concentraciones subterapéuticas y probablemente ineficaces [consulte Interacciones farmacológicas]. Los estudios in vivo indicaron evidencia de una baja propensión a causar interacciones farmacológicas con sustratos de CYP3A4, CYP2C9, CYP2C8, P-gp y transportador catiónico orgánico (OCT).
Tabla 4. Efecto de los fármacos coadministrados sobre la exposición sistémica a la linagliptina
|
Medicamento coadministrado |
Dosificación de fármacos coadministradosa |
Dosificación de Linagliptina |
Relación media geométrica (relación con/sin fármaco coadministrado) Sin efecto = 1.0 |
|
|
ABCd |
Cmáx |
|||
|
Metformina |
850 mg TID |
10 mg QD |
1.20 |
1.03 |
|
Gliburida |
1,75 mgc |
5 mg QD |
1.02 |
1.01 |
|
Pioglitazona |
45 mg QD |
10 mg QD |
1.13 |
1.07 |
|
Ritonavir |
200 mg BID |
5 mgc |
2.01 |
2.96 |
|
Rifampicinab |
600 mg QD |
5 mg QD |
0.60 |
0.56 |
a Dosis múltiple (estado estacionario) a menos que se indique lo contrario.
b Para obtener información sobre las recomendaciones clínicas [consulte Interacciones farmacológicas].
c Dosis única.
d AUC = AUC(0 a 24 horas) para tratamientos de dosis única y AUC = AUC(TAU) para tratamientos de dosis múltiples.
QD = una vez al día.
BID = dos veces al día.
TID = tres veces al día.
Tabla 5. Efecto de la linagliptina sobre la exposición sistémica de fármacos coadministrados
|
Medicamento coadministrado |
Dosificación del fármaco coadministradoa |
Dosificación de linagliptinaa |
Relación media geométrica (relación con/sin fármaco coadministrado) Sin efecto = 1.0 |
||
|
AUCc |
Cmáx |
||||
|
Metformina |
850 mg TID |
10 mg QD |
Metformina |
1.01 |
0.89 |
|
Gliburida |
1.75 mgb |
5 mg QD |
Gliburida |
0.86 |
0.86 |
|
Pioglitazona |
45 mg QD |
10 mg QD |
Pioglitazonametabolito M-IIImetabolito M-IV |
0.94 0.98 1.04 |
0.86 0.96 1.05 |
|
Digoxina |
0,25 mg QD |
5 mg QD |
Digoxina |
1.02 |
0.94 |
|
Simvastatina |
40 mg QD |
10 mg QD |
Simvastatina ácido de Simvastatina |
1.34 1.33 |
1.10 1.21 |
|
Warfarina |
10 mgb |
5 mg QD |
R-warfarina S-warfarina USD PT |
0.99 1.03 0.93d 1.03d |
1.00 1.01 1.04d 1.15d |
|
Etinilestradiol y levonorgestrel |
Etinilestradiol 0,03 mg y levonorgestrel 0,150 mg QD |
5 mg QD |
Etinilestradiol levonorgestrel |
1.01 1.09 |
1.08 1.13 |
a Dosis múltiple (estado estacionario) a menos que se indique lo contrario.
b Dosis única.
c AUC = AUC(INF) para tratamientos de dosis única y AUC = AUC(TAU) para tratamientos de dosis múltiples.
d AUC=AUC(0-168) y Cmáx = Emax para criterios de valoración farmacodinámicos.
INR = Razón Internacional Normalizada.
PT = Tiempo de protrombina.
QD = una vez al día.
TID = tres veces al día.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Estudios clínicos:
Estudios de control glucémico JARDIANZ® DPP:
Terapia combinada complementaria con metformina: Un total de 686 pacientes con diabetes tipo 2 participaron en un estudio doble ciego con control activo para evaluar la eficacia y seguridad de empagliflozin 10 mg o 25 mg en combinación con linagliptina 5 mg en comparación con los componentes individuales.
Los pacientes con diabetes tipo 2 controlados inadecuadamente con al menos 1500 mg de metformina por día, ingresaron a un período de prueba simple ciego con placebo durante 2 semanas. Al final del período de preinclusión, los pacientes que permanecieron controlados inadecuadamente y tenían una HbA1c entre 7% y 10.5% fueron aleatorizados 1:1:1:1:1 a uno de los 5 brazos de tratamiento activo de empagliflozina 10 mg o 25 mg, linagliptina 5 mg o linagliptina 5 mg en combinación con 10 mg o 25 mg de empagliflozina como tableta combinada de dosis fija.
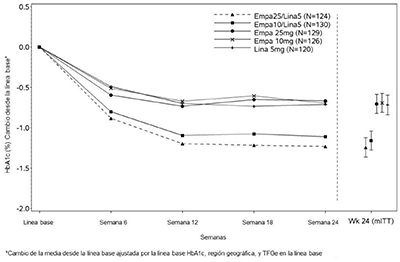
En la semana 24, empagliflozina 10 mg o 25 mg utilizada en combinación con linagliptina 5 mg proporcionó una mejora estadísticamente significativa en HbA1c (valor de p < 0,0001) y GPA (valor de p < 0,001) en comparación con los componentes individuales en pacientes que no habían sido tratados adecuadamente, controlados con metformina (ver Tabla 6, Figura 3). El tratamiento con JARDIANZ® DPP 25 mg/5 mg o JARDIANZ® DPP 10 mg/5 mg al día también resultó en una reducción estadísticamente significativa del peso corporal en comparación con linagliptina 5 mg (valor p < 0,0001). No hubo diferencias estadísticamente significativas en comparación con la empagliflozina sola.
Tabla 6. Parámetros glucémicos a las 24 semanas en un estudio que compara JARDIANZ® DPP con los componentes individuales como terapia adicional en pacientes controlados inadecuadamente con metformina
|
JARDIANZ® DPP 10 mg/5 mg |
JARDIANZ® DPP 25 mg/5 mg |
Empagliflozina 10 mg |
Empagliflozina 25 mg |
Linagliptina 5 mg |
|
|
HbA1c (%) |
|||||
|
Número de pacientes |
n = 135 |
n = 133 |
n = 137 |
n = 139 |
n = 128 |
|
Línea de base (media) |
8.0 |
7.9 |
8.0 |
8.0 |
8.0 |
|
Cambio desde la línea de base (media ajustada) |
-1.1 |
-1.2 |
-0.7 |
-0.6 |
-0.7 |
|
Comparación vs empagliflozina 25 mg o 10 mg (media ajustada) (95% IC)a |
-0,4 (0,6, 0,2)d |
-0,6 (0,7, 0,4)d |
- |
- |
- |
|
Comparación vs linagliptina 5 mg (media ajustada) (IC del 95%)a |
-0,4 (0,6, 0,2)d |
-0,5 (0,7, 0,3)d |
- |
- |
- |
|
Pacientes [n (%)] que alcanzaron HbA1c < 7%b |
74 (58) |
76 (62) |
35 (28) |
43 (33) |
43 (36) |
|
GPA (mg/dL) |
|||||
|
Número de pacientes |
n = 133 |
n = 131 |
n = 136 |
n = 137 |
n = 125 |
|
Línea de base (media) |
157 |
155 |
162 |
160 |
156 |
|
Cambio desde la línea de base (media ajustada) |
-33 |
-36 |
-21 |
-21 |
-13 |
|
Comparación vs empagliflozina 25 mg o 10 mg (media ajustada) (95% IC)a |
-12 (-18, -5)d |
-15 (-22, -9)d |
- |
- |
- |
|
Comparación vs linagliptina 5 mg (media ajustada) (IC del 95%)a |
-20 (-27, -13)d |
-23 (-29, -16)d |
- |
- |
- |
|
Peso corporal |
|||||
|
Número de pacientes |
n = 135 |
n = 134 |
n = 137 |
n = 140 |
n = 128 |
|
Línea de base (media) en kg |
87 |
85 |
86 |
88 |
85 |
|
% de cambio desde el inicio (media ajustada) |
-3.1 |
-3.4 |
-3.0 |
-3.5 |
-0.7 |
|
Comparación vs empagliflozina 25 mg o 10 mg (media ajustada) (95% IC)c |
0.0 (-0.9, 0.8) |
0.1 (-0.8, 0.9) |
- |
- |
- |
|
Comparación vs linagliptina 5 mg (media ajustada) (IC del 95%)c |
-2.4 (-3.3, -1.5)d |
-2.7 (-3.6, -1.8)d |
- |
- |
- |
a Población de análisis completo (caso observado) utilizando MMRM. El modelo MMRM incluyó el tratamiento, la función renal, la región, la visita, la interacción visita por tratamiento y la HbA1c inicial.
b Pacientes con HbA1c superior al 7% al inicio: JARDIANZ® DPP 25 mg/5 mg, n = 123; JARDIANZ® DPP 10 mg/5 mg, n = 128; empagliflozina 25 mg, n = 132; empagliflozina 10 mg, n = 125; linagliptina 5 mg, n = 119. Los que no completaron fueron considerados fracasos (NCF).
c Población de análisis completo utilizando la última observación realizada. El modelo ANCOVA incluyó tratamiento, función renal, región, peso inicial y HbA1c inicial.
d p < 0.001 para FPG; p < 0.0001 para HbA1c y peso corporal.
Figura 3. Cambio medio ajustado de HbA1c en cada punto temporal (completadores) y en la Semana 24 (población mITT)
Estudio de resultados cardiovasculares de empagliflozina en pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica: La empagliflozina está indicada para reducir el riesgo de muerte cardiovascular en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida. A continuación se presenta el efecto de la empagliflozina sobre el riesgo cardiovascular en pacientes adultos con diabetes tipo 2 y enfermedad cardiovascular aterosclerótica establecida y estable.
El estudio EMPA-REG OUTCOME, un ensayo de grupos paralelos, multicéntrico, multinacional, aleatorizado, doble ciego, comparó el riesgo de experimentar un evento cardiovascular adverso mayor (MACE) entre empagliflozina y placebo cuando éstos se agregaron y se usaron concomitantemente con tratamientos asistenciales estandarizados para la diabetes y la enfermedad cardiovascular aterosclerótica. Los medicamentos antidiabéticos coadministrados debían mantenerse estables durante las primeras 12 semanas del ensayo. Posteriormente, las terapias antidiabéticas y ateroscleróticas podrían ajustarse, a discreción de los investigadores, para garantizar que los participantes fueran tratados de acuerdo con la atención estándar para estas enfermedades.
Se trató un total de 7020 pacientes (empagliflozina 10 mg = 2345; empagliflozina 25 mg = 2342; placebo = 2333) y se siguió durante una mediana de 3,1 años. Aproximadamente el 72% de la población del estudio era caucásica, el 22% era asiática y el 5% era negra. La edad media fue de 63 años y aproximadamente el 72% eran hombres.
Todos los pacientes del estudio tenían diabetes mellitus tipo 2 inadecuadamente controlada al inicio del estudio (HbA1c mayor o igual al 7%). La HbA1c media al inicio del estudio fue del 8.1% y el 57% de los participantes tenían diabetes durante más de 10 años. Aproximadamente el 31%, el 22% y el 20% informaron antecedentes de neuropatía, retinopatía y nefropatía a los investigadores, respectivamente, y la TFGe media fue de 74 ml/min/1.73 m2. Al inicio, los pacientes fueron tratados con uno (~30%) o más (~70%) medicamentos antidiabéticos, incluidos metformina (74%), insulina (48%), sulfonilurea (43%) e inhibidor de la dipeptidil peptidasa-4 (11%).
Todos los pacientes tenían enfermedad cardiovascular aterosclerótica establecida al inicio, incluido uno (82%) o más (18%) de los siguientes: antecedentes documentados de enfermedad arterial coronaria (76%), accidente cerebrovascular (23%) o enfermedad arterial periférica (21%). Al inicio del estudio, la presión arterial sistólica media fue de 136 mmHg, la presión arterial diastólica media fue de 76 mmHg, la LDL media fue de 86 mg/dL, la HDL media fue de 44 mg/dL y la proporción media de albúmina a creatinina en orina (UACR) fue de 175 mg/g. Al inicio del estudio, aproximadamente el 81% de los pacientes fueron tratados con inhibidores del sistema renina angiotensina, el 65% con bloqueadores beta, el 43% con diuréticos, el 77% con estatinas y el 86% con agentes antiplaquetarios (principalmente aspirina).
El criterio de valoración principal en EMPA-REG OUTCOME fue el tiempo transcurrido hasta la primera aparición de un evento cardíaco adverso mayor (MACE). Un evento cardíaco adverso mayor se definió como la ocurrencia de una muerte cardiovascular o un infarto de miocardio (IM) no fatal o un accidente cerebrovascular no fatal. El plan de análisis estadístico había especificado previamente que las dosis de 10 y 25 mg se combinarían. Se utilizó un modelo de riesgos proporcionales de Cox para evaluar la no inferioridad frente al margen de riesgo preespecificado de 1.3 para el cociente de riesgos instantáneos de MACE y la superioridad sobre MACE si se demostraba la no inferioridad. El error de tipo 1 se controló en múltiples pruebas utilizando una estrategia de prueba jerárquica.
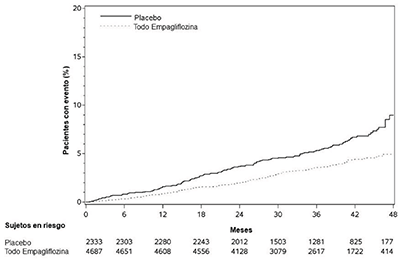
La empagliflozina redujo significativamente el riesgo de la primera aparición del criterio principal de valoración compuesto de muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal (HR: 0.86; IC del 95%: 0.74, 0.99). El efecto del tratamiento se debió a una reducción significativa del riesgo de muerte cardiovascular en sujetos aleatorizados a empagliflozina (HR: 0.62; IC del 95%: 0.49, 0.77), sin cambios en el riesgo de infarto de miocardio no mortal o accidente cerebrovascular no mortal (ver Tabla 7 y Figuras 4 y 5). Los resultados de las dosis de 10 mg y 25 mg de empagliflozina coincidieron con los resultados de los grupos de dosis combinadas.
Tabla 7. Efecto del tratamiento para el criterio principal de valoración compuesto y sus componentesa
|
Placebo N = 2333 |
Empagliflozina N = 4687 |
Cociente de riesgos instantáneos frente a placebo (95% IC) |
|
|
Compuesto de muerte cardiovascular, infarto de miocardio no fatal, accidente cerebrovascular no fatal (tiempo hasta la primera aparición)b |
282 (12.1%) |
490 (10.5%) |
0.86 (0.74, 0.99) |
|
Infarto de miocardio no fatalc |
121 (5.2%) |
213 (4.5%) |
0.87 (0.70, 1.09) |
|
Accidente cerebrovascular no fatalc |
60 (2.6%) |
150 (3.2%) |
1.24 (0.92, 1.67) |
|
Muerte cardiovascularc |
137(5.9%) |
172 (3.7%) |
0.62 (0.49, 0.77) |
a Conjunto tratado (pacientes que habían recibido al menos una dosis del fármaco del estudio)
b p-valor de superioridad (2 caras) 0.04.
c Número total de eventos.
Figura 4. Incidencia acumulada estimada del primer MACE
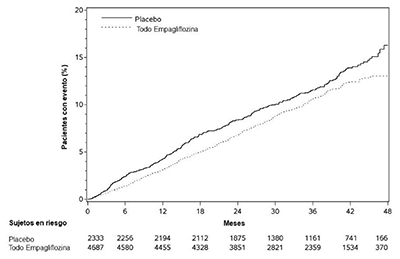
Figura 5. Incidencia acumulada estimada de muerte cardiovascular
La eficacia de la empagliflozina sobre la muerte cardiovascular fue generalmente consistente en los principales subgrupos demográficos y de enfermedades.
El estado vital se obtuvo para el 99.2% de los sujetos en el ensayo. Se registraron un total de 463 muertes durante el ensayo EMPA-REG OUTCOME. La mayoría de estas muertes se clasificaron como muertes cardiovasculares. Las muertes no cardiovasculares fueron sólo una pequeña proporción de las muertes y se equilibraron entre los grupos de tratamiento (2.1% en pacientes tratados con empagliflozina y 2.4% de pacientes tratados con placebo).
Ensayos de seguridad cardiovascular de linagliptina:
CARMELINA:
El riesgo cardiovascular de la linagliptina se evaluó en CARMELINA, un ensayo multinacional, multicéntrico, controlado con placebo, doble ciego, de grupos paralelos que comparó la linagliptina (n = 3494) con el placebo (n = 3485) en pacientes adultos con diabetes tipo 2 y antecedentes de enfermedad macrovascular y/o renal establecida. El ensayo comparó el riesgo de eventos cardiovasculares adversos mayores (MACE) entre la linagliptina y el placebo cuando éstos se agregaron a los tratamientos estándar para la diabetes y otros factores de riesgo cardiovascular. El ensayo se basó en eventos, la mediana de duración del seguimiento fue de 2.2 años y se obtuvo el estado vital del 99.7% de los pacientes.
Los pacientes eran elegibles para participar en el ensayo si eran adultos con diabetes tipo 2, con HbA1c de 6.5% a 10%, y tenían albuminuria y enfermedad macrovascular previa (39% de la población inscrita), o evidencia de deterioro de la función renal por TFGe y Criterios del cociente de albúmina y creatinina en orina (UACR) (42% de la población inscrita), o ambos (18% de la población inscrita).
Al inicio, la edad media era de 66 años y la población era 63% masculina, 80% caucásica, 9% asiática y 6% negra. La HbA1c media fue del 8.0% y la duración media de la diabetes mellitus tipo 2 fue de 15 años. La población del ensayo incluyó un 17% de pacientes ≥ 75 años y un 62% de pacientes con insuficiencia renal definida como TFGe < 60 ml/min/1.73 m2. La TFGe media fue de 55 ml/min/1.73 m2 y el 27% de los pacientes tenían insuficiencia renal leve (TFGe de 60 a 90 ml/min/1.73 m2), el 47% de los pacientes tenían insuficiencia renal moderada (TFGe de 30 a < 60 ml/min/1.73 m2) y el 15% de los pacientes tenían insuficiencia renal grave (TFGe < 30 ml/min/1.73 m2). Los pacientes tomaban al menos un fármaco antidiabético (97%), y los más frecuentes eran insulina y análogos (57%), metformina (54%) y sulfonilurea (32%). Los pacientes también tomaban antihipertensivos (96%), hipolipemiantes (76%), con un 72% con estatinas, y 62% con aspirina.
El criterio principal de valoración, MACE, fue el tiempo transcurrido hasta la primera aparición de uno de los tres resultados compuestos que incluyeron muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal. El estudio se diseñó como un ensayo de no inferioridad con un margen de riesgo preespecificado de 1.3 para el cociente de riesgos instantáneos de MACE. Un total de 434 pacientes con linagliptina y 420 pacientes con placebo experimentaron MACE. Tasa de incidencia de MACE en ambos brazos de tratamiento: 56.3 MACE por 1000 años-paciente con placebo frente a 57.7 MACE por 1000 años-paciente con linagliptina. El cociente de riesgos instantáneos estimado para MACE asociado con linagliptina en relación con el placebo fue de 1.02 con un intervalo de confianza del 95% de (0.89, 1.17). El límite superior de este intervalo de confianza, 1.17, excluyó el margen de riesgo de 1.3.
CAROLINA:
El riesgo cardiovascular de la linagliptina se evaluó en CAROLINA, un ensayo de grupos paralelos, multicéntrico, multinacional, aleatorizado, doble ciego, que comparó la linagliptina (N = 3023) con la glimepirida (N = 3010) en pacientes adultos con diabetes mellitus tipo 2 y antecedentes de enfermedad cardiovascular establecida y/o múltiples factores de riesgo cardiovascular. El ensayo comparó el riesgo de eventos cardiovasculares adversos mayores (MACE, por sus siglas en inglés) entre linagliptina y glimepirida cuando se agregaron a los tratamientos estándar para la diabetes y otros factores de riesgo cardiovascular. El ensayo se basó en eventos, la mediana de duración del seguimiento fue de 6.23 años y se obtuvo el estado vital del 99.3% de los pacientes.
Los pacientes eran elegibles para participar en el ensayo si eran adultos con diabetes tipo 2 con control glucémico insuficiente (definido como HbA1c de 6.5% a 8.5% o de 6.5% a 7.5% dependiendo de si no habían recibido tratamiento previo, en monoterapia o en terapia combinada), y se definieron como de alto riesgo cardiovascular con enfermedad vascular previa, evidencia de daño vascular relacionado con el órgano diana, edad ≥ 70 años y/o dos factores de riesgo cardiovascular (duración de la diabetes > 10 años, presión arterial sistólica > 140 mmHg, fumador, colesterol LDL ≥ 135 mg/dL).
Al inicio, la edad media era de 64 años y la población era 60% masculina, 73% caucásica, 18% asiática y 5% negra. La HbA1c media fue del 7.15% y la duración media de la diabetes tipo 2 fue de 7.6 años. La población del ensayo incluyó un 34% de pacientes ≥ 70 años y un 19% de pacientes con insuficiencia renal definida como TFGe < 60 ml/min/1.73 m2. El FGe medio fue de 77 ml/min/1.73 m2. Los pacientes tomaban al menos un fármaco antidiabético (91%) y los más frecuentes eran metformina (83%) y sulfonilurea (28%). Los pacientes también tomaban antihipertensivos (89%), hipolipemiantes (70%), estatinas en un 65% y aspirina (47%).
El criterio principal de valoración, MACE, fue el tiempo transcurrido hasta la primera aparición de uno de los tres resultados compuestos que incluyeron muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal. El estudio se diseñó como un ensayo de no inferioridad con un margen de riesgo preespecificado de 1.3 para el cociente de riesgos instantáneos de MACE. Un total de 356 pacientes tratados con linagliptina y 362 pacientes tratados con glimepirida experimentaron MACE. Tasa de incidencia de MACE en ambos brazos de tratamiento: 20.7 MACE por 1000 años-paciente con linagliptina frente a 21.2 MACE por 1000 años-paciente con glimepirida. El cociente de riesgos instantáneos estimado para MACE asociado con linagliptina en relación con glimepirida fue de 0.98 con un intervalo de confianza del 95% de (0.84, 1.14). El límite superior de este intervalo de confianza, 1.14, excluyó el margen de riesgo de 1.3.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Antes del inicio de JARDIANZ® DPP:
• Evalúe la función renal antes de iniciar JARDIANZ® DPP y según esté clínicamente indicado [consulte Advertencias y precauciones (Hipovolemia)].
• En pacientes con hipovolemia, corrija esta condición antes de iniciar JARDIANZ® DPP [consulte Advertencias y precauciones (Hipovolemia) y Uso en poblaciones específicas (Uso geriátrico, Insuficiencia renal)].
Dosis recomendada: La dosis recomendada de JARDIANZ® DPP es de 10 mg de empagliflozina/5 mg de linagliptina* una vez al día por la mañana, con o sin alimentos. JARDIANZ® DPP puede aumentarse a 25 mg de empagliflozina/5 mg de linagliptina una vez al día para un control glucémico adicional.
*Si no encuentra disponible la concentración adecuada de JARDIANZ® DPP, se podrá utilizar tabletas individuales de 10 mg de empagliflozina (Jardianz®) y 5 mg de linagliptina (Trayenta®) en lugar de Jardianz® DPP 10 mg/5mg.
Recomendaciones posológicas en pacientes con insuficiencia renal:
No se recomienda el uso de JARDIANZ® DPP en pacientes con una TFGe inferior a 30 mL/min/1.73 m2 y está contraindicado en pacientes en diálisis [consulte Indicaciones y uso, Contraindicaciones, Advertencias y precauciones (Hipovolemia) y Uso en Poblaciones (Insuficiencia renal)].
USO EN POBLACIONES ESPECÍFICAS:
Embarazo:
Resumen de riesgos:
Según los datos en animales que muestran efectos renales adversos de la empagliflozina, no se recomienda JARDIANZ® DPP durante el segundo y tercer trimestre del embarazo.
Los datos limitados disponibles con JARDIANZ® DPP, linagliptina o empagliflozina en mujeres embarazadas no son suficientes para determinar un riesgo asociado al fármaco de anomalías congénitas importantes y abortos espontáneos. Existen riesgos para la madre y el feto asociados con la diabetes mal controlada durante el embarazo (ver Consideraciones clínicas).
En estudios con animales, la empagliflozina, un componente de JARDIANZ® DPP, provocó cambios renales adversos en ratas cuando se administró durante un período de desarrollo renal correspondiente a finales del segundo y tercer trimestres del embarazo humano. Dosis de aproximadamente 13 veces la dosis clínica máxima causaron dilataciones de los túbulos y la pelvis renal que fueron reversibles. No se observaron efectos adversos en el desarrollo cuando se administró la combinación de linagliptina y empagliflozina a ratas preñadas (ver Datos).
El riesgo de fondo estimado de defectos congénitos importantes es del 6% al 10% en mujeres con diabetes pregestacional con HbA1c > 7 y se ha informado que es tan alto como del 20% al 25% en mujeres con HbA1c > 10. Se desconoce el riesgo de fondo estimado de aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Consideraciones clínicas:
Riesgo materno y/o embrionario/fetal asociado a la enfermedad: La diabetes mal controlada en el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro y complicaciones en el parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, muerte fetal y morbilidad relacionada con la macrosomía.
Datos:
Datos en animales: Los componentes combinados administrados durante el período de organogénesis no fueron teratogénicos en ratas hasta una dosis combinada de 700 mg/kg/día de empagliflozina y 140 mg/kg/día de linagliptina, que es 253 y 353 veces la exposición clínica.No se realizó un estudio de desarrollo prenatal y post-natal con los componentes combinados de JARDIANZ® DPP.
Empagliflozina: La empagliflozina administrada directamente a ratas jóvenes desde el día post-natal (DPN) 21 hasta el DPN 90 en dosis de 1, 10, 30 y 100 mg/kg/día provocó un aumento del peso de los riñones y dilatación pélvica y tubular renal a 100 mg/kg/día, que se aproxima a 13 veces la dosis clínica máxima de 25 mg, según el AUC. Estos hallazgos no se observaron después de un período de recuperación sin fármacos de 13 semanas. Estos resultados ocurrieron con la exposición al fármaco durante períodos de desarrollo renal en ratas que corresponden a finales del segundo y tercer trimestre del desarrollo renal humano.
En estudios de desarrollo embriofetal en ratas y conejos, la empagliflozina se administró a intervalos que coincidían con el período del primer trimestre de la organogénesis en humanos. Las dosis de hasta 300 mg/kg/día, que se aproximan a 48 veces (ratas) y 128 veces (conejos) la dosis clínica máxima de 25 mg (basada en el AUC), no produjeron efectos adversos en el desarrollo. En ratas, a dosis más altas de empagliflozina que causaron toxicidad materna, las malformaciones de los huesos de las extremidades aumentaron en los fetos a 700 mg/kg/día o 154 veces la dosis clínica máxima de 25 mg. La empagliflozina atraviesa la placenta y llega a los tejidos fetales en ratas. En el conejo, las dosis más altas de empagliflozina produjeron toxicidad materna y fetal a 700 mg/kg/día, o 139 veces la dosis clínica máxima de 25 mg.
En estudios de desarrollo prenatal y post-natal en ratas preñadas, se administró empagliflozina desde el día 6 de gestación hasta el día 20 de lactancia (destete) a una dosis de hasta 100 mg/kg/día (aproximadamente 16 veces la dosis clínica máxima de 25 mg) sin toxicidad materna. Se observó una reducción del peso corporal en las crías con una dosis mayor o igual a 30 mg/kg/día (aproximadamente 4 veces la dosis clínica máxima de 25 mg).
Linagliptina: No se observaron resultados adversos en el desarrollo cuando se administró linagliptina a ratas Wistar Han y conejos del Himalaya preñadas durante el período de organogénesis en dosis de hasta 240 mg/kg/día y 150 mg/kg/día, respectivamente. Estas dosis representan aproximadamente 943 veces (ratas) y 1943 veces (conejos) la dosis clínica máxima de 5 mg, según la exposición. No se observaron resultados funcionales, conductuales o reproductivos adversos en las crías después de la administración de linagliptina a ratas Wistar Han desde el día 6 de gestación hasta el día 21 de lactancia a una dosis 49 veces mayor que la dosis máxima recomendada en humanos, según la exposición.
La linagliptina atraviesa la placenta hacia el feto después de la administración oral en ratas y conejas preñadas.
Lactancia:
Resumen de riesgos: Hay información limitada sobre la presencia de JARDIANZ® DPP, o sus componentes individuales en la leche humana, los efectos en el lactante o los efectos en la producción de leche. La empagliflozina y la linagliptina están presentes en la leche de rata (consulte Datos). Dado que la maduración del riñón humano ocurre en el útero y durante los primeros 2 años de vida, cuando puede ocurrir la exposición durante la lactancia, puede haber riesgo para el riñón humano en desarrollo.
Debido al potencial de reacciones adversas graves en un bebé amamantado, incluido el potencial de que la empagliflozina afecte el desarrollo renal post-natal, informe a los pacientes que no se recomienda el uso de JARDIANZ® DPP durante la lactancia.
Datos: La empagliflozina estuvo presente en un nivel bajo en tejidos fetales de rata después de una dosis oral única a las madres en el día 18 de gestación. En la leche de rata, la proporción media de leche a plasma varió de 0,634 a 5, y fue mayor que uno de 2 a 24 horas. post-dosis. La proporción media máxima de leche a plasma de 5 se produjo 8 horas después de la dosis, lo que sugiere una acumulación de empagliflozina en la leche. Las ratas jóvenes expuestas directamente a la empagliflozina mostraron un riesgo para el riñón en desarrollo (dilatación pélvica renal y tubular) durante la maduración.
Uso pediátrico: No se ha establecido la seguridad y eficacia de JARDIANZ® DPP en pacientes pediátricos.
Uso geriátrico: JARDIANZ® DPP. La empagliflozina se asocia con diuresis osmótica, que podría afectar el estado de hidratación de los pacientes mayores de 75 años [consulte Advertencias y precauciones (Hipovolemia)].
Empagliflozina: En estudios de diabetes tipo 2 con empagliflozina, 2721 pacientes tratados con empagliflozina tenían 65 años o más y 491 pacientes tenían 75 años o más. En estos estudios, las reacciones adversas relacionadas con la hipovolemia ocurrieron en el 2.1%, 2.3% y 4.4% de los pacientes de 75 años o más en el grupo de placebo, empagliflozina 10 mg, y empagliflozina grupos de 25 mg una vez al día, respectivamente; y se produjeron infecciones del tracto urinario en el 10.5%, 15.7% y 15.1% de los pacientes de 75 años de edad y mayores en los grupos de placebo, empagliflozina 10 mg y empagliflozina 25 mg una vez al día, respectivamente.
Linagliptina: En los estudios de linagliptina, 1085 pacientes tratados con linagliptina tenían 65 años o más y 131 pacientes tenían 75 años o más. En estos estudios de linagliptina, no se observaron diferencias generales en la seguridad o eficacia de la linagliptina entre pacientes geriátricos y pacientes adultos más jóvenes.
Insuficiencia renal:
Empagliflozina: El beneficio hipoglucemiante de 25 mg de empagliflozina disminuyó en pacientes con empeoramiento de la función renal. Los riesgos de insuficiencia renal [consulte Advertencias y precauciones (Hipovolemia)], reacciones adversas de hipovolemia y reacciones adversas relacionadas con infecciones del tracto urinario aumentaron con el empeoramiento de la función renal.
Los estudios de eficacia y seguridad con empagliflozina no incluyeron pacientes con ESRD en diálisis o pacientes con una TFGe inferior a 30 ml/min/1.73 m2. La empagliflozina está contraindicada en pacientes en diálisis [consulte Indicaciones y uso y Contraindicaciones].
Insuficiencia hepática: JARDIANZ® DPP se puede usar en pacientes con insuficiencia hepática [consulte Farmacología clínica (Farmacocinética)].
SOBREDOSIS:
En caso de sobredosis de JARDIANZ® DPP, comuníquese con el Centro de control de intoxicaciones. No se ha estudiado la eliminación de empagliflozina por hemodiálisis y es improbable la eliminación de linagliptina por hemodiálisis o diálisis peritoneal.
DESCRIPCIÓN:
Las tabletas de JARDIANZ® DPP para uso oral contienen: Empagliflozina y linagliptina.
Empagliflozina: La empagliflozina es un inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT2).
El nombre químico de la empagliflozina es D-Glucitol,1,5-anhidro-1-C-[4-cloro-3-[[4-[[(3S)-tetrahidro-3-furanil]oxi]fenil]metil]fenilo ]-, (1S).
La fórmula molecular es C23H27ClO7 y el peso molecular es 450,91. La fórmula estructural es:
La empagliflozina es un polvo no higroscópico de color blanco a amarillento. Es muy poco soluble en agua, escasamente soluble en metanol, ligeramente soluble en etanol y acetonitrilo, soluble en 50% acetonitrilo/agua y prácticamente insoluble en tolueno.
Linagliptina: La linagliptina es un inhibidor de la enzima dipeptidil peptidasa-4 (DPP-4).
El nombre químico de la linagliptina es 1H-purina-2,6-diona, 8-[(3R)-3-amino-1-piperidinil]-7-(2-butin-1-il)-3,7-dihidro- 3-metil-1-[(4-metil-2-quinazolinil)metil]La fórmula molecular es C25H28N8O2 y el peso molecular es 472,54. La fórmula estructural es:
La linagliptina es una sustancia sólida de color blanco a amarillento, no o sólo ligeramente higroscópica. Es muy poco soluble en agua. La linagliptina es soluble en metanol, escasamente soluble en etanol, muy poco soluble en isopropanol y muy poco soluble en acetona.
JARDIANZ® DPP: Las tabletas de JARDIANZ® DPP están disponibles en dos concentraciones de dosis que contienen 10 mg o 25 mg de empagliflozina en combinación con 5 mg de linagliptina.
Los ingredientes inactivos de JARDIANZ® DPP son los siguientes: Núcleo de la tableta: manitol, almidón pregelatinizado, almidón de maíz, copovidona, crospovidona, talco y estearato de magnesio.
Recubrimiento: Hipromelosa, manitol, talco, dióxido de titanio, polietilenglicol y óxido férrico amarillo (10 mg/5 mg) u óxido férrico rojo (25 mg/5 mg).
PRESENTACIÓN:
Presentaciones:
La disponibilidad de las presentaciones depende de cada país.
Caja con 10 o 30 tabletas recubiertas de 5/10 o 5/25 mg.
Caja con 7 tabletas recubiertas de 5/10 o 5/25 mg. (Muestra Médica)
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Recomendaciones para el almacenamiento:
Consérvese a no más de 30 °C.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. No se use en el embarazo, en la lactancia ni en niños menores de 18 años.
Hecho en Alemania por:
Boehringer Ingelheim Pharma GmbH & Co. KG.
Binger Str. 173 55216 Ingelheim am
Rhein, Alemania.
Para:
BOEHRINGER INGELHEIM PROMECO, S.A. de C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocan, C.P. 16090, Xochimilco, Ciudad de México, México
Fecha de revisión de la monografía: OCT 2022
®Marca registrada