
JARDIANZ DUO COSTA RICA-GUATEMALA-HONDURAS-PANAMA
EMPAGLIFLOZINA, METFORMINA HCl
Tabletas
Caja, 60 Tabletas recubiertas, 5/850 mg/mg
Caja, 60 Tabletas recubiertas, 12.5/850 mg/mg
Caja, 60 Tabletas recubiertas, 12.5/1000 mg/mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada tableta recubierta contiene:
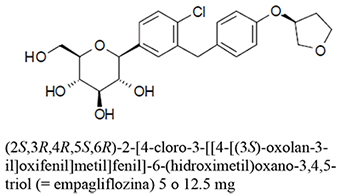
Empagliflozina: 5 mg, 12.5 mg
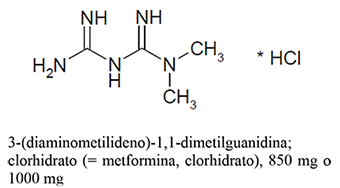
Clorhidrato de Metformina 850 mg, 1000 mg
Excipiente cbp: 1 tableta recubierta
Código ATC: A10BD20
TOXICOLOGÍA NO CLÍNICA:
Carcinogénesis, mutagénesis, alteración de la fertilidad
JARDIANZ® DUO
No carcinogenicidad, mutagenicidad o deterioro de la fertilidad se han realizado estudios con la combinación de empagliflozina y clorhidrato de metformina. Se realizaron estudios generales de toxicidad en ratas de hasta 13 semanas con los componentes combinados. Estos estudios indicaron que la combinación de empagliflozina y metformina no causa toxicidad aditiva.
Empagliflozina: La carcinogénesis se evaluó en estudios de 2 años realizados en ratones CD-1 y ratas Wistar. La empagliflozina no aumentó la incidencia de tumores en ratas hembra que recibieron dosis de 100, 300 o 700 mg/kg/día (hasta 72 veces la exposición desde la dosis clínica máxima de 25 mg). En ratas macho, los hemangiomas del ganglio linfático mesentérico aumentaron significativamente con 700 mg/kg/día o aproximadamente 42 veces la exposición de una dosis clínica de 25 mg. La empagliflozina no aumentó la incidencia de tumores en ratones hembra que recibieron dosis de 100, 300 o 1000 mg/kg/día (hasta 62 veces la exposición de una dosis clínica de 25 mg). Se observaron adenomas y carcinomas en los túbulos renales en ratones macho a 1000 mg/kg/día, que es aproximadamente 45 veces la exposición de la dosis clínica máxima de 25 mg. Estos tumores pueden estar asociados a una vía metabólica presente predominante en el riñón de ratones macho.
La empagliflozina no fue mutagénica ni clastogénica con o sin activación metabólica en el ensayo in vitro de mutagenicidad bacteriana Ames, el ensayo in vitro de células de linfoma de ratón L5178Y tk+/- y un ensayo de micronúcleos in vivo en ratas.
La empagliflozina no tuvo efectos sobre el apareamiento, la fertilidad o el desarrollo embrionario temprano en ratas macho o hembra tratadas hasta la dosis alta de 700 mg/kg/día (aproximadamente 155 veces la dosis clínica de 25 mg en machos y hembras, respectivamente).
Clorhidrato de metformina: Se han realizado estudios de carcinogenicidad a largo plazo en ratas (duración de la dosis de 104 semanas) y ratones (duración de la dosis de 91 semanas) a dosis de hasta 900 mg/kg/día y 1500 mg/kg/día, respectivamente. Ambas dosis son aproximadamente 4 veces la dosis diaria máxima recomendada en humanos de 2000 mg/kg/día según las comparaciones del área de superficie corporal. No se encontró evidencia de carcinogenicidad con metformina en ratones macho o hembras. De manera similar, no se observó potencial tumorigénico con metformina en ratas macho. Sin embargo, hubo una mayor incidencia de pólipos uterinos estromales benignos en ratas hembra tratadas con 900 mg/kg/día.
No hubo evidencia de un potencial mutagénico de la metformina en las siguientes pruebas in vitro: prueba de Ames (Salmonella typhimurium), prueba de mutación genética (células de linfoma de ratón) o prueba de aberraciones cromosómicas (linfocitos humanos). Los resultados de la prueba de micronúcleos de ratón in vivo también fueron negativos.
La fertilidad de ratas macho o hembra no se vio afectada por la metformina cuando se administró en dosis de hasta 600 mg/kg/día, que es aproximadamente 2 veces la MRHD según las comparaciones del área de superficie corporal.
INDICACIONES Y USO: JARDIANZ® DUO es una combinación de empagliflozina y clorhidrato de metformina (HCl) indicada como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
La empagliflozina está indicada para reducir el riesgo de muerte cardiovascular en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida [consulte Estudios clínicos (14)].
Limitación de uso:
JARDIANZ® DUO no se recomienda en pacientes con diabetes mellitus tipo 1. Puede aumentar el riesgo de cetoacidosis diabética en estos pacientes [consulte Advertencias y precauciones (5.2)].
CONTRAINDICACIONES: JARDIANZ® DUO está contraindicado en pacientes con:
• Insuficiencia renal grave (TFGe inferior a 30 ml/min/1.73 m2), enfermedad renal en etapa terminal o diálisis [consulte Advertencias y precauciones (5.1) y Uso en poblaciones específicas (8.6)]. • Acidosis metabólica aguda o crónica, incluida la cetoacidosis diabética [consulte Advertencias y precauciones (5.1)]. • Hipersensibilidad a la empagliflozina, la metformina o cualquiera de los excipientes de JARDIANZ® DUO, se han producido reacciones como angioedema [consulte Advertencias y precauciones (5.8)].
ADVERTENCIAS Y PRECAUCIONES:
• Acidosis láctica:
Ha habido casos, posteriores a la comercialización, de acidosis láctica asociada a metformina, incluidos casos mortales. Estos casos tuvieron un inicio sutil y se acompañaron de síntomas inespecíficos como malestar general, mialgias, dolor abdominal, dificultad respiratoria o aumento de la somnolencia; sin embargo, se han presentado hipotermia, hipotensión y bradiarritmias resistentes con acidosis grave. La acidosis láctica asociada a metformina se caracterizó por concentraciones elevadas de lactato en sangre (>5 mmol/litro), acidosis con brecha aniónica (sin evidencia de cetonuria o cetonemia) y una relación lactato:piruvato aumentada; niveles plasmáticos de metformina generalmente >5 mcg/mL. La metformina disminuye la captación hepática de lactato aumentando los niveles de lactato en sangre, lo que puede aumentar el riesgo de acidosis láctica, especialmente en pacientes en riesgo.
Si se sospecha acidosis láctica asociada a metformina, se deben instituir medidas de apoyo generales de inmediato en un entorno hospitalario, junto con la suspensión inmediata de JARDIANZ® DUO. En pacientes tratados con JARDIANZ® DUO con diagnóstico o fuerte sospecha de acidosis láctica, se recomienda hemodiálisis inmediata para corregir la acidosis y eliminar la metformina acumulada (la metformina es dializable, con un aclaramiento de hasta 170 ml/minuto en buenas condiciones hemodinámicas). La hemodiálisis a menudo ha resultado en la reversión de los síntomas y la recuperación.
Instruya a los pacientes y sus familias sobre los síntomas de la acidosis láctica y, si estos síntomas ocurren, indíqueles que descontinúen JARDIANZ® DUO e informen estos síntomas a su proveedor de atención médica.
Para cada uno de los factores de riesgo conocidos y posibles de acidosis láctica asociada a metformina, a continuación, se proporcionan recomendaciones para reducir el riesgo y controlar la acidosis láctica asociada a metformina:
Insuficiencia renal: Los casos de acidosis láctica asociada a metformina posteriores a la comercialización ocurrieron principalmente en pacientes con insuficiencia renal significativa. El riesgo de acumulación de metformina y acidosis láctica asociada a metformina aumenta con la gravedad de la insuficiencia renal porque la metformina se excreta sustancialmente por vía renal. Las recomendaciones clínicas basadas en la función renal del paciente incluyen [consulte Posología y administración (2.3) y Farmacología clínica (12.3)].
• Antes de iniciar JARDIANZ® DUO, obtenga una tasa de filtración glomerular estimada (TFGe).
• JARDIANZ® DUO está contraindicado en pacientes con una TFGe inferior a 30 ml/min/1.73 m2 [consulte Contraindicaciones (4)].
• Obtenga una TFGe al menos una vez al año en todos los pacientes que toman JARDIANZ® DUO. En pacientes con mayor riesgo de desarrollar insuficiencia renal (p. ej., adultos mayores), se debe evaluar la función renal con mayor frecuencia.
Interacciones con fármacos: El uso concomitante de JARDIANZ® DUO con medicamentos específicos puede aumentar el riesgo de acidosis láctica asociada con metformina: aquellas que alteran la función renal, provocan cambios hemodinámicos significativos, interfieren con el equilibrio ácido-base o aumentan la acumulación de metformina [consulte Interacciones farmacológicas (7)]. Por lo tanto, considere un monitoreo más frecuente de los pacientes.
65 años o más: El riesgo de acidosis láctica asociada a metformina aumenta con la edad del paciente porque los pacientes de edad avanzada tienen una mayor probabilidad de tener insuficiencia hepática, renal o cardíaca que los pacientes más jóvenes.
Evalúe la función renal con mayor frecuencia en pacientes de edad avanzada [consulte Uso en poblaciones específicas (8.5)].
Estudios radiológicos con contraste: La administración de agentes de contraste yodados intravasculares en pacientes tratados con metformina ha provocado una disminución aguda de la función renal y la aparición de acidosis láctica. Suspenda JARDIANZ® DUO en el momento o antes de un procedimiento de obtención de imágenes con contraste yodado en pacientes con una TFGe inferior a 60 ml/min/1.73 m2; en pacientes con antecedentes de insuficiencia hepática, alcoholismo o insuficiencia cardíaca; o en pacientes a los que se les administrará contraste yodado intraarterial. Vuelva a evaluar la TFGe 48 horas después del procedimiento de imagen y reinicie JARDIANZ® DUO si la función renal es estable.
Cirugía y otros procedimientos: La retención de alimentos y líquidos durante procedimientos quirúrgicos u otros puede aumentar el riesgo de hipovolemia, hipotensión e insuficiencia renal. JARDIANZ® DUO debe suspenderse temporalmente mientras los pacientes tengan una ingesta restringida de alimentos y líquidos.
Estados hipóxicos: Varios de los casos posteriores a la comercialización de acidosis láctica asociada con metformina ocurrieron en el contexto de insuficiencia cardíaca congestiva aguda (particularmente cuando se acompaña de hipoperfusión e hipoxemia). El colapso cardiovascular (choque), el infarto agudo de miocardio, la sepsis y otras condiciones asociadas con la hipoxemia se han asociado con acidosis láctica y también pueden causar azotemia prerrenal. Cuando ocurran tales eventos, suspenda JARDIANZ® DUO.
Consumo excesivo de alcohol: El alcohol potencia el efecto de la metformina sobre el metabolismo del lactato y esto puede aumentar el riesgo de acidosis láctica asociada a la metformina. Advierta a los pacientes sobre el consumo excesivo de alcohol mientras reciben JARDIANZ® DUO.
Insuficiencia hepática: Los pacientes con insuficiencia hepática han desarrollado casos de acidosis láctica asociada a metformina. Esto puede deberse a un aclaramiento de lactato alterado que da como resultado niveles sanguíneos de lactato más altos. Por lo tanto, evite el uso de JARDIANZ® DUO en pacientes con evidencia clínica o de laboratorio de enfermedad hepática.
• Cetoacidosis:
Se han identificado informes de cetoacidosis, una afección grave que pone en peligro la vida y requiere hospitalización urgente, en ensayos clínicos y vigilancia posterior a la comercialización en pacientes con diabetes mellitus tipo 1 y tipo 2 que reciben inhibidores del cotransportador de sodio-glucosa tipo 2 (SGLT2), incluida la empagliflozina. Se han notificado casos mortales de cetoacidosis en pacientes que toman empagliflozina. En ensayos controlados con placebo de pacientes con diabetes tipo 1, el riesgo de cetoacidosis aumentó en los pacientes que recibieron inhibidores de SGLT2 en comparación con los pacientes que recibieron placebo. JARDIANZ® DUO no está indicado para el tratamiento de pacientes con diabetes mellitus tipo 1 [consulte Indicaciones y uso (1)].
Los pacientes tratados con JARDIANZ® DUO que presenten signos y síntomas compatibles con acidosis metabólica grave deben ser evaluados para detectar cetoacidosis independientemente de los niveles de glucosa en sangre que presenten, ya que la cetoacidosis asociada con JARDIANZ® DUO puede estar presente incluso si los niveles de glucosa en sangre son inferiores a 250 mg/dL. Si se sospecha cetoacidosis, se debe suspender JARDIANZ® DUO, se debe evaluar al paciente y se debe sustituir el tratamiento de inmediato. El tratamiento de la cetoacidosis puede requerir reposición de insulina, líquidos y carbohidratos.
En muchos de los informes posteriores a la comercialización, y en particular en pacientes con diabetes tipo 1, la presencia de cetoacidosis no se reconoció de inmediato y el inicio del tratamiento se retrasó porque los niveles de glucosa en sangre iniciales estaban por debajo de los que normalmente se esperan para la cetoacidosis diabética (a menudo menos de 250 mg/día). dL). Los signos y síntomas en la presentación fueron consistentes con deshidratación y acidosis metabólica severa e incluyeron náuseas, vómitos, dolor abdominal, malestar generalizado y dificultad para respirar. En algunos casos, pero no en todos, los factores que predisponen a la cetoacidosis, como la reducción de la dosis de insulina, enfermedad febril aguda, ingesta calórica reducida, cirugía, trastornos pancreáticos que sugieren deficiencia de insulina (p. ej., diabetes tipo 1, antecedentes de pancreatitis o cirugía pancreática) y abuso de alcohol fueron identificados.
Antes de iniciar JARDIANZ® DUO, considere los factores en el historial del paciente que pueden predisponer a la cetoacidosis, incluida la deficiencia de insulina pancreática por cualquier causa, la restricción calórica y el abuso de alcohol.
Para los pacientes que se someten a una cirugía programada, considere suspender temporalmente JARDIANZ® DUO durante al menos 3 días antes de la cirugía [consulte Farmacología clínica (12.2, 12.3)].
Considere controlar la cetoacidosis y suspender temporalmente JARDIANZ® DUO en otras situaciones clínicas que se sabe que predisponen a la cetoacidosis (p. ej., ayuno prolongado debido a una enfermedad aguda o después de una cirugía). Asegúrese de que los factores de riesgo de cetoacidosis se resuelvan antes de reiniciar JARDIANZ® DUO.
Instruya a los pacientes sobre los signos y síntomas de la cetoacidosis e indíqueles que suspendan JARDIANZ® DUO y busquen atención médica de inmediato si se presentan signos y síntomas.
• Hipovolemia:
La empagliflozina puede causar hipovolemia intravascular que a veces puede manifestarse como hipotensión sintomática o cambios transitorios agudos en la creatinina [consulte Reacciones adversas (6.1)]. Ha habido informes posteriores a la comercialización de insuficiencia renal aguda, algunos que requirieron hospitalización y diálisis, en pacientes con diabetes mellitus tipo 2 que recibieron inhibidores de SGLT2, incluida la empagliflozina. Los pacientes con función renal alterada (TFGe inferior a 60 ml/min/1.73 m2), los pacientes de edad avanzada o los pacientes que toman diuréticos de asa pueden tener un mayor riesgo de hipovolemia o hipotensión. Antes de iniciar JARDIANZ® DUO en pacientes con una o más de estas características, evalúe el estado del volumen y la función renal. En pacientes con hipovolemia, corrija esta condición antes de iniciar JARDIANZ® DUO. Controle los signos y síntomas de hipovolemia y la función renal después de iniciar el tratamiento.
• Urosepsis y pielonefritis:
Ha habido informes posteriores a la comercialización de infecciones graves del tracto urinario, incluidas urosepsis y pielonefritis, que requirieron hospitalización en pacientes que recibieron inhibidores de SGLT2, incluida la empagliflozina. El tratamiento con inhibidores de SGLT2 aumenta el riesgo de infecciones del tracto urinario. Evalúe a los pacientes en busca de signos y síntomas de infecciones del tracto urinario y trátelos de inmediato, si está indicado [consulte Reacciones adversas (6)].
• Hipoglucemia con uso concomitante con insulina y secretagogos de insulina:
Se sabe que la insulina y los secretagogos de insulina causan hipoglucemia. El riesgo de hipoglucemia aumenta cuando la empagliflozina se usa en combinación con secretagogos de insulina (p. ej., sulfonilurea) o insulina [consulte Reacciones adversas (6.1)]. La metformina puede aumentar el riesgo de hipoglucemia cuando se combina con insulina y/o un secretagogo de insulina. Por lo tanto, es posible que se requiera una dosis más baja del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia cuando se usa en combinación con JARDIANZ® DUO.
• Fascitis necrosante del perineo (gangrena de Fournier):
Se han identificado informes de fascitis necrosante del perineo (gangrena de Fournier), una infección necrosante poco frecuente pero grave y potencialmente mortal que requiere intervención quirúrgica urgente, en la vigilancia posterior a la comercialización en pacientes con diabetes mellitus que reciben inhibidores de SGLT2, incluida empagliflozina. Se han notificado casos tanto en mujeres como en hombres. Los resultados graves han incluido hospitalización, múltiples cirugías y muerte.
Los pacientes tratados con JARDIANZ® DUO que presenten dolor o sensibilidad, eritema o hinchazón en el área genital o perineal, junto con fiebre o malestar general, deben ser evaluados para detectar fascitis necrosante. Ante la sospecha, iniciar tratamiento inmediatamente con antibióticos de amplio espectro y, si es necesario, desbridamiento quirúrgico. Suspenda JARDIANZ® DUO, controle de cerca los niveles de glucosa en sangre y proporcione una terapia alternativa adecuada para el control de la glucemia.
• Infecciones micóticas genitales:
La empagliflozina aumenta el riesgo de infecciones micóticas genitales [consulte Reacciones adversas (6.1)]. Los pacientes con antecedentes de infecciones micóticas genitales crónicas o recurrentes tenían más probabilidades de desarrollar infecciones micóticas genitales. Supervisar y tratar según corresponda.
• Reacciones de hipersensibilidad:
Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad graves (p. ej., angioedema) en pacientes tratados con empagliflozina. Si ocurre una reacción de hipersensibilidad, suspenda JARDIANZ® DUO; trate de inmediato según el estándar de atención y controle hasta que desaparezcan los signos y síntomas. JARDIANZ® DUO está contraindicado en pacientes con hipersensibilidad a la empagliflozina o a cualquiera de los excipientes de JARDIANZ® DUO [consulte Contraindicaciones (4)].
• Niveles de vitamina B12:
En ensayos clínicos de metformina de 29 semanas de duración, se observó una disminución a niveles inferiores a los normales de los niveles séricos de vitamina B12 previamente normales en aproximadamente el 7% de los pacientes tratados con metformina. Tal disminución, posiblemente debido a la interferencia del complejo B12-factor intrínseco en la absorción de B12, puede estar asociada con anemia, pero parece ser rápidamente reversible con la interrupción de la suplementación con metformina o vitamina B12. Ciertas personas (aquellas con una ingesta o absorción inadecuada de vitamina B12 o calcio) parecen estar predispuestas a desarrollar niveles de vitamina B12 por debajo de lo normal. Mida los parámetros hematológicos anualmente y la vitamina B12 en intervalos de 2 a 3 años en pacientes con JARDIANZ® DUO y controle cualquier anomalía [consulte Reacciones adversas (6.1)].
REACCIONES ADVERSAS:
Las siguientes reacciones adversas importantes se describen a continuación y en otras partes de la etiqueta:
• Acidosis láctica [consulte el Recuadro de advertencia y Advertencias y precauciones (5.1)]
• Cetoacidosis [consulte Advertencias y precauciones (5.2)]
• Hipovolemia [consulte Advertencias y precauciones (5.3)]
• Urosepsis y Pielonefritis [consulte Advertencias y precauciones (5.4)]
• Hipoglucemia con el uso concomitante con insulina y secretagogos de insulina [consulte Advertencias y precauciones (5.5)]
• Fascitis necrosante del perineo (gangrena de Fournier) [consulte Advertencias y precauciones (5.6)]
• Infecciones micóticas genitales [consulte Advertencias y precauciones (5.7)]
• Reacciones de hipersensibilidad [consulte Advertencias y precauciones (5.8)]
• Deficiencia de vitamina B12 [consulte Advertencias y precauciones (5.9)]
• Experiencia en ensayos clínicos:
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
La seguridad de la administración concomitante de empagliflozina (dosis diaria de 10 mg y 25 mg) y clorhidrato de metformina (dosis diaria media de aproximadamente 1800 mg) en 3456 pacientes con diabetes mellitus tipo 2 tratados durante 16 a 24 semanas, de los cuales 926 pacientes recibieron placebo, 1271 pacientes recibieron una dosis diaria de empagliflozina de 10 mg y 1259 pacientes recibieron una dosis diaria de empagliflozina 25 mg. La interrupción del tratamiento debido a eventos adversos en los grupos de tratamiento fue del 3.0%, 2.8% y 2.9% para el placebo, 10 mg de empagliflozina y 25 mg de empagliflozina, respectivamente.
Terapia de combinación adicional de empagliflozina con metformina: En un ensayo controlado con placebo de 24 semanas de empagliflozina 10 mg y 25 mg administrados una vez al día más metformina, no se informaron reacciones adversas, independientemente de la evaluación del investigador de la causalidad en ≥5% de los pacientes y con más frecuencia que en los pacientes que recibieron placebo.
Terapia de combinación adicional de empagliflozina con metformina y sulfonilurea: En un ensayo controlado con placebo de 24 semanas de empagliflozina 10 mg y 25 mg administrados una vez al día junto con metformina y sulfonilurea, se informaron reacciones adversas independientemente de la evaluación del investigador de la causalidad en ≥5% de los pacientes y con mayor frecuencia que en los pacientes que recibieron placebo en la Tabla 1 (ver también la Tabla 4).
|
Tabla 1 Reacciones adversas informadas en ≥5% de los pacientes tratados con empagliflozina añadida a metformina más sulfonilurea y mayores que con placebo en un estudio clínico controlado con placebo de 24 semanas |
|||
|
Reacciones Adversas |
Placebo (%) n=225 |
Empagliflozina 10 mg (%) n=224 |
Empagliflozina 25 mg (%) n=217 |
|
Hipoglucemia |
9.8 |
15.6 |
12.9 |
|
Infección del tracto urinario |
6.7 |
9.4 |
6.9 |
|
Nasofaringitis |
4.9 |
8.0 |
6.0 |
Empagliflozina: Los datos de la Tabla 2 se derivan de un conjunto de cuatro ensayos controlados con placebo de 24 semanas y datos de 18 semanas de un ensayo controlado con placebo con insulina basal. La empagliflozina se usó como monoterapia en un ensayo y como terapia complementaria en cuatro ensayos [consulte Estudios clínicos (14)].
Estos datos reflejan la exposición de 1976 pacientes a la empagliflozina con una duración media de la exposición de aproximadamente 23 semanas. Los pacientes recibieron placebo (N=995), empagliflozina 10 mg (N=999) o empagliflozina 25 mg (N=977) una vez al día. La edad media de la población fue de 56 años y el 3% tenía más de 75 años. Más de la mitad (55%) de la población eran hombres; El 46% eran blancos, el 50% eran asiáticos y el 3% eran negros o afroamericanos. Al inicio, el 57% de la población tenía diabetes durante más de 5 años y tenía una media de hemoglobina A1c (HbA1c) del 8%. Las complicaciones microvasculares establecidas de la diabetes al inicio del estudio incluyeron nefropatía diabética (7%), retinopatía (8%) o neuropatía (16%). La función renal inicial era normal o levemente alterada en el 91% de los pacientes y moderadamente alterada en el 9% de los pacientes (TFGe media de 86.8 ml/min/1.73 m2).
La Tabla 2 muestra las reacciones adversas comunes (excluyendo la hipoglucemia) asociadas con el uso de empagliflozina. Las reacciones adversas no estaban presentes al inicio del estudio, ocurrieron con mayor frecuencia con empagliflozina que con placebo y ocurrieron en más del 2% o en el 2% de los pacientes tratados con empagliflozina 10 mg o empagliflozina 25 mg.
|
Tabla 2 Reacciones adversas informadas en ≥2% de los pacientes tratados con empagliflozina y más que con placebo en estudios clínicos combinados controlados con placebo de monoterapia con empagliflozina o terapia combinada |
|||
|
Reacciones adversas |
Placebo (%) N = 995 |
Empagliflozina 10 mg (%) N = 999 |
Empagliflozina 25 mg (%) N = 977 |
|
Infección del tracto urinarioa |
7.6 |
9.3 |
7.6 |
|
Infecciones micóticas genitales femeninasb |
1.5 |
5.4 |
6.4 |
|
Infección del tracto respiratorio superior |
3.8 |
3.1 |
4.0 |
|
Aumento de orinac |
1.0 |
3.4 |
3.2 |
|
Dislipidemia |
3.4 |
3.9 |
2.9 |
|
Artralgia |
2.2 |
2.4 |
2.3 |
|
Infecciones micóticas genitales masculinasd |
0.4 |
3.1 |
1.6 |
|
Náusea |
1.4 |
2.3 |
1.1 |
|
aAgrupación predefinida de eventos adversos, que incluye, entre otros, infección del tracto urinario, bacteriuria asintomática, cistitis bLas infecciones micóticas genitales femeninas incluyen las siguientes reacciones adversas: infección micótica vulvovaginal, infección vaginal, vulvitis, candidiasis vulvovaginal, infección genital, candidiasis genital, infección genital fúngica, infección del tracto genitourinario, vulvovaginitis, cervicitis, infección urogenital fúngica, vaginitis bacteriana. Porcentajes calculados con el número de mujeres en cada grupo como denominador: placebo (N=481), empagliflozina 10 mg (N=443), empagliflozina 25 mg (N=420). cAgrupación predefinida de eventos adversos, incluidos, entre otros, poliuria, polaquiuria y nicturia dLas infecciones micóticas genitales masculinas incluyen las siguientes reacciones adversas: balanopostitis, balanitis, infecciones genitales fúngicas, infección del tracto genitourinario, balanitis candida, absceso escrotal, infección del pene. Porcentajes calculados con el número de sujetos masculinos en cada grupo como denominador: placebo (N=514), empagliflozina 10 mg (N=556), empagliflozina 25 mg (N=557). |
|||
La sed (incluida la polidipsia) se notificó en el 0%, el 1.7% y el 1.5% con placebo, empagliflozina de 10 mg y empagliflozina de 25 mg, respectivamente.
Hipovolemia: La empagliflozina provoca una diuresis osmótica, que puede provocar una contracción del volumen intravascular y reacciones adversas relacionadas con la hipovolemia. En el conjunto de cinco ensayos clínicos controlados con placebo, las reacciones adversas relacionadas con hipovolemia (p. ej., disminución de la presión arterial (ambulatoria), disminución de la presión arterial sistólica, deshidratación, hipotensión, hipovolemia, hipotensión ortostática y síncope) se informaron en un 0,3%, 0,5% y 0,3% de los pacientes tratados con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente. La empagliflozina puede aumentar el riesgo de hipotensión en pacientes con riesgo de contracción del volumen [consulte Uso en poblaciones específicas (8.5, 8.6)].
Aumento de la micción: En el grupo de cinco ensayos clínicos controlados con placebo, las reacciones adversas de aumento de la micción (p. ej., poliuria, polaquiuria y nicturia) ocurrieron con más frecuencia con empagliflozina que con placebo (consulte la Tabla 2). Específicamente, el 0.4%, 0.3% y 0.8% de los pacientes tratados con placebo, empagliflozina 10 mg y empagliflozina 25 mg, informaron nocturia, respectivamente.
Hipoglucemia: La incidencia de hipoglucemia por estudio se muestra en la Tabla 3. La incidencia de hipoglucemia aumentó cuando se administró empagliflozina con insulina o sulfonilurea.
|
Tabla 3 Incidencia de eventos hipoglucémicos generalesa y gravesb en estudios clínicos controlados con placeboc |
|||
|
Monoterapia (24 semanas) |
Placebo (n = 229) |
Empagliflozina 10 mg (n = 224) |
Empagliflozina 25 mg (n = 223) |
|
General (%) |
0.4 |
0.4 |
0.4 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con metformina (24 semanas) |
Placebo + Metformina (n=206) |
Empagliflozina 10 mg + Metformina (n=217) |
Empagliflozina 25 mg + Metformina (n=214) |
|
General (%) |
0.5 |
1.8 |
1.4 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con Metformina + Sulfonilurea (24 semanas) |
Placebo (n=225) |
Empagliflozina10 mg + metformina + sulfonilurea (n=224) |
Empagliflozina 25 mg + metformina + sulfonilurea (n=217 |
|
General (%) |
8.4 |
16.1 |
11.5 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con Pioglitazona +/- Metformina (24 semanas) |
Placebo (n=165) |
Empagliflozina10 mg +pioglitazona ± metformina (n=165) |
Empagliflozina 25 mg + pioglitazona ±metformina (n=168) |
|
General(%) |
1.8 |
1.2 |
2.4 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con Insulina basal +/- Metformina (18 semanasd) |
Placebo (n = 170) |
Empagliflozina 10 mg (n = 169) |
Empagliflozina 25 mg (n = 155) |
|
General (%) |
20.6 |
19.5 |
28.4 |
|
Grave (%) |
0 |
0 |
1.3 |
|
En combinación con Insulina MDI +/- Metformina (18 semanasd) |
Placebo (n = 188) |
Empagliflozina 10 mg (n = 186) |
Empagliflozina 25 mg (n = 189) |
|
General (%) |
37.2 |
39.8 |
41.3 |
|
Grave (%) |
0.5 |
0.5 |
0.5 |
|
aEventos hipoglucémicos globales: glucosa plasmática o capilar menor o igual a 70 mg/dL bEventos hipoglucémicos graves: que requieren asistencia independientemente de la glucosa en sangre cConjunto tratado (pacientes que habían recibido al menos una dosis del fármaco del estudio) dLa dosis de insulina no se pudo ajustar durante el período de tratamiento inicial de 18 semanas |
|||
Infecciones micóticas genitales: En el conjunto de cinco ensayos clínicos controlados con placebo, la incidencia de infecciones micóticas genitales (p. ej., infección micótica vaginal, infección vaginal, infección genital fúngica, candidiasis vulvovaginal y vulvitis) aumentó en pacientes tratadas con empagliflozina en comparación con placebo, y se produjo en 0.9%, 4.1% y 3.7% de los pacientes aleatorizados a placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente. La interrupción del estudio debido a una infección genital se produjo en el 0% de los pacientes tratados con placebo y en el 0.2% de los pacientes tratados con empagliflozina de 10 o 25 mg.
Las infecciones micóticas genitales ocurrieron con mayor frecuencia en mujeres que en hombres (ver Tabla 2).
La fimosis ocurrió con mayor frecuencia en pacientes masculinos tratados con empagliflozina 10 mg (menos del 0,1%) y empagliflozina 25 mg (0.1%) que con placebo (0%).
Infecciones del tracto urinario: En el grupo de cinco ensayos clínicos controlados con placebo, la incidencia de infecciones del tracto urinario (p. ej., infección del tracto urinario, bacteriuria asintomática y cistitis) aumentó en los pacientes tratados con empagliflozina en comparación con el placebo (consulte la Tabla 2). Los pacientes con antecedentes de infecciones del tracto urinario crónicas o recurrentes tenían más probabilidades de experimentar una infección del tracto urinario. La tasa de interrupción del tratamiento debido a infecciones del tracto urinario fue del 0.1%, 0.2% y 0.1% para placebo, 10 mg de empagliflozina y 25 mg de empagliflozina, respectivamente.
Las infecciones del tracto urinario ocurrieron con mayor frecuencia en pacientes de sexo femenino. La incidencia de infecciones del tracto urinario en pacientes aleatorizadas a placebo, empagliflozina 10 mg y empagliflozina 25 mg fue del 16.6%, 18.4% y 17.0%, respectivamente. La incidencia de infecciones del tracto urinario en pacientes varones asignados al azar a placebo, empagliflozina de 10 mg y empagliflozina de 25 mg fue del 3.2%, 3.6% y 4.1%, respectivamente [consulte Uso en poblaciones específicas (8.5)].
Metformina: Las reacciones adversas establecidas más comunes (>5%) debido al inicio de la terapia con metformina son diarrea, náuseas/vómitos, flatulencia, malestar abdominal, indigestión, astenia y dolor de cabeza.
Pruebas de laboratorio
Empagliflozina: Aumentos en la creatinina sérica y disminuciones en TFGe: El inicio de la empagliflozina provoca un aumento de la creatinina sérica y una disminución de la TFGe a las pocas semanas de iniciar el tratamiento y luego estos cambios se estabilizan. En un estudio de pacientes con insuficiencia renal moderada, se observaron cambios medios mayores. En un ensayo de resultados cardiovasculares a largo plazo, el aumento de la creatinina sérica y la disminución de la TFGe generalmente no superaron los 0.1 mg/dl y -9.0 ml/min/1.73 m2, respectivamente, en la semana 4, y se revirtió después de la interrupción del tratamiento, lo que sugiere que los cambios hemodinámicos agudos pueden desempeñar un papel en los cambios de la función renal observados con empagliflozina.
Aumento del colesterol de lipoproteínas de baja densidad (LDL-C): Se observaron aumentos relacionados con la dosis en el colesterol de lipoproteínas de baja densidad (LDL-C) en pacientes tratados con empagliflozina. El C-LDL aumentó un 2.3%, 4.6% y 6.5% en pacientes tratados con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente. El rango de niveles basales medios de LDL-C fue de 90.3 a 90.6 mg/dl en todos los grupos de tratamiento.
Aumento del hematocrito: En un conjunto de cuatro estudios controlados con placebo, la mediana del hematocrito disminuyó un 1.3% en el grupo placebo y aumentó un 2.8% en los pacientes tratados con 10 mg de empagliflozina y un 2.8% en los pacientes tratados con 25 mg de empagliflozina. Al final del tratamiento, el 0.6%, el 2.7% y el 3.5% de los pacientes con hematocritos inicialmente dentro del rango de referencia tenían valores por encima del límite superior del rango de referencia con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente.
Metformina:
Disminución de la vitamina B12: En ensayos clínicos de metformina de 29 semanas de duración, se observó una disminución a niveles por debajo de lo normal de los niveles séricos de vitamina B12 previamente normales en aproximadamente el 7% de los pacientes.
• Experiencia posterior a la comercialización:
Se han identificado reacciones adversas adicionales durante el uso posterior a la aprobación. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Empagliflozina:
Trastornos gastrointestinales: Estreñimiento
Infecciones: Fascitis necrotizante del perineo (gangrena de Fournier), urosepsis y pielonefritis.
Trastornos del metabolismo y la nutrición: Cetoacidosis
Trastornos renales y urinarios: Lesión renal aguda
Trastornos de la piel y del tejido subcutáneo: Angioedema, reacciones cutáneas (por ejemplo, erupción, urticaria)
Clorhidrato de metformina:
Trastornos hepatobiliares: Daño hepático colestásico, hepatocelular y mixto hepatocelular
INTERACCIONES MEDICAMENTOSAS:
|
Tabla 4 Interacciones clínicamente relevantes con JARDIANZ® DUO |
|
|
Inhibidores de la anhidrasa carbónica |
|
|
Impacto Clínico |
El topiramato u otros inhibidores de la anhidrasa carbónica (p. ej., zonisamida, acetazolamida o diclorfenamida) provocan con frecuencia una disminución del bicarbonato sérico e inducen acidosis metabólica hiperclorémica sin brecha aniónica. |
|
Intervención |
El uso concomitante de estos medicamentos con JARDIANZ® DUO puede aumentar el riesgo de acidosis láctica. Considere un monitoreo más frecuente de estos pacientes. |
|
Fármacos que reducen el aclaramiento de metformina |
|
|
Impacto Clínico |
Uso concomitante de fármacos que interfieren con los sistemas comunes de transporte tubular renal implicados en la eliminación renal de metformina (p. ej., transportador catiónico orgánico-2 [OCT2]/inhibidores de la extrusión de múltiples fármacos y toxinas [MATE] como ranolazina, vandetanib, dolutegravir y cimetidina) podría aumentar la exposición sistémica a la metformina y puede aumentar el riesgo de acidosis láctica [consulte Farmacología clínica (12.3)]. |
|
Intervención |
Considere los beneficios y riesgos del uso concomitante. |
|
Alcohol |
|
|
Impacto Clínico |
Se sabe que el alcohol potencia el efecto de la metformina sobre el metabolismo del lactato. |
|
Intervención |
Advierta a los pacientes sobre el consumo excesivo de alcohol mientras reciben JARDIANZ® DUO. |
|
Diuréticos |
|
|
Impacto Clínico |
La coadministración de empagliflozina con diuréticos resultó en un aumento del volumen de orina y de la frecuencia de las micciones, lo que podría aumentar el potencial de hipovolemia. |
|
Intervención |
Antes de iniciar JARDIANZ® DUO, evalúe el estado del volumen y la función renal. En pacientes con hipovolemia, corrija esta condición antes de iniciar JARDIANZ® DUO. Controle los signos y síntomas de hipovolemia y la función renal después de iniciar el tratamiento. |
|
Insulina o Secretagogos de Insulina |
|
|
Impacto Clínico |
El riesgo de hipoglucemia aumenta cuando la empagliflozina se usa en combinación con secretagogos de insulina (p. ej., sulfonilurea) o insulina. La metformina puede aumentar el riesgo de hipoglucemia cuando se combina con insulina y/o un secretagogo de insulina. |
|
Intervención |
La coadministración de JARDIANZ® DUO con un secretagogo de insulina (p. ej., sulfonilurea) o insulina puede requerir dosis más bajas del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia. |
|
Medicamentos que afectan el control glucémico |
|
|
Impacto Clínico |
Ciertos medicamentos tienden a producir hiperglucemia y pueden conducir a la pérdida del control glucémico. Estos fármacos incluyen las tiazidas y otros diuréticos, corticosteroides, fenotiazinas, productos tiroideos, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos, bloqueadores de los canales de calcio e isoniazida. |
|
Intervención |
Cuando dichos medicamentos se administran a un paciente que recibe JARDIANZ® DUO, se debe observar de cerca al paciente para mantener un control glucémico adecuado. Cuando dichos medicamentos se retiran de un paciente que recibe JARDIANZ® DUO, se debe observar de cerca al paciente por hipoglucemia. |
|
Prueba de glucosa en orina positiva |
|
|
Impacto Clínico |
Los inhibidores de SGLT2 aumentan la excreción de glucosa en orina y darán lugar a pruebas de glucosa en orina positivas. |
|
Intervención |
No se recomienda monitorear el control glucémico con pruebas de glucosa en orina en pacientes que toman inhibidores SGLT2. Use métodos alternativos para monitorear el control glucémico. |
|
Interferencia con el ensayo de 1,5-anhidroglucitol (1,5-AG) |
|
|
Impacto Clínico |
Las mediciones de 1,5-AG no son confiables para evaluar el control glucémico en pacientes que toman inhibidores de SGLT2. |
|
Intervención |
No se recomienda monitorear el control glucémico con el ensayo 1,5-AG. Use métodos alternativos para monitorear el control glucémico. |
FARMACOLOGÍA CLÍNICA:
Mecanismo de acción: JARDIANZ® DUO
JARDIANZ® DUO contiene: empagliflozina, un inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT2), y metformina, una biguanida.
Empagliflozina: El cotransportador de sodio-glucosa tipo 2 (SGLT2) es el transportador predominante responsable de la reabsorción de glucosa desde el filtrado glomerular hacia la circulación. La empagliflozina es un inhibidor de SGLT2. Al inhibir SGLT2, la empagliflozina reduce la reabsorción renal de la glucosa filtrada y reduce el umbral renal para la glucosa y, por lo tanto, aumenta la excreción urinaria de glucosa.
Clorhidrato de metformina: La metformina es un agente anti hiperglucemiante que mejora la tolerancia a la glucosa en pacientes con diabetes mellitus tipo 2, reduciendo la glucosa plasmática tanto basal como posprandial. No está química ni farmacológicamente relacionado con ninguna otra clase de agentes anti hiperglucémicos orales. La metformina disminuye la producción de glucosa hepática, disminuye la absorción intestinal de glucosa y mejora la sensibilidad a la insulina al aumentar la captación y utilización de glucosa periférica. A diferencia de las SU, la metformina no produce hipoglucemia ni en pacientes con diabetes mellitus tipo 2 ni en sujetos normales (excepto en circunstancias especiales) [consulte Advertencias y precauciones (5.5)] y no provoca hiperinsulinemia. Con la terapia con metformina, la secreción de insulina permanece sin cambios, mientras que los niveles de insulina en ayunas y la respuesta de insulina plasmática durante todo el día pueden disminuir.
• Farmacodinámica
Empagliflozina
Excreción de glucosa en orina: En pacientes con diabetes tipo 2, la excreción urinaria de glucosa aumentó inmediatamente después de una dosis de empagliflozina y se mantuvo hasta el final de un período de tratamiento de 4 semanas con un promedio de aproximadamente 64 gramos por día con 10 mg de empagliflozina y 78 gramos por día con 25 mg de empagliflozina una vez al día [consulte Estudios clínicos (14)]. Los datos de dosis orales únicas de empagliflozina en sujetos sanos indican que, en promedio, la elevación de la excreción urinaria de glucosa se aproxima al valor inicial en aproximadamente 3 días para las dosis de 10 mg y 25 mg.
Volumen urinario: En un estudio de 5 días, el aumento medio del volumen de orina en 24 horas desde el inicio fue de 341 ml el día 1 y de 135 ml el día 5 del tratamiento con 25 mg de empagliflozina una vez al día.
Electrofisiología cardíaca: En un estudio cruzado aleatorizado, controlado con placebo, con comparador activo, a 30 sujetos sanos se les administró una dosis oral única de 25 mg de empagliflozina, 200 mg de empagliflozina (8 veces la dosis máxima), moxifloxacino y placebo. No se observó ningún aumento en el intervalo QTc con 25 mg o 200 mg de empagliflozina.
• Farmacocinética: JARDIANZ® DUO
Administración de 12.5 mg de empagliflozina/1000 mg de clorhidrato de metformina en condiciones de alimento resultó en una disminución del 9% en el AUC y una disminución del 28% en la Cmax para la empagliflozina, en comparación con las condiciones en ayunas. Para la metformina, el AUC disminuyó un 12% y la Cmax disminuyó un 26% en comparación con las condiciones de ayuno. El efecto observado de los alimentos sobre la empagliflozina y la metformina no se considera clínicamente relevante.
Empagliflozina:
Absorción: La farmacocinética de la empagliflozina se ha caracterizado en voluntarios sanos y pacientes con diabetes tipo 2 y no se observaron diferencias clínicamente relevantes entre las dos poblaciones. Después de la administración oral, las concentraciones plasmáticas máximas de empagliflozina se alcanzaron 1,5 horas después de la dosis. Posteriormente, las concentraciones plasmáticas disminuyeron de manera bifásica con una fase de distribución rápida y una fase terminal relativamente lenta. El AUC y la Cmax plasmáticos medios en estado estacionario fueron 1870 nmol·h/L y 259 nmol/L, respectivamente, con 10 mg de empagliflozina una vez al día, y 4740 nmol·h/L y 687 nmol/L, respectivamente, con 25 mg de empagliflozina. tratamiento con empagliflozina una vez al día. La exposición sistémica a la empagliflozina aumentó de manera proporcional a la dosis en el rango de dosis terapéuticas. Los parámetros farmacocinéticos de dosis única y de estado estacionario de empagliflozina fueron similares, lo que sugiere una farmacocinética lineal con respecto al tiempo
La administración de 25 mg de empagliflozina después de la ingesta de una comida rica en grasas y calorías resultó en una exposición ligeramente menor; el AUC disminuyó aproximadamente un 16% y la Cmax disminuyó aproximadamente un 37%, en comparación con la condición en ayunas. El efecto observado de los alimentos sobre la farmacocinética de la empagliflozina no se consideró clínicamente relevante y la empagliflozina se puede administrar con o sin alimentos.
Distribución: El volumen de distribución aparente en estado estacionario se estimó en 73.8 L según un análisis farmacocinético poblacional. Después de la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, el reparto de glóbulos rojos fue de aproximadamente 36.8% y la unión a proteínas plasmáticas fue de 86.2%.
Eliminación: La semivida de eliminación terminal aparente de la empagliflozina se estimó en 12.4 h y el aclaramiento oral aparente fue de 10.6 L/h según el análisis farmacocinético poblacional. Después de la administración una vez al día, se observó una acumulación de hasta un 22%, con respecto al AUC plasmático, en el estado estacionario, lo que coincidió con la vida media de la empagliflozina.
Metabolismo: No se detectaron metabolitos principales de empagliflozina en plasma humano y los metabolitos más abundantes fueron tres conjugados de glucurónidos (2-O-, 3-O- y 6-O-glucurónido). La exposición sistémica de cada metabolito fue inferior al 10% del material total relacionado con el fármaco. Los estudios in vitro sugirieron que la principal ruta de metabolismo de la empagliflozina en humanos es la glucuronidación por la uridina 5’-difosfo-glucuronosiltransferasas UGT2B7, UGT1A3, UGT1A8 y UGT1A9.
Excreción: Tras la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, aproximadamente el 95.6% de la radiactividad relacionada con el fármaco se eliminó en heces (41.2%) u orina (54.4%). La mayor parte de la radiactividad relacionada con el fármaco recuperada en las heces era el fármaco original inalterado y aproximadamente la mitad de la radiactividad relacionada con el fármaco excretada en la orina era el fármaco original inalterado.
Metformina
Absorción: La biodisponibilidad absoluta de una de 500 mg de clorhidrato de metformina administrada en ayunas es de aproximadamente 50% a 60%. Estudios que utilizan dosis orales únicas de comprimidos de clorhidrato de metformina de 500 mg a 1500 mg y de 850 mg a 2550 mg, indican que existe una falta de proporcionalidad de la dosis con dosis crecientes, lo que se debe a una absorción disminuida más que a una alteración en la eliminación.
Los alimentos disminuyen la extensión y retrasan ligeramente la absorción de metformina, como lo demuestra una Cmax aproximadamente un 40% más baja, un AUC un 25% más baja y una prolongación de 35 minutos del tiempo hasta la concentración plasmática máxima (Tmax) después de la administración de una dosis única de 850 mg. comprimido de metformina con comida, en comparación con la misma concentración de comprimido administrada en ayunas. Se desconoce la relevancia clínica de estas disminuciones.
Distribución: El volumen aparente de distribución (V/F) de metformina luego de dosis orales únicas de comprimidos de clorhidrato de metformina de liberación inmediata de 850 mg promedió 654±358 L. La metformina se une insignificantemente a las proteínas plasmáticas. La metformina se reparte en los eritrocitos, probablemente en función del tiempo.
Eliminación: La metformina tiene una vida media de eliminación plasmática de aproximadamente 6.2 horas. En sangre, la vida media de eliminación es de aproximadamente 17.6 horas, lo que sugiere que la masa de eritrocitos puede ser un compartimento de distribución.
Metabolismo: Los estudios de dosis única intravenosa en sujetos normales demuestran que la metformina no experimenta metabolismo hepático (no se han identificado metabolitos en humanos) ni excreción biliar.
Excreción: Tras la administración oral, aproximadamente el 90% del fármaco absorbido se excreta por vía renal en las primeras 24 horas. El aclaramiento renal es aproximadamente 3.5 veces mayor que el aclaramiento de creatinina, lo que indica que la secreción tubular es la vía principal de eliminación de metformina.
Poblaciones Específicas
Insuficiencia renal: JARDIANZ® DUO : No se han realizado estudios que caractericen la farmacocinética de empagliflozina y metformina después de la administración de JARDIANZ® DUO en pacientes con insuficiencia renal.
Empagliflozina: En pacientes con insuficiencia renal leve (TFGe: de 60 a menos de 90 ml/min/1.73 m2), moderada (TFGe: de 30 a menos de 60 ml/min/1.73 m2) y grave (TFGe: menos de 30 ml/min/1.73 m2) insuficiencia renal y pacientes con insuficiencia renal terminal/enfermedad renal terminal (ESRD), el AUC de empagliflozina aumentó aproximadamente un 18%, 20%, 66% y 48%, respectivamente, en comparación con sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron similares en pacientes con insuficiencia renal moderada e insuficiencia renal terminal/ESRD, en comparación con sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron aproximadamente un 20% más altos en pacientes con insuficiencia renal leve y grave en comparación con sujetos con función renal normal. El análisis farmacocinético poblacional mostró que el aclaramiento oral aparente de empagliflozina disminuyó con una disminución de la TFGe, lo que provocó un aumento en la exposición al fármaco. Sin embargo, la fracción de empagliflozina que se excretó sin cambios en la orina y la excreción urinaria de glucosa disminuyó con la disminución de la TFGe.
Clorhidrato de metformina: En pacientes con función renal disminuida, la vida media plasmática y sanguínea de la metformina se prolonga y el aclaramiento renal se reduce. [consulte Contraindicaciones (4) y Advertencias y precauciones (5.1)].
Deterioro hepático: JARDIANZ® DUO: No se han realizado estudios que caractericen la farmacocinética de la empagliflozina y la metformina después de la administración de JARDIANZ® DUO en pacientes con insuficiencia hepática [consulte Advertencias y precauciones (5.1)].
Empagliflozina: En pacientes con insuficiencia hepática leve, moderada y grave según la clasificación de Child-Pugh, el AUC de la empagliflozina aumentó aproximadamente un 23%, 47% y 75%, y la Cmax aumentó aproximadamente un 4%, 23% y 48%, respectivamente, en comparación con sujetos con función hepática normal.
Clorhidrato de metformina: No se han realizado estudios farmacocinéticos de metformina en pacientes con insuficiencia hepática.
Efectos de la edad, el índice de masa corporal, el sexo y la raza:
Empagliflozina: Según el análisis farmacocinético de la población, la edad, el índice de masa corporal (IMC), el sexo y la raza (asiáticos versus principalmente blancos) no tienen un efecto clínicamente significativo sobre la farmacocinética de la empagliflozina [consulte Uso en poblaciones específicas (8.5)].
Clorhidrato de metformina: Los parámetros farmacocinéticos de metformina no difirieron significativamente entre sujetos normales y pacientes con diabetes mellitus tipo 2 cuando se analizaron según el sexo. De manera similar, en estudios clínicos controlados en pacientes con diabetes mellitus tipo 2, el efecto anti hiperglucémico de la metformina fue comparable en hombres y mujeres.
No se han realizado estudios de los parámetros farmacocinéticos de metformina según la raza. En estudios clínicos controlados de clorhidrato de metformina en pacientes con diabetes mellitus tipo 2, el efecto anti hiperglucémico fue comparable en caucásicos (n=249), negros (n=51) e hispanos (n=24).
Geriátrico: JARDIANZ® DUO: No se han realizado estudios que caractericen la farmacocinética de la empagliflozina y la metformina después de la administración de JARDIANZ® DUO en pacientes geriátricos [consulte Advertencias y precauciones (5.2) y Uso en poblaciones específicas (8.5)].
Empagliflozina: La edad no tuvo un impacto clínicamente significativo en la farmacocinética de la empagliflozina según un análisis farmacocinético poblacional [consulte Uso en poblaciones específicas (8.5)].
Clorhidrato de metformina: Datos limitados de estudios farmacocinéticos controlados de clorhidrato de metformina en sujetos adultos mayores sanos sugieren que el aclaramiento plasmático total de metformina disminuye, la vida media se prolonga y la Cmax aumenta, en comparación con sujetos jóvenes sanos. A partir de estos datos, parece que el cambio en la farmacocinética de metformina con el envejecimiento se explica principalmente por un cambio en la función renal.
Interacciones con fármacos: No se han realizado estudios de interacción farmacocinética de medicamentos con JARDIANZ® DUO; sin embargo, tales estudios se han realizado con los componentes individuales empagliflozina y clorhidrato de metformina.
Empagliflozina: Evaluación in vitro de interacciones farmacológicas: La empagliflozina no inhibe, inactiva ni induce las isoformas CYP450 in vitro los datos sugieren que la principal ruta de metabolismo de la empagliflozina en humanos es la glucuronidación por las uridina 5’-difosfo-glucuronosiltransferasas UGT1A3, UGT1A8, UGT1A9 y UGT2B7. La empagliflozina no inhibe UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. Por lo tanto, no se anticipa ningún efecto de la empagliflozina con medicamentos administrados de manera concomitante que son sustratos de las isoformas principales de CYP450 o UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. No se ha evaluado el efecto de la inducción de UGT (p. ej., inducción por rifampicina o cualquier otro inductor de la enzima UGT) sobre la exposición a empagliflozina.
La empagliflozina es un sustrato para la glicoproteína P (P-gp) y la proteína resistente al cáncer de mama (BCRP), pero no inhibe estos transportadores de salida a dosis terapéuticas. Según los estudios in vitro, se considera poco probable que la empagliflozina cause interacciones con fármacos que son sustratos de la P-gp. La empagliflozina es un sustrato de los transportadores de captación humanos OAT3, OATP1B1 y OATP1B3, pero no de OAT1 y OCT2. La empagliflozina no inhibe ninguno de estos transportadores de captación humanos a concentraciones plasmáticas clínicamente relevantes y, por lo tanto, no se prevé ningún efecto de la empagliflozina con los fármacos administrados de forma concomitante que son sustratos de estos transportadores de captación.
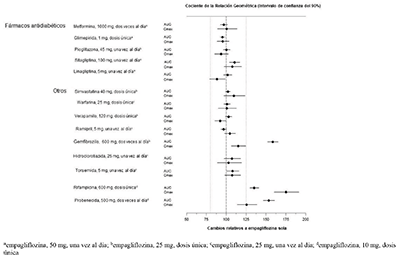
Evaluación in vivo de las interacciones farmacológicas: La farmacocinética de empagliflozina fue similar con y sin coadministración de clorhidrato de metformina, glimepirida, pioglitazona, sitagliptina, linagliptina, warfarina, verapamilo, ramipril y simvastatina en voluntarios sanos y con o sin coadministración de hidroclorotiazida y torsemida en pacientes con diabetes tipo 2 (ver Figura 1). En sujetos con función renal normal, la coadministración de empagliflozina con probenecida resultó en una disminución del 30% en la fracción de empagliflozina excretada en la orina sin ningún efecto sobre la excreción de glucosa en orina de 24 horas. Se desconoce la relevancia de esta observación para los pacientes con insuficiencia renal.
Figura 1 Efecto de diversos medicamentos sobre la farmacocinética de la empagliflozina según se muestra como un intervalo de confianza del 90% de la media geométrica del AUC y relaciones Cmax [las líneas de referencia indican 100% (80% - 125%)]
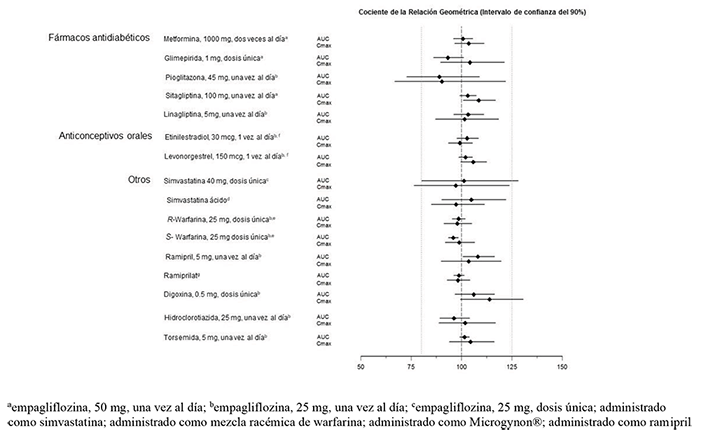
La empagliflozina no tuvo un efecto clínicamente relevante sobre la farmacocinética de la metformina, la glimepirida, la pioglitazona, la sitagliptina, la linagliptina, la warfarina, la digoxina, el ramipril, la simvastatina, la hidroclorotiazida, la torsemida y los anticonceptivos orales cuando se administraron junto con la empagliflozina (ver Figura 2).
Figura 2. Efecto de la empagliflozina sobre la farmacocinética de varios medicamentos, como se muestra como un intervalo de confianza del 90% de la media geométrica del AUC y relaciones Cmax [las líneas de referencia indican 100% (80% - 125%)]
• Clorhidrato de metformina
|
Tabla 5 Efecto del fármaco coadministrado sobre la exposición sistémica a la metformina plasmática |
|||||
|
Medicamento coadministrado |
Dosis de fármaco coadministrado* |
Dosis de Clorhidrato de metformina* |
Relación media geométrica (relación con/sin fármaco coadministrado) Sin efecto = 1.0 |
||
|
ABC† |
Cmáx |
||||
|
Gliburida |
5 mg |
850 mg |
metformina |
0.91‡ |
0.93‡ |
|
Furosemida |
40 mg |
850 mg |
metformina |
1.09‡ |
1.22‡ |
|
Nifedipina |
10 mg |
850 mg |
metformina |
1.16 |
1.21 |
|
Propranolol |
40 mg |
850 mg |
metformina |
0.90 |
0.94 |
|
Ibuprofeno |
400 mg |
850 mg |
metformina |
1.05‡ |
1.07‡ |
|
Los fármacos catiónicos eliminados por secreción tubular renal pueden reducir la eliminación de metformina [consulte Interacciones farmacológicas (7)]. |
|||||
|
Cimetidina |
400 mg |
850 mg |
metformina |
1.40 |
1.61 |
|
Los inhibidores de la anhidrasa carbónica pueden causar acidosis metabólica [consulte Interacciones farmacológicas (7)]. |
|||||
|
Topiramato** |
100 mg |
500 mg |
metformina |
1.25 |
1.17 |
|
* Toda la metformina y los medicamentos coadministrados se administraron en dosis únicas † ABC = ABC(INF) ‡ Razón de medias aritméticas **En estado estacionario con topiramato 100 mg cada 12 horas y metformina 500 mg cada 12 horas; ABC = ABC (0-12 horas) |
|||||
|
Tabla 6 Efecto de la metformina sobre la exposición sistémica al fármaco coadministrado |
|||||
|
Medicamento coadministrado |
Dosis de fármaco coadministrado* |
Dosis de Clorhidrato de metformina* |
Relación media geométrica (relación con/sin metformina) Sin efecto = 1.0 |
||
|
ABC† |
Cmáx |
||||
|
Gliburida |
5 mg |
500 mg§ |
gliburida |
0.78‡ |
0.63‡ |
|
Furosemida |
40 mg |
850 mg |
furosemida |
0.87‡ |
0.69‡ |
|
Nifedipina |
10 mg |
850 mg |
nifedipina |
1.10§ |
1.08 |
|
Propranolol |
40 mg |
850 mg |
propranolol |
1.01§ |
0.94 |
|
Ibuprofeno |
400 mg |
850 mg |
ibuprofeno |
0.97¶ |
1.01¶ |
|
Cimetidina |
400 mg |
850 mg |
cimetidina |
0.95§ |
1.01 |
|
* Toda la metformina y los medicamentos coadministrados se administraron en dosis únicas † AUC = AUC(INF) a menos que se indique lo contrario ‡ Razón de medias aritméticas, p-valor de diferencia <0.05 § AUC (0-24 horas) informado ¶ Razón de medias aritméticas |
|||||
ESTUDIOS CLÍNICOS:
Estudios de control glucémico JARDIANZ DUO: En pacientes con diabetes tipo 2, el tratamiento con empagliflozina y metformina produjo mejoras clínica y estadísticamente significativas en la HbA1c en comparación con el placebo. Se observaron reducciones en la HbA1c en todos los subgrupos, incluidos la edad, el sexo, la raza y el índice de masa corporal (IMC) inicial.
Terapia de combinación adicional de empagliflozina con metformina: Un total de 637 pacientes con diabetes tipo 2 participaron en un estudio doble ciego controlado con placebo para evaluar la eficacia y seguridad de empagliflozina en combinación con metformina.
Pacientes con diabetes tipo 2 controlada inadecuadamente con al menos 1500 mg de clorhidrato de metformina por día entraron a un periodo abierto de preinclusión, doble ciego con placebo durante 2 semanas. Al final del período de preinclusión, los pacientes que permanecieron inadecuadamente controlados y tenían una HbA1c entre 7 y 10% fueron aleatorizados para recibir placebo, empagliflozina 10 mg o empagliflozina 25 mg.
En la semana 24, el tratamiento con empagliflozina 10 mg o 25 mg diarios proporcionó reducciones estadísticamente significativas en HbA1c (valor de p <0.0001), GPA y peso corporal en comparación con el placebo (consulte la Tabla 7).
|
Tabla 7 Resultados en la semana 24 de un estudio controlado con placebo para Empagliflozina utilizada en combinación con metformina |
|||
|
Empagliflozina 10 mg + metformina N=217 |
Empagliflozina 25 mg + Metformina N=213 |
Placebo + Metformina N=207 |
|
|
HbA1c (%)a |
|||
|
Línea de base (media) |
7.9 |
7.9 |
7.9 |
|
Cambio desde la línea de base (media ajustada) |
-0.7 |
-0.8 |
-0.1 |
|
Diferencia de placebo + metformina (media ajustada) (IC 95%) |
-0.6b (-0.7,-0.4) |
-0.6b (-0.8, -0.5) |
-- |
|
Pacientes [n (%)] que lograron HbA1c <7% |
75 (38%) |
74 (39%) |
23 (13%) |
|
GPA (mg/dL)C |
|||
|
Línea de base (media) |
155 |
149 |
156 |
|
Cambio desde el inicio (media ajustada) |
-20 |
-22 |
6 |
|
Diferencia de placebo + metformina (media ajustada) |
-26 |
-29 |
-- |
|
Peso corporal |
|||
|
Media basal en kg |
82 |
82 |
80 |
|
% de cambio desde el inicio (media ajustada) |
-2.5 |
-2.9 |
-0.5 |
|
Diferencia con el placebo (media ajustada) (IC del 95%) |
-2.0b (-2.6,-1.4) |
-2.5b (-3.1, -1.9) |
-- |
|
aPoblación por intención de tratar modificada. Se utilizó la última observación del estudio (LOCF) para imputar los datos faltantes en la semana 24. En la semana 24, se imputó el 9.7%, el 14.1% y el 24.6% para los pacientes aleatorizados a empagliflozina 10 mg, empagliflozina 25 mg y placebo, respectivamente. bValor p de ANCOVA <0.0001 (HbA1c: el modelo ANCOVA incluye la HbA1c inicial, el tratamiento, la función renal y la región. Peso corporal y GPA: se usa el mismo modelo que para la HbA1c, pero además incluye el peso corporal inicial/GPA inicial, respectivamente). cGPA (mg/dL); para empagliflozina 10 mg, n=216, para empagliflozina 25 mg, n=213 y para placebo, n=207 |
|||
En la semana 24, la presión arterial sistólica se redujo de manera estadísticamente significativa en comparación con el placebo en -4.1 mmHg (corregida con placebo, valor de p <0.0001) para empagliflozina 10 mg y -4.8 mmHg (corregida con placebo, valor de p <0.0001) para empagliflozina 25 mg.
Tratamiento combinado inicial de empagliflozina con metformina: Un total de 1364 pacientes con diabetes tipo 2 participaron en un estudio doble ciego, aleatorizado y con control activo para evaluar la eficacia y seguridad de empagliflozina en combinación con metformina como terapia inicial en comparación con los componentes individuales correspondientes.
Los pacientes sin tratamiento previo con diabetes tipo 2 controlada de manera inadecuada ingresaron a un periodo abierto de preinclusión, doble ciego con placebo durante 2 semanas. Al final del período de preinclusión, los pacientes que seguían sin un control adecuado y tenían una HbA1c entre el 7 y el 10.5% se aleatorizaron a uno de los 8 brazos de tratamiento activo: empagliflozina 10 mg o 25 mg; clorhidrato de metformina1000 mg o 2000 mg; empagliflozina 10 mg en combinación con 1000 mg o 2000 mg de clorhidrato de metformina; o empagliflozina 25 mg en combinación con 1000 mg o 2000 mg de clorhidrato de metformina.
En la semana 24, la terapia inicial de empagliflozina en combinación con metformina proporcionó reducciones estadísticamente significativas en la HbA1c (valor de p <0.01) en comparación con los componentes individuales (consulte la Tabla 8).
|
Tabla 8 Parámetros glucémicos a las 24 semanas en un estudio que compara la empagliflozina y la metformina con los componentes individuales como terapia inicial |
||||||||
|
Empagliflozina 10 mg + metformina 1000 mga N=161 |
Empagliflozina 10 mg + metformina 2000 mga N=167 |
Empagliflozina 25 mg + metformina 1000 mga N=165 |
Empagliflozina 25 mg + metformina 2000 mga N=169 |
Empagliflozina 10 mg N=169 |
Empagliflozina 25 mg N=163 |
Metformina 1000 mg N=167 |
Metformina 2000 mga N=162 |
|
|
HbA1c (%) |
||||||||
|
Línea de base (media) |
8.7 |
8.7 |
8.8 |
8.7 |
8.6 |
8.9 |
8.7 |
8.6 |
|
Cambio desde la línea de base (media ajustada) |
-2.0 |
-2.1 |
-1.9 |
-2.1 |
-1.4 |
-1.4 |
-1.2 |
-1.8 |
|
Comparación frente a empagliflozina (media ajustada) (95% IC) |
-0.6b (-0.9,-0.4) |
-0.7b (-1.0, -0.5) |
-0.6c (-0.8, -0.3) |
-0.7b (-1.0,-0.5) |
-- |
-- |
-- |
-- |
|
Comparación vs metformina (media ajustada) (95% IC) |
-0.8b (-1.0,-0.6) |
-0.3b (-0.6, -0.1) |
-0.8c (-1.0,-0.5) |
-0.3c (-0.6,-0.1) |
-- |
-- |
-- |
-- |
|
Pacientes [n (%)] que lograron HbA1c <7% |
96 (63%) |
112 (70%) |
91 (57%) |
111 (68%) |
69 (43%) |
51 (32%) |
63 (38%) |
92 (58%) |
|
aDosis diaria total de clorhidrato de metformina, administrada en dos dosis iguales por día. bValor p ≤0.0062 (población por intención de tratar modificada [caso observado] El modelo MMRM incluyó tratamiento, función renal, región, visita, interacción visita por tratamiento y HbA1c inicial). cValor p ≤0.0056 (población por intención de tratar modificada [caso observado] El modelo MMRM incluyó tratamiento, función renal, región, visita, interacción visita por tratamiento y HbA1c inicial). |
||||||||
Terapia de combinación adicional de empagliflozina con metformina y sulfonilurea
Un total de 666 pacientes con diabetes tipo 2 participaron en un estudio doble ciego controlado con placebo para evaluar la eficacia y seguridad de empagliflozina en combinación con metformina más una sulfonilurea.
Pacientes con diabetes tipo 2 inadecuadamente controlada con al menos 1500 mg por día de metformina clorhidrato y con una sulfonilurea, ingresó a un período de preinclusión abierto de dos semanas con placebo. Al final del período de preinclusión, los pacientes que seguían sin un control adecuado y tenían una HbA1c entre el 7% y el 10% se aleatorizaron para recibir placebo, 10 mg de empagliflozina o 25 mg de empagliflozina.
El tratamiento con empagliflozina 10 mg o 25 mg diarios proporcionó reducciones estadísticamente significativas en HbA1c (valor de p <0.0001), FPG y peso corporal en comparación con el placebo (consulte la Tabla 9).
|
Tabla 9 Resultados en la semana 24 de un estudio controlado con placebo para empagliflozina en combinación con metformina y sulfonilurea |
|||
|
Empagliflozina 10 mg + Metformina + SU N=225 |
Empagliflozina 25 mg + Metformina + SU N=216 |
Placebo + Metformina + SU N=225 |
|
|
HbA1c (%)a |
|||
|
Línea de base (media) |
8.1 |
8.1 |
8.2 |
|
Cambio desde el inicio (media ajustada) |
-0.8 |
-0.8 |
-0.2 |
|
Diferencia con el placebo (media ajustada) (IC del 95%) |
-0.6b (-0.8,-0.5) |
-0.6b (-0.7,-0.4) |
-- |
|
Pacientes [n (%)] que lograron HbA1c <7% |
55 (26%) |
65 (32%) |
20 (9%) |
|
GPA (mg/dL)c |
|||
|
Línea de base (media) |
151 |
156 |
152 |
|
Cambio desde el inicio (media ajustada) |
-23 |
-23 |
6 |
|
Diferencia con placebo (media ajustada) |
-29 |
-29 |
-- |
|
Peso corporal |
|||
|
Media basal en kg |
77 |
78 |
76 |
|
% de cambio desde el inicio (media ajustada) |
-2.9 |
-3.2 |
-0.5 |
|
Diferencia con el placebo (media ajustada) (IC del 95%) |
-2.4b (-3.0,-1.8) |
-2.7b (-3.3,-2.1) |
-- |
|
aPoblación por intención de tratar modificada. Se utilizó la última observación del estudio (LOCF) para imputar los datos faltantes en la semana 24. En la semana 24, se imputó el 17.8%, el 16.7% y el 25.3% de los pacientes aleatorizados a empagliflozina 10 mg, empagliflozina 25 mg y placebo, respectivamente. bValor p de ANCOVA <0.0001 (HbA1c: el modelo ANCOVA incluye la HbA1c inicial, el tratamiento, la función renal y la región. Peso corporal y GPA: se usa el mismo modelo que para la HbA1c, pero además incluye el peso corporal inicial/GPA inicial, respectivamente). cGPA (mg/dL); para empagliflozina 10 mg, n=225, para empagliflozina 25 mg, n=215, para placebo, n=224 |
|||
Estudio con control activo frente a glimepirida en combinación con metformina:
La eficacia de la empagliflozina se evaluó en un estudio doble ciego controlado con glimepirida en 1545 pacientes con diabetes tipo 2 con control glucémico insuficiente a pesar del tratamiento con metformina.
Los pacientes con un control glucémico inadecuado y una HbA1c entre el 7% y el 10% después de un período de preinclusión de 2 semanas se aleatorizaron para recibir 25 mg de glimepirida o empagliflozina.
En la semana 52, 25 mg de empagliflozina y glimepirida redujeron la HbA1c y la FPG (ver Tabla 10, Figura 3). La diferencia en el tamaño del efecto observado entre la empagliflozina de 25 mg y la glimepirida excluyó el margen de no inferioridad preespecificado del 0.3%. La dosis diaria media de glimepirida fue de 2.7 mg y la dosis máxima aprobada en los Estados Unidos es de 8 mg por día.
|
Tabla 10 Resultados en la semana 52 de un estudio con control activo que compara la empagliflozina a la glimepirida como terapia complementaria en pacientes controlados inadecuadamente con metformina |
||
|
Empagliflozina 25 mg + Metformina N=765 |
Glimepirida + Metformina N=780 |
|
|
HbA1c(%)a |
||
|
Línea de base (media) |
7.9 |
7.9 |
|
Cambio desde el inicio (media ajustada) |
-0.7 |
-0.7 |
|
Diferencia con glimepirida (media ajustada) (IC 97,5%) |
-0.07b (-0.15, -0.01) |
-- |
|
GPA (mg/dL)d |
||
|
Línea de base (media) |
150 |
150 |
|
Cambio desde el inicio (media ajustada) |
-19 |
-9 |
|
Diferencia con glimepirida (media ajustada) |
-11 |
-- |
|
Peso corporal |
||
|
Media basal en kg |
82.5 |
83 |
|
% de cambio desde el inicio (media ajustada) |
-3.9 |
-2.0 |
|
Diferencia con glimepirida (media ajustada) (IC del 95%) |
-5.9c (-6.3,-5.5) |
-- |
|
aPoblación por intención de tratar modificada. Se utilizó la última observación del estudio (LOCF) para imputar los datos que faltaban en la semana 52. En la semana 52, se imputaron los datos del 15.3% y el 21.9% de los pacientes aleatorizados a empagliflozina 25 mg y glimepirida, respectivamente. bNo inferior, valor p del modelo ANCOVA <0,0001 (HbA1c: el modelo ANCOVA incluye la HbA1c inicial, el tratamiento, la función renal y la región) cValor p de ANCOVA <0.0001 (Peso corporal y GPA: se usa el mismo modelo que para HbA1c, pero además incluye el peso corporal inicial/GPA inicial, respectivamente). dGPA (mg/dL); para empagliflozina 25 mg, n=764, para glimepirida, n=779 |
||
Figura 3 Cambio medio ajustado de HbA1c en cada punto temporal (completadores) y en la semana 52 (población mITT) - LOCF - LOCF
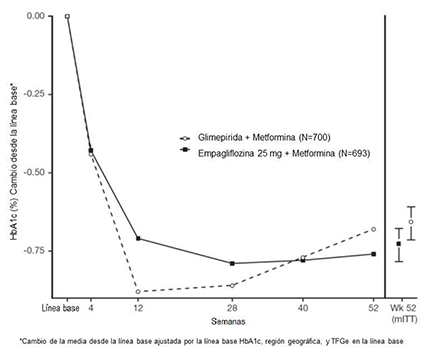
En la semana 52, el cambio medio ajustado desde el inicio en la presión arterial sistólica fue de -3.6 mmHg, en comparación con 2.2 mmHg para glimepirida. Las diferencias entre los grupos de tratamiento para la presión arterial sistólica fueron estadísticamente significativas (valor de p <0.0001).
En la semana 104, el cambio medio ajustado desde el inicio en HbA1c fue -0.75% para empagliflozina 25 mg y -0.66% para glimepirida. La diferencia media ajustada del tratamiento fue -0.09% con un intervalo de confianza del 97.5% de (-0.32%, 0.15%), excluyendo el margen de no inferioridad preespecificado del 0.3%. La dosis diaria media de glimepirida fue de 2.7 mg y la dosis máxima aprobada en los Estados Unidos es de 8 mg por día. El análisis de la semana 104 incluyó datos con y sin medicación de rescate glucémico concomitante, así como datos sin tratamiento. Los datos que faltaban para los pacientes que no proporcionaron ninguna información en la visita se imputaron en función de los datos observados sin tratamiento. En este análisis de imputación múltiple, el 13.9% de los datos se imputaron para empagliflozina 25 mg y el 12.9% para glimepirida.
En la semana 104, 25 mg diarios de empagliflozina dieron como resultado una diferencia estadísticamente significativa en el cambio desde el inicio para el peso corporal en comparación con glimepirida (-3.1 kg para 25 mg de empagliflozina frente a +1.3 kg para glimepirida; ANCOVA-LOCF, valor de p <0.0001).
Estudio de resultados cardiovasculares de empagliflozina en pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica:
La empagliflozina está indicada para reducir el riesgo de muerte cardiovascular en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida. A continuación, se presenta el efecto de la empagliflozina sobre el riesgo cardiovascular en pacientes adultos con diabetes tipo 2 y enfermedad cardiovascular aterosclerótica establecida y estable.
El estudio EMPA-REG OUTCOME, un ensayo de grupos paralelos, multicéntrico, multinacional, aleatorizado, doble ciego, comparó el riesgo de experimentar un evento cardiovascular adverso mayor (MACE) entre empagliflozina y placebo cuando estos se agregaron y se usaron concomitantemente con tratamientos asistenciales estandarizados para diabetes y enfermedad cardiovascular aterosclerótica. Los medicamentos antidiabéticos coadministrados debían mantenerse estables durante las primeras 12 semanas del ensayo. Posteriormente, las terapias antidiabéticas y ateroscleróticas podrían ajustarse, a discreción de los investigadores, para garantizar que los participantes fueran tratados de acuerdo con la atención estándar para estas enfermedades.
Se trató un total de 7020 pacientes (empagliflozina 10 mg = 2345; empagliflozina 25 mg = 2342; placebo = 2333) y se siguió durante una mediana de 3.1 años. Aproximadamente el 72% de la población del estudio era caucásica, el 22% era asiática y el 5% era negra. La edad media fue de 63 años y aproximadamente el 72% eran hombres.
Todos los pacientes del estudio tenían diabetes mellitus tipo 2 inadecuadamente controlada al inicio del estudio (HbA1c mayor o igual al 7%). La HbA1c media al inicio del estudio fue del 8,1% y el 57% de los participantes tenían diabetes durante más de 10 años. Aproximadamente el 31%, el 22% y el 20% informaron antecedentes de neuropatía, retinopatía y nefropatía a los investigadores, respectivamente, y la TFGe media fue de 74 ml/min/1.73 m2. Al inicio del estudio, los pacientes fueron tratados con uno (~30%) o más (~70%) medicamentos antidiabéticos, incluidos metformina (74%), insulina (48%) y sulfonilurea (43%).
Todos los pacientes tenían enfermedad cardiovascular aterosclerótica establecida al inicio, incluido uno (82%) o más (18%) de los siguientes: antecedentes documentados de enfermedad arterial coronaria (76%), accidente cerebrovascular (23%) o enfermedad arterial periférica (21%). Al inicio del estudio, la presión arterial sistólica media fue de 136 mmHg, la presión arterial diastólica media fue de 76 mmHg, la LDL media fue de 86 mg/dL, la HDL media fue de 44 mg/dL y la proporción media de albúmina a creatinina en orina (UACR) fue de 175 mg/g. Al inicio del estudio, aproximadamente el 81% de los pacientes fueron tratados con inhibidores del sistema renina angiotensina, el 65% con bloqueadores beta, el 43% con diuréticos, el 77% con estatinas y el 86% con agentes antiplaquetarios (principalmente aspirina).
El criterio de valoración principal en EMPA-REG OUTCOME fue el tiempo transcurrido hasta la primera aparición de un evento cardíaco adverso mayor (MACE). Un evento cardíaco adverso mayor se definió como la ocurrencia de una muerte cardiovascular o un infarto de miocardio (IM) no fatal o un accidente cerebrovascular no fatal. El plan de análisis estadístico había especificado previamente que las dosis de 10 y 25 mg se combinarían. Se utilizó un modelo de riesgos proporcionales de Cox para evaluar la no inferioridad frente al margen de riesgo preespecificado de 1.3 para el cociente de riesgos instantáneos de MACE y la superioridad sobre MACE si se demostraba la no inferioridad. El error de tipo 1 se controló en múltiples pruebas utilizando una estrategia de prueba jerárquica.
La empagliflozina redujo significativamente el riesgo de la primera aparición del criterio principal de valoración compuesto de muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal (HR: 0.86; IC del 95%: 0.74, 0.99). El efecto del tratamiento se debió a una reducción significativa del riesgo de muerte cardiovascular en sujetos aleatorizados a empagliflozina (HR: 0.62; IC del 95%: 0.49, 0.77), sin cambios en el riesgo de infarto de miocardio no mortal o accidente cerebrovascular no mortal (ver Tabla 11 y Figuras 4 y 5). Los resultados de las dosis de 10 mg y 25 mg de empagliflozina coincidieron con los resultados de los grupos de dosis combinadas.
|
Tabla 11 Efecto del tratamiento para el criterio principal de valoración compuesto y sus componentes |
|||
|
Placebo N=2333 |
Empagliflozina N=4687 |
Cociente de riesgos instantáneos frente a placebo (95% IC) |
|
|
Compuesto de muerte cardiovascular, infarto de miocardio no fatal, accidente cerebrovascular no fatal (tiempo hasta la primera aparición) b |
282 (12.1%) |
490 (10.5%) |
0.86 (0.74, 0.99) |
|
Infarto de miocardio no fatalc |
121 (5.2%) |
213 (4.5%) |
0.87 (0.70, 1.09) |
|
Accidente cerebrovascular no fatalc |
60 (2.6%) |
150 (3.2%) |
1.24 (0.92, 1.67) |
|
Muerte cardiovascularc |
137 (5.9%) |
172 (3.7%) |
0.62 (0.49, 0.77) |
|
aConjunto tratado (pacientes que habían recibido al menos una dosis del fármaco del estudio) bp-valor de superioridad (2 caras) 0.04 cNúmero total de eventos |
|||
Figura 4 Incidencia acumulada estimada del primer MACE
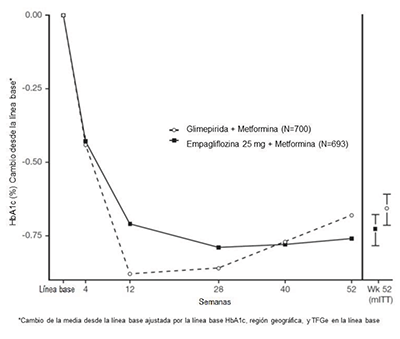
Figura 5 Incidencia acumulada estimada de muerte cardiovascular
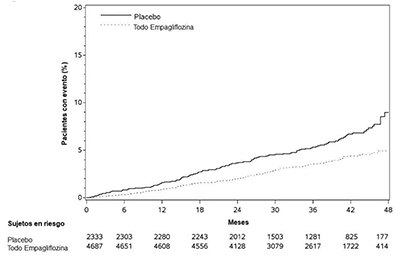
La eficacia de la empagliflozina sobre la muerte cardiovascular fue generalmente consistente en los principales subgrupos demográficos y de enfermedades.
El estado vital se obtuvo para el 99.2% de los sujetos en el ensayo. Se registraron un total de 463 muertes durante el ensayo EMPA-REG OUTCOME. La mayoría de estas muertes se clasificaron como muertes cardiovasculares. Las muertes no cardiovasculares fueron solo una pequeña proporción de las muertes y, se equilibraron entre los grupos de tratamiento (2.1% en pacientes tratados con empagliflozina y 2.4% de pacientes tratados con placebo).PRESENTACIONES:
Caja con 60 Tabletas Recubiertas de 5mg/850 mg, 5 mg/1000 mg, 12.5 mg/850 mg o 12.5 mg/1000mg en blister e instructivo anexo.
Caja con 7 Tabletas Recubiertas de 5mg/850 mg, 5 mg/1000 mg, 12.5 mg/850 mg o 12.5 mg/1000mg en blister e instructivo anexo (Muestra Médica)..
DOSIS Y ADMINISTRACIÓN:
Antes del inicio de JARDIANZ® DUO:
• Evalúe la función renal antes de iniciar JARDIANZ® DUO y según esté clínicamente indicado [consulte Advertencias y precauciones (5.1, 5.3)]. • En pacientes con hipovolemia corrija esta condición antes de iniciar JARDIANZ® DUO [consulte Advertencias y precauciones (5.3) y Uso en poblaciones específicas (8.5, 8.6)].
Posología y administración recomendada:
• Individualice la dosis inicial de JARDIANZ® DUO según el régimen actual del paciente:
— En pacientes que toman clorhidrato de metformina, cambiar a JARDIANZ® DUO que contiene 5 mg de empagliflozina con una dosis diaria total similar de clorhidrato de metformina;
— En pacientes que toman empagliflozina, cambie a JARDIANZ® DUO que contiene 850 mg de clorhidrato de metformina con una dosis diaria total similar de empagliflozina;
— En pacientes ya tratados con empagliflozina y clorhidrato de metformina, cambie a JARDIANZ® DUO que contenga las mismas dosis diarias totales de cada componente. • Supervise la efectividad y la tolerabilidad, y ajuste la dosis según corresponda, sin exceder la dosis diaria máxima recomendada de 25 mg de empagliflozina y 2000 mg de clorhidrato de metformina.
• Tome JARDIANZ® DUO dos veces al día con las comidas; con aumento gradual de la dosis para reducir los efectos secundarios gastrointestinales debidos a la metformina.
Recomendaciones posológicas en pacientes con insuficiencia renal:
• No se recomienda iniciar JARDIANZ® DUO en pacientes con una TFGe inferior a 45 ml/min/1.73 m2, debido al componente de metformina.
• JARDIANZ® DUO está contraindicado en pacientes con una TFGe inferior a 30 ml/min/1.73 m2 o en pacientes en diálisis [consulte Contraindicaciones (4), Advertencias y precauciones (5.1) y Uso en poblaciones específicas (8.6)].
Interrupción por procedimientos de imágenes de contraste yodado:
Suspender JARDIANZ® DUO en el momento o antes de un procedimiento de obtención de imágenes con contraste yodado en pacientes con una TFGe menor a 60 ml/min/1.73 m2; en pacientes con antecedentes de enfermedad hepática, alcoholismo o insuficiencia cardiaca; o en pacientes a los que se les administrará contraste yodado intraarterial. Vuelva a evaluar la TFGe 48 horas después del procedimiento de imagen; reinicie JARDIANZ® DUO si la función renal es estable [consulte Advertencias y precauciones (5.1)].
USO EN POBLACIONES ESPECÍFICAS:
• Embarazo:
Resumen de riesgos: Según los datos en animales que muestran efectos renales adversos de la empagliflozina, no se recomienda JARDIANZ® DUO durante el segundo y tercer trimestre del embarazo.
Los datos limitados disponibles con JARDIANZ® DUO o empagliflozina en mujeres embarazadas no son suficientes para determinar un riesgo asociado con el fármaco de anomalías congénitas graves y abortos espontáneos. Los estudios publicados con el uso de metformina durante el embarazo no informaron una asociación clara entre la metformina y el riesgo de malformaciones congénitas importantes o aborto espontáneo (ver Datos). Existen riesgos para la madre y el feto asociados con la diabetes mal controlada durante el embarazo (consulte Consideraciones clínicas).
En estudios con animales, la empagliflozina, un componente de JARDIANZ® DUO, provocó cambios renales adversos en ratas cuando se administró durante un período de desarrollo renal correspondiente a finales del segundo y terceros trimestres del embarazo humano. Dosis de aproximadamente 13 veces la dosis clínica máxima causó dilataciones de los túbulos y la pelvis renal que fueron reversibles. No se observaron efectos adversos en el desarrollo cuando se administró metformina a ratas o conejas preñadas (consulte Datos).
El riesgo de fondo estimado de defectos congénitos importantes es del 6% al 10% en mujeres con diabetes pregestacional con HbA1c >7 y se ha informado que es tan alto como del 20% al 25% en mujeres con HbA1c >10. Se desconoce el riesgo de fondo estimado de aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Consideraciones clínicas: Riesgo materno y/o embrionario/fetal asociado a la enfermedad: La diabetes mal controlada en el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro y complicaciones en el parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, muerte fetal y morbilidad relacionada con la macrosomía.
Datos
Datos humanos: Los datos publicados de los estudios posteriores a la comercialización no informaron una asociación clara entre metformina y defectos de nacimiento importantes, abortos espontáneos o resultados maternos o fetales adversos cuando se usó metformina durante el embarazo. Sin embargo, estos estudios no pueden establecer definitivamente la ausencia de ningún riesgo asociado con la metformina debido a las limitaciones metodológicas, incluido el tamaño pequeño de la muestra y los grupos de comparación inconsistentes.
Datos de animales:
Empagliflozina: La empagliflozina administrada directamente a ratas jóvenes desde el día posnatal (DPN) 21 hasta el DPN 90 en dosis de 1, 10, 30 y 100 mg/kg/día provocó un aumento del peso de los riñones y dilatación pélvica y tubular renal a 100 mg/kg/día que se aproxima a 13 veces la dosis clínica máxima de 25 mg, según el AUC. Estos hallazgos no se observaron después de un período de recuperación de 13 semanas sin fármacos. Estos resultados ocurrieron con la exposición al fármaco durante períodos de desarrollo renal en ratas que corresponden a finales del segundo y tercer trimestre del desarrollo renal humano.
En estudios de desarrollo embriofetal en ratas y conejos, la empagliflozina se administró a intervalos que coincidían con el período del primer trimestre de la organogénesis en humanos. Las dosis de hasta 300 mg/kg/día, que se aproximan a 48 veces (ratas) y 128 veces (conejos) la dosis clínica máxima de 25 mg (basada en el AUC), no produjeron efectos adversos en el desarrollo. En ratas, a dosis más altas de empagliflozina que causaron toxicidad materna, las malformaciones de los huesos de las extremidades aumentaron en los fetos a los 700 mg/kg/día o 154 veces la dosis clínica máxima de 25 mg. La empagliflozina atraviesa la placenta y llega a los tejidos fetales en ratas. En el conejo, las dosis más altas de empagliflozina produjeron toxicidad materna y fetal a los 700 mg/kg/día, o 139 veces la dosis clínica máxima de 25 mg.
En estudios de desarrollo prenatal y posnatal en ratas preñadas, se administró empagliflozina desde el día 6 de gestación hasta el día 20 de lactancia (destete) a una dosis de hasta 100 mg/kg/día (aproximadamente 16 veces la dosis clínica máxima de 25 mg) sin toxicidad materna. Se observó una reducción del peso corporal en las crías con una dosis mayor o igual a 30 mg/kg/día (aproximadamente 4 veces la dosis clínica máxima de 25 mg).
Clorhidrato de metformina: El clorhidrato de metformina no causó efectos adversos en el desarrollo cuando se administró a ratas Sprague Dawley y conejas preñadas en dosis de hasta 600 mg/kg/día durante el período de organogénesis. Esto representa una exposición de aproximadamente 2 y 6 veces la dosis clínica de 2000 mg, según el área de superficie corporal (mg/m2) para ratas y conejos, respectivamente.
Empagliflozina y Clorhidrato de metformina: No se observaron efectos adversos en el desarrollo cuando empagliflozina y clorhidrato de metformina se coadministraron a ratas preñadas durante el período de organogénesis a exposiciones de aproximadamente 35 y 14 veces la exposición clínica AUC de empagliflozina asociada con las dosis de 10 mg y 25 mg, respectivamente, y 4 veces la exposición clínica AUC de metformina asociada con la dosis de 2000 mg.
• Lactancia
Resumen de riesgos: Existe información limitada sobre la presencia de JARDIANZ® DUO o sus componentes (empagliflozina o metformina) en la leche humana, los efectos en el lactante o los efectos en la producción de leche. Los estudios publicados limitados informan que la metformina está presente en la leche humana (ver Datos). La empagliflozina está presente en la leche de ratas lactantes (consulte Datos). Dado que la maduración del riñón humano ocurre en el útero y durante los primeros 2 años de vida, cuando puede ocurrir la exposición durante la lactancia, puede haber riesgo para el riñón humano en desarrollo.
Debido al potencial de reacciones adversas graves en un lactante amamantado, incluido el potencial de empagliflozina para afectar el desarrollo renal posnatal, avise a los pacientes que no se recomienda el uso de JARDIANZ® DUO durante la lactancia.
Datos:
Estudios clínicos de lactancia publicados notifican que la metformina está presente en la leche humana, lo que resultó en dosis para lactantes de aproximadamente 0.11% a 1% de la dosis materna ajustada al peso y una relación leche/plasma que oscila entre 0,13 y 1. Sin embargo, los estudios no fueron diseñados para establecer definitivamente el riesgo de uso de metformina durante la lactancia debido al pequeño tamaño de la muestra y los datos limitados de eventos adversos recopilados en lactantes.
La empagliflozina estuvo presente en un nivel bajo en tejidos fetales de rata después de una dosis oral única a las madres en el día 18 de gestación. En la leche de rata, la proporción media de leche a plasma varió de 0.634 a 5, y fue mayor que uno de 2 a 24 horas posdosis. La proporción media máxima de leche a plasma de 5 se produjo 8 horas después de la dosis, lo que sugiere una acumulación de empagliflozina en la leche. Las ratas jóvenes expuestas directamente a la empagliflozina mostraron un riesgo para el riñón en desarrollo (dilatación pélvica renal y tubular) durante la maduración.
• Mujeres y hombres con potencial reproductivo: Analice la posibilidad de un embarazo no deseado con mujeres premenopáusicas, ya que la terapia con metformina puede provocar la ovulación en algunas mujeres anovulatorias.
• Uso pediátrico: No se ha establecido la seguridad y eficacia de JARDIANZ® DUO en pacientes pediátricos.
• Uso geriátrico: Debido a que pueden ocurrir anomalías en la función renal después de iniciar empagliflozina, la metformina se excreta sustancialmente por el riñón y el envejecimiento puede estar asociado con una función renal reducida, la función renal debe evaluarse con mayor frecuencia en pacientes de edad avanzada [consulte Posología y administración (2.1) y Advertencias y precauciones (5.1, 5.3)].
Empagliflozina: En estudios de diabetes tipo 2 con empagliflozina, 2721 pacientes tratados con empagliflozina tenían 65 años o más y 491 pacientes tenían 75 años o más. En estos estudios, se produjeron reacciones adversas relacionadas con la hipovolemia en el 2.1%, 2.3% y 4.4% de los pacientes de 75 años de edad y mayores en los grupos de placebo, empagliflozina 10 mg y empagliflozina 25 mg una vez al día, respectivamente; y se produjeron infecciones del tracto urinario en el 10.5%, 15.7% y 15.1% de los pacientes de 75 años de edad y mayores en los grupos de placebo, empagliflozina 10 mg y empagliflozina 25 mg una vez al día, respectivamente.
Clorhidrato de metformina: Los estudios clínicos de metformina no incluyeron un número suficiente de pacientes geriátricos para determinar si responden de manera diferente a los pacientes adultos más jóvenes.
• Insuficiencia renal: JARDIANZ® DUO no debe iniciarse en pacientes con una TFGe inferior a 45 ml/min/1.73 m2 debido al componente de metformina y está contraindicado en pacientes con insuficiencia renal grave (TFGe inferior a 30 ml/min/1.73 m2), enfermedad renal en etapa terminal, o diálisis.
Empagliflozina: El beneficio hipoglucemiante de 25 mg de empagliflozina disminuyó en pacientes con empeoramiento de la función renal. Los riesgos de insuficiencia renal [consulte Advertencias y precauciones (5.2)], reacciones adversas de hipovolemia y reacciones adversas relacionadas con infecciones del tracto urinario aumentaron con el empeoramiento de la función renal.
Clorhidrato de metformina: La metformina se excreta sustancialmente por vía renal y el riesgo de acumulación de metformina y acidosis láctica aumenta con el grado de insuficiencia renal [consulte Advertencias y precauciones (5.1)].
• Insuficiencia hepática: El uso de clorhidrato de metformina en pacientes con insuficiencia hepática se ha asociado con algunos casos de acidosis láctica. JARDIANZ® DUO no se recomienda en pacientes con insuficiencia hepática [consulte Advertencias y precauciones (5.1)].
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES:
JARDIANZ® DUO Tabletas:
|
Concentración de empagliflozina |
Concentración de clorhidrato de metformina |
Color/Forma |
Marcas en tabletas |
|
5 mg |
850 mg |
Tableta recubierta, de color amarillo pálido, ovalada, biconvexa |
Símbolo de la empresa Boehringer Ingelheim y “S5” grabado en un lado; el otro lado está grabado con “850” |
|
5 mg |
1000 mg |
Tableta recubierta, de color amarillo parduzco, ovalada, biconvexa |
Símbolo de la empresa Boehringer Ingelheim y “S5” grabado en un lado; el otro lado está grabado con “1000” |
|
12.5 mg |
850 mg |
Tableta recubierta, de color rosa pálido, ovalada, biconvexa |
Símbolo de la empresa Boehringer Ingelheim y “S12” grabado en un lado; el otro lado está grabado con “850” |
|
12.5 mg |
1000 mg |
Tableta recubierta, de color púrpura parduzco oscuro, ovalada, biconvexa |
Símbolo de la empresa Boehringer Ingelheim y “S12” grabado en un lado; el otro lado está grabado con “1000” |
SOBREDOSIS: En caso de sobredosis de JARDIANZ® DUO, comuníquese con el Centro de control de intoxicaciones.
Han ocurrido sobredosis de clorhidrato de metformina, incluyendo la ingestión de cantidades superiores a 50 gramos. Se ha informado acidosis láctica en aproximadamente el 32% de los casos de sobredosis de metformina [consulte Advertencias y precauciones (5.1)]. La metformina es dializable con un aclaramiento de hasta 170 ml/min en buenas condiciones hemodinámicas. Por lo tanto, la hemodiálisis puede ser útil para eliminar el fármaco acumulado en pacientes en quienes se sospecha una sobredosis de metformina.
No se ha estudiado la eliminación de empagliflozina por hemodiálisis.
DESCRIPCIÓN: Las tabletas de JARDIANZ® DUO para uso oral contienen: empagliflozina y clorhidrato de metformina.
Empagliflozina: La empagliflozina es un inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT2).
El nombre químico de la empagliflozina es D-Glucitol,1,5-anhidro-1-C-[4-cloro-3-[[4-[[(3S)-tetrahidro-3-furanil]oxi]fenil]metil]fenilo]-, (1S).
Su fórmula molecular es C23H27ClO7 y el peso molecular es 450.91. La fórmula estructural es:
La empagliflozina es un polvo no higroscópico de color blanco a amarillento. Es muy poco soluble en agua, escasamente soluble en metanol, ligeramente soluble en etanol y acetonitrilo; soluble en 50% acetonitrilo/agua; y prácticamente insoluble en tolueno.
Clorhidrato de metformina: El clorhidrato de metformina (clorhidrato de N, N-dimetilimidodicarbonimidica diamida) es una biguanida. El clorhidrato de metformina es un compuesto cristalino de color blanco a blanquecino con una fórmula molecular de C4H11N5• HCl y un peso molecular de 165,63. El clorhidrato de metformina es fácilmente soluble en agua y prácticamente insoluble en acetona, éter y cloroformo. El pKa de la metformina es 12,4. El pH de una solución acuosa al 1% de clorhidrato de metformina es 6.68. La fórmula estructural es:
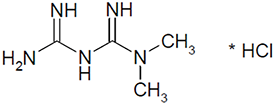
JARDIANZ® DUO
Las tabletas de JARDIANZ® DUO para administración oral están disponibles en cuatro dosis que contienen 5 mg de empagliflozina y 850mg de clorhidrato de metformina, 5 mg de empagliflozina y 1000 mg de clorhidrato de metformina, 12.5 mg de empagliflozina y 850 mg de clorhidrato de metformina, o 12.5 mg de empagliflozina y 1000 mg de clorhidrato de metformina.
Cada tableta recubierta de JARDIANZ® DUO contiene los siguientes ingredientes inactivos: copovidona, almidón de maíz, dióxido de silicio coloidal, estearato de magnesio. Recubrimiento pelicular: hipromelosa, dióxido de titanio, talco, polietilenglicol 400 y óxido férrico amarillo (5 mg/850 mg, 5 mg/1000 mg) u óxido férrico rojo y óxido ferroso férrico negro (12.5 mg/850 mg, 12.5 mg/ 1000 mg).
RECOMENDACIONES PARA EL ALMACENAMIENTO: Consérvese a no más de 30 °C.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica.
No se deje al alcance de los niños.
No se use en el embarazo, en la lactancia ni en niños menores de 18 años.
Nombre y domicilio del laboratorio
Hecho en México por:
BOEHRINGER INGELHEIM PROMECO, S.A. DE C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocan, C.P. 16090, Deleg. Xochimilco,
Ciudad de México, México.
® Marca registrada
Logo: Boehringer Ingelheim.
USPI 0289-16
Fecha de revisión de la monografía: MAR 2022