
LEVEMIR FLEXPEN
INSULINA DETEMIR
Solución para inyección
Estuche, 5 Pluma prellenada, 3 ml,
Estuche, 1 Pluma prellenada, 3 ml,
COMPOSICIÓN: Cada mL contiene:
|
Sustancia |
Cantidad |
Referencia de calidad |
|
Insulina detemir recombinante |
100,00 U |
NOVO NORDISK |
|
Glicerol |
16,00 mg |
F.Eur./USP/FJ |
|
Fenol |
1,80 mg |
F.Eur./USP/FJ |
|
Metacresol |
2,06 mg |
F.Eur./USP |
|
Fosfato disódico dihidratado |
0,89 mg |
F.Eur./USP |
|
Zinc (como acetato) |
65,40 μg |
F.Eur./USP/FJ |
|
Cloruro de sodio |
1,17 mg |
F.Eur./USP/FJ |
|
Hidróxido de sodio 2N, csp para ajuste de pH |
F.Eur./USP/FJ |
|
|
Ácido clorhídrico 2N, csp para ajuste de pH |
F.Eur./USP/FJ |
|
|
Agua para inyección csp |
1,0 mL |
F.Eur./USP/FJ |
FORMA FARMACÉUTICA: Solución para inyección en un dispositivo pre-llenado. Concentración: 100 U/mL.
INDICACIONES: Tratamiento de la diabetes mellitus en adultos, adolescentes y niños de 1 año de edad en adelante.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Insulinas y análogos para inyecciones, de acción prolongada. Código ATC: A10AE05.
Mecanismo de acción: LEVEMIR® es un análogo de insulina basal soluble, de acción prolongada con un efecto de duración prolongada que se utiliza como insulina basal.
El perfil de acción en el tiempo de LEVEMIR® es significativamente menos variable que el de la insulina NPH (Protamina neutral Hagedorn) y de la insulina glargina (Tabla 1).
|
Tabla 1. Variabilidad intra-sujeto del perfil de acción de la insulina detemir, insulina NPH e insulina glargina |
|||
|
Criterio de valoración farmacodinámica |
Insulina detemir Varianza |
Insulina NPH Varianza |
Insulina glargina Varianza |
|
AUCGIR,0-24h |
0.074 |
0.466 |
0.231 |
|
GIRmáx |
0.053 |
0.209 |
0.130 |
La acción prolongada de LEVEMIR® es mediada por la fuerte auto-asociación de las moléculas de insulina detemir en el sitio de inyección y unión a la albúmina mediante la cadena lateral de ácidos grasos. La insulina detemir se distribuye más lentamente a los tejidos periféricos deseados comparada con la insulina NPH. Estos mecanismos combinados de protracción proporcionan una absorción y perfil de acción más reproducibles de LEVEMIR® en comparación con la insulina NPH.
|
Parámetros farmacodinámicos para Detemir y NPH |
|||||
|
Insulina detemir |
NPH |
||||
|
0.2 U/kg |
0.3 U/kg |
0.4 U/kg |
0.3 UI/kg |
||
|
Duración de acción (hr) |
12 |
17† |
20 |
13 |
|
|
GIRmáx (mg/kg/min) |
1.1 |
1.4† |
1.7 |
1.6 |
|
|
† valores estimados |
|||||
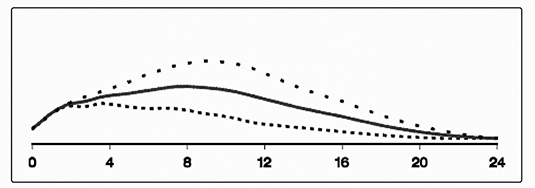
Tiempo desde la inyección de insulina (horas)
[Marca] ….. 0.2 U/kg ----- 0.3 U/kg … 0.4 U/kg
Figura 1. Perfiles de actividad para LEVEMIR® en pacientes con diabetes tipo 1.
La duración de acción es de hasta 24 horas dependiendo de la dosis, lo que ofrece la oportunidad de una administración una o dos veces al día. Si se administra dos veces al día, el estado estacionario ocurrirá después de la administración de 2 o 3 dosis. Para dosis en el intervalo de 0.2 – 0.4 U/kg, LEVEMIR® ejerce más de 50% de su efecto máximo de 3 a 4 horas y hasta aproximadamente 14 horas después de la administración de la dosis.
La proporcionalidad de la dosis en la respuesta farmacodinámica (efecto máximo, duración de acción, efecto total) se observa después de la administración subcutánea.
Se demostró un variabilidad día a día menor en la GPA durante el tratamiento con LEVEMIR® en comparación con NPH en estudios clínicos de largo plazo.
Estudios en pacientes con diabetes tipo 2 tratados con insulina basal en combinación con medicamentos antidiabéticos orales demostraron que el control glicémico (HbA1c) con LEVEMIR® es comparable con la insulina NPH y la insulina glargina y se asocia con un aumento de peso menor, consulte la Tabla 2.
|
Tabla 2. Cambios en el peso corporal después del tratamiento con insulina. |
||||
|
Duración del estudio |
Insulina detemir una vez al día |
Insulina detemir dos veces al día |
Insulina NPH |
Insulina glargina |
|
20 semanas |
+0.7 kg |
+1.6 kg |
||
|
26 semanas |
+1.2 kg |
+2.8 kg |
||
|
52 semanas |
+2.3 kg |
+3.7 kg |
+4.0 kg |
|
En estudios con un tratamiento combinado de insulina-ADO, el tratamiento con LEVEMIR® resultó en un riesgo 61-65% más bajo de hipoglucemia nocturna menor en comparación con insulina NPH.
Se realizó un estudio clínico aleatorizado, abierto en pacientes con diabetes tipo 2 que no llegaron al objetivo con productos medicinales antidiabéticos. El estudio inició con un periodo inicial de 12 semanas con liraglutida+ metformina, donde 61% logró un HbA1c < 7%. 39% de los pacientes que no logró el objetivo fue aleatorizado para recibir LEVEMIR® una vez al día agregado o continuar con liraglutida + metformina por 52 semanas. La adición de LEVEMIR® proporcionó una reducción mayor de HbA1c de 7.6% a 7.1% después de 52 semanas. No hubo episodios de hipoglucemia mayor. Cuando se agregó LEVEMIR® a liraglutida, el beneficio de peso de liraglutida se mantuvo, consulte la Tabla 3 a continuación.
|
Tabla 3. Datos de estudios clínicos – LEVEMIR® como complemento a liraglutida + metformina |
||||
|
Semanas de estudio |
LEVEMIR® + liraglutida + metformina aleatorizados N = 160 |
Liraglutida + metformina aleatorizados N = 149 |
Valor P |
|
|
Media de cambio en HbA1c de la evaluación basal (%) |
0-26 |
-0.51 |
+0.02 |
<0.0001 |
|
0-52 |
-0.50 |
0.01 |
<0.0001 |
|
|
Proporciones de pacientes que lograron el objetivo de HbA1c <7% (%) |
0-26 |
43.1 |
16.8 |
<0.0001 |
|
0-52 |
51.9 |
21.5 |
<0.0001 |
|
|
Cambio en el peso corporal de la evaluación basal (kg) |
0-26 |
-0.16 |
-0.95 |
0.0283 |
|
0-52 |
-0.05 |
-1.02 |
0.0416 |
|
|
Episodios de hipoglucemia menor (por año-paciente) |
0-26 |
0.286 |
0.029 |
0.0037 |
|
0-52 |
0.228 |
0.034 |
0.0011 |
|
En estudios de largo plazo (> 6 meses) en pacientes con diabetes tipo 1 que recibieron tratamiento de insulina basal-bolo, la glucosa plasmática en ayuno mejoró con LEVEMIR® en comparación con insulina NPH. El control glicémico (HbA1c) con LEVEMIR® fue comparable con insulina NPH, con un riesgo menor de hipoglucemia nocturna y sin aumento de peso asociado.
En estudios clínicos que utilizan tratamiento de insulina basal-bolo, los índices generales de hipoglucemia con LEVEMIR® e insulina NPH fueron similares. Los análisis de hipoglucemia nocturna en pacientes con diabetes tipo 1 mostraron un riesgo significativamente menor de hipoglucemia nocturna menor (capaces de auto tratarse y con confirmación de glucosa en sangre capilar menor a 2.8 mmol/l o 3.1 mmol/l si se expresa como glucosa plasmática) que con insulina NPH, mientras que no se observó diferencia en diabetes tipo 2.
El perfil de glucosa nocturna es más uniforme y estable con LEVEMIR® que con insulina NPH, lo que resulta en un riesgo menor de hipoglucemia nocturna.
Se ha observado el desarrollo de anticuerpos con el uso de LEVEMIR®, sin embargo, no parece tener algún impacto sobre el control glicémico.
PROPIEDADES FARMACOCINÉTICAS:
Absorción: Se alcanzó la concentración máxima en suero entre 6 y 8 horas después de la administración. Cuando se administró dos veces al día, se alcanzaron las concentraciones en suero en estado estacionario después de la administración de 2 a 3 dosis. La variación intra-paciente en la absorción es menor para LEVEMIR® que para otras preparaciones de insulina basal.
Distribución: Un volumen aparente de distribución para LEVEMIR® (aproximadamente 0.1 L/kg) indica que una fracción alta de insulina detemir circula en la sangre.
Los resultados de los estudios in vitro e in vivo de unión de proteínas demuestran que no hay una interacción clínicamente relevante entre la insulina detemir y los ácidos grasos u otros fármacos unidos a proteínas.
Metabolismo: La degradación de LEVEMIR® es similar a la de la insulina humana; todos los metabolitos formados están inactivos.
Eliminación: La semivida terminal después de la administración subcutánea se determina por el índice de absorción del tejido subcutáneo. La semivida terminal es de entre 5 y 7 horas, dependiendo de la dosis.
Linealidad: La proporcionalidad de la dosis en las concentraciones de suero (concentración máxima, grado de absorción) se observa después de la administración subcutánea en el rango de dosis terapéutica.
No hay diferencias clínicamente relevantes entre sexos en las propiedades farmacocinéticas de LEVEMIR®.
No se observaron interacciones farmacocinéticas o farmacodinámicas entre liraglutida y LEVEMIR® cuando se administró una sola dosis de LEVEMIR® 0.5 U/kg con liraglutida 1.8 mg a estado estacionario en pacientes con diabetes tipo 2.
Poblaciones especiales: Se investigaron las propiedades farmacocinéticas de LEVEMIR® en niños de 6-12 años y adolescentes de 13 a 17 años y se compararon con adultos con diabetes tipo 1. No hubo diferencia clínica en las propiedades farmacocinéticas.
No hubo diferencias clínicamente relevantes en la farmacocinética de LEVEMIR® entre sujetos mayores y jóvenes o entre sujetos con insuficiencia renal o hepática y sujetos saludables.
CONTRAINDICACIONES: Hipersensibilidad a la insulina detemir o a alguno de los excipientes.
ADVERTENCIAS Y PRECAUCIONES: Antes de viajar entre diferentes husos horarios el paciente debe buscar consejo médico, ya que esto implica que tendrá que tomar la insulina y su comida a diferentes horas.
Hiperglucemia: Una dosificación inadecuada o la descontinuación del tratamiento, en especial en la diabetes tipo 1 podrían provocar hiperglucemia y cetoacidosis diabética. Por lo regular, los primeros síntomas de hiperglucemia se desarrollan de manera gradual en un periodo de horas o días y pueden ser sed, aumento en la frecuencia de la micción, náuseas, vómito, somnolencia, sequedad y enrojecimiento de la piel, sequedad de boca, pérdida de apetito, así como aliento con olor a acetona. En la diabetes tipo 1, los eventos de hiperglucemia sin tratar eventualmente provocan cetoacidosis diabética, que es potencialmente letal.
Hipoglucemia: La omisión de una comida o el ejercicio físico extenuante y no planificado puede provocar hipoglucemia.
Puede presentarse hipoglucemia si la dosis de insulina es demasiado alta en relación con las necesidades de insulina.
Los pacientes que mejoraron en gran medida el control de glucosa en la sangre, por ejemplo, con un tratamiento intensificado de insulina, pueden experimentar un cambio en los síntomas regulares de aviso ante una hipoglucemia, por lo que deben estar concientizados al respecto. Los síntomas usuales de aviso pueden desaparecer en pacientes con diabetes de larga data.
Las enfermedades concomitantes, en especial las infecciones y padecimientos febriles, regularmente aumentan las necesidades de insulina del paciente. Las enfermedades concomitantes en los riñones, hígado o que afectan a las glándulas suprarrenales, pitituaria o tiroides pueden requerir cambios en la dosis de insulina.
Cambio a otros productos de insulina: El cambio a otro tipo o marca de insulina debe realizarse bajo estricta supervisión médica. Los cambios en la concentración, marca (fabricante), tipo, origen (animal, humana, análogo de insulina humana) y/o método de fabricación (ADN recombinante versus insulina de origen animal) podrían generar la necesidad de un cambio en la dosificación. Los pacientes que cambiaron a LEVEMIR® de otro tipo de insulina podrían requerir un cambio en la dosificación de la insulina que utilizaban usualmente. Si es necesario algún cambio, puede realizarse con la primera dosis o durante las primeras semanas o meses.
Reacciones en el sitio de inyección: Como con cualquier tratamiento con insulina, pueden presentarse reacciones en el sitio de inyección, como dolor, enrojecimiento, urticaria, inflamación, moretones y comezón. Podría ser útil rotar continuamente el sitio de inyección dentro de un área determinada para reducir o evitar estas reacciones, que regularmente desaparecen en algunos días o semanas. Rara vez las reacciones en el sitio de inyección pueden requerir la descontinuación de LEVEMIR®.
Combinación de tiazolidinedionas y productos medicinales de insulina: Se han reportado casos de insuficiencia cardíaca con el uso combinado de tiazolidinedionas e insulina, especialmente en pacientes con factores de riesgo para el desarrollo de insuficiencia cardíaca congestiva. Debe tenerse esto en cuenta si se considera iniciar tratamiento combinado con tiazolidinedionas y productos medicinales de insulina. Si se usa la combinación, los pacientes deben ser monitoreados en búsqueda de signos y síntomas de insuficiencia cardíaca congestiva, ganancia ponderal y edema. Las tiazolidinedionas deben ser descontinuadas si ocurre algún signo de deterioro cardíaco.
USO EN EMBARAZO Y LACTANCIA: Puede considerarse el tratamiento con LEVEMIR® durante el embarazo, si el beneficio justifica los posibles riesgos.
En general, se recomienda la intensificación del control y monitoreo de glucosa en la sangre en mujeres embarazadas con diabetes a lo largo del embarazo y cuando se está considerando embarazarse. Las necesidades de insulina con frecuencia descienden en el primer trimestre y aumentan de manera subsiguiente durante el segundo y tercer trimestre. Después del nacimiento, normalmente las necesidades de insulina regresan con rapidez a los valores antes del embarazo.
No se sabe si la insulina detemir se excreta en la leche humana. No se anticipan efectos metabólicos de la insulina detemir ingerida en el recién nacido o bebé en lactancia, ya que la insulina detemir, como péptido, se digiere en los aminoácidos en el tracto gastrointestinal humano.
Las mujeres en lactancia pueden requerir ajustes en la dosis de insulina.
EFECTOS EN LA CONDUCCIÓN DE VEHÍCULOS/MAQUINARIAS: La capacidad del paciente para concentrarse y reaccionar podría verse afectada como resultado de la hipoglucemia, lo cual puede representar un riesgo en situaciones donde estas capacidades son de importancia especial, como al manejar un auto u operar maquinaria.
Debe aconsejarse a los pacientes que tomen precauciones para evitar un episodio de hipoglucemia mientras manejan. Esto es de importancia particular para quienes han descuidado la concientización de las señales de aviso de hipoglucemia o no las reconocen, o quienes tienen episodios frecuentes de hipoglucemia. Bajo esas circunstancias, deberá considerarse si es conveniente manejar o no.
EFECTOS INDESEABLES:
a. Resumen del perfil de seguridad: Las reacciones adversas observadas en pacientes que utilizan LEVEMIR® principalmente se deben al efecto farmacológico de la insulina. El porcentaje general de pacientes tratados que se espera que experimenten reacciones farmacológicas adversas se estima en 12%.
La hipoglucemia es una reacción adversa que se reporta con mucha frecuencia, consulte la sección C a continuación.
A partir de las investigaciones clínicas se sabe que la hipoglucemia mayor, definida como requisito para intervención de un tercero, ocurre en aproximadamente 6% de los pacientes tratados con LEVEMIR®.
Las reacciones en el sitio de inyección se ven con mayor frecuencia durante el tratamiento con LEVEMIR® que con productos de insulina humana y pueden ser dolor, enrojecimiento, urticaria, inflamación, moretones, hinchazón y comezón en el sitio de inyección. La mayoría de las reacciones en el sitio de inyección son leves y temporales, y normalmente desaparecen durante la continuación del tratamiento en algunos días o semanas.
Al principio del tratamiento con insulina, pueden presentarse anomalías de refracción y edema, estas reacciones usualmente son temporales. La mejoría rápida en el control de glucosa en la sangre puede asociarse con una neuropatía dolorosa aguda, que regularmente es reversible. La intensificación del tratamiento de insulina con una mejoría abrupta en el control glicémico puede asociarse con el empeoramiento temporal de la retinopatía diabética, mientras que la mejoría en el control glicémico a largo plazo disminuye el riesgo de progresión de retinopatía diabética.
b. Lista tabulada de reacciones adversas: Las reacciones adversas listadas a continuación se basan en datos de estudios clínicos y se clasifican de acuerdo con la frecuencia de MedDRA y Clase de Órganos por Sistema. Las categorías de frecuencia se definen de acuerdo con la siguiente convención: Muy comunes (≥1/10); comunes (≥1/100 a <1/10); poco comunes (≥1/1,000 a <1/100); raros (≥1/10,000 a <1/1,000); muy raros (<1/10,000), desconocidos (no se puede estimar con la información disponible).
|
Trastornos del metabolismo y nutrición |
Poco comunes: Reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, salpullido, erupciones* |
|
Muy raros: Reacciones anafilácticas* |
|
|
Trastornos del metabolismo y nutrición |
Muy comunes: Hipoglucemia* |
|
Trastornos del sistema nervioso |
Raros: neuropatía periférica (neuropatía dolorosa) |
|
Trastornos del ojo |
Poco comunes: trastornos de refracción |
|
Poco comunes: retinopatía diabética |
|
|
Trastornos de la piel y tejido subcutáneo |
Poco comunes: lipodistrofia* |
|
Trastornos generales y condiciones del sitio de administración |
Comunes: reacciones en el sitio de inyección |
|
Poco comunes: Edema |
|
|
* Consulte la sección C. |
|
c. Descripción de las reacciones adversas seleccionadas: Reacciones alérgicas, reacciones posiblemente alérgicas, urticaria, salpullido, erupciones.
Las reacciones alérgicas, posiblemente alérgicas, urticaria, salpullido y erupciones son poco comunes cuando se utiliza LEVEMIR® en un régimen de bolo-basal. Sin embargo, cuando se utilizan en combinación con productos medicinales antidiabéticos orales, tres estudios clínicos han demostrado una frecuencia común (2.2%) de reacciones alérgicas y se han observado reacciones posiblemente alérgicas.
Reacciones anafilácticas: La incidencia de las reacciones de hipersensibilidad generalizada, incluyendo salpullido en la piel, comezón, sudor, molestias gastrointestinales, edema angioneurótico, dificultades para respirar, palpitaciones y reducción en la presión arterial, es muy rara pero podría ser potencialmente mortal.
Hipoglucemia: La reacción adversa reportada con mayor frecuencia es la hipoglucemia. Puede ocurrir si la dosis de insulina es demasiado alta en relación con los requisitos de insulina. La hipoglucemia grave puede causar inconsciencia y/o convulsiones y puede causar afectaciones temporales o permanentes de la función cerebral o incluso la muerte. Los síntomas de hipoglucemia usualmente se presentan repentinamente y pueden ser: sudor frío, piel pálida y fría, fatiga, nerviosismo o temblores, ansiedad, cansancio inusual o debilidad, confusión, dificultades para concentrarse, somnolencia, hambre excesiva, cambios en la visión, dolor de cabeza, náuseas y palpitaciones.
Lipodistrofia: Puede presentarse lipodistrofia, incluyendo lipohipertrofia, lipoatrofia en el sitio de inyección. La rotación continua del sitio de inyección en el área particular de aplicación puede ayudar a reducir el riesgo de desarrollar estas reacciones.
INTERACCIONES MEDICAMENTOSAS: Las siguientes sustancias pueden reducir las necesidades de insulina del paciente: Productos medicinales antidiabéticos orales, Inhibidores de Monoamina Oxidasa (MAOI), bloqueadores beta, inhibidores de la enzima convertidora de angiotensina (ACE), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar las necesidades de insulina del paciente: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormonas del crecimiento y danazol.
Los agentes beta bloqueadores pueden ocultar los síntomas de hipoglucemia. El octreotide o el lanreotide pueden aumentar o disminuir las necesidades de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucémico de la insulina.
DATOS DE SEGURIDAD PRECLÍNICA: Pruebas in vitro en líneas celulares humanas de investigación sobre unión a la insulina y sitios receptores de IGF-1 han demostrado que la insulina detemir tiene una afinidad reducida a ambos receptores, así como una reducción en el efecto en el crecimiento celular en comparación con la insulina humana.
Datos no clínicos revelan los riesgos comunes para el ser humano con base en los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetida, genotoxicidad, potencial carcinogénico, toxicidad en la reproducción.
MODO DE ADMINISTRACIÓN: LEVEMIR® es sólo para administración subcutánea. LEVEMIR® no debe administrase por vía intravenosa, ya que podría resultar en una hipoglucemia grave. También debe evitarse la administración intramuscular. No debe utilizarse LEVEMIR® en bombas de infusión de insulina.
LEVEMIR® se administra por vía subcutánea con una inyección en la pared abdominal, muslo, parte superior del brazo, la región del deltoides o la región glútea. Siempre deben cambiarse los sitios de inyección dentro de la misma área. Como con todos los productos de insulina, la duración de la acción varía de acuerdo con la dosis, sitio de inyección, flujo sanguíneo, temperatura y nivel de actividad física.
POSOLOGÍA: En combinación con los medicamentos antidiabéticos orales o como complemento a liraglutida, se recomienda utilizar LEVEMIR® una vez al día, inicialmente a una dosis de 10 U o 0.1-0.2 U/kg. La inyección puede administrarse en cualquier momento del día, pero a la misma hora siempre. La dosis de LEVEMIR® debe ajustarse de acuerdo con las necesidades individuales del paciente.
Con base en los resultados de estudios, puede utilizarse la siguiente guía de ajuste:
|
GPMP* promedio antes del desayuno |
Ajuste de dosis de LEVEMIR® |
|
>10.0 mmol/L (180 mg/dL) |
+8 U |
|
9.1-10.0 mmol/L (163-180 mg /dL) |
+6 U |
|
8.1-9.0 mmol/L (145-162 mg/dL) |
+4 U |
|
7.1-8.0 mmol/L (127-144 mg/dL) |
+2 U |
|
6.1-7.0 mmol/L (109-126 mg/dL) |
+2 U |
|
4.1-6.0 mmol/L: (73-108 mg/dl) |
Sin cambio (objetivo) |
|
Si una medición de GPMP es: |
|
|
3.1-4.0 mmol/L (56-72 mg/dL) |
-2 U |
|
< 3.1 mmol/L (<56 mg/dL ) |
-4 U |
|
*Glucosa plasmática medida por el paciente |
|
Cuando se utilice LEVEMIR® como parte de un régimen de insulina de bolo-basal, LEVEMIR® debe administrarse una o dos veces al día dependiendo de las necesidades del paciente. La dosificación de LEVEMIR® deberá ajustarse de manera individual.
Para los pacientes que requieran una dosificación dos veces al día para optimizar el control de glucosa en sangre, la dosis de la noche puede administrarse en la noche o a la hora de dormir. Podría necesitarse un ajuste de la dosificación si el paciente se somete a un aumento en la actividad física, cambia su dieta regular o durante enfermedades concomitantes.
Poblaciones especiales: Como con todos los productos de insulina, en pacientes de edad avanzada y pacientes con insuficiencia renal o hepática, debe intensificarse el monitoreo de la glucosa y ajustarse la dosis de LEVEMIR® de acuerdo a cada individuo.
Uso pediátrico: La eficacia y seguridad de LEVEMIR® quedaron demostradas en niños y adolescentes de 1 año de edad en adelante en estudios de hasta 12 meses.
Cambio de otros productos de insulina: Para el cambio a LEVEMIR® de productos de insulina de acción intermedia o prolongada podría necesitarse el ajuste de la dosis y horario de administración.
Como con todos los productos de insulina, se recomienda un monitoreo cuidadoso de la glucosa durante el cambio y luego en las semanas iniciales.
El tratamiento antidiabético concomitante podría necesitar un ajuste de dosis y/o horario de los medicamentos antidiabéticos orales o productos de insulina de acción rápida concurrente.
SOBREDOSIFICACIÓN: No puede definirse una sobredosis específica de insulina, sin embargo, puede desarrollarse hipoglucemia en etapas secuenciales si se administran dosis altas con respecto a las necesidades del paciente:
• Los episodios leves de hipoglucemia pueden tratarse con la administración oral de glucosa o productos con azúcar. Por tanto, se recomienda que el paciente diabético siempre lleve consigo productos que contengan azúcar.
• Los episodios de hipoglucemia grave en los que el paciente queda inconsciente pueden tratarse con la administración de glucagón por parte de una persona capacitada (0.5 a 1 mg) por vía intramuscular o subcutánea, o con glucosa por vía intravenosa aplicada por un profesional de la salud. También se puede administrar glucosa por vía intravenosa si el paciente no responde al glucagón en 10 o 15 minutos. Después de recuperar la conciencia, se recomienda al paciente la administración de carbohidratos orales para evitar una recaída.
PRESENTACIÓN: Estuche con 5 plumas pre-llenadas de 3 mL y estuche con 1 pluma pre-llenada de 3 mL.
Nombre del producto: LEVEMIR® FLEXPEN®.
Fabricante y país: NOVO NORDISK A/S, Dinamarca.
Titular de la autorización: NOVO NORDISK A/S, Dinamarca.
No todas las presentaciones mencionadas están disponibles en todos los países.
Última revisión local: Agosto 2019 basada en el ENDS v. 2.0 4 de abril 2017.
Pueden existir diferencias en cuanto a las indicaciones aprobadas para cada país. Siempre refiérase a la información prescriptiva completa local a disposición en el departamento médico de NOVO NORDISK.
NOVO NORDISK
® Marca registrada
CONDICIONES DE ALMACENAMIENTO: Temperatura de 2 a 8 °C. No congelar. Protéjase de la luz.
INSTRUCCIONES DE USO, MANIPULACIÓN Y DESTRUCCIÓN DEL REMANENTE NO UTILIZABLE DEL PRODUCTO: No debe compartir su LEVEMIR® FLEXPEN® ni agujas. No debe recargar el cartucho.
No debe utilizar LEVEMIR® si no se ve claro e incoloro.
Si se ha congelado a LEVEMIR® no deberá utilizarlo.
Deberá aconsejarse al paciente que deseche la aguja después de cada inyección.
Plazo de validez: 30 meses.