MICARDIS PLUS
HIDROCLOROTIAZIDA, TELMISARTÁN
Tabletas
1 Caja, 14 Tabletas, 80/12.5 mg/mg
1 Caja, 3 Tabletas, 80/12.5 mg/mg
COMPOSICIÓN:
Composición cualitativa y cuantitativa:
MICARDIS® PLUS 80 mg/12.5 mg tabletas.
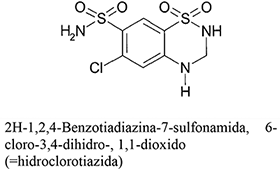
Cada TABLETA contiene 80 mg de telmisartán y 12.5 mg de hidroclorotiazida.
Excipiente(s) con efecto conocido:
MICARDIS® PLUS 80 mg/12.5 mg tabletas
Cada TABLETA contiene 112 mg de lactosa monohidrato equivalente a 107 mg de lactosa anhidra.
Cada TABLETA contiene 338 mg de sorbitol (E420).
Leyenda exclusiva para Cuba:
Contraindicaciones: Contiene lactosa, no administrar en pacientes con intolerancia a la lactosa.
Contiene sorbitol, no administrar en pacientes con
intolerancia a la fructosa.
Leyenda exclusiva para Panamá:
Este medicamento contiene almidón de maíz.
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento.
Este medicamento contiene sorbitol. Los pacientes con intolerancia hereditaria a la fructosa no deben tomar/usar este medicamento.
FORMA FARMACÉUTICA Y FORMULACIÓN:
Forma farmacéutica:
Tableta:
MICARDIS® PLUS 80 mg/12.5 tabletas.
Tableta ovalada de dos capas, roja y blanca de 6.2 mm, con el anagrama de la compañía y el código ‘H8’ grabado.

INDICACIONES TERAPÉUTICAS:
Datos clínicos:
Tratamiento de la hipertensión esencial.
MICARDIS® PLUS, asociación a dosis fijas (80 mg de telmisartán/12.5 mg de HCTZ), está indicado en adultos cuya presión arterial no puede controlarse adecuadamente sólo con telmisartán.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
La administración concomitante de HCTZ y telmisartán carece de efecto sobre las respectivas farmacocinéticas de estos dos fármacos, en individuos sanos.
Absorción:
Telmisartán: Después de la administración oral, las concentraciones máximas de telmisartán se alcanzan 0.5-1.5 horas después de la administración de la dosis. La biodisponibilidad absoluta de telmisartán a dosis de 40 mg y 160 mg fue 42 y 58% respectivamente. La comida reduce ligeramente la biodisponibilidad de telmisartán con una reducción del área bajo la curva concentración plasmática-tiempo (AUC) de alrededor del 6% con la tableta de 40 mg y de alrededor del 19% después de una dosis de 160 mg. Tres horas después de la administración, las concentraciones en plasma son similares si telmisartán se administra en ayunas o con alimento. No es de esperar que la pequeña disminución de la AUC provoque una disminución de la eficacia terapéutica. Telmisartán no se acumula significativamente en plasma en caso de administración repetida.
Hidroclorotiazida: Después de la administración oral de la asociación a dosis fijas, las concentraciones máximas de HCTZ se alcanzan aproximadamente al cabo de 1.0-3.0 horas después de la administración de la dosis. En base a la excreción renal acumulativa de HCTZ, la biodisponibilidad absoluta fue alrededor del 60%.
Distribución: Telmisartán se une de forma elevada a las proteínas plasmáticas (>99.5%), principalmente a la albúmina y a la glucoproteína alfa-1-ácida. El volumen de distribución aparente de telmisartán es de aproximadamente 500 litros, indicando una unión tisular adicional.
La unión de hidroclorotiazida a las proteínas plasmáticas es del 64% y su volumen aparente de distribución es de de 0.8 ± 0.3 L/kg.
Biotransformación: Telmisartán se metaboliza por conjugación para formar un acilglucurónido farmacológicamente inactivo. El glucurónido del compuesto original es el único metabolito que ha sido identificado en humanos.
Después de una dosis única de telmisartán marcado con C14, el glucurónido representa aproximadamente el 11% de la radiactividad medida en plasma. Las isoenzimas del citocromo P450 no se ven afectadas en el metabolismo de telmisartán.
Hidroclorotiazida no se metaboliza en el ser humano.
Eliminación:
Telmisartán: Después de la administración intravenosa u oral de telmisartán marcado con C14 la mayor parte de la dosis administrada (>97%) se eliminó en las heces vía excreción biliar. En orina sólo se encontraron cantidades insignificantes. El aclaramiento plasmático total de telmisartán después de la administración oral es >1.500 mL/min. La semivida de eliminación terminal fue >20 horas.
Hidroclorotiazida se excreta casi completamente como fármaco inalterado en la orina. Alrededor del 60% de la dosis oral se elimina en el plazo de 48 horas. El aclaramiento renal es de alrededor de 250-300 mL/min. La semivida de eliminación terminal de hidroclorotiazida es de 10-15 horas.
Linealidad/no linealidad:
Telmisartán: La farmacocinética de telmisartán administrado por vía oral no es lineal dentro del intervalo de dosis de 20-160 mg con aumentos más que proporcionales de las concentraciones en plasma (Cmáx y AUC) con dosis progresivamente mayores. Telmisartán no se acumula significativamente en plasma en caso de administración repetida.
Hidroclorotiazida muestra una farmacocinética lineal.
Farmacocinética en poblaciones específicas:
Edad avanzada: La farmacocinética de telmisartán no difiere entre los pacientes de edad avanzada y pacientes más jóvenes.
Sexo: Las concentraciones de telmisartán son por lo general 2-3 veces mayores en las mujeres que en los varones. Sin embargo, en ensayos clínicos no se han encontrado en mujeres elevaciones significativas de la respuesta de la presión arterial ni de la incidencia de hipotensión ortostática. No se requiere ajuste de dosis. Se advirtió una tendencia a concentraciones de HCTZ en plasma en mujeres superiores a las de los hombres. Esto no fue considerado de relevancia clínica.
Insuficiencia renal: Se observaron concentraciones plasmáticas menores en pacientes con insuficiencia renal tratados con diálisis. Telmisartán se une de forma elevada a las proteínas plasmáticas en sujetos con insuficiencia renal y no se puede eliminar mediante diálisis. La semivida de eliminación no varía en pacientes con insuficiencia renal. En pacientes con función renal insuficiente, la velocidad de eliminación de HCTZ está reducida. En un estudio típico realizado en pacientes con un aclaramiento medio de creatinina de 90 mL/min, la semivida de eliminación de HCTZ estaba aumentada. La semivida de eliminación en pacientes funcionalmente anéfricos es de alrededor de 34 horas.
Insuficiencia hepática: Los estudios farmacocinéticos en pacientes con insuficiencia hepática mostraron un aumento de la biodisponibilidad absoluta hasta casi el 100%. La semivida de eliminación no varía en pacientes con insuficiencia hepática.
CONTRAINDICACIONES:
• Hipersensibilidad al (a los) principio(s) activo(s) o a alguno de los excipientes incluidos.
• Hipersensibilidad a otras sustancias derivadas de la sulfonamida (ya que la HCTZ es un medicamento derivado de la sulfonamida).
• Segundo y tercer trimestres del embarazo (ver Advertencias y precauciones especiales de empleo y Fertilidad, embarazo y lactancia).
• Colestasis y trastornos obstructivos biliares.
• Insuficiencia hepática grave.
• Insuficiencia renal grave (aclaramiento de creatinina <30 mL/min), anuria.
• Hipopotasemia refractaria, hipercalcemia.
El uso concomitante de telmisartán/HCTZ con medicamentos con aliskiren está contraindicado en pacientes con diabetes mellitus o insuficiencia renal (TFG <60 mL/min/1.73 m2) (ver Interacción con otros medicamentos y otras formas de interacción y Propiedades farmacodinámicas).
PRECAUCIONES Y ADVERTENCIAS:
Advertencias y precauciones especiales de empleo:
Embarazo:No se debe iniciar ningún tratamiento con bloqueantes de los receptores de la angiotensina II durante el embarazo. Salvo que se considere esencial continuar el tratamiento con los bloqueantes de los receptores de la angiotensina II, las pacientes que estén planeando quedarse embarazadas deberán cambiar a un tratamiento antihipertensivo alternativo que tenga un perfil de seguridad conocido para su uso durante el embarazo. Cuando se diagnostique un embarazo, deberá interrumpirse inmediatamente el tratamiento con los bloqueantes de los receptores de la angiotensina II, y si procede, iniciar un tratamiento alternativo (ver Contraindicaciones y Fertilidad, embarazo y lactancia).
Insuficiencia hepática: Telmisartán/HCTZ no debe administrarse en pacientes con colestasis, trastornos obstructivos biliares o insuficiencia hepática grave (ver Contraindicaciones), ya que telmisartán se elimina principalmente en la bilis. Puede esperarse que estos pacientes presenten un aclaramiento de telmisartán reducido.
Además, telmisartán/HCTZ debe utilizarse con precaución en pacientes con función hepática insuficiente o enfermedad hepática progresiva, ya que pequeñas alteraciones del equilibrio de líquidos y electrolitos pueden precipitar un coma hepático. No se dispone de experiencia clínica con telmisartán/HCTZ en pacientes con insuficiencia hepática.
Hipertensión renovascular: En pacientes con estenosis bilateral de la arteria renal o estenosis de la arteria de un único riñón funcional, tratados con medicamentos que afecten al sistema renina-angiotensina-aldosterona, existe un riesgo aumentado de hipotensión grave e insuficiencia renal.
Insuficiencia renal y trasplante renal: Telmisartán/HCTZ no debe administrarse en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 mL/min) (ver Contraindicaciones). No se dispone de experiencia respecto a la administración de telmisartán/HCTZ en pacientes que han sufrido un trasplante renal reciente. La experiencia con telmisartán/HCTZ en pacientes con insuficiencia renal de leve a moderada es escasa y, por lo tanto, se recomienda la monitorización periódica de los niveles séricos de potasio, creatinina y ácido úrico. En pacientes con función renal insuficiente puede aparecer una azoemia asociada a diuréticos.
Telmisartán no se elimina de la sangre por hemofiltración y no es dializable.
Pacientes con depleción de volumen y/o sodio: En pacientes con depleción de volumen y/o sodio, ocasionada por un tratamiento intensivo con diuréticos, por una dieta restrictiva en sal, por diarreas o vómitos, puede producirse una hipotensión sintomática, especialmente después de la primera dosis. Estas situaciones, especialmente la depleción de volumen y/o sodio, deben ser corregidas antes de la administración de MICARDIS® PLUS.
Se han observado casos aislados de hiponatremia acompañada de síntomas neurológicos (náuseas, desorientación progresiva, apatía) con el uso de HCTZ.
Bloqueo dual del sistema renina-angiotensina-aldosterona (SRAA): Existe evidencia de que el uso concomitante de inhibidores de la enzima convertidora de angiotensina, bloquenates de los receptores de la angiotensina II o aliskiren aumenta el riesgo de hipotensión, hiperpotasemia y disminución de la función renal (incluyendo insuficiencia renal aguda). En consecuencia, no se recomienda el bloqueo dual del SRAA mediante la utilización combinada de inhibidores de la enzima convertidora de angiotensina, bloqueantes de los receptores de la angiotensina II o aliskiren (ver Interacción con otros medicamentos y otras formas de interacción y Propiedades farmacodinámicas).
Si se considera imprescindible la terapia de bloqueo dual, ésta sólo se debe llevar a cabo bajo la supervisión de un especialista y sujeta a una estrecha y frecuente monitorización de la función renal, los niveles de electrolitos y la presión arterial.
No se deben utilizar de forma concomitante los inhibidores de la enzima convertidora de angiotensina y los bloqueantes de los receptores de la angiotensina II en pacientes con nefropatía diabética.
Otras situaciones con estimulación del sistema renina-angiotensina-aldosterona: En pacientes cuyo tono vascular y función renal dependen principalmente de la actividad del sistema renina-angiotensina-aldosterona (p. ej., pacientes con insuficiencia cardiaca congestiva grave o enfermedad renal subyacente, incluyendo estenosis de la arteria renal), el tratamiento se ha asociado con medicamentos que afectan a este sistema con hipotensión aguda, hiperazoemia, oliguria o, raramente, fallo renal agudo (ver Reacciones adversas).
Aldosteronismo primario: Los pacientes con aldosteronismo primario no responden, generalmente, a los medicamentos antihipertensivos que actúan por inhibición del sistema renina-angiotensina. En consecuencia, no se recomienda el uso de telmisartán/HCTZ.
Estenosis valvular aórtica y mitral, cardiomiopatía hipertrófica obstructiva: Como sucede con otros vasodilatadores, se recomienda especial precaución en pacientes con estenosis aórtica o mitral o con cardiomiopatía hipertrófica obstructiva.
Efectos metabólicos y endocrinos: El tratamiento con tiazidas puede alterar la tolerancia a la glucosa, mientras que en pacientes diabéticos en tratamiento con insulina o antidiabéticos y en tratamiento con telmisartán puede aparecer hipoglucemia.
Por lo tanto, en estos pacientes se debe considerar una monitorización de la glucosa en sangre. Cuando esté indicado, puede ser necesario un ajuste de la dosis de insulina o de antidiabéticos. Durante el tratamiento con tiazidas puede ponerse de manifiesto una diabetes mellitus latente.
Un aumento de los niveles de colesterol y triglicéridos se ha asociado con el tratamiento diurético con tiazidas; sin embargo, con la dosis de 12,5 mg contenida en el medicamento no se han descrito efectos o estos han sido mínimos.
En algunos pacientes tratados con tiazidas puede aparecer hiperuricemia o desencadenarse una gota manifiesta.
Desequilibrio electrolítico: Como con cualquier paciente tratado con diuréticos, debe procederse a la determinación periódica de los electrólitos en suero a intervalos adecuados.
Las tiazidas, incluyendo hidroclorotiazida, pueden ser causa de desequilibrio de líquidos o electrólitos (incluyendo hipopotasemia, hiponatremia y alcalosis hipoclorémica). Son signos de indicio de desequilibrio de líquidos o de electrólitos, la sequedad de boca, sed, astenia, letargia, somnolencia, inquietud, dolor muscular o calambres, fatiga muscular, hipotensión, oliguria, taquicardia y trastornos gastrointestinales tales como náuseas o vómitos (ver Reacciones adversas).
Hipopotasemia: Si bien puede desarrollarse hipopotasemia con el uso de diuréticos tiazídicos, el tratamiento simultáneo con telmisartán puede reducir la hipopotasemia inducida por diuréticos. El riesgo de hipopotasemia es máximo en pacientes con cirrosis hepática, en pacientes con diuresis manifiesta, en pacientes que reciben una ingesta oral inadecuada de electrólitos y en pacientes tratados simultáneamente con corticosteroides u hormona adrenocorticotropa (ACTH) (ver Interacción con otros medicamentos y otras formas de interacción).
Hiperpotasemia: A la inversa, es posible una hiperpotasemia debida al bloqueo de los receptores de la angiotensina II (AT1) por el componente telmisartán del medicamento. Si bien no se ha documentado una hiperpotasemia clínicamente significativa con telmisartán/HCTZ, los factores de riesgo para el desarrollo de hiperpotasemia incluyen insuficiencia renal y/o insuficiencia cardiaca y diabetes mellitus. Con telmisartán/HCTZ deben administrarse conjuntamente con precaución, diuréticos ahorradores de potasio, suplementos de potasio o sustitutos de la sal conteniendo potasio (ver Interacción con otros medicamentos y otras formas de interacción).
Alcalosis hipoclorémica: Por lo general, el déficit de cloruro es leve y no suele requerir tratamiento.
Hipercalcemia: Las tiazidas pueden reducir la excreción urinaria de calcio y producir una elevación intermitente y ligera del calcio sérico en ausencia de trastornos conocidos del metabolismo del calcio. Una hipercalcemia marcada puede ser indicio de hiperparatiroidismo encubierto. La administración de tiazidas debe interrumpirse antes de realizar pruebas de la función paratiroidea.
Hipomagnesemia: Las tiazidas han demostrado aumentar la excreción urinaria de magnesio, lo que puede producir una hipomagnesemia (ver Interacción con otros medicamentos y otras formas de interacción).
Diferencias étnicas: Al igual que sucede con otros bloqueantes de los receptores de la angiotensina II, telmisartán es aparentemente, menos eficaz en la disminución de la presión arterial en la población de raza negra que en las demás, posiblemente, por una mayor prevalencia de niveles bajos de renina entre la población hipertensa de raza negra.
Cardiopatía isquémica: Como sucede con cualquier fármaco antihipertensivo, un descenso excesivo de la presión arterial en pacientes con cardiopatía isquémica o enfermedad cardiovascular isquémica, puede producir un infarto de miocardio o un accidente cerebrovascular.
General: Pueden producirse reacciones de hipersensibilidad a HCTZ en pacientes con o sin antecedentes de alergia o asma bronquial, si bien son más probables en pacientes con una historia de este tipo.
Con el uso de diuréticos tiazídicos, entre ellos la HCTZ, se ha descrito exacerbación o activación del lupus eritematoso sistémico.
Se han notificado casos de reacciones de fotosensibilidad con diuréticos tiazídicos (ver Reacciones adversas). Si se presenta una reacción de fotosensibilidad durante el tratamiento se recomienda la interrupción del mismo.
Si se considera necesario volver a administrar el diurético, se recomienda proteger las zonas expuestas al sol o a los rayos UVA artificiales.
Derrame coroideo, miopía aguda y glaucoma de ángulo cerrado: Hidroclorotiazida, una sulfonamida, puede provocar una reacción idiosincrática, dando lugar a un derrame coroideo con defecto del campo visual, miopía transitoria aguda y glaucoma agudo de ángulo cerrado. Los síntomas incluyen una aparición brusca de agudeza visual disminuida o dolor ocular y típicamente aparecen entre horas y semanas después del inicio del tratamiento. El glaucoma agudo de ángulo cerrado no tratado puede dar lugar a una pérdida de visión permanente. El tratamiento primario consiste en suspender hidroclorotiazida tan rápido como sea posible. Si no se consigue controlar la presión ocular, puede ser necesario considerar tratamientos médicos o quirúrgicos inmediatos. Los factores de riesgo para desarrollar glaucoma agudo de ángulo cerrado pueden incluir un historial de alergia a sulfonamida o penicilina.
Cáncer de piel no melanoma: Se ha observado un aumento del riesgo de cáncer de piel no-melanoma (CPNM) [carcinoma basocelular (CBC) y carcinoma de células escamosas (CEC)] con la exposición a dosis acumuladas crecientes de HCTZ en dos estudios epidemiológicos, con base en el Registro Nacional Danés de Cáncer (ver sección Reacciones adversas). Los efectos fotosensibilizantes de HCTZ podrían actuar como un posible mecanismo del CPNM.
Se informará a los pacientes tratados con HCTZ del riesgo de CPNM y se les indicará que se revisen de manera periódica la piel en busca de lesiones nuevas y que informen de inmediato cualquier lesión de la piel sospechosa. Se indicarán a los pacientes las posibles medidas preventivas, como limitar la exposición a la luz solar y a los rayos UV y, en caso de exposición, utilizar protección adecuada para reducir al mínimo el riesgo de cáncer de piel. Las lesiones de piel sospechosas se deben evaluar de forma rápida, incluidos los análisis histológicos de biopsias. Además, puede ser necesario reconsiderar el uso de HCTZ en pacientes que hayan experimentado previamente un CPNM (ver Reacciones adversas).
Toxicidad respiratoria aguda: Se han notificado casos graves muy raros de toxicidad respiratoria aguda, incluido síndrome de dificultad respiratoria aguda (SDRA), después de tomar hidroclorotiazida. El edema pulmonar suele aparecer entre unos minutos y unas horas después de la toma de hidroclorotiazida. Al inicio del tratamiento, los síntomas incluyen disnea, fiebre, insuficiencia pulmonar e hipotensión. Si se sospecha de un diagnóstico de SDRA, se debe retirar MICARDIS® PLUS y administrar el tratamiento adecuado. No se debe administrar hidroclorotiazida a pacientes que hayan experimentado previamente SDRA tras la ingesta de este fármaco.
Angioedema intestinal:
Se han notificado casos de angioedema intestinal en pacientes tratados con antagonistas de los receptores de la angiotensina II (ver sección 4.8). Estos pacientes presentaban dolor abdominal, náuseas, vómitos y diarrea. Los síntomas se resolvieron tras la interrupción de los antagonistas de los receptores de la angiotensina II. Si se diagnostica angioedema intestinal, se debe interrumpir el tratamiento con telmisartán e iniciar un seguimiento adecuado hasta que se haya producido la resolución completa de los síntomas.
Lactosa: Cada tableta contiene lactosa. Los pacientes con intolerancia hereditaria a la galactosa, deficiencia total de lactasa o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
Sorbitol:
MICARDIS® PLUS 80 mg/12.5 mg tabletas contiene 338 mg de sorbitol en cada comprimido. Los pacientes con intolerancia hereditaria a la fructosa (IHF) no deben tomar este medicamento.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por tableta; esto es, esencialmente “exento de sodio”.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Fertilidad, embarazo y lactancia:
Embarazo: No se recomienda el uso de los bloqueantes de los receptores de la angiotensina II durante el primer trimestre del embarazo (ver Advertencias y precauciones especiales de empleo). Está contraindicado el uso de los bloqueantes de los receptores de la angiotensina II durante el segundo y tercer trimestre del embarazo (ver Contraindicaciones y Advertencias y precauciones especiales de empleo). .
No existen datos suficientes sobre la utilización de telmisartán/HCTZ en mujeres embarazadas. Los estudios en animales han mostrado toxicidad para la reproducción (ver Datos preclínicos sobre seguridad).
La evidencia epidemiológica sobre el riesgo de teratogenicidad tras la exposición a inhibidores de la ECA durante el primer trimestre de embarazo no ha sido concluyente; sin embargo, no se puede excluir un pequeño aumento del riesgo. Aunque no hay datos epidemiológicos específicos sobre el riesgo que conlleva la administración de bloqueantes de los receptores de angiotensina II (ARAII) durante el embarazo, pueden existir riesgos similares para este tipo de medicamentos. Salvo que se considere esencial continuar el tratamiento con bloqueantes de los receptores de la angiotensina II, las pacientes que estén planeando quedarse embarazadas deben cambiar a un tratamiento antihipertensivo alternativo que tenga un perfil de seguridad conocido para su uso durante el embarazo. Cuando se diagnostique un embarazo, deberá interrumpirse inmediatamente el tratamiento con los bloqueantes de los receptores de la angiotensina II y, si procede, iniciar un tratamiento alternativo.
Se sabe que la exposición a bloqueantes de los receptores de la angiotensina IIdurante el segundo y el tercer trimestre induce fetotoxicidad humana (disminución de la función renal, oligohidramnios, retraso de la osificación craneal) y toxicidad neonatal (fallo renal, hipotensión, hiperpotasemia) (ver Datos preclínicos sobre seguridad).
Si se produce una exposición a bloqueantes de los receptores de la angiotensina II a partir del segundo trimestre del embarazo, se recomienda realizar una prueba de ultrasonidos de la función renal y del cráneo.
Los lactantes cuyas madres hayan sido tratadas con bloqueantes de los receptores de la angiotensina IIdeberán ser cuidadosamente monitorizados por si se produce hipotensión (ver Contraindicaciones y Advertencias y precauciones especiales de empleo).
Se dispone de experiencia limitada sobre el uso de HCTZ durante el embarazo, especialmente durante el primer trimestre. Los estudios en animales son insuficientes. Hidroclorotiazida atraviesa la placenta. En base al mecanismo de acción farmacológico de HCTZ, su uso durante el segundo y tercer trimestre puede comprometer la perfusión fetoplacentaria y puede provocar efectos fetales y neonatales como ictericia, alteraciones del equilibrio electrolítico y trombocitopenia.
Hidroclorotiazida no se debe usar para tratar el edema gestacional, la hipertensión gestacional o la preclampsia, debido al riesgo de disminución del volumen plasmático y de hipoperfusión placentaria, sin ningún efecto beneficioso sobre el curso de la enfermedad.
Hidroclorotiazida no se debe usar para tratar la hipertensión esencial en mujeres embarazadas, excepto en situaciones raras en las que no se pueda utilizar ningún otro tratamiento.
Lactancia: Puesto que no existe información relativa a la utilización de telmisartán/HCTZ durante la lactancia, se recomienda no administrar telmisartán/HCTZ durante este periodo. Es preferible cambiar a un tratamiento cuyo perfil de seguridad en el periodo de lactancia sea más conocido, especialmente en recién nacidos o prematuros.
Hidroclorotiazida se excreta en pequeñas cantidades en la leche materna. A dosis altas, las tiazidas provocan una diuresis intensa que puede inhibir la producción de leche. No se recomienda el uso de telmisartán/HCTZ durante la lactancia. En caso de utilizar telmisartán/HCTZ durante la lactancia, se deben utilizar las dosis más bajas posibles.
Fertilidad:No se han realizado estudios sobre la fertilidad en seres humanos con la asociación a dosis fijas ni con los componentes individuales.
En estudios preclínicos, no se han observado efectos de telmisartán e HCTZ en la fertilidad de machos y hembras.
REACCIONES ADVERSAS:
Resumen del perfil de seguridad: La reacción adversa más frecuente es mareo. Raramente puede aparecer angioedema grave (≥1/10.000 a <1/1.000).
La incidencia global de reacciones adversas descrita con telmisartán/HCTZ fue comparable a aquella descrita con solo telmisartán, en ensayos clínicos controlados randomizados que incluyeron 1.471 pacientes randomizados que recibieron telmisartán asociado a HCTZ (835) o telmisartán solo (636). La relación entre la incidencia de reacciones adversas y la dosis no se ha establecido y no se ha observado una correlación con el sexo, edad o raza de los pacientes.
Tabla de reacciones adversas: Las reacciones adversas notificadas en todos los ensayos clínicos y que se producen más frecuentemente (p ≤0.05) con telmisartán asociado a HCTZ que con placebo, se muestran a continuación, de acuerdo con la Clasificación por Órganos y Sistemas. Las reacciones adversas conocidas para cada componente individual, pero que no han sido observadas en los ensayos clínicos, pueden producirse durante el tratamiento con telmisartán/HCTZ.
Las reacciones adversas notificadas previamente con uno de los componentes individuales pueden ser posibles reacciones adversas con MICARDIS® PLUS, aunque no se hayan observado en los ensayos clínicos de este producto.
Las reacciones adversas han sido ordenadas según sus frecuencias utilizando la siguiente clasificación: Muy frecuentes (≥1/10); frecuentes (≥1/100, <1/10); poco frecuentes (≥1/1,000, <1/100); raras (≥1/10,000, <1/1,000); muy raras (<1/10,000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 1: Tabla de reacciones adversas (MedDRA) observadas en estudios controlados con placebo y en la experiencia poscomercialización
|
Clasificación por órganos y sistemas de MedDRA |
Reacciones adversas |
Frecuencia |
||
|---|---|---|---|---|
|
MICARDIS® PLUS |
Telmisartána |
Hidroclorotiazida |
||
|
Infecciones e infestaciones |
Sepsis incluyendo desenlace mortal |
Rara2 |
||
|
Bronquitis |
Rara |
|||
|
Faringitis |
Rara |
|||
|
Sinusitis |
Rara |
|||
|
Infección de las vías respiratorias superiores |
Poco frecuente |
|||
|
Infección de las vías urinarias |
Poco frecuente |
|||
|
Cistitis |
Poco frecuente |
|||
|
Neoplasias benignas, malignas y no especificadas (incluye quistes y pólipos) |
Cáncer de piel no melanoma (carcinoma basocelular y carcinoma epidermoide) |
Frecuencia no conocida2 |
||
|
Trastornos de la sangre y del sistema linfático |
Anemia |
Poco frecuente |
||
|
Eosinofilia |
Rara |
|||
|
Trombocitopenia |
Rara |
Rara |
||
|
Púrpura trombocitopénica |
Rara |
|||
|
Anemia aplásica |
Frecuencia no conocida |
|||
|
Anemia hemolítica |
Muy rara |
|||
|
Insuficiencia de médula ósea |
Muy rara |
|||
|
Leucopenia |
Muy rara |
|||
|
Agranulocitosis |
Muy rara |
|||
|
Trastornos del sistema inmunológico |
Reacción anafiláctica |
Rara |
||
|
Hipersensibilidad |
Rara |
Muy rara |
||
|
Trastornos del metabolismo y de la nutrición |
Hipopotasemia |
Poco frecuente |
Muy frecuente |
|
|
Hiperuricemia |
Rara |
Frecuente |
||
|
Hiponatremia |
Rara |
Rara |
Frecuente |
|
|
Hiperpotasemia |
Poco frecuente |
|||
|
Hipoglucemia (en pacientes diabéticos) |
Rara |
|||
|
Hipomagnesemia |
Frecuente |
|||
|
Hipercalcemia |
Rara |
|||
|
Alcalosis hipoclorémica |
Muy rara |
|||
|
Apetito disminuido |
Frecuente |
|||
|
Hiperlipidemia |
Muy frecuente |
|||
|
Hiperglucemia |
Rara |
|||
|
Diabetes mellitus mal controlada |
Rara |
|||
|
Trastornos psiquiátricos |
Ansiedad |
Poco frecuente |
Rara |
|
|
Depresión |
Rara |
Poco frecuente |
Rara |
|
|
Insomnio |
Rara |
Poco frecuente |
||
|
Trastornos del sueño |
Rara |
Rara |
||
|
Trastornos del sistema nervioso |
Mareo |
Frecuente |
Rara |
|
|
Síncope |
Poco frecuente |
Poco frecuente |
||
|
Parestesia |
Poco frecuente |
Rara |
||
|
Somnolencia |
Rara |
|||
|
Cefalea |
Rara |
|||
|
Trastornos oculares |
Alteración visual |
Rara |
Rara |
Rara |
|
Visión borrosa |
Rara |
|||
|
Glaucoma agudo de ángulo cerrado |
Frecuencia no conocida |
|||
|
Derrame coroideo |
Frecuencia no conocida |
|||
|
Trastornos del oído y del laberinto |
Vértigo |
Poco frecuente |
Poco frecuente |
|
|
Trastornos cardíacos |
Taquicardia |
Poco frecuente |
Rara |
|
|
Arritmias |
Poco frecuente |
Rara |
||
|
Bradicardia |
Poco frecuente |
|||
|
Trastornos vasculares |
Hipotensión |
Poco frecuente |
Poco frecuente |
|
|
Hipotensión ortostática |
Poco frecuente |
Poco frecuente |
Frecuente |
|
|
Vasculitis necrosante |
Muy rara |
|||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea |
Poco frecuente |
Poco frecuente |
|
|
Dificultad respiratoria |
Rara |
Muy rara |
||
|
Neomonitis |
Rara |
Muy rara |
||
|
Edema pulmonar |
Rara |
Muy rara |
||
|
Tos |
Poco frecuente |
|||
|
Enfermedad pulmonar intersticial |
Muy rara1,2 |
|||
|
Síndrome de dificultad respiratoria (SDRA) (ver Advertencias y precauciones especiales de empleo) |
Muy rara |
|||
|
Trastornos gastrointestinales |
Diarrea |
Poco frecuente |
Poco frecuente |
Frecuente |
|
Boca seca |
Poco frecuente |
Rara |
||
|
Flatulencia |
Poco frecuente |
Poco frecuente |
||
|
Dolor abdominal |
Rara |
Poco frecuente |
||
|
Estreñimiento |
Rara |
Rara |
||
|
Dispepsia |
Rara |
Poco frecuente |
||
|
Vómitos |
Rara |
Poco frecuente |
Frecuente |
|
|
Gastritis |
Rara |
|||
|
Molestias abdominales |
Rara |
Rara |
||
|
Náuseas |
Frecuente |
|||
|
Pancreatitis |
Muy rara |
|||
|
Trastornos hepatobiliares |
Función hepática anormal/trastorno hepático |
Rara2 |
Rara2 |
|
|
Ictericia |
Rara |
|||
|
Colestasis |
Rara |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Angioedema (incluyendo desenlace mortal) |
Rara |
Rara |
|
|
Eritema |
Rara |
Rara |
||
|
Prurito |
Rara |
Poco frecuente |
||
|
Exantema |
Rara |
Poco frecuente |
Frecuente |
|
|
Hiperhidrosis |
Rara |
Poco frecuente |
||
|
Urticaria |
Rara |
Rara |
Frecuente |
|
|
Eccema |
Rara |
|||
|
Erupción farmacológica |
Rara |
|||
|
Erupción cutánea tóxica |
Rara |
|||
|
Síndrome seudolúpico |
Muy rara |
|||
|
Reacción de fotosensibilidad |
Rara |
|||
|
Necrólisis epidérmica tóxica |
Muy rara |
|||
|
Eritema multiforme |
Frecuencia no conocida |
|||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor de espalda |
Poco frecuente |
Poco frecuente |
|
|
Espasmos musculares (calambres en las piernas) |
Poco frecuente |
Poco frecuente |
Frecuencia no conocida |
|
|
Mialgia |
Poco frecuente |
Poco frecuente |
||
|
Artralgia |
Rara |
Rara |
||
|
Dolor en las extremidades (dolor en las piernas) |
Rara |
Rara |
||
|
Dolor tendinoso (síntomas de tipo tendinitis) |
Rara |
|||
|
Lupus eritematoso sistémico |
Rara1 |
Muy rara |
||
|
Trastornos renales y urinarios |
Disfunción renal |
Poco frecuente |
Frecuencia no conocida |
|
|
Insuficiencia renal aguda |
Poco frecuente |
Poco frecuente |
||
|
Glucosuria |
Rara |
|||
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil |
Poco frecuente |
Frecuente |
|
|
Trastornos generales y alteraciones en el lugar de administración |
Dolor torácico |
Poco frecuente |
Poco frecuente |
|
|
Enfermedad seudogripal |
Rara |
Rara |
||
|
Dolor |
Rara |
|||
|
Astenia (debilidad) |
Poco frecuente |
Frecuencia no conocida |
||
|
Fiebre |
Frecuencia no conocida |
|||
|
Exploraciones complementarias |
Ácido úrico en sangre aumentado |
Poco frecuente |
Rara |
|
|
Creatinina en sangre aumentada |
Rara |
Poco frecuente |
||
|
Creatina-fosfocinasa en sangre aumentada |
Rara |
Rara |
||
|
Enzimas hepáticas aumentadas |
Rara |
Rara |
||
|
Hemoglobina disminuida |
Rara |
|||
1 Basado en la experiencia poscomercialización.
2 Ver las subsecciones siguientes para más información.
a Las reacciones adversas se produjeron con frecuencia similar en pacientes tratados con placebo y con telmisartán. En ensayos controlados con placebo, la incidencia global de reacciones adversas descrita con telmisartán (41.4%) fue normalmente comparable a placebo (43.9%). Las reacciones adversas detalladas anteriormente han sido recogidas de todos los ensayos clínicos de pacientes tratados con telmisartán para la hipertensión o de pacientes de 50 años de edad o más que presentaban un alto riesgo de acontecimientos cardiovasculares.
Descripción de reacciones adversas seleccionadas:
Función hepática anormal/trastorno hepático: La mayoría de casos de función hepática anormal/trastorno hepático procedentes de la experiencia poscomercialización con telmisartán se dieron en pacientes japoneses. Los pacientes japoneses tienen mayor probabilidad de experimentar estas reacciones adversas.
Sepsis: En el ensayo PRoFESS se observó una mayor incidencia de sepsis con telmisartán en comparación con placebo. Este acontecimiento puede ser un hallazgo casual o estar relacionado con un mecanismo actualmente no conocido (ver Propiedades farmacodinámicas).
Enfermedad pulmonar intersticial: Se han notificado casos de enfermedad pulmonar intersticial procedentes de la experiencia poscomercialización asociados temporalmente a la toma de telmisartán. Sin embargo, no se ha establecido una relación causal.
Cáncer de piel no melanoma: Con base en los datos disponibles de estudios epidemiológicos, se ha observado una asociación dependiente de la dosis acumulada entre HCTZ y el CPNM (ver Advertencias y precauciones especiales de empleo y Propiedades farmacodinámicas).
Angioedema intestinal: Se han notificado casos de angioedema intestinal después del uso de antagonistas de los receptores de la angiotensina II (ver sección 4Advertencias y precauciones especiales de empleo).
EFECTOS SOBRE LA CAPACIDAD DE CONDUCCIÓN Y EL USO DE MAQUINARIA:
Efectos sobre la capacidad para conducir y utilizar máquinas: MICARDIS® PLUS puede influir sobre la capacidad para conducir y utilizar máquinas. A veces se pueden producir mareos, síncope o vértigo al tomar antihipertensivos tales como telmisartán/HCTZ.
Si los pacientes experimentan estos efectos adversos, deben evitar tareas potencialmente peligrosas como conducir o utilizar máquinas.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacción con otros medicamentos y otras formas de interacción:
Litio:
Durante la administración concomitante de litio con inhibidores de la enzima convertidora de la angiotensina, se han descrito aumentos reversibles de las concentraciones de litio sérico así como de su toxicidad. Se han notificado asimismo casos raros con bloqueantes del receptor de la angiotensina II (incluyendo telmisartán/HCTZ). No se recomienda la administración conjunta de litio con telmisartán/HCTZ (ver sección 4.4). Si esta asociación se considera imprescindible, se recomienda una cuidadosa monitorización del nivel de litio en suero durante la administración concomitante.
Medicamentos asociados con la pérdida de potasio y la hipopotasemia (p.ej. otros diuréticos kaliuréticos, laxantes, corticosteroides, ACTH, amfotericina, carbenoxolona, penicilina G sódica, ácido salicílico y derivados): Si estos fármacos se prescriben junto con la asociación HCTZ-telmisartán, se aconseja monitorizar los niveles plasmáticos de potasio. Estos medicamentos pueden potenciar el efecto de la HCTZ sobre el potasio sérico (ver Advertencias y precauciones especiales de empleo).
Productos de contraste yodados: En caso de deshidratación causada por diuréticos, existe un aumento del riesgo de insuficiencia renal funcional aguda, especialmente durante el uso de dosis altas de productos de contraste yodados. Se requiere rehidratación antes de la administración del producto yodado.
Medicamentos que pueden aumentar los niveles de potasio o inducir hiperpotasemia (p. ej., inhibidores ECA, diuréticos ahorradores de potasio, suplementos de potasio, sustitutos de la sal que contengan potasio, ciclosporina u otros medicamentos tales como la heparina sódica).
Si estos medicamentos se prescriben junto con la asociación HCTZ-telmisartán, se aconseja monitorizar los niveles plasmáticos de potasio. En base a la experiencia con el uso de otros medicamentos que contrarrestan el sistema renina-angiotensina, la administración concomitante de los medicamentos antes mencionados puede llevar a aumentos del potasio sérico y, por lo tanto, no se recomienda (ver Advertencias y precauciones especiales de empleo).
Medicamentos afectados por alteraciones del potasio en suero:
Se recomienda la monitorización periódica del potasio en suero y del ECG cuando telmisartán/HCTZ se administra con medicamentos afectados por alteraciones del potasio en suero (p. ej., glucósidos digitálicos, antiarrítmicos) y los siguientes medicamentos inductores de torsades de pointes (que incluyen algunos antiarrítmicos), ya que la hipopotasemia es un factor de predisposición de torsades de pointes.
- Antiarrítmicos de Clase Ia (p. ej., quinidina, hidroquinidina, disopiramida)
- Antiarrítmicos de Clase III (p. ej., amiodarona, sotalol, dofetilida, ibutilida)
- Algunos antipsicóticos (p. ej., tioridazina, clorpromazina, levomepromazina, trifluoperazina, ciamemazina, sulpirida, sultoprida, amisulprida, tiaprida, pimozida, haloperidol, droperidol)
- Otros (p. ej., bepridil, cisaprida, difemanil, eritromicina IV, halofantrina, mizolastina, pentamidina, esparfloxacino, terfenadina, vincamina IV).
Glucósidos digitálicos: La hipomagnesemia o hipopotasemia inducida por las tiazidas favorece la aparición de arritmia inducida por los digitálicos (ver Advertencias y precauciones especiales de empleo).
Digoxina: Cuando se administró telmisartán conjuntamente con digoxina se observaron aumentos medios en el pico de la concentración plasmática (49%) y en el valle de la concentración plasmática (20%) de digoxina. Al iniciar, ajustar e interrumpir el tratamiento con telmisartán, se deben monitorizar los niveles de digoxina para mantenerlos en el rango terapéutico.
Otros agentes antihipertensivos: Telmisartán puede aumentar el efecto hipotensor de otros antihipertensivos.
Los datos de los estudios clínicos han demostrado que el bloqueo dual del sistema renina angiotensina-aldosterona (SRAA) mediante el uso combinado de inhibidores de la enzima convertidora de angiotensina, bloqueantes de los receptores de la angiotensina II o aliskiren se asocia con una mayor frecuencia de acontecimientos adversos tales como hipotensión, hiperpotasemia y disminución de la función renal (incluyendo insuficiencia renal aguda) en comparación con el uso de un solo agente con efecto sobre el SRAA (ver Contraindicaciones, Advertencias y precauciones especiales de empleo y Propiedades farmacodinámicas).
Antidiabéticos (orales e insulina): Puede ser necesario un ajuste de la dosis del antidiabético (ver Advertencias y precauciones especiales de empleo).
Metformina: Metformina debe utilizarse con precaución: existe riesgo de acidosis láctica, inducida por un posible fallo de la función renal, asociado a HCTZ.
Colestiramina y resinas de colestipol: La absorción de HCTZ se altera en presencia de resinas de intercambio aniónico.
Antiinflamatorios no esteroideos: El tratamiento con AINe (es decir, ácido acetilsalicílico administrado en dosis propias de un tratamiento antiinflamatorio, inhibidores de la COX-2 y AINe no selectivos) puede reducir los efectos diuréticos, natriuréticos y antihipertensivos de los diuréticos tiazídicos y los efectos antihipertensivos de los antagonistas de los receptores de la angiotensina II.
En algunos pacientes con la función renal alterada (por ejemplo pacientes deshidratados o pacientes de edad avanzada con la función renal alterada), la administración conjunta de bloqueantes de los receptores de la angiotensina II y agentes inhibidores de la ciclooxigenasa puede resultar en un mayor deterioro de la función renal, incluyendo posible fallo renal agudo, que normalmente es reversible. Por lo tanto, la combinación debe administrarse con precaución, especialmente en pacientes de edad avanzada. Los pacientes deben ser hidratados de forma adecuada, y debe considerarse la monitorización de la función renal al inicio del tratamiento concomitante y de forma periódica a partir de entonces.
En uno de los estudios, la administración conjunta de telmisartán y ramipril condujo a un aumento de hasta 2.5 veces la AUC0-24 y Cmáx de ramipril y ramiprilato. Se desconoce la relevancia clínica de esta observación.
Aminas presoras (p. ej., noradrenalina): El efecto de aminas presoras puede estar disminuido.
Miorrelajantes no despolarizantes (p. ej., tubocurarina): HCTZ puede potenciar el efecto de los miorrelajantes no despolarizantes.
Medicamentos utilizados en el tratamiento de la gota (p. ej., probenecid, sulfinpirazona y alopurinol): Puede ser necesario el ajuste de dosis de los medicamentos uricosúricos, ya que HCTZ puede elevar el nivel de ácido úrico en suero. Puede ser necesario un aumento de la dosis de probenecid o de la sulfinpirazona. La administración conjunta de la tiazida puede aumentar la incidencia de reacciones de hipersensibilidad de alopurinol.
Sales de calcio: Los diuréticos tiazídicos pueden aumentar los niveles de calcio en suero debido a una excreción reducida. Si es necesario prescribir suplementos de calcio o medicamentos ahorradores de calcio (p. ej., tratamiento con vitamina D), los niveles de este en suero deben monitorizarse y proceder al correspondiente ajuste de dosis.
Beta-bloqueantes y diazóxido: El efecto hiperglucemiante de los beta-bloqueantes y del diazóxido puede ser potenciado por las tiazidas.
Anticolinérgicos (p. ej., atropina, biperideno): Pueden aumentar la biodisponibilidad de diuréticos del tipo de las tiazidas al reducir la motilidad gastrointestinal y la velocidad de vaciamiento gástrico.
Amantadina: Las tiazidas pueden aumentar el riesgo de efectos adversos ocasionados por amantadina.
Citotóxicos (p. ej., ciclofosfamida, metotrexato): Las tiazidas pueden reducir la excreción renal de medicamentos citotóxicos y potenciar sus efectos mielosupresores.
En base a sus propiedades farmacológicas, es posible que los siguientes medicamentos potencien el efecto hipotensor de todos los antihipertensivos, incluyendo telmisartán: baclofeno, amifostina.
Además, la hipotensión ortostática puede agravarse por el alcohol, los barbitúricos, los narcóticos o los antidepresivos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Datos preclínicos sobre seguridad: En estudios preclínicos de seguridad realizados con la administración conjunta de telmisartán e HCTZ en ratas y perros normotensos, dosis que producían una exposición comparable a la del rango terapéutico clínico no dieron lugar a hallazgos adicionales no observados ya con la administración única de cada una de estas sustancias. No se observaron hallazgos toxicológicos de relevancia para el uso terapéutico en humanos.
Hallazgos toxicológicos bien conocidos correspondientes a estudios preclínicos con inhibidores de la enzima convertidora de la angiotensina y bloqueantes de los receptores de la angiotensina II fueron: una reducción de los parámetros de la serie roja (eritrocitos, hemoglobina, hematocrito), alteraciones de la hemodinámica renal (aumento de la creatinina y nitrógeno ureico en sangre), aumento de la actividad de la renina en plasma, hipertrofia/hiperplasia de células yuxtaglomerulares y lesión de la mucosa gástrica. Las lesiones gástricas no se produjeron o mejoraron con suplementos salinos orales y alojamiento en grupo de los animales. En perros se observaron dilatación y atrofia de túbulos renales. Se considera que estos hallazgos obedecen a la actividad farmacológica de telmisartán. No se observaron efectos de telmisartán sobre la fertilidad masculina o femenina.
No se observó evidencia clara de un efecto teratógeno; sin embargo, a niveles de dosis tóxicas de telmisartán se observó un efecto en el desarrollo postnatal de la descendencia como, por ejemplo, peso corporal inferior y retraso en abrir los ojos.
Telmisartán no mostró evidencia de mutagenicidad ni de actividad clastogénica de importancia en estudios in vitro ni de carginogenicidad en ratas y ratones. Estudios con HCTZ han demostrado evidencia equívoca de efecto genotóxico o carcinogénico en algunos modelos experimentales.
Para el potencial fetotóxico de la asociación telmisartán/hidroclorotiazida, ver Fertilidad, embarazo y lactancia.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y forma de administración:
Posología: La asociación a dosis fijas debe tomarse en pacientes cuya presión arterial no puede controlarse adecuadamente sólo con telmisartán. Se recomienda la titulación individual de la dosis de cada uno de los dos componentes, antes de cambiar a la asociación a dosis fijas. Si es clínicamente apropiado, puede considerarse el cambio directo de la monoterapia a las asociaciones fijas.
• MICARDIS® PLUS 80 mg/12.5 mg puede administrarse una vez al día en pacientes cuya presión arterial no se controla adecuadamente con MICARDIS® 80 mg.
Edad avanzada: No es necesario un ajuste de dosis en pacientes de edad avanzada.
Insuficiencia renal: La experiencia en pacientes con insuficiencia renal de leve a moderada es pequeña, pero no ha sugerido efectos adversos renales y no se considera necesario ajustar la dosis. Se aconseja una monitorización periódica de la función renal (ver sección Advertencias y precauciones especiales de empleo). Debido al componente hidroclorotiazida, la asociación a dosis fijas está contraindicada en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min) (ver sección Contraindicaciones).
Telmisartán no se elimina de la sangre por hemofiltración y no es dializable.
Insuficiencia hepática: En pacientes con insuficiencia hepática de leve a moderada, MICARDIS® PLUS se debe administrar con precaución. Para telmisartán, la posología no debe superar los 40 mg una vez al día. La asociación a dosis fijas está contraindicada en pacientes con insuficiencia hepática grave (ver sección Contraindicaciones). Las tiazidas deben utilizarse con precaución en pacientes con insuficiencia hepática (ver Advertencias y precauciones especiales de empleo).
Población pediátrica: No se ha establecido la seguridad y eficacia de MICARDIS® PLUS en pacientes menores de 18 años. No se recomienda el uso de MICARDIS® PLUS en niños y adolescentes.
Forma de administración: Las tabletas de MICARDIS® PLUS son para administración oral una vez al día y deben tragarse enteros con líquido. MICARDIS® PLUS puede tomarse con o sin alimentos.
Precauciones que se deben tomar antes de manipular o administrar el medicamento: MICARDIS® PLUS debe mantenerse en el blíster sellado debido a las propiedades higroscópicas de las tabletas. Las tabletas deben sacarse del blíster justo antes de la administración (ver Precauciones especiales de eliminación y otras manipulaciones).
PROPIEDADES FARMACÉUTICAS:
Propiedades farmacológicas:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Bloquenates de los receptores de la angiotensina II (ARA) y diuréticos, código ATC: C09DA07.
MICARDIS® PLUS es una asociación de un bloqueante de los receptores de la angiotensina II, telmisartán, y un diurético tiazídico, hidroclorotiazida. La asociación de estos componentes tiene un efecto antihipertensivo aditivo, reduciendo la presión arterial en mayor grado que la administración única de cada uno de los componentes. MICARDIS® PLUS una vez al día produce reducciones eficaces y suaves de la presión arterial dentro del rango de dosis terapéuticas.
Mecanismo de acción: Telmisartán es un bloqueante específico de los receptores de la angiotensina II subtipo 1 (AT1), eficaz por vía oral. Telmisartán desplaza a la angiotensina II, con una afinidad muy elevada, de su lugar de unión al receptor subtipo AT1, el cual es responsable de las conocidas acciones de la angiotensina II. Telmisartán no presenta ninguna actividad agonista parcial en el receptor AT1. Telmisartán se une selectivamente al receptor AT1. La unión es de larga duración. Telmisartán no muestra una afinidad destacable por otros receptores, incluyendo los AT2 y otros receptores AT menos caracterizados. El papel funcional de estos receptores no es conocido ni tampoco el efecto de su posible sobreestimulación por la angiotensina II, cuyos niveles están aumentados por telmisartán. Los niveles plasmáticos de aldosterona son disminuidos por telmisartán. Telmisartán no inhibe la renina plasmática humana ni bloquea los canales iónicos. Telmisartán no inhibe el enzima convertidor de la angiotensina (quininasa II), enzima que también degrada la bradiquinina. Por lo tanto, no es de esperar una potenciación de los efectos adversos mediados por bradiquinina.
Una dosis de 80 mg de telmisartán administrada a voluntarios sanos, inhibe casi completamente el aumento de la presión arterial producido por la angiotensina II. El efecto inhibidor se mantiene durante 24 horas y es todavía medible hasta las 48 horas.
Hidroclorotiazida es un diurético tiazídico. No se conoce a fondo el mecanismo del efecto antihipertensivo de los diuréticos tiazídicos. Las tiazidas afectan a los mecanismos tubulares renales de reabsorción de electrólitos, aumentando directamente la excreción de sodio y cloruro en cantidades, de forma aproximada, equivalentes. La acción diurética de HCTZ reduce el volumen de plasma, potencia la actividad de la renina en plasma, aumenta la secreción de aldosterona, con el consiguiente incremento de la pérdida de bicarbonato y potasio urinarios, y reduce el potasio en suero. Debido, al parecer, al bloqueo del sistema renina-angiotensina-aldosterona, la administración simultánea de telmisartán tiende a invertir la pérdida de potasio asociada con estos diuréticos. Con HCTZ, la diuresis se inicia en 2 horas y el efecto máximo se alcanza al cabo de unas 4 horas, mientras que la acción tiene una duración aproximada de 6-12 horas.
Efectos farmacodinámicos:
Tratamiento de la hipertensión esencial: Después de la administración de la primera dosis de telmisartán, el inicio de la actividad antihipertensiva se produce gradualmente en 3 horas. La reducción máxima de la presión arterial se alcanza generalmente a las 4-8 semanas de iniciar el tratamiento y se mantiene durante el tratamiento a largo plazo. El efecto antihipertensivo persiste de forma constante hasta 24 horas después de la administración, incluso durante las últimas 4 horas previas a la administración siguiente, tal como se demuestra por mediciones ambulatorias de la presión arterial. Esto se confirma por mediciones hechas en el punto de máximo efecto e inmediatamente antes de la dosis siguiente (relación valle/pico, constantemente por encima del 80%, observada después de dosis de 40 mg y 80 mg de telmisartán en estudios clínicos controlados con placebo).
En pacientes hipertensos, telmisartán reduce la presión arterial tanto sistólica como diastólica sin afectar a la frecuencia del pulso. La eficacia antihipertensiva de telmisartán es comparable a la de fármacos representativos de otras clases de antihipertensivos (tal como se demostró en ensayos clínicos en los cuales se comparó telmisartán con amlodipino, atenolol, enalaprilo, hidroclorotiazida y lisinoprilo).
Después de la interrupción brusca del tratamiento con telmisartán, la presión arterial retorna gradualmente a los valores pre-tratamiento durante un periodo de varios días, sin evidencia de hipertensión de rebote.
En los ensayos clínicos, donde se comparó directamente los dos tratamientos antihipertensivos, la incidencia de tos seca fue significativamente menor en pacientes tratados con telmisartán que en aquellos tratados con inhibidores del enzima convertidor de la angiotensina.
Eficacia clínica y seguridad:
Prevención cardiovascular: El ensayo ONTARGET (ONgoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial) comparó los efectos de telmisartán, ramipril y la combinación de telmisartán y ramipril sobre los resultados cardiovasculares en 25.620 pacientes de 55 años de edad o mayores con historia de arteriopatía coronaria, ictus, ataque isquémico transitorio (AIT), arteriopatía periférica o diabetes mellitus tipo 2 acompañados de evidencia de daños en los órganos diana (p. ej., retinopatía, hipertrofia ventricular izquierda, macro o microalbuminuria), al ser una población en riesgo de acontecimientos cardiovasculares.
Los pacientes se aleatorizaron a uno de los siguientes tres grupos de tratamiento: telmisartán 80 mg (n = 8.542), ramipril 10 mg (n = 8.576), o la combinación de telmisartán 80 mg más ramipril 10 mg (n = 8.502), y se les realizó seguimiento durante un tiempo de observación medio de 4.5 años.
Telmisartán mostró un efecto similar a ramipril en la reducción de la variable primaria compuesta por muerte cardiovascular, infarto de miocardio no mortal, ictus no mortal u hospitalización por insuficiencia cardíaca congestiva. La incidencia de la variable primaria fue similar en los grupos de telmisartán (16.7%) y ramipril (16.5%). El cociente de riesgos para telmisartán versus ramipril fue de 1.01 (intervalo de confianza 97.5 % 0.93-1.10, p (no inferioridad) = 0.0019 en un margen de 1.13). La tasa de mortalidad por cualquier causa fue de 11.6% y 11.8% entre los pacientes tratados con telmisartán y ramipril, respectivamente.
Se observó que la eficacia de telmisartán era similar a la de ramipril en la variable secundaria pre-especificada de muerte cardiovascular, infarto de miocardio no mortal e ictus no mortal (0.99 intervalo de confianza 97.5% 0,90-1,08), p [no inferioridad] = 0,0004), variable principal en el ensayo de referencia HOPE (The Heart Outcomes Prevention Evaluation Study), que había estudiado el efecto de ramipril versus placebo.
El ensayo TRANSCEND aleatorizó pacientes intolerantes a los IECA con criterios de inclusión similares al ensayo ONTARGET con telmisartán 80 mg (n = 2.954) o placebo (n = 2.972), ambos administrados además del tratamiento convencional. La duración media del seguimiento fue de 4 años y 8 meses. No se encontró ninguna diferencia estadísticamente significativa en la incidencia de la variable principal compuesta (muerte cardiovascular, infarto de miocardio no mortal, ictus no mortal u hospitalización por insuficiencia cardiaca congestiva) (15,7% en el grupo de telmisartán y 17,0% en el grupo de placebo con un cociente de riesgos de 0,92 [intervalo de confianza 95% 0,81-1,05, p = 0,22]). En la variable secundaria preespecificada compuesta por muerte cardiovascular, infarto de miocardio no mortal e ictus no mortal hubo evidencia de un beneficio de telmisartán en comparación con placebo (0,87 [intervalo de confianza 95% 0,76-1,00, p = 0,048]). No hubo ninguna evidencia de beneficio en la mortalidad cardiovascular (cociente de riesgos 1,03, intervalo de confianza 95% 0,85-1,24).
Tos y angioedema se notificaron con menor frecuencia en pacientes tratados con telmisartán que en pacientes tratados con ramipril, mientras que hipotensión se notificó con mayor frecuencia con telmisartán.
Combinar telmisartán y ramipril no añadió ningún beneficio adicional a ramipril o telmisartán solos. La mortalidad CV y todas las causas de mortalidad fueron numéricamente superiores con la combinación.
Además, hubo una incidencia significativamente superior de hiperpotasemia, insuficiencia renal, hipotensión y síncope en el grupo de la combinación. Por lo tanto, no se recomienda el uso de la combinación de telmisartán y ramipril en esta población.
En el ensayo “Prevention Regimen for Effectively avoiding Second Strokes” (PRoFESS), en pacientes de 50 años en adelante, que habían padecido un accidente cerebrovascular reciente, se observó una mayor incidencia de sepsis con el tratamiento de telmisartán en comparación al grupo de placebo, 0.70 % frente a 0.49% [RR 1.43 (intervalo de confianza 95% 1.00-2.06)]; la incidencia de casos de sepsis mortal fue mayor en pacientes que tomaban telmisartán (0.33%) frente a pacientes que tomaban placebo (0.16 %) [RR 2.07 (intervalo de confianza 95% 1.14-3.76)]. La mayor tasa de casos de sepsis observada en asociación con el uso de telmisartán podría ser un hecho aislado o estar relacionado con un mecanismo actualmente no conocido.
Dos grandes estudios aleatorizados y controlados (ONTARGET [ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial] y VA NEPHRON-D [The Veterans Affairs Nephropathy in Diabetes]) han estudiado el uso de la combinación de un inhibidor de la enzima convertidora de angiotensina con un bloqueante de los receptores de la angiotensina II.
ONTARGET fue un estudio realizado en pacientes con antecedentes de enfermedad cardiovascular o cerebrovascular o diabetes mellitus tipo 2, acompañada con evidencia de daño en los órganos diana. Para obtener información más detallada, ver arriba en el apartado “Prevención cardiovascular”.
VA NEPHRON-D fue un estudio en pacientes con diabetes mellitus tipo 2 y nefropatía diabética.
Estos estudios no mostraron ningún beneficio significativo sobre la mortalidad y los resultados renales y/o cardiovasculares, en cuanto se observó un aumento del riesgo de hiperpotasemia, daño renal agudo y/o hipotensión, comparado con la monoterapia. Dada la similitud de sus propiedades farmacológicas, estos resultados también resultan apropiados para otros inhibidores de la enzima convertidora de angiotensina y antagonistas de los receptores de angiotensina II.
En consecuencia, no se deben utilizar de forma concomitante los inhibidores de la enzima convertidora de angiotensina y los bloqueantes de los receptores de la angiotensina II en pacientes con nefropatía diabética.
ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) fue un estudio diseñado para evaluar el beneficio de añadir aliskiren a una terapia estándar con un inhibidor de la enzima convertidora de angiotensina o un bloqueante de los receptores de lav angiotensina II en pacientes con diabetes mellitus tipo 2 e insuficiencia renal crónica, enfermedad cardiovascular, o ambas. El estudio se dio por finalizado prematuramente a raíz de un aumento en el riesgo de resultados adversos. La muerte por causas cardiovasculares y los ictus fueron ambos numéricamente más frecuentes en el grupo de aliskiren que en el grupo de placebo, y se notificaron acontecimientos adversos y acontecimientos adversos graves de interés (hiperpotasemia, hipotensión y disfunción renal) con más frecuencia en el grupo de aliskiren que en el de placebo.
Estudios epidemiológicos han demostrado que el tratamiento a largo plazo con HCTZ reduce el riesgo de morbilidad y mortalidad cardiovasculares.
Se desconocen, por el momento, los efectos de la asociación a dosis fijas de telmisartán/HCTZ sobre la mortalidad y morbilidad cardiovascular.
Cáncer de piel no melanoma: Con base en los datos disponibles de estudios epidemiológicos, se ha observado una asociación dependiente de la dosis acumulada entre HCTZ y el CPNM. En un estudio se incluyó a una población formada por 71.533 casos de CBC y 8.629 casos de CCE emparejados con 1.430.833 y 172.462 controles de la población, respectivamente. El uso de dosis altas de HCTZ (≥50.000 mg acumulados) se asoció a una OR ajustada de 1.29 (IC del 95%: 1.23-1.35) para el CBC y de 3.98 (IC del 95%: 3.68-4.31) para el CCE. Se observó una clara relación entre la dosis acumulada y la respuesta tanto en el CBC como en el CCE. Otro estudio mostró una posible asociación entre el cáncer de labio (CCE) y la exposición a HCTZ: 633 casos de cáncer de labios se emparejaron con 63.067 controles de la población, utilizando una estrategia de muestreo basada en el riesgo. Se demostró una relación entre la dosis acumulada y la respuesta con una OR ajustada de 2.1 (IC del 95%: 1.7-2.6) que aumentó hasta una OR de 3.9 (3.0-4.9) con el uso de dosis altas (~25.000 mg) y una OR de 7.7 (5.7-10.5) con la dosis acumulada más alta (~100.000 mg) (ver Advertencias y precauciones especiales de empleo).
Población pediátrica: La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con MICARDIS® PLUS en todos los grupos de la población pediátrica en la hipertensión (ver Posología y forma de administración para consultar la información sobre el uso en la población pediátrica).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis:
La información disponible de sobredosis con telmisartán en humanos es limitada. No se ha establecido el grado en que HCTZ se elimina por hemodiálisis.
Síntomas: Las manifestaciones más destacadas en caso de sobredosis de telmisartán fueron hipotensión y taquicardia; también se han notificado bradicardia, mareo, vómitos, aumento de la creatinina sérica y fallo renal agudo. La sobredosis de HCTZ se asocia con depleción de electrólitos (hipopotasemia, hipocloremia) e hipovolemia como resultado de diuresis excesiva. Los signos y síntomas más habituales de sobredosis son náuseas y somnolencia. La hipopotasemia puede tener como consecuencia espasmos musculares y/o arritmia acentuada asociada con el uso concomitante de glucósidos digitálicos o determinados medicamentos antiarrítmicos.
Tratamiento: Telmisartán no se elimina por hemofiltración y no es dializable. El paciente debe someterse a una monitorización estrecha y el tratamiento debe ser sintomático y de soporte. El tratamiento depende del tiempo transcurrido desde la ingestión y de la gravedad de los síntomas. Entre las medidas sugeridas se incluye la inducción del vómito y/o el lavado gástrico. El carbón activado puede ser útil en el tratamiento de las sobredosis. Deben monitorizarse con frecuencia la creatinina y los electrólitos séricos. En caso de hipotensión, el paciente debe ser colocado en decúbito supino, con administración rápida de sales y reposición de la volemia.
PRESENTACIONES:
Naturaleza y contenido del envase:
Blísters de aluminio/aluminio (PA/Al/PVC/Al o PA/PA/Al/PVC/Al).
La disponibilidad de las presentaciones depende de cada país.
Caja con 14 tabletas con 80 mg/12.5 mg.
Caja con 3 tabletas con 80 mg/12.5 mg (muestra médica)
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Precauciones especiales de conservación: Consérvese a no más de 30 °C y en lugar seco. Protéjase de la luz. Conservar en el embalaje original para protegerlo de la humedad.
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continua de la relación beneficio/riesgo del medicamento. Se invita a los profesionales de salud a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación de su país y/o farmacovigilancia.mex@boehringer-ingelheim.com.
Precauciones especiales de eliminación y otras manipulaciones: MICARDIS® PLUS debe mantenerse en el blíster sellado debido a las propiedades higroscópicas de las tabletas. Las tabletas deben sacarse del blíster justo antes de la administración.
Ocasionalmente, se ha observado que la capa exterior del envase blíster se separa de la interior entre los alveolos del blíster. Si esto se detecta, no se requiere ninguna acción.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Hecho en Alemania por:
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Str. 173
55216, Ingelheim am Rhein, Alemania
Acondicionado por:
Boehringer Ingelheim Promeco S.A. de C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocan,
C.P. 16090, Deleg. Xochimilco, D.F., México.
Para:
BOEHRINGER INGELHEIM PROMECO S.A. DE C.V.
Calle del Maíz No. 49,
Col. Barrio Xaltocan, C.P. 16090,
Deleg. Xochimilco, Ciudad de México, México
®Marca registrada
Fecha de revisión de la monografía: 06 Diciembre, 2024