
OZEMPIC DUALDOSE/FIXDOSE PANAMÁ
SEMAGLUTIDA
Solución inyectable
1 Empaque, 1 Pluma precargada, 0,25/0,5 mg/mg
1 Empaque, 1 Pluma precargada, 1 mL,
1 Empaque, 1 Pluma precargada, 3 mL, 1 mg
1 Empaque, 1 Pluma precargada, 3 mL, 2 mg
COMPOSICIÓN:
Excipientes:
Fosfato disódico dihidrato, propilenglicol, fenol, ácido clorhídrico/hidróxido de sodio (para ajustar el nivel de pH), cantidad de agua para inyectables suficiente para una solución de 1 mL correspondiente a 0,367 mg de sodio.
Forma farmacéutica y cantidad de sustancia activa por unidad:
Solución isotónica clara, incolora o casi incolora; pH = 7,4.
OZEMPIC® DUALDOSE 0,25 mg o 0,5 mg/dosis: 1 mL de solución contiene 1,34 mg de semaglutida*. Una pluma precargada contiene 2 mg de semaglutida* en 1,5 mL de solución.
OZEMPIC® FIXDOSE 1 mg/dosis: 1 mL de solución contiene 1,34 mg de semaglutida*. Una pluma precargada contiene 4 mg de semaglutida* en 3 mL de solución.
OZEMPIC® FIXDOSE 2 mg/dosis: 1 mL de solución contiene 2,68 mg de semaglutida*. Una pluma precargada contiene 8 mg de semaglutida* en 3 mL de solución.
*Producido genéticamente por tecnología de ADN recombinante en células de Saccharomyces cerevisiae.
INDICACIONES TERAPÉUTICAS:
Indicaciones/usos:
OZEMPIC® se utiliza para el tratamiento de adultos con diabetes mellitus tipo 2 con un control insuficiente como complemento a la dieta y ejercicio:
• Como monoterapia en caso de contraindicación o intolerancia a la metformina.
• En combinación con otros medicamentos hipoglucemiantes (consulte Eficacia clínica para los resultados sobre las combinaciones investigadas en los estudios clínicos).
PROPIEDADES FARMACOLÓGICAS:
Propiedades/efectos:
Código ATC: A10BJ06
Mecanismo de acción:
Semaglutida es un análogo de GLP-1 con una homología de secuencia de 94% al GLP-1 humano. GLP-1 es una hormona fisiológica. Semaglutida actúa como un agonista del receptor de GLP-1 que se une selectivamente al receptor de GLP-1, el receptor objetivo para GLP-1 nativo, y lo activa. Los receptores de GLP-1 se expresan en el páncreas, cerebro, corazón, sistema vascular, sistema inmune y en los riñones.
En comparación con GLP-1 nativo, semaglutida posee una vida media prolongada de aproximadamente 1 semana, que es la razón por la cual es apropiada para una inyección subcutánea una vez a la semana. El mecanismo de prolongación principal es la unión a albúmina, que conduce a una eliminación renal reducida y una protección contra la degradación metabólica.
Además, semaglutida es estable frente a la degradación por la enzima DPP-4.
Semaglutida reduce el nivel de glucosa sanguíneo en una forma dependiente de la glucosa estimulando la secreción de insulina y reduciendo la secreción de glucagón. Cuando son altos los niveles sanguíneos de glucosa, se estimula la secreción de insulina y se inhibe la secreción de glucagón. El mecanismo de reducción de la glucosa sanguínea también incluye un pequeño retraso en el vaciado gástrico en la fase posprandial temprana. Durante la hipoglucemia, semaglutida disminuye la secreción de insulina y no deteriora la secreción de glucagón.
Semaglutida reduce el peso corporal y la masa grasa corporal a través de una menor ingesta de energía. El mecanismo incluye por lo general una disminución del apetito; esto incluye una mayor sensación de saciedad y una menor sensación de hambre. Se reduce la resistencia a la insulina. Esto presuntamente ocurre debido a la reducción en el peso corporal.
Farmacodinamia:
Todas las investigaciones farmacodinámicas se realizaron después de 12 semanas de tratamiento (incluyendo el escalamiento de la dosis) en estado estacionario, con tratamiento de 1 mg de semaglutida una vez a la semana.
Glucosa sanguínea en ayuno y posprandial:
En pacientes con diabetes tipo 2, el tratamiento con semaglutida 1 mg resultó en una reducción en el nivel de glucosa sanguíneo en términos de cambio absoluto desde la basal (mmol/L) y una reducción relativa en comparación con el placebo (%) para glucosa en ayuno (1,6 mmol/L; reducción de 22%), glucosa posprandial después de 2 horas (4,1 mmol/L; reducción de 37%), media del nivel de glucosa de 24 horas (1,7 mmol/L; reducción de 22%) y picos de glucosa posprandial durante las tres comidas (0,6 a 1,1 mmol/L) en comparación con placebo.
Semaglutida redujo la glucosa sanguínea en ayuno después de la primera dosis.
Función de células beta y secreción de insulina:
En comparación con el placebo, semaglutida mejoró la respuesta insulínica de primera y segunda fase después de un bolo de glucosa intravenoso con un incremento del triple y el doble, respectivamente. Después de una prueba de estimulación de arginina en pacientes con diabetes mellitus tipo 2, semaglutida incrementó la capacidad secretora de células beta máxima en comparación con placebo. Además, el tratamiento de semaglutida incrementó la concentración de insulina en ayunas en comparación con placebo.
Secreción de glucagón:
En pacientes con diabetes mellitus tipo 2, semaglutida resultó en las siguientes reducciones relativas en el glucagón en comparación con el placebo: glucagón en ayuno (8–21%), respuesta de glucagón posprandial (14–15%) y media de concentración de glucagón de 24 horas (12%).
Secreción de insulina y glucagón dependiente de glucosa:
Semaglutida disminuyó los niveles de glucosa sanguínea elevados estimulando la secreción de insulina e inhibiendo la secreción de glucagón en una forma dependiente de la glucosa. Con semaglutida, la tasa de secreción de insulina en pacientes con diabetes mellitus tipo 2 fue comparable con la de los sujetos saludables.
Durante la hipoglucemia inducida, semaglutida no alteró las respuestas contrarreguladoras a mayores niveles de glucagón y no deterioró la disminución del péptido C en pacientes con diabetes mellitus tipo 2 en comparación con placebo.
Vaciado gástrico:
Semaglutida causó una prolongación menor del vaciado gástrico posprandial temprano, con lo que se reduce la tasa a la cual la glucosa aparece en la circulación después de la ingesta de alimentos.
Apetito, ingesta de energía y elección alimenticia:
En comparación con placebo, semaglutida redujo la ingesta de energía de tres comidas consecutivas ad libitum en un 18-35%. Esto se vio respaldado por una supresión del apetito inducida por semaglutida en el estado de ayuno, así como después de la ingesta de alimentos, un mejor control de la conducta alimenticia, una reducción en los antojos y una preferencia relativamente menor para alimentos grasosos.
Lípidos sanguíneos en ayuno y posprandiales:
En comparación con el placebo, semaglutida redujo los niveles de triglicéridos en ayuno y concentraciones de colesterol de lipoproteína de muy baja densidad (VLDL) en un 12% y 21%, respectivamente. La respuesta de triglicéridos y colesterol de VLDL posprandial después de una comida alta en grasas se redujo en un > 40%.
El efecto de semaglutida sobre la repolarización cardiaca se investigó en un estudio de QTc detallado. Semaglutida no prolongó los intervalos QTc en niveles de dosis supraterapéuticos (hasta 1,5 mg en estado estacionario).
Eficacia clínica:
La eficacia y seguridad de OZEMPIC® 0,5 mg y 1 mg administrados una vez a la semana se evaluaron en seis estudios controlados aleatorizados que incluyeron 7215 pacientes con diabetes mellitus tipo 2 (de los cuales 4107 recibieron tratamiento con OZEMPIC®). Cinco estudios (SUSTAIN 1 - 5) tuvieron la evaluación de la eficacia glucémica como el objetivo primario, mientras que un estudio (SUSTAIN 6) tuvo la evaluación de seguridad cardiovascular como el objetivo primario.
La eficacia y seguridad de OZEMPIC® 2 mg una vez a la semana se examinaron en un estudio de fase 3b (SUSTAIN FORTE) en 961 pacientes incluidos en el ensayo.
Además, se realizó un estudio adicional de fase 3b (SUSTAIN 7) con 1201 pacientes para comparar la eficacia y seguridad de OZEMPIC® 0,5 mg y 1 mg una vez a la semana con las de dulaglutida 0,75 mg y 1,5 mg una vez a la semana. El estudio de fase 3b (SUSTAIN 9) con 302 pacientes se llevó a cabo para evaluar la eficacia y seguridad de semaglutida además de una terapia existente con un inhibidor de SGLT2 (con o sin metformina o sulfonilurea) en pacientes con diabetes mellitus tipo 2.
El tratamiento con OZEMPIC® demostró reducciones sostenidas, estadísticamente superiores y clínicamente significativas en el valor de HbA1c (Figura 1) y el peso corporal por hasta 2 años en comparación con placebo y preparaciones de control activas (sitagliptina, insulina glargina, exenatida ER y dulaglutida).
Figura 1. Valor de HbA1c (%), cambio estimado al final del tratamiento en comparación con el valor inicial en SUSTAIN 1-7+9 (OZEMPIC® 0,5 mg gris oscuro; OZEMPIC® 1 mg negro; productos comparadores blanco; y placebo gris claro)

La edad, el género, la raza, el IMC y el peso corporal (kg) basales, la duración de la diabetes y la gravedad de insuficiencia renal no tuvieron efecto sobre la eficacia de OZEMPIC®.
Los resultados se refieren a la fase de tratamiento para todos los participantes aleatorizados en cada caso (análisis basados en modelos mixtos para mediciones repetidas o imputación múltiple).
Además, se llevó a cabo un estudio de fase 3b de 52 semanas (SUSTAIN 11) para estudiar el efecto de la semaglutida en comparación con la insulina aspártica (en bolo con las tres comidas principales), tanto como complemento de la metformina como de la insulina glargina optimizada (U100).
SUSTAIN 1: Monoterapia.
En SUSTAIN 1, un estudio de 30 semanas, doble ciego, controlado con placebo, 388 pacientes controlados inadecuadamente con dieta y ejercicio recibieron tratamiento con OZEMPIC® 0,5 mg u OZEMPIC® 1 mg una vez a la semana o placebo.
Tabla 2. SUSTAIN 1: Resultados en la Semana 30
|
OZEMPIC® 0,5 mg |
OZEMPIC® 1 mg |
Placebo |
|
|---|---|---|---|
|
Población (N) con intención de tratar (IDT) |
128 |
130 |
129 |
|
Valor de HbA1c (%) |
|||
|
Valor basal (media) |
8,1 |
8,1 |
8,0 |
|
Cambio desde la basal en la Semana 30 |
-1,5 |
-1,6 |
0,0 |
|
Diferencia respecto al placebo [IC del 95%] |
-1,4 [-1,7; -1,1]a |
-1,5 [-1,8; -1,2]a |
|
|
Pacientes (%) que alcanzaron un valor de HbA1c < 7% |
74b |
72b |
25 |
|
Diferencia (razón de momios) respecto al placebo [IC del 95%] |
16,9 [8,4; 33,9] |
15,7 [8,0; 30,8] |
|
|
Peso corporal (kg) |
|||
|
Valor inicial (media) |
89,8 |
96,9 |
89,1 |
|
Cambio desde la basal en la Semana 30 |
-3,7 |
-4,5 |
-1,0 |
|
Diferencia respecto al placebo [IC del 95%] |
-2,7 [-3,9; -1,6]a |
-3,6 [-4,7; -2,4]a |
- |
a p <0,0001 (bilateral) para superioridad, ajustado con relación a la multiplicidad en función de la prueba jerárquica del valor de HbA1c y el peso corporal
b p <0,0001 para diferencia en el tratamiento, no ajustado con relación a la multiplicidad
SUSTAIN 2- combinación de OZEMPIC® frente a sitagliptina, con 1-2 antidiabéticos orales: metformina y/o tiazolidinedionas.
En SUSTAIN 2, un estudio de 56 semanas doble ciego, 1231 pacientes recibieron tratamiento con OZEMPIC® 0,5 mg u OZEMPIC® 1 mg una vez a la semana o sitagliptina 100 mg una vez al día, cada vez en combinación con metformina (94%) y/o tiazolidinedionas (6%).
Tabla 3. SUSTAIN 2: Resultados en la Semana 56
|
Población (N) con intención de tratar (IDT) |
OZEMPIC® 0,5 mg |
OZEMPIC® 1 mg |
Sitagliptina 100 mg |
|
409 |
409 |
407 |
|
|
OZEMPIC® 0,5 mg |
OZEMPIC® 1 mg |
Sitagliptina 100 mg |
|
|
Valor de HbA1c (%) |
|||
|
Valor basal (media) |
8,0 |
8,0 |
8,2 |
|
Cambio desde la basal en la Semana 56 |
-1,3 |
-1,6 |
-0,5 |
|
Diferencia respecto a sitagliptina [IC del 95%] |
-0,8 [-0,9; -0,6]a |
-1,1 [-1,2; -0,9]a |
- |
|
Pacientes (%) que alcanzaron un valor de HbA1c <7% |
69b |
78b |
36 |
|
Diferencia (razón de momios) respecto a sitagliptina [IC del 95%] |
4,2 [3,02; 5,74] |
7,9 [5,59; 11,22] |
|
|
Peso corporal (kg) |
|||
|
Valor basal (media) |
89,9 |
89,2 |
89,3 |
|
Cambio desde la basal en la Semana 56 |
-4,3 |
-6,1 |
-1,9 |
|
Diferencia respecto a sitagliptina [IC del 95%] |
-2,3 [-3,1; -1,6]a |
-4,2 [-4,9; -3,5]a |
- |
a p <0,0001 (bilateral) para superioridad, ajustado con relación a la multiplicidad en función de la prueba jerárquica del valor de HbA1c y el peso corporal
b p <0,0001 para diferencia en el tratamiento, no ajustado con relación a la multiplicidad
SUSTAIN 9: OZEMPIC® frente a placebo como adición a una terapia existente con un inhibidor de SGLT2 ± metformina o SU.
En un ensayo doble ciego controlado con placebo de 30 semanas, 302 pacientes con diabetes mellitus tipo 2 que no estaban controlados adecuadamente con un inhibidor de SGLT2 con o sin metformina o SU fueron aleatorizados para recibir OZEMPIC® 1,0 mg una vez a la semana o placebo.
Tabla 4. SUSTAIN 9: Resultados en la Semana 30
|
Población (N) con intención de tratar (IDT) |
OZEMPIC® 1 mg |
Placebo |
|
151 |
151 |
|
|
HbA1c (%) |
||
|
Valor basal (media) |
8,0 |
8,1 |
|
Cambio desde la basal en la Semana 30 |
-1,5 |
-0,1 |
|
Diferencia respecto al placebo [IC del 95%] |
-1,42 [-1,61; -1,24]a |
- |
|
Pacientes (%) que alcanzaron un valor de HbA1c < 7% |
78,7 |
18,7 |
|
Diferencia (razón de momios) respecto al placebo [IC del 95%] |
27,32b [12,80; 58,30] |
- |
|
Peso corporal (kg) |
||
|
Valor basal (media) |
89,6 |
93,8 |
|
Cambio desde la basal en la Semana 30 |
-4,7 |
-0,9 |
|
Diferencia respecto al placebo [IC del 95%] |
-3,81 [-4,70; -2,93]a |
- |
a p < 0,0001 (bilateral) para superioridad, ajustada por multiplicidad en función de las pruebas jerárquicas del valor de HbA1c y peso corporal
b p < 0,0001 para diferencia de tratamiento, no ajustado por multiplicidad
SUSTAIN 7: OZEMPIC® frente a dulaglutida, ambos en combinación con metformina.
En un estudio abierto de 40 semanas, 1201 pacientes con metformina se aleatorizaron a OZEMPIC® 0,5 mg o 1 mg una vez a la semana o dulaglutida 0,75 mg o 1,5 mg una vez a la semana. El estudio comparó 0,5 mg de semaglutida con 0,75 mg de dulaglutida y 1 mg de semaglutida con 1,5 mg de dulaglutida.
Tabla 5. SUSTAIN 7: Resultados en la Semana 40
|
Población (N) con intención de tratar (IDT) |
Semaglutida 0,5 mg |
Semaglutida 1 mg |
Dulaglutida 0,75 mg |
Dulaglutida 1,5 mg |
|
301 |
300 |
299 |
299 |
|
|
Semaglutida 0,5 mg |
Semaglutida 1 mg |
Dulaglutida 0,75 mg |
Dulaglutida 1,5 mg |
|
|
HbA1c (%) |
||||
|
Valor basal (media) |
8,3 |
8,2 |
8,2 |
8,2 |
|
Cambio desde la basal en la Semana 40 |
-1,5 |
-1,8 |
-1,1 |
-1,4 |
|
Diferencia respecto a la dulaglutida [IC del 95%] |
-0,4b [-0,6, -0,2]a |
-0,4c [-0,6, -0,3]a |
- |
- |
|
Pacientes (%) que alcanzaron un valor de HbA1c < 7% |
68 |
79 |
52 |
67 |
|
Diferencia (razón de momios) con respecto a dulaglutida [IC del 95%] |
2,5 [1,68; 3,64] |
2,0 [1,28; 3,00] |
||
|
Peso corporal (kg) |
||||
|
Valor basal (media) |
96,4 |
95,5 |
95,6 |
93,4 |
|
Cambio desde la basal en la Semana 40 |
-4,6 |
-6,5 |
-2,3 |
-3,0 |
|
Diferencia respecto a dulaglutida [IC del 95%] |
-2,3b [-3,0, -1,5]a |
-3,6c [-4,3, -2,8]a |
- |
- |
a p <0,0001 (bilateral) para superioridad
b 0,5 mg de OZEMPIC® versus 0,75 mg de dulaglutida
c 1 mg de OZEMPIC® versus 1,5 mg de dulaglutida
SUSTAIN 3: OZEMPIC® frente a exenatida ER, ambos en combinación con metformina o metformina con sulfonilurea.
En SUSTAIN 3, 813 pacientes que recibieron tratamiento con metformina sola (49%), con metformina más sulfonilureas (45%) o con otros antidiabéticos (6%) recibieron tratamiento adicionalmente con OZEMPIC® 1 mg una vez a la semana o con exenatida ER 2 mg una vez a la semana durante 56 semanas. El estudio no fue doble ciego.
Tabla 6. SUSTAIN 3: Resultados en la Semana 56
|
OZEMPIC® 1 mg |
Exenatida ER 2 mg |
|
|
Población (N) con intención de tratar (IDT) |
404 |
405 |
|
Valor de HbA1c (%) |
||
|
Valor basal (media) |
8,4 |
8,3 |
|
Cambio desde la basal en la Semana 56 |
-1,5 |
-0,9 |
|
Diferencia respecto a exenatida [IC del 95%] |
-0,6 [-0,8; -0,4]a |
- |
|
Pacientes (%) que alcanzaron un valor de HbA1c <7% |
67b |
40 |
|
Diferencia (razón de momios) respecto a exenatida ER [IC del 95%] |
3,9 [2,80; 5,38] |
|
|
Peso corporal (kg) |
||
|
Valor basal (media) |
96,2 |
95,4 |
|
Cambio desde la basal en la Semana 56 |
-5,6 |
-1,9 |
|
Diferencia respecto a exenatida [IC del 95%] |
-3,8 [-4,6, -3,0]a |
- |
a p <0,0001 (bilateral) para superioridad, ajustado con relación a la multiplicidad en función de la prueba jerárquica del valor de HbA1c y el peso corporal
b p <0,0001 para diferencia en el tratamiento, no ajustado con relación a la multiplicidad
SUSTAIN 4: OZEMPIC® frente a insulina glargina, ambos en combinación con 1 - 2 antidiabéticos orales: metformina, o metformina y sulfonilurea.
En SUSTAIN 4, un total de 1089 pacientes que recibieron tratamiento con metformina sola (48%) o con metformina más sulfonilureas (51%) recibieron tratamiento adicionalmente con OZEMPIC® 0,5 mg una vez a la semana, OZEMPIC® 1 mg una vez a la semana o insulina glargina una vez al día durante 30 semanas. El ensayo no fue doble ciego.
Tabla 7. SUSTAIN 4: Resultados en la Semana 30
|
OZEMPIC® 0,5 mg |
OZEMPIC® 1 mg |
Insulina glargina |
|
|
Población (N) con intención de tratar (IDT) |
362 |
360 |
360 |
|
Valor de HbA1c (%) |
|||
|
Valor basal (media) |
8,1 |
8,2 |
8,1 |
|
Cambio desde la basal en la Semana 30 |
-1,2 |
-1,6 |
-0,8 |
|
Diferencia respecto de insulina glargina [IC del 95%] |
-0,4 [-0,5; - 0,2]a |
-0,8 [-1,0; -0,7]a |
- |
|
Pacientes (%) que alcanzaron un valor de HbA1c < 7% |
57b |
73b |
38 |
|
Diferencia (razón de momios) respecto a insulina glargina [IC del 95%] |
2,4 [1,73; 3,28] |
5,8 [4,08; 8,19] |
|
|
Peso corporal (kg) |
|||
|
Valor basal (media) |
93,7 |
94,0 |
92,6 |
|
Cambio desde la basal en la Semana 30 |
-3,5 |
-5,2 |
+1,2 |
|
Diferencia respecto de insulina glargina [IC del 95%] |
-4,6 [-5,3; - 4,0]a |
-6,34 [-7,0; - 5,7]a |
- |
a p < 0,0001 (bilateral) para superioridad, ajustado con relación a la multiplicidad en función de la prueba jerárquica del valor de HbA1c y el peso corporal
b p < 0,0001 para diferencia entre el tratamiento, no ajustado con relación a la multiplicidad
SUSTAIN 5: OZEMPIC® frente a placebo, ambos en combinación con insulina basal.
En SUSTAIN 5, un total de 397 pacientes con un control inadecuado con insulina basal con o sin metformina recibieron tratamiento adicionalmente con OZEMPIC® 0,5 mg una vez a la semana, OZEMPIC® 1 mg una vez a la semana o con placebo durante 30 semanas. El estudio no fue doble ciego.
Tabla 8. SUSTAIN 5: Resultados en la Semana 30
|
OZEMPIC® 0,5 mg |
OZEMPIC® 1 mg |
Placebo |
|
|
Población (N) con intención de tratar (IDT) |
132 |
131 |
133 |
|
Valor de HbA1c (%) |
|||
|
Valor basal (media) |
8,4 |
8,3 |
8,4 |
|
Cambio desde la basal en la Semana 30 |
-1,4 |
-1,8 |
-0,1 |
|
Diferencia respecto al placebo [IC del 95%] |
-1,4 [-1,6; -1,1]a |
-1,8 [-2,0; -1,5]a |
- |
|
Pacientes (%) que alcanzaron un valor de HbA1c < 7% |
61b |
79b |
11 |
|
Diferencia (razón de momios) respecto al placebo [IC del 95%] |
14,7 [7,43; 29,02] |
34,3 [16,59; 70,83] |
|
|
Peso corporal (kg) |
|||
|
Valor basal (media) |
92,7 |
92,5 |
89,9 |
|
Cambio desde la basal en la Semana 30 |
-3,7 |
-6,4 |
-1,4 |
|
Diferencia respecto al placebo [IC del 95%] |
-2,3 [-3,3; -1,3]a |
-5,1 [-6,1; -4,0]a |
- |
a p <0,0001 (bilateral) para superioridad, ajustado con relación a la multiplicidad en función de la prueba jerárquica del valor de HbA1c y el peso corporal
b p <0,0001 para diferencia en el tratamiento, no ajustado con relación a la multiplicidad
SUSTAIN FORTE: OZEMPIC® 2 mg frente a OZEMPIC® 1 mg.
En un estudio doble ciego de 40 semanas, se aleatorizaron 961 pacientes con un control insuficiente con metformina o sin sulfonilurea, para recibir tratamiento con OZEMPIC® 1 mg una vez a la semana u OZEMPIC® 2 mg una vez a la semana.
El tratamiento con OZEMPIC® 2 mg generó reducciones estadísticamente superiores en el valor de la HbA1c en comparación con OZEMPIC® 1 mg después de 40 semanas de tratamiento.
Tabla 9. SUSTAIN FORTE: Resultados tras 40 semanas de tratamiento con OZEMPIC® 2 mg con metformina con o sin SU
|
OZEMPIC® 1 mg |
OZEMPIC® 2 mg |
|
|---|---|---|
|
Población (N) con intención de tratar (IDT) |
481 |
480 |
|
Valor de HbA1c (%) |
||
|
Valor basal (media) |
8,8 |
8,9 |
|
Cambio desde la basal en la Semana 40 |
-1,9 o -2,0 |
-2,2 |
|
Diferencia con OZEMPIC® 1 mg [IC del 95%] |
- |
-0,2 [-0,4; -0,1]a |
|
Pacientes (%) que alcanzaron valores de HbA1c < 7% |
58b |
68b |
|
Peso corporal (kg) |
||
|
Valor basal (media) |
98,6 |
100,1 |
|
Cambio desde la basal en la Semana 40 |
-6,0 |
-6,9 |
|
Diferencia con OZEMPIC® 1 mg [IC del 95%] |
-0,9 [-1,7; -0,2]e |
|
a p <0,001 (bilateral) para superioridad, ajustado con relación a la multiplicidad en función de la prueba jerárquica del valor de HbA1c y el peso corporal
b p <0,0001 para diferencia en el tratamiento, no ajustado por multiplicidad
c p < 0,05 (bilateral) para superioridad, ajustado con relación a la multiplicidad en función de la prueba jerárquica del valor de la HbA1c y el peso corporal
SUSTAIN 11: Semaglutida en comparación con insulina aspártica (IAsp) como complemento en pacientes que logran un control glucémico insuficiente con insulina basal, insulina glargina y metformina.
En un ensayo sin enmascaramiento de 52 semanas, 1748 pacientes cuya diabetes mellitus tipo 2 estaba insuficientemente controlada después de una fase de preinclusión de 12 semanas con insulina glargina y metformina, fueron aleatorizados en una proporción 1:1 a semaglutida una vez a la semana (0,5 mg o 1,0 mg) o a IAsp tres veces al día en las comidas principales. La duración promedio de la diabetes en la población del estudio fue de 13,4 años y el valor medio de HbA1c fue de 8,6%. El valor de HbA1c estuvo en el rango del 6,5-7,5%.
El tratamiento con semaglutida no fue inferior al tratamiento con IAsp. La diferencia media (semaglutida – IAsp) en la reducción de la HbA1c [IC del 95%] en la Semana 52 fue de -0,29 [-0,38; -0,20]. La reducción de la HbA1c en la Semana 52 fue 1,5% para la semaglutida frente a - 1,2% para la IAsp, es decir, el efecto reductor de glucosa de la semaglutida fue cuantitativamente mayor que el de la IAsp). La cantidad de episodios hipoglucémicos graves fue baja en ambos grupos de tratamiento y cuantitativamente más baja con semaglutida (4 episodios) que en el grupo de IAsp (7 episodios; HR [IC del 95%]: 0,6 [0,2; 2,2]).
El tratamiento con semaglutida redujo el peso corporal medio hasta la semana 52 en 4,1 kg, mientras que aumentó en 2,8 kg con IAsp (diferencia estimada entre tratamientos [IC del 95%] a favor de la semaglutida: -6,99 kg [-7,41, 6,57]).
Combinación con monoterapia de sulfonilurea:
En SUSTAIN 6 (ver a continuación) se evaluó un subgrupo que recibió monoterapia con sulfonilurea en la Semana 30. En la evaluación basal, 123 pacientes recibieron monoterapia con sulfonilurea. El valor de HbA1c en la evaluación basal fue 8,2%, 8,4% y 8,4% para OZEMPIC® 0,5 mg, OZEMPIC® 1 mg y placebo, respectivamente. En la Semana 30, el cambio en el valor de HbA1c fue -1,6%, -1,5% y 0,1% para OZEMPIC® 0,5 mg, OZEMPIC® 1 mg y placebo, respectivamente.
Combinación con insulina premezclada ± 1–2 ADO:
En SUSTAIN 6 (ver a continuación), se evaluó un subgrupo que recibió una insulina premezclada (con o sin 2 ADO) en la Semana 30. En la evaluación basal, 867 pacientes recibieron una insulina premezclada. El valor de HbA1c en la evaluación basal fue 8.8%, 8,9% y 8,9% para OZEMPIC® 0,5 mg, OZEMPIC® 1 mg y placebo, respectivamente. En la Semana 30, el cambio en el valor HbA1c fue -1,3%, -1,8% y 0,4% para OZEMPIC® 0,5 mg, OZEMPIC® 1 mg y placebo, respectivamente.
Seguridad cardiovascular:
SUSTAIN 6 es un ensayo clínico aleatorizado, doble ciego en el que se comparó la seguridad cardiovascular de semaglutida 0,5 mg y semaglutida 1 mg una vez a la semana con la de placebo en 3297 pacientes con diabetes mellitus tipo 2. El estudio inscribió 2735 (83%) pacientes con enfermedad cardiovascular preexistente y 562 (17%) pacientes con un alto riesgo de eventos cardiovasculares. Tanto semaglutida como placebo se administraron además de la terapia antidiabética preexistente. El periodo de observación fue 2 años.
El criterio de valoración primario fue el tiempo desde la aleatorización a la primera aparición de un evento cardiovascular adverso grave (ECAG). Un ECAG se definió como la aparición de uno de los tres componentes: “muerte cardiovascular”, “infarto al miocardio no fatal” o “accidente cerebrovascular no fatal”. El criterio de valoración secundario fue el tiempo desde la aleatorización a la primera aparición de un criterio de valoración de ECAG extendido. Este criterio de valoración extendido incluyó revascularizaciones coronarias o periféricas adicionales, angina de pecho inestable que requiere hospitalización u hospitalización debido a insuficiencia cardiaca. El estudio se diseñó como un estudio de no inferioridad. El criterio para la decisión de no inferioridad fue el límite superior de 1,8 del intervalo de confianza de 95% para el cociente de riesgo de ECAG.
El número total de criterios de valoración primarios de ECAG fue 254, incluidos 108 (6,6%) con semaglutida y 146 (8,9%) con placebo. Se confirmó la seguridad cardiovascular de semaglutida en comparación con placebo (Figuras 2 y 3).
Figura 2. Gráfica de Kaplan-Meier del tiempo hasta la primera aparición del criterio de valoración compuesto: muerte cardiovascular, infarto al miocardio no fatal o accidente cerebrovascular no fatal (SUSTAIN 6)
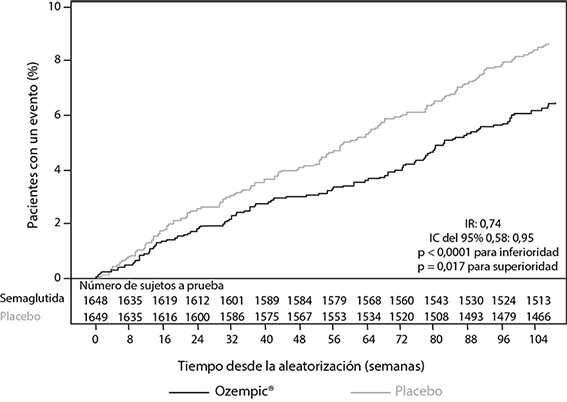
Figura 3. Diagrama de bosque: análisis de los tipos individuales de eventos cardiovasculares (SUSTAIN 6)

La diferencia del valor de HbA1c en la Semana 104 en comparación con la basal de semaglutida 0,5 mg fue de -1,1% vs -0,4% para placebo, y de -1,4% para semaglutida 1 mg vs 0,4 para placebo.
Farmacocinética:
Absorción:
La concentración máxima se alcanzó 1 a 3 días después de la inyección. La exposición en estado estacionario se alcanzó después de 4 a 5 semanas de una administración una vez a la semana. Con base en los análisis farmacocinéticos poblacionales con datos de pacientes con diabetes mellitus tipo 2, las concentraciones medias en estado estacionario tras la administración subcutánea de 0,5 mg y 1 mg de semaglutida fueron aproximadamente 16 nmol/L y 30 nmol/L, respectivamente.
En el estudio que comparó 1 mg y 2 mg de semaglutida, las concentraciones medias en estado estacionario fueron de 27 nmol/L y 54 nmol/L.
La exposición a semaglutida incrementó de manera proporcional para las dosis de 0,5 mg y 1 mg. Se alcanzó una exposición similar con la administración subcutánea de semaglutida en el abdomen, muslo o parte superior del brazo. La biodisponibilidad absoluta tras la administración subcutánea de semaglutida fue 89%.
Distribución:
La media del volumen de distribución tras la administración intravenosa de semaglutida en pacientes con diabetes mellitus tipo 2 fue alrededor de 12,5 litros. Semaglutida se unió extensivamente a la albúmina plasmática (> 99%).
Metabolismo:
Semaglutida se metaboliza por ruptura proteolítica del esqueleto proteico y beta-oxidación secuencial de las cadenas laterales de ácidos grasos. El metabolito plasmático más frecuente constituyó < 8% de la exposición entera y se identificó como semaglutida con un truncamiento de los primeros 13 aminoácidos del N-terminal.
Eliminación:
Las vías de excreción primarias del material relacionado a semaglutida fueron a través de la orina y las heces. Aproximadamente 3% de la dosis se excretó como semaglutida intacta vía orina. En pacientes con diabetes mellitus tipo 2, la eliminación de semaglutida fue alrededor de 0,05 L/h. Con una vida media de eliminación de alrededor de 1 semana, semaglutida estará presente en la circulación por hasta 5 semanas después de la última dosis.
Cinética en grupos de pacientes específicos:
La siguiente información relativa a la edad, el género, la raza y el peso corporal se basa en el análisis farmacocinético poblacional de los datos de estudios de fase 3a.
Deterioro hepático:
El deterioro hepático no tuvo ningún impacto sobre la exposición de semaglutida. La farmacocinética de semaglutida se evaluó en pacientes con diferentes grados de deterioro hepático (leve, moderado, grave) en comparación con sujetos con una función hepática normal en un estudio con una dosis única de 0,5 mg de semaglutida.
Deterioro renal:
El deterioro renal no tuvo un impacto clínicamente significativo sobre la farmacocinética de semaglutida, aunque la Cmáx disminuyó y se presentó más tarde en los pacientes con una mayor insuficiencia renal. Esto se demostró con una dosis única de 0,5 mg de semaglutida para pacientes con diferentes grados de deterioro renal (leve, moderado, grave o pacientes que requieren diálisis) en comparación con sujetos con función renal normal. Esto también se demostró para los sujetos con diabetes mellitus tipo 2 y con deterioro renal con base en los datos de estudios de fase 3a (Análisis farmacocinético poblacional).
Pacientes de edad avanzada:
La edad no tiene ningún efecto sobre la farmacocinética de semaglutida en pacientes de 20 a 86 edad.
Niños y adolescentes:
Semaglutida no se ha estudiado en niños y adolescentes.
Género y raza:
El género y la raza no tuvieron ningún efecto sobre la farmacocinética de semaglutida.
CONTRAINDICACIONES:
Hipersensibilidad a la sustancia activa o a cualquiera de los excipientes enlistados en la sección Composición.
PRECAUCIONES Y ADVERTENCIAS:
Advertencias y precauciones:
OZEMPIC® no debe utilizarse en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
Efectos gastrointestinales:
El uso de agonistas del receptor de GLP-1 puede asociarse a efectos gastrointestinales no deseados. Esto debe considerarse al tratar pacientes con insuficiencia renal debido a que las náuseas, los vómitos y la diarrea pueden provocar deshidratación, lo que puede causar el deterioro de la función renal.
Pancreatitis aguda:
Se ha observado pancreatitis aguda con el uso de agonistas del receptor de GLP-1. Se debe informar a los pacientes sobre los síntomas característicos de la pancreatitis aguda. Si se sospecha pancreatitis, se debe interrumpir OZEMPIC®; si se confirma la pancreatitis aguda, no se debe reiniciar OZEMPIC®. Los pacientes con una historia de pancreatitis no fueron tratados con semaglutida en los estudios clínicos. Se debe tener precaución con estos pacientes. Al menos que se presenten otros signos o síntomas de pancreatitis aguda, un incremento aislado de enzimas pancreáticas no indica necesariamente una pancreatitis aguda.
Hipoglucemia:
Los pacientes tratados con OZEMPIC® en combinación con una sulfonilurea o insulina pueden tener un mayor riesgo de hipoglucemia. El riesgo de hipoglucemia se puede disminuir reduciendo la dosis de sulfonilurea o insulina al iniciar el tratamiento con OZEMPIC®.
Riesgo de tumores de células C de la tiroides:
Estudios preclínicos con agonistas del receptor de GLP-1 en roedores indican que los agonistas del receptor de GLP-1 pueden estar asociados con un mayor riesgo de hiperplasia focal de células C y tumores de células C de la tiroides (consulte la sección Datos preclínicos).
Se desconoce si existe una conexión en humanos entre los agonistas del receptor de GLP-1 y los tumores de células C de tiroides, incluyendo carcinoma medular de tiroides (CMT). Los pacientes con CMT y los pacientes con antecedentes de síndrome de neoplasia endocrina múltiple tipo 2 (MEN 2) no fueron tratados con semaglutida en los estudios clínicos. Por lo tanto, se necesita una evaluación cuidadosa del riesgo/beneficio antes del tratamiento con OZEMPIC® en este grupo específico. No se ha establecido el valor clínico del monitoreo de rutina del nivel de calcitonina sérica.
Retinopatía diabética:
En un amplio estudio de seguridad cardiovascular se observó un aumento del riesgo: complicaciones por retinopatía diabética con el tratamiento con semaglutida en comparación con el tratamiento estándar (50 [3,0%] versus 29 [1,8%]). Los pacientes que se vieron afectados principalmente (> 80% de los casos) fueron aquellos que ya habían presentado retinopatía diabética al inicio del tratamiento; un factor de riesgo adicional fue el uso concomitante de insulina (consulte Efectos no deseados). Semaglutida sólo debe usarse en estos pacientes de alto riesgo bajo el monitoreo cercano de un oftalmólogo. Una corrección excesivamente rápida de la hiperglucemia crónica puede estar asociada con un empeoramiento inicial de la retinopatía diabética, aunque la mejoría a largo plazo del control glucémico reduce el riesgo de retinopatía diabética. Por lo tanto, se debe considerar una reducción de la dosis de insulina al inicio del tratamiento con semaglutida además de insulina.
Efectos gastrointestinales (no deseados):
Se han notificado lesiones renales agudas y empeoramiento de la insuficiencia renal crónica, que a veces requieren hemodiálisis, en pacientes tratados con agonistas del receptor GLP-1 después de la comercialización. Algunos de estos eventos se han informado en pacientes sin enfermedad renal subyacente conocida. La mayoría de los eventos informados ocurrieron en pacientes que ya experimentaban náuseas, vómitos, diarrea o deshidratación. Se debe controlar la función renal al iniciar o aumentar la titulación del tratamiento con OZEMPIC® en pacientes que notifiquen reacciones adversas gastrointestinales graves.
Excipientes:
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, por lo que es prácticamente “libre de sodio”.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo/lactancia:
Embarazo:
Estudios en animales han demostrado toxicidad reproductiva (consulte Datos preclínicos). Existen datos limitados relativos al uso de semaglutida en mujeres embarazadas. Por ende, semaglutida no debe utilizarse durante el embarazo. Se recomienda que las mujeres en edad fértil utilicen anticonceptivos al recibir tratamiento con semaglutida. Si una paciente desea embarazarse o se presenta un embarazo, se debe interrumpir el tratamiento con semaglutida. El tratamiento con semaglutida se debe interrumpir por lo menos 2 meses antes de un embarazo planeado debido a su larga vida media (consulte Farmacocinética).
Lactancia:
Semaglutida pasa en la leche de ratas lactantes. Debido a que no se puede excluir un riesgo para un lactante, semaglutida no debe utilizarse durante la lactancia.
Fertilidad:
Se desconoce el efecto de semaglutida sobre la fertilidad humana. Semaglutida no afectó la fertilidad de ratas macho. En ratas hembra, se observó un ciclo más largo y una ligera disminución en el número de ovulaciones a las dosis asociadas con la pérdida de peso materna.
EFECTO EN LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS:
Efectos sobre la capacidad para conducir vehículos y operar maquinaria:
OZEMPIC® no tiene o posee una influencia insignificante sobre la capacidad para conducir o utilizar maquinaria. Al utilizarse en combinación con sulfonilureas o insulina, se debe recomendar a los pacientes que tomen precauciones para evitar hipoglucemia al conducir y utilizar maquinaria (consulte Advertencias y precauciones).
REACCIONES ADVERSAS:
Efectos no deseados:
Resumen del perfil de seguridad:
En ocho estudios clínicos, 4792 pacientes recibieron OZEMPIC® solo o en combinación con otros medicamentos reductores de glucosa sanguínea. La duración del tratamiento varió de 30 semanas hasta 2 años.
Los efectos no deseados que se notificaron con más frecuencia en los estudios clínicos fueron trastornos gastrointestinales, incluidas náuseas, diarrea y vómito. En general, estos efectos fueron leves a moderados y con una duración corta.
En un estudio de fase 3b de 40 semanas de duración, 959 pacientes recibieron 1 mg o 2 mg de semaglutida. El perfil de seguridad de 2 mg de semaglutida fue coherente con el perfil de seguridad de semaglutida observado en los estudios de fase 3a. La frecuencia de trastornos gastrointestinales con 2 mg de semaglutida solo fue ligeramente elevada en comparación con 1 mg de semaglutida (34,0% frente a 30,8%).
Listado tabular de reacciones adversas:
La Tabla 1 enlista los efectos no deseados notificados en los estudios clínicos para pacientes con diabetes mellitus tipo 2 en ensayos clínicos de fase 3 (incluido el estudio a largo plazo con criterios de valoración cardiovasculares) y los informes poscomercialización (para más información, consulte Propiedades/Efectos). Las frecuencias de los efectos no deseados (excepto las complicaciones de retinopatía diabética, para las cuales puede consultar la nota al pie de la Tabla 1) se basan en datos agrupados de ensayos clínicos, excluye los estudios de resultados cardiovasculares.
Lista de efectos no deseados:
Los efectos no deseados se enlistan a continuación según la clasificación por órganos y sistemas y la frecuencia. Las frecuencias se definen de la siguiente manera: muy común (≥ 1/10); común (≥ 1/100, < 1/10); poco común (≥ 1/1000, < 1/100); raro (≥ 1/10 000, < 1/1000); muy raro (< 1/10 000) no conocida (no puede estimarse a partir de datos disponibles)
Tabla 1. Frecuencia de efectos no deseados de OZEMPIC®
|
Clasificación por órgano y sistemas según MedDRA |
Frecuencia |
Efecto no deseado |
|---|---|---|
|
Trastornos del sistema inmune |
Poco común |
Hipersensibilidad |
|
Raro |
Reacción anafiláctica |
|
|
Trastornos del metabolismo y la nutrición |
Muy común |
Hipoglucemiaa al utilizarse con insulina o sulfonilureas |
|
Común |
Hipoglucemiaa al utilizarse con otros antidiabéticos orales (ADO) Disminución del apetito |
|
|
Trastornos del sistema nervioso |
Común |
Mareo |
|
Poco común |
Disgeusia |
|
|
Trastornos oculares |
Común |
Complicaciones de retinopatía diabéticab |
|
Trastornos cardíacos |
Poco común |
Frecuencia cardíaca elevada |
|
Trastornos gastrointestinales |
Muy común |
Náusea Diarrea |
|
Común |
Vómito Dolor abdominal Distensión abdominal Estreñimiento Dispepsia Gastritis Enfermedad de reflujo gastroesofágico Eructos Flatulencias |
|
|
Poco común |
Pancreatitis aguda |
|
|
Retraso en el vaciado gástrico |
||
|
Trastornos hepatobiliares |
Común |
Colelitiasis |
|
Poco común |
Colecistitis |
|
|
Trastornos de la piel y del tejido subcutáneo |
No conocida |
Angioedemac |
|
Trastornos generales y afecciones en el sitio de administración |
Común |
Fatiga |
|
Poco común |
Reacciones en el sitio de la inyección |
|
|
Exploraciones complementarias |
Común |
Lipasa elevada Amilasa elevada Pérdida de peso |
a) Hipoglucemia definida como grave (que requiere la asistencia de otra persona) o sintomática, en combinación con un nivel de glucosa sanguínea < 3,1 mmol/L.
b) Las complicaciones de retinopatía diabética incluyen: necesidad de fotocoagulación retiniana y tratamiento con agentes intravítreos, hemorragia vítrea, inicio de ceguera relacionada con la diabetes. Frecuencia basada en el estudio de resultados cardiovasculares.
c) A partir de informes posteriores a la comercialización.
Estudio de resultados cardiovasculares y de seguridad de 2 años:
En la población con riesgo cardiovascular, el perfil de reacciones adversas fue similar al observado en otros estudios clínicos (descrito en Propiedades y efectos).
Descripción de efectos no deseados seleccionados:
Trastornos del metabolismo y de la nutrición:
• Muy común: hipoglucemia al utilizarse con insulina (10,7%) o sulfonilureas (10,4%)
• Común: hipoglucemia al utilizarse con otros ADO
No se observaron episodios de hipoglucemia grave al utilizar OZEMPIC® como monoterapia. Se observó principalmente hipoglucemia grave cuando se utilizó OZEMPIC® con una sulfonilurea (1,2% de los sujetos, 0,03 eventos/años-paciente) o insulina (1,5% de los sujetos, 0,02 eventos/años-paciente). Se observaron pocos episodios (0,1% de los sujetos, 0,001 eventos/años-paciente) al utilizar OZEMPIC® en combinación con otros ADO además de sulfonilurea.
Trastornos oculares:
Común-Complicaciones de retinopatía diabética:
Las complicaciones de retinopatía diabética fueron un criterio de valoración en un estudio clínico de 2 años con 3297 pacientes con diabetes mellitus tipo 2 y alto riesgo cardiovascular. En este estudio, las complicaciones de retinopatía diabética se presentaron con más frecuencia en pacientes que recibieron tratamiento con OZEMPIC® (3,0%) que con placebo (1,8%). Más de 80% de los pacientes con una complicación de retinopatía diabética tuvieron retinopatía diabética documentada antes del inicio del tratamiento. En pacientes que no tuvieron retinopatía diabética (documentada) en su historia médica, el número de eventos bajo OZEMPIC® y placebo fue similar.
En estudios clínicos con una duración de hasta 1 año que incluyeron 4807 pacientes con diabetes mellitus tipo 2, se presentaron efectos no deseados relacionados a retinopatía diabética en 1,7% de los pacientes que recibieron OZEMPIC® y en 2.0% de los pacientes que recibieron productos comparadores.
Trastornos gastrointestinales:
• Muy común: náuseas (19,9%), diarrea (13,3%)
• Comunes: vómitos, dolor abdominal, sensación de distensión abdominal, estreñimiento, dispepsia, gastritis, enfermedad de reflujo gastroesofágico, eructos, flatulencias
En pacientes que recibieron tratamiento con OZEMPIC® 0,5 mg y 1 mg, se presentaron náuseas en 17.0% y 19,9%, diarrea en 12,2% y 13,3% y vómito en 6,4% y 8,4%, respectivamente. La mayoría de estos eventos fueron leves a moderados y con corta duración. En 3,9% y 5% de los pacientes, los eventos resultaron en la interrupción del tratamiento. Los eventos se notificaron con más frecuencia en los meses iniciales del tratamiento.
• Poco común: pancreatitis aguda
La frecuencia de casos confirmados de pancreatitis aguda notificados en estudios clínicos de fase 3a fue de 0,3% con semaglutida y de 0,2% con el referente de comparación. En el estudio de 2 años sobre criterios de valoración cardiovasculares, la frecuencia de casos confirmados de pancreatitis fue de 0,5% con semaglutida y de 0,6% con el placebo (consulte Advertencias y precauciones especiales).
• Poco común: hipersensibilidad
En los estudios clínicos de fase 3a, se notificaron acontecimientos de hipersensibilidad (p. ej., urticaria, erupción cutánea) en el 0,3% de los pacientes que recibieron semaglutida, que el investigador consideró que estaban relacionados causalmente con el tratamiento.
Efectos adversos posteriores a la comercialización:
Trastornos renales y del tracto urinario: Daño renal agudo (consulte la sección Advertencias y precauciones).
Interrupción del tratamiento debido a una reacción adversa:
La incidencia de interrupciones de tratamiento debido a efectos no deseados fue de 8,7% para los pacientes que recibieron tratamiento con OZEMPIC® 1 mg. Los efectos adversos más frecuentes fueron trastornos gastrointestinales.
Es muy importante notificar una sospecha de reacción adversa después de la autorización de comercialización. Permite la supervisión continua de la relación riesgo-beneficio del medicamento. Se les solicita a los profesionales de salud que notifiquen cualquier sospecha de una reacción adversa seria o nueva a través del correo io-balat-clat-safety@novonordisk.com
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones:
Datos in vivo: El vaciado gástrico retardado causado por semaglutida puede influir sobre la absorción de los medicamentos orales coadministrados. El efecto potencial de semaglutida sobre la absorción de los medicamentos orales coadministrados que se enumeran a continuación, se investigó en estudios con 1 mg de semaglutida en estado estacionario. No se observaron interacciones farmacológicas clínicamente relevantes entre semaglutida y los medicamentos evaluados. Por consiguiente, no se requiere ningún ajuste de la dosis para la coadministración con semaglutida.
Anticonceptivos orales: No se anticipa que semaglutida disminuya el efecto de los anticonceptivos orales dado que semaglutida no cambió la exposición general de etinilestradiol y levonorgestrel a un grado clínicamente relevante cuando se coadministró un anticonceptivo oral (medicamento combinado que consiste en 0,03 mg de etinilestradiol/0,15 mg de levonorgestrel) con semaglutida. No se vio afectada la exposición de etinilestradiol. Se observó un incremento del 20% para la exposición a levonorgestrel en estado estacionario. La Cmáx no se vio afectada para ninguno de los compuestos.
Atorvastatina:
Semaglutida no cambió la exposición general de atorvastatina tras una administración de dosis única de atorvastatina (40 mg). Con semaglutida, la Cmáx de atorvastatina se redujo en un 38%. Esto se evaluó como clínicamente no relevante.
Digoxina:
Semaglutida no cambió la exposición general o la Cmáx de digoxina tras una dosis única de digoxina (0,5 mg).
Metformina:
Semaglutida no cambió la exposición general o la Cmáx de metformina tras la administración de 500 mg de metformina dos veces al día por 3,5 días.
Warfarina:
Semaglutida no cambió la exposición general o la Cmáx de warfarina R y S tras una dosis única de warfarina (25 mg). No se determinó un efecto clínicamente relevante sobre los efectos farmacodinámicos de warfarina de acuerdo con las medidas de la Relación Normalizada Internacional (INR).
Estudios in vitro:
Estudios in vitro han demostrado que semaglutida posee un potencial muy bajo para inhibir o inducir las enzimas del CYP e inhibir los transportadores de sustancias activas.
HALLAZGOS DE LABORATORIO CLÍNICO:
Datos preclínicos:
Los datos preclínicos no revelan ningún riesgo especial para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad de las dosis repetidas o genotoxicidad.
Carcinogenicidad:
Los tumores de células C de tiroides no letales observados en roedores son un efecto de clase para los agonistas del receptor de GLP-1. Los tumores de células C de tiroides aparecieron en exposiciones clínicamente relevantes en ratas y ratones en estudios de carcinogenia de 2 años. Los tumores de células C en roedores son causados por un mecanismo mediado por el receptor de GLP-1 específico no genotóxico al cual los roedores son particularmente sensibles. La relevancia para humanos es probablemente baja, pero no puede excluirse por completo.
Toxicidad reproductiva:
Semaglutida no afectó de forma negativa el desempeño en el apareamiento o en la fertilidad de machos en los estudios de fertilidad en ratas. En ratas hembra, se observó un mayor ciclo y una ligera reducción en los cuerpos lúteos (ovulaciones) con dosis que se asociaron con pérdida de peso corporal materno.
En estudios del desarrollo embriofetal en ratas, semaglutida causó embriotoxicidad por debajo de las exposiciones clínicamente relevantes. Semaglutida causó reducciones notorias en el peso corporal materno y reducciones en la supervivencia y el crecimiento embrionario. En los fetos, se observaron malformaciones esqueléticas y viscerales mayores, incluidos efectos sobre los huesos largos, las costillas, las vértebras, la cola, los vasos sanguíneos y los ventrículos cerebrales. Las evaluaciones mecanicistas indicaron que la embriotoxicidad fue causada por una insuficiencia mediada por el receptor de GLP-1 del suministro de nutrientes a los embriones a través del saco vitelino de las ratas. Debido a las diferencias de las especies en la anatomía y función del saco vitelino, y debido a la falta de expresión del receptor de GLP-1 en el saco vitelino de primates no humanos, se consideró poco probable que el mecanismo mediado por el receptor de GLP-1 sea de relevancia para humanos.
En estudios de toxicidad del desarrollo en conejos y monos cynomolgus se observó un incremento en la pérdida de embarazos y un incremento ligero sobre la incidencia de anormalidades fetales con exposiciones clínicamente relevantes.
Los hallazgos se correlacionaron con una pérdida de peso corporal materna notoria de hasta 16%. Se desconoce si estos efectos están relacionados a un menor consumo materno de alimentos como efecto directo de GLP-1.
Se evaluaron el crecimiento y desarrollo posnatal en monos cynomolgus. Los lactantes fueron ligeramente más pequeños al momento del parto, pero se recuperaron durante el periodo de lactancia.
En ratas jóvenes, semaglutida causó un retraso en la maduración sexual tanto en machos como en hembras. Estos retrasos no tuvieron impacto sobre la fertilidad y la capacidad reproductiva de ningún sexo o sobre la capacidad de las hembras para mantener el embarazo.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología/uso:
Inicio del tratamiento: La dosis inicial de OZEMPIC® es de 0,25 mg una vez a la semana. Después de 4 semanas, la dosis debe incrementarse a 0,5 mg una vez a la semana. Después de por lo menos 4 semanas adicionales con una dosis de 0,5 mg una vez a la semana, la dosis puede incrementarse a 1 mg una vez a la semana para mejorar el control glucémico. Después de al menos 4 semanas con una dosis de 1 mg una vez a la semana, la dosis se puede aumentar a 2 mg una vez a la semana.
Tratamiento combinado: Al añadir OZEMPIC® a una terapia existente con metformina y/o tiazolidinediona o un inhibidor de SGLT2 (inhibidor del cotransportador de sodio-glucosa tipo 2), la dosis existente de metformina y/o tiazolidinediona o un inhibidor de SGLT2 se puede continuar sin cambios. Al añadir OZEMPIC® a una terapia existente con sulfonilurea o insulina, se debe considerar una reducción en la dosis de sulfonilurea o de insulina para disminuir el riesgo de hipoglucemia. En tal caso, también se debe tener en cuenta que una mejora excesivamente rápida del control glucémico puede resultar en un empeoramiento temporal de la retinopatía diabética (consulte Advertencias y precauciones).
Instrucciones especiales de dosificación:
Pacientes con insuficiencia hepática: No se requiere ajuste de dosis en pacientes con insuficiencia hepática.
Pacientes con insuficiencia renal: No se requiere ajuste de dosis en pacientes con insuficiencia renal.
Pacientes de edad avanzada (≥ 65 años): No se requiere ajuste de dosis en pacientes de edad avanzada.
Niños y adolescentes: No se ha investigado la seguridad y eficacia de OZEMPIC® en niños y adolescentes menores de 18 años.
Dosis olvidada:
Si se omite una dosis, se debe administrar tan pronto como sea posible, y dentro de los 5 días posteriores a la dosis omitida. Si han transcurrido más de 5 días, no debe administrarse la dosis omitida. La siguiente dosis debe administrarse en el día programado. Para más información sobre la administración, consulte Otra información.
Método de administración:
• OZEMPIC® se administra una vez a la semana, a cualquier hora del día, con o sin alimentos.
• OZEMPIC® se inyecta por vía subcutánea en el abdomen, muslo o parte superior del brazo. El sitio de inyección puede cambiarse sin ajustar la dosis. OZEMPIC® no debe administrarse por vía intravenosa o intramuscular.
El día de la administración semanal puede cambiar de ser necesario, siempre y cuando existan por lo menos 2 días (> 48 horas) entre las dos dosis.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis:
Se han notificado sobredosis de hasta 4 mg en una dosis única y de hasta 4 mg por semana en estudios clínicos. La reacción adversa notificada con más frecuencia fue la náusea. Todos los pacientes se recuperaron sin complicaciones.
No existe antídoto específico para una sobredosis con OZEMPIC®. En caso de sobredosis, se debe iniciar un tratamiento de soporte apropiado de acuerdo con los signos y síntomas clínicos del paciente. En vista de la larga vida media de OZEMPIC® de aproximadamente 1 semana, es posible que se necesite un período prolongado de observación y tratamiento de estos síntomas (consulte Farmacocinética).
INFORMACIÓN COMPLEMENTARIA:
Otra información:
Incompatibilidades:
Dado que no se han realizado estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Vida útil: 36 meses.
Este medicamento no debe usarse después de la fecha de vencimiento (CADUCA) que aparece en el empaque.
Vida útil después de la apertura:
Estable durante 6 semanas después de su apertura.
Instrucciones especiales de almacenamiento:
• Antes de abrir: Almacenar en un refrigerador (2 - 8°C). No congelar. Proteger de la luz.
• Después de abrir: Almacenar a menos de 30°C o en un refrigerador (2 - 8°C). No congelar.
Cuando no esté utilizando la pluma de OZEMPIC®, mantenga la pluma con la tapa puesta para protegerla de la luz.
OZEMPIC® debe protegerse del calor y la luz excesivos.
Retire la aguja después de cada inyección y almacene la pluma OZEMPIC® sin la aguja.
Mantener fuera del alcance de los niños.
Instrucciones de manejo:
Se debe aconsejar al paciente que deseche la aguja después de cada inyección y almacene la pluma de OZEMPIC® sin la aguja colocada. Esto evita agujas obstruidas, contaminación, infección, fuga de solución y una dosificación inexacta. Las agujas y otros materiales de desecho deben desecharse de acuerdo con los requisitos locales.
La pluma de OZEMPIC® es para uso exclusivo de una persona. OZEMPIC® no debe utilizarse si no tiene un aspecto claro e incoloro.
OZEMPIC® puede inyectarse con agujas de una longitud de hasta 8 mm. La pluma se ha diseñado para utilizarse con las agujas desechables NovoFine® o NovoTwist®.
PRESENTACIÓN:
Empaques:
Existen tres variedades de plumas precargadas de OZEMPIC®:
OZEMPIC® DualDose, solución inyectable en una pluma precargada:
• La solución inyectable de OZEMPIC® DualDose en la pluma precargada permite que se dispensen dosis de 0,25 mg o 0,5 mg. Esta pluma está diseñada para el escalamiento de la dosis y terapia de mantenimiento en la dosis de 0,5 mg.
Empaque con una pluma precargada con 6 agujas desechables de NovoFine® Plus (B)
OZEMPIC® FixDose 1 mg, solución inyectable en una pluma precargada:
• La solución inyectable de OZEMPIC® FixDose 1 mg/dosis en una pluma precargada de 3 mL permite solo la administración de dosis de 1 mg. Esta pluma solo se debe utilizar como parte del tratamiento de mantenimiento con la dosis de 1 mg.
Empaque con una pluma precargada con 4 agujas desechables de NovoFine® Plus (B)
OZEMPIC® FixDose 2 mg, solución inyectable en pluma precargada:
• La solución inyectable de OZEMPIC® 2 mg/dosis en una pluma precargada de 3 mL permite solo la administración de dosis de 2 mg. Esta pluma solo se debe utilizar como parte del tratamiento de mantenimiento con la dosis de 2 mg. La pluma contiene 3 mL de solución.
Empaque de 1 pluma precargada con 4 agujas desechables NovoFine® Plus (B)
Fecha de revisión del texto
Diciembre 2023