
PARIET
RABEPRAZOL
Comprimidos
Paquete,14 Comprimidos,10 mg
Paquete,100 Comprimidos,10 mg
Paquete,100 Comprimidos,20 mg
Paquete,100 Comprimidos,10 mg
Paquete,14 Comprimidos,10 mg
PSICOQUÍMICA:
Nombre genérico: Rabeprazole sódico.
Nombre químico: (±)-sodio 2 [[4-(3-metoxipropoxi)-3-metilpiridina-2-yl] metilsulfinil]-1H-benzimidazole.
Fórmula molecular: C18H20N3O3SNa
Peso molecular: 381,43
Fórmula estructural:
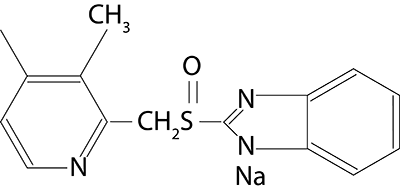
Descripción: Rabeprazole sódico ocurre como polvo blanco a blanco amarillento.
Es inodoro. Es muy soluble en agua y methanol, libremente soluble en etanol deshidratado y acetato de etil, y prácticamente insoluble en éter y hexano.
No presenta rotación óptica.
Es higroscópico.
Punto de fusión: 225°C (con descomposición).
Coeficiente de partición: alrededor de 214 (pH 7,0 sistema agua-octanol).
INDICACIONES: Úlcera gástrica, úlcera duodenal, úlcera estomacal, esofagitis de reflujo y síndrome de Zollinger-Ellison.
Precauciones: La administración de PARIET podrá ocultar síntomas de cáncer gástrico.
Por lo tanto, es necesario determinar que la úlcera no sea maligna antes de iniciar la administración de este producto.
EFICACIA CLÍNICA:
Efectos clínicos: Los resultados de pruebas clínicas de rotulación abierta y doble-ciego realizados con PARIET en casos de úlcera gástrica, úlcera del duodeno, esofagitis de reflujo y úlcera estomacal se resumen en la tabla siguiente:
|
Enfermedad |
Indice de curación |
|
Úlcera gástrica |
95,2% (401/421) |
|
Úlcera duodenal |
98,1% (364/371) |
|
Esofagitis de reflujo |
90,9% (50/55) |
|
Úlcera estomacal |
83,3% (10/12 |
El índice general de mejoría de 2 pacientes de síndrome de Zollinger-Ellison fue de 100%.
En estudio de farmacología clínica se ha demostrado que el aumento del pH gástrico fue mayor a dosis de 20 mg que a dosis de 10 mg. Se ha comprobado la utilidad del PARIET en el tratamiento de úlceras intratables usando una dosis de 20 mg una vez al día.
La utilidad clínica del PARIET en el tratamiento de las úlceras gástricas y duodenales ha sido demostrada en pruebas clínicas doble-ciegos1).
FARMACOLOGÍA:
Inhibición de H+-K+-ATPase (in vitro): Rabeprazole sódico inhibe fuertemente la H+-K+-ATPase preparada con mucosa gástrica de cerdo1), 3).
Inhibición de secreción ácida gástrica: Rabeprazole sódico inhibe la secreción de ácido gástrico estimulada por dibutil ciclo-AMP en glándulas gástricas aisladas de conejos (in vitro)4).
Rabeprazole sódico exhibió fuerte inhibición de la secreción ácida gátrica estimulada por histamina o pentagastrina en perros con fístula gástrica crónica así como la secreción ácida gástrica basal en la secreción ácida gástrica estimulada por histamina en ratas4), 5), 6).
La reversión de la actividad antisecretora es más rápida y el aumento en los niveles de gastrina sérica es menor con rabeprazole sódico que con otros inhibidores de la bomba de protón4), 7).
Acción antiúlcera: En ratas rabeprazole sódico ha demostrado una fuerte acción antiúlceras contra varias úlceras experimentales y una acción mejorada en lesiones experimentales de la mucosa gástrica (inducida por estrés antigripal, estrés de inmersión en agua, ligación pilórica, cisteamina o etanol-HCI)5), 8).
FARMACOCINÉTICA:
Concentraciones en la sangre: En la figura siguiente se muestra los cambios en el tiempo de la concentración media en el plasma del rabeprazole sódico administrado oralmente a varones voluntarios adultos a dosis de 20 mg en ayunas y después de comer. En la tabla se presentan los valores medios de parámetros farmacocinéticos determinados para sujetos individuales durante la administración de PARIET en ayunas y después de comer. El Tmáx se prolongó en 1.7 horas después de la administración, después de comer en comparación con la administración en ayunas y se observaron diferencias de absorción de un individuo a otro.
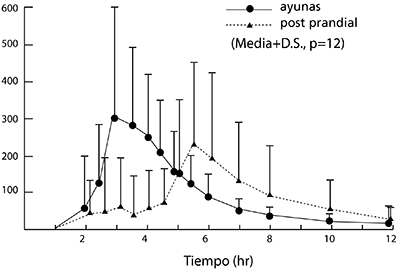
Concentración de rabeprazole sódico en el plasma tras administración oral de PARIET a dosis de 20 mg en ayunas o tras ingerir alimentos.
Efectos de alimentos en parámetros farmacocinéticos
|
Condiciones de administración |
Ayunas |
Después de comer |
|
Parámetro |
||
|
Cmáx (ng/mL) |
437 ± 237 |
453 ± 138 |
|
Tmáx (h) |
3,6 ± 0,9 |
5.3 ± 1,4 |
|
AUC (ng•h/mL) |
937 ± 617 |
901 ± 544 |
|
t½ (h) |
1,49 ± 0.68 |
1,07 ± 0,47 |
Media ± D.S., n = 12.
10 mg o 20 mg de rabeprazole sódico fueron administrados a varones voluntarios sanos en ayunas. En la tabla siguiente se presentan los valores medios de los parámetros farmacocinéticos.
Parámetros farmacocinéticos después de una sola administración oral de PARIET (varones voluntarios sanos a dosis de 20 mg.
|
Dosis |
Cmáx (ng/mL) |
Tmáx (h) |
AUC (ng•h/mL) |
t½ |
|
(h) |
||||
|
10 mg |
247 ± 24 |
3,8 ± 0,5 |
440 ± 24 |
0,85 ± 0,04 |
|
20 mg |
406 ± 64 |
3,1 ± 0,2 |
809 ± 186 |
1,02 ± 0,16 |
Media ± D.S., n = 6.
Excreción urinaria: La forma no metabolizada de la droga no fue detectada en la orina de 6 voluntarios adultos sanos durante hasta 72 horas después de la administración de una dosis oral de 20 mg de rabeprazole sódico y aproximadamente un 30% de la dosis fue excretada por la orina como metabolico de barboxilato en su conjugación con ácido glucónico.
PRECAUCIONES:
Administración cuidadosa (PARIET debe ser administrado cuidadosamente a los siguientes pacientes): Pacientes con historial de hipersensibilidad a la droga.
Pacientes de función hepática disminuida [Se han referido reacciones psiconeuróticas adversas en pacientes de cirrosis hepática (véase Reacciones adversas)].
Pacientes de edad avanzada (véase Uso en personas de edad).
Precauciones importantes: PARIET puede ser administrado a dosis de 20 mg una vez al día en casos de condiciones de morbidez severa y úlceras recurrentes e intratables.
REACCIONES ADVERSAS: Fueron reporta-das reacciones adversas en 22 de 1,244 pacientes (1,77%) y también fueron reportados análisis de laboratorio en 82 (6,59%) (a la fecha de aprobación).
Reacciones adversas clínicamente significativas (compuestos análogos):
Choque: Se ha reportado la ocurrencia rara de reacciones anafilácticas o choque con compuestos análogos (omeprazole y lansoprazole). Si se observa cualquier anomalía, debe suspenderse PARIET y darse tratamiento apropiado.
Hematología: Se ha reportado la ocurrencia rara de pancitopenia, trombocitopenia, agranulocitosis y anemia hemolílica, y la ocurrencia infrecuente de granulocitopenia y anemia con compuestos análogos (omeprazole y lansoprazole).
Si se observa cualquier anomalía, debe suspenderse PARIET y darse tratamiento apropiado.
Reacciones adversas clínicamente significativas (informes extranjeros):
Fuera de Japón se han reportado perturbaciones visuales con un compuesto análogo (omeprazole).
Otras reacciones adversas:
|
0.1% a < 5% |
0,1% |
|
|
Hipersensibilidad1 |
Erupción o urticaria |
Comezón |
|
Hematológicas2 |
Eritropenia, leucopenia, leucocitosis, eusinofilia, neutrofilia o linfopenia |
|
|
Hepáticas3 |
Elevaciones de GOT, GPT, AL-P y GTP, LDH o bilirubina total |
|
|
Cardiovascular |
Palpitaciones |
|
|
Gastrointestinal |
Estreñimiento, diarrea o sensación de abdomen alterado |
Náuseas, dolor bajo abdomen y sensación de pesadez estomacal |
|
Psiconeurológicas4 |
Dolor de cabeza |
Mareos, somnolencia, debilidad de las extremidades, hipoestesia, fuerza de agarre disminuida, movimiento disminuido lengua y aturdimiento |
|
Otras |
Edema, niveles elevados de colesterol total, triglicéridos y BUN o proteinuria |
Malestar |
|
1 En caso de producirse esos síntomas, debe suspenderse el PARIET. 2 Es aconsejable realizar análisis hematológicos periódicamente durante la administración del PARIET. Al observarse anomalías, deben tomarse medidas adecuadas, como suspender el PARIET. 3 Es aconsejable realizar análisis bioquímicos periódicamente duante la administración de PARIET. De observarme anomalías, deben tomarse medidas adecuadas, como suspender el medicamento. 4 Se han referido debilidad de las extremidades, hipoestesia, fuerza de agarre disminuida, movimientos mermados de la lengua y aturdimiento en un paciente de cirrosis hepática, y fuera de Japón se ha referido confusión, desorientación, y letargia en un paciente de cirrosis hepática con historial de encefalopatía hepática. |
||
Uso en las personas de edad: PARIET es metabolizado principalmente en el hígado. Dado que las personas de edad suelen tener hipofunción hepática fisiológica, es probable que experimenten reacciones adversas al medicamento. Por lo tanto, es aconsejable tomar medidas como un intervalo de descanso en su administración bajo supervisión cuidadosa, si ocurrieren reacciones adversas como síntomas gastrointestinales (véase Reacciones adversas).
Uso durante embarazo o lactancia: PARIET sólo debe usarse en las mujeres embarazadas o en las que sospechen que están embarazadas si los beneficios terapéuticos esperados contrarrestan los posibles riesgos del tratamiento.
[En experimentos animales se ha referido fetotoxicidad (osificación retardada en ratas, pérdida de peso y osificación retardada en conejos) con el rabeprazole sódico (400 mg/kg p.o. en ratas, 30 mg/kv I.V. en conejos)].
PARIET no debe ser administrado a las madres lactantes. Sin embargo, de ser indispensable, debe suspenderse la lactancia.
(En estudios animales se ha referido que el rabeprazole sódico es excretado en la leche materna).
Uso en niños: No se ha establecido la inocuidad del PARIET en los niños (no hay experiencia clínica).
Precauciones relativas al uso:
Administración: Dado que PARIET es un comprimido con recubierta entérica, a los pacientes debe indicárseles no mascarlo o triturarlo sino tragarse el comprimido entero.
Presentación: A los pacientes debe indicárseles empujar el comprimido para sacarlo de la lámina oprimible (PTP) antes de ingerirlo (se ha reportado que al tragar la lámina inintencionalmente las puntas duras y agudas podrían penetrar la mucosa del esófago perforándola, lo que conduce a complicaciones graves, como mediastinitis).
Otras precauciones: Se ha reportado que en un estudio de carcinogenicidad en el cual se administró 5 mg/kg/día o una cantidad mayor de rabeprazole sódico a ratas mediante administración oral durante 2 años, se observaron carcinoides en el estómago de las ratas hembras.
En experimentos animales se han reportado aumento del peso tiroideo y los niveles de la tiroxina sérica (ratas, 25 mg/kg/día o más p.o.). Por lo tanto, debe vigilarse cuidadosamente la función tiroides durante la administración de PARIET.
INTERACCIONES DE DROGAS: Precauciones de coadministración (PARIET debe coadministrarse cuidadosamente con las siguientes drogas).
|
Drogas |
Señales, síntomas y tratamiento |
Mecanismo y factores riesgo |
|
Digoxina |
Podría aumentar concentración digoxina en la sangre |
Absorción de digoxina es promovida debido al aumento del pH gástrico. |
|
Fenitoína |
Se ha referido que un compuesto análogo (omeprazole) prolonga el metabolismo y la excreción de la fenitoína. |
|
|
Antiácido contentivo de hidróxido de
|
Se ha reportado que el AUC medio del plasma disminuye de 8% aluminio ge V hidróxido magnésico a 6% después de la coadministración simultánea de un antiácido y PARIET y la administración de PARIET y hora después de la administración del antiácido, respectivamente, comparado con la administración de PARIET solamente. |
POSOLOGÍA Y ADMINISTRACIÓN: La do- sis usual en los adultos es de 10 mg de rabeprazole sódico administrado oralmente una vez al día.
Sin embargo, la dosis podría aumentarse hasta 20 mg oralmente una vez al día dependiendo de la severidad de los síntomas.
Para el tratamiento de la úlcera gástrica, úlcera estomacal y esofagitis de reflujo, la administración usual deberá limitarse hasta 8 semanas, y para la úlcera duodenal, hasta 6 semanas.
Precauciones: Debe observarse cuidadosamente al paciente durante la administración y las dosis acumulativas deben mantenerse al mínimo conforme a la condición de la enfermedad.
También es aconsejable no usar este producto como terapia de mantenimiento porque no ha habido experiencia suficiente con su uso a largo término.
DESCRIPCIÓN:
Composición: Los comprimidos de PARIET de 10 mg son comprimidos amarillo claro recubiertos de película (comprimidos con recubierta entérica) contentivos de 10 mg de rabeprazole sódico. Los comprimidos de PARIET de 20 mg son comprimidos amarillo claro recubiertos de película (comprimidos con recubierta entérica) contentivos de 20 mg de rabeprazole sódico.
Descripción del producto:
|
Nombre comercial |
Forma posológica y código de identificación |
Aspecto |
Color |
||
|
Anverso |
Reverso |
Lateral |
|||
|
PARIET Comprimidos de 10 mg |
Comprimidos recubiertos de pelílula Î 240 |
Diámetro 6.7 mm |
Peso 132 mg |
Espesor 3.6 mm |
Amarillo claro 1 |
|
PARIET Comprimidos de 20 mg |
Comprimidos recubiertos de película Î 243 |
Diámetro 7.2 mm |
Peso 163 mg |
Espesor 3.6 mm |
Amarillo claro |
PRESENTACIÓN: PARIET Comprimidos de 10 mg paquetes PTP de 14 comprimidos y 100 comprimidos.
PARIET Comprimidos de 20 mg paquetes PTP de 100 comprimidos.
ALMACENAJE Y MANIPULACIÓN:
Almacenaje: PARIET debe guardarse a temperatura ambiente y protegerse de la humedad tras abrirlo.
Fecha de expiración: PARIET debe usarse antes de la fecha de expiración indicada en el paquete (trambién se recomienda usar el PARIET lo más pronto posible después de abrirlo).
REFERENCIAS:
|
Referencia Núm. |
|
|
1) Nakazawa, S. et al.: Modern Physician, 14, 38 (1994). |
PRT-0090 |
|
2) Fujisaki, H. et al.: S. et al.: Jpn. Pharmacol, Soc., 102, 389 (1993) |
PRT-0035 |
|
3) Morii, M. et al.: Biochem. Pharmacol, 39, 661 (1990) |
PRT-0136 |
|
4) Fujisaki, H. et al.: Biochem, Pharmacol, 42, 321 (1991) |
PRT-0036 |
|
5) Fujisaki, H. et al.: Drug Invest., 3, 328 (1991) |
PRT-0039 |
|
6) Murakami, M. et al.: G.I. Research, 1, 439 (1993) |
PRT-0038 |
|
7) Kawai, T. et al.: G.I. Research, 1, 274 (1993) |
PRT-0043 |
|
8) Murakami, M. et al.: G.I. Research, 1, 497 (1993) |
PRT-0128 |
Nota:
Versión revisada: Marzo 1998.
Manufacturado por:
EISAI
Hecho por:
EISAI Co., LTD, Japón
Empacado por:
EISAI, Taiwan Inc.