
SOLIQUA
INSULINA GLARGINA, LIXISENATIDA
Solución inyectable
1 Pluma prellenada, 3 mL, 33 mcg
1 Pluma prellenada, 3 mL, 50 mcg
1 Pluma prellenada, 3 mL, 100 mcg
1 Pluma prellenada, 3 mL, 150 mcg
COMPOSICIÓN:
Ingrediente activo:
Insulina glargina y lixisenatida.
Excipientes:
Glicerol (85%), metionina, metacresol, cloruro de zinc, ácido clorhídrico (para el ajuste del pH), hidróxido de sodio (para el ajuste del pH), agua para inyección.
FORMA FARMACÉUTICA Y FORMULACIÓN:
Forma farmacéutica:
SOLIQUA® se encuentra disponible en forma de solución estéril para inyección en pluma/lapicera prellenada/precargada en dos presentaciones:
SOLIQUA® pluma/lapicera prellenada/precargada de 10-40 que contiene por mL: 100 unidades de insulina glargina* y 50 mcg de lixisenatida
SOLIQUA® pluma/lapicera precargada de 30-60 que contiene por mL: 100 unidades de insulina glargina y 33 mcg de lixisenatida
El producto se administrará por vía parenteral (subcutánea)
INDICACIONES TERAPÉUTICAS:
Indicaciones:
SOLIQUA® está indicado para el tratamiento de adultos con diabetes mellitus tipo 2 para mejorar el control glucémico, como coadyuvante a la dieta y el ejercicio junto con metformina con o sin inhibidores SGLT-2 (para los resultados del estudio con respecto al efecto sobre el control glucémico y las poblaciones estudiadas, ver secciones de Precauciones, Advertencias y Farmacodinámica).
Vea la sección Eficacia clínica y Estudios clínicos para los datos disponibles sobre las diferentes combinaciones.
Limitaciones de uso (ver Advertencias):
• SOLIQUA® no se recomienda en pacientes con diabetes mellitus tipo 1.
• SOLIQUA® no se recomienda para el tratamiento de la cetoacidosis diabética.
• SOLIQUA® no se ha estudiado en pacientes con antecedentes de pancreatitis (véase Advertencias). Otras terapias antidiabéticas deben ser consideradas en pacientes con antecedentes de pancreatitis.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacodinamia:
Modo de acción y características farmacodinámicas:
Mecanismo de acción:
SOLIQUA® combina dos agentes hipoglucemiantes con mecanismos de acción complementarios: insulina glargina, un análogo de insulina basal, y lixisenatida, un agonista del receptor de GLP-1, que se dirige a la glucosa plasmática en ayunas (GPA) y glucosa en plasma posprandial (GPP) para mejorar el control glucémico en pacientes con diabetes tipo 2, mientras minimiza el aumento de peso y el riesgo de hipoglucemia.
Insulina glargina: La actividad primaria de insulina, incluida la insulina glargina, es la regulación del metabolismo de glucosa. La insulina y sus análogos reducen la glucosa en sangre estimulando la captación de glucosa periférica, especialmente por el sistema musculoesquelético y la grasa, e inhibiendo la producción de glucosa hepática. La insulina inhibe la lipólisis y la proteólisis, y aumenta la síntesis de proteínas.
Lixisenatida: Lixisenatida es un agonista del receptor del péptido similar al glucagón tipo 1 (GLP-1). El receptor de GLP-1 es el blanco para el GLP-1 nativo, una hormona incretina endógena que potencia la secreción de insulina dependiente de glucosa de las células beta y suprime el glucagón de las células alfa en el páncreas.
Similar al GLP-1 endógeno, la acción de lixisenatida es mediada mediante una interacción específica con receptores de GLP-1, incluidos aquellos en las células alfa y beta pancreáticas. Después de una comida, lixisenatida activa las siguientes respuestas fisiológicas del individuo:
• Aumenta la secreción de insulina por las células β.
• Hace lento el vaciamiento gástrico.
• Suprime la secreción de glucagón por las células α.
Lixisenatida estimula la secreción de insulina dependiente de glucosa. En paralelo, se suprime la secreción de glucagón. Lixisenatida también hace lento el vaciamiento gástrico reduciendo así la velocidad en la que la glucosa derivada de la comida se absorbe y aparece en la circulación. Se ha mostrado que lixisenatida conserva la función de las células beta y evita la muerte celular (apoptosis) en las células de los islotes pancreáticos, humanas aisladas.
Propiedades de farmacodinamia:
SOLIQUA®
La combinación de insulina glargina y lixisenatida no tiene impacto en la farmacodinamia de insulina glargina. El impacto de la combinación de insulina glargina y lixisenatida en la farmacodinamia de lixisenatida no se ha estudiado en los estudios de fase 1.
Consistente con una concentración relativamente constante y con el perfil de tiempo de la insulina glargina durante 24 horas sin pico pronunciado cuando se administra sola, la tasa de utilización de glucosa y el perfil de tiempo fueron similares, sin pico pronunciado, cuando se administró en la combinación de insulina glargina y lixisenatida.
El curso de tiempo de la acción de insulinas, incluido SOLIQUA®, puede variar inter e intraindividuo.
Insulina glargina: En los estudios clínicos con insulina glargina (100 unidades/mL) el efecto hipoglucemiante en una base molar (es decir, cuando se administra a las mismas dosis) de insulina glargina intravenosa es aproximadamente el mismo que para la insulina humana.
Lixisenatida: En un estudio controlado con placebo de 28 días en pacientes con diabetes tipo 2 que evaluó los efectos de las dosis de 5 a 20 mcg una vez al día (Q.D.) o dos veces al día (B.I.D.) de lixisenatida en la glucosa en sangre inducida por un desayuno de prueba estandarizado, 10 y mcg Q.D. o B.I.D. de lixisenatida mejoraron el control glucémico a través de los efectos de disminución de las concentraciones de glucosa tanto posprandiales como en ayunas en pacientes con diabetes tipo 2. Lixisenatida administrada en este estudio en la mañana a una dosis de 20 mcg Q.D. mantuvo disminuciones estadísticamente significativas en la glucosa en sangre posprandial después del desayuno, almuerzo y cena.
Glucosa posprandial: En un estudio de tratamiento de 4 semanas en pacientes con diabetes tipo 2 en combinación con metformina y en un estudio de tratamiento de 8 semanas en combinación con insulina glargina o sin metformina, lixisenatida 20 mcg una vez al día administrada antes del desayuno, demostró una reducción de la glucosa en plasma posprandial (AUC 0:30-4:30 h) después de la comida de prueba. La cantidad de pacientes con niveles por debajo de 140 mg/dL (7.77 mmol/L) 2 horas después de la comida fue del 69,3% después de 28 días y del 76,1% después de 56 días.
Secreción de insulina: En un estudio de monoterapia, lixisenatida sola restaura la secreción de insulina de primera fase en pacientes con diabetes tipo 2 en una manera dependiente de glucosa en 2.8 veces (IC (intervalo de confianza) del 90%, 2,5 a 3,1) y aumenta la secreción de insulina de segunda fase en 1.6 veces (IC del 90%, 1,4 a 1,7) en comparación con placebo que se mide por el AUC.
Vaciamiento gástrico: Después de una prueba estandarizada con alimento marcado, lixisenatida lentifica el vaciamiento gástrico, reduciendo así la tasa de absorción de glucosa posprandial. Después del tratamiento de 28 días con lixisenatida sola, el efecto de desaceleración del vaciamiento gástrico se mantiene en pacientes con diabetes tipo 2.
Secreción de glucagón: Lixisenatida (sola) 20 mcg una vez al día, demostró reducción de los niveles de glucagón posprandial contra el inicio después de una prueba de comida en pacientes con diabetes tipo 2. En el estudio de pinzamiento hipoglucémico en sujetos sanos que evaluó el efecto de la inyección única de 20 mcg de lixisenatida en la respuesta de glucagón, se conservó la respuesta del glucagón contrarregulatorio bajo condiciones hipoglucémicas en la presencia de concentraciones eficaces de lixisenatida en plasma.
Electrofisiología cardiaca (QTc): El efecto de lixisenatida en la repolarización cardiaca se analizó en un estudio del intervalo QTc (1.5 veces la dosis aprobada de mantenimiento) que indica que no hay impacto relevante de lixisenatida en la repolarización ventricular.
Frecuencia cardiaca: No se observó aumento en la frecuencia cardiaca promedio en los estudios controlados con placebo, fase 3, de SOLIQUA®.
Eficacia clínica y estudios clínicos:
Resumen de los estudios clínicos:
La seguridad y la eficacia de SOLIQUA® en el control glucémico se evaluó en tres estudios clínicos aleatorizados en pacientes con diabetes mellitus tipo 2:
• Añadido a metformina (sin tratamiento previo con insulina).
• Cambio desde la insulina basal.
• Cambio desde el agonista del receptor GLP-1.
En cada uno de los ensayos controlados con activo, el tratamiento con SOLIQUA® produjo mejorías clínica y estadísticamente significativas en la hemoglobina A1c (HbA1c).
El alcance de niveles más bajos de HbA1c y el logro de una reducción mayor en la HbA1c no aumentó las tasas de hipoglucemia con el tratamiento de combinación contra la insulina glargina sola (vea la sección Reacciones adversas).
En el estudio clínico de adición a metformina, la dosis de inicio fue de 10 unidades (10 unidades de insulina glargina y 5 mcg de lixisenatida). En el estudio clínico del cambio de insulina basal, la dosis de inicio fue de 20 unidades (20 unidades de insulina glargina y 10 mcg de lixisenatida) o 30 unidades (30 unidades de insulina glargina y 10 mcg de lixisenatida) dependiendo de la dosis previa de insulina. En ambos estudios, la dosis se ajustó una vez a la semana con base en la mediana del automonitoreo de valores de glucosa plasmática de los tres días previos, en conformidad con la tabla 4 siguiente.
Tabla 4. Algoritmo del ajuste de dosis de SOLIQUA®
|
Automonitoreo de glucosa plasmática en ayunas (mg/dL) {mmol/LL} |
Cambio de dosis (unidades/día) |
|
> 140 {> 7,77} |
+ 4 |
|
> 100 y ≤ 140 {> 5,55 y ≤ 7,77} |
+ 2 |
|
80 a 100 {4,44 a 5,55} |
Sin cambio |
|
< 80 {< 4,44} |
-2 |
Estudio clínico en pacientes con diabetes tipo 2 no controlada con tratamiento ADO:
Añadido a metformina (sin tratamiento previo con insulina):
Un total de 1.170 pacientes con diabetes tipo 2 fueron aleatorizados en un estudio abierto, de 30 semanas, controlado con activo para evaluar la eficacia y seguridad de SOLIQUA® en comparación con los componentes individuales, insulina glargina (100 unidades/mL) y lixisenatida (20 mcg).
Los pacientes con diabetes tipo 2, tratados con metformina sola o con el tratamiento de metformina y un segundo ADO que podía ser una sulfonilúrea o una glinida, o un inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT-2) o un inhibidor de dipeptidil peptidasa 4 (DPP-4), y que no estaban adecuadamente controlados con este tratamiento (rango de HbA1c del 7,5% al 10% para los pacientes previamente tratados con metformina sola y entre el 7,0% y el 9% para los pacientes previamente tratados con metformina y un segundo tratamiento hipoglucemiantes oral) ingresaron a un periodo de adaptación durante 4 semanas. Durante esta fase de adaptación, se optimizó el tratamiento de metformina y se suspendió cualquier otro ADO. Al final del periodo de adaptación, los pacientes que continuaron inadecuadamente controlados (HbA1c entre el 7% y el 10%) fueron aleatorizados a SOLIQUA®, insulina glargina o lixisenatida. De los 1479 pacientes que se incluyeron en el periodo de preinclusión, sólo se aleatorizaron 1170. Las principales razones para no entrar en la fase de aleatorización fueron un valor de la GPA > 13,9 mmol/L y un valor de HbA1c < 7% o > 10% al final de la fase de preinclusión.
La población con diabetes tipo 2 aleatorizada tuvo las siguientes características: la edad promedio fue de 58,4 años, el 50,6 % eran hombres, 90,1 % eran caucásicos, 6,7% eran negros o afroamericanos y el 19,1 % eran hispanos. El índice de masa corporal (IMC por la sigla en español) promedio al inicio fue de 31,7 kg/m2 con un 63,4% de pacientes con un IMC ≥ 30 kg/m2. La duración promedio de la diabetes fue de aproximadamente 9 años. El tratamiento con metformina de base era obligatorio y el 58% de los pacientes recibía un tratamiento adicional con otro ADO en el momento de la selección, siendo una sulfonilúrea en el 54% de los pacientes.
En la semana 30, SOLIQUA® proporcionó mejoría estadísticamente significativa en la HbA1c (valor de p < 0,0001) en comparación con los componentes individuales. En un análisis previamente especificado de este parámetro de valoración primario, las diferencias observadas fueron consistentes respecto a la HbA1c inicial (< 8% o ≥ 8%) o el uso inicial de ADO (metformina sola o metformina más un segundo ADO).
Vea la tabla 5 y la figura 2 para los demás parámetros de valoración en el estudio.
Tabla 5. Resultados a las 30 semanas-estudio clínico de adición a metformina (población de intención de tratamiento modificada [IDTm])
|
SOLIQUA® |
Insulina glargina |
Lixisenatida |
|
|
Cantidad de pacientes (IDTm) |
468 |
466 |
233 |
|
HbA1c (%)31 |
|||
|
Inicio (promedio; posterior a la fase de adaptación) |
8,1 |
8,1 |
8,1 |
|
Fin del estudio (promedio) |
6,5 |
6,8 |
7,3 |
|
Cambio en los MC desde el inicio (promedio) |
-1,6 |
-1,3 |
-0,9 |
|
Diferencia contra insulina glargina [intervalo de confianza del 95%] (valor de p) |
-0,3 [-0,4, -0,2] (< 0,0001) |
||
|
Diferencia contra lixisenatida [intervalo de confianza del 95%] (valor de p)32 |
-0,8 [-0,9, -0,7] (< 0,0001) |
||
|
Cantidad de pacientes (%) que alcanzó HbA1c < 7% en la semana 30* |
345 (74%) |
277 (59%) |
77 (33%) |
|
Glucosa en plasma en ayunas (mg/dL) {mmol/L} |
|||
|
Inicio (promedio) |
178,0 {9,88} |
175,7 {9,75} |
176,4 {9,79} |
|
Fin del estudio (promedio) |
113,9 {6,32} |
117,6 {6,53} |
148,9 {8,27} |
|
Cambio en los MC respecto al inicio (promedio) |
-62,4 {-3,46} |
-59,0 {-3,27} |
-27,0 {-1,50} |
|
Diferencia en los MC contra glargina (promedio) [IC del 95%] (valor de p) |
-3,5 [-7,6 a 0,7] {-0.19 [-0.420 a 0.038]} (0.1017) |
||
|
Diferencia en los MC contra lixisenatida (promedio) [IC del 95%] (valor de p) |
-35,4 [-40,5 a -30,3] {-1,96 [-2,246 a 1,682]} (< 0,0001) |
||
|
GPP de 2 horas (mg/dL) {mmol/L} [variación de glucosa de 2 h** (mg/dL) {mmol/L}] |
|||
|
Inicio (promedio) |
273,7 {15,19} |
263,2 {14,61} |
265,2 {14,72} |
|
Fin del estudio (promedio) |
164,9 {9,15} |
204,5 {11,35} |
180 {9,99} |
|
Cambio en los MC desde el inicio hasta la semana 30 (promedio) |
-102,4 {-5,68} |
-59,6 {-3,31} |
-82,62 {-4,58} |
|
Diferencia en los MC en comparación con insulina glargina (media) [IC del 95%] |
42,9 (-50,3 a -35,4) {-2,38 (-2,79 a -1,96)} |
||
|
Diferencia en los MC en comparación con lixisenatida (media) [IC del 95%] |
-19.8 (-29,4 a -10,3) {-1,10 (-1,63 a -0,57)} |
||
|
Peso corporal promedio (kg) |
|||
|
Inicial (promedio) |
89,4 |
89,8 |
90,8 |
|
Cambio MC desde el inicio (promedio) |
-0,3 |
1,1 |
-2,3 |
|
Comparación contra insulina glargina [intervalo de confianza del 95%]* (valor de p) |
-1,4 [-1,9 a -0,9] (< 0,0001) |
||
|
Comparación contra lixisenatida [intervalo de confianza del 95%] |
2,01 [1,4 a 2,6] |
||
|
Cantidad (%) de pacientes que alcanzaron HbA1c < 7,0% sin aumento del peso corporal en la semana 30 |
202 (43,2%) |
117 (25,1%) |
65 (27,9%) |
|
Diferencia en la proporción contra insulina glargina [intervalo de confianza del 95%] (valor de p) |
18,1 [12,2 a 24,0] (< 0,0001) |
||
|
Diferencia en la proporción contra lixisenatida [intervalo de confianza del 95%]* |
15,2 [8,1 a 22,4] |
||
|
Dosis diaria de insulina glargina |
|||
|
Dosis de insulina MC en la semana 30 (promedio) |
39,8 |
40,5 |
NA |
* No incluida en el procedimiento de pruebas step-down predefinido.
** GPP de 2 h menos el valor de la glucosa antes de la comida.
Figura 2: HbA1c (%) promedio al inicio de la selección, punto de aleatorización en cada punto de tiempo (pacientes que completaron) y en la semana 30 (última observación realizada -LOCF*)-población de intención de tratamiento modificada (IDTm)

* LOCF = Última observación realizada.
Los pacientes en el grupo de SOLIQUA® reportaron una disminución estadística y significativamente mayor en el punto 7 promedio del perfil de SMPG desde el inicio hasta la semana 30 (-60,36 mg/dL {3,35 mmol/L}) en comparación con los pacientes en el grupo de insulina glargina (-47,87 mg/dL {-2,66 mmol/L}); diferencia 12,49 mg/dL {-0,69 mmol/L}) y pacientes en el grupo de lixisenatida (-35,11 mg/dL; diferencia 25,24 mg/dL) {(-1,95 mmol/L; diferencia – 1,40 mmol/L)} (p < 0,0001 para ambas comparaciones). En todos los puntos de tiempo, los valores promedio de la glucosa plasmática de 30 semanas fueron más bajos en el grupo de SOLIQUA® que tanto en el grupo de insulina glargina como en el grupo de lixisenatida, con la única excepción del valor previo al desayuno que fue similar entre el grupo de SOLIQUA® y el grupo de glargina insulina.
Estudios clínicos en pacientes con diabetes tipo 2 no controlada con insulina basal:
Cambio de la insulina basal:
Un total de 736 pacientes con diabetes tipo 2 participaron en un estudio multicéntrico, aleatorizado, de 30 semanas, controlado con activo, abierto, de 2 grupos paralelos de tratamiento, para evaluar la eficacia y seguridad de SOLIQUA® en comparación con insulina glargina (100 unidades/mL).
Los pacientes seleccionados que tenían diabetes tipo 2 fueron tratados con insulina basal durante al menos 6 meses, y recibieron una dosis diaria fija de 15 y 40 unidades sola o combinada con 1 o 2 ADO (metformina o alguna sulfonilúrea o glinida, o con un inhibidor de SGLT-2 o un inhibidor de DPP-4), tuvieron una HbA1c entre 7,5% y 10%, y una GBA ≤ 180 mg/dL {9,99 mmol/L} o 200 mg/dL {11,1 mmol/L} dependiendo de su tratamiento hipoglucemiante previo.
Después de la selección, los pacientes elegibles (n = 1018) ingresaron a la fase de adaptación de 6 semanas en la que los pacientes continuaron con, o fueron cambiados a insulina glargina, en caso de que tomaran otra insulina basal, y se les tituló o estabilizó su dosis de insulina mientras continuaban con metformina (si la tomaban anteriormente). Se suspendió cualquier otro ADO. Al final del periodo de adaptación, los pacientes con HbA1c entre el 7% y el 10%, GBA ≤ 140 mg/dL {7,77 mmol/L} y dosis diaria de insulina glargina de 20 a 50 unidades, fueron aleatorizados a SOLIQUA® (n = 367) o a insulina glargina (n = 369).
Esta población con diabetes tipo 2 tenía las siguientes características: la edad promedio fue de 60 años, 46,7% eran varones, 91,7% eran caucásicos, 5,2% eran negros o afroamericanos y 17,9% eran hispanos. El índice de masa corporal (IMC) promedio fue de aproximadamente 31 kg/m2, con un 57,3% de pacientes con un IMC ≥ 30 kg/m2. En el momento de la selección el 64,4% de los pacientes recibieron insulina glargina como insulina basal y un 95,0% de los pacientes recibieron al menos un ADO concomitante.
La duración promedio de la diabetes fue de aproximadamente 12 años y la duración media del tratamiento previo con insulina basal de alrededor de 3 años.
En la semana 30, SOLIQUA® brindó mejoría estadísticamente significativa en la HbA1c (valor de p < 0,0001) en comparación con insulina glargina.
Vea la tabla 6 y la figura 3 para los demás parámetros de valoración en el estudio.
Tabla 6. Resultados a las 30 semanas-estudio de diabetes tipo 2 no controlada en población de IDTm con insulina basal
|
SOLIQUA® |
Insulina glargina |
|
|
Cantidad de pacientes (IDTm) |
366 |
365 |
|
HbA1c (%) |
||
|
En la selección (promedio) |
8,5 |
8,5 |
|
Inicio (promedio; posterior a la fase de adaptación) |
8,1 |
8,1 |
|
Fin tratamiento (promedio) |
6,9 |
7,5 |
|
Cambio en los MC desde el inicio (promedio) |
-1.1 |
-0,6 |
|
Diferencia contra insulina glargina [intervalo de confianza del 95%] (valor de p) |
-0,5 [-0,6, -0,4] (< 0,0001) |
|
|
Pacientes [n (%)] que alcanzaron HbA1c < 7 % en la semana 30* |
201 (54,9%) |
108 (29,6%) |
|
Glucosa plasmática en ayunas (mg/dL) {mmol/L} |
||
|
Inicio (promedio) |
132,0 {7,33} |
13,0 {7,32} |
|
Fin del estudio (promedio) |
122,1 {6,78} |
120,5 {6,69} |
|
Cambio desde el inicio en los MC (promedio) |
-6,3 {-0,.35} |
-8,3 {-0,47) |
|
Diferencia en comparación con insulina glargina |
2,0 (-3.8 a -7.7) {0,11 (-0,21 a 0,43)} |
|
|
GPP de 2 horas (mg/dL) {mmol/L} [variación de glucosa de 2 h** (mg/dL) {mmol/L} |
||
|
Inicio (promedio) |
267,5 {14,85} |
269,7 {14,97} |
|
Fin del estudio (promedio) |
178,5 {9,91} |
241,59 {13,41} |
|
Cambio en los MC desde el inicio hasta la semana 30 (promedio) |
-85,1 {-4,72} [-70,2 {-3,90}] |
-25,1 {-1,39} [-8,4 {-0,47}] |
|
Diferencia contra insulina glargina [intervalo de confianza del 95%] (valor de p) |
54,0 (-70,1 a -50,0) {-3,00 (-3,89 a -2,77)} |
|
|
Peso corporal promedio (kg) |
||
|
Inicial (promedio) |
87,8 |
87,1 |
|
Cambio en los MC desde el inicio (promedio) |
-0,7 |
0,7 |
|
Comparación contra insulina glargina [intervalo de confianza del 95%] (valor de p) |
-1,4 [-1,8 a -0,9] (< 0,0001) |
|
|
Cantidad (%) de pacientes que alcanzaron HbA1c < 7.0% sin aumento del peso corporal en la semana 30 |
125 (34,2%) |
49 (13,4%) |
|
Diferencia en la proporción contra insulina glargina [intervalo de confianza del 95%] (valor de p) |
20,8 [15,0 a 26,7] (< 0,0001) |
|
|
Dosis diaria de insulina glargina |
||
|
Inicial (promedio) |
35,0 |
35,2 |
|
Punto final (promedio) |
46,7 |
46,7 |
|
Dosis de insulina en los MC en la semana 30 (promedio) |
10,6 |
10,9 |
* No incluida en el procedimiento de pruebas step-down predefinido.
** GPP de 2 h menos el valor de la glucosa antes de la comida.
Figura 3: HbA1c (%) promedio al inicio de la selección, en la aleatorización, en cada punto de tiempo (pacientes que completaron) y en la semana 30 (LOCF*) - población de IDTm
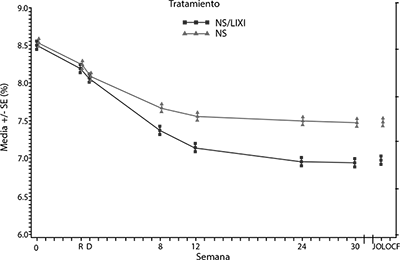
*LOCF = última observación realizada.
Cambio desde agonista del recetor GLP-1:
Estudio clínico en pacientes con diabetes tipo 2 insuficientemente controlados con un agonista del receptor GLP-1:
La eficacia y seguridad de SOLIQUA® en comparación con el tratamiento con un agonista del receptor GLP-1 anterior al ensayo sin cambio, se estudiaron en un ensayo aleatorizado, abierto, de 26 semanas.
El ensayo incluyó a 514 pacientes con diabetes mellitus tipo 2 inadecuadamente controlados (nivel de HbA1c de 7% a 9% ambos incluidos) mientras fueron tratados durante al menos 4 meses con liraglutida o exenatida o durante al menos 6 meses con dulaglutida, albiglutida o exenatida de liberación prolongada, todos a la dosis máxima tolerada, y metformina sola o en combinación con pioglitazona, un inhibidor SGLT-2 o ambos. Los pacientes elegibles fueron aleatorizados para recibir SOLIQUA® o para continuar con su anterior agonista del receptor GLP-1, ambos además de su tratamiento antidiabético oral anterior.
En la selección, el 59,7% de los sujetos recibió un agonista del receptor GLP-1 una o dos veces al día y el 40,3% recibió un agonista del receptor GLP-1 una vez por semana. En la selección, el 6,6% de los sujetos recibieron pioglitazona y el 10,1% un inhibidor de SGLT-2 en combinación con metformina.
La población de estudio tenía las siguientes características: la edad media era de 59,6 años, el 52,5% de los sujetos eran hombres. La duración media de la diabetes fue de 11 años, la duración media del tratamiento previo con un agonista del receptor GLP-1 fue de 1,9 años, el IMC promedio fue de aproximadamente 32,9 kg/m2, la TFGe media fue de 87,3 mL/min/1,73 m2 y el 90,7% de los pacientes tenían una TFGe ≥ 60 mL/min.
En la semana 26, SOLIQUA® proporcionó una mejora estadísticamente significativa en HbA1c (p < 0,0001). Un análisis preespecificado por el subtipo de agonista del receptor GLP-1 (formulación una vez/dos veces al día o semanalmente) utilizado en la selección, mostró que el cambio de HbA1c en la semana 26 fue similar para cada subgrupo y consistente con el análisis primario de toda la población.
La dosis diaria promedio de SOLIQUA® en la semana 26 fue de 43,5 unidades.
Ver tabla y figura a continuación para las otras variables del estudio.
Resultados a las 26 semanas: Estudio en pacientes con diabetes tipo 2 no controlados con un agonista del receptor GLP-1 (población por IDTm)
|
SOLIQUA® |
Insulina glargina |
|
|
Número de pacientes (IDTm) |
252 |
253 |
|
HbA1c (%) |
||
|
Inicio (media, después de la fase de preinclusión) |
7,8 |
7,8 |
|
Fin de tratamiento (media) |
6,7 |
7,4 |
|
Cambio en los MC respecto al inicio (media) |
-1,0 |
-0,4 |
|
Diferencia en comparación con un agonista del receptor GLP-1 [IC del 95%] (valor de p) |
-0,6 [-0,8 a -0,5] (< 0,0001) |
|
|
Pacientes [n (%)] que alcanzan HbA1c < 7% en la semana 26* |
156 (61,9%) |
65 (25,7%) |
|
Diferencia proporcional (intervalo de confianza del 95%) en comparación con un agonista del receptor GLP-1 |
36.1% (28,1% a 44,0%) |
|
|
Valor de p |
(< 0,0001) |
|
|
Glucosa plasmática en ayunas (mmol/L) |
||
|
Inicio (media) |
9,06 |
9,45 |
|
Fin del estudio (media) |
6,86 |
8,66 |
|
Cambio en los MC respecto al inicio (media) |
-2,28 |
-0,60 |
|
Diferencia en comparación con un agonista del receptor GLP-1 [IC del 95%] (Valor de p) |
-1,67 (-0,21 a 0,43) (< 0,0001) |
|
|
GPP a las 2 horas (mmol/L)** |
||
|
Inicio (media) |
14,85 |
14,97 |
|
Fin del estudio (media) |
9,91 |
13,41 |
|
Cambio en los MC respecto al inicio (media) |
-4,72 |
-1,39 |
|
Diferencia en los MC en comparación con un agonista del receptor GLP-1 (media) [Intervalo de confianza del 95%] (valor de p) |
-2,9 (-3,42 a 2,28) (< 0,0001) |
|
|
Peso corporal medio (kg) |
||
|
Inicio (media) |
||
|
Cambio en los MC respecto al inicio (media) |
||
|
Comparación con agonistas del receptor GLP-1) [Intervalo de confianza del 95%] (valor de p) |
-3,03 [2,417 a 3,643] (< 0,0001) |
|
** GPP a las 2 horas menos el valor de glucosa preprandial
Figura: Media de la HbA1c (%) por visita durante el periodo de tratamiento aleatorizado de 26 semanas-población por IDTm)
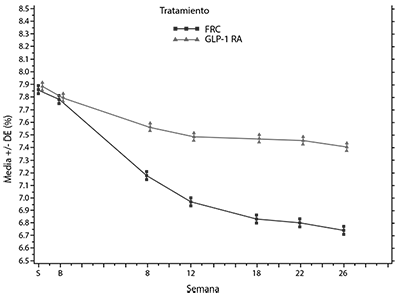
Uso concomitante de SOLIQUA® con inhibidores SGLT-2 (iSGLT2):
El uso concomitante de SOLIQUA® con un iSGLT2 está respaldado por un análisis de subgrupos de 3 ensayos clínicos aleatorizados en fase 3 (119 pacientes con la combinación de ratio fijo (CRF) de insulina glargina/lixisenatida que también recibieron un iSGLT2).
Un estudio realizado en Europa y América del Norte, incluyó datos de 26 pacientes (10,1%) que recibieron concomitantemente CRF de insulina glargina/lixisenatida, metformina y un iSGLT2. Dos estudios Fase 3 más del programa de desarrollo clínico japonés específico, realizado en pacientes que no alcanzaron un control glucémico adecuado con ADO, proporcionaron datos de 59 pacientes (22,7%) y 34 pacientes (21,1%), respectivamente, que recibieron concomitantemente un iSGLT2 y CRF de insulina glargina/lixisenatida.
Los datos de estos 3 estudios, mostraron que el inicio con SOLIQUA® en pacientes inadecuadamente controlados con un tratamiento que incluye un iSGLT2 conduce a un cambio mejorado de HbA1c vs. los comparadores. No hubo incremento del riesgo de hipoglucemia, ni diferencias relevantes en el perfil de seguridad global entre los pacientes que usaban un iSGLT2 comparados con los que no.
Estudios de eventos cardiovasculares:
La seguridad cardiovascular de insulina glargina y lixisenatida se ha establecido en los ensayos clínicos ORIGIN y ELIXA, respectivamente. No se ha conducido ensayo clínico cardiovascular con SOLIQUA®.
Insulina glargina:
El ensayo de reducción de resultados con intervención inicial con glargina (es decir, ORIGIN) fue un estudio abierto, aleatorizado, de 12.537 pacientes que comparó LANTUS con la atención de referencia al momento de la primera incidencia de algún evento adverso cardiovascular mayor (MACE). MACE se define como el compuesto de muerte CV, infarto del miocardio no fatal y accidente cerebrovascular no fatal. La mediana de la duración del seguimiento del estudio fue de 6,2 años. La incidencia de MACE fue similar entre LANTUS y el tratamiento de referencia en ORIGIN [Hazard Ratio (IC del 95%) para EACM: 1,02 (0,94-1,11)].
En el ensayo ORIGIN, la incidencia global de cáncer (todos los tipos combinados) [proporción de riesgo (IC del 95%): 0,99 (0,88, 1,11)] o de defunción por cáncer [proporción de riesgo (IC del 95%): 0.94 (0,77, 1,15) también fue similar entre los grupos de tratamiento.
Lixisenatida:
El estudio ELIXA fue un estudio aleatorizado, doble ciego, controlado con placebo, multinacional que evaluó los resultados cardiovasculares (CV) durante el tratamiento con lixisenatida en pacientes (n = 6068) con diabetes mellitus tipo 2 después de un evento reciente de síndrome coronario agudo. El parámetro de valoración primario combinado de eficacia fue el tiempo hasta la primera incidencia de alguno de los siguientes eventos adjudicados positivamente por el comité de adjudicación de eventos cardiovasculares; defunción cardiovascular, infarto del miocardio no fatal, accidente cerebrovascular no fatal, u hospitalización por angina inestable. Los parámetros de valoración CV secundarios incluyeron un compuesto del parámetro de valoración primario, u hospitalización por insuficiencia cardiaca o revascularización coronaria. Los cambios en la proporción albúmina-creatinina (UACR) a las 108 semanas también fue un parámetro de valoración secundario previamente especificado.
La mediana de la duración del tratamiento fue de 22,4 meses en el grupo de lixisenatida y de 23,3 meses en el grupo de placebo, y la mediana de duración del seguimiento del estudio fue de 25,8 y de 24,7 meses; respectivamente. La HbA1c promedio (± SD) en los grupos de lixisenatida y de placebo fue de 7,72 (± 1,32)% y de 7,64 (± 1,28)% al inicio y de 7,46 (± 1,48) % a los 24 meses, respectivamente.
La incidencia del parámetro de valoración primario fue similar en los grupos de lixisenatida y de placebo; la proporción de riesgo (PR) para lixisenatida contra placebo fue de 1,017, con un intervalo de confianza (IC) del 95 % de 2 colas asociado de 0,886 a 1,168. También se observaron porcentajes similares para los parámetros de valoración secundarios, y para todos los componentes individuales de los parámetros de valoración combinados. Los porcentajes de pacientes hospitalizados por insuficiencia cardiaca fueron del 4,0% y del 4,2% en el grupo de lixisenatida y de placebo, respectivamente (PR [IC del 95%] = 0.96 [0,75 a 1,23]).
Se observó un aumento más pequeño en la proporción albúmina - creatinina (UACR) desde el inicio hasta la semana 108 en lixisenatida en comparación con placebo: -10,04% ± 3,53%; IC del 95% = -16,95% a -3,13%.
Población pediátrica:
La Agencia Europea de Medicamentos ha eximido de la obligación de presentar los resultados de los ensayos realizados con SOLIQUA® en todos los grupos de la población pediátrica en el tratamiento de la diabetes mellitus tipo 2.
Farmacocinética:
SOLIQUA®
La proporción de insulina glargina-lixisenatida no tiene impacto relevante en la farmacocinética (PK) de insulina glargina en SOLIQUA®. En comparación con la administración de lixisenatida sola, la Cmáx es más baja mientras que el AUC es generalmente comparable cuando se administra como SOLIQUA®. Las diferencias observadas en la farmacocinética (PK) de lixisenatida cuando se administra como SOLIQUA® sola no se considera que sean clínicamente relevantes.
Absorción:
SOLIQUA®
La relación insulina glargina/lixisenatida no tiene un impacto relevante en la PK de la insulina glargina y lixisenatida en SOLIQUA®.
Después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida a pacientes con diabetes tipo 1, insulina glargina no mostró pico pronunciado. La exposición a insulina glargina osciló entre el 86% y el 101% en comparación con la administración de insulina glargina sola. Esta diferencia no se considera clínicamente relevante.
Después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida a pacientes con diabetes tipo 1, la mediana de la tmáx de lixisenatida fue en el rango de 2,5 a 3,0 horas. Hubo una pequeña disminución en la Cmáx de lixisenatida del 22% al 34% en comparación con la administración simultánea aparte de insulina glargina y lixisenatida, que probablemente no sea clínicamente significativa.
No hay diferencias clínicamente relevantes en la tasa de absorción cuando lixisenatida se administra por vía subcutánea en el abdomen, muslo o brazo.
Distribución:
Lixisenatida: Lixisenatida tiene un nivel bajo de unión a proteína humanas (55%). El volumen aparente de distribución de lixisenatida después de la administración subcutánea de insulina glargina/lixisenatida (Vz/F) es de aproximadamente 100 L. El volumen aparente de distribución de insulina glargina después de la administración subcutánea de la insulina glargina/lixisenatida (Vss/F) es aproximadamente 1700 L.
Metabolismo y eliminación:
Insulina glargina: Un estudio del metabolismo en humanos que recibieron insulina glargina sola indica que la insulina glargina se metaboliza en parte en el término carboxilo de la cadena β en el depósito subcutáneo para formar dos metabolitos activos con actividad in vitro similar a la de insulina humana, M1 (21A-Gli-insulina) y M2 (21A-Gli-des-30B-Thr-insulina).
El principal compuesto circulante en plasma es el metabolito M1. Los hallazgos farmacocinéticos y farmacodinámicos indican que el efecto de la inyección subcutánea de insulina glargina se basa principalmente en la exposición a M1.
Lixisenatida: Como un péptido, lixisenatida se elimina a través de la filtración glomerular, seguida por la reabsorción tubular y posterior degradación metabólica, que resulta en péptidos más pequeños y aminoácidos, que se vuelven a introducir en el metabolismo de la proteína. Después de la administración de dosis múltiples en pacientes con diabetes tipo 2, la semivida terminal media fue de aproximadamente 3 horas y el aclaramiento aparente medio (CL/F) de aproximadamente 35 L/h.
Poblaciones especiales:
Daño renal: En sujetos con insuficiencia renal leve (aclaramiento de creatinina de 60-90 ml/min, según la fórmula de Cockcroft-Gault), moderada (aclaramiento de creatinina de 30-60 mL/min) y grave (aclaramiento de creatinina de 15-30 mL/min) el AUC de lixisenatida aumentó en un 46 %, 51% y 87%, respectivamente.
La insulina glargina no se ha estudiado en pacientes con insuficiencia renal. En pacientes con insuficiencia renal, las necesidades de insulina pueden reducirse a causa de la disminución del metabolismo de la insulina.
Daño hepático:
Lixisenatida: Como lixisenatida se depura principalmente mediante el riñón, no se han realizado estudios de farmacocinética en pacientes con daño hepático agudo o crónico. No se espera que la disfunción hepática afecte la farmacocinética de lixisenatida. La insulina glargina no se ha estudiado en pacientes diabéticos con insuficiencia hepática. En pacientes con insuficiencia hepática, los requisitos de insulina pueden disminuir debido a la capacidad reducida para la gluconeogénesis y al metabolismo de la insulina reducido.
Edad, etnia y género:
Insulina glargina: El efecto de la edad, etnia y género en la farmacocinética de insulina glargina no se ha evaluado. En los ensayos clínicos controlados en adultos con insulina glargina (100 unidades/mL), los análisis de subgrupo con base en la edad, etnia, y género no afectaron las diferencias en la seguridad y eficacia.
Lixisenatida: El efecto de la edad, la raza y el sexo en la farmacocinética de la insulina glargina no se ha estudiado. En un estudio farmacocinético en sujetos ancianos no diabéticos, la administración de 20 mcg de lixisenatida produjo un aumento medio del AUC de lixisenatida en un 29% en la población anciana (11 sujetos de 65 a 74 años y 7 sujetos de ≥ 75 años) en comparación con 18 sujetos de 18 a 45 años de edad, probablemente relacionados con una función renal reducida en el grupo de mayor edad.
El origen étnico no tuvo un efecto clínicamente relevante sobre la farmacocinética de lixisenatida según los resultados de estudios farmacocinéticos en sujetos caucásicos, japoneses y chinos.
El género no tiene un efecto clínicamente relevante en la farmacocinética de lixisenatida. El peso corporal no tiene un efecto clínicamente relevante sobre el AUC de lixisenatida.
Obesidad:
No se ha evaluado el efecto del índice de masa corporal en la farmacocinética de SOLIQUA®.
Inmunogenicidad:
En presencia de anticuerpos anti-lixisenatida, la exposición a lixisenatida y la variabilidad en la exposición se ven incrementados de manera acusada con independencia del nivel de dosis.
Población pediátrica:
No se han llevado a cabo estudios con SOLIQUA® en niños, ni en adolescentes menores de 18 años.
CONTRAINDICACIONES:
SOLIQUA® está contraindicado en pacientes con hipersensibilidad conocida a lixisenatida, insulina glargina o a cualquiera de los ingredientes inactivos en la formulación.
PRECAUCIONES:
Advertencias:
Uso de SOLIQUA®:
Trazabilidad:
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
SOLIQUA® no se deberá utilizar en pacientes con diabetes mellitus tipo 1 o para el tratamiento de cetoacidosis diabética.
Se debe enseñar a los pacientes a realizar una rotación continua del punto de inyección para reducir el riesgo de sufrir lipodistrofia y amiloidosis cutánea. Hay un posible riesgo de retraso de la absorción de insulina y empeoramiento del control de la glucemia tras las inyecciones de insulina en puntos con estas reacciones. Se ha notificado que un cambio repentino en el punto de inyección en una zona no afectada produce hipoglucemia. Se recomienda vigilar la glucosa en sangre después de cambiar el punto de inyección y podrá considerarse el ajuste de las medicaciones antidiabéticas.
Riesgo de pancreatitis:
El uso de agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) se ha asociado con un riesgo de desarrollar pancreatitis aguda. Se han reportado pocos eventos de pancreatitis aguda con lixisenatida, aunque no se ha establecido una relación causal. Se deberá informar a los pacientes de los síntomas característicos de pancreatitis aguda: dolor abdominal persistente e intenso. Si se sospecha de pancreatitis, se deberá suspender SOLIQUA®; si se confirma pancreatitis aguda, no se deberá reiniciar SOLIQUA®. Utilice con precaución en pacientes con antecedentes de pancreatitis.
Precauciones:
Hipoglucemia: La hipoglucemia fue la reacción adversa no deseable observada que se reportó con mayor frecuencia durante el tratamiento con SOLIQUA®. Puede ocurrir hipoglucemia si la dosis de SOLIQUA® es más alta que la requerida. Los factores que aumenten la susceptibilidad a hipoglucemia requieren de monitorización estrecha en particular y puede ser necesario el ajuste de dosis. Los factores incluyen:
- Cambio en el área de inyección.
- Mejor sensibilidad a la insulina (p. ej., eliminación de factores de estrés).
- Actividad física no acostumbrada, en exceso o prolongada.
- Enfermedad intercurrente (p. ej., vómito y diarrea).
- Ingesta alimentaria inadecuada.
- Comidas omitidas.
- Consumo de alcohol.
- Ciertos trastornos endocrinos descompensados (p. ej., en el hipotiroidismo y en la insuficiencia de la pituitaria anterior o adrenocortical).
- Tratamiento concomitante con otros productos medicinales (vea la sección Interacciones).
- La lixisenatida y/o la insulina en combinación con una sulfonilurea pueden aumentar el riesgo de hipoglucemia. Por lo tanto, SOLIQUA® no debe administrarse en combinación con una sulfonilurea.
La dosis de SOLIQUA® se debe personalizar con base en la respuesta clínica y titular con base en la necesidad de insulina del paciente (vea la sección Posología y Administración).
El efecto prolongado de insulina glargina subcutánea puede retrasar la recuperación de la hipoglucemia.
Uso en pacientes con gastroparesia grave:
El uso de agonistas del receptor de GLP-1 se puede asociar con reacciones adversas gastrointestinales. SOLIQUA® no se ha estudiado en pacientes con enfermedad gastrointestinal grave, incluida la gastroparesia grave y, por lo tanto, no se recomienda el uso de SOLIQUA® en estos pacientes.
Daño renal: No hay experiencia terapéutica en pacientes con deterioro renal grave (depuración de creatinina < 30 mL/min) o enfermedad en etapa terminal. No se recomienda el uso en pacientes con daño renal grave o con enfermedad terminal (vea la sección Poblaciones especiales).
Productos medicinales concomitantes: El retraso en el vaciamiento gástrico con lixisenatida puede reducir la tasa de absorción de los productos medicinales administrados por vía oral. SOLIQUA® se deberá utilizar con precaución en pacientes que reciban productos medicinales orales que requieran de absorción gastrointestinal rápida, que requieran de la monitorización clínica cuidadosa o que tengan una proporción terapéutica estrecha (vea la sección Interacciones - Lixisenatida).
Deshidratación: Se deberá advertir a los pacientes tratados con SOLIQUA® del riesgo potencial de deshidratación en relación con las reacciones gastrointestinales adversas y de que tomen precauciones para evitar la depleción de líquidos.
Formación de anticuerpos: La administración de SOLIQUA® puede provocar la formación de anticuerpos contra insulina glargina y lixisenatida. En casos raros, la presencia de tales anticuerpos puede necesitar del ajuste de la dosis de SOLIQUA® a fin de corregir la tendencia de hiperglucemia e hipoglucemia.
Evitar errores de medicación: Se debe indicar a los pacientes que siempre deben revisar la etiqueta de la pluma antes de cada inyección para evitar confusiones accidentales entre las dos potencias diferentes de SOLIQUA® y confusiones con otros medicamentos inyectables para la diabetes.
Para evitar errores de dosificación y una posible sobredosis, ni los pacientes ni los profesionales de la salud deben usar una jeringa para extraer el medicamento del cartucho de la pluma precargada en una jeringa.
Excipientes: Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, es decir, es esencialmente “libre de sodio”.
Este medicamento contiene metacresol, que puede causar reacciones alérgicas.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
No hay datos clínicos sobre los embarazos expuestos de los estudios clínicos controlados con el uso de SOLIQUA®, insulina glargina o lixisenatida.
Se desconoce el riesgo potencial para los humanos. SOLIQUA® no se deberá utilizar durante el embarazo.
Si una paciente desea embarazarse, o si ocurre el embarazo, se deberá suspender SOLIQUA®.
Los estudios de animales con lixisenatida o insulina glargina, no indican efectos directos nocivos en el embarazo.
Insulina glargina:
Una gran cantidad de datos en mujeres embarazadas (más de 1000 desenlaces de embarazos) con insulina glargina no indican efectos adversos específicos de insulina glargina en el embarazo ni malformaciones específicas, o toxicidad del feto o neonatal con insulina glargina. Los datos de animales no indican toxicidad reproductiva con insulina glargina.
Lixisenatida:
Los estudios en animales han mostrado toxicidad reproductiva (vea la sección Datos de seguridad preclínica).
Fertilidad:
Los estudios en animales con lixisenatida o insulina glargina no indican efectos negativos directos respecto a la fertilidad.
Mujeres en edad fértil:
SOLIQUA® no se recomienda en mujeres en edad fértil que no usan anticonceptivos.
Lactancia:
Se desconoce si SOLIQUA® se excreta en la leche humana. Debido a la falta de experiencia, SOLIQUA® no se deberá utilizar durante la lactancia.
No se prevén efectos metabólicos de la insulina glargina ingerida en los recién nacidos/bebés amamantados, ya que la insulina glargina, como péptido, se digiere en aminoácidos en el tracto gastrointestinal humano.
EFECTO EN LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS:
Conducción de un vehículo o realización de otras tareas peligrosas:
SOLIQUA® tiene una influencia nula o insignificante en la capacidad para conducir o utilizar máquinas. Sin embargo, la capacidad del paciente para concentrarse y reaccionar se puede deteriorar como resultado de, por ejemplo, la hipoglucemia o hiperglucemia o, por ejemplo, como resultado del deterioro visual. Esto puede constituir un riesgo en situaciones en las que estas capacidades sean de importancia especial (p. ej., conducir un auto u operar maquinaria).
Se deberá advertir a los pacientes que tomen precauciones para evitar la hipoglucemia mientras manejan. Esto es particularmente importante en aquellos en los que el conocimiento reducido o la falta de este sobre los síntomas de alerta de hipoglucemia, o que tengan episodios frecuentes de hipoglucemia. Se deberá tener prudencia al conducir en estas circunstancias.
REACCIONES ADVERSAS:
Reacciones y adversas:
Se utiliza siguiente calificación de frecuencia del CIOMS, cuando aplique:
Muy comunes ≥ 10%; comunes ≥ 1 y < 10%; poco comunes ≥ 0,1 y < 1%; raros ≥ 0,01 y < 0,1 %; muy raros < 0,01%; se desconoce (no se puede estimar con los datos disponibles).
Insulina glargina y lixisenatida:
Resumen del perfil de seguridad:
Los estudios clínicos fase 3 de SOLIQUA® incluyeron 834 pacientes tratados con SOLIQUA®.
Las reacciones adversas no deseables reportadas con mayor frecuencia con SOLIQUA® fueron hipoglucemia y reacciones adversas gastrointestinales (vea la sección Descripción de las reacciones adversas seleccionadas siguientes).
Lista tabulada de reacciones adversas
|
Sistema de clasificación de órganos |
Frecuencia |
|||
|
Muy comunes |
Comunes |
Poco comunes |
No conocida |
|
|
Infecciones e infestaciones |
Nasofaringitis Infección del tracto respiratorio superior |
|||
|
Trastornos del sistema inmunológico |
Urticaria |
|||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia |
|||
|
Trastornos del sistema nervioso |
Mareos |
Cefalea |
||
|
Trastornos gastrointestinales |
Náuseas Diarrea Vómitos |
Dispepsia Dolor abdominal |
||
|
Trastornos de la piel y del tejido subcutáneo |
Amiloidosis cutánea Lipodistrofia |
|||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones en el lugar de la inyección |
Fatiga |
||
Hipoglucemia:
Los ataques graves de hipoglucemia, especialmente si son recurrentes, pueden producir daño neurológico. Los episodios prolongados o graves de hipoglucemia pueden ser de riesgo para la vida.
En muchos pacientes, los signos y síntomas de neuroglucopenia son precedidos por signos de contrarregulación adrenérgica. En general, entre mayor y más rápida sea la disminución de glucosa en sangre, más notable es el fenómeno de contrarregulación y de sus síntomas.
Reacciones adversas sintomáticas o graves documentadas de hipoglucemia
|
Pacientes sin tratamiento previo con insulina |
Cambio de insulina basal |
Cambio desde un agonista del receptor GLP-1 |
|||||
|
SOLIQUA® |
Insulina glargina |
Lixisenatida |
SOLIQUA® |
Insulina glargina |
SOLIQUA® |
Insulina glargina |
|
|
N |
469 |
467 |
233 |
365 |
365 |
255 |
256 |
|
Hipoglucemia sintomática documentada* |
|||||||
|
Pacientes con evento, n (%) |
120 (25,6%) |
110 (23,6%) |
15 (6,4%) |
146 (40,0) |
155 (42,5) |
71 (27,8%) |
6 (2,3%) |
|
Eventos por paciente-año, n |
1,44 |
1,22 |
0,34 |
3,03 |
4,22 |
1,54 |
0,08 |
|
Hipoglucemia grave** |
|||||||
|
Eventos por paciente-año, n |
0 |
< 0,01 |
0 |
0,02 |
< 0,01 |
< 0,01 |
0 |
* La hipoglucemia sintomática documentada fue un evento en el que los síntomas típicos de hipoglucemia estuvieron acompañados de una concentración medida de glucosa en plasma ≤ 70 mg/dL (3.9 mmol/L).
** La hipoglucemia sintomática grave fue un evento que requirió de la ayuda de otra persona para administrar de forma activa carbohidratos, glucagón u otras acciones de resucitación.
Trastornos gastrointestinales: Las reacciones gastrointestinales adversas (náusea, vómito y diarrea) fueron reportadas con frecuencia durante el periodo de tratamiento. En pacientes tratados con SOLIQUA®, la incidencia de náusea, diarrea y vómito relacionados fue del 8,4%, 2,2% y 2,2%, respectivamente. Las reacciones gastrointestinales adversas fueron en su mayoría de naturaleza leve y transitoria. En los pacientes tratados con lixisenatida, la incidencia de náusea, diarrea y vómito relacionados fue del 22,3%, 3% y 3,9%, respectivamente.
Lipodistrofia: La administración subcutánea de productos inyectables que contienen insulina podría resultar en lipoatrofia (depresión en la piel) o lipohipertrofia (agrandamiento o engrosamiento del tejido) en el sitio de inyección. Los sitios de inyección se deberán rotar en la misma región (abdomen, muslos o deltoides) de una inyección a la otra para disminuir el riesgo de lipodistrofia.
Trastornos del sistema inmune:
Se han reportado reacciones alérgicas (urticaria) posiblemente relacionadas con SOLIQUA® en el 0,3% de los pacientes. Se han reportado de casos de reacción alérgica generaliza, incluida reacción anafiláctica y angioedema durante el uso de insulina glargina y lixisenatida comercializadas.
Inmunogenicidad: La administración de SOLIQUA® puede desencadenar la formación de anticuerpos antiinsulina glargina y/o antilixisenatida.
La incidencia de formación de anticuerpos antiinsulina glargina fue del 21,0% y 26,2%. En aproximadamente el 93% de los pacientes, los anticuerpos antiinsulina glargina mostraron una reactividad cruzada frente a la insulina humana. La incidencia de la formación de anticuerpos antilixisenatida fue del 43%, aproximadamente. Ni la presencia de anticuerpos antiinsulina glargina ni la de anticuerpos antilixisenatida tuvieron impacto clínicamente relevante en la seguridad y en la eficacia.
Transtornos de la piel y del tejido subcutáneo: Pueden producirse lipodistrofia y amiloidosis cutánea en el punto de inyección y retrasar la absorción local de insulina. La rotación continua del punto de inyección dentro de la zona de administración de la inyección puede ayudar a reducir o prevenir estas reacciones.
Reacciones en el sitio de inyección: Algunos pacientes con terapia de insulina, incluyendo SOLIQUA®, han experimentado eritema, edema local y prurito en el lugar de aplicación de la inyección. Estas condiciones normalmente fueron autolimitantes.
Frecuencia cardiaca: Se han notificado casos de aumento de la frecuencia cardiaca con el uso de agonistas del receptor GLP1, así como un aumento transitorio en algunos estudios con lixisenatida. No se ha observado un aumento de la media de la frecuencia cardiaca en ninguno de los estudios en fase 3 con SOLIQUA®.
Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones:
No se han realizado estudios de interacción con SOLIQUA®.
Varias sustancias afectan el metabolismo de glucosa y pueden requerir del ajuste de dosis de SOLIQUA®.
Insulina glargina:
Varias sustancias afectan el metabolismo de glucosa y pueden requerir del ajuste de dosis de insulina y particularmente de la monitorización estrecha.
Los siguientes son ejemplos de las sustancias que pueden aumentar el efecto hipoglucemiante en sangre y la susceptibilidad a la hipoglucemia:
Antidiabéticos orales, inhibidores de la ECA, salicilatos, disopiramida; fibratos; fluoxetina, inhibidores de la MAO; pentoxifilina; propoxifeno; y antibióticos sulfonamidas.
Los siguientes son ejemplos de sustancias que pueden reducir el efecto hipoglucemiante en sangre: corticosteroides; danazol; diazóxido; diuréticos; agentes simpaticomiméticos (tales como epinefrina [adrenalina], salbutamol, y terbutalina); glucagón; isoniazida; derivados de fenotiazina; somatropina; hormonas tiroideas; estrógenos, progestágenos (p. ej., anticonceptivos orales), inhibidores de la proteasa y medicamentos antipsicóticos atípicos (p. ej., olanzapina y clozapina).
Los bloqueadores beta, clonidina, sales de litio y alcohol pueden potenciar o debilitar el efecto hipoglucemiante en sangre de insulina. Pentamidina puede provocar hipoglucemia, que en ocasiones puede ser seguida por hiperglucemia.
Además, bajo la influencia de productos medicinales simpaticolíticos tales como bloqueadores beta, clonidina, guanetidina y reserpina, los signos de la contrarregulación adrenérgica se pueden reducir o estar ausentes.
Lixisenatida:
Lixisenatida es un péptido y no lo metaboliza el citocromo P450. En los estudios in vitro, lixisenatida no afectó la capacidad de las isoenzimas del citocromo P450 ni de los transportadores analizados.
Efecto del vaciamiento gástrico en los medicamentos orales:
Lixisenatida retrasa el vaciamiento gástrico que puede reducir la tasa de absorción de los medicamentos administrados por vía oral. Utilice con precaución cuando se administre de forma concomitante con medicamentos orales con una proporción terapéutica estrecha o que requieran de la monitorización clínica cuidadosa. Si tales medicamentos se administran con alimentos, se debe alertar a los pacientes que los tomen con alguna comida o colación cuando no se administre lixisenatida.
Los medicamentos orales que son particularmente dependientes en concentraciones umbrales para eficacia, tales como antibióticos, se deberán administrar al menos 1 hora antes o 4 horas después de la inyección de SOLIQUA®.
Las formulaciones gastrorresistentes que contienen sustancias sensibles a la degradación gástrica deben administrarse 1 hora antes o 4 horas después de la inyección de lixisenatida.
Paracetamol (acetaminofén):
Se utilizó como producto medicinal modelo para evaluar el efecto de lixisenatida en el vaciamiento gástrico. Lixisenatida 10 mcg no cambió la exposición total (AUC) de acetaminofén después de la administración de una dosis única de acetaminofén 1000 mg, ya sea antes o después de lixisenatida. No se observaron efectos en la Cmáx y tmáx de acetaminofén cuando se administró acetaminofén una hora antes de lixisenatida. Cuando se administró 1 a 4 horas después de 10 mcg de lixisenatida, la Cmáx de acetaminofén disminuyó en 29% y 31%, respectivamente, y la mediana de tmáx se retrasó en 2,0 y 1,75 horas, respectivamente.
Con base en estos resultados, no se requiere de ajuste de la dosis de acetaminofén, pero, cuando se requiere un inicio de acción rápido por temas de eficacia, debe tenerse en cuenta el retraso de la tmáx observado cuando se administra paracetamol entre 1 hora antes y 4 horas después de lixisenatida.
Anticonceptivos orales:
Después de la administración de una dosis única de algún producto anticonceptivo oral (etinilestradiol 0,03 mg/levonorgestrel 0,15 mg) 1 hora antes u 11 horas después de 10 mcg de lixisenatida, la Cmáx, AUC, t½ y tmáx de etinilestradiol y levonorgestrel no cambiaron.
La administración del anticonceptivo oral 1 o 4 horas después de lixisenatida no afectó el AUC ni la t½ de etinilestradiol y levonorgestrel, mientras que la Cmáx de etinilestradiol disminuyó en 52% y 39%, respectivamente, y la Cmáx de levonorgestrel disminuyó en 46% y 20%, respectivamente, y la mediana de la tmáx se retrasó en 1 a 3 horas.
Con base en estos resultados, no se requiere del ajuste de dosis de los anticonceptivos orales. Se recomienda administrar los anticonceptivos orales al menos 1 hora antes o al menos 11 horas después de la administración de SOLIQUA®.
Atorvastatina:
Cuando lixisenatida 20 mcg y atorvastatina 40 mg se administraron de forma concomitante en la mañana por 6 días, no se afectó la exposición de atorvastatina, aunque la Cmáx se disminuyó en 31 % y la tmáx se retrasó en 3,25 horas.
No se observó tal incremento para la tmáx cuando se administró atorvastatina en la noche y lixisenatida en la mañana, pero el AUC y la Cmáx de atorvastatina aumentaron en 27% y 66%, respectivamente.
Estos cambios no son clínicamente relevantes y, por lo tanto, no se requiere del ajuste de la dosis para atorvastatina cuando se administra de forma concomitante con SOLIQUA®. No obstante, debido al retraso en la tmáx, se deberá alertar a los pacientes que tomen atorvastatina al menos 1 hora antes u 11 horas después de la administración de SOLIQUA®.
Warfarina y otros derivados de cumarina:
Después de la administración concomitante de warfarina 25 mg con la administración repetida de lixisenatida 20 mcg, no hubo efectos en el AUC ni en la proporción normalizado internacional (INR), aunque la Cmáx se redujo en 19% y la tmáx se retrasó 7 horas.
Con base en estos resultados, no se requiere del ajuste de dosis para warfarina cuando se administra con SOLIQUA®; sin embargo, durante el inicio o el final del tratamiento con lixisenatida, se recomienda una monitorización frecuente del INR en pacientes tratados con warfarina y/o derivados de la cumarina.
Digoxina:
Después de la administración concomitante de lixisenatida 20 mcg y de digoxina 0,25 mg en estado de equilibrio, el AUC de digoxina no fue afectado. La tmáx de digoxina se retrasó 1,5 horas y la Cmáx se redujo en 26%.
Con base en estos resultados, no se requiere de ajuste de dosis para digoxina cuando se administra de forma concomitante con SOLIQUA®.
Ramipril:
Después de la administración concomitante de lixisenatida 20 mcg y ramipril 5 mg durante 6 días, el AUC de ramipril incrementó en 21%, mientras que la Cmáx se redujo en 63%. El AUC y la Cmáx del metabolito activo (ramiprilat) no fueron afectados. La tmáx de ramipril y de ramiprilat se retrasó en aproximadamente 2,5 horas.
Con base en estos resultados, no se requiere del ajuste de dosis de ramipril cuando se administre de forma concomitante con SOLIQUA®.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Datos de seguridad preclínica:
No se han conducido estudios en animales con la combinación de insulina glargina y lixisenatida para evaluar la carcinogenia, mutagenia o el deterioro de la fertilidad.
Insulina glargina:
Los datos preclínicos de insulina glargina no revelan peligro especial para humanos con base en los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetida, genotoxicidad, potencial carcinogénico, y toxicidad para la reproducción.
Lixisenatida:
En los estudios de carcinogenia subcutánea de 2 años, se observaron tumores de células T de tiroides no letales en ratas y ratones y se considera que pueden ser provocados por un mecanismo mediado por el receptor no genotóxico de GLP-1 al que los roedores son particularmente sensibles. Se observó hiperplasia de las células C y adenoma en todas las dosis en ratas y no se pudo definir un nivel sin efecto adverso observado (NOAEL). En ratones, estos efectos ocurrieron en una proporción de exposición por arriba de 9,3 veces cuando se compara con la exposición humana a la dosis terapéutica. No se observó carcinoma de células C en ratones y no ocurrió carcinoma de células C en ratas con una proporción de exposición relativa a la exposición a una dosis terapéutica humana de aproximadamente 900 veces. En un estudio de carcinogenicidad subcutánea, de 2 años de duración, en ratones, se observaron 3 casos de adenocarcinoma de endometrio en el grupo de dosis media, con un aumento estadísticamente significativo correspondiente a un nivel de exposición de 97 veces. No se demostró ningún efecto relacionado con el tratamiento.
Los estudios en animales no indicaron efectos nocivos directos respecto a la fertilidad de machos y hembras en ratas.
Se observaron lesiones reversibles testiculares y del epidídimo en perros tratados con lixisenatida. No se observó efecto relacionado a espermatogénesis en machos sanos. En los estudios de desarrollo embriofetal, se observaron malformaciones, retardo en el crecimiento, retardo en la osificación y efectos esqueléticos en ratas a todas las dosis (proporción de 5 veces la exposición en comparación con la exposición humana) y en conejos con dosis elevadas (proporción de 32 veces la exposición en comparación con la exposición humana) de lixisenatida. En ambas especies, hubo una toxicidad materna ligera que consistió en la reducción del consumo de alimentos y peso corporal disminuido.
El crecimiento neonatal se redujo en ratas macho expuestas a dosis de lixisenatida durante la gestación y la lactancia, observándose un ligero aumento en la mortalidad de las crías.
Incompatibilidades y compatibilidades:
Este producto medicinal no se debe mezclar con otros productos medicinales.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y administración:
SOLIQUA® es titulable y se encuentra disponible en dos plumas/lapiceras, que brindan diferentes opciones de dosificación. La diferenciación entre las concentraciones de las plumas/lapiceras se basa en el rango de dosis de la pluma/lapicera:
• SOLIQUA® 100 unidades/mL y 50 mcg/mL: pluma/lapicera de 10-40.
- 1 unidad de SOLIQUA® contiene una unidad de insulina glargina y 0,5 mcg de lixisenatida.
- Permite dosis diarias entre 10 y 40 unidades de SOLIQUA® (10 a 40 unidades de insulina glargina en combinación con 5 a 20 mcg de lixisenatida).
• SOLIQUA® 100 unidades/mL y 33 mcg/mL: pluma/lapicera de 30-60.
- 1 unidad de SOLIQUA® contiene 1 unidad de insulina glargina y 0,33 mcg de lixisenatida.
- Permite dosis diarias entre 30 y 60 unidades de SOLIQUA® (30 a 60 unidades de insulina glargina/10 a 20 mcg de lixisenatida).
Para evitar errores en la medicación, asegúrese de que la pluma/lapicera correcta de SOLIQUA®, pluma/lapicera de (10-40) o pluma/lapicera de (30-60) se indique en la formula médica. La dosis diaria máxima de SOLIQUA® es de 60 unidades de SOLIQUA® (60 unidades de insulina glargina y 20 mcg de lixisenatida).
SOLIQUA® se deberá administrar por vía subcutánea una vez al día durante la hora previa a cualquier comida. Es preferible que la inyección prandial de SOLIQUA® se realice antes de la misma comida diaria, cuando se haya elegido la comida más conveniente. Si se omite la dosis de SOLIQUA®, se deberá inyectar dentro de la hora previa a la próxima comida.
La dosis de SOLIQUA® se debe individualizar con base en la respuesta clínica y se titula con base en la necesidad de insulina del paciente. La dosis de lixisenatida se incrementa o se reduce junto con la dosis de insulina glargina y también depende de qué pluma/lapicera se utilice.
El ajuste de la dosis de SOLIQUA® en los pacientes debe hacerse bajo supervisión médica y con la monitorización adecuada de la glucosa (vea las secciones Advertencias y Precauciones).
Inicio de SOLIQUA®:
Dosis de inicio de SOLIQUA®:
El tratamiento con insulina basal o agonistas del receptor del péptido 1 similar al glucagón (GLP-1) o hipoglucemiantes orales distintos de metformina e inhibidores SGLT-2, se deben suspender antes del inicio del tratamiento con SOLIQUA®.
La dosis de inicio de SOLIQUA® se selecciona con base en el tratamiento previo contra la diabetes y a fin de no exceder la dosis de inicio recomendada de lixisenatida de 10 mcg:
Dosis de inicio de SOLIQUA®
|
Tratamiento previo |
|||||
|
Pacientes no tratados previamente con insulina (tratamiento con antidiabéticos orales o agonistas del receptor GLP-1) |
Insulina glargina (U 100)** < 20 unidades |
Insulina glargina (U 100)** ≥ 20 a < 30 unidades |
Insulina glargina (U 100)** ≥ 30 a ≤ 60 unidades |
||
|
Dosis de inicio y pluma/lapicera |
SOLIQUA® pluma/lapicera (10-40) |
10 unidades (10 U insulina glargina/5 mcg lixisenatida)* |
20 unidades (20 U insulina glargina/10 mcg lixisenatida)* |
||
|
SOLIQUA® pluma/lapicera (30-60) |
30 unidades (30 U insulina glargina/10 mcg lixisenatida)* |
||||
* Unidades de insulina glargina (100 unidades/mL)/mcg de lixisenatida.
** Si se tomó alguna insulina basal diferente.
• Para la insulina basal dos veces al día o insulina glargina U300-Toujeo®, la dosis total diaria que previamente se tomó se deberá reducir en 20% para elegir la dosis de inicio de SOLIQUA®.
• Para cualquier otra insulina basal en una dosis única al día, se deberá aplicar la misma regla que para la insulina glargina (U100).
Titulación de la dosis de SOLIQUA®:
SOLIQUA® se administrará de acuerdo a las necesidades individuales de insulina del paciente. Se recomienda optimizar el control glucémico mediante el ajuste de dosis basado en la monitorización de la glucosa plasmática en ayunas (vea la sección Eficacia clínica y Estudios clínicos).
Se recomienda la monitorización estrecha de glucosa durante el inicio y en las siguientes semanas.
• Si el paciente comienza con la pluma/lapicera de 10 - 40 de SOLIQUA®, la dosis se puede titular hasta una dosis máxima de 40 unidades/día con esta pluma/lapicera.
• Para dosis totales diarias > 40 unidades/día cambie a la pluma/lapicera de 30-60 de SOLIQUA®.
• Si el paciente usa la pluma/lapicera de 30-60 de SOLIQUA® la dosis se puede titular hasta una dosis máxima de 60 unidades/día con esta pluma/lapicera.
• Para dosis totales diarias > 60 unidades/día, no utilice SOLIQUA®.
Administración:
La administración es una inyección subcutánea en el abdomen, deltoides, o muslo. La velocidad de absorción, y por consecuencia el inicio de duración de acción, pueden verse afectados por el ejercicio y otras variables tales como estrés, enfermedad intercurrente o cambios en los medicamentos administrados de forma concomitante o régimen alimenticio.
Los sitios de inyección se deberán rotar dentro de la misma región (abdomen, muslo o deltoides) de una inyección a otra para disminuir el riesgo de lipodistrofia (vea Reacciones adversas).
Poblaciones especiales:
Niños:
La seguridad y la eficacia de SOLIQUA® en pacientes pediátricos menores de 18 años de edad no se ha establecido.
Ancianos (≥ 65 años de edad):
SOLIQUA® se puede utilizar en pacientes ancianos. La dosis se deberá ajustar de forma individual, con base en la monitorización de glucosa. La experiencia terapéutica en pacientes ≥ 75 años de edad es limitada.
Daño hepático:
El efecto del daño hepático en la farmacocinética de SOLIQUA® no se ha estudiado. Lixisenatida se depura principalmente a través del riñón, no se espera que la disfunción hepática afecte la farmacocinética de lixisenatida. En pacientes con daño hepático, los requisitos de insulina pueden disminuir debido a la capacidad reducida de gluconeogénesis y la disminución en el metabolismo de insulina. Puede ser necesaria la monitorización frecuente de glucosa y el ajuste de dosis para SOLIQUA® en pacientes con daño hepático.
Daño renal: No hay experiencia terapéutica con el uso de lixisenatida en pacientes con daño renal grave (depuración de creatinina < 30 mL/min) o enfermedad renal en etapa terminal y, por lo tanto, no se recomienda usar lixisenatida en estas poblaciones. En pacientes con deterioro renal, los requisitos de insulina pueden disminuir debido a la reducción en el metabolismo de insulina. Puede ser necesaria la monitorización frecuente de glucosa y el ajuste de dosis para SOLIQUA® en pacientes con daño renal.
MODO DE EMPLEO:
Preparación y manejo:
Inspeccione SOLIQUA® antes de cada uso. SOLIQUA® sólo se debe utilizar si la solución es clara, incolora, sin partículas visibles. Dado que SOLIQUA® es una solución, no requiere de la resuspensión antes de su uso.
Antes del primer uso, la pluma/lapicera se debe almacenar a temperatura ambiental por 1 a 2 horas.
SOLIQUA® no se debe mezclar con ninguna otra insulina ni diluir. La mezcla o dilución puede cambiar su perfil de tiempo y acción, y la mezcla puede provocar la precipitación.
Se debe adjuntar una aguja nueva antes de cada uso. Las agujas no se deben reutilizar. El paciente deberá descartar la aguja después de cada inyección.
En el caso de agujas bloqueadas, los pacientes deben seguir las especificaciones descritas en las Instrucciones para su uso que acompañan el prospecto del envase.
Nunca se deben reutilizar las plumas/lapiceras vacías y se deben descartar de forma adecuada.
Para evitar la posible transmisión de enfermedades, cada pluma/lapicera debe ser utilizada únicamente por un paciente.
La etiqueta siempre se debe verificar antes de cada inyección para evitar errores en la medicación entre SOLIQUA® y otros productos medicinales hipoglucemiantes inyectables, incluidas las 2 diferentes plumas/lapiceras de SOLIQUA® (vea la sección Administración).
Antes de usar SOLIQUA®, se deben leer cuidadosamente las instrucciones para su uso incluidas en el prospecto del envase.
Fabricado por:
Sanofi-Aventis Deutschland GmbH,
Industriepark Höchst, Brüningstraße 50, D-65926 Frankfurt am Main, Alemania.
Revisión local:
Julio de 2021.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis:
Signos y síntomas: Hay datos clínicos limitados disponibles respecto a la sobredosis de SOLIQUA®.
Se pueden desarrollar hipoglucemia y reacciones adversas gastrointestinales si un paciente recibe más SOLIQUA® del requerido.
Insulina glargina: Un exceso de insulina, relativa a la ingesta de alimentos, gasto de energía o ambos, puede producir hipoglucemia grave y en algunos casos prolongados de riesgo para la vida.
Lixisenatida: Durante los estudios clínicos, se administraron dosis hasta de 60 mcg de lixisenatida a pacientes con diabetes tipo 2 en un estudio de 13 semanas. Fueron bien toleradas y sólo se observó un aumento en la incidencia de trastornos gastrointestinales.
Manejo:
Insulina glargina:
Los episodios leves de hipoglucemia usualmente pueden ser tratados con carbohidratos orales. Los ajustes en la dosis del medicamento, régimen de comidas, o ejercicio pudieran ser necesarios.
Los episodios más graves que culminaron en coma, convulsiones, o deterioro neurológico pueden ser tratados con glucagón intramuscular o subcutáneo, o con glucosa intravenosa concentrada. Puede ser necesaria la ingesta sostenida de carbohidratos y la observación ya que la hipoglucemia pudiera recurrir después de la recuperación clínica aparente.
El tratamiento de apoyo adecuado se deberá iniciar según los signos y síntomas clínicos del paciente, y la dosis de SOLIQUA® se deberá reducir a la dosis prescrita.
En el caso de reacciones adversas gastrointestinales, debe iniciarse tratamiento de soporte apropiado en función de los signos y síntomas clínicos del paciente.
CLASIFICACIÓN:
Clase terapéutica o farmacológica:
Código ATC: A10AE54. (Medicamentos antidiabéticos, insulinas y análogos de acción prolongada inyectables).
DESCRIPCIÓN:
Fracciones activas/ingredientes activos:
Insulina glargina:
Análogo de insulina humana recombinante.
(21A-Gli-30Ba-L-Arg-30Bb-L-Arg-insulina humana).
La insulina glargina es producida mediante tecnología ADN recombinante que utiliza Escherichia coli (cepa K12) como el organismo de producción.
La insulina glargina tiene la siguiente fórmula estructural:
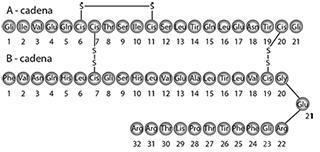
Lixisenatida:
Péptido que contiene 44 aminoácidos, que se amida en terminal C del aminoácido (posición 44). El orden de los aminoácidos se proporciona en la siguiente figura. Su peso molecular es de 4858,5 y la fórmula empírica es C215H347N61O65S con la siguiente estructura química:
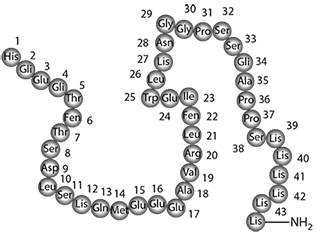
Lixisenatida es un polvo amorfo, higroscópico, blanco a blanquecino.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Naturaleza y contenido del envase:
Pluma/lapicera desechable (3 ml).
Cartucho de vidrio de 3 mL ensamblado en una pluma/lapicera prellenada/precargada.
Cada ml de SOLIQUA® en jeringa precargada de 10-40 contiene 100 unidades de insulina glargina y 50 mcg de lixisenatida.
Una pluma/lapicera precargada contiene 3 mL equivalentes a 300 unidades de insulina glargina y 150 mcg de lixisenatida.
Una unidad de SOLIQUA® contiene 1 unidad de insulina glargina y 0,5 mcg de lixisenatida.
Cada mL de SOLIQUA® pluma/lapicera precargada de 30-60 contiene 100 unidades de insulina glargina y 33 mcg de lixisenatida.
Una pluma/lapicera precargada contiene 3 mL equivalentes a 300 unidades de insulina glargina y 100 mcg de lixisenatida.
Una unidad de SOLIQUA® contiene una unidad de insulina glargina y 0,33 mcg de lixisenatida.
Condiciones de almacenamiento y vida de anaquel:
Dos años.
Vida de anaquel después del primer uso de la pluma/lapicera: 14 días.
Plumas/lapiceras no abiertas (no en uso):
Almacene en un refrigerador (2 °C a 8 °C).
No congele ni coloque cerca del compartimento del congelador ni de un paquete del congelador.
Mantenga la pluma/lapicera precargada en la caja de cartón a fin de protegerla de la luz.
Plumas/lapiceras abiertas (en uso):
Almacene por debajo de 30 °C. No refrigere.
No congele.
No almacene con la aguja adjunta.
Almacene la pluma/lapicera lejos del calor o luz directa. La tapa de la pluma/lapicera se debe poner de vuelta en la pluma/lapicera después de cada inyección a fin de protegerla de la luz.
REFERENCIAS:
Referencias bibliográficas:
1 Module 2.3.P, Drug Product, section 2.3.P.1 Description and composition of the drug product (insulin glargine/lixisenatide), solution for injection – Table 1 Composition of insulin glargine / lixisenatide solution for injection 100 U/mL insulin glargine with 50 or 33 μg/mL lixisenatide
2 Module 2.5 CO section 1.2.1.4 Dosing Concept
3 CSR EFC12405 section 8.4.5 selection of doses in the study
4 Lixisenatide CCDS V5
5 Module 2.5 Clinical Overview section 1.2.1.4
6 Insulin glargine CCDS V18
7 Module 2.7.3 Summary of Clinical Efficacy, Summary of Clinical Efficacy, section 1.6.2.2.1.2 Titration
8 Module 5.3.5.1 Study EFC12404 16.1.1 Protocol, section 8.2.4.1.1 In both groups
9 Module 5.3.5.1 Study EFC12404 16.1.1 Protocol, section 7.2.1 Exclusion criteria related to study methodology
10 Module 5.3.5.1 Study EFC12405 16.1.1 Protocol, section 7.2.1 Exclusion criteria related to study methodology
11 Module 2.7.4 Summary of Clinical Safety, section 2.6.1.1 Phase 2/3, Phase 3 study pools, and Study EFC12404 - Table 13 - Demographics and baseline characteristics in Phase 2/3 and Phase 3 study pools and in Study EFC12404 – Safety population
12 Module 2.7.2 Summary of Clinical Pharmacology, section 1.1.4 Lixisenatide monotherapy studies - Pharmacokinetics and pharmacodynamics
13 Insulin glargine CCDS V18
14 Lixisenatide CCDS V5
15 Module 1.11.4; Lixisenatide PI submitted July 2015, section 8.8 Patients with Gastroparesis
16 Module 2.7.4, Summary of Clinical Safety; section 5.1.1. Phase 3 controlled study pool and Study EFC12404
17 Module 2.7.3 Summary of Clinical Efficacy, section 1.6.2.5 Selection of patient population
18 Module 2.7.3 Summary of Clinical Efficacy, section 1.6.2.5 Selection of patient population
19 ISS table 1.5.2.50 (related events)
20 Module 2.7.4 Summary of Clinical Safety, section 3.1 Study EFC12404 - Table 16 - Summary of symptomatic hypoglycemia recorded on the dedicated eCRF and meeting the protocol definition during the on-treatment period in Study EFC12404 – Safety population
21 Module 2.7.4 Summary of Clinical Safety, section 3.1 Study EFC12404 - Table 16 - Summary of symptomatic hypoglycemia recorded on the dedicated eCRF and meeting the protocol definition during the on-treatment period in Study EFC12404 – Safety population
22 Module 2.7.4 Summary of Clinical Safety, section 3.2 Study EFC12405 - Table 18 - Summary of symptomatic hypoglycemia recorded on the dedicated eCRF and meeting the protocol definition during the on-treatment period in Study EFC12405 – Safety population
23 Module 2.7.4 Summary of Clinical Safety, section 3.2 Study EFC12405 - Table 18 - Summary of symptomatic hypoglycemia recorded on the dedicated eCRF and meeting the protocol definition during the on-treatment period in Study EFC12405 – Safety population
24 Percentages from ISS table 1.5.2.50 (related events)
25 ISS, table 1.5.7.1 and 1.5.7.2
26 Module 2.5 Clinical Overview, section 1.2.1 Rationale for the indication of interest
27 Module 2.7.2 Summary of Clinical Pharmacology, section 3.6.3.1.1 Definitive study BDR10880
28 Module 5.3.5.1 Clinical Study Report EFC12404, section 8.4.6 Selection and timing of dose for each patient – Table 1 Dose adjustment algorithm
29 Module 5.3.5.1 Clinical Study Report EFC12405, section 8.4.6.2 Open-label randomized treatment period – Table 1 Dose adjustment algorithm
30 CSR EFC12404 (LixiLan O)
31 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.2 Primary endpoint: change from baseline to Week 30 in HbA1c – Table 3 Study EFC12404: Mean change in HbA1c (%) from baseline to week 30 using MMRM – mITT population
32 Module 5.3.5.1 Clinical Study Report EFC12404 section 10.1.1. Primary analysis – Table 15 Mean change in HbA1c (%) from baseline to Week 30 using MMRM – mITT population
33 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.3 Secondary endpoint – Table 4 Study EFC12404: Number (%) of patients with HbA1c value <7.0% or ≤6.5% at Week 30 mITT population
34 Module 2.7.3 Clinical Summary of Efficacy section, 2.2.1.3 Secondary endpoints – Table 7 EFC12404: Mean change in fasting plasma glucose (mg/dL) from baseline to Week 30 using MMRM – mITT population
35 For mmol/L: table 16.2.6.2.10 in 404
36 Module 5.3.5.1 Clinical Study Report EFC12404, section 10.2.4 Fasting plasma glucose
37 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.3 Secondary endpoints (subsection: Prandial glucose control during a standardized breakfast meal)
38 Module 2.7.3 Clinical Summary of Efficacy section 2.2.1.3 Secondary endpoints – Table 5 Study EFC12404: Mean change in 2-hour plasma glucose excursions (mg/dL) during a standardized meal test from baseline to Week 30 using ANCOVA – mITT population
39 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.3 Secondary endpoints – Table 6 Study EFC12494: Mean body weight (kg) from baseline to Week 30 using MMRM – mITT population
40 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.3 Secondary endpoints – Table 8 Study EFC12404: Number (%) of patients reaching HbA1c <7.0% with no body weight gain at Week 30 – mITT population
41 Module 5.3.5.1 Clinical Study Report EFC12404 section 10.2.6.1. Patients reaching HbA1c <7% with no body weight gain at Week 30 – Table 24 Number (%) of patients reaching HbA1c <7% with no body weight gain at Week 30 – mITT population
42 Module 5.3.5.1 Clinical Study Report EFC12404 section 10.2.6.1. Patients reaching HbA1c <7% with no body weight gain at Week 30 – Table 24 Number (%) of patients reaching HbA1c <7% with no body weight gain at Week 30 – mITT population
43 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.3 Secondary endpoints (subsection: Insulin glargine dose)
44 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.2 Primary endpoint: change from baseline to Week 30 in HbA1c - Figure 8 Study EFC12404: Mean HbA1c (%) by visit during the study period – mITT population
45 Module 5.3.5.1 Clinical Study Report EFC12404 16.2.6 Efficacy response data, section 16.2.6.2.54 Mean change in average 7-point SMPG in conventional unit (mg/dL) from baseline to Week 30 using MMRM - mITT population.
46 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.1.3 Secondary endpoints (subsection: Change in the daily average of the 7-point SMPG from baseline to Week 30)
47 Module 5.3.5.1 Clinical Study Report EFC12404, section 10.2.5 Seven-point self- monitored glucose profiles
48 CSR EFC12405 (LixiLan L)
49 Module 5.3.5.1 Clinical Study Report EFC12405
50 Module 2.7.3 Clinical Summary of Efficacy
51 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.2 Primary endpoint: change from baseline to Week 30 in HbA1c – Table 14 Study EFC12405: Mean change in HbA1c (%) from baseline to Week 30 using MMRM – mITT population
52 Module 5.3.5.1 Clinical Study Report EFC12405, section 9.3 Data sets analyzed – Table 11 Analysis populations – Randomized Population
53 Module 5.3.5.1 Clinical Study Report EFC12405, section 10.1.1 Primary analysis
54 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.3 Secondary endpoints. (subsection: Proportion of responders with HbA1c <7% or ≤6.5% at Week 30)
55 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.3 Secondary endpoints – Table 20 Study EFC12405: Mean change in fasting plasma glucose (mg/dL) from baseline to Week 30 using MMRM - mITT population. (subsection: Fasting plasma glucose)
56 Module 5.3.5.1 Clinical Study Report EFC12405, section 10.2.2 Prandial glycemic control during a standardized meal test
57 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.3 Secondary endpoints. (subsection: Prandial glucose control during a standardized meal
58 For mmol/L: CSR appendix table 16.2.6.2.1 and .10
59 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.3 Secondary endpoints] (subsection: Change in body weight from baseline to Week 30)
60 Module 5.3.5.1 Clinical Study Report EFC12405, section 10.2.3 Body weight – Table 22 Mean change in body weight (kg) from baseline to Week 30 using MMRM - mITT population
61 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.3 Secondary endpoints – Table 17 Study EFC12405: Number (%) of patients reaching HbA1c <7.0% with no body weight gain at Week 30 – mITT population
62 Module 5.3.5.1 Clinical Study Report EFC12405, section 10.2.5.1 Percentage of patients reaching HbA1c <7% with no body weight gain at Week 30 – Table 24 Number (%) of patients reaching HbA1c <7% with no body weight gain at Week 30 - mITT population
63 Module 5.3.5.1 Clinical Study Report EFC12405, section 10.2.6.1 Insulin glargine dose at Week 30 – Table 27 Mean change in daily insulin glargine dose (U) from baseline to Week 30 using MMRM - mITT population]
64 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.3 Secondary endpoints. (subsection: insulin glargine dose)
65 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.3 Secondary endpoints. (subsection: insulin glargine dose)
66 Module 2.7.3 Clinical Summary of Efficacy, section 2.2.2.2 Primary endpoint: change from baseline to Week 30 in HbA1c – Figure 13 Study EFC12405: Mean HbA1c (%) by visit – mITT population
67 Insulin glargine CCDS V18 (Study 4032 (ORIGIN) CSR)
68 Lixisenatide CCDS V5 (CSR EFC11319. A randomized, double-blind, placebo- controlled, parallel-group, multicenter study to evaluate cardiovascular outcomes during treatment with lixisenatide in type 2 diabetic patients after an Acute Coronary Syndrome event.-Jun-2015.)
69 Module 2.7.2 Summary of Clinical Pharmacology, section 3.1.1 Single dose pharmacokinetics
70 Module 2.7.2 Summary of Clinical Pharmacology, section 3.7 Pharmacokinetic/Pharmacodynamic relationships
71 Module 2.7.2 Summary of Clinical Pharmacology, section 3.3.1 Absorption, Distribution, Elimination, and Metabolism
72 Module 2.7.2 Summary of Clinical Pharmacology, section 3.2.1 Single Dose Pharmacokinetics
73 Module 1.11.4; Lixisenatide PI submitted July 2015, section 12.3 Pharmacokinetics
74 Module 2.6.6. Nonclinical Toxicology Written Symmary, section 5 Carcinogenicity (including supportive toxicokinetics evaluations
75 Module 2.6.6. Nonclinical Toxicology Written Summary, section 4 Genotoxicity
76 Module 2.6.6 Nonclinical Toxicology Written Summary, section 6 Reproductive and Developmental Toxicity including range-finding studies and supportive toxicokinetics evaluations
77 Module 3.2.P Drug Product, section 3.2.P.8.1 Stability summary and conclusions, Section 1
78 Module 3.2.P Drug Product, section 3.2.P.8.1 Stability summary and conclusions, Section 1
79 Agencia Europea de Medicamentos (EMA) – Resumen de las Características del Producto. SULIQUA. Fecha de última actualización 10/08/2020. Disponible en: https://www.ema.europa.eu/en/documents/product-information/suliqua-epar-product-information_es.pdf