
VALDYNE
CELECOXIB
Cápsulas duras
Cápsulas duras, 200 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada CÁPSULA de 200 mg contiene 200 mg de celecoxib.
FORMA FARMACÉUTICA: Cápsulas duras para uso oral.
Cápsulas de 200 mg: Cápsulas opacas, blancas con una banda dorada marcadas con los números 7767 y 200.
INDICACIONES TERAPÉUTICAS:
Tratamiento sintomático de la osteoartritis y artritis reumatoide.
Manejo del dolor agudo.
Tratamiento de la dismenorrea primaria.
Alivio de los signos y síntomas de la artritis idiopática juvenil en pacientes de 2 años y mayores con un peso corporal igual o mayor a 10 kg.
PARTICULARIDADES FARMACÉUTICAS:
Estructura y nombre químico del principio activo: 4-[5-(4-metilfenil)-3-(trifluorometil) pirazol-1-il]benzeno sulfonamida.
PROPIEDADES FARMACOCINÉTICAS:
Grupo farmacoterapéutico: Coxibs M01AH.
El mecanismo de acción de celecoxib es por medio de la inhibición de la síntesis de prostaglandina, principalmente por la inhibición de la ciclooxigenasa 2 (COX-2). A concentraciones terapéuticas en los seres humanos, el celecoxib no inhibe la ciclooxigenasa 1 (COX-1). La COX-2 es inducida en respuesta a los estímulos inflamatorios. Esto conduce a la síntesis y acumulación de prostanoides inflamatorios, en particular la prostaglandina E2, causando inflamación, edema y dolor. El celecoxib actúa como un agente analgésico, antiinflamatorio y antipirético en modelos animales, bloqueando la producción de prostanoides inflamatorios por medio de la inhibición de la COX-2. En modelos animales con tumor en el colon, el celecoxib redujo la incidencia y multiplicidad de los tumores.
Los estudios in vivo y ex vivo muestran que el celecoxib tiene una afinidad muy baja por la enzima ciclooxigenasa 1 (COX-1) expresada constitutivamente. En consecuencia, a dosis terapéuticas, el celecoxib no tiene efectos sobre los prostanoides sintetizados por la activación de la COX-1, por lo tanto, no interfiere en los procesos fisiológicos normales relacionados con la COX-1 en los tejidos, particularmente el estómago, intestino y plaquetas.
Estudios clínicos:
Osteoartritis (OA): El celecoxib ha demostrado una reducción significativa en el dolor articular, en comparación con placebo. El celecoxib fue evaluado para el tratamiento de los signos y los síntomas de la OA de la rodilla y cadera en aproximadamente 4.200 pacientes en ensayos clínicos controlados con placebo y activos hasta de 12 semanas de duración. En pacientes con OA, el tratamiento con celecoxib de 100 mg dos veces al día o 200 mg una vez al día, produjo una mejoría en el índice de osteoartritis de WOMAC (Universidades de Western Ontario y McMaster), un compuesto del dolor, rigidez y medidas funcionales en la OA. En tres estudios de 12 semanas para evaluar el dolor acompañado de crisis de OA, las dosis de celecoxib de 100 mg dos veces al día y 200 mg dos veces al día, proporcionaron una reducción significativa del dolor en el lapso de 24 a 48 horas de inicio de la dosificación. A dosis de 100 mg dos veces al día o 200 mg dos veces al día, la eficacia de celecoxib mostró ser similar a naproxeno en dosis de 500 mg dos veces al día. Las dosis de 200 mg dos veces al día no proporcionaron beneficios adicionales superiores a los observados con 100 mg dos veces al día. Una dosis diaria total de 200 mg ha mostrado ser equivalentemente eficaz administrada a 100 mg dos veces al día o 200 mg una vez al día.
Artritis reumatoide (AR): El celecoxib ha demostrado una reducción significativa en la sensibilidad articular/dolor e inflamación de las articulaciones, en comparación con placebo. El celecoxib fue evaluado para el tratamiento de los signos y síntomas de la AR en aproximadamente 2100 pacientes, en ensayos clínicos controlados con placebo y activos hasta de 24 semanas de duración. El celecoxib mostró ser superior a placebo en estos estudios, utilizando el Índice de Respuesta ACR20, un compuesto de las medidas clínicas, de laboratorio y funcionales en AR. Las dosis de celecoxib de 100 mg dos veces al día y 200 mg dos veces al día fueron similares en efectividad y ambas comparables con 500 mg de naproxeno dos veces al día.
Aunque el celecoxib en dosis de 100 mg dos veces al día y 200 mg dos veces al día proporcionó una eficacia general similar, algunos pacientes derivaron beneficios adicionales de la dosificación diaria de 200 mg dos veces al día. Dosis de 400 mg dos veces al día no proporcionaron ningún beneficio adicional sobre los observados con 100-200 mg dos veces al día.
Artritis idiopática juvenil (AIJ): En un estudio de 12 semanas, aleatorio, doble ciego, controlado con medicamento activo, de grupos paralelos, multicéntrico, de no inferioridad, 242 pacientes, de 2 a 17 años de edad con AIJ oligoarticular, oligoarticular extendida o poliarticular (factor reumatoide positivo o negativo) y en pacientes con AIJ de inicio sistémico (con características sistémicas actualmente inactivas), recibieron los siguientes tratamientos: Celecoxib 3 mg/kg (hasta un máximo de 150 mg) dos veces al día; celecoxib 6 mg/kg (hasta un máximo de 300 mg) dos veces al día; naproxeno 7.5 mg/kg (hasta un máximo de 500 mg) dos veces al día. Las tasas de respuesta se basaron en el criterio ACR30 pediátrico, que es un compuesto de medidas clínicas, de laboratorio y funcionales de la AIJ.
Las tasas de respuesta a la semana 12, empleando el ACR30 pediátrico, fueron: 69%, 80% y 67% en los grupos de tratamiento de celecoxib 3 mg/kg, celecoxib 6 mg/kg, y naproxeno, respectivamente, demostrando la no inferioridad de ambas dosis en relación a naproxeno. Se observó la persistencia del efecto del tratamiento durante una extensión abierta de 12 semanas al estudio doble ciego de 12 semanas, en la que 202 pacientes recibieron celecoxib 6 mg/kg hasta un máximo de 300 mg dos veces al día.
No se ha estudiado la eficacia ni la seguridad de celecoxib en la AIJ por más de 6 meses. No se ha evaluado la toxicidad cardiovascular a largo plazo en niños expuestos a celecoxib y no se sabe si el riesgo a largo plazo puede ser similar a lo observado en adultos expuestos a celecoxib o a otros AINEs no selectivos y selectivos de la COX-2. (Ver Advertencias y precauciones especiales para su uso: Efectos cardiovasculares).
Analgesia, incluyendo dismenorrea primaria: En los modelos analgésicos agudos de dolor posquirúrgico oral, dolor quirúrgico post-ortopédico y dismenorrea primaria, el celecoxib alivió el dolor que fue evaluado por los pacientes como moderado a severo. Dosis únicas (Véase Posología y método de administración) de celecoxib proporcionaron un alivio del dolor en el lapso de 60 minutos.
Espondilitis anquilosante (EA): Celecoxib se evaluó en pacientes con EA en dos estudios clínicos controlados con placebo y con producto activo (naproxeno o ketoprofeno) de 6 y 12 semanas de duración. En dosis de 100 mg dos veces al día, 200 mg una vez al día y 400 mg una vez al día, se mostró que celecoxib era estadísticamente superior al placebo en estos estudios para las tres medidas de eficacia primarias que valoraban la intensidad global del dolor (Escala Análoga Visual), la actividad global de la enfermedad (Escala Análoga Visual) y el daño funcional (Índice Funcional de Espondilitis anquilosante de Bath). En el estudio de 12 semanas no hubo diferencia en el grado de mejoría entre las dosis de 200 mg y 400 mg de celecoxib en una comparación del cambio promedio con respecto a los parámetros basales, pero hubo un mayor porcentaje de pacientes con respuesta a celecoxib 400 mg, 53%, que a celecoxib 200 mg, 44%, según los criterios de respuesta de la Valoración de Espondilitis anquilosante (ASAS 20). La ASAS 20 define al sujeto con respuesta como aquel con mejoría de por lo menos 20% con respecto al valor basal y una mejoría absoluta de por lo menos 10 mm en una escala de 0 a 100 mm, por lo menos en tres de los cuatro dominios siguientes: dolor global del paciente, Índice Funcional de Bath para Espondilitis anquilosante e inflamación. El análisis de sujetos con respuesta tampoco demostró cambios en los índices de respuesta después de 6 semanas.
Poliposis adenomatosa familiar (PAF): El celecoxib fue evaluado para la regresión y reducción en el número de pólipos colorrectales adenomatosos, los cuales podrían conducir al desarrollo de cáncer colorrectal en pacientes con poliposis adenomatosa familiar (PAF), como un adjunto para el cuidado usual (es decir, supervisión endoscópica, cirugía). En un ensayo aleatorizado, a doble ciego, controlado con placebo de 6 meses de duración, el celecoxib a dosis de 400 mg dos veces al día mostró ser estadísticamente superior a placebo, según medición por una reducción porcentual en el número de pólipos colorrectales (p = 0.003) y en la carga de pólipos, lo cual constituye la suma de los diámetros de los pólipos (p = 0.001). Además, el celecoxib demostró una superioridad clínica y estadística (p < 0.04) en la mejora endoscópica general en el colon, recto y duodeno. El celecoxib fue efectivo y bien tolerado a una dosis de 400 mg dos veces al día. Las figuras 1 y 2, y la Tabla 1 resumen estos datos.
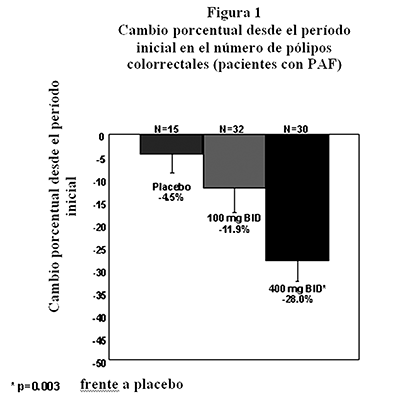
|
Tabla 1 Cambio porcentual medio en las variables de eficacia en los pacientes con PAF* |
|||
|
Placebo N = 15 |
Celecoxib 100 mg 2 veces al día N = 32 |
Celecoxib 400 mg |
|
|
Numero de Pólipos |
-4.5% |
-11.9% |
28.0%* |
|
Carga de Pólipos |
-4.9% |
-14.6% |
-30.7%* |
|
% de Respuesta: |
6.7% |
31.2% |
53.3%* |
|
? 25% Reducción en el número de pólipos |
|||
|
* Pacientes con pólipos colorrectales. * p = 0.003 frente a placebo. |
|||
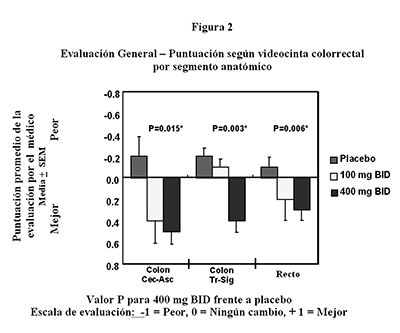
El perfil de eventos adversos reportado para los pacientes en este ensayo de PAF fue similar al reportado para los pacientes en los ensayos controlados de artritis.
Información adicional originada de ensayos clínicos:
Estudios endoscópicos: Se efectuaron evaluaciones endoscópicas GI superiores programadas en más de 4.500 pacientes con artritis que fueron reclutados en cinco ensayos clínicos controlados, aleatorizados, de 12-24 semanas de duración utilizando comparadores activos, dos de los cuales también incluyeron controles con placebo. No hubo ninguna relación consistente entre la incidencia de úlceras gastroduodenales y la dosis de celecoxib sobre el rango estudiado.
La Tabla 2 resume la incidencia de úlceras endoscópicas en dos estudios de 12 semanas de duración que reclutaron pacientes en los cuales las endoscopias iniciales no revelaron úlceras.
|
Tabla 2. Incidencia de úlceras gastroduodenales en los estudios endoscópicos de pacientes con OA y AR |
||
|
Estudios de 3 meses |
||
|
Estudio 1 (n = 1108) |
Estudio 2 (n= 1049) |
|
|
Placebo |
2.3% (5/217) |
2.0% (4/200) |
|
Celecoxib de 50 mg dos veces al día |
3.4% (8/233) |
--- |
|
Celecoxib de 100 mg dos veces al día |
3.1% (7/227) |
4.0% (9/223) |
|
Celecoxib de 200 mg dos veces al día |
5.9% (13/221) |
2.7% (6/219) |
|
Celecoxib de 400 mg dos veces al día |
--- |
4.1% (8/197) |
|
Naproxeno de 500 mg dos veces al día |
16.2% (34/210)* |
17.6% (37/210)* |
|
*p ? 0.05 frente a todos los otros tratamientos |
||
La Tabla 3 resume la información proveniente de dos estudios de 12 semanas de duración que reclutaron pacientes en quienes las endoscopias del periodo inicial no revelaron úlceras. A los pacientes se les realizaron endoscopias cada 4 semanas, con el fin de obtener información sobre el riesgo de úlcera en el transcurso del tiempo.
|
Tabla 3 Incidencia de úlceras gastroduodenales provenientes de estudios endoscópicos en series de 3 meses en pacientes con OA y AR |
||||
|
Semana 4 |
Semana 8 |
Semana 12 |
Final |
|
|
Estudio 3 (n = 523) |
||||
|
Celecoxib 200 mg dos veces al día |
4.0% (10/252)* |
2.2% (5/227)* |
1.5% (3/196)* |
7.5% (20/266)* |
|
Naproxeno 500 mg dos veces al día |
19.0% (47/247) |
14.2% (26/182) |
9.9% (14/141) |
34.6% (89/257) |
|
Estudio 4 (n =1062) |
||||
|
Celecoxib 200 mg dos veces al día |
3.9% (13/337) † |
2.4% (7/296) † |
1.8% (5/274) † |
7.0% (25/356) † |
|
Diclofenaco 75 mg dos veces al día |
5.1% (18/350) |
3.3% (10/306) |
2.9% (8/278) |
9.7% (36/372) |
|
Ibuprofeno 800 mg tres veces al día |
13.0% (42/323) |
6.2% (15/241) |
9.6% (21/219) |
23.3% (78/334) |
|
*p? 0.05 celecoxib frente a naproxeno con base en los análisis de intervalo y acumulativos †p? 0.05 celecoxib frente a ibuprofeno con base en los análisis de intervalo y acumulativos |
||||
Se realizó un estudio aleatorizado, a doble ciego, de 6 meses de duración en 430 pacientes con AR, durante el cual se efectuó un examen endoscópico a los 6 meses.
La incidencia de úlceras endoscópicas en los pacientes que tomaron celecoxib de 200 mg dos veces al día fue 4% frente a 15% para los pacientes que tomaron diclofenaco (SR) de liberación prolongada 75 mg dos veces al día (p < 0.001).
En 4 de 5 estudios endoscópicos, aproximadamente 11% de los pacientes (440/4.000) estaban tomando aspirina (? 325 mg/día). En los grupos de celecoxib, la tasa de úlceras endoscópicas pareció ser más alta en los usuarios de aspirina que en los no usuarios. Sin embargo, la tasa incrementada de úlceras en estos usuarios de aspirina fue menor que las tasas de úlceras endoscópicas observadas en los grupos del comparador activo, con o sin aspirina.
La correlación entre los hallazgos de los estudios endoscópicos y la incidencia relativa de eventos GI superiores serios clínicamente significativos no ha sido establecida. Se ha observado sangrado GI superior serio, clínicamente significativo, en pacientes que recibieron celecoxib en ensayos controlados y de diseño abierto, aunque con poca frecuencia (Véase Advertencias especiales y precauciones especiales para uso, Efectos GI).
Metaanálisis de seguridad gastrointestinal de los estudios de osteoartritis y artritis reumatoide: Un análisis de 31 estudios clínicos aleatorizados controlados en osteoartritis y artritis reumatoide, con la participación de 39.605 pacientes con osteoartritis (N = 25.903), artritis reumatoide (N = 3.232) o pacientes con cualquier condición (N = 10.470) compararon la incidencia de eventos GI adversos en los pacientes tratados con placebo o AINES (incluyendo naproxeno, diclofenaco e ibuprofeno). La incidencia de úlceras clínicas y sangrados por úlceras con la dosis diaria total de celecoxib de 200 – 400 mg fue de 0.2%, en comparación con una incidencia de 0.6% con respecto a los AINES (RR = 0.35; intervalo de confianza de 95% - 0.22 – 0.56).
Uso con aspirina: El estudio de seguridad a largo plazo de celecoxib en artritis (CLASS) fue un estudio de resultados de seguridad, prospectivo, a largo plazo, realizado posterior a la comercialización en aproximadamente 5.800 pacientes con OA y 2.200 pacientes con AR. Los pacientes recibieron celecoxib de 400 mg dos veces al día (4 y 2 veces la dosificación recomendada para OA y AR, respectivamente y la dosis aprobada para PAF), ibuprofeno de 800 mg tres veces al día o diclofenaco de 75 mg dos veces al día (dosis terapéuticas comunes). Las exposiciones medianas para celecoxib (n = 3.987) y diclofenaco (n = 1.996) fueron de 9 meses, mientras que para ibuprofeno (n = 1.985) de 6 meses. Se proporcionaron las tasas acumulativas de Kaplan-Meier a los 9 meses para todos los análisis. El criterio de evaluación primario de este estudio de resultados fue la incidencia de úlceras complicadas (sangrado, perforación u obstrucción gastrointestinal). A los pacientes se les permitió tomar dosis bajas concomitantes (? 325 mg/día) de aspirina (ASA) para la profilaxis cardiovascular (subgrupos de ASA: celecoxib, n = 882; diclofenaco, n = 445; ibuprofeno, n = 412). Las diferencias en la incidencia de úlceras complicadas entre celecoxib y el grupo combinado de ibuprofeno y diclofenaco no fueron estadísticamente significativas. Estos pacientes con celecoxib y dosis bajas concomitantes de ASA experimentaron tasas cuatro veces más altas de úlceras complicadas, en comparación con aquellos que no recibieron ASA (Véase Advertencias especiales y precauciones especiales para uso, Efectos GI). Los resultados para celecoxib se muestran en la Tabla 4.
|
Tabla 4 Efectos de la coadministración de aspirina en dosis bajas sobre las tasas de úlcera complicada con CELECOXIB de 400 mg dos veces al día en (Tasas de Kaplan-Meier a los 9 meses [%]) |
||
|
No usuarios de aspirina |
Usuarios de aspirina |
|
|
n = 3105 |
n = 882 |
|
|
Úlceras complicadas |
0.32 |
1.12 |
Función plaquetaria: En voluntarios sanos, el celecoxib a dosis terapéuticas y a dosis variadas de 600 mg dos veces al día (tres veces la dosis más alta recomendada) no tuvo efectos sobre la agregación plaquetaria y tiempo de sangrado, en comparación con placebo. Los controles activos (inhibidores no específicos de la COX) redujeron significativamente la agregación plaquetaria y prolongaron el tiempo de sangrado.
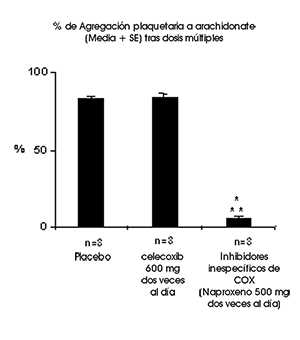
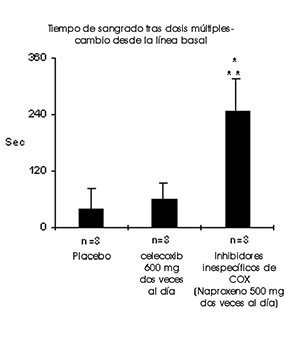
* Significativamente diferente de placebo; p < 0.05
* Significativamente diferente de celecoxib; p < 0.05
Seguridad cardiovascular – Ensayos actuales:
La información preliminar proveniente de tres estudios a largo plazo con la participación de pacientes con Pólipos Adenomatosos Esporádicos o predispuestos al desarrollo de la enfermedad de Alzheimer tratados con celecoxib está disponible. En uno de los tres estudios, el APC (siglas en ingles de prevención de adenomas colorrectales con celecoxib), hubo un aumento en los eventos cardiovasculares relacionado con la dosis (principalmente, infarto del miocardio) con dosis de celecoxib de 200 mg dos veces al día y 400 mg dos veces al día, en comparación con placebo. El alto riesgo fue aparente aproximadamente después de un año de tratamiento. El riesgo relativo (RR) para el criterio de evaluación compuesto (muerte cardiovascular, IM o AVC) fue de 3.4 (IC 95%, 1.4 – 8.5) para la dosis más alta y 2.5 (95% IC 1.0 – 6.4) para la dosis más baja de celecoxib, en comparación con placebo. La tasa acumulativa a través de aproximadamente 3 años de estudio para el criterio de evaluación compuesto fue de 3.0% para la dosis más alta de celecoxib, 2.2% para la dosis más baja de celecoxib y 0.9% para placebo. La información preliminar de otro estudio de pólipos adenomatosos esporádicos (Pre-SAP, por sus siglas en inglés) y del estudio de prevención (ADAPT, por sus siglas en inglés), no mostró un riesgo cardiovascular significativamente incrementado con celecoxib de 400 mg una vez al día y 200 mg dos veces al día, respectivamente, en comparación con placebo. Esta información será actualizada cuando la información final esté disponible.
Estudio de celecoxib versus omeprazol y diclofenaco en pacientes con riesgo de osteoartritis y artritis reumatoidea. (CONDOR): En esta prospectiva, un estudio de 24 semanas en pacientes mayores de 60 años o con historia de úlceras gastroduodenales (usuarios de bajas dosis de aspirina fueron excluídos), el porcentaje de pacientes con eventos GI clínicamente significativos (Composición del Criterio principal de valoración) fue menor en pacientes tratados con celecoxib 200 mg dos veces al día, comparado con pacientes tratados con diclofenaco SR 75 mg dos veces al día + omeprazol 20 mg una vez al día. Está diferencia fue manejada por el decrecimiento clínicamente significativo en hemoglobina (≥2 g/dL) y /o hematocrito (≥10%) de origen GI definido o presumido.
Los resultados para los componentes individuales para estos criterios de valoración se muestran a continuación:
|
Composición criterios de valoración GI predefinidos celecoxib 200 mg BID (N = 2238) Diclofenaco SR 75 mg BID + omeprazol 20 mg QD (N = 2246) |
|
|
Componentes |
n (%) de pacientes |
|
Hemorragia gastroduodenal |
3 (0.1) 3 (0.1) |
|
Hemorragia en intestino grueso |
1 (<0.1) 1 (<0.1) |
|
Hemorragia GI águda de origen desconocido |
1 (<0.1) 0 (0.0) |
|
Decrecimiento clinicamente significativo de hemoglobina (≥2 g/dL) y/o hematocrito (≥10%) de origen GI definido |
5 (0.2) 24 (1.1) |
|
Decrecimiento clinicamente significativo de hemoglobina (≥2 g/dL) y/o hematocrito (≥10%) de origen GI oculto presumido |
10 (0.4) 53 (2.3) |
|
Total* |
20 (0.9) 81 (3.6) |
|
Para los siguientes componentes de la composición de criterios de valoración GI Predefinidos, no se encontraron ninguno de los siguientes eventos en los grupos tratados: obstrucción de la salida gástrica; perforaciones gastroduodenales, de intestino delgado o de intestino grueso; hemorragias en intestino delgado. Todos los eventos comprendidos como criterios de valoración fueron juzgados por un panel de expertos independiente y ciego con asignaciones de tratamiento al azar. |
|
Seguridad cardiovascular – Estudios a largo plazo en pacientes con pólipos adenomatosos esporádicos: Se llevaron a cabo dos estudios con celecoxib en pacientes con pólipos adenomatosos esporádicos, el estudio APC (Prevención de Adenomas con Celecoxib) y el estudio PreSAP (Prevención de Pólipos Espontáneos). En el estudio APC hubo un aumento relacionado con la dosis en el parámetro de valoración compuesto de muerte cardiovascular, infarto miocárdico o apoplejía (adjudicada) con celecoxib, en comparación con el placebo durante 3 años de tratamiento. El estudio PreSAP no mostró un aumento estadísticamente significativo en el riesgo para el mismo parámetro de valoración compuesto.
En el estudio APC, los indices de riesgos comparados con el placebo con respecto a un parámetro de valoración compuesto de muerte cardiovascular, infarto miocárdico o apoplejía (adjudicada) fueron 3.4 (95% CI 1.4 - 8.5) con celecoxib 400 mg dos veces al día y 2.8 (95% CI 1.1 - 7.2) con celecoxib 200 mg dos veces al día (los índices acumulativos para este parámetro de valoración compuesto durante 3 años fueron 20/671 sujetos, 3.0%, y 17/685 sujetos, 2.5%, respectivamente, en comparación con 6/679 sujetos, 0.9%, para placebo). Los aumentos para ambos grupos con dosis de celecoxib contra placebo fueron impulsados sobre todo por el infarto miocárdico.
En el estudio PreSAP, el índice de riesgo comparado con el placebo para este mismo parámetro de valoración compuesto fue 1.2 (95% CI 0.6 - 2.4) con celecoxib 400 mg una vez al día (los índices acumulativos para este parámetro de valoración compuesto durante 3 años fueron 21/933 sujetos, 2.3%, comparado con 12/628 sujetos, 1.9%, para placebo).
Estudio a largo plazo de Prevención Antiinflamatoria en la Enfermedad de Alzheimer (ADAPT, por sus siglas en inglés) – seguridad cardiovascular: Los datos de otro estudio a largo, el estudio ADAPT, no mostraron un riesgo cardiovascular significativamente mayor con celecoxib 200 mg dos veces al día en comparación con placebo. El riesgo relativo, en comparación con placebo, para un punto final compuesto similar (muerte CV, IM, evento vascular cerebral) fue del 1.14 (IC 95% 0.61 - 2.12) con celecoxib 200 mg dos veces al día.
Seguridad cardiovacular – Metaanálsisis del uso de estudios crónicos: No se ha realizado ningún estudio clínico controlado, a largo plazo, diseñado específicamente para evaluar la seguridad CV de la dosificación crónico de celecoxib de cualquier duración. Sin embargo, se ha efectuado un metaanálisis de la información de seguridad (eventos adversos serios reportados no adjudicados) de 41 estudios clínicos completados de celecoxib hasta un máximo de un año de duración, lo cual representa 44.308 pacientes ?24.933 (56.3%) expuestos a los AINES, 4.057 (9.2%) pacientes expuestos a placebo y 1.328 (3.0%) pacientes expuestos a rofecoxib?.
En este análisis, la incidencia del criterio de evaluación compuesto de muerte CV, infarto del miocardio no fatal y AVC no fatal fue similar entre celecoxib (N = 19.773) y el tratamiento de AINES no selectivos (N = 13.990) (RR = 0.86, IC 95%, 0.59 – 1.26). Este patrón de efecto se mantuvo con o sin el uso de ASA (< 325 mg). La incidencia de infarto del miocardio no fatal tendió a ser más alta (RR = 1.49, IC 95%, 0.82 – 2.70); sin embargo, la de AVC no fatal fue significativamente más baja (RR = 0.33, IC 95%, 0.14 – 0.78) y aquella de muerte cardiovascular fue comparable (RR = 0.72, IC 95%, 0.37 – 1.39) para celecoxib, en comparación con AINES no selectivos combinados.
En este análisis, la incidencia del criterio de evaluación compuesto de muerte CV, infarto del miocardio no fatal y AVC no fatal fue de 0.31% para celecoxib (N = 7462) y 0.20% para el tratamiento con placebo (N = 4.057) (RR = 1.26, IC 95%, 0.57 – 2.80). Este patrón de efecto se mantuvo con o sin el uso de ASA (< 325 mg). La incidencia de infarto del miocardio no fatal tendió a ser significativa (RR = 1.24, IC 95%, 0.27 – 5.76), al igual que la relacionada con muerte cardiovascular (RR = 1.74, IC de 95%, 0.49 – 6.17) y el de AVC no fatal fue similar (RR = 0.80, IC de 95%, 0.19 – 3.31) para celecoxib, en comparación con placebo.
Seguridad cardiovascular: Los resultados de seguridad cardiovascular fueron evaluados en el ensayo CLASS (véase la descripción del ensayo). Las tasas acumulativas de Kaplan-Meier para los eventos adversos cardiovasculares tromboembólicos serios reportados por el investigador (incluyendo IM, embolismo pulmonar, trombosis venosa profunda, angina inestable, ataques de isquemia transitoria y accidentes cerebrovasculares isquémicos) no demostraron ninguna diferencia entre los grupos de tratamiento de celecoxib, diclofenaco o ibuprofeno.
Las tasas acumulativas en todos los pacientes a los nueve meses para celecoxib, diclofenaco e ibuprofeno fueron de 1.2%, 1.4% y 1.1%, respectivamente. Las tasas acumulativas en los no usuarios de ASA a los nueve meses, en cada uno de los tres grupos de tratamiento, fueron menos de 1%. Las tasa acumulativas para infarto del miocardio en los no usuarios de ASA, a los nueve meses en cada uno de los tres grupos de tratamiento, fueron menos de 0.2%. No hubo grupo placebo en el ensayo CLASS, lo cual limita la capacidad de determinar si los tres medicamentos ensayados presentaban o no un riesgo elevado de eventos CV o si todos ellos aumentaron el riesgo a un grado similar.
PROPIEDADES FARMACOCINÉTICAS:
Absorción: La farmacocinética del celecoxib ha sido evaluada en aproximadamente 1500 individuos. Cuando se administra en condiciones de ayuno, el celecoxib es bien absorbido, alcanzando concentraciones plasmáticas pico después de aproximadamente 2-3 horas. La biodisponibilidad oral de las cápsulas es aproximadamente de 99%, relativa a la administración en la suspensión (forma de dosificación oral óptimamente disponible). En condiciones de ayuno, tanto los niveles plasmáticos pico (Cmáx) como el área bajo la curva (ABC) son aproximadamente proporcionales a dosis hasta de 200 mg dos veces al día; con dosis más altas, hay menos incrementos proporcionales en la Cmáx y el ABC.
Distribución: La fijación a proteínas del plasma, la cual es independiente de la concentración, es alrededor de 97% a concentraciones plasmáticas terapéuticas y el celecoxib preferiblemente no se liga a los eritrocitos en la sangre.
Efectos del alimento: La dosificación con alimento (comidas de alto contenido de grasa) retarda la absorción de celecoxib produciendo una Tmáx de aproximadamente 4 horas y aumentando la biodisponibilidad en alrededor de 20%. (Véase Posología y método de administración).
En voluntarios adultos sanos, la exposición sistémica global (ABC) de celecoxib fue equivalente cuando celecoxib se administró como una cápsula intacta o mezclando el contenido de la cápsula en papilla de manzana. No se observaron alteraciones significativas en la Cmáx, Tmáx o T1/2 después de la administración del contenido de la cápsula en papilla de manzana.
Metabolismo: El metabolismo de celecoxib está mediado sobre todo por el citocromo P450 2C9. Se han identificado tres metabolitos, sin actividad inhibidora de COX-1 ni COX-2, en el plasma humano; son un alcohol primario, el ácido carboxílico correspondiente y su conjugado glucurónido. La actividad del citocromo P450 2C9 es baja en personas con polimorfismos genéticos que reducen la actividad enzimática, como los homocigotos para el polimorfismo CYP2C9*3.
En un estudio farmacocinético de celecoxib 200 mg administrado una vez al día en voluntarios sanos con genotipo68 CYP2C9*1/*1, CYP2C9*1/*3 o CYP2C9*3/*3, la mediana de Cmáx y AUC 0-24 de celecoxib el día 7 fue aproximadamente 4 y 7 veces más alta en sujetos con genotipo CYP2C9*3/*3 en comparación con otros genotipos. En tres estudios de dosis única que incluyeron un total de 5 sujetos con genotipo CYP2C9*3/*3, el AUC 0-24 de la dosis única aumentó casi 3 veces en comparación con los sujetos de metabolismo normal. Se estima que la frecuencia del genotipo homocigótico *3/*3 es 0.3 – 1.0% entre diferentes grupos étnicos72. 29 Pfizer Confidencial.
Celecoxib debe usarse con cuidado en los pacientes con certeza o sospecha de metabolismo deficiente mediante CYP2C9 con base en los antecedentes o experiencias previas con otros sustratos de CYP2C9. Considere iniciar el tratamiento con la mitad de la dosis más baja recomendada. (Ver Posología y método de administración y Interacciones con otros productos medicinales y otras formas de interacción).
Excreción: La eliminación de celecoxib es principalmente por el metabolismo hepático, excretándose menos del 1% de la dosis excretada intacta en la orina. Después de una dosificación variada, la vida media de eliminación es de 8-12 horas y la tasa de depuración es de aproximadamente 500 mL/min. Con dosificaciones variadas, las concentraciones plasmáticas del estado en equilibrio se alcanzaron antes del día 5. La variabilidad entre los sujetos en los principales parámetros farmacocinéticos (ABC, Cmáx, vida media de eliminación) es de alrededor de 30%. El volumen medio de distribución del estado en equilibrio es aproximadamente de 500L/70kg en adultos jóvenes sanos, indicando una amplia distribución de celecoxib dentro de los tejidos. Los estudios preclínicos indican que el medicamento cruza la barrera hematoencefálica.
Poblaciones especiales:
Adultos mayores: En la población >65 años existe un incremento de uno y medio a dos en el Cmáx y ABC promedio de celecoxib. Esto principalmente es un cambio que se relaciona con el peso y no con la edad, siendo los niveles de celecoxib más altos en individuos de menor peso y consecuentemente más altos en la población de ancianos que generalmente son de un peso medio más bajo, que la población más joven. Por lo tanto, las mujeres ancianas tienden a presentar concentraciones plasmáticas del medicamento más altas que los hombres ancianos. Generalmente no es necesario ningún ajuste en la dosificación. Sin embargo, para los pacientes ancianos con un peso corporal más bajo que el promedio, (<50 kg), se debe iniciar la terapia con la dosis más baja recomendada.
Niños: Se evaluó la farmacocinética en estado estable de celecoxib, administrado en una suspensión oral de investigación, a 152 pacientes con artritis idiopática juvenil (AIJ) de 2 a 17 años de edad con un peso 10 kg con AIJ oligoarticular, oligoarticular extendida o poliarticular (factor reumatoide positivo o negativo) y a pacientes con AIJ de inicio sistémico (con características sistémicas actualmente inactivas). El análisis farmacocinético poblacional indicó que la eliminación oral (no ajustada por peso corporal) de celecoxib aumenta menos que proporcionalmente con un mayor peso; se prevé que los pacientes de 10 kg y 25 kg tendrán un depuración 40% y 24% menor, respectivamente, en comparación con pacientes adultos con AR con un peso de 70 kg.
Con la administración dos veces al día de cápsulas de 50 mg a pacientes con AIJ con un peso 10 a 25 kg y con la administración dos veces al día de cápsulas de 100 mg a pacientes con AIJ con un peso >25 kg se deben alcanzar concentraciones plasmáticas similares a las observadas en el estudio clínico que demostró la no inferioridad de celecoxib en relación a naproxeno 7.5 mg/kg dos veces al día. (Ver Posología y método de administración). Celecoxib no se ha evaluado en pacientes con AIJ menores de 2 años, en pacientes con peso corporal menor a 10 kg (22 lbs.) o por más de 24 semanas.
Raza: Un metaanálisis de estudios farmacocinéticos ha sugerido un ABC aproximadamente 40% más alto de celecoxib en la población de raza negra, en comparación con la población caucásica. La causa e importancia clínica de este hallazgo se desconocen por lo que, el tratamiento debe ser iniciado con la dosis más baja recomendada.
Insuficiencia hepática: Las concentraciones plasmáticas de celecoxib en pacientes con daño hepático leve (Escala de Child-Pugh, Clase A) no son significativamente diferentes a aquellas de los controles asociados con la edad y sexo. En los pacientes con daño hepático moderado (Escala de Child-Pugh, Clase B), las concentraciones plasmáticas de celecoxib son aproximadamente dos veces aquellas de los controles asociados. Para la dosificación en pacientes con daño hepático véase Posología y método de administración.)
La dosificación diaria recomendada de las cápsulas de celecoxib debe ser reducida aproximadamente un 50% en los pacientes con PAF con daño hepático moderado.
Insuficiencia renal: En voluntarios ancianos con reducciones en la tasa de filtración glomerular (TFG) (TFG media >65 mL/min/1.73 m2) relacionadas con la edad y en pacientes con insuficiencia renal estable crónica (TFG de 35-60 mL/min/1.73 m2), la farmacocinética de celecoxib fue comparable a aquella observada en los pacientes con función renal normal. No se descubrió ninguna relación significativa entre la creatinina sérica (o depuración de creatinina) y depuración de celecoxib. No se esperaría una insuficiencia renal severa que alterara la depuración de celecoxib, dado que la principal ruta de eliminación es por el metabolismo hepático dando lugar a metabolitos inactivos.
Efectos renales: En este momento las funciones relativas de la COX-1 y COX-2 en la fisiología renal no se comprenden completamente. El celecoxib reduce la excreción urinaria de PGE2 y 6-keto-PGF1? (un metabolito prostaciclínico), pero abandona al tromboxano sérico B2 (TXB2) y excreción urinaria de 11-deidro-TXB2, un metabolito de tromboxano (ambos productos de la COX-1) inafectados. Estudios específicos han mostrado que celecoxib no produce reducciones en la TFG en ancianos o aquellos con insuficiencia renal crónica. Estos estudios han demostrado también reducciones transitorias en la excreción fraccionaria de sodio. En estudios de pacientes con artritis, se ha observado una incidencia comparable de edema periférico como las observadas con inhibidores no específicos de la COX (que también poseen una actividad inhibitoria de la COX-2). Esto fue más evidente en los pacientes que recibieron una terapia diurética concomitante. Sin embargo, no se han observado incidencias aumentadas de hipertensión y falla cardiaca y el edema periférico ha sido leve y autolimitante.
Datos preclínicos de seguridad: La información preclínica de seguridad no reveló ningún peligro especial para los seres humanos basándose en estudios convencionales de toxicidad, de dosis repetida, mutagenicidad o carcinogenicidad. Estudios de toxicidad convencionales embriofetales dieron como resultado apariciones, dependientes de la dosis, de hernia diafragmática en los fetos de las ratas y malformaciones cardiovasculares en los fetos de los conejos. En ambas especies, estos efectos fueron observados a niveles de exposición sistémica 5-6 veces los observados con la dosis clínica recomendada más alta (400 mg al día).
En las ratas, la exposición a celecoxib durante el desarrollo embrionario temprano produjo pérdidas previas y posteriores a la implantación y disminuyó la supervivencia embriofetal. Estos efectos que fueron observados con dosis orales de aproximadamente seis veces la exposición sistémica humana, son esperados después de la inhibición de la síntesis de prostaglandinas.
Toxicología animal: Se observó un incremento en la incidencia de hallazgos de base de espermatocele con o sin 32 cambios secundarios como hipospermia epididimal así como dilatación mínima a leve de los túbulos seminíferos en la rata joven. Estos hallazgos reproductivos, aunque aparentemente estaban relacionados con el tratamiento, no se incrementaron en cuanto a incidencia ni a severidad con la dosis y pueden indicar una exacerbación de una condición espontánea. No se observaron hallazgos reproductivos similares en estudios de perros jóvenes o adultos o en ratas adultas que recibieron celecoxib. Se desconoce la significancia clínica de esta observación.
CONTRAINDICACIONES:
El celecoxib está contraindicado en:
• Pacientes con hipersensibilidad conocida a celecoxib o a cualquier otro ingrediente del producto;
• Pacientes con hipersensibilidad conocida a sulfonamida;
• Pacientes que han experimentado asma, urticaria o reacciones de tipo alérgico después de tomar ácido acetilsalicílico (aspirina) o medicamentos antiinflamatorios no esteroides (AINEs), incluyendo otros inhibidores específicos de la ciclooxigenasa-2 (COX-2).
• Tratamiento de dolor perioperatorio en caso de implante de bypass coronario.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES ESPECIALES PARA USO:
Eventos trombóticos cardiovasculares: Celecoxib puede elevar el riesgo de eventos trombóticos cardiovasculares serios, infarto miocárdico y apoplejía, los cuales pueden ser mortales. Todos los AINES tienen un riesgo similar. El riesgo puede incrementarse con la dosis, la duración del uso y los factores de riesgo cardiovascular basales. Los pacientes con enfermedad cardiovascular conocida tienen un mayor riesgo. Para minimizar el riesgo potencial de un evento cardiovascular adverso en pacientes tratados con celecoxib, debe usarse la menor dosis efectiva durante el menor tiempo posible. Los médicos y los pacientes deben mantenerse alerta ante el desarrollo de tales eventos, aún en ausencia de síntomas cardiovasculares previos. Los pacientes deben estar informados sobre los signos y/o síntomas de toxicidad cardiovascular seria y los pasos a tomar en caso que aparezcan. (ver Propiedades farmacodinámicas).
Dos estudios clínicos grandes controlados con diferente AINES selectivos para la COX-2 en el tratamiento del dolor durante los primeros 10 a 14 días después de un procedimiento de bypass coronario evidenciaron una mayor incidencia de infarto miocárdico y apoplejía. (Ver Contraindicaciones).
Celecoxib no es un sustituto del ácido acetilsalicílico para la prevención de enfermedades tromboembólicas cardiovasculares por la falta de efecto en la función plaquetaria. Como celecoxib no inhibe la agregación plaquetaria, no deben suspenderse los tratamientos antiplaquetarios (p. ej.: ácido acetilsalicílico).
Hipertensión: Como con todos los AINES, celecoxib puede desencadenar el inicio de hipertensión o la agravación de hipertensión preexistente, cualquiera de las cuales contribuye al aumento en la incidencia de eventos cardiovasculares. Los AINES, incluídos el celecoxib, deben usarse con precaución en pacientes con hipertensión. La presión sanguínea debe vigilarse de cerca al inicio del tratamiento con celecoxib y durante todo el curso terapéutico.
Retención de líquidos y edema: Al igual que con otros medicamentos que se sabe inhiben la síntesis de prostaglandinas, se ha observado retención de líquidos y edema en algunos pacientes que toman celecoxib. Por lo tanto, los pacientes con insuficiencia cardiaca congestiva preexistente o con hipertensión deben vigilarse de cerca. Celecoxib debe usarse con precaución en pacientes con una función cardiaca comprometida, edema preexistente u otras condiciones que predispongan a, o que se empeoran por retención de líquidos, incluyendo aquellos que toman diuréticos o que de otra manera están en riesgo de hipovolemia.
Efectos gastrointestinales (GI): Han ocurrido perforaciones, úlceras o sangrados gastrointestinales (GI) superiores, en pacientes tratados con celecoxib. Los pacientes con más riesgo para el desarrollo de estos tipos de complicaciones GI con AINEs son los ancianos, pacientes con enfermedad cardiovascular, pacientes que usan aspirina concomitante, o pacientes con enfermedad gastrointestinal activa anterior o historia de la misma, tales como ulceración, sangrado GI y condiciones inflamatorias. La mayoría de los reportes espontáneos de eventos gastrointestinales fatales han acontecido en pacientes de la tercera edad o débiles.
Uso de warfarina o agentes similares: En pacientes con administración concomitante de warfarina o agentes similares se han reportado eventos hemorrágicos serios, algunos de ellos mortales. Como hay informes de aumento en el tiempo de protrombina (INR), la actividad anticoagulante debe vigilarse después de iniciar el tratamiento con celecoxib o cuando se modifica la dosis.
Efectos renales: Los AINEs, incluyendo celecoxib, pueden causar toxicidad renal. Los estudios clínicos con celecoxib han demostrado efectos renales similares a los observados con AINEs comparadores. Los pacientes en mayor riesgo de desarrollar toxicidad renal son aquellos con una función renal alterada, insuficiencia cardiaca, disfunción hepática y las personas de edad avanzada. Estos pacientes deben vigilarse cuidadosamente mientras reciben tratamiento con celecoxib.
Se debe tener precaución al iniciar tratamiento en pacientes deshidratados. Se recomienda rehidratar a los pacientes primero y después iniciar el tratamiento con celecoxib.
Enfermedad renal avanzada: La función renal debe vigilarse de cerca en pacientes con enfermedad renal avanzada que reciben celecoxib. (Ver Posología y método de administración).
Efectos hepáticos: Los pacientes con daño hepático severo (Escala de Child-Pugh, Clase C) no han sido estudiados. No se recomienda el uso de celecoxib en pacientes con daño hepático severo. Celecoxib debe ser utilizado con precaución cuando se trata a pacientes con daño hepático moderado (Escala de Child-Pugh, Clase B), e iniciarse con la dosis más baja recomendada. (Véase Posología y método de administración).
Un paciente con síntomas o signos de disfunción hepática o en quién se hayan reportado pruebas anormales de función hepática, debe ser controlado cuidadosamente para detectar evidencias de desarrollo de una reacción hepática más severa, mientras recibe la terapia de celecoxib.
Reacciones anafilactoides: Al igual que con los AINEs en general, se han reportado reacciones anafilactoides en pacientes expuestos a celecoxib (ver Contraindicaciones).
Reacciones cutáneas serias: Rara vez se han reportado reacciones cutáneas serias, algunas de ellas mortales, incluyendo dermatitis exfoliativa, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica, en relación con el uso de celecoxib.
Parece que los pacientes tienen el riesgo más alto de estos eventos al principio del curso terapéutico: En la mayoría de los casos, el inicio del evento ocurre en la mayoría de los casos en el primer mes de tratamiento. Celecoxib debe suspenderse a la primera aparición de erupción cutánea, lesiones en mucosas o cualquier otro signo de hipersensibilidad.
Poliposis adenomatosa familiar (PAF): No se ha demostrado que el tratamiento con celecoxib en PAF reduzca el riesgo de cáncer gastrointestinal ni la necesidad de colectomía profiláctica u otras intervenciones quirúrgicas relacionadas con la PAF. Por lo tanto, no debe alterarse la atención usual para los pacientes por la administración concurrente de celecoxib. En particular, no debe reducirse la frecuencia de la vigilancia endoscópica rutinaria ni debe retrasarse la colectomía profiláctica ni otras operaciones relacionadas con la poliposis adenomatosa familiar.
Artritis idiopática juvenil (AIJ) de inicio sistémico: Los AINEs, incluyendo celecoxib, deben usarse con precaución en pacientes con AIJ de inicio sistémico debido al riesgo de coagulación intravascular diseminada. Los pacientes a 8 quienes se les administre celecoxib y que padezcan de AIJ de inicio sistémico deben vigilarse en cuanto al desarrollo de pruebas anormales de coagulación.
General: Al reducir la inflamación, celecoxib puede reducir la utilidad de los signos diagnósticos, como fiebre, para detectar infecciones.
Se debe evitar el uso concomitante de celecoxib y de un AINE que no sea aspirina.
USO DURANTE EL EMBARAZO Y LACTANCIA:
Uso en el embarazo: No hay estudios en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (Véase Información preclínica de seguridad). Se desconoce la importancia de estos datos para los seres humanos.
Embarazo, categoría C y categoría D de la semana 30 de gestación en adelante.
El celecoxib, al igual que con otros medicamentos que inhiben la síntesis de prostaglandina, puede producir inercia uterina y cierre prematuro del conducto arterioso, por lo cual debe evitarse durante el tercer trimestre del embarazo.
El celecoxib debe ser utilizado durante el embarazo únicamente, si el beneficio potencial para la madre justifica el riesgo potencial para el feto.
Lactancia: Estudios en ratas muestran que celecoxib se excreta en la leche en concentraciones similares a las plasmáticas. La administración de celecoxib a mujeres lactantes muestra transferencia muy baja del fármaco a la leche materna. Por la posibilidad de reacciones adversas en lactantes por el celecoxib, debe decidirse si se suspende la lactancia natural o se suspende el fármaco, después de considerar el beneficio esperado para la madre con el fármaco.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR VEHÍCULOS Y USO DE MAQUINARIA: El efecto del celecoxib sobre la capacidad de conducir o uso de maquinaria no ha sido estudiado, pero con base en sus propiedades farmacodinámicas y perfil general de seguridad, no es probable que tenga algún efecto.
EFECTOS INDESEABLES:
Estudios clínicos:
1. Las siguientes reacciones adversas de la Tabla 1 se reportaron con índices mayores de 0.01% y superiores a los del placebo durante 12 estudios clínicos controlados con placebo o productos activos con duración de hasta 12 semanas y dosis diarias de 100 mg a 800 mg en adultos. Las reacciones adversas se listan por sistema orgánico y se ordenan por frecuencia. Las frecuencias se definen como: frecuente ( 1% y < 10%), infrecuente ( 0.1% y < 1%), rara ( 0.01% y < 0.1%).
|
Tabla 1. Reacciones adversas de los 12 estudios clínicos controlados con placebo y/o medicamento activo con una duración hasta de 12 semanas y dosis diarias de 100 mg -800 mg en adultos |
|
|
Clase de sistema orgánico |
Evento adverso |
|
Infecciones e infestaciones |
|
|
Trastornos sanguíneos y del sistema linfático |
|
|
Trastornos del sistema inmunitario |
Alergia agravada |
|
Trastornos psiquiátricos |
|
|
Trastornos del sistema nervioso Infrecuente |
|
|
Trastornos oculares |
|
|
Trastornos óticos y laberínticos |
|
|
Trastornos cardiacos |
|
|
Trastornos vasculares |
|
|
Trastornos respiratorios, torácicos y mediastinales |
|
|
Trastornos gastrointestinales Infrecuente Raro |
Vómito Úlcera gástrica, úlcera duodenal, ulceración esofágica, perforación intestinal, pancreatitis |
|
Trastornos hepatobiliares |
|
|
Trastornos de piel y tejido subcutáneo Infrecuente Raro |
Alopecia, equimosis, urticaria Angioedema, erupción ampollar |
|
Trastornos generales y alteraciones en sitio de administración |
|
|
Lesión, intoxicación y alteraciones en los procedimientos |
|
Población pediátrica: Generalmente, las reacciones adversas observadas en el estudio pediátrico transcendental. (Ver Propiedades Farmacocinéticas: Artritis Idiopática Juvenil [AIJ]) fueron similares a las observadas en estudios de artritis en adultos. (Ver la Tabla 1). Asimismo, las siguientes reacciones adversas no están mencionadas en la Tabla 1 y el investigador en el estudio pediátrico trascendental consideró que tenían una relación posible con el tratamiento con celecoxib: Cefalea (2 reportes, 1.3%), exacerbación de hematuria (1 reporte, 0.6%)75 y asma [1 paciente que presentaba asma controlada en la basal] (1 reporte, 0.6%). En comparación con naproxeno, celecoxib, a dosis de 3 y 6 mg/kg dos veces al día, no tuvo un efecto nocivo observable en el crecimiento ni en el desarrollo durante el estudio doble ciego de 12 semanas.
2) Las siguientes reacciones adversas adicionales * de la Tabla 2 se reportaron con índices de incidencia mayores a los del placebo en estudios a largo plazo sobre prevención de pólipos con duración de hasta 3 años y dosis diarias de 400 mg hasta 800 mg. (Propiedades farmacodinámicas: Seguridad cardiovascular – Estudios a largo plazo en pacientes con pólipos adenomatosos esporádicos). Las reacciones adversas se listan por clase de sistema orgánico y se ordenan por frecuencia. Las frecuencias se definen como: muy frecuente (10%), frecuente (1% y < 10%), infrecuente (0.1% y < 1%).
|
Tabla 2. |
|
|
Clase de sistema orgánico |
Evento adverso |
|
Infecciones e infestaciones Infrecuente |
Infección por Helicobacter, herpes zoster, erisipela, infección de herida, infección gingival, laberintitis, infección bacteriana |
|
Neoplasmas benignos, malignos y no especificados |
|
|
Trastornos psiquiátricos |
|
|
Trastornos del sistema nervioso |
|
|
Trastornos oculares |
|
|
Trastornos óticos y laberínticos |
|
|
Trastornos cardiacos |
|
|
Trastornos vasculares |
Trombosis venosa profunda, hematoma |
|
Trastornos respiratorios, torácicos y mediastinales Infrecuente |
Disfonía |
|
Trastornos gastrointestinales
|
Náusea, enfermedad por reflujo gastroesofágico, divertículo, vómito,* disfagia, síndrome de intestino irritable Hemorragia hemorroidal, evacuaciones intestinales frecuentes, ulceración bucal, estomatitis |
|
Trastornos de piel y tejido subcutáneo |
|
|
Trastornos musculoesqueléticos y de tejido conectivo |
|
|
Trastornos renales y urinarios |
|
|
Trastornos mamarios y del sistema reproductor Infrecuente |
Hemorragia vaginal, sensibilidad mamaria, dismenorrea, quiste ovárico, síntomas menopáusicos |
|
Trastornos generales y alteraciones en sitio de administración |
Edema |
|
Pruebas de laboratorio |
Aumento de potasio sérico, aumento de sodio sérico, descenso de testosterona en sangre, descenso de hematocrito, aumento de hemoglobina |
|
Lesión, intoxicación y complicaciones de procedimientos |
Fractura de pie, fractura de extremidad inferior, epicondilitis, ruptura tendinosa, fractura |
* La hipertensión, vómito y diarrea se incluyen en la Tabla 2 porque se reportaron con mayor frecuencia en estos estudios, que duraron 3 años, en comparación con la Tabla 1, que incluye reacciones adversas de estudios con duración de 12 semanas.
INTERACCIÓN CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN:
Generales: El metabolismo de celecoxib es principalmente mediado por la vía de la isoenzima (CYP) 2C9 del citocromo P450 en el hígado. Cuando se conoce o sospecha que los pacientes son metabolizadores deficientes de la CYP2C9, se les debe administrar el celecoxib con precaución, dado que podrían tener niveles plasmáticos anormalmente altos debido a una disminución en la depuración metabólica.
Los estudios in vitro indican que el celecoxib, a pesar de que no es un substrato, es un inhibidor de la CYP2D6. Por lo tanto, hay un potencial de interacción farmacológico in vivo con medicamentos que son metabolizados por la CYP2D6.
Específicas por fármaco:
Interacción de celecoxib con warfarina o agentes similares: Véase Advertencias especiales y precauciones especiales para uso – Uso con Warfarina o agentes similares.
Fluconazol y ketoconazol: La administración concomitante de fluconazol a una dosis de 200 mg una vez al día produjo un incremento doble en la concentración plasmática de celecoxib. Este incremento es debido a la inhibición del metabolismo de celecoxib por la vía de la CYPP450 2C9 por el fluconazol. El celecoxib debe ser administrado a la dosis recomendada más baja en los pacientes que reciben fluconazol, inhibidor de la CYP2C9 (Véase Posología y método de administración). El ketoconazol, un inhibidor de la CYP3A4, no mostró ninguna inhibición clínicamente relevante en el metabolismo de celecoxib.
Inhibidores de la ECA y antagonistas de la angiotensina II: La inhibición de las prostaglandinas puede disminuir el efecto antihipertensivo de los inhibidores de la enzima convertidora de angiotensina (ECA) y/o los antagonistas de la angiotensina II. Esta interacción debe considerarse en pacientes que toman celecoxib al mismo tiempo que inhibidores de la ACE y/o antagonistas de la angiotensina II. Sin embargo, un estudio clínico con lisinopril no mostró interacción farmacodinámica significativa con respecto a la presión sanguínea.
Diuréticos: Estudios clínicos han demostrado que los AINES, en algunos pacientes, pueden reducir el efecto natriurético de la furosemida y los tiazidas por inhibición de la síntesis de prostaglandina renal.
Anticonceptivos orales: En un estudio de interacción, el celecoxib no tuvo efectos clínicamente relevantes sobre la farmacocinética de un anticonceptivo prototipo oral de combinación (1 mg de noretindrona/0.035 mg de etinilestradiol).
Litio: En sujetos sanos, los niveles plasmáticos de litio aumentaron aproximadamente 17% en los sujetos que recibieron litio en conjunto con celecoxib. Los pacientes en tratamiento con litio deben ser controlados cuidadosamente cuando se les administre o retire el celecoxib.
Aspirina: El celecoxib no interfiere con el efecto antiplaquetario de aspirina en dosis bajas (Véase Advertencias especiales y precauciones especiales para uso, Efectos GI). Debido a su falta de efectos plaquetarios, el celecoxib no constituye un reemplazo del ácido acetilsalicílico en el tratamiento profiláctico de la enfermedad cardiovascular.
Otros: No se han observado interacciones clínicamente importantes con celecoxib y antiácidos (aluminio y magnesio), omeprazol, metotrexato, glibenclamida (gliburida), fenitoína o tolbutamida.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: Las cápsulas de celecoxib, a dosis hasta de 200 mg dos veces al día, pueden ser tomadas con o sin comidas.
Como los riesgos cardiovasculares de celecoxib pueden aumentar con la dosis y duración de la exposición, deberán usarse la duración más corta posible y la dosis diaria efectiva más baja.
Tratamiento sintomático de la osteoartritis: La dosis recomendada de celecoxib es de 200 mg administrados como una dosis única al día. La seguridad ha sido demostrada con dosis hasta de 400 mg dos veces al día.
Tratamiento sintomático de artritis reumatoide: La dosis recomendada de celecoxib es de 200 mg una o dos veces al día. La seguridad ha sido demostrada con dosis hasta de 400 mg dos veces al día.
Espondilitis anquilosante (EA): La dosis recomendada de celecoxib es de 200 mg, administrados como dosis única o como 100 mg dos veces al día. Algunos pacientes pueden beneficiarse con una dosis diaria total de 400 mg.
Manejo del dolor agudo: La dosis recomendada es de 400 mg, inicialmente, seguida por una dosis adicional de 200 mg, en caso necesario el primer día. Los siguientes días, la dosis recomendada es de 200 mg dos veces al día, según sea necesario.
Tratamiento de la dismenorrea primaria: La dosis recomendada es de 400 mg, inicialmente, seguida por una dosis adicional de 200 mg, si fuera necesario el primer día. Los días posteriores, la dosis recomendada es de 200 mg dos veces al día, según sea necesario.
Adultos mayores: Generalmente no es necesario ningún ajuste en la dosificación. Sin embargo, para pacientes de la tercera edad con un peso menor a los 50 kg, es recomendable iniciar la terapia con la dosis más baja recomendada.
Niños:
Artritis idiopática juvenil:
Pacientes pediátricos (2 años y mayores): Dosis 10 kg a 25 kg. Cápsula de 50 mg dos veces al día >25 kg. Cápsula de 100 mg dos veces al día.
Daño hepático: Ningún ajuste es necesario en los pacientes con insuficiencia hepática leve (Escala de Child-Pugh, Clase A). Administre celecoxib a la dosis más baja recomendada en los pacientes con artritis o dolor con daño hepático moderado (Escala de Child-Pugh, Clase B).
La dosis diaria recomendada de las cápsulas de celecoxib en los pacientes con PAF con daño hepático moderado (Escala de Child-Pugh Clase B) debe ser reducida aproximadamente al 50%.
Los pacientes con daño hepático severo (Escala de Child-Pugh Clase C) no han sido estudiados. (Véase Advertencias especiales y precauciones especiales para uso- Efectos hepáticos).
Daño renal: Ningún ajuste en la dosificación es necesario en los pacientes con daño renal leve o moderado. No hay experiencia clínica en pacientes con daño renal severo. (Véase Advertencias especiales y precauciones especiales para uso - Efectos renales).
Pacientes con metabolismo deficiente CYP2C9: Celecoxib debe administrarse con precaución a los pacientes con sospecha o certeza de metabolismo deficiente mediante CYP2C9 con base en antecedentes o experiencias previas con otros sustratos CYP2C9. Se debe considerar iniciar el tratamiento con la mitad de la dosis recomendada.
Sin embargo, a una dosis de 400 mg dos veces al día, el metabolismo deficiente en pacientes con genotipo CYP2C9*3/*3 puede generar exposiciones a celecoxib mayores que las exposiciones para las cuales se ha estudiado la seguridad en estudios clínicos. Por tanto, el riesgo de una alta exposición a celecoxib en metabolizadores deficientes se debe considerar cuidadosamente en el tratamiento de pacientes con PAF.
SOBREDOSIS: La experiencia clínica en cuanto a sobredosis es limitada. Dosis únicas hasta de 1200 mg y dosis múltiples hasta de 1200 mg dos veces al día han sido administradas a sujetos sanos, sin efectos adversos clínicamente significativos. En caso de que se sospeche sobredosis, deberá proporcionarse un cuidado médico de soporte apropiado. No es probable que la diálisis constituya un método eficiente para la eliminación del medicamento debido a la alta fijación a proteínas del mismo.
Algunos síntomas relacionados con la sobredosis de AINEs son: Letargia, nauseas, vómitos y dolor epigástico, que normalmente son reversibles con medidas de soporte.
PRECAUCIONES ESPECIALES PARA EL ALMACENAMIENTO: Almacénese a temperatura menor a 30 ºC.
PFIZER
® Marca registrada