
ZITHROMAX
AZITROMICINA
Gránulos
Gránulos de liberación prolongada para suspensión, 2,0 Gramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
POLVO para suspensión oral: Dihidrato de azitromicina 209.64 mg/5 ml equivalente a 200 mg/5 ml azitromicina base.
TABLETA con película de recubrimiento 250 mg: Dihidrato de azitromicina 262.05 mg equivalente a 250 mg azitromicina base.
TABLETA con película de recubrimiento 500 mg: Dihidrato de azitromicina 524.10 mg equivalente a 500 mg azitromicina base.
TABLETA con película de recubrimiento 600 mg: Dihidrato de azitromicina 628.93 mg equivalente a 600 mg azitromicina base.
POLVO para solución intravenosa: Dihidrato de azitromicina 524.1 mg equivalente a 500 mg de azitromicina base en 5 mL.
GRÁNULOS del liberación prolongada 2,0 g: Dihidrato de azitromicina 2096,20 mg equivalente a 2.0 g azitromicina base.
INDICACIONES TERAPÉUTICAS: La azitromicina está indicada para el tratamiento de las infecciones causadas por organismos susceptibles; infecciones del tracto respiratorio bajo incluidas bronquitis y neumonía, infecciones odontoestomatológicas, infecciones de piel y tejidos blandos, otitis media aguda e infecciones del tracto respiratorio superior incluídas sinusitis y faringitis/amigdalitis. (La penicilina es el fármaco usual de elección en el tratamiento de la faringitis por Streptococcus pyogenes, incluida la profilaxis de la fiebre reumática. La azitromicina suele ser eficaz para erradicar los estreptococos de la orofaringe; sin embargo, en el presente no se dispone de datos que demuestren la eficacia de la azitromicina y la consiguiente prevención de la fiebre reumática).
En enfermedades de transmisión sexual en hombres y mujeres, la azitromicina está indicada para el tratamiento de infecciones genitales no complicadas causadas por Chlamydia trachomatis. También está indicada en el tratamiento del chancroide causado por el Haemophilus ducreyi, y en la infección genital no complicada causada por Neisseria gonorrhoeae no multirresistente; es preciso descartar la infección concomitante con Treponema pallidum.
La azitromicina está indicada, ya sea sola o en combinación con rifabutina, para la profilaxis de la infección por el complejo del Mycobacterium avium-intracellulare (MAC), una infección oportunista prevalente en pacientes que tienen infección avanzada por el virus de la inmunodeficiencia humana (VIH).
La azitromicina está indicada, en combinación con el etambutol, para el tratamiento de la infección MAC diseminada (DMAC) en pacientes con infección avanzada por VIH.
La azitromicina intravenosa (IV) está indicada para el tratamiento de neumonía adquirida en la comunidad (NAC) causada por organismos susceptibles, incluyendo Legionella pneumophila, en pacientes que requieren terapia intravenosa inicial.
La azitromicina intravenosa (IV) está indicada para el tratamiento de enfermedad inflamatoria pélvica (PID) causada por organismos susceptibles (Chlamydia trachomatis, Neisseria gonorrhoea, Mycoplasma hominis), en pacientes que requieren terapia intravenosa inicial.
Azitromicina en gránulos de liberación prolongada para suspensión oral para adultos: Azitromicina en gránulos de liberación prolongada está indicada para el tratamiento de cepas susceptibles de bacterias en infecciones del tracto respiratorio leves a moderadas:
• Sinusitis bacteriana aguda debido a Haemophilus influenzae, Moraxella catarrhalis o Streptococcus pneumoniae.
• Neumonía adquirida en la comunidad debido a Chlamydophila pneumoniae, Haemophilus influenzae, Mycoplasma pneumoniae o Streptococcus pneumoniae.
FARMACOCINÉTICA EN GRUPOS ESPECIALES DE PACIENTES:
Ancianos: En voluntarios ancianos (>65 años) se observaron valores ligeramente más altos de ABC después un régimen de 5 días que en voluntarios jóvenes (<40 años), pero no se considera que estos hallazgos estén dotados de importancia clínica, por lo que no se recomienda hacer ajustes de la dosis.
Deterioro de la función renal: La farmacocinética de la azitromicina en sujetos con deterioro leve a moderado de la función renal (GFR 10 - 80 mL/min) no se vio afectada luego de una dosis única de un gramo de azitromicina de liberación inmediata. Se observaron diferencias estadísticamente significativas en el ABC0-120 (8,8 µg•h/mL vs. 11,7 µg•h/mL), Cmáx (1,0 µg/mL vs. 1,6 µg/mL) y CLr (2,3 mL/min./kg vs. 0,2 mL/min/kg) entre el grupo que tenía deterioro grave de la función renal (GFR < 10 mL/min) y el grupo que tenía función renal normal.
Deterioro de la función hepática: En pacientes que tienen deterioro leve (clase A) a moderado (clase B) de la función hepática, no hay evidencia de que haya un cambio marcado en la farmacocinética sérica de la azitromicina comparados con los que tienen función hepática normal. En estos pacientes la depuración urinaria de la azitromicina parece incrementarse, tal vez para compensar la disminución de la depuración hepática.
PARTICULARIDADES FARMACÉUTICAS:
Incompatibilidades:
Intravenoso: No se deben añadir otras sustancias, aditivos o medicaciones intravenosas a la azitromicina intravenosa, ni infundirlas al mismo tiempo por la misma línea intravenosa.
Instrucciones para el uso, manejo y disposición final (si es del caso): Polvo para suspensión oral: Golpee el frasco para aflojar el polvo. Al frasco de 600 mg añádale 9 mL de agua; al frasco de 900 mg añádale 12 mL de agua; al frasco de 1200 mg añádale 15 mL de agua; al frasco de 1500 mg añádale 19 mL de agua. Agite bien. Agite inmediatamente antes de usar.
Cuando se administra a niños que pesan menos de 15 kg la suspensión debe medirse lo más exactamente posible. Para administrar a niños que pesan más de 15 kg, la suspensión se debe administrar usando un dispositivo medidor adecuado.
Tabletas: Las tabletas se deben tragar enteras.
Preparación de la solución intravenosa (IV) para administración IV:
Reconstitución: Prepare la solución para infusión IV inicial añadiendo 4,8 mL de agua estéril para inyección al vial de 500 mg y agitando el vial hasta cuando todo el fármaco esté disuelto.
Dado que la azitromicina IV se suministra al vacío, se recomienda usar una jeringa estándar de 5 mL (no automatizada) para asegurar que se dispensa la cantidad exacta de 4,8 mL de agua estéril para inyección. Cada mL de solución reconstituída contiene 100 mg de azitromicina.
La estabilidad química y física durante el uso del producto reconstituido ha sido demostrada durante 24 horas a temperatura por debajo de 30 °C. Cuando se diluye conforme a las instrucciones, la solución diluida permanece estable química y físicamente durante 24 horas a 30 °C o menos o durante 7 días si se guarda refrigerada a 5 °C.
Desde el punto de vista microbiológico, el producto debe ser usado de inmediato. Si este no es el caso, los tiempos de almacenamiento en uso y las condiciones previas al uso son de la responsabilidad del usuario y por lo general no deberían superar las 24 horas entre 2 y 8 °C, a menos que la reconstitución y la dilución hayan tenido lugar en condiciones asépticas demostradas.
Diluya esta solución aun más antes de la administración como se dice a continuación:
Dilución: Para suministrar azitromicina en un intervalo de concentración de 1,0-2,0 mg/mL, transfiera 5 mL de la solución de azitromicina de 100 mg/mL a la cantidad apropiada de los diluyentes que se enumeran a continuación:
|
Concentración final de la solución para infusión (mg/mL) |
Cantidad de diluyente (mL) |
|
1,0 mg/mL |
500 mL |
|
2,0 mg/mL |
250 mL |
La solución reconstituida se puede diluir con:
Solución salina normal (cloruro de sodio al 0,9%).
Solución salina normal al medio (cloruro de sodio al 0,45%).
Dextrosa al 5% en agua.
Solución de lactato de Ringer.
Dextrosa al 5% en solución salina normal al medio (cloruro de sodio al 0,45%) con 20 mEq de KCl.
Dextrosa al 5% en solución de lactato de Ringer.
Dextrosa al 5% en solución salina normal al tercio (cloruro de sodio al 0,3%).
Dextrosa al 5% en solución salina normal al (cloruro de sodio al 0,45%).
Normosol®-M en dextrosa al 5%.
Normosol®-R en dextrosa al 5%.
Los productos medicamentosos para uso parenteral se deben someter a inspección visual para detectar material en partículas antes de la administración. Si se detecta material en partículas en los fluidos reconstituidos, se debe desechar la solución del medicamento.
La azitromicina, en gránulos de liberación prolongada, 2,0 g.
Reconstitución: Agregar 60 ml de agua y volver a tapar. Agitar bien.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Macrólidos, código ATC J01FA.
La azitromicina es la primera de una subclase de antibióticos macrólidos, conocidos como azálidos, y químicamente diferente con la eritromicina. Desde el punto de vista químico se deriva mediante la inserción de un átomo de nitrógeno en el anillo de lactona de la eritromicina A. El nombre químico de la azitromicina es 9-desoxi-9a-aza-9a-metil-9a-homoeritromicina A. El peso molecular es de 749,0.
El modo de acción de la azitromicina es la inhibición de la síntesis de las proteínas bacterianas por fijación a la subunidad 50s del ribosoma y evitando la translocación de los péptidos.
Mecanismo de la resistencia: Existen dos determinantes principales de la resistencia en los aislados clínicos de Streptococcus pneumoniae y el Streptococcus pyogenes: Mef y erm. El mef codifica una bomba de flujo que media la resistencia únicamente contra macrólidos de 14 y 15 elementos. También se ha descrito al mef en otras varias especies. El gen erm codifica una metiltransferasa 23S-rRNA que añade grupos metilo a la adenina 2058 del 23S rRNA (sistema de numeración del rRNA de la E. coli).
El nucleótido metilado se encuentra en el dominio V y se ha visto que interactúa con las lincosamidas y la estreptogramina B, además de con los macrólidos, de lo cual resulta un fenotipo conocido como resistencia mLSB. Erm(B) y erm(A) se encuentran en aislados clínicos de S. pneumoniae y S. pyogenes.
La bomba AcrAB-TolC en el Haemophilus influenzae es responsable de los niveles más elevados innatos de los valores de CIM a los macrólidos.
En aislados clínicos, las mutaciones en el 23S rRNA, en especial en los nucleótidos 2057-2059 o 2611 del dominio V, o las mutaciones en las proteínas del ribosoma L4 o L22 son infrecuentes.
Puntos de quiebre: Los valores de la concentración mínima inhibitoria (MIC) se deberían obtener usando métodos estandarizados de laboratorio como los definidos por EUCAST (Comité europeo de pruebas de susceptibilidad antimicrobiana, por sus siglas en inglés) o CLSI (Instituto de estándares clínicos y de laboratorio, por sus siglas en inglés).
EUCAST MIC:
H. influenzae: Susceptible ≤ 0.12 mg/L y resistente >4 mg/L:
M. catarrhalis: Susceptible ≤0.5 mg/L y resistente >0.5 mg/L:
Streptococci incluyendo S. pneumoniae y S. pyogenes: Susceptible ≤ 0.25 mg/L y resistente >0.5 mg/L.
CLSI MIC:
Haemophilus spp.: Susceptible ≤ 4 mg/L sin recomendación para punto de quiebre de resistencia.*
M. catarrhalis: Susceptible ≤ 2 mg/L y resistente ≥ 8 mg/L.
Streptococci incluyendo S. pneumoniae y S. pyogenes: Susceptible ≤ 0.5 mg/L y resistente ≥ 2 mg/L.
* La ausencia actual de información sobre cepas resistentes hace imposible definir cualquier categoría diferente de las susceptibles. Si las cepas arrojan resultados de CIM diferentes de susceptible, se deben enviar a un laboratorio de referencia para que les practiquen pruebas adicionales.
Espectro antibacteriano: La susceptibilidad de las especies bacterianas a la azitromicina se muestran a continuación: La prevalencia de la resistencia adquirida puede variar geográficamente y en el tiempo para algunas especies y es deseable contar con información local sobre la resistencia, en especial cuando se tratan infecciones graves. Según la necesidad, se debe buscar la asesoría de expertos cuando la prevalencia de la resistencia local es tal que la utilidad del agente en al menos algunos tipos de infecciones es cuestionable.
Especies frecuentemente susceptibles:
Bacterias aerobias Gram-positivas: Estreptococos (grupos C, F, G) y del estreptococos del grupo Viridans.
Bacterias aerobias Gram-negativas: Bordetella pertussis, Haemophilus ducreyi, Haemophilus influenzae*§, Haemophilus parainfluenzae*, Legionella pneumophila, Moraxella catarrhalis* y Neisseria gonorrhoeae.
Otras: Chlamydia pneumoniae*, Chlamydia trachomatis, Mycoplasma pneumoniae* y Ureaplasma urealyticum. Patógenos oportunistas asociados a infecciones por VIH: Mycobacterium avium-intracellulare complex, Pneumocystis carinii y Toxyplasma gondii.
Especies para las cuales resistencia adquirida puede ser un problema:
Bacterias aerobias Gram-positivas: Streptococcus pneumoniae*, Streptococcus pyogenes*, Staphylococcus aureus.
Organismos con resistencia inherente: Enterobacterias, Pseudomonas spp.
Nota: La azitromicina demuestra resistencia cruzada con cepas gran-positivas resistentes a eritromicina.
* Especies para las cuales se ha demostrado eficacia en estudios clínicos.
§ Especies que tienen susceptibilidad intermedia natural.
PROPIEDADES FARMACOCINÉTICAS:
Absorción: Luego de la administración oral en seres humanos, la azitromicina se distribuye ampliamente por todo el organismo; la biodisponibilidad es de aproximadamente 37%. La administración de las cápsulas de azitromicina luego de una comida sustancial reduce la biodisponibilidad en al menos 50%. El tiempo que transcurre hasta cuando se alcanzan los niveles plasmáticos máximos es de 2-3 horas.
Distribución: En estudios en animales se han observado altas concentraciones de azitromicina en los fagocitos. En modelos experimentales se liberan concentraciones más altas de azitromicina durante la fagocitosis activa que de los fagocitos no estimulados. En modelos animales esto se traduce en que se aportan altas concentraciones de azitromicina al lugar de la infección.
Los estudios de farmacocinética en los seres humanos han demostrado niveles de azitromicina marcadamente más elevados en los tejidos que en el plasma (hasta 50 veces la máxima concentración observada en el plasma), lo cual indica que el fármaco se liga firmemente a los tejidos. Las concentraciones en los tejidos diana, como pulmón, amígdala y próstata, superan la CIM90 para los patógenos probables después de una dosis única de 500 mg.
Luego de la administración oral de dosis diarias de 600 mg de azitromicina, la máxima concentración plasmática media (Cmáx) fue de 0,33 µg/mL y 0,55 µg/mL en el día 1 y día 22 respectivamente. Las concentraciones pico promedio observadas en los glóbulos blancos, el lugar principal de la infección diseminada por MAC, fueron de 252 µg/mL (± 49%) y permanecieron por encima de 146 µg/mL (± 33%) durante 24 horas en el estado de equilibrio.
Eliminación: La vida media de eliminación terminal del plasma refleja de cerca la vida media del agotamiento tisular de 2 a 4 días. Cerca de 12% de una dosis administrada por vía intravenosa se excreta por la orina en el curso de 3 días en la forma del medicamento original, la mayor parte en las primeras 24 horas. La excreción biliar de la azitromicina constituye una importante vía de eliminación para el fármaco intacto luego de la administración oral. Se han encontrado concentraciones muy altas del compuesto no modificado en la bilis humana, junto con 10 metabolitos, formados por N y O desmetilación, por hidroxilación de los anillos de desosamina y aglucona, y por fisión del conjugado de cladinosa.
La comparación de la HPLC y los estudios de microbiología en los tejidos hace pensar que los metabolitos no desempeñan una función en la actividad microbiológica de la azitromicina.
Azitromicina en gránulos de liberación prolongada para solución oral:
Absorción: Los gránulos de liberación prolongada están formulados para liberar azitromicina lentamente en el intestino delgado.
La biodisponibilidad relativa de azitromicina, en gránulos de liberación prolongada, en comparación con la formulación de azitromicina en sachet es 83%. Las concentraciones séricas pico se logran aproximadamente 2,5 horas después.
Efecto de la coadministración de alimentos: Cuando se administró una dosis de 2,0 g de azitromicina, en gránulos de liberación prolongada a sujetos sanos tras una comida rica en grasas, las concentraciones séricas pico y la exposición sistémica aumentaron (115% y 23%, respectivamente). Tras una comida estándar en sujetos sanos, la concentración sérica pico aumentó un 119%, pero la exposición sistémica no se modificó.
Los resultados de los estudios clínicos sugieren que la azitromicina, en gránulos de liberación prolongada, se tolera mejor cuando se lo administra en ayunas.
Distribución: La unión a la proteína sérica de azitromicina depende de la concentración, disminuyendo de 51% a 0,02 µg/ml a 7% a 2,0 µg/ml. Tras la administración oral, la azitromicina se distribuye ampliamente por todo el cuerpo con un volumen de distribución en estado estable aparente de 31,1 l/kg.
Las concentraciones de azitromicina son más altas en tejidos que en plasma y suero. La distribución extensiva de los fármacos a tejidos puede ser relevante a la actividad clínica. La actividad antimicrobiana de la azitromicina se relaciona con el pH y se reduciría con la reducción del pH. Por ende, las concentraciones elevadas en tejido no deben ser interpretadas como relacionadas en forma cuantitativa con la eficacia clínica.
Metabolismo: La mayoría de la azitromicina disponible sistématicamente se excreta sin cambios por la bilis. No se realizaron estudios in vitro e in vivo para evaluar el metabolismo de azitromicina.
Eliminación: Las concentraciones séricas de azitromicina, en gránulos de liberación prolongada, tras una dosis única de 2,0 g disminuyeron en un patrón polifásico, lo que llevó a una vida media de eliminación terminal de 59 horas. La vida media terminal prolongada podría deberse al mayor volumen de distribución aparente.
La excreción biliar de azitromicina, predominantemente como fármaco sin modificar, es la principal vía de eliminación. A lo largo de una semana, aproximadamente 6% de la dosis administrada aparece como droga no modificada en orina.
CONTRAINDICACIONES: El uso de este producto está contraindicado en pacientes con hipersensibilidad a la azitromicina, eritromicina, a cualquier antibiótico macrólido, cetólido o a cualquier excipiente.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES PARA EL USO: Igual que sucede con la eritromicina y otros macrólidos, se ha informado de infrecuentes reacciones alérgicas serias, incluidos angioedema y anafilaxia (rara vez mortales). Algunas de estas reacciones a la azitromicina han dado lugar a síntomas recurrentes que requirieron de un periodo más prolongado de observación y tratamiento.
Puesto que el hígado es la principal vía de eliminación de la azitromicina, el uso de la azitromicina debe ser realizado con precaución en pacientes que tienen enfermedad hepática importante.
En pacientes que reciben derivados del ergot, el ergotismo ha sido precipitado por la administración conjunta de algunos antibióticos macrólidos. No hay información concerniente a la posibilidad de una interacción entre el ergot y la azitromicina. Sin embargo, a causa de la posibilidad teórica de ergotismo, no se deben administrar al mismo tiempo azitromicina y derivados del ergot.
Igual que sucede con cualquier preparado antibiótico, se recomienda la observación de los signos de sobreinfección con organismos no susceptibles, incluidos los hongos.
Clostridium difficile asociado con diarrea (CDAD) se ha reportado con el uso de casi todos los agentes antibacteriales, incluyendo azitromicina, y pueden tener un rango en severidad desde diarrea moderada a colitis fatal. El tratamiento con agentes antibacteriales altera la flora normal del colon permitiendo el sobre-crecimiento de C. difficile.
C. difficile produce toxinas A y B las cuales contribuyen al desarrollo de CDAD.
Las hipertoxinas que producen las cepas del C. difficile causan incremento en la morbilidad y mortalidad pues esas infecciones pueden ser refractarias ala la terapia antimicrobial y pueden requerir colectomía.
CDAD debe ser considerada en todos los pacientes que presenten diarrea después de el uso de antibióticos. Una historia médica cuidadosa es necesaria desde que CDAD ha sido reportado que ocurre hasta los dos meses después de la administración de agentes antibacteriales.
En pacientes que tenían deterioro grave de la función renal (TFG <10 mL/min) se observó un aumento de 33% en la exposición sistémica a la azitromicina (ver Propiedades farmacocinéticas).
Azitromicina en gránulos de liberación prolongada para suspensión oral para adultos:
Precaución en pacientes diabéticos: 5 ml de suspensión reconstituída contienen 3.87 g de sucrosa.
Debido al contenido de sucrosa 83.87 g/5 ml de suspensión reconstituida, este medicamento no está indicado para personas con intolerancia a la fructosa (intolerancia hereditaria a la fructosa), mala absorción a glucosa-galactosa o deficiencia de sacarasa-isomaltosa.
En el tratamiento con otros macrólidos se ha observado una prolongación de la repolarización cardiaca y el intervalo QT, lo cual supone el riesgo de que sobrevengan arritmia cardiaca y torsades de pointes. No es posible descartar por completo un efecto similar con la azitromicina en pacientes que corren un alto riesgo de prolongación de la repolarización cardiaca (ver Efectos indeseables).
Administración intravenosa: La azitromicina para inyección debe reconstituirse y diluirse siguiendo las instrucciones y administrarla en infusión intravenosa en no menos de 60 minutos. No se debe administrar en bolo intravenoso o inyección intramuscular (ver Posología y método de administración y Instrucciones para uso, manejo y disposición final).
No se han establecido la seguridad ni la eficacia de la azitromicina intravenosa para el tratamiento de las infecciones en los niños o adolescentes menores de 16 años. En estudios clíncos controlados la azitromicina se ha administrado a pacientes pediátricos (de 6 meses a 16 años de edad) por vía oral.
Azitromicina en gránulos de liberación prolongada: La azitromicina, en gránulos de liberación prolongada para suspensión oral contiene 19,36 g de sucrosa. Pacientes con problemas hereditarios graves de intolerancia a la fructosa, mal absorción de glucosa-galactosa o insuficiencia de sucrasa-isomaltasa no deben recibir este medicamento.
La azitromicina, en gránulos de liberación prolongada para suspensión oral contiene 148 mg de sodio.
EMBARAZO Y LACTANCIA: Se han llevado a cabo estudios de reproducción en animales con dosis suficientes para alcanzar concentraciones moderadamente tóxicas para la madre sin encontrar evidencia de daños fetales causados por la azitromicina. No obstante, no se han hecho estudios adecuados y bien controlados en mujeres gestantes. Dado que los estudios de reproducción en animales no siempre son predictores de la respuesta humana, la azitromicina sólo deberá usarse durante el embarazo si la necesidad para ello es clara.
No hay información sobre la secreción por la leche materna. Dado que muchos fármacos se excretan por la leche humana, no deberá usarse la azitromicina en mujeres lactantes a menos que el médico piense que el beneficio potencial justifica el posible riesgo para el bebé.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y OPERAR MAQUINARIAS: No hay evidencias que hagan suponer que la azitromicina pueda tener un efecto sobre la capacidad del paciente para conducir vehículos u operar maquinarias.
EFECTOS INDESEABLES: La azitromicina es bien tolerada y tiene una baja incidencia de efectos secundarios.
Los siguientes efectos indeseables han sido informados en estudios clínicos:
Trastornos de la sangre y el sistema linfático: En ocasiones se han observado episodios transitorios de neutropenia leve en estudios clínicos.
Trastornos del oído y el laberinto: El deterioro de la función auditiva (incluidos pérdida auditiva, sordera o tinnitus) ha sido informado en algunos pacientes que reciben azitromicina. Muchos de estos casos han sido asociados con el uso prolongado de dosis altas en estudios de investigación. En aquellos casos en los cuales se disponía de información del seguimiento la mayor parte de los eventos fue reversible.
Trastornos gastrointestinales: Náuseas, vómito, diarrea, heces blandas, molestias abdominales (dolor/calambres) y flatulencia.
Trastornos hepatobiliares: Anomalías de la función hepática.
Trastornos de la piel y el tejido celular subcutáneo: Reacciones alérgicas incluidos erupción y angioedema.
Trastornos generales y afecciones del lugar de administración: Dolor e inflamación localizados en el lugar de la infusión.
Se han informado los siguientes efectos indeseables en asociación con estudios clínicos sobre la profilaxis y el tratamiento de la DMAC:
Las reacciones adversas más frecuentes (>5% en cualquier grupo de tratamiento) en pacientes con infección por VIH que recibían azitromicina para la profilaxis de la DMAC fueron diarrea, dolor abdominal, náuseas, heces blandas, flatulencia, vómito, dispepsia, erupción, prurito, cefalea y artralgia.
Cuando se da azitromicina 600 mg al día para el tratamiento de la infección DMAC durante periodos prolongados, los efectos secundarios relacionados con el tratamiento que se han informado con más frecuencia incluyen dolor abdominal, náuseas, vómito, diarrea, flatulencia, cefalea, alteraciones visuales, y deterioro de la función auditiva.
Los siguientes se han reportado en estudios clínicos con adultos con azitromicina en gránulos de liberación prolongada:
En general, las reacciones adversas más comunes en pacientes adultos recibiendo dosis de 2 g de azitromicina en gránulos para liberación prolongada fueron diarrea (12%), náusea (4%), dolor abdominal (3%), cefalea (1%) y vómito (1%). La incidencia de reacciones adversas gastrointestinales fue de 17% para azitromicina en gránulos de liberación prolongada para suspensión oral y 10% para los comparadores.
Las reacciones adversas por tratamiento con azitromicina de gránulos de liberación prolongada ocurrieron en una frecuencia menor a 1%, incluyen:
Infecciones e infestaciones: Neumonía, infección fúngica, faringitis, gastroenteritis, candidiasis oral, desórdenes respiratorios, rinitis, infección vaginal.
Desórdenes sanguíneos y de sistema linfático: Leucopenia, eosinofilia.
Desórdenes metabólicos y nutricionales: Disminución del apetito.
Desórdenes psiquiátricos: Insomnio.
Desórdenes del sistema nervioso central: Parestesias, mareos, disguesia.
Desórdenes visuales: Deterioro visual.
Desórdenes auditivos: Vértigo.
Desórdenes cardiacos: Palpitaciones.
Desórdenes vasculares: Calores.
Desórdenes respiratorios: Disnea, epistaxis.
Desórdenes gastrointestinales: Gastritis, disfagia, distensión abdominal, estreñimiento, boca seca, dispepsia, ulceración en boca, hipersecreción salivar, hipersecreción, flatulencia.
Desórdenes en piel y tejido subcutáneo: Prurito, urticaria, rash, dermatitis, piel seca, hiperhidrosis.
Desórdenes musculoesqueléticos, de hueso y tejido conectivo: Osteoartritis, mialgia, dolor de espalda, dolor de cuello.
Desórdenes renales y urinarios: Disuria, dolor renal.
Desórdenes en sistema reproductivo y mamas: Metrorragia, desorden testicular.
Desórdenes generales y condiciones en el sitio de administración: Dolor de pecho, edema facial o periférico, astenia, dolor, pirexia, dolor renal.
Investigaciones: Aumento de la fosfatasa alcalina sérica, aumento de la aspartato aminotransferasa, aumento de la alanina aminotransferasa sérica.
Daño y envenenamiento: Complicaciones posteriores a los procedimientos.
Anormalidades en resultados de laboratorio: En sujetos con valores de referencia normales, se informaron las siguientes anomalías de laboratorio clínicamente significativas (independientes de la relación con el fármaco) en estudios clínicos de azitromicina, en gránulos de liberación prolongada.
• Con incidencia mayor o igual que 1%: Basófilos, eosinófilos, monocitos y neutrófilos aumentados, bicarbonato disminuido, linfocitos anormales.
• Con incidencia menor a 1%: Aumento en aspartato aminotransferasa, alanina aminotransferasa, bicarbonato, bilirrubina, urea en sangre, cloruro, creatinina, glucosa y plaquetas, disminución de hematocrito, potasio anormal, sodio y conteo de leucocitos.
Donde como seguimiento, los cambios en los exámenes de laboratorio parecieron ser reversibles.
En la experiencia posterior a la comercialización se han informado los siguientes efectos indeseables adicionales:
Infecciones e infestaciones: Moniliasis y vaginitis.
Trastornos del sistema sanguíneo y el sistema linfático: Trombocitopenia.
Trastornos del sistema inmunológico: Anafilaxia (rara vez mortal) (ver Advertencias y precauciones especiales para el uso).
Trastornos del metabolismo y la nutrición: Anorexia.
Trastornos psiquiátricos: Reacciones agresivas, nerviosismo, agitación y ansiedad.
Trastornos del sistema nervioso: Mareo, convulsiones, cefalea, hiperactividad, hipoestesia, parestesias, somnolencia y síncope. Se han producido unos pocos informes de alteraciones del gusto y el olfato.
Trastornos del oído y el laberinto: Vértigo.
Trastornos cardiacos: Se han informado palpitaciones y arritmias incluida la taquicardia ventricular (igual que se observa con otros macrólidos). Ha habido unos pocos reportes de prolongación del intervalo QT y torsades de pointes. No se ha establecido una relación de causalidad entre la azitromicina y estos efectos (ver Advertencias y precauciones especiales para el uso).
Trastornos vasculares: Hipotensión.
Trastornos gastrointestinales: Vómito/diarrea (que rara vez se traducen en deshidratación), dispepsia, estreñimiento, colitis seudomembranosa, pancreatitis y unos pocos reportes de cambio de coloración de la lengua.
Trastornos hepatobiliares: Se ha informado de hepatitis e ictericia colestática, así como unos pocos casos de necrosis e insuficiencia hepática, que raramente han ocasionado la muerte.
Trastornos de la piel y el tejido celular subcutáneo: Reacciones alérgicas incluidos prurito, erupción, fotosensibilidad, edema, urticaria y angioedema. Raramente se ha reportado reacciones cutáneas serias como eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica.
Trastornos músculo esqueléticos y del tejido conectivo: Artralgia.
Trastornos renales y urinarios: Nefritis intersticial e insuficiencia renal aguda.
Trastornos generales y afecciones en el lugar de la administración: Se ha informado de astenia, fatiga y malestar general.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
Antiácidos: En un estudio de farmacocinética en el cual se investigaron los efectos de la administración simultánea de antiácido con azitromicina, no se observó efecto sobre la biodisponibilidad aunque las concentraciones séricas máximas se redujeron en cerca de 25%. En los pacientes que reciben a la vez azitromicina y antiácidos, los fármacos no se deben tomar al mismo tiempo. La co-administración de azitromicina en gránulos de liberación prolongada y una dosis única de 20 mL de co-magaldrox (hidróxido de aluminio e hidróxido de magnesio) no afecta el grado y la extensión de la absorción de la azitromicina.
Cetirizina: En voluntarios sanos, la administración conjunta de un régimen de 5 días de azitromicina con cetirizina 20 mg en el estado de equilibrio no produjo interacción farmacocinética ni cambios significativos en el intervalo QT.
Didanosina (dideoxiinosina): La administración conjunta de 1200 mg/día de azitromicina con 400 mg/día didanosina en 6 sujetos VIH positivos no pareció afectar la farmacéutica del estado de equilibrio de la didanosina comparada con placebo.
Digoxina: La administración concomitante de antibióticos macrólidos, incluyendo la azitromicina, con sustratos de p-glicoproteínas, como la digoxina, ha reportado un aumento en los niveles séricos de sustratos de p-glicoproteínas. Por lo tanto, si se administra concomitantemente azitromicina y digoxina, la posibilidad de elevar las concentraciones de digoxina sérica aumentan, debe ser considerada.
Zidovudina: Las dosis únicas de 1000 mg y las dosis múltiples de 1200 mg o 600 mg tuvieron poco efecto sobre la farmacocinética plasmática o la excreción urinaria de la zidovudina o su metabolito glucurónido. Sin embargo, la administración de azitromicina aumentó la concentraciones de la zidovudina fosforilada, el metabolito clínicamente activo, en células mononucleares de sangre periférica. No está clara la importancia clínica de este hallazgo pero puede ser beneficioso para los pacientes.
La azitromicina no ejerce una interacción significativa con el sistema hepático del citocromo P450. No se cree que sufra las interacciones medicamentosas farmacocinéticas como las que se observan con la eritromicina y otros macrólidos. La inducción o desactivación del citocromo P450 hepático a través del complejo citocromo-metabolito no tiene lugar con la azitromicina.
Ergot: A causa de la posibilidad teórica de ergotismo, no se recomienda el uso concomitante de azitromicina y los derivados del ergot (ver Advertencias y precauciones especiales para el uso).
Se han llevado a cabo estudios de farmacocinética entre la azitromicina y los siguientes fármacos de los que se sabe que sufren importante metabolismo mediado por el citocromo P450.
Atorvastatina: La coadministración de atorvastatina (10 mg al día) y azitromicina (500 mg al día) no alteró las concentraciones plasmáticas de la atorvastatina (con base en un examen de inhibición de la H mg CoA reductasa).
Carbamazepina: En un estudio de interacción farmacocinética en voluntarios sanos, no se observó un efecto significativo en los niveles plasmáticos de carbamazepina o su metabolito activo en pacientes que recibieron azitromicina de forma concomitante.
Cimetidina: En un estudio de farmacocinética en el cual se investigaron los efectos de una dosis única de cimetidina, dada 2 horas antes de la azitromicina, sobre la farmacocinética de la azitromicina, no se observó alteración de la farmacocinética de la azitromicina.
Anticoagulantes orales de tipo cumadín: En un estudio de interacción farmacocinética, la azitromicina no alteró el efecto anticoagulante de una dosis única de 15 mg de warfarina administrada a voluntarios sanos. Se han producido informes en el periodo posterior a la comercialización de una potenciación de la anticoagulación como consecuencia de la administración conjunta de azitromicina y anticoagulantes orales de tipo cumadín. Si bien no se ha establecido una relación de causalidad, es preciso dar consideración a la frecuencia de la vigilancia del tiempo de protrombina cuando se usa azitromicina en pacientes que reciben anticoagulantes orales de tipo cumadín.
Ciclosporina: En un estudio farmacocinético en voluntarios sanos a los cuales se les administró una dosis oral de 500 mg/día de azitromicina durante 3 días, seguida de una dosis única oral de 10 mg/kg de ciclosporina, la Cmáx y el ABC0-5 resultantes de la ciclosporina se encontraron elevados en grado significativo. En consecuencia, es preciso tener cuidado antes de considerar la administración concurrente de estos fármacos. Si la administración conjunta es necesaria, se deben monitorizar los niveles de ciclosporina y ajustar la dosis apropiadamente.
Efavirenz: La coadministración de una dosis única de 600 mg de azitromicina y 400 mg de efavirenz al día durante 7 días no dio lugar a interacciones farmacocinéticas dotadas de importancia clínica.
Fluconazol: La coadministración de una dosis única de 1200 mg de azitromicina no alteró la farmacocinética de una dosis única de 800 mg de fluconazol. La exposición total y la vida media de la azitromicina no se modificaron con la administración conjunta de fluconazol; no obstante, se observó una disminución no clínicamente significativa en la Cmáx (18%) de la azitromicina.
Indinavir: La coadministración de una dosis única de 1200 mg de azitromicina no tuvo efecto estadísticamente significativo sobre la farmacocinética del indinavir administrado en dosis de 800 mg tres veces al día durante 5 días.
Metilprednisolona: En un estudio de interacción farmacocinética en voluntarios sanos, la azitromicina no tuvo efecto significativo sobre la farmacocinética de la metilprednisolona.
Midazolam: En voluntarios sanos, la coadministración de azitromicina 500 mg/día durante 3 días no causó cambios clínicamente significativos en la farmacocinética ni en la farmacodinámica de una dosis única de 15 mg de midazolam.
Nelfinavir: La administración conjunta de azitromicina (1200 mg) y nelfinavir (750 mg tres veces al día) dio lugar a un aumento de las concentraciones de azitromicina. No se observaron efectos adversos clínicamente significativos ni se necesitó hacer ajustes de la dosis.
Rifabutina: La administración conjunta de azitromicina y rifabutina no afectó las concentraciones séricas de ninguno de los dos fármacos.
Se observó neutropenia en sujetos que recibieron tratamiento concomitante con azitromicina y rifabutina. Si bien la neutropenia se ha asociado con el uso del rifabutina, no se ha logrado establecer una relación de causalidad con la combinación con azitromicina (ver Efectos indeseables).
Sildenafil: En voluntarios sanos normales de sexo masculino no hubo evidencia de que la azitromicina (500 mg al día durante 3 días) tuviese efecto sobre el ABC y la Cmáx, del sildenafil o su principal metabolito circulante.
Terfenadina: Los estudios farmacocinéticos no han informado evidencia de una interacción entre la azitromicina y la terfenadina. Se ha informado de unos pocos casos en los cuales no fue posible descartar por completo dicha interacción; sin embargo, no hubo evidencia específica de la existencia de tal interacción.
Teofilina: No hay evidencia de una interacción farmacocinética clínicamente significativa al administrar del forma conjunta azitromicina y teofilina en voluntarios sanos.
Triazolam: En 14 voluntarios sanos, la administración conjunta de azitromicina 500 mg en el día 1 y 250 mg en el día 2 con 0,125 mg de triazolam en el día 2 no tuvo efecto significativo sobre ninguna de las variables farmacocinéticas para el triazolam comparado con el triazolam y el placebo.
Trimetoprim/sulfametoxazol: La administración conjunta de trimetoprim/sulfametoxazol DS (160 mg/800 mg) durante 7 días con azitromicina 1200 mg en el día 7 no tuvo efecto significativo sobre las concentraciones pico, la exposición total o la excreción urinaria del trimetoprim o el sulfametoxazol. Las concentraciones séricas de azitromicina fueron similares a las observadas en otros estudios.
DATOS DE SEGURIDAD PRECLÍNICA: Se ha observado fosfolipidosis (acumulación intracelular de fosfolípidos) en varios tejidos (por ejemplo, ojo, ganglios de las raíces dorsales, hígado, vesícula biliar, riñón, bazo, y páncreas) de ratones, ratas y perros a los que se les han dado múltiples dosis de azitromicina. La fosfolipidosis se ha observado en grado similar en los tejidos de ratas y perros neonatos. Se ha demostrado que este efecto es reversible después de la cesación del tratamiento de azitromicina. Se desconoce la importancia de este hallazgo para los animales y los seres humanos.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: La azitromicina oral de debe administrar en una única dosis diaria. A continuación se da el periodo de la dosificación con respecto a la infección.
La administración de las cápsulas de azitromicina luego de una comida sustancial reduce la biodisponibilidad en por lo menos 50%. En consecuencia, y en común con muchos otros antibióticos, cada dosis de las cápsulas se debe tomar al menos 1 hora antes o 2 horas después de las comidas.
La azitromicina en tabletas y polvo para suspensión oral se puede tomar con o sin alimento.
En adultos: Para el tratamiento de enfermedades de transmisión sexual causadas por Chlamydia trachomatis, Haemophilus ducreyi, o Neisseria gonorrhoeae susceptible, la dosis es de 1000 mg en dosis única oral.
Para la profilaxis contra las infecciones MAC en pacientes infectados con el virus de la inmunodeficiencia humana (HIV), la dosis es de 1200 mg una vez a la semana.
Para el tratamiento de las infecciones DMAC en pacientes con infección avanzada por VIH, la dosis recomendada es de 600 mg una vez al día. La azitromicina se debe administrar en combinación con otros agentes antimicobacterianos que han demostrado actividad in vitro contra el MAC, como el etambutol en la dosis aprobada.
Zithromax IV:
Para el tratamiento de la NAC causada por los organismos indicados en pacientes adultos, la dosis recomendada de azitromicina intravenosa es 500 mg en una única dosis diaria por vía IV durante por lo menos dos días. La terapia intravenosa debe ir seguida de azitromicina oral en una sola dosis diaria oral de 500 mg para completar un curso de terapia de 7 a 10 días. La definición del momento oportuno para hacer la conversión a la terapia oral debe quedar a discreción del médico y de conformidad con la respuesta clínica.
Para el tratamiento de la EPI causada por organismos indicados en mujeres adultas la dosis recomendada de azitromicina intravenosa es de 500 mg en una sola dosis por vía IV durante uno o dos días. La terapia intravenosa debe ir seguida de azitromicina por vía oral en dosis única diaria de 250 mg hasta completar un curso de 7 días de terapia. La decisión del momento oportuno para convertir a la terapia oral se debe tomar a discreción del médico y de conformidad con la respuesta clínica. Si se sospecha la presencia de microorganismos anaerobios como contribuyentes a la infección, se puede administrar un agente antimicrobiano en combinación con la azitromicina.
Para todas las demás indicaciones en las cuales se administra la presentación oral, la dosificación total de 1500 mg se debe dar en 500 mg al día durante 3 días. Como alternativa, se puede dar la misma dosis total en el curso de 5 días dando 500 mg en el primer día, seguida de 250 mg al día en los días 2 a 5.
Administración intravenosa: Después de la reconstitución y la dilución, la vía recomendada de la administración para la azitromicina intravenosa es mediante la infusión IV únicamente. No se debe administrar en bolo intravenoso ni en inyección intramuscular (ver Advertencias y precauciones especiales para el uso y Instrucciones para uso, manejo y disposición final).
La concentración y la velocidad de infusión de la azitromicina intravenosa (IV) debe ser de 1 mg/mL en el lapso de 3 horas o 2 mg/mL en el transcurso de 1 hora. Una dosis intravenosa de 500 mg de azitromicina se debe infundir en un tiempo mínimo de una (1) hora.
En niños: La dosis máxima total recomendada para cualquier tratamiento es de 1500 mg en los niños.
En general, la dosis total en niños es de 30 mg/kg. El tratamiento para la faringitis estreptocócica en niños debe dosificarse en un régimen diferente (ver más adelante).
La dosis total de 30 mg/kg se debe dar en una sola dosis diaria de 10 mg/kg al día durante 3 días, o darla en 5 días con una dosis única diaria de 10 mg/kg en día 1, seguida de 5 mg/kg en los días 2-5.
Como alternativa a la anterior dosificación, el tratamiento en los niños que presentan otitis media aguda se puede dar en una sola dosis de 30 mg/kg.
En la faringitis estreptocócica en los niños se ha demostrado que la azitromicina dada en una sola dosis de 10 mg/kg o 20 mg/kg durante 3 días es eficaz; con todo, no se debe sobrepasar la dosis de 500 mg. En estudios clínicos en los cuales se han comparado estos dos regímenes de dosificación se observó similar eficacia clínica pero se hizo evidente una mayor erradicación bacteriológica con la dosis de 20 mg/kg al día. No obstante, la penicilina es el fármaco usual de elección para el tratamiento de la faringitis por Streptococcus pyogenes, incluida la profilaxis de la fiebre reumática.
En los niños que pesan menos de 15 kg, la azitromicina en suspensión se debe medir lo más exactamente posible. En los niños que pesan más de 15 kg, la suspensión de azitromicina o, como alternativa, la azitromicina en sobres pediátricos, se debe administrar de acuerdo a la guía que aparece a continuación:
|
Azitromicina suspensión, 30 mg/kg dosis total de tratamiento |
|||
|
Peso (kg) |
Régimen de 3 días |
Régimen de 5 días |
Tamaño de frasco (mg) |
|
< 15 |
10 mg/kg una vez al día en los días 1-3. |
10 mg/kg en el día 1, seguido de 5 mg/kg en los días 2-5. |
600 |
|
15-25 |
200 mg (5 mL) una vez al día en los días 1-3. |
200 mg (5 mL) en el día 1, seguido de 100 mg (2,5 mL) una vez al día en los días 2-5. |
600 |
|
26-35 |
300 mg (7,5 mL) una vez al día en los días 1-3. |
300 mg (7,5 mL) en el día 1, seguido de 150 mg (3,75 mL) una vez al día en los días 2-5. |
900 |
|
36-45 |
400 mg (10 mL) una vez al día en los días 1-3. |
400 mg (10 mL) en el día 1, seguido de 200 mg (5 mL) una vez al día en los días 2-5. |
1200 |
|
> 45 |
Igual dosis que para el adulto. |
Igual dosis que para el adulto. |
1500 |
Las tabletas de azitromicina sólo se deben administrar a los niños con un peso superior a 45 kg.
No se han establecido la seguridad ni la eficacia de la azitromicina intravenosa para el tratamiento de las infecciones en los niños o adolescentes menores de 16 años. En estudios clíncos controlados la azitromicina se ha administrado a pacientes pediátricos (de 6 meses a 16 años de edad) por vía oral.
No se han establecido la seguridad ni la eficacia para la prevención o el tratamiento de la MAC en los niños. Con base en los datos de farmacocinética en los niños, una dosis de 20 mg/kg sería similar a la del adulto de 1200 mg pero con una Cmáx más alta.
Azitromicina en gránulos de liberación prolongada para suspensión oral para adultos: Se aconseja que los pacientes tomen azitromicina en gránulos de liberación prolongada con el estómago vacío (por lo menos 1 hora antes o 2 horas después de una comida).
La dosis recomendada para adultos y adolescentes es una dosis única de 2,0 g de azitromicina en gránulos de liberación prolongada.
En el caso poco probable de que un paciente vomite dentro de los 5 minutos de la administración de azitromicina gránulos de liberación prolongada, deberá ingerirse una segunda dosis. Debido a la insuficiente información que existe sobre la absorción de azitromicina si un paciente vomita entre 5 y 60 minutos después de la administración, una terapia alternativa se puede considerar. En pacientes con vaciamiento gástrico normal, una segunda dosis de azitromicina en gránulos de liberación prolongada para suspensión oral no está garantizada si el vómito ocurre en más de 60 minutos después de la administración.
Poblaciones especiales: No se recomienda la administración de azitromicina en gránulos de liberación prolongada a niños menores de 12 años.
En ancianos: En los ancianos se usa la misma dosificación que en los pacientes adultos.
En pacientes con deterioro de la función renal: No es necesario hacer ajustes de la dosis en pacientes que tienen deterioro leve a moderado de la función renal (TFG 10-80 mL/min). Se debe tener cuidado al administrar azitromicina a los pacientes que tienen deterioro grave de la función renal (GFR < 10 mL/min.) (ver Advertencias y precauciones especiales para el uso y Propiedades farmacocinéticas).
En pacientes que tienen deterioro de la función hepática: En pacientes que tienen deterioro leve a moderado de la función hepática se pueden usar las mismas dosis que en los pacientes que tienen función hepática normal (ver Advertencias y precauciones especiales para el uso).
SOBREDOSIS: Los eventos adversos experimentados con dosis superiores a las recomendadas fueron similares a los que se observan con dosis normales. En el evento de una sobredosis se indica poner en marcha medidas generales sintomáticas y de soporte según sean necesarias.
CONDICIONES DE ALMACENAMIENTO: Almacenar a una temperatura menor de 30 °C.
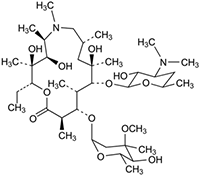
Estructura y nombre químico del principio activo: (2R,3S,4R,5R,8R,10R,11R,12S,13S,14R)-13-[(2,6-Dideoxi-3-C-metil-3-O-metil-α-L-ribo-hexopiranosil)oxi]-2-etil-3,4,10-trihidroxi-3,5,6,8,10,12,14-heptametil-11-[[3,4,6-trideoxi-3-(dimetilamino)-β-D-xylo-hexopiranosil]oxi]-1-oxa-6-azaciclopentadecan-15-ona.
Documento de producto referencia No.: NA.
Fecha: 03 de noviembre, 2010.
Reemplaza: 28 de agosto, 2007.
PFIZER
® Marca registrada